Abstract
目的
探讨经超声酸蚀/阳极氧化联合改性钛(titanium modified by ultrasonic acid etching/anodic oxidation,UAT)负载内皮祖细胞外泌体(endothelial progenitor cells-exosome,EPCs-exo)后,对脂肪来源干细胞(adipose-derived stem cells,ADSCs)生长以及成骨、成血管分化的影响。
方法
取10只SD大鼠脂肪组织及骨髓,分别采用胶原酶消化法和密度梯度离心法分离培养ADSCs及EPCs,并经流式细胞仪鉴定。取第3~5代EPCs采用试剂盒提取exo,并经Western blot检测CD9、CD81进行鉴定。采用超声酸蚀和阳极氧化方法对3D打印技术制备的钛片进行联合改性制备UAT,扫描电镜观察改性前后材料表面形貌;将UAT分别置于不同浓度(100、200 ng/mL)EPCs-exo溶液中,采用BCA法检测其体外吸附及释放EPCs-exo能力。然后,将UAT置于含不同浓度EPCs-exo(0、100、200 ng/mL)的DMEM培养液,并与第3代ADSCs复合培养,构建UAT-ADSCs-exo。通过激光共聚焦显微镜观察细胞形态、活/死细胞染色、细胞增殖检测,评价生物相容性;ALP染色及茜素红染色,RT-PCR检测成骨相关基因骨钙素(osteocalcin,OCN)、RUNT相关基因2(RUNT-related transcription factor 2,Runx2)、ALP、Ⅰ型胶原蛋白(collagen type 1,COL-1)和成血管相关基因VEGF,免疫荧光染色观测成骨(OCN)及成血管(VEGF)相关蛋白表达,评价负载EPCs-exo的UAT对ADSCs成骨、成血管分化能力的影响。
结果
扫描电镜观察示改性后UAT表面形成了微纳米多级复合结构;UAT 48 h内能吸附约77% EPCs-exo,而吸附在UAT表面的EPCs-exo在8 d内呈连续稳定释放,200 ng/mL组吸附及释放量明显优于100 ng/mL组,差异均有统计学意义(P<0.05)。生物相容性检测示,复合培养后各组细胞均生长良好,其中200 ng/mL组优于其他组,细胞完全铺展,有丰富伪足,活细胞数量及细胞活性均高于其他组(P<0.05)。ADSCs成骨和成血管能力检测示,与其余两组比较,200 ng/mL组ADSCs的ALP活性和矿化能力增强,成骨和成血管基因OCN、Runx2、COL-1、ALP 和VEGF表达均增高,OCN和VEGF蛋白亦增高,差异均有统计学意义(P<0.05)。
结论
EPCs-exo能有效促进UAT表面ADSCs的黏附、增殖及成骨、成血管分化,其中浓度为200 ng/mL时效果最显著。
Keywords: 改性钛, 脂肪来源干细胞, 内皮祖细胞, 外泌体, 成骨分化, 成血管分化
Abstract
Objective
To investigate the effects of titanium modified by ultrasonic acid etching/anodic oxidation (UAT) loaded with endothelial progenitor cells-exosome (EPCs-exo) on proliferation and osteogenic and angiogenic differentiations of adipose-derived stem cells (ADSCs).
Methods
The adipose tissue and bone marrow of 10 Sprague Dawley rats were harvested. Then the ADSCs and EPCs were isolated and cultured by collagenase digestion method and density gradient centrifugation method, respectively, and identified by flow cytometry. Exo was extracted from the 3rd to 5th generation EPCs using extraction kit, and CD9 and CD81 were detected by Western blot for identification. The three-dimensional printed titanium was modified by ultrasonic acid etching and anodic oxidation to prepare the UAT. The surface characteristics of UAT before and after modification was observed by scanning electron microscopy; UAT was placed in EPCs-exo solutions of different concentrations (100, 200 ng/mL), and the in vitro absorption and release capacity of EPCs-exo was detected by BCA method. Then, UAT was placed in DMEM medium containing different concentrations of EPCs-exo (0, 100, 200 ng/mL), and co-cultured with the 3rd generation ADSCs to construct UAT-ADSCs-exo. Cell morphology by laser confocal microscopy, live/dead cell staining, and cell proliferation were observed to evaluate biocompatibility; alkaline phosphatase (ALP) staining and alizarin red staining, RT-PCR detection of osteogenesis-related genes [osteocalcin (OCN), RUNT-related transcription factor 2 (Runx2), ALP, collagen type 1 (COL-1)] and angiogenesis-related gene [vascular endothelial growth factor (VEGF)], immunofluorescence staining for osteogenesis (OCN)- and angiogenesis (VEGF)-related protein expression were detected to evaluate the effect on the osteogenic and angiogenic differentiation ability of ADSCs.
Results
Scanning electron microscopy showed that micro-nano multilevel composite structures were formed on the surface of UAT. About 77% EPCs-exo was absorbed by UAT within 48 hours, while EPCs-exo absorbed on the surface of UAT showed continuous and stable release within 8 days. The absorption and release amount of 200 ng/mL group were significantly higher than those of 100 ng/mL group (P<0.05). Biocompatibility test showed that the cells in all concentration groups grew well after culture, and the 200 ng/mL group was better than the other groups, with fully spread cells and abundant pseudopodia, and the cell count and cell activity were significantly higher than those in the other groups (P<0.05). Compared with the other groups, 200 ng/mL group showed enhanced ALP activity and mineralization ability, increased expressions of osteogenic and angiogenic genes (OCN, Runx2, COL-1, ALP, and VEGF), as well as increased expressions of OCN and VEGF proteins, with significant differences (P<0.05).
Conclusion
EPCs-exo can effectively promote the adhesion, proliferation, and osteogenic and angiogenic differentiation of ADSCs on UAT surface, the effect is the most significant when the concentration is 200 ng/mL.
Keywords: Modified titanium, adipose-derived stem cells, endothelial progenitor cells, exosome, osteogenic differentiation, angiogenic differentiation
金属钛是目前应用比较广泛的骨科替代材料[1],但该材料具有生物惰性,难以与骨组织直接结合,而骨结合不良是临床植入物松动、脱落以及周围组织发炎的主要原因[2]。因此,对金属钛进行改性,提高其生物活性和骨结合能力具有重要意义[3]。本课题组前期成功制备了超声酸蚀/阳极氧化联合改性钛(titanium modified by ultrasonic acid etching/anodic oxidation,UAT),体外实验证实改性后的材料生物活性和亲水性明显提高,能促进细胞增殖、黏附和成骨分化,但成血管能力并不理想[4]。而材料植入体内后,如果周围血管长入速度过慢或达不到内层,会导致血液循环障碍,使成骨效果不稳定,因此需要对UAT进一步优化。
外泌体(exosome,exo)是细胞分泌的一种囊泡结构,含有多种蛋白质、信使RNA、微小RNA及细胞因子,是细胞旁分泌的关键组分,可参与细胞间的通信及调控[5-6]。近期研究发现,内皮祖细胞exo(endothelial progenitor cells-exo,EPCs-exo)可促进细胞增殖、迁移及血管生成,有效提高血管密度,进而加快骨再生进程[7-8]。本研究旨在将UAT负载EPCs-exo进行进一步改性,研究改性后材料对脂肪来源干细胞(adipose-derived stem cells,ADSCs)成骨和成血管分化能力的影响。报告如下。
1. 材料与方法
1.1. 实验动物与主要试剂、仪器
6~8周龄雄性SD大鼠10只,体质量约250 g,购于河北省实验动物中心。
DMEM、FBS、胰蛋白酶、青霉素、链霉素、Ⅰ型胶原酶(GIBCO公司,美国);内皮细胞培养基(endothelial cell medium,ECM;Science公司,美国);M199(Therm公司,美国);Percoll淋巴细胞分离液(General Electric公司,美国);exo提取试剂盒(大连美仑生物技术有限公司);BCA蛋白定量试剂盒、ALP试剂盒(上海碧云天生物技术有限公司);细胞计数试剂盒8(cell counting kit 8,CCK-8;武汉博士德生物工程有限公司);单克隆抗体 CD29、CD90、CD34、CD133(Abcam公司,美国);活/死细胞染色试剂盒(南京凯基生物技术股份有限公司);茜素红染色试剂盒、鬼笔环肽(北京索莱宝科技有限公司);RNA提取试剂盒、RT-PCR 试剂盒(北京天根生化科技有限公司)。
扫描电镜(ZEISS公司,德国);激光共聚焦显微镜(Andor公司,英国);流式细胞仪(Milipore公司,美国);酶标仪(Molecular Devices公司,美国);实时荧光定量PCR仪、CO2培养箱(Thermo 公司,美国)。
1.2. ADSCs培养及鉴定
采用颈椎脱臼法处死10只大鼠,分离腹股沟及附睾周围脂肪组织,加入达脂肪组织体积2倍的0.1%Ⅰ型胶原酶,37℃消化60 min,200目筛网过滤; 以1200×g离心10 min;弃上清,DMEM重悬细胞后,置于37℃、5%CO2培养箱培养并传代。取第3代ADSCs,胰蛋白酶消化后制成细胞悬液,调整细胞密度为5×108个/mL。取200 µL细胞悬液加入5 µL CD29、2 µL CD90荧光抗体,避光孵育30 min,流式细胞仪检测细胞表面抗原表达。
1.3. EPCs-exo提取及鉴定
取1.2处死大鼠的胫骨和股骨,D-Hank 液反复冲洗骨髓腔并收集骨髓,以1500×g离心5 min,M199重悬细胞,加入等体积Percoll淋巴细胞分离液,以1500×g离心15 min;吸取中间白膜层单核细胞,调整细胞密度为1×109个/L,接种于含ECM的培养瓶中,置于37℃、5%CO2培养箱培养并传代。取第3代EPCs,采用流式细胞仪检测CD34、CD133表达。
取第3~5代EPCs提取exo,PBS清洗细胞后更换无血清培养基培养48 h。收集细胞上清液,4℃以3000×g离心20 min;去除细胞和碎片,将上清液转移至超速离心管中,加入1/2体积的exo提取试剂,混匀,4℃孵育过夜。取出离心管,于4℃以10 000×g离心60 min;弃上清,无菌PBS重悬,获得EPCs-exo。取EPCs-exo行Western blot检测CD9、CD81表达。
1.4. UAT制备及观察
1.4.1. UAT制备
取本课题组前期采用3D打印技术制备的钛片[4],室温下置于蚀刻溶液(2%氢氟酸及1.8%盐酸混合液)5 min。将酸蚀后的钛片作为阳极、铂片作为阴极,两极以间距40 mm置于含0.25%氢氟酸、2%去离子水的乙二醇溶液进行阳极氧化,磁力搅拌器匀速搅拌;氧化条件:氧化电压为15 V恒定直流电压,氧化时间1 h[4];获得UAT。
1.4.2. 观测指标
① UAT表征:扫描电镜下观察经超声酸蚀和阳极氧化方法改性前后的样品表面形貌。
② UAT体外吸附和释放EPCs-exo能力检测:采用PBS溶液制备不同浓度(100、200 ng/mL)EPCs-exo溶液,然后放置UAT,于2、4、8、12、24、48 h采用BCA法检测溶液中EPCs-exo含量,评价UAT吸附EPCs-exo能力。
将上述步骤中放置48 h吸附EPCs-exo的UAT置于24孔板中,加入200 μL PBS溶液,于0、2、4、6、8 d收集培养液并更换200 μL新鲜PBS溶液,采用BCA法检测各时间点培养液中EPCs-exo含量,计算累积释放率(%),评价UAT释放EPCs-exo能力。
1.5. UAT-ADSCs-exo构建及观测
1.5.1. UAT-ADSCs-exo构建
将UAT置于24孔板中,分别加入1 mL含不同浓度EPCs-exo(0、100、200 ng/mL)的DMEM培养液,于37℃、5%CO2条件下孵育48 h,使EPCs-exo吸附于UAT表面后,将其转至新24孔板内,每孔1个。取ADSCs调整细胞密度为2×104个/mL,按照每孔1 mL将细胞悬液滴至UAT表面,开始复合培养UAT-ADSCs-exo,并在相应时间点进行后续观测。
1.5.2. 生物相容性检测
① 细胞形态观察:复合培养7 d,各组取部分样品PBS清洗、多聚甲醛固定15 min、含0.5%Triton X-100的PBS溶液室温下透膜处理10 min,FITC标记鬼笔环肽液室温染色20 min,Hoechst 33258 复染15 min,激光共聚焦显微镜下观察细胞形态。
② 活/死细胞染色检测:复合培养7 d,各组取部分样品PBS清洗后,按照活/死细胞染色试剂盒说明书配制工作液并加入孔板中,室温孵育30 min,激光共聚焦显微镜下观察活/死细胞情况,绿色荧光为活细胞、红色荧光为死细胞。每个样品取5个视野,用 Image J软件计数活细胞。
③ 细胞增殖检测:复合培养1、3、5、7 d,各组加入10%CCK-8 溶液孵育2 h,使用酶标仪检测450 nm波长处吸光度(A)值。
1.5.3. ADSCs成骨和成血管能力观测
① ALP染色及茜素红染色:复合培养7 d,各组4%多聚甲醛固定2 min,加入ALP染色试剂室温避光孵育15 min,观察细胞染色情况;另复合培养7、14 d时按ALP试剂盒说明书操作,检测细胞ALP活性。复合培养21 d行茜素红染色,用10% 氯化十六烷基吡啶溶解后,酶标仪测定562 nm 波长处A值,观察其矿化能力。各组均取3孔进行上述观测。
②成骨及成血管相关基因检测:复合培养14 d,用RNA提取试剂盒提取细胞总RNA,测定浓度,按逆转录试剂盒与RT-PCR试剂盒进行逆转录与多聚酶联反应,分析成骨相关基因骨钙素(osteocalcin,OCN)、RUNT相关基因2(RUNT-related transcription factor 2,Runx2)、ALP、Ⅰ型胶原蛋白(collagen type 1,COL-1)和成血管相关基因VEGF的表达。反应体系为20 μL。使用β-actin作为参考基因,采用2–ΔΔCt 法计算各目的基因的相对表达量。基因引物序列见表1。
表 1.
Primer sequences of genes (5′→3′)
各基因引物序列(5′→3′)
| 基因
Gene |
引物序列
Primer sequence |
| OCN | 上游CAGACAAGTCCCACACAGCA
Forward 下游CCAGCAGAGTGAGCAGAGAG Reverse |
| Runx2 | 上游ATCATTCAGTGACACCACCA
Forward 下游GTAGGGGCTAAAGGCAAAAG Reverse |
| ALP | 上游ATGCTCAGGACAGGATCAAA
Forward 下游CGGGACATAAGCGAGTTTCT Reverse |
| COL-1 | 上游AGCTCGATACACAATGGCCT
Forward 下游CCTATGACTTCTGCGTCTGG Reverse |
| VEGF | 上游CTACCTCCACCATGCCAAGT
Forward 下游CTCGATTGGATGGCAGTAGC Reverse |
| β-actin | 上游CCTCTATGACAACACAGT
Forward 下游AGCCACCAATCCACACAG Reverse |
③ 成骨及成血管相关蛋白检测:复合培养14 d,PBS和多聚甲醛处理细胞后,加入 OCN(1∶100)、VEGF(1∶100)一抗孵育过夜;PBS洗去一抗,加入相应二抗避光染色1 h,DAPI染色15 min,激光共聚焦显微镜观察,Actin染色呈红色,OCN、VEGF染色呈绿色,细胞核染色呈蓝色,Image J软件对荧光强度进行定量分析。
1.6. 统计学方法
采用SPSS23.0统计软件进行分析。数据以均数±标准差表示,组间比较采用单因素方差分析,两两比较采用LSD检验,检验水准α=0.05。
2. 结果
2.1. 细胞与exo鉴定
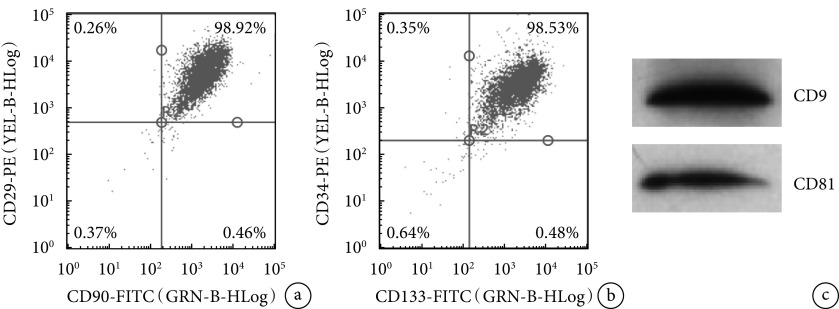
流式细胞仪检测培养的两种细胞分别高表达ADSCs标记物CD29、CD90以及EPCs标记物CD34、CD133,符合ADSCs、EPCs表面抗原特征,且纯度较高(图1a、b)。Western blot检测示EPCs-exo表面蛋白CD9、CD81呈强阳性表达(图1c),表明分离获得的白色沉淀物为exo。
图 1.
Identification of cells and exo
细胞与exo鉴定
a. 流式细胞术鉴定ADSCs;b. 流式细胞术鉴定EPCs;c. Western blot检测EPCs-exo
a. Identification of ADSCs by flow cytometry; b. Identification of EPCs by flow cytometry; c. Identification of EPCs-exo by Western blot
2.2. UAT观测
2.2.1. UAT表征
扫描电镜观察,改性前样品表面不平坦,未见纳米级孔隙。改性后样品表面可见平缓峰-谷形沟壑形貌,在垄沟底部有散在分布的突起状结构,呈珊瑚状;突起状结构是由10个左右直径为70~80 nm的纳米颗粒聚集而成,突起状结构之间有较多相互连接的纳米级孔隙。见图2。
图 2.
Scanning electron microscopy observation of UAT
扫描电镜观察UAT
从左至右分别为放大40、100、20 k、100 k倍 a. 改性前;b. 改性后
The magnification from left to right for 40, 100, 20 k, and 100 k, respectively a. Before modification; b. After modification

2.2.2. UAT体外吸附和释放EPCs-exo能力
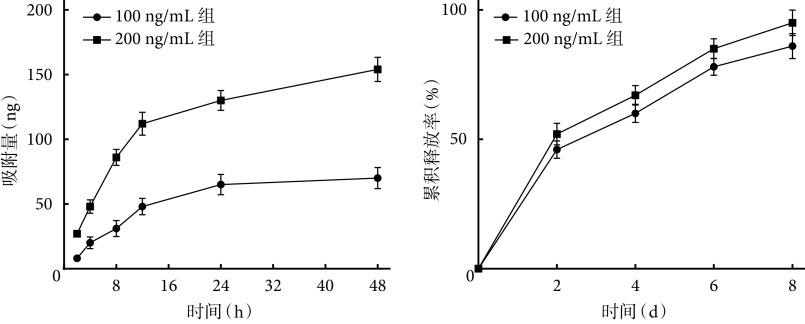
UAT在48 h内能吸附约77% EPCs-exo,而吸附在UAT表面的EPCs-exo在8 d内呈现连续稳定释放。两浓度组间吸附量及累及释放率比较,差异均有统计学意义(P<0.05)。见图3。
图 3.
The ability of UAT to absorb and release EPCs-exo in vitro
UAT体外吸附和释放EPCs-exo能力检测
2.3. UAT-ADSCs-exo观测
2.3.1. 生物相容性检测
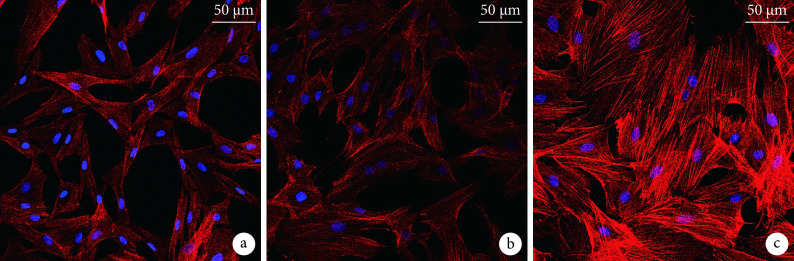
① 细胞形态观察:复合培养7 d后,激光共聚焦显微镜下见各组ADSCs在UAT表面生长良好。其中,0 ng/mL组和100 ng/mL组细胞呈细长形状,丝状伪足相对较少;200 ng/mL组细胞呈多边形,完全铺展,与材料表面呈接触生长,且与邻近细胞建立了丰富丝状伪足接触。见图4。
图 4.
Observation of cell morphology by laser confocal microscope at 7 days after co-culture (×100)
复合培养7 d激光共聚焦显微镜观察细胞形态(×100)
a. 0 ng/mL组;b. 100 ng/mL组;c. 200 ng/mL组
a. 0 ng/mL group; b. 100 ng/mL group; c. 200 ng/mL group
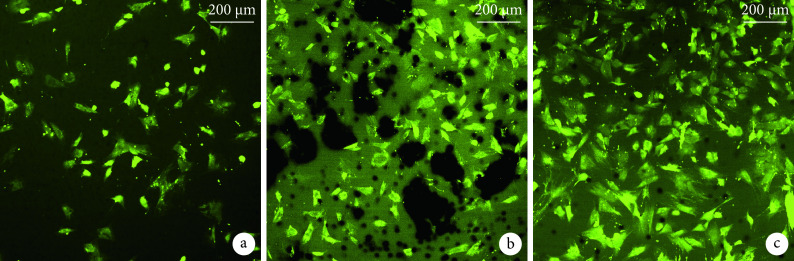
② 活/死细胞染色观察:复合培养7 d后,激光共聚焦显微镜下见各组ADSCs均在UAT表面生长良好,未见明显红染死细胞。0 ng/mL组、100 ng/mL组、200 ng/mL组活细胞数量分别为(85.33±2.51)、(138.65±2.52)、(178.02±2.64)个。组间差异均有统计学意义(P<0.05)。见图5。
图 5.
Observation of cell viability by laser confocal microscope at 7 days after co-culture (×40)
复合培养7 d激光共聚焦显微镜观察细胞成活情况(×40)
a. 0 ng/mL组; b. 100 ng/mL组;c. 200 ng/mL组
a. 0 ng/mL group; b. 100 ng/mL group; c. 200 ng/mL group
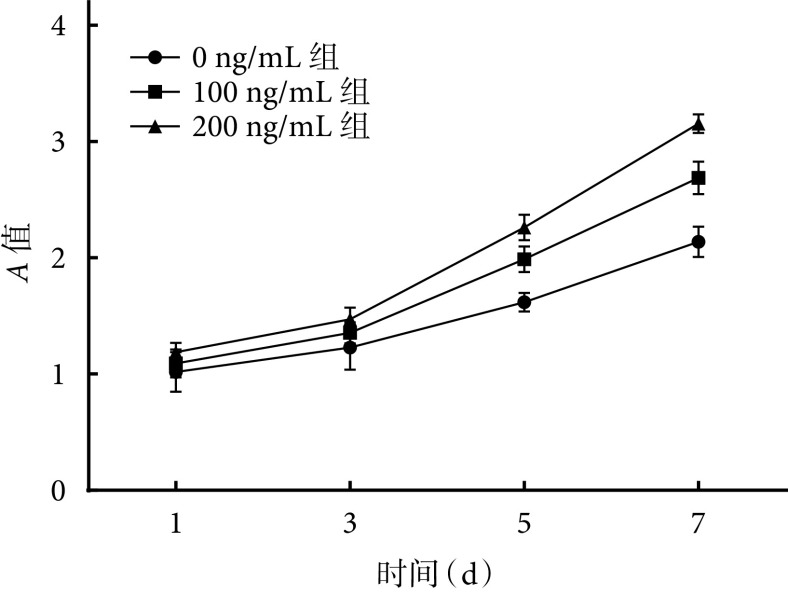
③ 细胞增殖检测:随培养时间延长,各组ADSCs活性逐渐增加。培养前3 d各组细胞A值差异无统计学意义(P>0.05);5 d后200 ng/mL组显著高于其余组,差异有统计学意义(P<0.05)。见图6。
图 6.
Cell growth curve of each group
各组细胞生长曲线
2.3.2. ADSCs成骨和成血管能力检测
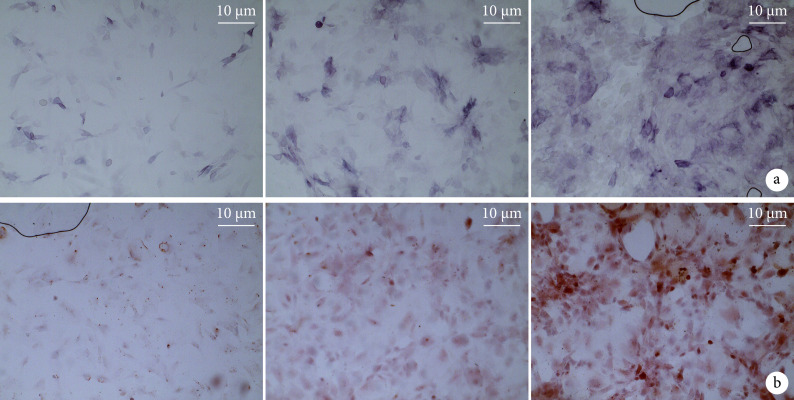
① ALP染色及茜素红染色: 随EPCs-exo浓度升高,ADSCs成骨能力逐渐增强,200 ng/mL组ALP染色和茜素红染色程度较其他两组明显增强(图7)。
图 7.
ALP staining at 7 days after co-culture and alizarin red staining at 21 days after co-culture (×40)
各组复合培养7 d ALP染色和21 d茜素红染色观察(×40)
从左至右依次为0 ng/mL组、100 ng/mL组、200 ng/mL组 a. ALP染色;b. 茜素红染色
From left to right for 0 ng/mL group, 100 ng/mL group, and 200 ng/mL group, respectively a. ALP staining; b. Alizarin red staining
定量分析结果显示,各时间点200 ng/mL组ADSCs的ALP活性和矿化能力均高于其余两组,100 ng/mL组高于0 ng/mL组,差异均有统计学意义(P<0.05)。见表2。
表 2.
Comparison of ALP activity and mineralization ability between groups (n=3,
 )
)
各组细胞ALP活性及矿化能力比较(n=3,
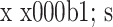 )
)
| 组别
Group |
ALP活性
ALP activity |
矿化能力
Mineralization ability |
|
| 7 d | 14 d | ||
|
*与0 ng/mL组比较P<0.05,#与100 ng/mL组比较P<0.05
*Compared with 0 ng/mL group, P<0.05;#compared with 100 ng/mL group, P<0.05 | |||
| 0 ng/mL | 0.183±0.005# | 0.301±0.003# | 0.234±0.004# |
| 100 ng/mL | 0.213±0.006* | 0.331±0.003* | 0.392±0.003* |
| 200 ng/mL | 0.353±0.004*# | 0.432±0.004*# | 0.467±0.005*# |
| 统计值
Statistic |
F=1060.770
P<0.001 |
F=1412.912
P<0.001 |
F=2857.284
P<0.001 |
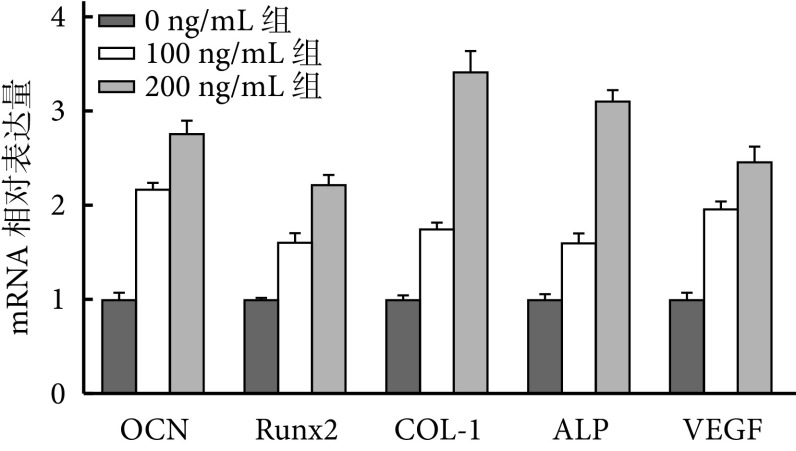
② 成骨及成血管相关基因检测:复合培养14 d后,与0 ng/mL组相比,100 ng/mL组和200 ng/mL组OCN、Runx2、COL-1、ALP 和VEGF基因表达均增强,其中以200 ng/mL组最明显,组间比较差异均有统计学意义(P<0.05)。见图8。
图 8.
The expression of osteogenesis- and angiogenesis-related genes by RT-PCR at 14 days after co-culture
复合培养14 d RT-PCR检测成骨及成血管相关基因表达
③ 成骨及成血管相关蛋白检测:复合培养14 d,随浓度增加,ADSCs中OCN和VEGF蛋白表达呈递增趋势,200 ng/mL组表达水平高于其他组,组间比较差异均有统计学意义(P<0.05)。见图9及表3。
图 9.
Immunofluorescence staining at 14 days after co-culture (Fluorescence microscope×100)
复合培养14 d各组免疫荧光染色观察(荧光显微镜×100)
从左至右依次为Actin染色、OCN/VEGF染色、细胞核染色、三者合并图像 从上至下依次为 0 ng/mL 组、100 ng/mL 组、200 ng/mL 组 a. OCN;b. VEGF
From left to right for Actin staining, OCN/VEGF staining, nucleus staining, and merge image, respectively From top to bottom for 0 ng/mL group, 100 ng/mL group, 200 ng/mL group, respectively a. OCN; b. VEGF
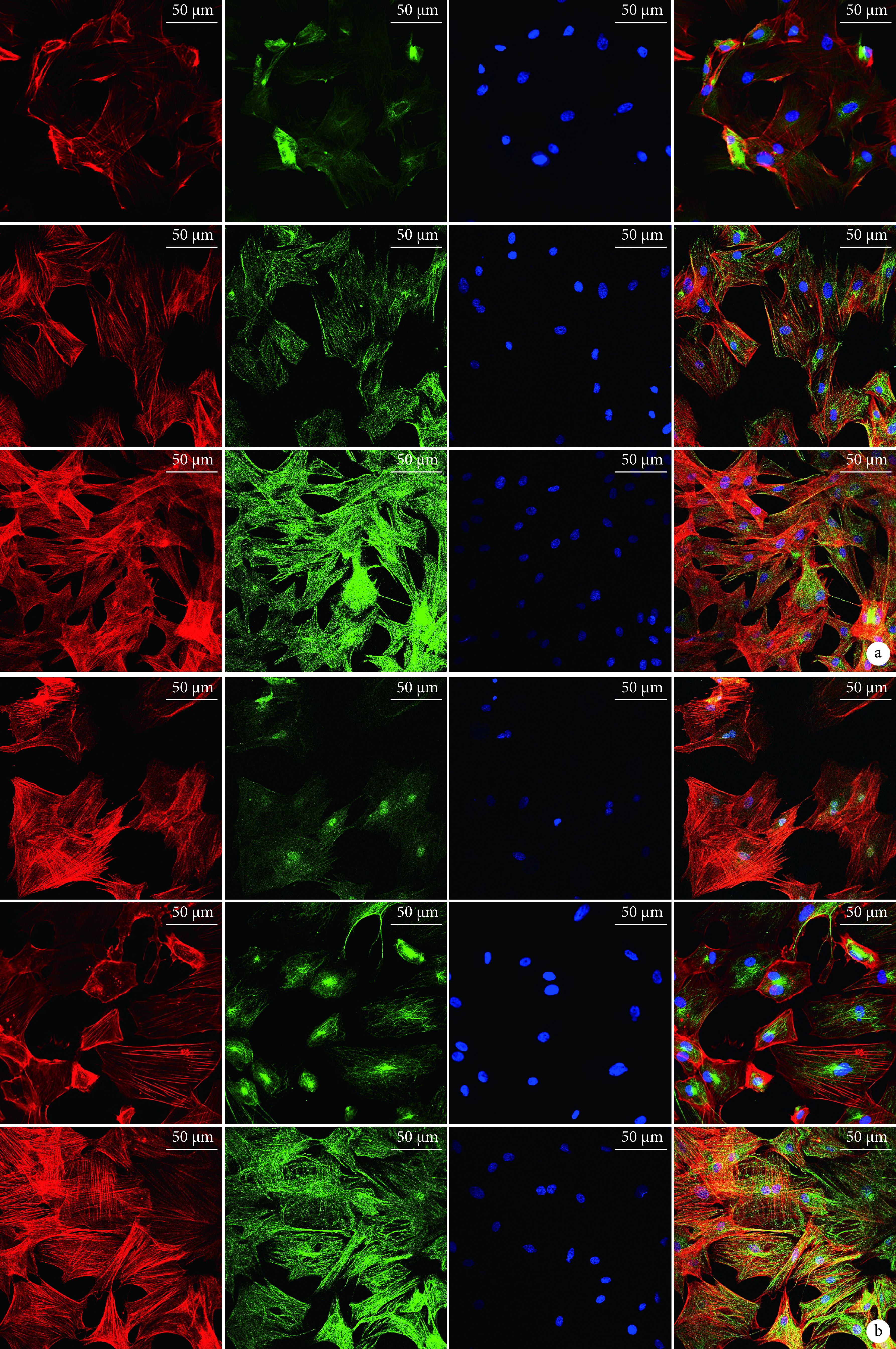
表 3.
Comparison of immunofluorescence intensity between groups (n=3,
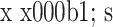 )
)
各组细胞免疫荧光强度比较(n=3,
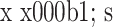 )
)
| 组别
Group |
OCN | VEGF |
|
*与0 ng/mL组比较P<0.05,#与100 ng/mL组比较P<0.05
*Compared with 0 ng/mL group, P<0.05;#compared with100 ng/mL group, P<0.05 | ||
| 0 ng/mL | 94.880±0.456# | 86.837±1.062# |
| 100 ng/mL | 104.990±0.235* | 97.493±0.755* |
| 200 ng/mL | 144.780±0.310*# | 121.750±0.384*# |
| 统计值
Statistic |
F=17 412.286
P<0.001 |
F=1 560.544
P<0.001 |
3. 讨论
exo是由细胞分泌的纳米级细胞外囊泡,包含蛋白质、RNA等多种生物活性物质,具有介导细胞间通讯、促进抗原提呈等功能[9],是骨组织工程领域中新兴的治疗手段,具有良好的骨修复作用[10]。Geng等[11]将miR-21纳米胶囊负载至经酸处理的钛表面,发现钛促细胞成骨和成血管能力显著增强。Zhai等[12]提取经成骨诱导10、15 d MSCs的exo,发现其能促进MSCs成骨分化,将其加载至3D打印纯钛支架后植入大鼠骨缺损处,发现有哈弗管结构的新骨和血管形成。以上研究表明exo具有同时促进细胞成骨及成血管的作用。本研究对负载exo的UAT生物相容性进行了观测。结果显示,复合培养后与0 ng/mL组相比,200 ng/mL组UAT表面上生长的ADSCs铺展最充分;活/死细胞染色和CCK-8检测结果示随着exo浓度的增高,UAT表面ADSCs的活性提高;表明exo呈浓度依赖性提高细胞活性,促进细胞黏附和增殖。
ALP是成骨细胞分泌的一种酶,其表达活性常被作为成骨分化的一个重要指标[13]。新骨形成需要成骨细胞分泌细胞外基质,之后继续矿化,产生钙结节[14]。Runx2是成骨分化过程中的重要转录因子。OCN在骨形成过程中调节晶体生长[15]。为了验证UAT-ADSCs-exo的成骨效果,本研究进行了ALP活性和细胞矿化能力检测,结果表明exo能促进ADSCs在UAT表面的成骨分化。RT-PCR结果显示随着exo浓度增加,成骨相关基因OCN、 Runx2、ALP、COL-1表达量显著提高,具有明显剂量依赖性。我们认为UAT的纳米多孔结构能促进ADSCs成骨分化,而加入exo后成骨效应显著提高,这可能与exo能良好诱导血管生成有关。
血管化是骨再生的关键,血管形成后可以输送营养物质、生长因子、矿物质和氧气,促进新陈代谢,利于组织修复[16]。exo可以通过其内含的蛋白质、mRNA、微小RNA对血管新生微环境进行调节,从而促进血管生成,使骨再生效应增强。Jia等[7]研究提示EPCs-exo能显著加速血管形成和成骨效应。然而exo是否能大量负载于UAT表面并保持恒定浓度,对血管生成至关重要。Zhai等[12]的研究表明exo可以很好地吸附在钛合金支架上,并逐渐释放到周围环境中。我们用BCA试剂盒评估了UAT对exo的加载和释放情况,结果显示约77% exo在48 h内被吸附,且释放比例均匀一致,分析这可能与阳极氧化后在钛表面生成的纳米级孔隙有关,该结构具有独特性能,可以增加材料表面积,提高材料亲水性,利于蛋白质的吸附和释放。
VEGF在趋化细胞、促进有丝分裂和血管生成中发挥作用,并能促进ADSCs的成骨分化,其表达水平可反映血管化程度。本研究中,VEGF基因和蛋白表达都随着exo浓度升高逐渐增强。exo可将有促血管生成作用的mRNA转运至细胞中,通过激活信号通路,诱导细胞进入血管生成程序,从而促进毛细血管样结构生成。有研究将间充质细胞来源exo注射至骨折大鼠体内,发现exo可通过诱导缺氧诱导因子1α促进VEGF的表达,使骨再生能力增强[17]。越来越多研究表明,成骨细胞和EPCs通过信号分子相互联系,相互促进。成骨细胞可释放VEGF,促进EPCs血管化;新生血管一方面为骨组织形成输送氧气和营养成分,另一方面还可以通过释放成骨相关因子,如BMP-2或BMP-4促进成骨细胞分化成熟[18]。
本研究成功制备了UAT-ADSCs-exo,体外研究表明其具有较好的生物安全性、较强的成骨及成血管诱导能力,但体内成骨和成血管效果及相关分子机制有待进一步探索。
利益冲突 在课题研究和文章撰写过程中不存在利益冲突;经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道
伦理声明 研究方案经沧州医学高等专科学校动物实验伦理委员会批准(CY-SYDW-2019-01);实验动物使用许可证号:SYXK(冀)2019-006
作者贡献声明 王静:实验实施、实验结果统计分析及文章撰写;邱严力:实验设计;唐亮、刘洪利:结果收集整理
Funding Statement
沧州市重点研发计划自筹项目(213107003)
Cangzhou Key Research and Development Plan Self-Funded Project (213107003)
References
- 1.Chouirfa H, Bouloussa H, Migonney V, et al Review of titanium surface modification techniques and coatings for antibacterial applications. Acta Biomater. 2019;83:37–54. doi: 10.1016/j.actbio.2018.10.036. [DOI] [PubMed] [Google Scholar]
- 2.Spriano S, Yamaguchi S, Baino F, et al A critical review of multifunctional titanium surfaces: New frontiers for improving osseointegration and host response, avoiding bacteria contamination. Acta Biomater. 2018;79:1–22. doi: 10.1016/j.actbio.2018.08.013. [DOI] [PubMed] [Google Scholar]
- 3.Jiang H, Ma X, Zhou W, et al The effects of hierarchical micro/nano-structured titanium surface on osteoblast proliferation and differentiation under diabetic conditions. Implant Dent. 2017;26(2):263–269. doi: 10.1097/ID.0000000000000576. [DOI] [PubMed] [Google Scholar]
- 4.Ren B, Wan Y, Liu C, et al. Improved osseointegration of 3D printed Ti-6Al-4V implant with a hierarchical micro/nano surface topography: An in vitro and in vivo study. Mater Sci Eng C Mater Biol Appl, 2021, 118: 111505. doi: 10.1016/j.msec.2020.111505.
- 5.Tkach M, Théry C Communication by extracellular vesicles: Where we are and where we need to go. Cell. 2016;164(6):1226–1232. doi: 10.1016/j.cell.2016.01.043. [DOI] [PubMed] [Google Scholar]
- 6.Li X, Jiang C, Zhao J Human endothelial progenitor cells-derived exosomes accelerate cutaneous wound healing in diabetic rats by promoting endothelial function. J Diabetes Complications. 2016;30(6):986–992. doi: 10.1016/j.jdiacomp.2016.05.009. [DOI] [PubMed] [Google Scholar]
- 7.Jia Y, Zhu Y, Qiu S, et al Exosomes secreted by endothelial progenitor cells accelerate bone regeneration during distraction osteogenesis by stimulating angiogenesis. Stem Cell Res Ther. 2019;10(1):12–25. doi: 10.1186/s13287-018-1115-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.曹骑麟, 王婷, 熊伟, 等 Exos-ADSCs-nHAC/PLGA组织工程骨对大鼠颅骨缺损修复的实验研究. 中国美容整形外科杂志. 2021;32(4):234–237. doi: 10.3969/j.issn.1673-7040.2021.04.016. [DOI] [Google Scholar]
- 9.Rodrigues M, Fan J, Lyon C, et al Role of extracellular vesicles in viral and bacterial infections: Pathogenesis, diagnostics, and therapeutics. Theranostics. 2018;8(10):2709–2721. doi: 10.7150/thno.20576. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Domvri K, Petanidis S, Anestakis D, et al Exosomal lncRNA PCAT-1 promotes Kras-associated chemoresistance via immunosuppressive miR-182/miR-217 signaling and p27/CDK6 regulation. Oncotarget. 2020;11(29):2847–2862. doi: 10.18632/oncotarget.27675. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Geng Z, Yu Y, Li Z, et al. miR-21 promotes osseointegration and mineralization through enhancing both osteogenic and osteoclastic expression. Mater Sci Eng C Mater Biol Appl, 2020, 111: 110785. doi: 10.1016/j.msec.2020.110785.
- 12.Zhai M, Zhu Y, Yang M, et al. Human mesenchymal stem cell derived exosomes enhance cell-free bone regeneration by altering their miRNAs profiles. Adv Sci (Weinh), 2020, 7(19): 2001334. doi: 10.1002/advs.202001334.
- 13.Ji Y, Wang M, Liu W, et al Chitosan/nHAC/PLGA microsphere vehicle for sustained release of rhBMP-2 and its derived synthetic oligopeptide for bone regeneration. J Biomed Mater Res A. 2017;105(6):1593–1606. doi: 10.1002/jbm.a.35962. [DOI] [PubMed] [Google Scholar]
- 14.Sun T, Yao S, Liu M, et al Composite scaffolds of mineralized natural extracellular matrix on true bone ceramic induce bone regeneration through Smad1/5/8 and ERK1/2 pathways. Tissue Eng Part A. 2018;24(5-6):502–515. doi: 10.1089/ten.tea.2017.0179. [DOI] [PubMed] [Google Scholar]
- 15.Tsao YT, Huang YJ, Wu HH, et al. Osteocalcin mediates biomineralization during osteogenic maturation in human mesenchymal stromal cells. Int J Mol Sci, 2017, 18(1): 159. doi: 10.3390/ijms18010159.
- 16.Diomede F, Marconi GD, Fonticoli L, et al. Functional relationship between osteogenesis and angiogenesis in tissue regeneration. Int J Mol Sci, 2020, 21(9): 3242. doi: 10.3390/ijms21093242.
- 17.Zhang Y, Hao Z, Wang P, et al. Exosomes from human umbilical cord mesenchymal stem cells enhance fracture healing through HIF-1α-mediated promotion of angiogenesis in a rat model of stabilized fracture. Cell Prolif, 2019, 52(2): e12570. doi: 10.1111/cpr.12570.
- 18.Hu K, Olsen BR Osteoblast-derived VEGF regulates osteoblast differentiation and bone formation during bone repair. J Clin Invest. 2016;126(2):509–526. doi: 10.1172/JCI82585. [DOI] [PMC free article] [PubMed] [Google Scholar]