Zusammenfassung
Hintergrund Chronische Niereninsuffizienz (CKD) ist in der Bevölkerung ab einem Alter von 40 Jahren genauso verbreitet wie Diabetes oder koronare Herzkrankheit. Obwohl eine CKD das Risiko für Folgeerkrankungen oder vorzeitigen Tod erhöht, wissen Patienten oft nichts von ihrer Erkrankung. In einer Auswertung deutscher Daten war die Unkenntnis über eine CKD bei Frauen größer als bei Männern.
Methode Es wurden Baseline-Daten aus dem Jahr 2010 von 3305 CKD-Patienten aus deutschen Kohortenstudien und Registern ausgewertet. Eine CKD der Stadien 1–4 war nach veröffentlichten Leitlinien definiert. Das Patientenwissen über eine CKD wurde über Selbstauskunft kodiert. Der Anteil von Patienten ohne Wissen über eine CKD sowie die geschlechtsspezifische Anteilsdifferenz (jeweils mit 95 %-Konfidenzintervall) wurde nach CKD-Stadien und weiteren Komorbiditäten berechnet. Darüber hinaus wurde die Prävalenz-Ratio (PR) für die Nichtkenntnis einer CKD für Frauen im Vergleich zu Männern grob und nach Alter und weiteren Risikofaktoren adjustiert geschätzt.
Ergebnisse In den Subgruppen nach Alter, CKD-Stadium und Komorbiditäten wussten Frauen seltener von ihrer CKD als Männer. Der Anteilsunterschied im Wissen um eine CKD stieg mit höherem CKD-Stadium an und betrug im Stadium 4 21 Prozentpunkte (7,6; 34,6) zuungunsten der Frauen. Bei Patienten mit einer CKD im Stadium 3b und Bluthochdruck Grad 2 wussten 61 % der Frauen nichts von ihrer Erkrankung, verglichen mit 45 % der Männer. Das PR für die Unkenntnis einer CKD für Frauen im Vergleich zu Männern im voll-adjustierten Modell stieg von 1,08 (1,00; 1,16) bei einer CKD 3a auf 1,75 (1,14; 2,68) bei einer CKD im Stadium 4.
Folgerung Frauen wissen in allen untersuchten Subgruppen seltener von ihrer CKD als Männer. Der Geschlechtsunterschied besteht unabhängig von allen untersuchten Einflussfaktoren. Mögliche Ursachen sind unbewusste geschlechtsbezogene Unterschiede in der Versorgung (gender bias) oder in der Patient-Arzt-Kommunikation.
Schlüsselwörter: chronische Niereninsuffizienz, CKD; Geschlechtsunterschiede; Unkenntnis einer Erkrankung; Prädiktoren einer CKD-Unkenntnis
Abstract
Introduction Chronic kidney failure (CKD) is as common as diabetes or coronary heart disease in a population aged 40 years and older. Although CKD increases the risk of secondary diseases or premature death, patients with CKD are often unaware of their disease. In a recent analysis of German data, unawareness CKD was higher in women than in men.
Methods Baseline data from 2010 of 3,305 CKD patients from German cohort studies and registries were analyzed. Stage 1–4 CKD was defined by eGFR (estimated glomerular filtration rate) and albumin-creatinine ratio according to the KDIGO-guideline. Patient knowledge of CKD was coded according to self-report. The proportion of patients without knowledge of CKD and the sex-specific proportion difference (each with 95 % confidence interval) were calculated according to CKD stages and additional comorbidities (diabetes, hypertension, anemia, and cardiovascular disease). In addition, the prevalence ratio (PR) for not knowing about CKD was estimated for women compared to men crude and adjusted for age and other risk factors.
Results Women were less likely than men to know about their CKD in all subgroups studied by age, CKD stage, and comorbidities. The proportion difference for CKD awareness increased with higher CKD stage and was 21 percentage points (7.6; 34.6) at the expense of women in CKD stage 4. Among patients with CKD stage 3b and concomitant grade 2 hypertension, 61 % of women versus 45 % of men were unaware of their disease. The PR for CKD unawareness in women compared with men in the fully adjusted model increased from 1.08 (1.00; 1.16) in CKD stage 3a to 1.75 (1.14; 2.68) in CKD stage 4.
Conclusion Despite the presence risk factors that necessitate monitoring of renal function, less than half of patients know they have CKD stage 3b or 4. Women are less likely to be aware of their CKD in all subgroups. Possible causes are gender-related differences in primary health care (gender bias) or in patient-doctor communication.
Key words: chronic kidney disease, CKD; sex differences; disease unawareness; predictors of CKD unawareness
Einleitung
Chronische Niereninsuffizienz (CKD) ist in der Bevölkerung ab einem Alter von 40 Jahren mit einer Prävalenz von etwa 10 % ebenso häufig wie Diabetes mellitus, koronare Herzkrankheit oder Depression. Die Folgen für die Gesundheit der einzelnen Patienten sind ein erhöhtes Risiko für ein terminales Nierenversagen, für kardiovaskuläre Folgeerkrankungen und für vorzeitigen Tod. Trotz der individuellen Folgen und der sozialen Kosten von Nierenersatz-Therapien ist die Erkrankung selten im Fokus der Öffentlichkeit. In einer Aufstellung wichtiger chronischer Erkrankungen in Bremer Allgemeinarzt-Praxen wurde chronische Niereninsuffizienz nicht mit aufgeführt 1 , obwohl die Prävalenz in diesem Setting auf etwa 30 % geschätzt wird 2 .
Da eine CKD meist über lange Zeit asymptomatisch bleibt, ist in den früheren Stadien eine Diagnose aufgrund von Beschwerden der Patienten eher selten. In der „Studie zur Gesundheit Erwachsener in Deutschland (DEGS)“ wussten 72 % der 187 Befragten mit einer CKD im Stadium 3–5 nicht von ihrer Krankheit 3 . Ähnlich hohe Anteile von CKD-Patienten mit unbekannter Niereninsuffizienz werden aus USA, Großbritannien, Australien oder Kanada berichtet 4 5 6 7 . Bei Vorliegen einer Albuminurie oder Anämie scheint die Chance, über eine vorhandene CKD Bescheid zu wissen, erhöht 4 .
Nicht nur bezogen auf das Monitoring der Medikation weisen Leitlinien auf die Bedeutung der Niereninsuffizienz als Prädiktor, Risikofaktor und mögliche Folgeerkrankung bei Diabetes, Hypertonie oder Herzinsuffizienz hin. Daher ist anzunehmen, dass eine noch asymptomatische Niereninsuffizienz im Rahmen der Behandlung von Diabetes mellitus, kardiovaskulären Erkrankungen oder älteren Patienten frühzeitig diagnostiziert wird. Jedoch ist auch der Anteil von vorerkrankten Personen mit Unkenntnis ihrer CKD hoch. Zwei von 3 Patienten mit koronarer Herzkrankheit 8 oder Diabetes 9 in Deutschland wussten nicht von ihrer CKD. Bei 80 % der Patienten war die prävalente Niereninsuffizienz nicht in der Patientenakte vermerkt 8 .
Im „National Health and Nutrition Examination Survey (NHANES)“ wurde für die Erhebungsperiode 2007–2010 bei 620 Personen kaukasischer Abstammung ein deutlicher Geschlechtsunterschied zuungunsten von Frauen, bezogen auf die Kenntnis über die eigene Nierenerkrankung, berichtet (Odds Ratio (OR) = 2,45 (95 %- Konfidenzintervall (KI): 1,21; 4,95)) 10 . Eine Auswertung von Teilnehmern deutscher CKD-Kohortenstudien und -Register ergab, dass mehr Männer (34 %) als Frauen (29 %) von ihrer CKD im Stadium 1–4 wussten 9 .
Das Ziel unserer Untersuchung ist es, diese Geschlechtsunterschiede genauer zu untersuchen und mögliche Ursachen für die geschlechtsabhängige Unkenntnis einer prävalenten Niereninsuffizienz bei CKD-Patienten in Deutschland zu finden. Dabei sollen Patienten verschiedener CKD-Stadien und Komorbiditäten, wie z. B. Diabetes und kardiovaskuläre Erkrankungen, mitberücksichtigt werden.
Material und Methoden
Es wurden Baseline-Daten von 2010 aus deutschen Kohortenstudien und Registern ausgewertet. Diese enthalten neben studienspezifischen Fragen auch einen gemeinsamen Pool an Fragen zu Demografie, Klinik, Komorbiditäten und Laboranalysen und wurden in einem standardisierten Vorgehen zur sogenannten Kern-Datenbank zusammengeführt und zu Auswertungen über die originären Studien-Fragestellungen hinaus Kohorten-übergreifend bereitgestellt. Für die Untersuchung der Bekanntheit der CKD haben wir diese Kern-Datenbank mit Daten aus der Diabetes-Kohorte (DIACORE, N = 1.093), dem Coronary-Artery-Disease-and-Renal-Failure-Register (CAD-Ref, N = 1.173) und der Berliner Initiative-Studie (BIS, N = 1.039) zusammen ausgewertet 11 12 13 .
Die ausgewerteten Baseline-Daten umfassen Alter, Geschlecht, Blutdruck (mmHg), Body-Mass-Index (BMI, kg/m2), Erhebung von Vorerkrankungen und Medikamenten sowie zentral analysierte (Firma Synlab, Mannheim) Laborwerte zu Serumkreatinin (mg/dl), Albumin (g/l), Hämoglobin (g/dl), Albumin-Kreatinin-Ratio (ACR, mg/g) und HbA1c (%).
Da die Bekanntheit einer prävalenten CKD geschätzt werden sollte, wurden nur diejenigen Studienteilnehmer berücksichtigt (N = 3305), die gemäß ihrer Serumkreatinin- und Urin-Albumin-Werte nach Definition der internationalen Leitlinie KDIGO (Kidney Disease: Improving Global Outcomes) 14 eine CKD der Stadien 1–4 hatten.
Variablen-Definition
Eine unbekannte CKD wurde gemäß der Antwort der Studienteilnehmer auf die Frage: ‚Wurde Ihnen jemals gesagt, dass Sie nierenkrank seien oder dass Sie Nierensteine haben? kodiert. Serumkreatinin wurde mit der enzymatischen Methode auf einer Roche Cobas 6000 C502 bestimmt. Die geschätzte glomeruläre Filtrationsrate (eGFR, ml/min/1,73 m²) wurde mit der CKD-Epi-Formel berechnet 15 .
Das Alter wurde in Altersgruppen (< 50, 50–59, 60–69, 70–79 und ≥ 80 Jahre) einbezogen.
Die Einnahme antihypertensiver Medikation wurde gemäß Selbstangabe der Teilnehmer kodiert. Die Einnahme antidiabetischer Medikamente wurde angenommen, wenn eines der angegebenen Medikamente einen ATC-Code, beginnend mit A10 aufwies. HbA1c war für 2471 Patienten vorhanden.
Eine ACR von 30–299 mg/g wurde als Mikroalbuminurie, eine ACR ≥ 300 als Makroalbuminurie kodiert. Eine Anämie wurde bei Frauen bei einem Hb < 12 g/dl, bei Männern < 13 g/dl kodiert. Bei einem BMI ≥ 30 kg/m² wurde Adipositas kodiert. Die KDIGO-Leitlinie von 2012 empfiehlt, bei Patienten mit CKD den Blutdruck auf einen Zielwert von unter 140 mmHg systolisch und unter 90 mmHg diastolisch zu senken 14 . Dieser Grenzwert wurde als Grenze für eine gute bzw. weniger gute Blutdruck-Kontrolle verwendet. Ein Blutdruck von ≥ 160 mmHg systolisch oder ≥ 95 mmHg diastolisch wurde als nicht adäquate Blutdruckkontrolle klassifiziert. Als anzustrebender Wert für den HbA1c gilt nach KDIGO < 7 %. Als Zielwert bei Niereninsuffizienz wird etwa 7 % empfohlen 14 . HbA1c-Werte wurden in die Kategorien < 7, 7–< 7.5, 7.5–< 9 und ≥ 9 % eingeteilt, um eine optimale, adäquate, weniger gute und inadäquate Glukose-Kontrolle zu kodieren.
Eine kardiovaskuläre Vorerkrankung wurde bei mindestens einer positiven Antwort auf die Fragen nach erlittenem/r Herzinfarkt, Bypass-Operation, Schlaganfall oder Herzversagen angenommen.
Für jeden Teilnehmer wurde mit der Kidney-failure-risk-equation (KFRE) die Wahrscheinlichkeit für das Eintreten eines terminalen Nierenversagens innerhalb der nächsten 5 Jahre geschätzt 16 .
Zusammenfassend über die Risikofaktoren Alter ≥ 70 Jahre, Makroalbuminurie, Anämie, Adipositas, kardiovaskuläre Vorerkrankungen, antihypertensive sowie antidiabetische Medikation wurde die Variable „Summe CKD-relevanter Risikofaktoren“ gebildet. Dazu wurden für jeden vorliegenden Risikofaktor ein Punkt angenommen und die Belastungen addiert. Die Variable hat demnach einen Wertebereich von 0 (keine CKD-bezogenen Risikofaktoren) bis 7.
Umgang mit fehlenden Werten
Alle Auswertungen wurden als „Complete-case“-Analyse durchgeführt. Die Variablen ‚antihypertensive Medikation‘ (N = 2), ‚Blutdruck‘ (N = 4), ‚BMI‘ (N = 8), ‚Proteinurie‘ und der davon abgeleitete KFRE-Risikoscore (N = 74) und ‚Anämie‘ (N = 150) enthielten fehlende Werte.
Statistische Methoden
Stratifiziert nach Altersgruppen, CKD-Stadien, BMI- und Blutdruck-Kategorien, nach antihypertensiver und antidiabetischer Medikation, den Komorbiditäten (Anämie, Albuminurie, kardiovaskulären Vorerkrankungen) sowie dem Risiko für ein terminales Nierenversagen wurden die Prävalenz-Differenzen (mit 95 %-Konfidenzintervallen [KI], exakten Konfidenzintervallen nach Clopper-Pearson) hinsichtlich des Anteils an Männern und Frauen mit einer unbekannten CKD berechnet. Die Prävalenz der Unbekanntheit einer vorliegenden CKD (mit 95 % KI) wurde geschlechtsspezifisch und zusätzlich stratifiziert nach CKD-Stadien für die genannten Subgruppen geschätzt.
Zusätzlich haben wir die Prävalenz-Ratio (PR, mit 95 %-KI) für die Unkenntnis einer vorliegenden CKD geschlechtsspezifisch, univariat für demografische und klinische Merkmale, sowie für Frauen im Vergleich zu Männern, CKD-Stadien-spezifisch grob sowie nach Alter und den in der Analyse berücksichtigten Risikofaktoren adjustiert (antihypertensive Medikation, antidiabetische Medikation, Albuminurie, Bluthochdruck, Adipositas, kardiovaskuläre Vorerkrankungen und Kohorten-Zugehörigkeit) sowie durch Regressionsmodelle (Poisson-Verteilung mit robuster Varianzschätzung) geschätzt.
Alle Auswertungen wurden mit SAS 9.4 durchgeführt.
Ergebnisse
Von 3305 teilnehmenden Personen waren 1237 (37 %) Frauen ( Tab. 1 ). Etwa ein Drittel der Frauen (35 %) und knapp ein Viertel der Männer (24 %) war 80 Jahre und älter. Dieser Unterschied ist dadurch begründet, dass unter den Frauen ein größerer Anteil an Teilnehmern der BIS-Studie zu finden ist (43 %) als bei den Männern (25 %). Der Anteil von Personen mit einer höhergradigen CKD (Stadium 4) betrug in beiden Geschlechtern etwa 6 %. Knapp 90 % aller Teilnehmer gaben an, antihypertensive Medikation einzunehmen. Frauen waren häufiger adipös als Männer (46 % vs. 41 %) und hatten häufiger einen inadäquat kontrollierten Blutdruck (≥ 160/95 mmHg) (25 % vs. 20 %). Männer nahmen öfter antidiabetische Medikation als Frauen (47 % vs. 42 %), ihr HbA1c war jedoch häufiger schlecht kontrolliert (21 % vs. 16 % für HbA1c ≥ 7,5 %). Sie hatten häufiger eine Makroalbuminurie (12 % vs. 7 %) und gaben deutlich häufiger als Frauen eine ischämische Herzkrankheit (28 % vs. 16 %) oder Herzversagen (16 % vs. 6 %) als Vorerkrankung an.
Tab. 1. Beschreibung der Studienteilnehmer mit einer Niereninsuffizienz Stadium 1–4 (N = 3.305) nach Geschlecht; Baseline-Daten deutscher Kohortenstudien und Register mit Bezug zu chronischer Niereninsuffizienz (= Kern-Datenbank), 2010: Anzahl von Personen (%), Mittelwert (MW), (Standardabweichung (STD) oder Median (Interquartils-Range (IQR)).
| Frauen | Männer | Gesamt | |
| Alle | 1.237 (37,4) | 2.068 (62,6) | 3.305 |
| Alter (Jahre) MW (STD) | 75,0 (10,6) | 72,6 (10,2) | 73,5 (10,4) |
| Altersgruppen | |||
|
29 (2,3) | 54 (2,6) | 83 (2,5) |
|
89 (7,2)) | 149 (7,2) | 238 (7,2) |
|
157 (12,7) | 491 (23,7) | 648 (19,6) |
|
531 (42,9) | 869 (42,0) | 1400 (42,4) |
|
431 (34,9) | 505 (24,4) | 936 (28,3) |
| Kohorte/Register | |||
|
344 (27,8) 368 (29,8) 525 (42,4) |
829 (40,1) 725 (35,1) 514 (24,8) |
1.173 (35,5) 1.093 (33.1) 1.039 (31.4) |
| eGFR (ml/min/1,73 m²), Median (IQR) | 53,7 (44,5; 68,8) | 56,6 (46,0; 77,3) | 55,3 (45,3; 74,3) |
|
112 (9,1) | 250 (12,1) | 362 (11,0) |
|
277 (22,4) | 580 (28,1) | 857 (25,9) |
|
528 (42,7) | 756 (36,6) | 1284 (38,9) |
|
245 (19,8) | 366 (17,7) | 611 (18,5) |
|
75 (6,01) | 116 (5,6) | 191 (5,8) |
| Albuminurie (N = 3.231) | |||
| ACR (mg/g), Median (IQR) | 32,0 (10,0; 67,6) | 46,5 (15,8; 128,2) | 40,3 (13,0; 101,2) |
|
562 (46,5) | 671 (33,2) | 1233 (38,2) |
|
568 (47,0) | 1111 (54,9) | 1679 (52,0) |
|
78 (6,5) | 241 (11,9) | 319 (9,9) |
| BMI (kg/m²), MW (Std) | 30,0 (6,0) | 29,6 (5,2) | 29,8 (5,5) |
|
250 (20,3) | 359 (17,4) | 609 (18,5) |
|
413 (33,5) | 869 (42,1) | 1282 (38,9) |
|
570 (46,3) | 836 (40,5) | 1406 (42,6) |
| Antihypertensive Medikation | 1096 (88,7) | 1844 (89,2) | 2940 (89,0) |
| Blutdruck (mmHg), Mean (Std) | |||
|
605 (49,0) | 1108 (53,7) | 1713 (51,9) |
|
328 (26,5) | 536 (26,0) | 864 (26,2) |
|
303 (24,5) | 421 (20,4) | 724 (21,9) |
| Antidiabetische Medikation | 523 (42,3) | 972 (47,0) | 1495 (45,2) |
| Hba1c (N = 2.471) (%) MW (Std) | 6,6 (1,1) | 6,7 (1,1) | 6,7 (1,1) |
|
738 (74,5) | 1021 (69,5) | 1759 (71,5) |
|
95 (9,6) | 143 (9,7) | 238 (9,7) |
|
120 (12,1) | 237 (16,1) | 357 (14,5) |
|
38 (3,8) | 69 (4,7) | 107 (4,4) |
| Anämie 1 (N = 3.155) | 229 (19,3) | 530 (27,0) | 759 (24,1) |
| Kardiovaskuläre Vorerkrankung 2 | 312 (25.2) | 792 (38.3) | 1104 (33.4) |
| Risiko ESRD (nach KFRE) (N = 3.231) | |||
|
1033 (85,5) | 1630 (80,6) | 2663 (82,4) |
|
92 (7,6) | 193 (9,5) | 285 (8,8) |
|
54 (4,5) | 110 (5,4) | 164 (5,1) |
|
29 (2,4) | 90 (4,5) | 119 (3,7) |
| 4 und mehr Risikofaktoren 3 | 139 (11,3) | 284 (13,7) | 423 (12,8) |
ACR = Albumin-Kreatinin-Ratio, BMI = Body Mass Index, CAD-Ref = Coronary Artery Disease – Renal Failure Register, CKD = chronische Niereninsuffizienz, eGFR = geschätzte glomeruläre Filtrationsrate, ESRD = End stage renal disease, IQR = Inter-Quartils-Range, KFRE = kidney failure risk equation, MW = Mittelwert, Std = Standardabweichung.
Anämie = Hb < 12 g/dl (Frauen), < 13 g/dl (Männer).
Ischämische Herzkrankheit, Herzversagen oder Schlaganfall.
Risikofaktoren = Makroalbuminurie, Bluthochdruck, Diabetes, kardiovaskuläre Vorerkrankung, Anämie, Adipositas, Alter ≥ 70 Jahre.
Die Unkenntnis über eine CKD war bei beiden Geschlechtern hoch. Bei einer CKD im Stadium 1 oder 2 waren jeweils 82 % der Männer und Frauen nicht über ihre CKD informiert ( Abb. 1 ).
Abb. 1.
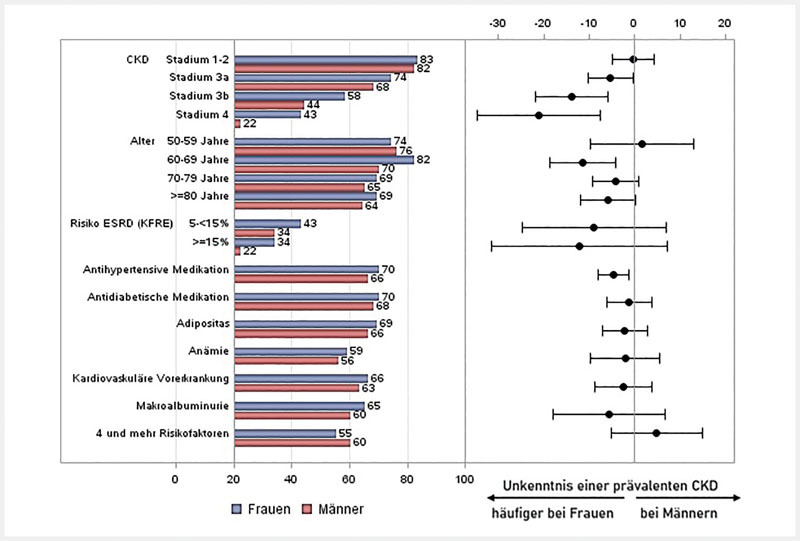
Geschlechtsspezifische Prävalenz der Unkenntnis über eine vorliegende CKD: nach CKD-Stadien und weiteren Einflussfaktoren (links) sowie absolute Risikodifferenz (Unkenntnis bei Männern – Unkenntnis bei Frauen) mit 95 %-Konfidenzintervall (rechts). Baseline-Daten von 3305 Teilnehmern an deutschen Kohortenstudien und Registern mit Bezug zu chronischer Niereninsuffizienz (= Kern-Datenbank), 2010 – eigene Darstellung. ACR Albumin-Kreatinin-Ratio, BMI = Body-Mass-Index, CKD = chronische Niereninsuffizienz, ESRD = End Stage Renal Disease (terminales Nierenversagen), KFRE = Kidney Failure Risk Equation. Definitionen der in der Abbildung verwendeten Variablen: Adipositas = BMI ≥ 30 kg/m²; Anämie = Hb< 12 (Frauen), Hb < 13 (Männer); Kardiovaskuläre Vorerkrankungen = Herzinfarkt, Schlaganfall, Herzversagen; Makroalbuminurie = ACR ≥ 300 mg/g; Risikofaktoren = Makroalbuminurie, Bluthochdruck, Diabetes, kardiovaskuläre Vorerkrankung, Anämie, Adipositas, Alter ≥ 70.
Ein Geschlechtsunterschied in der Kenntnis ihrer CKD war ab einer CKD im Stadium 3a sichtbar, in dem 74 % (95 %-Konfidenzintervall: 70–77 %) der Frauen und 68 % (65–72 %) der Männer keine Kenntnis über ihre Krankheit hatten. Dieser Unterschied nahm mit steigendem CKD-Stadium deutlich zu. Frauen mit einer CKD im Stadium 3b hatten um 14 %-Punkte seltener Kenntnis über ihre Erkrankung als Männer (57,6 % vs. 43,7 %). Bei Vorliegen einer CKD, Stadium 4 betrug die Differenz 21 %-Punkte (Männer 43 % vs. Frauen 22 %).
Die Betrachtung der geschlechtsspezifischen Prävalenz-Ratios zeigt unterschiedlich starke Assoziationen einzelner klinischer Merkmale mit der Kenntnis über eine prävalente CKD ( Tab. 2 ). Eine Albuminurie war mit häufigerer Unkenntnis einer CKD assoziiert; dies besonders deutlich bei Männern (PR: 1,15 (1,07; 1,23)). Eine Anämie dagegen war mit häufigerem Wissen über eine CKD assoziiert (PR für Frauen: 0,78 (0,70; 0,88), für Männer: 0,80 (0,74; 0,87)). Bluthochdruck oder antidiabetische Medikation war bei Männern mit häufigerer Unkenntnis assoziiert.
Tab. 2. Geschlechtsspezifische univariate Prävalenz-Ratios (95 %-Konfidenzinterval) für Unkenntnis einer prävalenten CKD – stratifiziert nach demographischen und klinischen Merkmalen. Baseline-Daten deutscher Kohortenstudien und Register mit Bezug zu chronischer Niereninsuffizienz (= Kern-Datenbank), 2010.
| Frauen | Männer | |
Altersgruppen
|
1.06 (0.85; 1.33) Referenz |
1.02 (0.86; 1.21) Referenz |
|
1,08 (0,94; 1,25) | 0,93 (0,83; 1,03) |
|
0,93 (0,81; 1,06) | 0,85 (0,77; 0,95) |
|
0,92 (0,81; 1,07) | 0,85 (0,76; 0,95) |
| CKD – Stadien | ||
|
Referenz | Referenz |
|
0,89 (0,83; 0,96) | 0,83 (0,78; 0,88) |
|
0,71 (0,63; 0,79) | 0,54 (0,48; 0,61) |
|
0,51 (0,39; 0,67) | 0,28 (0,20; 0,40) |
| Kohorte/Register | ||
|
Referenz 1,06 (0,96; 1,16) 1,01 (0,92; 1,10) |
Referenz 1,05 (0,99; 1,13) 0,93 (0,86; 1,01) |
| Risikofaktoren | ||
|
1,07 (1,00; 1,15) | 1,15 (1,07; 1,23) |
|
0,93 (0,87; 1,00) | 0,99 (0,93; 1,05) |
|
0,86 (0,79; 0,94) | 0,84 (0,77; 0,91) |
|
0,97 (0.90; 1.04) | 1,05 (0,99; 1,12) |
|
0,96 (0,89; 1,03) | 1,04 (0,98; 1,11) |
|
0,78 (0,70; 0,88) | 0,80 (0,74; 0,87) |
|
0,89 (0.81; 0.98) | 0,94 (0,87;1,01) |
|
Referenz | Referenz |
|
0,72 (0,59; 0,87) | 0,67 (0,58; 0,78) |
|
0,56 (0,41; 0,77) | 0,45 (0,35; 0,59) |
|
0,46 (0,28; 0,75) | 0,30 (0,20; 0,44) |
|
0,75 (0,65; 0,88) | 0,89 (0,80; 0,98) |
CAD-Ref = Coronary Artery Disease – Renal Failure Register, CKD = chronische Niereninsuffizienz, ESRD = Endstage renal disease, terminales Nierenversagen, ACR = Albumin-Kreatinin-Ratio, BMI = Body Mass Index. *Referenz-Gruppe: CKD-Patienten ohne das entsprechende Merkmal.
Albuminurie = ACR ≥ 30 mg/g.
Adipositas = BMI ≥ 30 kg/m².
Bluthochdruck = Systolisch ≥ 140 mmHg oder diastolisch ≥ 90 mmHg.
Anämie = Hb < 12 g/dl (Frauen), Hb < 13 g/dl (Männer).
Kardiovaskuläre Vorerkrankung = ischämische Herzkrankheit oder Herzinsuffizienz oder Schlaganfall.
Bestimmt durch die Kidney Failure Risk Equation.
Risikofaktoren: Makroalbuminurie, Bluthochdruck, Diabetes, kardiovaskuläre Vorerkrankung, Anämie, Adipositas, Alter ≥ 70 Jahre.
Stratifiziert nach CKD-Stadium ist der geschlechtsspezifische Unterschied in der Unkenntnis auch bei Personen mit Komorbiditäten und über alle Altersgruppen sichtbar ( Tab. 3 ). Bei einer CKD im Stadium 3–4 ist dies besonders deutlich für die Altersgruppe 60–69 Jahre: In 73 % (45–92 %) der Frauen, aber nur 34 % (21–49 %) der Männer sind in diesem Alter in Unkenntnis einer CKD im Stadium 3b; 44 % (14–79 %) der Frauen gegenüber 12 % (1,5–36 %) der Männer wissen nichts von ihrer CKD im Stadium 4. Antidiabetisch behandelte Patientinnen und Patienten waren – wenn überhaupt – nur unwesentlich häufiger über ihre Niereninsuffizienz informiert. Bei gleichzeitigem Vorliegen von 4 oder mehr der ausgewählten Risikofaktoren wussten Frauen mit einer CKD im Stadium 3a oder 4 häufiger von ihrer Erkrankung als Männer. In der BIS-Studie wussten Frauen seltener von einer fortgeschrittenen CKD (CKD-Stadien 3b und 4) als die Teilnehmerinnen der anderen Studien. Der Geschlechtsunterschied war hier besonders deutlich: etwa 2 von 3 Frauen war ihre CKD 3b bzw. CKD 4 nicht bekannt. Bei männlichen BIS-Teilnehmern war dies bei einer CKD 3b bei 45 %, bei einer CKD 4 bei 29 % der Fall.
Tab. 3. Anzahl (N) Patienten je Untergruppe sowie Anteil der Patienten ohne Kenntnis über eine vorliegende chronische Niereninsuffizienz (CKD) (% mit 95 %-Konfidenzintervall) stratifiziert nach Geschlecht und CKD Stadium sowie weiteren CKD bezogenen Risikofaktoren. Baseline-Daten von 3305 Teilnehmern an deutschen Kohortenstudien und Registern mit Bezug zu chronischer Niereninsuffizienz (= Kern-Datenbank), 2010.
| CKD Stadium 1 oder 2 | CKD Stadium 3a | CKD Stadium 3b | CKD Stadium 4 | ||||||
| Frauen | Männer | Frauen | Männer | Frauen | Männer | Frauen | Männer | ||
| Alle | N | 389 | 830 | 528 | 756 | 245 | 366 | 75 | 116 |
| % | 82,5 (78,4; 86,2) | 82,2 (79,4; 84,7) | 73,7 (69,7; 77,4) | 68,4 (64,9; 71,7) | 57,6 (51,1; 63,8) | 43,7 (38,6; 49,0) | 42,7 (31,3; 54,6) | 21,6 (14,5; 30,2) | |
| Alter 1 | |||||||||
| 50–59 Jahre | N % | 59 81,4 (69,1; 90,3) |
118 82,2 (74,1; 88,6) |
19 79,0 (54,4; 94,0) |
19 73,7 (53,9; 93,5) |
7 28,6 (3,7; 71,0) |
7 14,3 (0,3; 57,9) |
4 25,0 (0,6; 80,6) |
5 20,0 (0,5; 71,6) |
| 60–69 Jahre | N % | 75 84,0 (73,7; 91,5) |
270 83,7 (78,8; 87,9) |
58 86,2 (74,6; 93,9) |
154 64,3 (56,2; 71,8) |
15 73,3 (44,9; 92,2) |
50 34,0 (21,2; 48,8) |
9 44,4 (13,7; 78,8) |
17 11,8 (1,5; 36,4) |
| 70–79 Jahre | N % | 153 81,7 (74,7; 87,5) |
298 82,6 (77,8; 86,7) |
257 72,0 (66,1; 77,4) |
350 66,9 (61,7; 71,8) |
93 49,5 (38,9; 60,0) |
171 43,9 (36,3; 61,6) |
28 39,3 (21,5; 59,4) |
50 18,0 (8,6; 31,4) |
| 80 + Jahre | N % | 77 81,8 (71,4; 89,7) |
97 74.2 (64,4; 82,6) |
192 71,9 (65,0; 78,1) |
231 73,2 (67,0; 78,8) |
128 64,1 (55,1; 72,4) |
137 48,9 (39,9; 79,8) |
34 47,1 (29,8; 64,9) |
40 32,5 (18,6; 49,1) |
| CAD-Ref | N % | 113 92,9 (86,7; 96,9) |
316 88,9 (84,9; 92,2) |
134 73,1 (64,8; 80,4) |
325 66,8 (61,4; 71,9) |
73 45,2 (33,5; 57,3) |
143 35,0 (27,2; 43,4) |
24 8,3 (1,0; 27,0) |
45 11,1 (3,7; 24,1) |
| Diabetes Kohorte (DIACORE) | N % | 151 78,8 (71,4; 85,0) |
380 79,0 (74,9; 82,9) |
144 79,2 (71,6; 85,5) |
216 69,9 (63,3; 75,9) |
49 55,1 (41,2; 69,0) |
89 55,1 (44,1; 65,6) |
24 54,2 (32,8; 74,5) |
40 27,5 (14,6; 43,9) |
| Berlin Initiative Studie (BIS) | N % | 125 77,6 (69,3; 84,6) |
134 75.4 (67,2; 82,4) |
250 70,8 (64,7; 76,4) |
215 69,3 (62,7; 75,4) |
123 65,9 (56,8; 74,2) |
134 45,5 (36,9; 54,4) |
27 63,0 (42,4; 80,6) |
31 29,0 (14,2; 48,0) |
| Adipositas (BMI≥ 30 kg/m²) | N % | 184 77,7 (71,0; 83,5) |
390 80,5 (76,2; 84,3) |
233 72,5 (66,3; 78,2) |
266 65,0 (59,0; 70,8) |
107 58,9 (49,0; 68,3) |
134 41,8 (33,3; 50,6) |
46 34,8 (21,4; 50,3) |
46 26,1 (14,3; 41,1) |
| Antihypertensive Medikation | N % | 324 81,5 (76,8; 85,6) |
703 81,8 (78,7; 84,6) |
465 73,3 (69,1; 77,3) |
683 67,2 (63,5; 70,7) |
235 57,0 (50,4; 63,4) |
349 43,3 (38,0; 48,7) |
72 43,1 (31,4; 55,3) |
109 22,0 (14,7; 31,0) |
| Blutdruckkontrolle 2 | |||||||||
| Weniger gut | N % | 93 75,3 (65,2; 83,6) |
231 83,1 (77,7; 87,7) |
149 75,2 (67,4; 81,9) |
187 70,1 (62,9; 76,5) |
64 53,1 (40,2; 65,7) |
91 44,0 (33,6; 54,8) |
22 27,3 (10,7; 50,2) |
27 29,6 (13,8; 50,2) |
| Inadäquat | N % | 117 83,8 (75,8; 89,9) |
211 80,1 (74,1; 85,3) |
126 69,1 (60,0; 77,0) |
131 65,7 (56,9; 73,7) |
49 61,2 (46,2; 74,8) |
67 44,8 (32,6; 57,4) |
11 54,6 (23,4; 83,3) |
; * |
| Antidiabetische Medikation | N % | 198 78,8 (72,4; 84,3) |
468 80,1 (76,2; 83,7) |
195 73,9 (67,1; 80,0) |
315 67,0 (61,5; 72,2) |
89 51,7 (40,8; 62,4) |
137 46,7 (38,2; 55,4) |
41 43,9 (28,5; 60,3) |
52 28,9 (17,1; 43,1) |
| Mikroalbuminurie (ACR 30- < 300 mg/g) | N % | 355 82,8 (78,5; 86,6) |
719 83,2 (80,2; 85,8) |
113 71.7 (62,4; 79,8) |
220 65,9 (59,2; 72,2) |
75 54,7 (42,8; 66,2) |
131 42,8 (34,2; 51,7) |
25 40,0 (21,1; 61,3) |
41 19,5 (8,8; 34,9) |
| Makroalbuminurie (ACR ≥ 300 mg/g) | N % | 34 79,4 (62,1; 91,3) |
111 75,7 (66,6; 83,3) |
16 75,0 (47,6; 92,7) |
52 71,2 (56,9; 82,9) |
16 50,0 (24,7; 75,4) |
44 34,1 (20,5; 49,9) |
12 33,3 (9,9; 65,1) |
34 23,5 (10,8; 41,2) |
| Anämie 3 | N % | 37 83,8 (68,0; 93,8) |
99 73,7 (63,9; 82,1) |
85 68,2 (57,2; 77,9) |
213 67,1 (60,4; 73,4) |
70 47,1 (35,1; 59,5) |
147 46,3 (38,0; 54,7) |
37 32,4 (18,0; 49,8) |
71 21,1 (12,2; 32,4) |
| Kardiovaskuläre Vorerkrankung 4 | N % | 81 77,8 (67,2; 86,3) |
266 83,1 (78,0; 87,4) |
116 73,3 (64,3; 81,1) |
301 65,1 (59,4; 70,5) |
85 54,1 (43,0; 65,0) |
162 43,2 (35,5; 51,2) |
30 36,7 (19,9; 56,1) |
63 22,2 (12,7; 34,5) |
| 4 oder mehr Risikofaktoren 5 | N % | 28 75,0 (55,1; 89,3) |
90 73,3 (63,0; 82,1) |
48 62,5 (47,4; 76,1) |
87 66,7 (55,8; 76,4) |
37 51,4 (34,3; 68,1) |
67 47,8 (35,4; 60,3) |
26 26,9 (11,6; 47,8) |
40 37,5 (22,7; 54,2) |
ACR = Albumin-Kreatinin-Ratio, BMI = Body Mass Index, CAD–Ref = Coronary Artery Disease – Renal Failure Register, CKD = chronische Niereninsuffizienz. * keine Patienten mit diesen Merkmalen.
Altersgruppe < 50 Jahre ist nicht dargestellt, da die geringe Anzahl von Personen in den Strata keine Abschätzung der Prävalenz der CKD-Unkenntnis erlaubt. Altersgruppe 50–59 Jahre: Schätzung der Prävalenz der Unkenntnis bei CKD Stadien 3b und 4 wegen kleiner Fallzahl nur eingeschränkt interpretierbar, da sehr großes Konfidenzintervall.
Blutdruckkontrolle weniger gut: systolisch 140-< 160 mmHg oder diastolisch 90-< 95 mmHg, inadäquat: systolisch ≥ 160mHg oder diastolisch ≥ 95 mmHg.
Anämie = Hb < 12 g/dl (Frauen), Hb < 13 g/dl (Männer).
Herzversagen oder ischämische Herzkrankheit oder Schlaganfall.
Risikofaktoren = Makroalbuminurie, Bluthochdruck, Diabetes, kardiovaskuläre Vorerkrankung, Anämie, Adipositas, Alter ≥ 70.
Auch nach Adjustierung ausgewählter Einflussfaktoren zeigt sich der mit CKD-Stadium ansteigende Geschlechtsunterschied: Die PR für die Unkenntnis einer CKD im Stadium 3a beträgt 1,08 (1,00; 1,16) und 1,75 (1,14; 2,68) bei CKD im Stadium 4 ( Tab. 4 ).
Tab. 4. CKD Stadium-spezifisches Prävalenz Ratio (PR) für die Unkenntnis einer prävalenten CKD von Frauen im Vergleich zu Männern (N = Anzahl der in den jeweiligen Modellen einbezogene Beobachtungen)- Roh, sowie adjustiert nach Alter, und zusätzlichen Einflussfaktoren. Baseline-Daten von 3.305 Teilnehmern an deutschen Kohortenstudien und Registern mit Bezug zu chronischer Niereninsuffizienz (= Kern-Datenbank), 2010.
| Modell für geschlechtsspezifische Kenntnis einer CKD |
CKD 1 oder 2 | CKD 3a | CKD 3b | CKD 4 | |
| …Roh | N | 1.219 | 1.284 | 611 | 191 |
| PR | 1,00 (0,95; 1,06) | 1,08 (1,00; 1,16) | 1,32 (1,12; 1,54) ǂ | 1,98 (1,28; 3,06) | |
| …adjustiert nach Alter | N | 1.219 | 1.284 | 611 | 191 |
| PR | 1,01 (0,95; 1,07) | 1.08 (1.00; 1.16) | 1,27 (1,09; 1,49) | 1,90 (1,23; 2,94) | |
| …adjustiert nach allen Einflussfaktoren 1 | N | 1.214 | 1.233 | 591 | 180 |
| PR | 1,02 (0,96; 1,08) | 1,08 (1,00; 1,16) | 1,25 (1,07; 1,46) ǂǂ | 1,75 (1,14; 2,68) | |
ACR = Albumin-Kreatinin-Ratio, BMI = Body Mass Index, CAD-Ref = Coronary Artery Disease – Renal Failure Register, CKD = chronische Niereninsuffizienz, PR = Prävalenz-Ratio.
Interpretationsbeispiel: PR = 1,32 = > Frauen sind 1,32x so häufig in Unkenntnis einer vorliegenden CKD 3b wie Männer.
adjustiert nach Alter, antihypertensive Medikation, antidiabetische Medikation, Albuminurie (ACR≥ 30 mg/g), kardiovaskuläre Vorerkrankungen (Herzinfarkt, Schlaganfall, Herzversagen), Adipositas (BMI ≥ 30 kg/m²), Bluthochdruck (Systolisch ≥ 140 mmHg oder diastolisch ≥ 90 mmHg) und Kohorten-Zugehörigkeit (CAD-Ref, DIACORE, BIS).
Interpretationsbeispiel: PR = 1,25 = > Frauen sind 1,24x so häufig in Unkenntnis einer vorliegenden CKD 3b wie Männer – unabhängig vom Alter und vom Vorliegen weiterer Einflussfaktoren.
Diskussion
Die Unkenntnis über eine prävalente CKD in allen Stadien ist bei Frauen häufiger als bei Männern. Der Geschlechtsunterschied zuungunsten der Frauen wächst mit steigendem CKD-Stadium und besteht unabhängig vom Alter und dem Vorliegen weiterer Risikofaktoren und Vorerkrankungen wie Diabetes mellitus, Hypertonie, Proteinurie oder kardiovaskulärer Erkrankungen.
Da es in Deutschland kein strukturiertes CKD-Screening gibt, ist der hohe Anteil unbekannter Niereninsuffizienz für beide Geschlechter in den frühen Stadien 1 und 2 nicht überraschend. Obwohl 98 % der Betroffenen antihypertensiv oder antidiabetisch behandelt wurden oder eine kardiovaskuläre Vorerkrankung hatten, ist auch der Anteil von Personen mit einer unbekannten CKD im Stadium 3b oder 4 hoch 9 . Die Empfehlungen einer regelmäßigen Kontrolle der Nierenfunktion in den Versorgungsleitlinien zu Diabetes mellitus oder kardiovaskulären Erkrankungen sowie zum Medikationsmonitoring scheinen nicht dazu zu führen, dass betroffene CKD-Patienten von ihrer Erkrankung erfahren. Nach einer Auswertung von Daten aus Allgemein- und Facharztpraxen 2016 in Deutschland zum Monitoring von Nierenfunktion und Blutdruck bei Diabetikern wurde nur bei 15 % der Betroffenen in allgemeinärztlicher Behandlung die jährliche Bestimmung der Nierenfunktion durchgeführt 17 . Bei einer länger als einem Jahr zurückliegenden Diabetes-Diagnose verringerte sich die Chance auf eine jährliche Überprüfung der eGFR (OR = 0,72 (0,62–0,83)). Die empfohlene, halbjährliche Überprüfung des Blutdrucks wurde nur bei 52 % der Diabetiker durchgeführt. Eine prävalente koronare Herzkrankheit hatte keine Auswirkung auf die Frequenz dieses Monitorings. Ähnliches galt auch für die Behandlung von Hypertonikern 18 .
Jedoch – selbst wenn eine CKD-Diagnose nach Überprüfung der Nierenfunktion erfolgt – könnte diese Information nicht immer an Patienten weitergegeben werden. Dies wäre insbesondere bei älteren Patienten denkbar, da der altersunabhängige eGFR-Grenzwert für Niereninsuffizienz von < 60 ml/min/1,73 m² kritisch diskutiert wird 19 . Viele Ärzte sehen das Absinken der Nierenfunktion eher als einen normalen Alterungs-Prozess denn als eine zu diagnostizierende und zu therapierende Krankheit 19 .
Schwierigkeiten im Verständnis der Arzt-Informationen könnten dazu führen, dass die Bedeutung der Niereninsuffizienz durch den Patienten nicht erkannt wird. Untersuchungen der Arzt-Patienten-Kommunikation zeigten, dass Gespräche nach einer CKD-Diagnose seltener stattfinden und weniger informativ sind als bei anderen chronischen Erkrankungen. Dabei ist die Informiertheit der Patienten wichtig, um Therapieziele zu erreichen und die Compliance zu erhöhen 7 20 .
Es ist schwer zu erklären, warum Frauen in fast allen betrachteten Subgruppen seltener von ihrer Erkrankung wussten als Männer und warum der Geschlechtsunterschied in den höheren Stadien der Niereninsuffizienz (Stadium 3b und 4) deutlich zunimmt. Ein geschlechtsbezogener Unterschied in der Unkenntnis über eine CKD der Stadien 3–5 wurde bisher nur mit NHNANES-Daten aus den USA beschrieben 10 . In fast allen Untergruppen (nach Alter, Krankheits-Stadium oder nach Risikofaktoren) war ein Geschlechtsunterschied zuungunsten der Frauen sichtbar.
Da Männer mit einer Niereninsuffizienz ein höheres Risiko für ein terminales Nierenversagen haben als Frauen 21 22 , könnte dies dazu führen, dass Ärzte die Nierenfunktion bei Männern mit bekannter CKD in einem früheren Stadium häufiger überprüfen und die Patienten somit häufiger von ihrer Krankheit wissen. Allerdings sind Frauen allgemein öfter von einer Niereninsuffizienz betroffen 22 , was wiederum eine häufigere Kontrolle der Nierenfunktion in der regulären Versorgung bei weiblichen Patienten – insbesondere bei Vorliegen weiterer Risikofaktoren – initiieren müsste.
Frauen interessieren sich im Allgemeinen mehr für gesundheitliche Themen und suchen häufiger aktiv nach Gesundheits-Informationen als Männer 23 24 , die wiederum seltener an Vorsorgeprogrammen teilnehmen und häufiger ein gesundheitliches Risikoverhalten zeigen 25 . Diese Unterschiede im Gesundheitsverhalten würden erwarten lassen, dass Frauen häufiger über ihre Niereninsuffizienz Bescheid wissen als Männer.
In unseren Daten sind keine Angaben zur Bildung der Teilnehmer und Teilnehmerinnen verfügbar. Es ist aber anzunehmen, dass Studien-Teilnehmende ein höheres Bildungsniveau haben als Personen, die kein Interesse an Studien haben 26 . Im höheren Alter könnte ein Kohorteneffekt einer geringeren Schulbildung bei Frauen zu einer selteneren Kenntnis der CKD beitragen. Die Geschlechtsunterschiede im Krankheitswissen waren jedoch gerade bei Betroffenen im Alter von 60–69 Jahren groß. Insbesondere der deutliche Anstieg des geschlechtsspezifischen Unterschieds in der Kenntnis der CKD in den höheren CKD-Stadien kann durch eine potenziell niedrigere Bildung der Frauen nicht erklärt werden. Die höhere Prävalenz der CKD-Unkenntnis bei Frauen ist in allen CKD-Stadien über fast alle Altersgruppen erkennbar. Frauen im Alter von 70–79 Jahren mit einer CKD im Stadium 1 oder 2 sowie Frauen im Alter von 80 Jahren und mehr mit einer CKD im Stadium 3a gaben sogar etwas häufiger an, von ihrer Krankheit zu wissen als Männer.
Ärzte und – in geringerem Ausmaß – Ärztinnen sind nicht immun gegen einen unbewussten Geschlechter-Bias 27 28 . Geschlechtsspezifische Unterschiede in der Behandlung von Patienten und Patientinnen wurden für verschiedene Erkrankungen beschrieben. Im Falle einer koronaren Herzkrankheit werden bei Frauen seltener optimale Präventionsmaßnahmen eingeleitet 29 ; trotz gleicher Anamnese werden sie seltener invasiv behandelt als Männer 30 31 32 33 34 35 . Im Vergleich zu Männern wurden Frauen mit Brustschmerzen unabhängig vom Alter seltener zur weiteren Abklärung zum Belastungstest oder ins Krankenhaus überwiesen 36 . In Allgemeinarzt-Praxen wurde bei Patientinnen mit Hypertonie seltener eine Bestimmung und ein Monitoring von Risikofaktoren durchgeführt als bei Patienten. Wurde die Betreuung von einer Ärztin durchgeführt, war der Geschlechtsunterschied kleiner 37 . Allgemeine Präventionsmaßnahmen werden häufiger für Männer als für Frauen verschrieben (OR = 1,60 (1,47; 1,75)) und häufiger von Ärztinnen als von Ärzten (OR = 1,35 (1,05; –1,73)) 38 .
Limitationen
Die ausgewerteten Daten stammen zwar bereits aus dem Jahr 2010, wir gehen aber davon aus, dass ein Geschlechtsunterschied in der CKD-Kenntnis unabhängig vom Jahr der Datenerhebung ist. Die von uns beschriebene Fragestellung wurde bisher in Deutschland noch nicht untersucht. Im Vergleich zu Daten anderer deutscher Surveys oder Kohorten – auch aus jüngerer Zeit – enthält die von uns verwendete Datenbasis eine auch im internationalen Vergleich außergewöhnlich große Anzahl von Patienten mit Niereninsuffizienz, denen auch die Frage nach Kenntnis ihrer Erkrankung gestellt wurde. Unsere Analyse bezieht sich darüber hinaus auf qualitätsgesicherte Daten und zentral analysierte Laborwerte von Patienten mit CKD und/oder CKD-bezogenen Komorbiditäten und Risikofaktoren. Informationen zu Bildung oder Sozialstatus der Teilnehmer war nicht verfügbar. Wie von uns dargestellt, ist nicht anzunehmen, dass dieser Faktor die Geschlechtsunterschiede entscheidend beeinflusst. Die hier vorgestellte Auswertung wurde nach Bereitstellung der harmonisierten Gesamtdatenbank post-hoc mit den Daten der Kohortenstudien durchgeführt. Daher waren gegebenenfalls weitere in dem Zusammenhang interessierende Variablen nicht verfügbar. Die Kernaussage unserer Auswertung wird durch diesen Sachverhalt jedoch nicht beeinflusst.
Fazit
Die Unkenntnis von Patienten und Patientinnen über eine prävalente CKD ist in Deutschland sehr häufig. Der dabei beobachtete Geschlechtsunterschied ist besonders in den späteren CKD-Stadien 3b und 4 sehr ausgeprägt. Der Unterschied in der Kenntnis über eine CKD zwischen den Geschlechtern bleibt bestehen, unabhängig von prävalenten Risikofaktoren oder Komorbiditäten wie Diabetes oder kardiovaskulären Erkrankungen. Als Ursache kann ein nicht leitliniengetreues Monitoring der Nierenfunktion bei Patienten mit höherem CKD-Risiko vermutet werden, verbunden mit geschlechtsabhängigen Behandlungsunterschieden in der allgemeinen Versorgung. Die konsequente Umsetzung der Leitlinien-Empfehlungen, das Bewusstmachen von vorhandenen unbewussten Geschlechts-Stereotypen in der Behandlung sowie Verbesserungen in der Arzt-Patienten-Kommunikation bei Niereninsuffizienz könnten zu einer häufigeren Diagnose und zu einer besseren Kenntnis der Erkrankung führen. Diese Faktoren zusammen könnten darüber hinaus zu rechtzeitiger Behandlung mit höherer Patienten-Compliance führen.
Danksagung
Wir bedanken uns für die Unterstützung durch die KfH-Stiftung Präventivmedizin, 63263 Neu-Isenburg.
Footnotes
Interessenkonflikt Die Autorinnen/Autoren geben an, dass kein Interessenkonflikt besteht.
Kernaussagen.
Mehr als die Hälfte von Patienten mit einer chronischen Niereninsuffizienz im Stadium 3 und höher wissen nicht, dass sie daran erkrankt sind.
Frauen wissen deutlich häufiger als Männer nicht, dass sie eine chronische Niereninsuffizienz haben – dieser Unterschied vergrößert sich mit ansteigendem CKD-Stadium.
Der Anteil von Patienten ohne Kenntnis ihrer CKD sinkt nur marginal bei gleichzeitigem Vorliegen von Diabetes, Hypertonie oder kardiovaskulären Erkrankungen – unabhängig vom CKD-Stadium.
Ein unbewusster Geschlechter-Bias in der primären Patientenversorgung oder bei der Arzt-Patienten-Kommunikation könnte zum Geschlechtsunterschied in der Kenntnis über eine vorliegende CKD beitragen.
Finanzierung
Die Kern-Datenbank wird finanziert und betrieben durch die Stiftung Präventivmedizin des Kuratoriums für Dialyse und Nierentransplantation e. V., KfH.
Ethik
Die Ethikkommissionen der jeweils zuständigen Institutionen haben die Datenschutzbestimmungen und die Studienprotokolle der Kohorten-Studien und Register, deren Daten in der Kern-Datenbank zusammengestellt wurden, genehmigt:
CAD-REF: Ethikvotum durch Ethikkomitee der Landesärztekammer Westfalen-Lippe und der medizinischen Fakultät der Westfälischen Wilhelms-Universität Münster 2007 (No. 2007–315-f-S).
BIS: Ethikvotum durch das Ethikkomitee der Charité – Universitätsmedizin, Berlin, 2008 (No. EA2/009/08)
DIACORE: Ethikvotum durch das Ethikkomitee der Universitäten Regensburg and Mannheim, 2007 (No. 06/139) and 2012 (Nr. 2012–248N-MA).
Von allen Teilnehmern liegt eine schriftliche Patienteneinwilligung in die Studienteilnahme vor. Die Studien wurden im Einvernehmen mit der Deklaration von Helsinki ausgeführt.
Studienregistrierung
CAD-REF: ClinicalTrials.gov under the identifier number NCT00 679 419
( http://clinicaltrials.gov/ct2/show/NCT00679419?term=NCT00679419&rank=1 ).
Literatur
- 1.Edigi G, Schelp H. Prävalenz chronischer Krankheiten und Qualitätsindikatoren in einer Bremer Hausarztpraxis. Z Allg Med. 2009;85:187–195. [Google Scholar]
- 2.Gergei I, Klotsche J, Woitas R et al. Chronic kidney disease in primary care in Germany. J Public Health. 2017;25:223–230. [Google Scholar]
- 3.Girndt M, Trocchi P, Scheidt-Nave C et al. The Prevalence of Renal Failure. Results from the German Health Interview and Examination Survey for Adults, 2008-2011 (DEGS1) Dtsch Arztebl Int. 2016;113:85–91. doi: 10.3238/arztebl.2016.0085. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Tuot D S, Plantinga L C, Hsu C Y et al. Chronic kidney disease awareness among individuals with clinical markers of kidney dysfunction. Clin J Am Soc Nephrol. 2011;6:1838–1844. doi: 10.2215/cjn.00730111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Al Rahbi F, Al Salmi I. Awareness, knowledge, and perception of chronic kidney disease patients at renal medicine outpatientsʼ clinic. Saudi J Kidney Dis Transpl. 2020;31:1351–1360. doi: 10.4103/1319-2442.308344. [DOI] [PubMed] [Google Scholar]
- 6.Plantinga L C, Boulware L E, Coresh J et al. Patient awareness of chronic kidney disease: trends and predictors. Arch Intern Med. 2008;168:2268–2275. doi: 10.1001/archinte.168.20.2268. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.McIntyre N J, Fluck R, McIntyre C et al. Treatment needs and diagnosis awareness in primary care patients with chronic kidney disease. Br J Gen Pract. 2012;62:e227–232. doi: 10.3399/bjgp12X636047. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Wagner M, Wanner C, Schich M et al. Patientʼs and physicianʼs awareness of kidney disease in coronary heart disease patients – a cross-sectional analysis of the German subset of the EUROASPIRE IV survey. BMC Nephrol. 2017;18:321. doi: 10.1186/s12882-017-0730-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Stolpe S, Kowall B, Scholz C et al. Unawareness for chronic kidney disease is high in all stages, age groups and comorbidities and higher in women than in men. medRxiv. 2021 doi: 10.1101/2021.05.21.21257582. [DOI] [Google Scholar]
- 10.Hodlmoser S, Winkelmayer W C, Zee J et al. Sex differences in chronic kidney disease awareness among US adults, 1999 to 2018. PLoS One. 2020;15:e0243431. doi: 10.1371/journal.pone.0243431. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Schaeffner E S, Ebert N, Delanaye P et al. Two novel equations to estimate kidney function in persons aged 70 years or older. Ann Intern Med. 2012;157:471–481. doi: 10.7326/0003-4819-157-7-201210020-00003. [DOI] [PubMed] [Google Scholar]
- 12.Brand E, Pavenstädt H, Schmieder R E et al. The Coronary Artery Disease and Renal Failure (CAD-REF) registry: trial design, methods, and aims. Am Heart J. 2013;166:449–456. doi: 10.1016/j.ahj.2013.06.010. [DOI] [PubMed] [Google Scholar]
- 13.Dörhöfer L, Lammert A, Krane V et al. Study design of DIACORE (DIAbetes COhoRtE) – a cohort study of patients with diabetes mellitus type 2. BMC Med Genet. 2013;14:25. doi: 10.1186/1471-2350-14-25. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Stevens P E, Levin A. Evaluation and management of chronic kidney disease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline. Ann Intern Med. 2013;158:825–830. doi: 10.7326/0003-4819-158-11-201306040-00007. [DOI] [PubMed] [Google Scholar]
- 15.Trocchi P, Girndt M, Scheidt-Nave C et al. Impact of the estimation equation for GFR on population-based prevalence estimates of kidney dysfunction. BMC Nephrol. 2017;18:341. doi: 10.1186/s12882-017-0749-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Tangri N, Grams M E, Levey A S et al. Multinational Assessment of Accuracy of Equations for Predicting Risk of Kidney Failure: A Meta-analysis. JAMA. 2016;315:164–174. doi: 10.1001/jama.2015.18202. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Kostev K, Lucas A, Jacob L. Frequency of Blood Pressure and Estimated Glomerular Filtration Rate Testing in Type 2 Diabetes Mellitus: A Retrospective Study with 43,509 Patients. Exp Clin Endocrinol Diabetes. 2019;127:455–460. doi: 10.1055/a-0581-4870. [DOI] [PubMed] [Google Scholar]
- 18.Jacob L, Seitz F, Kostev K. Frequency of blood pressure and estimated glomerular filtration rate monitoring in patients affected by hypertension: a retrospective study with 176 565 patients in Germany. Blood Press Monit. 2018;23:85–90. doi: 10.1097/mbp.0000000000000311. [DOI] [PubMed] [Google Scholar]
- 19.Delanaye P, Jager K J, Bokenkamp A et al. CKD: A Call for an Age-Adapted Definition. J Am Soc Nephrol. 2019;30:1785–1805. doi: 10.1681/ASN.2019030238. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Greene J, Hibbard J H. Why does patient activation matter? An examination of the relationships between patient activation and health-related outcomes. J Gen Intern Med. 2012;27:520–526. doi: 10.1007/s11606-011-1931-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Brar A, Markell M. Impact of gender and gender disparities in patients with kidney disease. Curr Opin Nephrol Hypertens. 2019;28:178–182. doi: 10.1097/mnh.0000000000000482. [DOI] [PubMed] [Google Scholar]
- 22.Carrero J J, Hecking M, Chesnaye N C et al. Sex and gender disparities in the epidemiology and outcomes of chronic kidney disease. Nat Rev Nephrol. 2018;14:151–164. doi: 10.1038/nrneph.2017.181. [DOI] [PubMed] [Google Scholar]
- 23.Bidmon S, Terlutter R. Gender Differences in Searching for Health Information on the Internet and the Virtual Patient-Physician Relationship in Germany: Exploratory Results on How Men and Women Differ and Why. J Med Internet Res. 2015;17:e156. doi: 10.2196/jmir.4127. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Ek S. Gender differences in health information behaviour: a Finnish population-based survey. Health Promot Int. 2015;30:736–745. doi: 10.1093/heapro/dat063. [DOI] [PubMed] [Google Scholar]
- 25.Dawson K A, Schneider M A, Fletcher P C et al. Examining gender differences in the health behaviors of Canadian university students. J R Soc Promot Health. 2007;127:38–44. doi: 10.1177/1466424007073205. [DOI] [PubMed] [Google Scholar]
- 26.Enzenbach C, Wicklein B, Wirkner K et al. Evaluating selection bias in a population-based cohort study with low baseline participation: the LIFE-Adult-Study. BMC Med Res Methodol. 2019;19:135. doi: 10.1186/s12874-019-0779-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.White A A, 3rd, Stubblefield-Tave B. Some Advice for Physicians and Other Clinicians Treating Minorities, Women, and Other Patients at Risk of Receiving Health Care Disparities. J Racial Ethn Health Disparities. 2017;4:472–479. doi: 10.1007/s40615-016-0248-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Chapman E N, Kaatz A, Carnes M. Physicians and implicit bias: how doctors may unwittingly perpetuate health care disparities. J Gen Intern Med. 2013;28:1504–1510. doi: 10.1007/s11606-013-2441-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Banks E, Welsh J, Joshy G et al. Comparison of cardiovascular disease risk factors, assessment and management in men and women, including consideration of absolute risk: a nationally representative cross-sectional study. BMJ Open. 2020;10:e038761. doi: 10.1136/bmjopen-2020-038761. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Alfredsson J, Stenestrand U, Wallentin L et al. Gender differences in management and outcome in non-ST-elevation acute coronary syndrome. Heart. 2007;93:1357–1362. doi: 10.1136/hrt.2006.102012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Hao Y, Liu J, Liu J et al. Sex Differences in In-Hospital Management and Outcomes of Patients With Acute Coronary Syndrome. Circulation. 2019;139:1776–1785. doi: 10.1161/circulationaha.118.037655. [DOI] [PubMed] [Google Scholar]
- 32.Isorni M A, Blanchard D, Teixeira N et al. Impact of gender on use of revascularization in acute coronary syndromes: the national observational study of diagnostic and interventional cardiac catheterization (ONACI) Catheter Cardiovasc Interv. 2015;86:E58–E65. doi: 10.1002/ccd.25921. [DOI] [PubMed] [Google Scholar]
- 33.Walli-Attaei M, Joseph P, Rosengren A et al. Variations between women and men in risk factors, treatments, cardiovascular disease incidence, and death in 27 high-income, middle-income, and low-income countries (PURE): a prospective cohort study. Lancet. 2020;396:97–109. doi: 10.1016/s0140-6736(20)30543-2. [DOI] [PubMed] [Google Scholar]
- 34.Zhao M, Vaartjes I, Graham I et al. Sex differences in risk factor management of coronary heart disease across three regions. Heart. 2017;103:1587–1594. doi: 10.1136/heartjnl-2017-311429. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Zhao M, Woodward M, Vaartjes I et al. Sex Differences in Cardiovascular Medication Prescription in Primary Care: A Systematic Review and Meta-Analysis. J Am Heart Assoc. 2020;9:e014742. doi: 10.1161/jaha.119.014742. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Bösner S, Haasenritter J, Hani M A et al. Gender bias revisited: new insights on the differential management of chest pain. BMC Fam Pract. 2011;12:45. doi: 10.1186/1471-2296-12-45. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Patrice C, Delpech R, Panjo H et al. Differences based on patient gender in the management of hypertension: a multilevel analysis. J Hum Hypertens. 2021 doi: 10.1038/s41371-020-00450-y. [DOI] [PubMed] [Google Scholar]
- 38.Delpech R, Bloy G, Panjo H et al. Physiciansʼ preventive practices: more frequently performed for male patients and by female physicians. BMC Health Serv Res. 2020;20:331. doi: 10.1186/s12913-020-05136-2. [DOI] [PMC free article] [PubMed] [Google Scholar]


