Abstract
최근의 연구들은 알츠하이머병의 병리가 단순히 아밀로이드와 타우단백질의 축적만이 아닌, 혈액뇌장벽(blood brain barrier; 이하 BBB) 이상과 같은 미세혈관병리와 밀접한 관련이 있음을 밝히고 있다. BBB 투과도 변화는 아밀로이드 및 타우 단백질 축적뿐 아니라 신경염증과 신경 퇴행성변화를 일으킴으로써 결국 임상 치매를 야기한다. 최근에는 알츠하이머 및 관련 질환의 BBB 이상을 보기 위한 MR 영상의 이용이 증가하고 있다. 이 종설에서는 알츠하이머병에서 BBB와 관련된 병리를 소개하고, BBB 투과도 변화에 대한 MR 영상 연구들을 소개할 것이다. 또한 BBB 투과도 측정을 위한 MR 방법론 개요와 문제점들을 제시할 것이다.
Keywords: Alzheimer Disease, Cerebral Small Vessel Disease, Blood-Brain Barrier, Permeability, Perfusion, Magnetic Resonance
Abstract
Accumulating evidence suggests that Alzheimer's disease (AD) is not only caused by accumulation of abnormal proteins, including amyloid and tau, but is also closely associated with abnormalities in the microvascular environment including the blood-brain barrier (BBB), both of which lead to neuroinflammation and neurodegeneration. Application of in vivo magnetic resonance imaging (MRI) has recently increased to assess BBB permeability in AD and related diseases. Here, we provide a narrative review of BBB permeability-related pathology in Alzheimer dementia and recent MRI research on BBB permeability changes in AD and related diseases. Furthermore, we briefly introduce the measurement of BBB permeability using MRI and its methodological issues.
서론
21세기 들어 급격하게 고령화 사회로 진입한 한국에서는 치매 유병률 역시 급격하게 증가하여 약 7.0~13.1%로 추정되며, 2050년까지 치매 환자 수는 20년마다 두 배로 증가할 것으로 예측하고 있다(1). 고령화 사회로 인한 치매 관련 복지 예산 역시 급격히 증가하고 있다는 점에, 치매의 예방, 진단 및 치료는 의학적인 도전만이 아니라 사회경제적 측면에서도 시급히 해결하여야 할 중대한 보건 문제이다.
현재 치매 영상의 주된 역할은 가역성 치매의 원인이 되는, 뇌종양, 염증성질환, 수두증 등을 감별하고, 알츠하이머 치매 혹은 다른 퇴행성 치매에 특징적인 뇌위축을 평가하고, 동반되는 혈관성 병변인 뇌백질병변이나 미세출혈 정도 등을 확인하는 것이다(1).
최근 치매의 원인 및 병리기전에 혈액뇌장벽(blood-brain barrier; 이하 BBB) 투과도 변화가 중요한 역할을 한다는 증거가 늘어나고 있다(2,3,4,5). 하지만, 관련된 영상의학 연구는 상대적으로 적은 편이다(6,7,8). 이에 본 종설에서는 알츠하이머 치매 및 혈관성 치매에서 BBB 투과도 장애와의 관련성에 관한 기존 연구 결과들을 요약하고, BBB 투과도 변화를 측정할 수 있는 영상기법 및 영상 연구 결과를 소개하고자 한다.
알츠하이머 치매의 개요
알츠하이머 치매(Alzheimer dementia)는 가장 흔한 치매 원인 중 하나이고, 아밀로이드 판(plaque)의 형성과 신경세포 내의 타우단백질의 이상침착이 대표적인 병리현상이지만, 이 외에도 신경염증세포의 활성, 콜린신경의 소실, BBB 투과성 증가 등이 병의 진행과 관련이 있다는 연구 결과들이 있다(1).
현재의 주류 가설인 아밀로이드 가설에서는 세포막을 관통하는(transmembrane) 아밀로이드 전구단백질(amyloid precursor protein)이 두 가지 단백분해효소(β와 γ-secretase)에 의하여 분해되어 베타 아밀로이드 펩티드(beta amyloid peptide; 이하 Aβ) 조각을 만들며, 이 조각들이 세포 밖에서 아밀로이드 판(amyloid plaque)을 형성한다. 한편 아밀로이드 판의 형성은 미세관(microtubule) 유지에 관여하는 세포 내 타우단백질의 과인산화를 촉발하여 신경원섬유매듭(neurofibrillary tangle)을 형성하며, 이는 정상적인 신경세포의 기능저하를 유발한다. Aβ 축적에 따른 산화스트레스와 염증반응은 시냅스 및 신경세포의 온전함(integrity)이 소실되고, 최종적으로 신경세포사멸 및 뇌위축을 초래하고 임상증상이 나타나게 한다. 시간적으로는 알츠하이머 치매 임상증상 발현 20~30년 전 이미 아밀로이드 병리가 시작되었음을 의미한다(9). 아밀로이드 축적이 최초 병리 유발자이며, 타우단백질 침착에 반드시 아밀로이드가 필요하다는 가설은 아밀로이드 병리 없이도 타우단백질 침착을 보고한 연구에 의하여 도전받고 있지만(10), 여전히 알츠하이머 치매를 잘 설명하는 가설이다.
따라서, 아밀로이드 축적을 가장 중요한 신경세포 손상의 원인으로 간주하고, 이를 타깃으로 하는 신약 연구가 현재 활발하게 진행되고 있다(11). 하지만 현재까지 거의 모든 항-아밀로이드 신약임상시험이 긍정적인 효과를 보고하지 못하고 있다. 이에 치매병리가 비가역적으로 진행된 상태에 약물이 투여되어 효과를 보지 못했다는 설명과 주류 가설이 아밀로이드 가설 외의 다른 원인 인자를 조절해야 한다는 설명이 대립하고 있다(11).
최근 연구 결과들에 의하면, 치매 진행에는 여러 위험인자가 작용한다. 가족성 알츠하이머 치매를 일으키는 amyloid precursor protein (APP), presenilin (PSEN) 유전자변이를 제외하고, 특발성 알츠하이머 치매의 가장 강력한 유전적 위험인자는 아포지단백질 E (apolipoprotein E; 이하 ApoE) 유전자변이이다(12,13). 인간 ApoE의 경우 ε2, ε3, ε4의 3개의 대립유전자가 있으며, ε4대립 유전자는 알츠하이머 치매의 위험인자로서 유전형이 ε3/ε4인 경우 알츠하이머 치매 위험도가 4배, ε4/ε4인 경우 경우 14배 증가한다고 알려져 있으며, 반대로 ε2대립유전자가 있는 경우 미약하게나마 치매위험도가 낮아진다(14,15).
유전적요인을 제외하면 치매발병위험도가 가장 큰 인자는 뇌혈관 질환 및 혈관성 위험인자이다(16,17). 혈관성 위험인자는 고혈압, 고지혈증, 당뇨, 흡연 및 심혈관질환이 포함된다(18). 뇌혈관질환은, ApoE 유전자변이 및 다른 혈관성 위험인자와는 독립적으로 치매 발병 위험인자로서 작용한다(17).
뇌혈관질환과 치매의 관련성
뇌혈관질환 중 비교적 큰 혈관의 동맥경화증과 미세혈관의 경화증 모두 알츠하이머 치매의 위험도를 증가시키는 것으로 알려져 있다(17). 특히 뇌소혈관질환(cerebral small vessel disease)은 뇌의 소동맥, 모세혈관, 소정맥의 병리 변화를 아우르는 통칭으로 치매 환자의 45%, 뇌졸중의 20%, 허혈성 뇌졸중의 25%에서 발견된다(19).
뇌소혈관질환은 백질 고신호강도(white matter hyperintensity; 이하 WMH), 열공성 경색, 미세출혈, 확장된 혈관주위공간(perivascular space; 이하 PVS) 등을 포함하며, CT 혹은 MR이 발달하기 전에는 병리조직으로만 확인할 수 있었지만, 지금은 MR 영상이 진단에 필수적이다(20). 2013년 Wardlaw 등(21)에 의해 영상진단에 대한 용어 표준화가 되기 전에는 뇌소혈관질환 연구가 다양한 용어와 정의로 진행되어 뇌소혈관질환을 하나의 통일된 질환 혹은 위험인자로 연구하고 평가하기가 더욱 힘들었다. 최근 연구 결과들은 WMH, 열공성 경색, 미세출혈 등이 공통된 미세혈관병리를 공유하며, 전반적인 침범 양상을 보여 전뇌질환(whole brain disease)으로 간주하기도 한다(22). 동양인과 서양인의 뇌소혈관질환의 기저양상이 다르다는 연구보고들도 있다(22,23).
열공성 경색(lacunar infarct)은 최근에 발생한 1.5 cm 이하의 작은 경색으로서 뇌백질, 기저핵, 뇌교, 뇌간을 침범하여 만성화하면 열공을 형성한다(21). 소혈관질환이 가장 흔한 원인이고, 일부는 중뇌동맥의 죽종(atheroma), 심장 혹은 경동맥에서 온 색전증이 원인인 것으로 알려져 있다(21,22). 과거에는 고혈압에 동반된 지방유리질증(lipohyalinosis)이 소혈관질환의 주원인일 것으로 추정했으나, 실제로는 많은 환자가 정상 혈압이다(24).
WMH는 인지장애, 치매, 우울증과 관련이 있으며 뇌졸중과 치매 위험이 각각 3배, 2배 증가하고 사망률도 증가한다(25). WMH의 조직병리는 다양하지만 뇌조직 MR 연구에서는 수초와 축삭의 다양한 정도의 소실과 기질의 느슨해짐(slight disentanglement of the matrix to varying degrees of myelin and axon loss)을 보고한다(26,27). WMH에서 보이는 미세한 변화는 정상으로 보이는 백질(normal appearing white matter; 이하 NAWM)에서도 일어날 수 있다(28,29). WMH의 기전은 불완전 경색, 만성관류저하, 정맥의 콜라젠화 등이 제시되고 있지만 아직 증거는 부족하다. 최근에는 WMH와 BBB 장애와의 연관성을 뒷받침하는 연구들이 발표되고 있다(30,31). 아마도 BBB 장애가 체액, 혈장성분 및 세포의 누출을 야기하고, 혈관주위 염증, 탈수초화 및 gliosis를 초래하는 것으로 가설을 제시한다. 따라서 관류저하, 정맥병리, BBB 장애가 복합적으로 작용하여 WMH를 일으킬 것으로 추정되나, 가장 중요한 원인은 아직 밝혀져 있지 않다.
혈관주위공간(PVS)은 T2 강조영상에서 보이는 뇌미세혈관을 둘러싸는 액체공간으로 노화 및 소혈관질환정도에 따라 증가하며(32), 치매 위험도도 증가하고 인지기능악화와 관련있다(22,33). PVS의 기전은 확실히 알려져 있지 않으며, BBB 장애의 지표(34), 뇌간질액의 배출장애(35), 혹은 염증표지자와의 관련을 시사하는 연구가 있다(36).
미세혈관출혈(cerebral microbleeds)은 T2* 강조영상 혹은 자화강조영상에서 강한 저신호강도의 점으로 보이며, 지방유리질증과 아밀로이드혈관증(amyloid angiopathy)이 가장 흔한 원인이다(21,22). 미세혈관출혈 자체는 대부분 무증상 병변이나, 혈관성 위험인자에 노출되었다는 표식(37), 혹은 아밀로이드 침착의 표지자로 생각되고 있다(38).
미세혈관손상 혹은 BBB 손상의 증거
알츠하이머 치매의 병리기전에서 뇌혈관질환의 역할에 대한 증거가 점점 더 쌓이면서 치매병리는 신경세포뿐 아니라, 신경혈관단위 내의 여러 세포들에 영향을 미친다는 것이 밝혀지고 있다(2,5,6,39,40,41).
BBB는 다른 용어로는 신경혈관단위(neurovascular unit)로 표현할 수 있으며, BBB 혹은 신경혈관단위는 혈관내피세포, 이와 상호작용하는 혈관주위세포(pericyte), 별아교세포(astrocyte), 신경세포 및 바닥판막(basal lamina membrane)으로 구성되어 있다. 혈관내피세포 간의 경계는 치밀이음부(tight junction)로 구성되고, 이는 혈액에서 유래하는 독성물질이 수동적 확산으로 뇌 내로 유입되는 것을 제한한다(4).
실험연구에서는 노화에 따라 BBB가 퇴행성변화를 보인다고 보고하고 있다(41). 바닥판이 두꺼워지고, 치밀이음부는 소실되고, 별아교세포 endfeet 크기가 커진다. 결국 혈액 내의 독성 단백질 등이 뇌 내로 유입되게 된다(42).
알츠하이머 치매병리에는 BBB의 구조적 파괴와 BBB 기능조절장애의 두 가지 기전이 역할을 한다(4). BBB 파괴는 혈액 내 신경독성물질-섬유소(fibrin), 섬유소원(fibrinogen), 플라즈민(plasmin), 플라스미노겐(plasminogen), 트롬빈(thrombin), 및 자가항체-이 혈관주위공간에 축적되게 하고, 이는 신경손상과 염증반응을 야기한다. 뇌 내로 유입된 알부민은 부종, 관류저하, 조직저산소증을 야기한다. 혈관주위세포의 박리(detachment)와 퇴행성변화는 BBB 파괴를 야기하는데, ApoE 유전자변이의 종류에 따라 혈관주위세포대사와 BBB 구조 유지에 서로 다르게 작용한다. ε4 대립유전자형인 경우 기질금속단백분해효소(matrix metalloproteinase-9; MMP-9) 매개하에 BBB 치밀이음부와 바닥판막의 퇴행성변화가 생겨, 결국 BBB가 파괴된다. BBB를 통한 물질 전달의 조절장애는 Aβ 배출과 유입의 균형을 깨뜨리며, 혈관주위통로를 통한 배출도 충분하지 않아 PVS에 Aβ 아밀로이드가 축적된다(4).
선행 연구들은 미세혈관손상과 동반된 신경염증이 알츠하이머 치매의 증상발현전에 초기병리로 나타난다고 하고(43,44), 따라서 알츠하이머 병리기전에 중요한 역할을 할 수 있음을 제시하고 있다. 최근에 널리 지지 받고 있는 2회 충격 혈관 가설(two-hit vascular hypothesis)에서는 미세혈관 손상이 최초 손상 요소로 작용하며 그 자체로 충분히 신경손상과 신경변성을 일으킨다(44). 첫 번째 타격인 미세혈관손상은 관류저하와 BBB 기능저하를 모두 포함하며, Aβ 독성물질의 축적을 촉진시키는 역할을 하며, Aβ 아밀로이드 축적은 2번째 타격이 된다. 2회 충격 혈관 가설을 고려하면, BBB 및 미세혈관손상과 관련된 미세구조의 변화와 관류변화뿐 아니라, BBB 기능저하로 인한 BBB 투과도 변화를 정확히 영상화하는 것이, 뇌혈관질환에 의한 치매 진행의 병태생리기전를 파악함과 동시에, 치매 진행과정 평가의 새로운 지표를 제시함으로써, 새로운 영상진단 표지자를 제시할 수 있을 것이다.
BBB 투과도 영상
고전적인 BBB 투과도 측정방법
고전적으로 BBB 투과도의 측정은 뇌척수액(cerebrospinal fluid; 이하 CSF) 채취로 알부민 뇌척수액-혈청비(CSF-serum albumin index)를 측정하면 가능하다. 기존 연구에서 알부민 뇌척수액-혈청비는 경도인지장애 환자의 임상중등도에 따라 증가함을 보였다(5,45). 알부민 뇌척수액-혈청비는 BBB 투과도의 전반적 측정도구이며, BBB 누출 위치를 정확히 파악할 수 없으며, 요추천자가 필요한 침습적인 검사라는 단점이 있다. 알부민의 분자량이 66.5 kDa로 상당히 큰 단백질 분자이기 때문에, 알부민 농도의 차이가 보이려면, 상당히 진행된 BBB 손상일 경우에만 측정 가능하다(45).
역동성 조영증강 MR 영상을 이용한 BBB 투과도 측정방법
1991년 Toft 등(46,47)은 처음으로 역동성 조영증강(dynamic contrast enhancement; 이하 DCE) 기법을 이용하여 BBB 투과도 계산을 위한 수학적 모델(Toft 모델)을 제안하였다. 가돌리늄 조영제의 경우, 분자량이 550 Da으로 낮고, 상대적으로 미세한 정도의 투과도를 측정할 수 있다.
DCE 영상의 기본원리는 가돌리늄 조영제를 투여하고, 적어도 몇 분 이상 반복적으로 T1 강조영상을 획득하여, 조직의 T1 변화를 시간적으로 측정하는 것이다. 이때 조영제 농도는 T1 신호변화에서 추정할 수 있으며, 조영제-시간곡선을 알게 되면, 약물동력학분석을 통해, 조직 내로 조영제가 분포한 정도를 알아낼 수 있다. 이는 몇 가지 생리학적 지표—동맥주입함수(arterial input function; 이하 AIF)등—에 의하여 결정되며, 영상조건이나, 영상기법과는 상대적으로 무관하다(46).
보통 DCE 영상에서 BBB 투과도를 계산하는 수학적 모델은 이구획 모델(two compartment model), extended Toft 모델, Patlak 모델 이 세 가지가 대표적이다(48).
기존 뇌종양 영상 연구에서 주로 이용되는 extended Toft 모델에서는 세 가지 중요한 변수—체적전달상수[volume transfer constant, Ktrans (min−1)], 조직단위체적당 혈관외세포외공간부피[volume of extravascular extracellular space (EES) per unit volume of tissue, Ve (0 < ve < 1)], 혈관외세포외공간에서 혈장으로의 속도상수[rate constant between EES and plasma, Kep(min−1)]—를 추출한다. 이중 Kep는 Ktrans/Ve로 표현된다. 혈류가 제한적인 경우(혈장유량에 비하여 투과도가 매우 높은 상황)에는 Ktrans가 단위부피당 혈장유량(flow)에 상응하며, 투과도가 제한적인 경우(투과도가 혈장유량에 비하여 매우 낮은 상황)에는 Ktrans는 단위부피당 투과도표면적곱(permeability surface area product; PSP)과 일치한다(46,47).
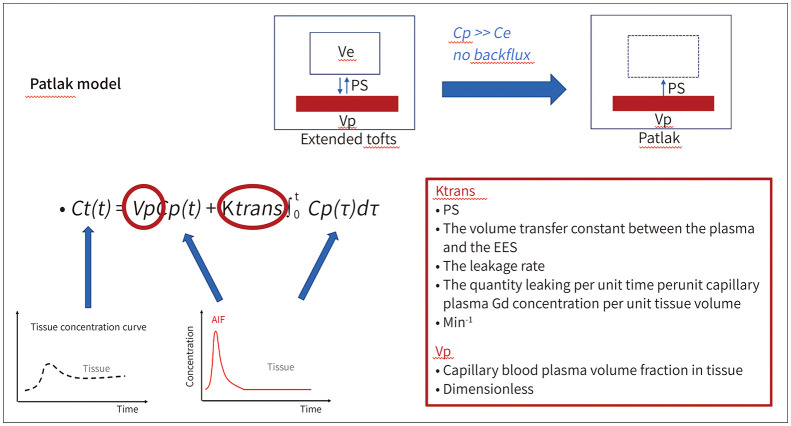
Patlak model은 extended Toft model의 특수한 예로 볼 수 있으며, 퇴행성 신경질환이나 치매와 같이 매우 미세한 정도의 BBB 누출을 예상하는 경우이며, 혈관외세포외공간으로부터 혈관 내로의 역류(backflux)가 거의 없는 것으로 가정한다. 따라서 구해지는 지표는 Ktrans와 혈장부피분율(plasma volume fraction; 이하 Vp) 단 두 가지이다. Ktrans를 누출속도(leakage rate)라고도 표현하며, BBB 투과도 변화를 나타내는 지표이다. Vp는 조직 내의 미세혈관 내 혈장부피분율(fraction)을 나타낸다(Fig. 1) (48,49).
Fig. 1. The Patlak model for blood–brain barrier permeability for dynamic contrast-enhanced MRI.
It is a simplified version of the extended Tofts and two-compartment models. It assumes that there is minimal or no backflux from the brain to the arteries (i.e. Cp >> Ce). Accordingly, it only provides the estimation of two parameters: the volume transfer constant and Vp.
AIF = arterial input function, Ce = concentration of contrast in the interstitial space, Cp = concentration of contrast in blood plasma, Ktrans = volume transfer constant, EES = extravascular extracellular space, PS = permeability surface-area product, Ve = fractional interstitial volume, Vp = fractional plasma volume
치매 관련 DCE 영상 연구
알츠하이머 치매 및 경도인지장애에서의 연구 결과
2009년 Starr 등(50)이 1.5 Tesla (이하 T)에서 30분간 획득한 DCE 영상기법을 이용한 신호증강비(signal enhancement ratio)를 이용하여, 알츠하이머 치매에서 BBB 투과도 변화가 초기에 일어남을 보고하였다. 2016년 Van de Harr 등(51)은 3 T에서 이중 시간해상도(dual temporal resolution) 기법을 적용하여 Ktrans와 Vp를 측정하여서, 뇌백질과 회색질에서 정상인과 알츠하이머 치매에서 값의 차이는 없으나, BBB 투과도가 증가한 분획(fraction)은 알츠하이머 치매에서 의미 있게 높다고 보고하였다. 2015년 Montagne 등(6)이 정상인, 경도인지장애 환자에서 3 T에서 16분간 획득한 DCE 영상으로, Ktrans가 뇌백질에서는 차이를 보이지 않았으나, 해마에서는 경도인지장애에서 의미 있게 증가함을 보고하였다. 동일한 연구진들의 후속 연구에서는 BBB 투과도 변화가 초기 알츠하이머 치매 환자에서 타우단백질이나 아밀로이드 침착과도 독립적으로 초기 인지기능장애에 작용함을 밝혀냄으로써 BBB 투과도가 인지기능예측을 위한 초기 생체지표로서 사용될 수 있음을 제시하였다(8).
혈관성 치매 및 혈관성인지장애에서의 연구 결과
소혈관질환에 대해서는 2013년 1.5 T를 이용한 DCE 연구에서 처음으로 뇌백질병변의 투과도 변화를 시사하는 연구가 발표되었다(30). 2017년 Zhang 등(52)이, 3 T에서 이중 시간해상도기법을 이용한 DCE 영상으로 정상인과 비교할 때, 소혈관질환의 NAWM, WMH 및 뇌피질의(잡음을 제외하고, 누출속도의 area under bar를 계산한) BBB 누출 체적(leakage volume)은 의미 있게 증가함을 보고하였다(52). 한편, Huisa 등(53)은 Binswanger 병 환자를 대상으로 한 DCE 연구에서 뇌백질의 BBB 투과도가 WMH 부위는 이미 낮고, 오히려 NAWM와의 경계부와 NAWM에서 증가함을 관찰하여, BBB 파괴가 능동적으로 진행하는 과정임을 시사하였다.
DCE 영상의 문제점 및 개선방안
BBB 투과도 모델에 대한 문제점
현재로서는 Patlak 모델이 치매에서와 같은 미세한 BBB 투과도 변화측정에 가장 적합하다고 알려져 있으나, Cramer 등(54)에 의하면, 3 × 10−3/min−1 이상의 Ktrans는 Patlak 모델에서 과소평가 될 수 있다(54). 따라서 Patlak 모델을 이용하는 경우, 원하는 차이를 발견하지 못하는 위음성 결과의 위험성이 존재한다. 가장 바람직한 것은 이구획 모델이지만, 이 경우 적절한 피팅(fitting)을 위하여, 높은 시간해상도(짧은 시간간격)이 필요하고(54), 변수가 많아져서 수학적 복합성이 증가하는 문제점이 있어서 현재로서는 권고하지 않고 있다(48,55).
BBB 영상 기법에 대한 문제점
BBB 영상은 단순한 T1 고속저각영상획득(Fast Low Angle Short; FLASH) 혹은 T1 포화회복(saturation recovery) 영상을 얻으며, 이는 모든 종류의 MR 기기에서 이용할 수 있다는 장점이 있으나, 시간적으로 신호변동성을 피할 수 없다는 점에서 앞으로 이를 극복할 수 있는 안정적인 신호를 보이는 새로운 영상시퀀스가 필요하다.
또한 미세한 BBB 투과도 측정을 위한 이상적인 획득시간은 적어도 10~15분 이상이 전문가들의 일치된 견해이나(48,54,55), 이는 현실적으로 임상 현장에서 불가능하며, 가능한 10분 이내의 영상 프로토콜로 정확한 계산이 가능한 방법 개발이 필요하다. BBB 투과도 측정에 대한 시간에 따른 안정성(stability) 혹은 재현성(repeatability)에 대한 연구도 현재로는 없는 실정이다(56).
BBB 투과도 측정은 큰 혈관이 있는 부위는 Ktrans가 과대평가될 수 있어서, 이는 전체 뇌분석 혹은 관심영역분석 모두에서 문제점이 될 수 있다(57). 또한 연구자들이 Ktrans의 두 가지 단위 표기를 혼용함으로써 생긴 오류까지 더해져서 후속 연구 및 연구자들에게 혼란을 주고 있다(57).
따라서 현재로서는 연구자들이 Thrippleton 등(55)이 제시하는 바대로 표준화 프로토콜을 이용하고, Patlak model을 기반으로 표준단위(min−1)를 이용할 것을 추천한다(Fig. 2).
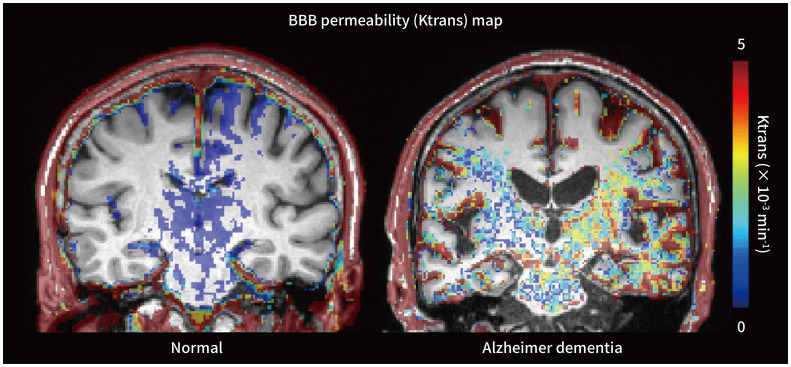
Fig. 2. Exemplary cases of BBB permeability (Ktrans) maps overlayed on coronal T1-weighted images. Compared to the normal control subject, the patient with Alzheimer dementia shows increased Ktrans values in the bilateral medial temporal lobes and other brain regions. Ktrans is a volume transfer constant between blood plasma and the extravascular extracellular space. Cognitive normal subject (left image). Patient with Alzheimer's disease (right image).
BBB = blood–brain barrier
BBB 투과도 영상의 개선방안
AIF를 개선하고, 최대한 느린 투과도를 정확히 측정하기 위하여, 일부 연구자들은 이중 시간해상도방법을 이용하여, 첫 번째 조영제의 일차통과(first pass) 시에는 낮은 공간해상도와 높은 시간해상도 영상을 얻고(약 1.5분), 두 번째로 높은 공간해상도에 낮은 시간해상도영상을 25분가량 획득하는 방식을 취하기도 한다(51). 이 방법은 매력적이기는 하지만, 긴 획득시간으로 임상적으로는 적용하기가 힘들다.
최근에는 Golden-angle Radial Sparce Parallel (GRASP) 영상시퀀스를 이용하며, DCE를 이용한 투과도 계산 시 모델 피팅을 좀 더 정확하게 할 수 있는 장점이 있다고 보고한다(58). 딥러닝 기법을 이용하여, 자동으로 AIF를 추출해내는 방법도 시도되고 있다. 그 외에, 전혀 가돌리늄 조영제를 사용하지 않은 투과도 영상도 제안되고 있다(59). 이는 확산강조(diffusion weighting)를 추가한 동맥스핀라벨링(arterial spin labeling; ASL) 기법으로서 물분자(분자량 18 Da)의 투과도를 측정할 수 있다고 제안하지만, 현재 생물학적 의의는 불명확하다(59).
BBB 투과도와 글림파틱시스템(Glymphatic System)과의 관계
과거에는 BBB 기능이 혈액으로부터 유입되는 독성 단백질의 축적을 방지할 뿐만 아니라, 비정상적인 단백질의 배출에도 일차적인 역할을 한다고 여겨졌다(60). 즉 선행 연구에 의하면, BBB가 파괴되면 Aβ 축적을 야기하고, Aβ 축적은 다시 BBB 파괴를 더욱더 가속화한다(61).
최근 지지를 얻고 있는 글림파틱시스템 가설에 따르면 간질액(interstitial space fluid; ISF)이 CSF와 서로 교환하고, 이는 별아교세포 endfeet의 아쿠아포린 4 물통로(aquaporin 4 water channel)에 의해 촉진된다고 추정하며, 이로 인한 글림파틱 덩이흐름(glymphatic bulk flow)이 간질액으로부터 이러한 독성 물질들을 제거하는 역할을 한다고 추정한다(62,63). 기존 연구들에서는 Aβ의 75%를 BBB가 제거하고, 글림파틱시스템이 10%를 담당하는 것으로 보고 있으나(64), 기존의 생각보다는 더 많은 정도의 Aβ 제거를 글림파틱시스템이 담당할지도 모른다는 주장을 뒷받침하는 최근 동물실험 결과도 있다(62,63).
그러나, 글림파틱시스템의 실체 및 역할에 대해서는 아직 논쟁중이며, 아마도 BBB와 글림파틱시스템은 서로 어느 정도는 중첩되고 상보적인 역할을 하는 것으로 보이며, 두 시스템 간의 상호작용은 아직 분명하게 밝혀지지 않았다(60,65)
또한 BBB 기능저하과 글림파틱시스템을 각각 생체 내에서 영상화하는 시도는 있으나, 두 시스템을 같이 연구한 영상 연구는 아직까지 없다.
결론
결론적으로 치매 영상에서 DCE 영상을 이용한 BBB 투과도 영상은 현재 환자 대상 연구에서 의미 있는 결과를 도출하고 있으나, 아직은 치매 MR 영상에서 반드시 필요한 도구로서 정립하기 위해서는 다기관 효과 비교 연구가 선행되어야 할 것이다. 특히, 이 경우에는 현재 알츠하이머 치매 진단에서 초기 변화인 미세혈관성병리의 생체 내 영상마커가 확실하게 정립된 것이 없음을 고려할 때, 초기혈관병변을 평가하고 진단하는 검사가 될 것으로 기대된다.
Acknowledgments
This work was supported by the National Research Foundation of Korea (NRF) grant funded by the Korea government (MSIP) (No. 2017R1A2B4010634) and a grant of the Korea Health Technology R&D Project through the Korea Health Industry Development Institute (KHIDI), funded by the Ministry of Health & Welfare, Republic of Korea (grant number HI18C1038).
Footnotes
Conflicts of Interest: The author has no potential conflicts of interest to disclose.
References
- 1.Park M, Moon WJ. Structural MR imaging in the diagnosis of Alzheimer's disease and other neurodegenerative dementia: current imaging approach and future perspectives. Korean J Radiol. 2016;17:827–845. doi: 10.3348/kjr.2016.17.6.827. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Ujiie M, Dickstein DL, Carlow DA, Jefferies WA. Blood-brain barrier permeability precedes senile plaque formation in an Alzheimer disease model. Microcirculation. 2003;10:463–470. doi: 10.1038/sj.mn.7800212. [DOI] [PubMed] [Google Scholar]
- 3.Papassotiropoulos A, Streffer JR, Tsolaki M, Schmid S, Thal D, Nicosia F, et al. Increased brain beta-amyloid load, phosphorylated tau, and risk of Alzheimer disease associated with an intronic CYP46 polymorphism. Arch Neurol. 2003;60:29–35. doi: 10.1001/archneur.60.1.29. [DOI] [PubMed] [Google Scholar]
- 4.Montagne A, Zhao Z, Zlokovic BV. Alzheimer's disease: a matter of blood-brain barrier dysfunction? J Exp Med. 2017;214:3151–3169. doi: 10.1084/jem.20171406. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Bowman GL, Kaye JA, Moore M, Waichunas D, Carlson NE, Quinn JF. Blood-brain barrier impairment in Alzheimer disease: stability and functional significance. Neurology. 2007;68:1809–1814. doi: 10.1212/01.wnl.0000262031.18018.1a. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Montagne A, Barnes SR, Sweeney MD, Halliday MR, Sagare AP, Zhao Z, et al. Blood-brain barrier breakdown in the aging human hippocampus. Neuron. 2015;85:296–302. doi: 10.1016/j.neuron.2014.12.032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Van de Haar HJ, Burgmans S, Jansen JF, Van Osch MJ, Van Buchem MA, Muller M, et al. Blood-brain barrier leakage in patients with early Alzheimer disease. Radiology. 2017;282:615. doi: 10.1148/radiol.2017164043. [DOI] [PubMed] [Google Scholar]
- 8.Nation DA, Sweeney MD, Montagne A, Sagare AP, D'Orazio LM, Pachicano M, et al. Blood-brain barrier breakdown is an early biomarker of human cognitive dysfunction. Nat Med. 2019;25:270–276. doi: 10.1038/s41591-018-0297-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Jack CR, Jr, Knopman DS, Jagust WJ, Shaw LM, Aisen PS, Weiner MW, et al. Hypothetical model of dynamic biomarkers of the Alzheimer's pathological cascade. Lancet Neurol. 2010;9:119–128. doi: 10.1016/S1474-4422(09)70299-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Bloom GS. Amyloid-β and tau: the trigger and bullet in Alzheimer disease pathogenesis. JAMA Neurol. 2014;71:505–508. doi: 10.1001/jamaneurol.2013.5847. [DOI] [PubMed] [Google Scholar]
- 11.Cummings J, Lee G, Ritter A, Sabbagh M, Zhong K. Alzheimer's disease drug development pipeline: 2019. Alzheimers Dement (N Y) 2019;5:272–293. doi: 10.1016/j.trci.2019.05.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Liu CC, Liu CC, Kanekiyo T, Xu H, Bu G. Apolipoprotein E and Alzheimer disease: risk, mechanisms and therapy. Nat Rev Neurol. 2013;9:106–118. doi: 10.1038/nrneurol.2012.263. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Polvikoski T, Sulkava R, Haltia M, Kainulainen K, Vuorio A, Verkkoniemi A, et al. Apolipoprotein E, dementia, and cortical deposition of beta-amyloid protein. N Engl J Med. 1995;333:1242–1247. doi: 10.1056/NEJM199511093331902. [DOI] [PubMed] [Google Scholar]
- 14.Sando SB, Melquist S, Cannon A, Hutton ML, Sletvold O, Saltvedt I, et al. APOE epsilon 4 lowers age at onset and is a high risk factor for Alzheimer's disease; a case control study from central Norway. BMC Neurol. 2008;8:9. doi: 10.1186/1471-2377-8-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Neu SC, Pa J, Kukull W, Beekly D, Kuzma A, Gangadharan P, et al. Apolipoprotein E genotype and sex risk factors for Alzheimer disease: a meta-analysis. JAMA Neurol. 2017;74:1178–1189. doi: 10.1001/jamaneurol.2017.2188. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Baumgart M, Snyder HM, Carrillo MC, Fazio S, Kim H, Johns H. Summary of the evidence on modifiable risk factors for cognitive decline and dementia: a population-based perspective. Alzheimers Dement. 2015;11:718–726. doi: 10.1016/j.jalz.2015.05.016. [DOI] [PubMed] [Google Scholar]
- 17.Arvanitakis Z, Capuano AW, Leurgans SE, Bennett DA, Schneider JA. Relation of cerebral vessel disease to Alzheimer's disease dementia and cognitive function in elderly people: a cross-sectional study. Lancet Neurol. 2016;15:934–943. doi: 10.1016/S1474-4422(16)30029-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Deschaintre Y, Richard F, Leys D, Pasquier F. Treatment of vascular risk factors is associated with slower decline in Alzheimer disease. Neurology. 2009;73:674–680. doi: 10.1212/WNL.0b013e3181b59bf3. [DOI] [PubMed] [Google Scholar]
- 19.Pantoni L. Cerebral small vessel disease: from pathogenesis and clinical characteristics to therapeutic challenges. Lancet Neurol. 2010;9:689–701. doi: 10.1016/S1474-4422(10)70104-6. [DOI] [PubMed] [Google Scholar]
- 20.Rosenberg GA, Wallin A, Wardlaw JM, Markus HS, Montaner J, Wolfson L, et al. Consensus statement for diagnosis of subcortical small vessel disease. J Cereb Blood Flow Metab. 2016;36:6–25. doi: 10.1038/jcbfm.2015.172. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Wardlaw JM, Smith EE, Biessels GJ, Cordonnier C, Fazekas F, Frayne R, et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. Lancet Neurol. 2013;12:822–838. doi: 10.1016/S1474-4422(13)70124-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Shi Y, Wardlaw JM. Update on cerebral small vessel disease: a dynamic whole-brain disease. Stroke Vasc Neurol. 2016;1:83–92. doi: 10.1136/svn-2016-000035. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Fanning JP, Wong AA, Fraser JF. The epidemiology of silent brain infarction: a systematic review of population-based cohorts. BMC Med. 2014;12:119. doi: 10.1186/s12916-014-0119-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Jackson CA, Hutchison A, Dennis MS, Wardlaw JM, Lindgren A, Norrving B, et al. Differing risk factor profiles of ischemic stroke subtypes: evidence for a distinct lacunar arteriopathy? Stroke. 2010;41:624–629. doi: 10.1161/STROKEAHA.109.558809. [DOI] [PubMed] [Google Scholar]
- 25.Debette S, Markus HS. The clinical importance of white matter hyperintensities on brain magnetic resonance imaging: systematic review and meta-analysis. BMJ. 2010;341:c3666. doi: 10.1136/bmj.c3666. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Gouw AA, Seewann A, Van der, Barkhof F, Rozemuller AM, Scheltens P, et al. Heterogeneity of small vessel disease: a systematic review of MRI and histopathology correlations. J Neurol Neurosurg Psychiatry. 2011;82:126–135. doi: 10.1136/jnnp.2009.204685. [DOI] [PubMed] [Google Scholar]
- 27.Prins ND, Scheltens P. White matter hyperintensities, cognitive impairment and dementia: an update. Nat Rev Neurol. 2015;11:157–165. doi: 10.1038/nrneurol.2015.10. [DOI] [PubMed] [Google Scholar]
- 28.Maniega SM, Valdés Hernández MC, Clayden JD, Royle NA, Murray C, Morris Z, et al. White matter hyperintensities and normal-appearing white matter integrity in the aging brain. Neurobiol Aging. 2015;36:909–918. doi: 10.1016/j.neurobiolaging.2014.07.048. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Park M, Moon Y, Han SH, Kim HK, Moon WJ. Myelin loss in white matter hyperintensities and normal-appearing white matter of cognitively impaired patients: a quantitative synthetic magnetic resonance imaging study. Eur Radiol. 2019;29:4914–4921. doi: 10.1007/s00330-018-5836-x. [DOI] [PubMed] [Google Scholar]
- 30.Wardlaw JM, Doubal FN, Valdes-Hernandez M, Wang X, Chappell FM, Shuler K, et al. Blood-brain barrier permeability and long-term clinical and imaging outcomes in cerebral small vessel disease. Stroke. 2013;44:525–527. doi: 10.1161/STROKEAHA.112.669994. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Li Y, Li M, Zhang X, Shi Q, Yang S, Fan H, et al. Higher blood-brain barrier permeability is associated with higher white matter hyperintensities burden. J Neurol. 2017;264:1474–1481. doi: 10.1007/s00415-017-8550-8. [DOI] [PubMed] [Google Scholar]
- 32.Charidimou A, Boulouis G, Pasi M, Auriel E, Van Etten ES, Haley K, et al. MRI-visible perivascular spaces in cerebral amyloid angiopathy and hypertensive arteriopathy. Neurology. 2017;88:1157–1164. doi: 10.1212/WNL.0000000000003746. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Wardlaw JM, Smith C, Dichgans M. Mechanisms of sporadic cerebral small vessel disease: insights from neuroimaging. Lancet Neurol. 2013;12:483–497. doi: 10.1016/S1474-4422(13)70060-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Li Y, Li M, Yang L, Qin W, Yang S, Yuan J, et al. The relationship between blood-brain barrier permeability and enlarged perivascular spaces: a cross-sectional study. Clin Interv Aging. 2019;14:871–878. doi: 10.2147/CIA.S204269. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Naganawa S, Nakane T, Kawai H, Taoka T. Lack of contrast enhancement in a giant perivascular space of the basal ganglion on delayed FLAIR images: implications for the glymphatic system. Magn Reson Med Sci. 2017;16:89–90. doi: 10.2463/mrms.ci.2016-0114. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Owens T, Bechmann I, Engelhardt B. Perivascular spaces and the two steps to neuroinflammation. J Neuropathol Exp Neurol. 2008;67:1113–1121. doi: 10.1097/NEN.0b013e31818f9ca8. [DOI] [PubMed] [Google Scholar]
- 37.Shams S, Martola J, Granberg T, Li X, Shams M, Fereshtehnejad SM, et al. Cerebral microbleeds: different prevalence, topography, and risk factors depending on dementia diagnosis—the Karolinska Imaging Dementia Study. AJNR Am J Neuroradiol. 2015;36:661–666. doi: 10.3174/ajnr.A4176. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Cordonnier C, Al-Shahi Salman R, Wardlaw J. Spontaneous brain microbleeds: systematic review, subgroup analyses and standards for study design and reporting. Brain. 2007;130:1988–2003. doi: 10.1093/brain/awl387. [DOI] [PubMed] [Google Scholar]
- 39.Grinberg LT, Thal DR. Vascular pathology in the aged human brain. Acta Neuropathol. 2010;119:277–290. doi: 10.1007/s00401-010-0652-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Sengillo JD, Winkler EA, Walker CT, Sullivan JS, Johnson M, Zlokovic BV. Deficiency in mural vascular cells coincides with blood-brain barrier disruption in Alzheimer's disease. Brain Pathol. 2013;23:303–310. doi: 10.1111/bpa.12004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Halliday MR, Rege SV, Ma Q, Zhao Z, Miller CA, Winkler EA, et al. Accelerated pericyte degeneration and blood-brain barrier breakdown in apolipoprotein E4 carriers with Alzheimer's disease. J Cereb Blood Flow Metab. 2016;36:216–227. doi: 10.1038/jcbfm.2015.44. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Bors L, Tóth K, Tóth EZ, Bajza Á, Csorba A, Szigeti K, et al. Age-dependent changes at the blood-brain barrier. A comparative structural and functional study in young adult and middle aged rats. Brain Res Bull. 2018;139:269–277. doi: 10.1016/j.brainresbull.2018.03.001. [DOI] [PubMed] [Google Scholar]
- 43.Janelidze S, Mattsson N, Stomrud E, Lindberg O, Palmqvist S, Zetterberg H, et al. CSF biomarkers of neuroinflammation and cerebrovascular dysfunction in early Alzheimer disease. Neurology. 2018;91:e867–e877. doi: 10.1212/WNL.0000000000006082. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Nelson AR, Sweeney MD, Sagare AP, Zlokovic BV. Neurovascular dysfunction and neurodegeneration in dementia and Alzheimer's disease. Biochim Biophys Acta. 2016;1862:887–900. doi: 10.1016/j.bbadis.2015.12.016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Bowman GL, Dayon L, Kirkland R, Wojcik J, Peyratout G, Severin IC, et al. Blood-brain barrier breakdown, neuroinflammation, and cognitive decline in older adults. Alzheimers Dement. 2018;14:1640–1650. doi: 10.1016/j.jalz.2018.06.2857. [DOI] [PubMed] [Google Scholar]
- 46.Tofts PS, Brix G, Buckley DL, Evelhoch JL, Henderson E, Knopp MV, et al. Estimating kinetic parameters from dynamic contrast-enhanced T(1)-weighted MRI of a diffusable tracer: standardized quantities and symbols. J Magn Reson Imaging. 1999;10:223–232. doi: 10.1002/(sici)1522-2586(199909)10:3<223::aid-jmri2>3.0.co;2-s. [DOI] [PubMed] [Google Scholar]
- 47.Tofts PS, Kermode AG. Measurement of the blood-brain barrier permeability and leakage space using dynamic MR imaging. 1. Fundamental concepts. Magn Reson Med. 1991;17:357–367. doi: 10.1002/mrm.1910170208. [DOI] [PubMed] [Google Scholar]
- 48.Heye AK, Thrippleton MJ, Armitage PA, Valdés Hernández MDC, Makin SD, Glatz A, et al. Tracer kinetic modelling for DCE-MRI quantification of subtle blood-brain barrier permeability. Neuroimage. 2016;125:446–455. doi: 10.1016/j.neuroimage.2015.10.018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Patlak CS, Blasberg RG. Graphical evaluation of blood-to-brain transfer constants from multiple-time uptake data. Generalizations. J Cereb Blood Flow Metab. 1985;5:584–590. doi: 10.1038/jcbfm.1985.87. [DOI] [PubMed] [Google Scholar]
- 50.Starr JM, Farrall AJ, Armitage P, McGurn B, Wardlaw J. Blood-brain barrier permeability in Alzheimer's disease: a case-control MRI study. Psychiatry Res. 2009;171:232–241. doi: 10.1016/j.pscychresns.2008.04.003. [DOI] [PubMed] [Google Scholar]
- 51.Van de Haar HJ, Burgmans S, Jansen JF, Van Osch MJ, Van Buchem MA, Muller M, et al. Blood-brain barrier leakage in patients with early Alzheimer disease. Radiology. 2016;281:527–535. doi: 10.1148/radiol.2016152244. [DOI] [PubMed] [Google Scholar]
- 52.Zhang CE, Wong SM, Van de, Staals J, Jansen JF, Jeukens CR, et al. Blood-brain barrier leakage is more widespread in patients with cerebral small vessel disease. Neurology. 2017;88:426–432. doi: 10.1212/WNL.0000000000003556. [DOI] [PubMed] [Google Scholar]
- 53.Huisa BN, Caprihan A, Thompson J, Prestopnik J, Qualls CR, Rosenberg GA. Long-term blood-brain barrier permeability changes in Binswanger disease. Stroke. 2015;46:2413–2418. doi: 10.1161/STROKEAHA.115.009589. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Cramer SP, Larsson HB. Accurate determination of blood-brain barrier permeability using dynamic contrast-enhanced T1-weighted MRI: a simulation and in vivo study on healthy subjects and multiple sclerosis patients. J Cereb Blood Flow Metab. 2014;34:1655–1665. doi: 10.1038/jcbfm.2014.126. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Thrippleton MJ, Backes WH, Sourbron S, Ingrisch M, Van Osch MJP, Dichgans M, et al. Quantifying blood-brain barrier leakage in small vessel disease: review and consensus recommendations. Alzheimers Dement. 2019;15:840–858. doi: 10.1016/j.jalz.2019.01.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Raja R, Rosenberg GA, Caprihan A. MRI measurements of blood-brain barrier function in dementia: a review of recent studies. Neuropharmacology. 2018;134:259–271. doi: 10.1016/j.neuropharm.2017.10.034. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Lim CM, Moon WJ. Methodologic concerns on the reported values for assessing permeability of the blood-brain barrier in the hippocampus. AJNR Am J Neuroradiol. 2019;40:E65–E66. doi: 10.3174/ajnr.A6228. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Lu Y, Ma L, Qin J, Wang Z, Guo J, Zhao Y, et al. The value of GRASP on DCE-MRI for assessing response to neoadjuvant chemotherapy in patients with esophageal cancer. BMC Cancer. 2019;19:999. doi: 10.1186/s12885-019-6247-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Shao X, Ma SJ, Casey M, D'Orazio L, Ringman JM, Wang DJJ. Mapping water exchange across the blood-brain barrier using 3D diffusion-prepared arterial spin labeled perfusion MRI. Magn Reson Med. 2019;81:3065–3079. doi: 10.1002/mrm.27632. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Verheggen ICM, Van Boxtel MPJ, Verhey FRJ, Jansen JFA, Backes WH. Interaction between blood-brain barrier and glymphatic system in solute clearance. Neurosci Biobehav Rev. 2018;90:26–33. doi: 10.1016/j.neubiorev.2018.03.028. [DOI] [PubMed] [Google Scholar]
- 61.Burgmans S, Van de Haar HJ, Verhey FR, Backes WH. Amyloid-β interacts with blood-brain barrier function in dementia: a systematic review. J Alzheimers Dis. 2013;35:859–873. doi: 10.3233/JAD-122155. [DOI] [PubMed] [Google Scholar]
- 62.Iliff JJ, Wang M, Liao Y, Plogg BA, Peng W, Gundersen GA, et al. A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid β. Sci Transl Med. 2012;4:147ra111. doi: 10.1126/scitranslmed.3003748. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Kress BT, Iliff JJ, Xia M, Wang M, Wei HS, Zeppenfeld D, et al. Impairment of paravascular clearance pathways in the aging brain. Ann Neurol. 2014;76:845–861. doi: 10.1002/ana.24271. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Shibata M, Yamada S, Kumar SR, Calero M, Bading J, Frangione B, et al. Clearance of Alzheimer's amyloidss(1-40) peptide from brain by LDL receptor-related protein-1 at the blood-brain barrier. J Clin Invest. 2000;106:1489–1499. doi: 10.1172/JCI10498. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.Hladky SB, Barrand MA. Elimination of substances from the brain parenchyma: efflux via perivascular pathways and via the blood-brain barrier. Fluids Barriers CNS. 2018;15:30. doi: 10.1186/s12987-018-0113-6. [DOI] [PMC free article] [PubMed] [Google Scholar]