Abstract
신생아 위장관 응급 질환은 소화관을 따라 어디에서나 발생하는 다양한 장애를 포함한다. 이러한 질환들의 경우 대부분 후천성 질환이 아닌 선천성 기형에 의한 것이나 산전 검사에서 확인되지 않은 경우도 많아 이에 대한 산후 평가가 필요하게 된다. 이 시기의 신생아의 경우 성인과 달리 전산화단층촬영(computed tomography; 이하 CT)과 자기공명영상(magnetic resonance imaging; 이하 MRI)이 제한적인 경우가 많아 초기 복부 방사선 촬영에서의 진단이 중요하게 되어 복부 방사선 촬영에서 보일 수 있는 소견들에 대해 숙지하는 것이 필요하다. 또한 추가적으로 진단에 사용될 수 있는 복부 초음파, 투시 검사의 소견, 적응증에 대해 이해하는 것이 진단과 이에 따른 적절한 처치를 위해 중요하다. 이에 이 논문에서는 신생아 위장관 응급 질환에서 나타날 수 있는 다양한 영상 소견에 대해 기술하고 정리하였다.
Keywords: Infant, Newborn, Gastrointestinal Diseases
Abstract
Newborn gastrointestinal tract emergency diseases include various disorders that occur anywhere along the digestive tract. Most of them are congenital malformations, not acquired diseases. Many of them cannot be confirmed on prenatal examination, and consequently, postnatal evaluation is required. Unlike adults, in newborn babies, detailed evaluations with computed tomography (CT) and magnetic resonance imaging (MRI) are often limited, so making the diagnosis based on early abdominal radiography is most important. Therefore, it is necessary to be familiar with the radiologic findings that may be seen on imaging studies. In addition, it is important to understand abdominal ultrasound and fluoroscopy findings, which can be used in addition to simple radiography and indications that can be used for further diagnosis and appropriate treatment. Therefore, this study describes and organizes the various imaging findings that may occur in neonatal gastrointestinal emergencies.
서론
신생아기의 위장관 응급 질환은 대개 장 폐색의 형태로 나타나게 된다(1,2,3,4,5). 임상적으로 의심 가능한 환아들에서 빠른 진단과 치료방침의 결정에 있어 영상의학적 검사는 중요하나 신생아기의 영상의학적 검사는 제한적인 경우가 많다. 이러한 상황에서 적절한 영상의학적 검사를 선택하여 시행하고 빠른 진단을 내리는 것이 매우 중요하며 이에 이 논문에서는 영상의학 검사와 주요 질환의 영상의학적 소견에 대해 소개하고자 한다.
영상의학 검사
복부 방사선 촬영
복부 방사선 촬영은 초기 검사로 질환의 유무를 의심하고 향후 시행할 다른 영상 검사의 종류를 결정할 수 있게 하는 향후 추적관찰에 가장 중요한 검사이다. 복부 방사선 촬영의 경우 앙와위s(upine view)의 영상이 주로 사용된다. 정립상(erect view)을 시행할 수 없는 신생아의 경우 상체를 잡고 시행하는 입위(upright view)를 성인의 정립상대신 시행할 수 있으나 제한적으로 사용되며 측와위(left side down decubitus view)로 대체하는 경우가 많다.
신생아기 복부 방사선 촬영에서는 식도위경계(esophagogastric junction; EG junction), 회맹판(ileocecal valve; 이하 IC valve)의 미성숙으로 정상적으로 소장 내의 가스가 보일 수 있고 정상적으로 소장과 대장 전반에 가스가 많고 장내 fluid는 적어 장의 경계가 명확하며 원형, 타원형의 형태로 보인다. 이에 가스의 분포와 함께 장의 팽창 정도, 팽창된 장의 분포를 함께 확인하여야 하며 팽창 정도는 대개 척추체의 넓이를 기준으로 판단하는 경우가 많다. 이에 더하여 팽창된 장관의 위치와 추적검사에서 팽창된 양상의 위치, 정도변화를 바탕으로 장의 상태를 복부 방사선 촬영에서 확인할 수 있으며 이를 바탕으로 장운동의 저해가 생길 수 있는 병적인 상황에 대한 진단이 가능하다.
또한 팽창된 장의 정도와 위치에 따라 장 폐색을 진단할 수 있으며 폐색 정도에 대해 판단할 수도 있다. 이러한 경우 입위, 측와위가 도움이 될 수 있다. 장내의 가스뿐 아니라 장관 벽 내의 가스, 간문맥 가스도 복부 방사선 촬영에서 확인 가능하다.
이에 더하여 장외 가스인 기복증도 복부 방사선 촬영에서 확인이 가능하며 기복증의 경우 누워있는 환아의 간음영 위로 생기는 저음영의 영역으로 확인할 수 있으며 이로 인해 겸상인대(falciform ligament)가 드러나게 되는 것도 진단의 중요한 근거가 된다. 소량의 기복증의 확인을 위해 환아가 누운 자세에서 옆에서 촬영하는 영상(cross table lateral view)이 도움이 될 수 있다(6)
복부 초음파
신생아기 복부 초음파 검사는 방사선 노출 없이 시행할 수 있는 검사로 고형장기 및 장관계 이상에 대한 초기 검사로 권해진다(6). 특히 신생아 중환아실 환아의 이동 없이 병실에서 이동식 검사가 가능하다.
사용이 되는 초음파 탐촉자 중 고빈도 탐촉자(7.5 MHz 이상)를 사용하면 높은 공간 해상도를 제공하여 세부적인 병변을 확인할 수 있으며 장관계 병변 확인에 유용하다(7,8).
그러나 환아의 상태에 따라 누르며 검사하는 것이 환아에게 부담이 될 수 있으며 협조가 되지 않는 환아의 검사에 있어서는 검사자의 역량이 중요하게 되어 검사자의 숙련도가 검사의 정확도에 영향을 미치기도 한다.
검사 시 금식을 시행하면 장의 연동운동이 감소되어 실제의 연동운동 정도를 확인할 수 없다는 의견도 있으며 검사 30분 전 무탄수화물을 섭취하게 하는 것이 도움이 된다고도 하나 소아 환자에서 검사 시 이러한 시간을 지키기가 어려운 경우가 많다. 또한 검사 시 대개 장뿐만 아니라 고형장기, 담낭을 같이 검사하여야 하는 경우에 금식이 필요한 경우가 많으며 이런 경우 검사 도중 수유를 진행하는 것이 환아의 진정에 도움이 될 수 있다.
투시 검사
투시 검사 중 상부 위장관 조영술은 식도, 위, 근위부 소장 이상에 대해 추가적인 정보를 얻을 수 있다(6,8). 특히 식도협착증, 중장 회전이상(Midgut malrotation), 중장 염전(Midgut volvulus)에 사용된다. 대장 조영술의 경우 작은결장증(이상 unused microcolon)을 확인할 수 있으며 Meconium obstruction of prematurity에서는 진단과 함께 치료적인 목적으로 사용될 수 있다. 수술 후 협착과 합병증에 대한 평가를 위해서도 투시 검사가 유용하다.
투시 검사를 위해서 체액과 비슷한 농도로 희석한 위장관 조영제가 사용되며 barium이 가장 흔하게 사용되는 조영제이다. Barium은 상부 위장관, 대장 조영술에 사용될 수 있으나 장천공 시복막염의 위험이 있으며 다량의 흡인의 경우 문제가 될 수 있다. Gastrofin과 같은 고장성 조영제를 사용하는 경우 수분을 끌어들이는 성격이 있어 폐로 흡인되는 경우 폐부종의 위험이 있으나 장내에서 장벽의 수분을 장내로 끌어들이게 되며 이러한 성격을 이용하면 관장에 사용될 수도 있다.
각론
식도 폐쇄증(Esophageal Atresia)
식도 폐쇄증은 식도의 선천성 질환 중 가장 중요하며, 그 원인은 명확히 알려져 있지 않으나 태생 3~5주에 일어나는 초기의 전장(primitive foregut)에서 원시 기관과 식도의 분리가 정상적으로 이루어지지 않아 생기는 발생학적 문제 혹은 허혈성 손상으로 인한 후유증이라고 설명된다.
근위부 식도 폐색과 동반되어 근위부, 원위부 식도와 기관 사이의 누공의 유무에 따라 대표적으로 5개의 아형으로 분류한다(6). 이중 근위부 식도의 폐색과 함께 원위부 식도와 기관 사이에 누공이 형성되는 경우(esophageal atresia with tracheoesophageal fistula)가 80~90%가량으로 가장 흔하다. 다른 장기의 동반된 기형은 50~60%의 빈도이며 가장 흔한 기형의 조합이 vertebral, anorectal, cardiac, tracheoesophageal, renal and limb defects (이하 VACTERL)로 알려져 있어 이 조합의 장기에 대한 검사가 같이 필요하다(4,5,6,9,10)
산전 검사에서 작은 위가 보이며 양수 과다가 함께 있는 경우 식도 폐쇄를 진단할 수 있으나 위 양성률이 높아 산후 검사가 진단에 중요하다
진단에는 흉부 방사선 촬영에서 근위부 식도 주머니의 확장이 보이며 대부분 제2~4 흉추 부위에 있다. 호기시 혹은 우는 도중 영상이 촬영되면 식도 주머니의 확장이 보이지 않을 수 있어 구위관(orogastric tube)을 삽입하여 이 끝이 근위부 식도 주머니 끝에서 말려 올라오는 것을 확인하는 것이 근위부 식도 폐쇄를 진단할 수 있는 객관적인 근거가 될 수 있겠다(Fig. 1). 또한, 흉부 방사선 촬영에서 포함된 상복부의 위장관 내 가스 유무를 확인하는 것이 기관 식도루의 유무를 확인하여 아형을 분류하는 데에 도움이 된다(Fig. 1) (6).
Fig. 1. Cases of 2-day-old male neonates with esophageal atresia: comparison between esophageal atresia with and without tracheoesophageal fistula.
A, B. Note kinking of the inserted orogastric tube within the proximal esophageal pouch in both (A) and (B). Note that the presence of stomach gas (arrow) defines the presence of the tracheoesophageal fistula (A). Non-delineable stomach gas defines the absence of the tracheoesophageal fistula (B).
수술 전 가장 흔한 합병증으로는 흡인성 폐렴이 있으며 수유 후에 생길 수 있으며 원위부 식도와 기관 사이의 누공이 있는 경우 위산이 폐로 흡인될 수 있다. 흡인성 폐렴은 대개 우상엽의 증가된 음영으로 나타난다.
수술 전에 단순촬영 외에 추가적으로 3D CT로 협착부의 간격이나 루(fistula)를 평가할 뿐 아니라 대동맥궁의 위치를 확인할 수 있으나 이용은 제한적이며 다른 동반 기형에 대한 판단을 위해 사용되는 경우가 더 흔하다.
아형 중 H형의 식도기관루의 경우 식도의 폐색 없이 식도와 기관 사이에 루가 존재하는 경우로 다른 아형의 식도 폐색과는 달리 구위관은 정상적인 위 내에 위치하게 되어 정상으로 오인되는 경우가 흔하다. 그러나 식도기관루를 통한 흡인이 반복되어 흡인성 폐렴이 발생하면 이에 대한 원인을 검사하는 과정에서 식도 조영술을 시행하여 루를 확인하면 진단할 수 있게 된다(Fig. 2). 대개의루는 2번째 흉추 위에 위치하고 있으며 식도에서 기관으로 아래에서 위로 향하고 간헐적으로 열려 누운 자세에서의 진단은 어려우며 엎드린 자세에서 구위관을 통해 조영제를 주입하며 확인하는 것이 루를 정확히 찾는 데에 도움이 된다(Fig. 2) (8).
Fig. 2. A 5-day-old male neonate with esophageal atresia: complained of repetitive aspiration and desaturation during feeding.
A. Repetitive pneumonic consolidation is noted in both the perihilar areas on a simple chest radiograph.
B. During esophagography, there is an oblique fistulous tract (arrow) connecting the esophagus and trachea. It is diagnosed as a H-type tracheoesophageal fistula.
치료는 위중도에 따라 루를 제거하고 근위부, 원위부 식도를 연결해 주는 한 단계의 수술을 시행하거나 근위부, 원위부 식도 간의 거리가 멀 경우 위조루술(gastrostomy)을 일차적으로 시행한 후 순차적으로 루 제거와 문합을 시행하는 방법을 사용한다.
일차적인 위조루술 후 식도 문합 전 원위부 식도 주머니 평가가 필요한 경우 위식도역류를 노리개 젖꼭지 등으로 유발하며 위조루술 부위를 통해 공기나 조영제(바륨)를 주입한 뒤 역류되는 공기, 바륨의 높이로 원위부 식도 주머니의 위치를 예측할 수 있다(Fig. 3A, B).
Fig. 3. Evaluation of the distal esophageal pouch level after gastrostomy in esophageal atresia patients.
A, B. Reflux of air (A) or contrast material (B) within the distal esophageal pouch (arrows) is noted during sucking of a pacifier.
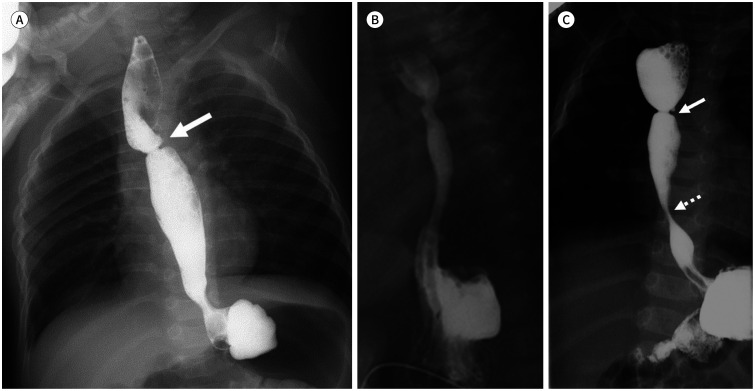
근위부, 원위부 식도 문합 이후 추적검사로는 투시 검사를 시행하며 문합 부위 협착(Fig. 4A)을 확인하여 문합부의 협착이나 누출을 확인하여야 한다(4,5). 수술 후에 정상적인 위식도 경계가 상 방으로 이동하며 열공 탈장(hiatal hernia)이 발생하는 경우(Fig. 4B)가 흔하여 위식도 역류의 유무도 확인이 필요하다. 식도 폐쇄증의 10%가량에서 식도협착증이 원위부 식도에 같이 있는 경우 (Fig. 4C)가 있어 수술 후 추적검사에서 함께 평가가 필요하다(11).
Fig. 4. Postoperative complications of esophageal atresia.
A. Postoperative stenosis at the anastomosis level (arrow).
B. Sliding hernia due to the stretched gastroesophageal junction above the diaphragm.
C. Postoperative stenosis at the anastomosis level (arrow) with another stenosis at the distal esophagus (dot arrow) suggest the coexistence of esophageal stenosis.
식도협착증(Esophageal Stenosis)
식도협착증은 식도 폐쇄보다 빈도가 적은 매우 드문 질환이다. 대개 고형 식이시 발생하는 연하곤란이나 음식이 협착부테 걸려 발생하는 반복적인 구토 등으로 나타난다. 또한 식도 폐쇄와 동반되는 경우가 흔하여 수술 후 식도에 대한 검사 시에 발견되는 경우도 있다.
병리학적으로 세 가지 아형으로 나뉘며 식도 하부 1/3에 호발하는 연골기관기관지 잔유물(cartilaginous tracheobronchial remnant)로 인한 협착과 이 상방에서 호발하는 섬유근육형 협착 (fibromuscular stenosis), 막성 결막(membranous diaphragm)이 있다.
식도 조영술이 협착의 유무, 위치, 범위, 정도를 확인하는 검사로 사용되며 섬유근육형 협착에서는 점차적으로 좁아지는 형태로, 막성 결막의 경우 막의 형태로 보이는 식도의 근위부 혹은 중간부분의 국소적 협착이 있다. 연골기관기관지 잔유물의 경우 원위부 식도에서 협착 부위를 확인할 수 있다(Fig. 5A). 이 경우 중간엽조직이 식도로 분화되는 과정에서 기관의 연골조직이 식도에 잔류한 경우로 호흡상피가 내부로 배열된 벽 내의 낭포 공간으로 조영제가 고이게 되어 협착부에서 돌출되는 선상의 식도 벽 내의 조영제 열들이 확인된다(Fig. 5B).
Fig. 5. A 3-year-old boy with esophageal stenosis manifesting as vomiting after food ingestion.
A. During esophagography, there is stenosis at the distal esophagus with an impacted bean (arrow), which is noted as a filling defect.
B. During follow-up esophagography after removal, there is linear outpouching staining (dot arrow) at the stenotic level (arrow) suggesting an underlying tracheobronchial remnant.
치료 목적으로 중재적 풍선확장술이 협착 부위를 넓혀주는 데 사용된다. 그러나 연골기관기관지 잔유물의 경우 연골조직이 잔존하여 시술이 효과적이지 않으며 천공과 같은 심각한 합병증이 생길 수 있어 중재적 시술을 시행하지 않으며 수술을 시행한다(12,13).
중장 회전이상 및 염전(Midgut Malrotation and Volvulus)
원시 중간 창자가 배아 외 체강에 위치하여 있다가 다시 체내로 돌아 들어오게 되는 과정에서 상장간막 동맥을 축으로 시계 반대 방향 270도 회전 후 복막에 고정되어 자리를 잡게 된다(1,14). 이러한 회전과 고정 과정에서 발생하는 문제들을 통틀어 중장 회전이상이라고 칭한다. 회전이상은 증상을 일으키는 경우 대개 생후 1개월 이내에 진단되게 되며 증상이 발현되지 않는 경우 우연히 발견되거나 진단되지 않는 경우가 많아 정확한 발생률을 알 수 없는 질환이다.
회전이상(Fig. 6)은 대부분 증상이 없으나 중장 염전(Fig. 7)이나 장간막 띠(ladd band)로 인한 십이지장 폐색 혹은 소장의 허혈 등에 의한 토혈, 혈변, 복통 등이 발현된다(4,5,6). 이러한 증상은 십이지장 폐쇄, 협착과 유사하다. 장간막 띠는 맹장(cecum)과 우하복부의 후복막을 연결하는 섬유성 띠로 회전이상이 생겨 맹장의 위치가 변화하게 되면 이 띠가 다른 장과 유착을 만들어 폐색이 되거나 염전을 유발하게 된다(1,14).
Fig. 6. A 10-month-old girl with malrotation, who has a mildly distended abdomen without vomiting.
A. There is a nonspecific bowel gas pattern. A relatively small bowel gas-like shadow is noted in the rightsided abdomen, and large bowel gas-like shadow is noted in the left-sided abdomen.
B. Reversed SMA (A) and SMV (V) relations are noted on ultrasonography.
C. Normal upper gastrointestinal series, for comparison.
D. In the upper gastrointestinal series, the duodenal C-loop is noted at the normal location, on the right side to the right pedicle. However, the duodenojejunal junction (arrow) shows a medial location, and jejunum courses to the right upper quadrant abdomen area (dot arrow).
SMA = superior mesenteric artery, SMV = superior mesenteric vein
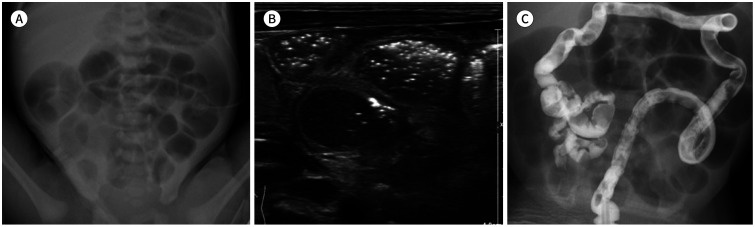
Fig. 7. A 3-day-old male neonate with midgut volvulus manifesting as massive vomiting.
A. On a simple radiograph, the distended stomach and duodenal bulb show the “double bubble sign.”
B. The typical “whirling sign” is noted on ultrasonography. The SMV (V), bowel, and bowel mesentery show whirling around the SMA (A), strongly suggesting volvulus.
C. In the upper gastrointestinal series, the duodenum and jejunum show a spiral appearance in the right upper quadrant of the abdomen, which shows the “cock screw sign.”
SMA = superior mesenteric artery, SMV = superior mesenteric vein
복부 방사선 촬영에서 회전이상의 경우 정상 혹은 비특이적 소견을 보일 수 있으며(Fig. 6A) 중장 염전의 경우에는 위와 십이지장의 팽대 소견을 보일 수 있다(Fig. 7A) (15). 이러한 ‘double bubble sign’은 십이지장 폐쇄에서도 보일 수 있어 이에 대한 감별을 위해 초음파 검사가 도움이 될 수 있다.
초음파 검사는 중환아실 환아에 대한 선별검사로 더 간편하게 활용된다. 초음파 검사에서 상장 간막 정맥과 동맥의 위치를 확인하는 것이 기본이며 대개 간좌엽을 기준으로 하방으로 초음파 탐촉자를 움직이면 위의 유문, 췌장을 지나 상장간막 정맥과 동맥을 확인할 수 있다. 정상적인 위치는 상장간막 정맥이 동맥과 비교하여 환아의 오른쪽에 위치하여야 한다. 회전이상 경우 상장간막 정맥이 동맥의 좌측(50~85%) 혹은 전방(15~20%)에 위치하게 된다(Fig. 6B) (6,8,16). 상장간막정맥과 동맥이 제 위치에 있을 때 가능하면 십이지장의 세 번째 부분이 췌장 뒤를 지나 좌상복부로의 주행을 확인하고 IC valve 및 맹장이 우하복부에 위치함을 확인하면 초음파에서 회전이상의 가능성이 적다고 말할 수 있다(17).
중장 염전의 경우 특징적인 소견은 도플러 검사에서의 ‘whirlpool sign’이며 이는 상장간막 동맥을 중심으로 시계방향으로 꼬인 소장, 장간막 및 확장된 장간막 정맥이 보이는 소견이다(Fig. 7B) (18,19,20,21). 상방으로 위와 십이지장 구부의 확장이 보이며 확장된 위, 십이지장 구부벽이 두꺼워지지 않는 점이 다른 십이지장 자체의 폐색과의 차이점으로 보기도 한다(18).
상부 위장관 조영술에서 정상 장관의 주행을 확인하기 위해서는 십이지장 C-loop과 십이지장공장 경계부의 모양, 위치를 확인하는 것이 가장 중요하다(22). 조영제(바륨)가 처음으로 지나가는 순간의 십이지장 C-loop와 십이지장공장 경계부의 모양과 위치를 확인하는 것이 중요하며 이후 조영제의 흐름을 따라 좌상복부에 공장에서 하복부의 회장 순서로 소장의 위치를 파악한다. 십이지장 C-loop의 정상 위치는 제1요추체의 우측 pedicle의 우측에 위치한다(Fig. 6C).
중장 회전이상의 경우 초음파 검사로 진단하며 상부 위장관 조영술로 확인이 필요하지 않으나 정확한 장의 위치 확인이 필요한 경우 시행되며 회전이상과 흔히 동반되는 내장 역위(heterotaxy syndrome)의 경우 상장간막 동맥과 정맥의 위치만으로 회전이상의 진단이 어렵게 되어 이에 대한 확인을 위해 사용되기도 한다(23,24,25,26). 중장 회전이상에서 상부 위장관 조영술을 시행하면 C-loop가 아래로 늘어져 있고 십이지장공장 경계부의 위치가 비정상이며 공장이 우상복부에 위치한다(Fig. 6D) (23). 중장 염전의 경우 소장이 상장간막 동맥을 싸고 돌아가는 ‘corkscrew sign(spiral sign)’ 혹은 ‘pig tail sign’이 특징적 소견이며 원추형의 십이지장 폐색이 동반된다(Fig. 7C) (6,14). 그러나 상부 위장관 조영술은 신생아들에게는 비교적 침습적인 검사로 초음파에서 진단이 어려울 때 보조적으로 사용한다.
십이지장폐쇄증(Duodenal Atresia) 및 협착증(Stenosis)
선천성 위장관 폐쇄 중 비교적 흔한 질환이다. 발생학적으로는 십이지장의 내강이 발달 중에 제대로 재소통(recanalization) 되지 않은 것으로 설명되며 폐쇄 및 협착 부위가 대부분 바터 팽대부 혹은 이의 직하방에 생기게 되어 복부 팽만이 동반된 담즙성 구토를 유발한다(4,5). 다른 위장관, 신장 혹은 심장의 기형이 동반되며 이중 고리 췌장(annular pancreas)이나 회전이상이 동반되는 경우가 1/3가량에 있다. 다운증후군과 동반되기도 한다
정도에 따라 세 가지 아형으로 나뉘며 Type I의 경우 완전 혹은 부분적인 막성 폐쇄, II의 경우 섬유성 끈으로 연결된 폐쇄, III의 경우 연결되지 않는 부분이 있는 경우이다.
복부 방사선 촬영에서 가스로 팽창된 위와 십이지장 구부(duodenal bulb)가 보이는 ‘double bubble sign’이 진단에 가장 중요하나 환아가 토한 직후에는 가스가 차있지 않아 이러한 소견이 보이지 않을 수도 있어 추적관찰이 필요하다(Fig. 8A) (1,6,15). 복부 방사선 촬영 소견이 진단에 가장 중요하며 초음파에서도 팽창된 십이지장 구부와 협착된 하부 소장을 확인할 수 있다(Fig. 8B). 추가적인 검사는 필요하지 않으나 동반된 기형이나 담도의 변화에 대해 초음파를 시행하기도 한다(Fig. 8C).
Fig. 8. A female neonate at birth with duodenal atresia.
A. The typical “double bubble sign” is noted on a simple radiograph.
B. On ultrasonography, there is a distended duodenal bulb (D) with a non-delineable, collapsed 3rd portion of the duodenum.
C. There is also wall thickening of the common bile duct (arrow), suggesting cholangitis.
십이지장협착증의 경우 복부 방사선 촬영에서 진단하는 것이 용이하지 않으며 심한 경우 십이지장 구부의 확장과 차이를 보이는 하부 소장 가스를 보이게 된다(Fig. 9A). 상부 위장관 조영술이 진단에 중요하여 소량의 조영제를 사용하여 협착의 위치, 원인(내인성 혹은 외인성)에 대한 정보를 얻을 수 있다. 십이지장 웹(duodenal web)의 경우 상부 위장관 조영술에서 ‘wind sock appearance’를 확인할 수 있으며(Fig. 9B) 초음파 검사에서 팽창된 근위부 십이지장과 동반된 에코가 있는 얇은 곡선의 막을 확인할 수 있다(Fig. 9C) (6,27).
Fig. 9. A 2-day-old female neonate with duodenal stenosis and a distended abdomen.
A. On a simple radiograph, a relatively distended stomach and duodenal bulb are noted. Gas passage to the distal small and large bowel loop is noted.
B, C. In the upper gastrointestinal series and ultrasonography, the distended duodenum (D) and thin web-like structure (arrows) are delineated.
소장폐쇄증(Small Bowel Atresia) 및 협착증(Stenosis)
공장과 회장의 폐쇄와 협착증은 선천성 위장관 협착 중 가장 흔하다. 폐쇄 및 협착부의 위치에 따라 양수 과다증을 보이는 경우가 있으며 담즙성 구토와 복부팽창, 태변 배출의 문제를 동반한다. 십이지장 폐쇄와는 달리 자궁 내에서의 허혈로 인한 후유증으로 이해되며 다른 기형과 동반되는 경우가 적다. 근위부에 생기는 경우 연관기형이 더 흔한 것으로 되어 있다(28). 원위부 회장, 근위부 공장에 생기는 경우가 근위부 회장, 원위부 공장에 생기는 경우보다 많다.
다섯 아형으로 분류되며 type I의 경우 완전 혹은 부분적인 막성폐쇄, II의 폐쇄 부위가 섬유성 끈으로 연결된 폐쇄, IIIa의 경우 소장 폐쇄와 장간막의 소실이 함께 있는 경우, IIIb의 경우 긴 분절의 소장, 장간막 소실이 있는 경우이다. IIIb의 경우 남은 원위부 소장 부분이 돌돌 말려있는 모양을 보여 ‘apple peel appearance’라 한다. Type IV는 여러 분절에 폐쇄가 동반되어 있는 경우이다(6).
단순 복부 방사선 촬영에서 가스로 팽대된 소장이 팽창된 십이지장 구부, 위와 함께 보이는 ‘triple bubble sign’이 있으면 근위부 공장의 폐쇄를 진단할 수 있다(Fig. 10). 원위부 폐쇄일수록 팽대된 소장의 길이가 더 길어지며 소장 폐색 소견을 보이는 ‘multiple bubble sign’이 보이게 된다(Fig.11A). 이와 동반되어 천공이 생기게 되면 이로 인한 복수, meconium pseudocyst, 복막, 장관 내, 장관벽 내의 석회화를 관찰할 수 있다. 원위부 회장의 폐쇄의 경우에는 가스가 차 다른 장관보다 더 늘어난 장관(bulbous segment)이 보이고 직장 내 가스가 보이지 않아 Hirschsprung's disease와의 감별 진단이 어려운 경우도 있으며 이러한 경우 대장 조영술이 감별에 필요하다(Fig.11A, B) (15).
Fig. 10. A female neonate at birth with jejunal atresia.
A. The typical “triple bubble sign” is noted.
B. On ultrasonography, there is a distended duodenum (D) and proximal jejunum (J) with non-delineable, collapsed other small bowel loops. Normal relations of superior mesenteric artery (A) and superior mesenteric vein (V) are also noted.
Fig. 11. A 2-day-old male neonate with ileal atresia.
A. On a simple radiograph, distended small bowel loops show the “multiple bubble sign.” A bulbous dilated segment (arrow) is noted at the lower abdomen.
B. In the lateral view, rectal gas is not noted. At this point, Hirschsprung's disease is hard to differentiate.
C. During enema, by using a water-soluble contrast material, decreased diameter of the colon loop is noted, which suggests an unused microcolon.
D. Dilated fluid-filled small bowel loops with a collapsed unused microcolon (arrow) can also be noted on ultrasonography.
대장 조영술은 폐색이 있는 경우로 수용성 조영제를 사용하여 직경 1 cm 이하로 대장의 직경이 감소되어 있는 unused microcolon을 확인할 수 있다(Fig. 11C) (6). 이러한 unused microcolon은 상방의 폐색으로 사용되지 못한 대장의 직경이 감소되는 것으로 meconium ileus, proximal colon atresia, meconium obstruction of prematurity, Berdon syndrome, total colonic aganglinosis에서도 보인다(15).
초음파 검사는 필수적이는 않으나 늘어난 협착부 상방의 소장과 unused microcolon을 확인할 수도 있으며(Fig.11D) 천공 시에 동반될 수 있는 합병증(meconium peritonitis, meconium pseudocyst 등)의 가능성이 있는 경우, 가능성은 낮으나 동반기형 등에 대한 검사에 이용된다.
Meconium Related Disorder
태변복막염(Meconium Peritonitis)
자궁 내에서 장관의 폐색이나 염전으로 인하여 장천공이 발생하게 되면 태변이 복강으로 새어 나오게 된다. 태변 자체는 무균상태로 복강 내에서 화학적 복막염을 유발하게 된다. 이로 인해 태변성 복수가 복강 내에 발생하게 되어 산전 초음파에서 발견이 가능하게 된다.
이때 새어 나온 태변의 양과 이로 인한 복막염의 정도, 천공의 자연 치유 유무에 따라 아형과 예후가 결정되게 된다(29). 천공이 산전에 자연적으로 치유되면 산후에는 더 이상 진행되지 않고 태변성 복수가 흡수된 흔적으로 석회화가 고형 장기에 남아 있을 수 있으며 초상 돌기(processus vaginalis)를 통해 복강 내에서 음낭 내로 태변성 복수가 저류되면 음낭 내에도 석회화가 생길 수 있다. 이런 경우를 healed type이라 한다. 치유되는 과정에 유착이 생기게 되면 장 폐색이 남게 되는 fibro-adhesive type이 된다.
천공이 산전에 치유되지 않고 태변성 복수가 있는 상태에서 태어나 산후에도 지속되게 되면 세균성 복막염으로 진행되는 generalized type이 된다. 이러한 태변성 복수가 천공된 장 주변으로 낭종을 형성하게 되면 cystic type이 된다.
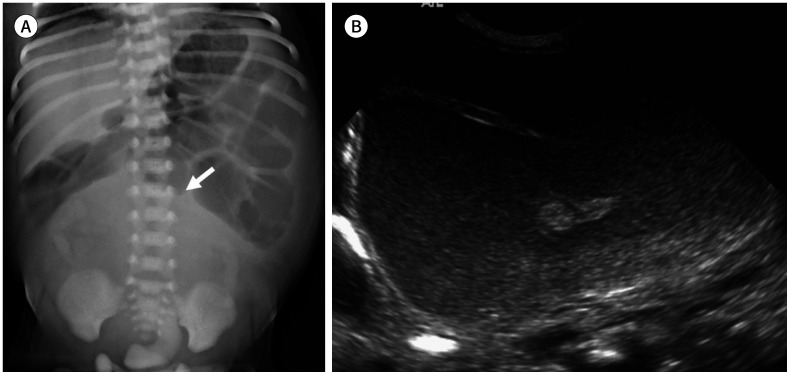
영상의학 검사에서도 각각의 아형이 각기 다른 소견을 보이게 된다. Healed type의 경우 단순 복부 촬영, 초음파에서 석회화가 간, 비장 등 고형장기 음영를 따라 보일 수 있으며 남아의 경우 음낭을 포함하여 검사를 시행하면 음낭 내 석회화도 확인할 수 있다(Fig. 12) (29,30). Fibro-adhesive type은 정도에 따라 장 폐색의 소견을 석회화에 더해 확인할 수 있다.
Fig. 12. female neonate at birth with healed-type meconium peritonitis who does not have specific symptoms.
A, B. Calcification (arrows) along the liver is noted on both simple radiograph and ultrasonography. Note the absence of a definite abnormal bowel gas pattern. These findings can be seen in healed-type meconium peritonitis.
Cystic type 경우 단순 복부 촬영에서 연부조직 음영의 meconium pseudocyst로 인해 장이 압박되며 밀려나는 소견이 보이며 이 음영의 벽을 따라 석회화가 관찰된다(Fig. 13). 초음파 검사에서도 복강 내 단순 복부 촬영에서 석회화뿐 아니라 낭종 혹은 복수의 특성을 평가할 수 있다(31,32,33). Generalized type 경우 많은 양의 복수가 확인되며 초음파에서 내부에 떠다니는 태변 찌꺼기들이 눈 폭풍이 몰아치는 것처럼 보이며 이를 ‘snow storm configuration’이라고 한다(Fig. 14) (34).
Fig. 13. A male neonate at birth with meconium pseudocyst and a distended abdomen.
A. On a simple radiograph, a space occupying lesion (arrow) is noted in the lower abdominal area.
B. A cystic lesion with a peripheral echogenic calcification and inner echogenic dirty debris are noted in the lower abdomen area on ultrasonography.
Fig. 14. A male neonate at birth with meconium peritonitis.
A. The distended abdomen with ascites is noted on a simple radiograph. A lucent area in the mid upper portion of the abdomen (arrows) suggests pneumoperitoneum.
B, C. Echogenic debris within the ascites is noted in the whole abdominal area with bowel thickening (B), suggesting a “snowstorm appearance.” Ascites passage through the inguinal canal to the scrotal sac is also noted (C).
Meconium Obstruction of Prematurity
미숙아, 특히 극소 체중의 미숙아(< 1500 g)가 태변을 제대로 배출하지 못하여 생기는 질환을 칭하며 이는 신경절의 미숙한 발달과 점도가 높고 끈적이는 태변 자체의 성질에 의한 기능적인 장애로 알려져 있으며 meconium ileus와는 달리 기존 질환이 없다. 생후 태변의 배출이 소량이거나 전혀 없는 경우가 있으며 본질적인 회장폐쇄와는 달리 태변만 제거해 주면 대다수에서 호전된다(35,36,37).
복부 방사선 촬영에서는 근위부 장관의 팽창 소견이 보인다(Fig. 15A). 초음파 검사에서 장관의 염증 소견이 없고 팽창된 모습만 보이며 장관 내에서 태변을 확인할 수 있다(Fig. 15B). 태변은 비교적 저에코의 장관 내 물질로 보이며 내부에 고에코의 점(hyperechoic speckle)들이 보이는 것이 이후의 대변과 구분되는 특징이다. 초음파 검사는 이외의 다른 폐쇄의 원인을 감별할 수 있어 감별 진단에 도움이 된다.
Fig. 15. A 2-day-old female preterm neonate with meconium obstruction of prematurity. She is a 28-week preterm neonate with a body weight of approximately 1.1 kg at the initial examination.
A. A simple radiograph on the 3rd day after birth shows distended bowel loops.
B. On ultrasonography, a hypoechoic meconium within large bowel loops is revealed.
C. On the 6th day after birth, water-soluble contrast enema was performed. A post-procedure simple radiograph shows contrast material filling of the distal small bowel loops with filling defects due to meconium.
진단 및 치료를 위한 희석된 고장성 수용성 조영제(gastrografin)를 이용한 대장 조영술을 시행하면 충만결손 음영으로 나타나는 태변과 microcolon을 확인할 수 있다(Fig. 15C) (35,36,37). 수용성 조영제를 사용한 투시 검사 후에 태변 배출이 촉진되면 복부팽창이 호전될 수 있으나 관장 후에도 증상이 호전되지 않으면 수술이 필요하다. 시술의 효과를 높이기 위해 조영제를 IC valve 상방의 말단 회장으로의 주입해야 하며 반복적인 시술이 필요할 수 있다(35).
태변장폐색증(Meconium Ileus)
Meconium ileus는 원위부 회장에서 태변으로 인해 소장이 폐색되는 질환으로 낭성섬유증(cystic fibrosis)의 첫 증상으로 나타나게 되며 낭성섬유증이 흔하지 않은 우리나라에서는 거의 발생하지 않는 것으로 알려져 있다(38,39). 임상적인 양상은 회장 폐쇄와 비슷하다.
단순 복부 방사선 촬영에서 장관 내에 ‘soap bubble’ 형태의 내용물이 보일 수 있으며 근위부의 소장 팽대가 있으나 늘어난 정도에 비해 air-fluid level이 없는 것이 전형적 소견이다(4,5,6). 고장성 수용성 조영제를 사용한 대장 조영술(gastrografin enema)은 진단 및 치료에 매우 유익하며 microcolon과 원형 혹은 난형의 충만결손음영이 원위부 회장과 대장에서 관찰된다. 초음파 검사에서는 높은 에코를 가진 물질인 태변을 팽창된 공장 내에서 확인할 수 있으며 이는 회장폐쇄증과 감별되는 소견이다.
항문직장기형
항문직장기형은 비뇨직장중격(urorectal septum)의 비정상적인 발달로 인해 발생하는 항문직장 및 비뇨생식기의 이상을 전반적으로 총칭하는 광범위한 스펙트럼의 질환군이다. 외형상의 이상으로 발견되게 된다.
항문과 치골직장근(puborectalis muscle)과의 관계, 루의 유무와 위치에 따라 high, intermediate, low type의 세 가지 아형으로 나뉘게 된다(Fig. 16) (40).
Fig. 16. Ultrasonography of anorectal malformation cases with the transperineal approach.
A. A low-type anorectal malformation: a hypoechoic fistulous tract (arrow) at the skin to the anus (A) is noted. There is no connection between fistulous tract and bulbar urethra (U).
B. An intermediate-type anorectal malformation: a hypoechoic fistulous tract (arrow) between the rectum (R) and the bulbar urethra (U) is noted.
C. A high-type anorectal malformation: a hypoechoic fistulous tract (arrow) between the rectum (R) and the upper vagina (V) is noted.
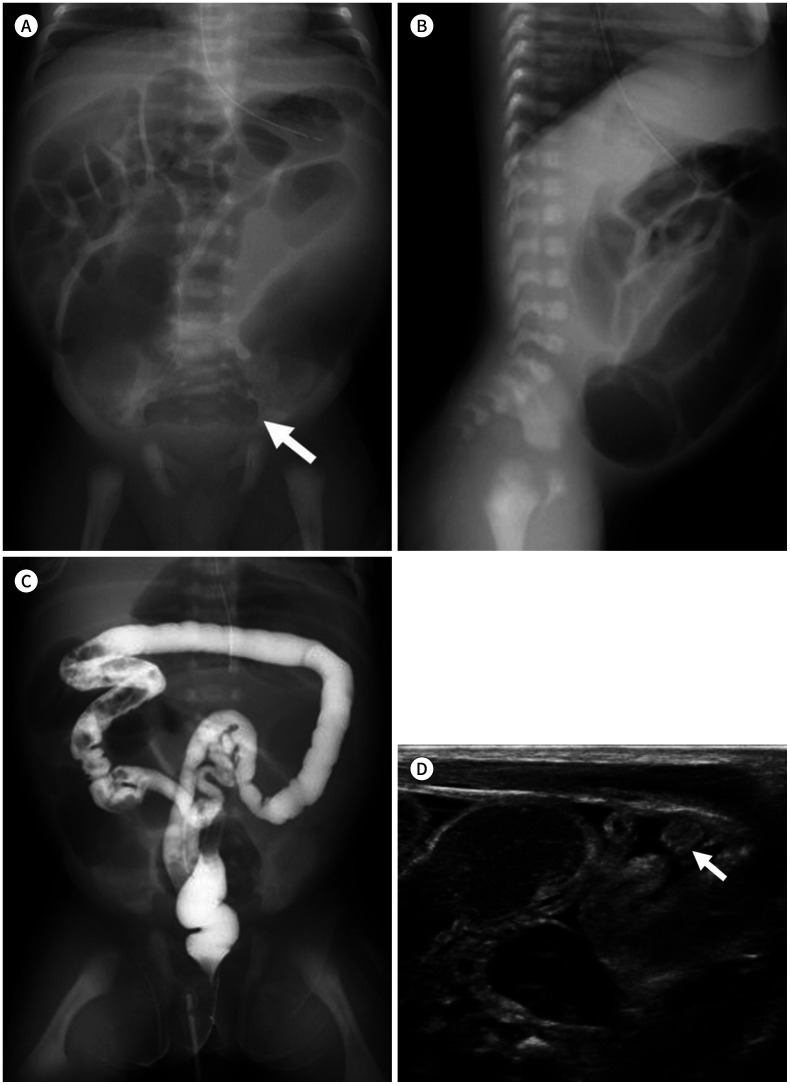
동반되는 기형은 50~70%가량이며 비뇨생식계 기형이 가장 많고 high type 경우 low type보다 두 배 이상으로 빈도가 높다(Fig. 17) (40). 또한 다양한 증후군의 일부로 발현되기도 하며 식도 폐쇄증과 같이 VACTERL 조합의 질환으로 알려져 있어 이 조합의 장기에 대한 검사가 같이 필요하다(6,9,10). 또한, Currarino syndrome은 항문직장 기형, 천골의 부분적 결손, 천골 전방의 종괴 [기형종, 수막류(meningocele), 장관 낭종(enteric cyst)] 등이 같이 보이는 경우를 일컫는다(Fig. 18) (41,42).
Fig. 17. A male neonate with multiple anomalies (VACTERL association) associated with a high-type anorectal malformation.
A. Sacral deformity (arrow) is noted with distended bowel loops due to distal obstruction.
B. A hypoechoic fistula (arrow) between the rectum (R) and the prostatic urethra (U) suggests a high-type anorectal malformation.
C. Coarctation of the aorta is noted with a large PDA (arrow).
D. Esophageal atresia is noted with kinking of the orogastric tube (arrow).
E. A single right kidney is noted on MRI.
F. Pre-axial polydactyly is noted (arrow).
PDA = patent ductus arteriosus, VACTERL = vertebral, anorectal, cardiac, tracheoesophageal, renal, alimentary and limb defects
Fig. 18. A male neonate with Currarino syndrome.
A. Sacral deformity (arrow) is noted with a distended sigmoid colon (dot arrow).
B. A solid and cystic presacral mass with intralesional fat suggests presacral teratoma (arrow).
C. Rectal stenosis (arrow) is also noted on colon study.
영상의학 검사의 역할은 막혀있는 직장의 끝부분의 위치를 확인하고 동반되는 루의 위치를 확인한다. 치골직장근(puborectalis muscle) 및 괄약근(sphincter muscle complex)의 발달 정도, 동반된 기형을 확인하여 이후 예후를 예측할 수 있다.
Invertogram은 과거 환아를 거꾸로 두고 시행하는 방사선 촬영이다. 이때 가스로 찬 직장의 끝부분과 anal dimple과의 거리로 아형을 예측할 수 있다. 좌골의 아래 1/3 부분으로 좌골과 평행으로 그려지는 M line이 치골직장근(puborectalis muscle)과 일치하는 것으로 제시되었으며 이러한 M line과 직장 끝의 위치를 비교하였으나 그 진단적 유용성은 낮아 최근에는 쓰이지 않는다(43).
항문직장 기형에서도 가장 쉽게 사용되는 영상의학적 검사는 초음파 검사로 미저골하부(infracoccygeal) 혹은 경회음(transperineal) 접근법으로 직장 끝부분의 위치와 저에코의 선으로 나타나는 루를 확인하여 아형을 분류하는 데에 유용하다(Fig. 16) (6,40,44). 경회음 초음파 검사에서 막힌 직장의 끝에서 회음부까지의 길이가 15 mm 이하이면 low type으로 생각되나 이 역시 기술적인 면에서 제한점이 있다(4,5). 이보다 루의 위치가 아형을 구분하는데 더 정확한 것으로 생각된다. 초음파에서는 동반 기형 중 신장 기형 등을 함께 확인할 수 있다.
MRI는 초음파, CT에 비해 항문직장기형에 연관된 해부학적 세부사항들을 확인할 수 있으며 특히 치골직장근(pubococcygeal muscle) 및 괄약근(sphincter muscle complex)의 발달 정도를 함께 확인할 수 있다(45).
Necrotizing Enterocolitis
미숙아에서 생후 1~2주, 위장관 영양(enteral nutrition)을 시작하는 시기에 생길 수 있는 질환으로 합병증과 사망률이 높다. 특히 주수와 체중이 낮은 환아들에서 더 흔하다(4,5,46).
환아의 미성숙함, 장관 벽의 손상, 이로 인한 허혈, 괴사 등 다양한 원인이 복합적으로 영향을 미치는 것으로 이해된다. 명확한 원인은 알려져 있지 않으나 장관의 미성숙함으로 인해 생기는 허혈이 생기게 되면 점막의 손상이 발생하고 손상 부위에 세균성 감염이 생기게 되며 패혈증의 상태로 진행될 수 있는 질환으로 이해되어 미숙아에서 생길 수 있는 장관계 질환 중 응급으로 생각된다(46,47). 다른 장관의 허혈을 유발하는 상황에서도 생길 수 있으며 저혈압을 동반하는 패혈증, 수술, 쇼크 등에서도 발생되며 선천성 심기형이 있는 환아에서도 보일 수 있다(4,5,46,47).
단순 복부 방사선 촬영은 미숙아에서 장관가스의 유무, 양, 패턴을 분석하는 데에 유용하다. 정상적인 장관가스에서 보이는 ‘mosaic pattern’이 사라지며 병변이 생긴 장관이 팽창하게 된다. 추적검사에서 팽창된 장관의 패턴이나 배열이 바뀌지 않는 ‘persistent fixed bowel loop sign’이 관찰된다(Fig. 19A, B) (6,46,47,48). 특히 팽창된 장관들이 나란히 배열되는 ‘palisading pattern’이 동반될 수 있다(Fig. 19A). 장관 벽 내의 공기증(pneumatosis intestinalis), 간문맥의 공기(portal vein gas)가 동반될 수 있다(Fig. 19 A–C) (6,46,47,48).
Fig. 19. Variable simple radiographic findings of necrotizing enterocolitis.
A. Palisading patterned bowel distention is noted with pneumatosis intestinalis, which shows a lucent lining along the bowel wall.
B. No significant interval changes of the bowel gas pattern since a previous study (A) suggests fixed bowel loops.
C. A hypo-lucent line along the portal vein suggests portal vein gas (arrow).
D. Development of a hypodense area above the liver is due to pneumoperitoneum. There is linear density above the hypodense area above the liver (arrow), which shows a shadow of the falciform ligament sandwiched between air. A relatively well delineable high density lining along the bowel wall in the left-sided abdomen suggests the double-wall sign (Rigler sign) (dot arrow).
E. A cross table lateral view is useful to detect mild pneumoperitoneum (arrow).
장천공이 발생하여 기복증(pneumoperitoneum)이 생기면 간 위로 저음영의 공기층이 확인되며 간과 앞 복벽을 연결하는 겸상인대(falciform ligament)가 선상음영으로 나타나는 특징적인 소견을 볼 수 있다(Fig. 19D, E) (47,49). 기복증은 수술 유무를 결정하는 중요한 소견으로 초기 소량의 공기층은 cross table lateral view를 이용하면 유용하다.
초음파 검사는 장벽 자체의 변화를 확인하는 데에 단순 촬영과 비교하여 유용하다. 장벽은 초기에는 두꺼워지며 혈류가 증가하나(Fig. 20A) 이후 장벽이 얇아지며 혈류와 연동운동이 감소되기도 한다(47,50). 장관 벽 내의 공기증(pneumatosis intestinalis)이 있는 경우 장관 벽 내에 이동하지 않는 산재된 고에코의 점들을 확인할 수 있으며 후방으로 지저분한 음영이 동반되기도 한다(Fig. 20B) (47,50,51). 연동 운동이나 환자의 자세, 호흡과 무관하게 움직이지 않는 것도 장관 벽내 공기증의 특징이다.
Fig. 20. Variable ultrasonographic findings of necrotizing enterocolitis.
A. Diffuse bowel wall thickening with hyperemia can be noted.
B. Pneumatosis intestinalis is noted with an echogenic air bubble (arrows) within the mural layer.
C. Portal vein gas shows a linear echogenic lining along the portal vein branch. If Color doppler study is performed at the portal vein tract, there are multiple artifacts resulting from the passing air bubble when portal vein gas is present.
D. Dirty ascites with debris (arrow) can be noted.
간문맥의 공기(portal vein gas) 역시 고에코의 점들이 가지치는 패턴을 보이며 간문맥을 따라 이동하는 양상이 보이고 간 가장자리의 비의존적 부분에 고이는 양상을 보인다(47,51). 이때 간문맥에서 색도플러 검사를 시행하면 간문맥 내에서 공기가 지나가면서 만들어지는 인공물을 확인할 수 있다(Fig. 20C). 기복증은 초음파가 진단적 도구로 사용되지 않으나 단순 복부 촬영에서 보이지 않는 소량의 복강 내 공기가 고에코의 선 형태로 간 표면에서 확인될 수 있고(47,51). 복수는 초음파에서 일차적인 확인이 가능하다(Fig. 20D) (47,51).
질환이 호전되면 팽창되었던 장관이 정상 ‘mosaic pattern’을 다시 보이게 된다(47). 그러나 장관 벽 내의 공기증, 간문맥의 공기는 일시적으로 보이는 소견으로 존재 유무가 질병의 위중도와 연관되지 않으며 소견이 곧 임상적인 호전을 의미하지는 않는 것으로 알려져 있다.
결론
본 종설에서는 신생아기 위장관 질환에 사용될 수 있는 영상의학 검사에 대해 설명하고, 각각의 신생아 위장관 응급 질환에서 보일 수 있는 영상의학적 소견을 초기 복부 방사선 촬영 및 복부초음파, 투시 검사에 초점을 맞추어 기술하였다. 신생아 위장관 응급 질환은 영상 검사에서 비교적 특징적인 소견을 보이나 익숙하지 않은 경우 질환의 진단에 어려움이 있을 수 있다. 이에 상기 기술된 소견들에 대한 정리를 통하여 이러한 질환군에 익숙해지고 이를 바탕으로 적절한 진단을 내리고 추가적인 영상 검사를 시행할 수 있도록 하는 것이 중요할 것으로 생각된다.
Footnotes
- Conceptualization, C.H.
- data curation, Y.S.K., L.S.M.
- project administration, C.H.
- resources, L.S.M.
- supervision, C.H.
- visualization, Y.S.K.
- writing—original draft, C.H.
Conflicts of Interest: The authors have no potential conflicts of interest to disclose.
References
- 1.Vinocur DN, Lee EY, Eisenberg RL. Neonatal intestinal obstruction. AJR Am J Roentgenol. 2012;198:W1–W10. doi: 10.2214/AJR.11.6931. [DOI] [PubMed] [Google Scholar]
- 2.Hernanz-Schulman M. Imaging of neonatal gastrointestinal obstruction. Radiol Clin North Am. 1999;37:1163–1186. doi: 10.1016/s0033-8389(05)70255-4. vi-vii. [DOI] [PubMed] [Google Scholar]
- 3.McAlister WH, Kronemer KA. Emergency gastrointestinal radiology of the newborn. Radiol Clin North Am. 1996;34:819–844. [PubMed] [Google Scholar]
- 4.Rao P. Neonatal gastrointestinal imaging. Eur J Radiol. 2006;60:171–186. doi: 10.1016/j.ejrad.2006.07.021. [DOI] [PubMed] [Google Scholar]
- 5.Cumming WA, Williams JL. Neonatal gastrointestinal imaging. Clin Perinatol. 1996;23:387–407. [PubMed] [Google Scholar]
- 6.Stanescu AL, Liszewski MC, Lee EY, Phillips GS. Neonatal gastrointestinal emergencies: step-by-step approach. Radiol Clin North Am. 2017;55:717–739. doi: 10.1016/j.rcl.2017.02.010. [DOI] [PubMed] [Google Scholar]
- 7.Anupindi SA, Halverson M, Khwaja A, Jeckovic M, Wang X, Bellah RD. Common and uncommon applications of bowel ultrasound with pathologic correlation in children. AJR Am J Roentgenol. 2014;202:946–959. doi: 10.2214/AJR.13.11661. [DOI] [PubMed] [Google Scholar]
- 8.Hiorns MP. Gastrointestinal tract imaging in children: current techniques. Pediatr Radiol. 2011;41:42–54. doi: 10.1007/s00247-010-1743-2. [DOI] [PubMed] [Google Scholar]
- 9.Solomon BD. The etiology of VACTERL association: current knowledge and hypotheses. Am J Med Genet C Semin Med Genet. 2018;178:440–446. doi: 10.1002/ajmg.c.31664. [DOI] [PubMed] [Google Scholar]
- 10.Van de Putte R, Van Rooij IALM, Marcelis CLM, Guo M, Brunner HG, Addor MC, et al. Spectrum of congenital anomalies among VACTERL cases: a EUROCAT population-based study. Pediatr Res. 2020;87:541–549. doi: 10.1038/s41390-019-0561-y. [DOI] [PubMed] [Google Scholar]
- 11.Wu Y, Wu C. Congenital esophageal atresia associated with a tracheobronchial remnant. Korean J Thorac Cardiovasc Surg. 2019;52:170–173. doi: 10.5090/kjtcs.2019.52.3.170. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Yoo HJ, Kim WS, Cheon JE, Yoo SY, Park KW, Jung SE, et al. Congenital esophageal stenosis associated with esophageal atresia/tracheoesophageal fistula: clinical and radiologic features. Pediatr Radiol. 2010;40:1353–1359. doi: 10.1007/s00247-010-1603-0. [DOI] [PubMed] [Google Scholar]
- 13.Newman B, Bender TM. Esophageal atresia/tracheoesophageal fistula and associated congenital esophageal stenosis. Pediatr Radiol. 1997;27:530–534. doi: 10.1007/s002470050174. [DOI] [PubMed] [Google Scholar]
- 14.Strouse PJ. Disorders of intestinal rotation and fixation (“malrotation”) Pediatr Radiol. 2004;34:837–851. doi: 10.1007/s00247-004-1279-4. [DOI] [PubMed] [Google Scholar]
- 15.Maxfield CM, Bartz BH, Shaffer JL. A pattern-based approach to bowel obstruction in the newborn. Pediatr Radiol. 2013;43:318–329. doi: 10.1007/s00247-012-2573-1. [DOI] [PubMed] [Google Scholar]
- 16.Weinberger E, Winters WD, Liddell RM, Rosenbaum DM, Krauter D. Sonographic diagnosis of intestinal malrotation in infants: importance of the relative positions of the superior mesenteric vein and artery. AJR Am J Roentgenol. 1992;159:825–828. doi: 10.2214/ajr.159.4.1529850. [DOI] [PubMed] [Google Scholar]
- 17.Karmazyn B. Duodenum between the aorta and the SMA does not exclude malrotation. Pediatr Radiol. 2013;43:121–122. doi: 10.1007/s00247-012-2537-5. [DOI] [PubMed] [Google Scholar]
- 18.Hameed S, Caro-Domínguez P, Daneman A, Zani-Ruttenstock E, Zani A, Navarro OM. The role of sonography in differentiating congenital intrinsic duodenal anomalies from midgut malrotation: emphasizing the new signs of duodenal and gastric wall thickening and hyperechogenicity. Pediatr Radiol. 2020;50:673–683. doi: 10.1007/s00247-020-04616-1. [DOI] [PubMed] [Google Scholar]
- 19.Pracros JP, Sann L, Genin G, Tran-Minh VA, Morin de Finfe CH, Foray P, et al. Ultrasound diagnosis of midgut volvulus: the “whirlpool” sign. Pediatr Radiol. 1992;22:18–20. doi: 10.1007/BF02011603. [DOI] [PubMed] [Google Scholar]
- 20.Cooper J, So H, Cohen HL. Ultrasound diagnosis of midgut volvulus. J Ultrasound Med. 1992;11:178. doi: 10.7863/jum.1992.11.4.178. [DOI] [PubMed] [Google Scholar]
- 21.Chao HC, Kong MS, Chen JY, Lin SJ, Lin JN. Sonographic features related to volvulus in neonatal intestinal malrotation. J Ultrasound Med. 2000;19:371–376. doi: 10.7863/jum.2000.19.6.371. [DOI] [PubMed] [Google Scholar]
- 22.Sizemore AW, Rabbani KZ, Ladd A, Applegate KE. Diagnostic performance of the upper gastrointestinal series in the evaluation of children with clinically suspected malrotation. Pediatr Radiol. 2008;38:518–528. doi: 10.1007/s00247-008-0762-8. [DOI] [PubMed] [Google Scholar]
- 23.Applegate KE, Anderson JM, Klatte EC. Intestinal malrotation in children: a problem-solving approach to the upper gastrointestinal series. Radiographics. 2006;26:1485–1500. doi: 10.1148/rg.265055167. [DOI] [PubMed] [Google Scholar]
- 24.Choi KS, Choi YH, Cheon JE, Kim WS, Kim IO. Intestinal malrotation in patients with situs anomaly: implication of the relative positions of the superior mesenteric artery and vein. Eur J Radiol. 2016;85:1695–1700. doi: 10.1016/j.ejrad.2016.07.013. [DOI] [PubMed] [Google Scholar]
- 25.Long FR, Kramer SS, Markowitz RI, Taylor GE, Liacouras CA. Intestinal malrotation in children: tutorial on radiographic diagnosis in difficult cases. Radiology. 1996;198:775–780. doi: 10.1148/radiology.198.3.8628870. [DOI] [PubMed] [Google Scholar]
- 26.Newman B, Koppolu R, Murphy D, Sylvester K. Heterotaxy syndromes and abnormal bowel rotation. Pediatr Radiol. 2014;44:542–551. doi: 10.1007/s00247-013-2861-4. [DOI] [PubMed] [Google Scholar]
- 27.Yoon CH, Goo HW, Kim EA, Kim KS, Pi SY. Sonographic windsock sign of a duodenal web. Pediatr Radiol. 2001;31:856–857. doi: 10.1007/s002470100005. [DOI] [PubMed] [Google Scholar]
- 28.Dalla Vecchia LK, Grosfeld JL, West KW, Rescorla FJ, Scherer LR, Engum SA. Intestinal atresia and stenosis: a 25-year experience with 277 cases. Arch Surg. 1998;133:490–496. doi: 10.1001/archsurg.133.5.490. discussion 496-497. [DOI] [PubMed] [Google Scholar]
- 29.Govaert P, Van Hecke R, Vanhaesebrouck P, Verpaele A, Derom F, Defoort P. Meconiumperitonitis: diagnose, etiologie en behandeling. Tijdschr Kindergeneeskd. 1991;59:98–105. [PubMed] [Google Scholar]
- 30.Salman AB, Karaoğlanoğ N, Suma S. Abdominal, scrotal, and thoracic calcifications owing to healed meconium peritonitis. J Pediatr Surg. 1999;34:1415–1416. doi: 10.1016/s0022-3468(99)90024-6. [DOI] [PubMed] [Google Scholar]
- 31.Chan KW, Lee KH, Wong HY, Tsui SY, Wong YS, Pang KY, et al. Cystic meconium peritonitis with jejunoileal atresia: is it associated with unfavorable outcome? World J Clin Pediatr. 2017;6:40–44. doi: 10.5409/wjcp.v6.i1.40. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Lee GS, Chandran S, Rajadurai VS. Calcified meconium pseudocyst: X-ray diagnosis of meconium peritonitis at birth. BMJ Case Rep. 2015;2015:bcr2015211052. doi: 10.1136/bcr-2015-211052. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Puri B. Meconium peritonitis presenting as a pseudocyst. Med J Armed Forces India. 1996;52:207. doi: 10.1016/S0377-1237(17)30808-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Wu CC. Sonographic findings of generalized meconium peritonitis presenting as neonatal ascites. J Clin Ultrasound. 1988;16:48–51. doi: 10.1002/jcu.1870160110. [DOI] [PubMed] [Google Scholar]
- 35.Cho HH, Cheon JE, Choi YH, Lee SM, Kim WS, Kim IO, et al. Ultrasound-guided contrast enema for meconium obstruction in very low birth weight infants: factors that affect treatment success. Eur J Radiol. 2015;84:2024–2031. doi: 10.1016/j.ejrad.2015.06.006. [DOI] [PubMed] [Google Scholar]
- 36.Nakaoka T, Nishimoto S, Tsukazaki Y, Santo K, Higashio A, Kamiyama M, et al. Ultrasound-guided hydrostatic enema for meconium obstruction in extremely low birth weight infants: a preliminary report. Pediatr Surg Int. 2017;33:1019–1022. doi: 10.1007/s00383-017-4129-9. [DOI] [PubMed] [Google Scholar]
- 37.Siddiqui MM, Drewett M, Burge DM. Meconium obstruction of prematurity. Arch Dis Child Fetal Neonatal Ed. 2012;97:F147–F150. doi: 10.1136/adc.2010.190157. [DOI] [PubMed] [Google Scholar]
- 38.Sathe M, Houwen R. Is meconium ileus associated with worse outcomes in cystic fibrosis. J Cyst Fibros. 2019;18:746. doi: 10.1016/j.jcf.2019.10.003. [DOI] [PubMed] [Google Scholar]
- 39.Wood KE. Meconium ileus in a neonate with cystic fibrosis. N Engl J Med. 2018;378:1142. doi: 10.1056/NEJMicm1700400. [DOI] [PubMed] [Google Scholar]
- 40.Alamo L, Meyrat BJ, Meuwly JY, Meuli RA, Gudinchet F. Anorectal malformations: finding the pathway out of the labyrinth. Radiographics. 2013;33:491–512. doi: 10.1148/rg.332125046. [DOI] [PubMed] [Google Scholar]
- 41.AbouZeid AA, Mohammad SA, Seada M, Khiamy K, Gamal R. Currarino triad: importance of preoperative magnetic resonance imaging. European J Pediatr Surg Rep. 2019;7:e86–e89. doi: 10.1055/s-0039-3399533. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Lee SC, Chun YS, Jung SE, Park KW, Kim WK. Currarino triad: anorectal malformation, sacral bony abnormality, and presacral mass--a review of 11 cases. J Pediatr Surg. 1997;32:58–61. doi: 10.1016/s0022-3468(97)90094-4. [DOI] [PubMed] [Google Scholar]
- 43.Niedzielski JK. Invertography versus ultrasonography and distal colostography for the determination of bowel-skin distance in children with anorectal malformations. Eur J Pediatr Surg. 2005;15:262–267. doi: 10.1055/s-2005-865765. [DOI] [PubMed] [Google Scholar]
- 44.Han TI, Kim IO, Kim WS. Imperforate anus: US determination of the type with infracoccygeal approach. Radiology. 2003;228:226–229. doi: 10.1148/radiol.2281011900. [DOI] [PubMed] [Google Scholar]
- 45.Thomeer MG, Devos A, Lequin M, De Graaf N, Meeussen CJ, Meradji M, et al. High resolution MRI for preoperative work-up of neonates with an anorectal malformation: a direct comparison with distal pressure colostography/ fistulography. Eur Radiol. 2015;25:3472–3479. doi: 10.1007/s00330-015-3786-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Neu J, Walker WA. Necrotizing enterocolitis. N Engl J Med. 2011;364:255–264. doi: 10.1056/NEJMra1005408. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Epelman M, Daneman A, Navarro OM, Morag I, Moore AM, Kim JH, et al. Necrotizing enterocolitis: review of state-of-the-art imaging findings with pathologic correlation. Radiographics. 2007;27:285–305. doi: 10.1148/rg.272055098. [DOI] [PubMed] [Google Scholar]
- 48.Wexler HA. The persistent loop sign in neonatal necrotizing enterocolitis: a new indication for surgical intervention? Radiology. 1978;126:201–204. doi: 10.1148/126.1.201. [DOI] [PubMed] [Google Scholar]
- 49.Coursey CA, Hollingsworth CL, Wriston C, Beam C, Rice H, Bisset G., 3rd Radiographic predictors of disease severity in neonates and infants with necrotizing enterocolitis. AJR Am J Roentgenol. 2009;193:1408–1413. doi: 10.2214/AJR.08.2306. [DOI] [PubMed] [Google Scholar]
- 50.Silva CT, Daneman A, Navarro OM, Moore AM, Moineddin R, Gerstle JT, et al. Correlation of sonographic findings and outcome in necrotizing enterocolitis. Pediatr Radiol. 2007;37:274–282. doi: 10.1007/s00247-006-0393-x. [DOI] [PubMed] [Google Scholar]
- 51.Gale HI, Gee MS, Westra SJ, Nimkin K. Abdominal ultrasonography of the pediatric gastrointestinal tract. World J Radiol. 2016;8:656–667. doi: 10.4329/wjr.v8.i7.656. [DOI] [PMC free article] [PubMed] [Google Scholar]