Abstract
Hintergrund
Tabakkonsum ist die häufigste vermeidbare Ursache für Krebserkrankungen und Krebstodesfälle. Tabakkonsum steht nicht nur im Zusammenhang mit Lungenkrebs, sondern hat Einfluss auf die Krebsentstehung in fast allen Organsystemen.
Ziel der Arbeit
Das Ziel dieses Übersichtsartikels ist es, auf die verschiedenen beteiligten Organsysteme in der tabakassoziierten Krebsentstehung näher einzugehen.
Material und Methoden
Zunächst erfolgt eine kurze Einführung in die Thematik, gefolgt von einer ausführlichen Beschreibung der verschiedenen Tumorentitäten, die mit dem Tabakkonsum assoziiert sind.
Ergebnisse
Der Tabakkonsum wird mit der Verursachung vieler Krebsarten in Verbindung gebracht. Nach aktuellen Erkenntnissen kann Tabakkonsum Mund‑, Pharynx‑, Larynx‑, Ösophagus‑, Magen‑, Nieren‑, Pankreas‑, Leber‑, Blasen‑, Zervix‑, Kolon- und Rektumkarzinome sowie die akute myeloische Leukämie verursachen.
Diskussion
Tabakkonsum ist nicht nur Hauptursache für die Entstehung von Lungenkrebs, sondern hat auch einen großen Einfluss auf die Entstehung bösartiger Erkrankungen in anderen Organsystemen. Daher muss bei der Bildauswertung von Rauchern ein besonderes Augenmerk auf andere maligne Begleiterkrankungen gelegt werden.
Schlüsselwörter: Tabak, Rauchen, Neoplasien, Karzinogenese, Nikotin
Abstract
Background
Tobacco use is the leading preventable cause of cancer and cancer deaths. Tobacco use is not only related to lung cancer, but has an impact on a wide range of different cancer entities in almost every organ system.
Objectives
The aim of this review article is to shed light on the different organ systems involved in tobacco-associated carcinogenesis.
Materials and methods
For this purpose, first a brief introduction into the topic is given, followed by a detailed description of the different tumor entities associated with tobacco use.
Results
Tobacco consumption has been clearly implicated in the causation of many types of cancer, affecting multiple organ systems. Based on current evidence, tobacco use can cause cancer of the mouth and throat, larynx, esophagus, stomach, kidney, pancreas, liver, bladder, cervix, colon and rectum, and acute myeloid leukemia.
Conclusion
Tobacco use is not only main cause in the development of lung cancer, but has a major impact in the development of cancer in other organ systems. Therefore, special attention must be given to possible concomitant malignancies when evaluating images of smokers.
Keywords: Tobacco, Smoking, Neoplasms, Carcinogenesis, Nicotine
Der Tabakkonsum ist ein etablierter Risikofaktor für die Karzinogenese in fast allen Organsystemen [18]. Tabak verursacht Neoplasien der Lunge, des Larynx und Pharynx, der Mundhöhle, des Ösophagus und des Magens, des Urogenitaltrakts, der Leber und des Pankreas sowie des Dickdarms und des hämatologischen Systems [21]. Je nach Lokalisation und Geschlecht sind 8–82 % dieser Neoplasien auf das Rauchen zurückzuführen [22]. Das Ziel dieses Übersichtsartikels ist es, die verschiedenen beteiligten Organsysteme in der tabakassoziierten Krebsentstehung aufzuzeigen.
Mund, Nasennebenhöhlen, Pharynx und Larynx
Diese Organgruppe ist neben der Lunge das am häufigsten betroffene System der tabakassoziierten Karzinogenese [15]. Anfang der 1990er Jahre des vorigen Jahrhunderts analysierte eine Studie 454 Patienten mit Mundhöhlenkarzinom und stellte fest, dass 60 % der Patienten mit Mundhöhlenkarzinom rauchten [17]. Über 95 % der Neubildungen waren Plattenepithelkarzinome (Abb. 1; [17]).
Folgestudien zeigten, dass Tabak oxidativen Stress auf das Gewebe auslöst, eine epigenetische Veränderung oraler Epithelzellen verursachen sowie mehrere systemische Immunfunktionen hemmen kann und so die Entstehung von Neoplasien begünstigt [12, 15].
Primäre Zigarren- und Pfeifenraucher haben ein etwas geringeres Risiko für Lungenkrebs als Zigarettenraucher, aber ihr Risiko für Larynx‑, Pharynx‑, Mundhöhlen- und Ösophagusneoplasien ist ähnlich, wenn nicht sogar größer als das von Zigarettenrauchern [1]. Orale Tabakprodukte, wie z. B. Schnupftabak oder Kautabak, haben eine Assoziation mit Neubildungen der Wangenschleimhaut, des Zahnfleischs und der inneren Oberfläche der Lippen [1]. Zudem kann die Kombination von Tabakkonsum mit Alkohol das Krebsrisiko vervielfachen [19].
Ösophagus und Magen
Tabakrauchen erhöht das Risiko für ein Plattenepithelkarzinom des Ösophagus stark und das Risiko für ein Adenokarzinom des Ösophagus moderat [25]. Die Raucherentwöhnung verringert zeitabhängig das Risiko für ein Plattenepithelkarzinom des Ösophagus, während es einen begrenzten Einfluss auf das Risiko eines Adenokarzinoms des Ösophagus hat [25].
Auf ähnliche Weise ist das Rauchen mit der Entstehung von Magenkrebs vergesellschaftet, wobei Fundus und Kardia bzw. proximale, nahe dem Ösophagus gelegene Magenanteile häufiger betroffen sind als weiter distal gelegene [20]. Auch bei Ösophagus- und Magenkarzinomen stellt der Genuss von Alkohol ein additives Krebsentstehungsrisiko dar [19].
Pankreas und Leber
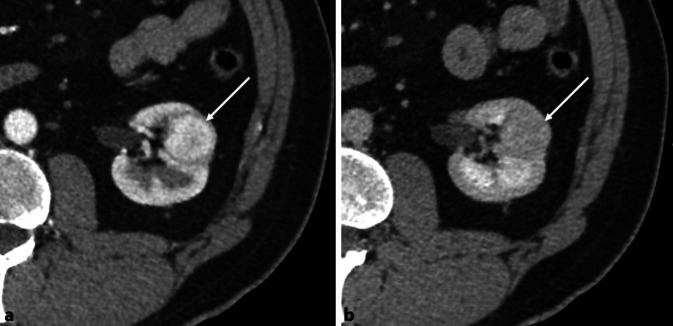
Pankreas
Rauchen ist einer der wichtigsten Risikofaktoren für die Entstehung des Pankreaskarzinoms (Abb. 2): Das Risiko, an einem Pankreaskarzinom zu erkranken, ist bei Rauchern etwa doppelt so hoch wie bei Personen, die nie geraucht haben. Es wird angenommen, dass etwa 25 % der Pankreaskarzinome durch Zigarettenrauchen verursacht werden. Auch das Rauchen von Zigarren und die Verwendung von rauchlosen Tabakprodukten erhöhen das Risiko. Das Risiko für die Entstehung eines Pankreaskarzinom sinkt jedoch, sobald eine Person mit dem Rauchen aufhört [11].
Leber
Rauchen führt zur Entstehung von Stoffen mit kanzerogenem Potenzial, die das Risiko eines hepatozellulären Karzinoms (HCC) erhöhen. Zudem hat das Rauchen einen additiven kanzerogenen Effekt bei Patienten mit Virushepatitis [4]. Tabakrauchen wird mit der Unterdrückung von Tumorsuppressorgenen, wie beispielsweise p53, sowie der T‑Zell-Antwort in Verbindung gebracht [4]. Zudem erhöht das Rauchen den Eisengehalt der Leber und favorisiert somit die Entwicklung einer Leberfibrose und damit das Risiko der Entstehung eines HCC [5].
Nieren und Blase
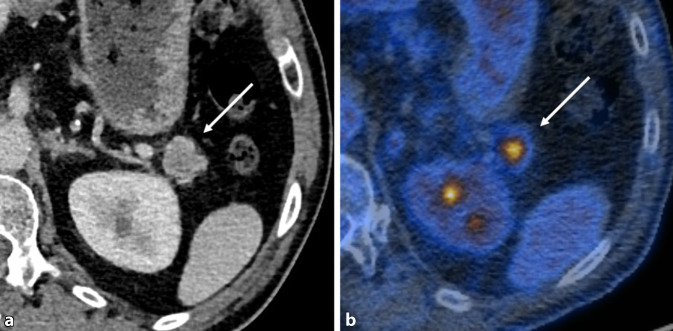
Mehreren Studien deuten bei Rauchern auf ein deutlich erhöhtes Risiko für die Entstehung von Neoplasien des Urogenitaltrakts hin (Abb. 3; [28]). Zigarettenraucher haben ein etwa dreifach höheres Risiko für Harnwegskrebs als Nichtraucher [28]: In Europa kann etwa die Hälfte der Fälle von Harnwegskrebs bei Männern und ein Drittel der Fälle bei Frauen dem Rauchen zugeschrieben werden [28].
Blase
Der am besten untersuchte Zusammenhang von Tabakrauchen und der Krebsentstehung im Urogenitalsystem ist jener der Harnblase und geht bis auf die 50er Jahre des 20. Jahrhunderts zurück: Diesen Untersuchungen zufolge ist das Rauchen sowohl bei Männern als auch bei Frauen der am besten etablierte Risikofaktor für die Entstehung von Blasenkrebs [10]. Das Risiko von Rauchern, an Blasenkrebs zu erkranken, erhöhte sich gemäß dieser Studien um den Faktor 3 im Vergleich zu Nichtrauchern [10]. Die Zusammensetzung von Zigaretten hat sich jedoch in den letzten 50 Jahren verändert, die Verringerung der Teer- und Nikotinkonzentrationen [26] gingen mit einem Anstieg der Konzentration spezifischer Karzinogene, darunter β‑Naphthylamin, ein bekanntes Blasenkarzinogen, und tabakspezifische Nitrosamine, einher [9]. Mit diesen Veränderungen in den Bestandteilen des Zigarettenrauchs haben epidemiologische Studien ein höheres rauchassoziiertes relatives Risiko für Lungenkrebs beobachtet [9]. Ein kürzlich erschienener Bericht der New England Bladder Study, einer großen bevölkerungsbasierten Fall-Kontroll-Studie, deutet darauf hin, dass die Assoziation zwischen Zigarettenrauchen und Blasenkrebs möglicherweise ebenfalls zugenommen hat [2, 7].
Niere
Auch die Niere bleibt von den Auswirkungen des Tabakkonsums nicht verschont: In einer Studie von Yuan et al. [27] in welcher 1024 Patienten mit Nierenzellkarzinom (RCC) eingeschlossen wurden, hatten Raucher, die 40 oder mehr Zigaretten/Tag rauchten, im Vergleich zu lebenslangen Nichtrauchern ein fast zweifach erhöhtes RCC-Risiko [27]. Es gab hingegen keine messbaren Unterschiede im RCC-Risiko zwischen Rauchern von gefilterten und nicht gefilterten Zigaretten oder zwischen denen, die Zigarettenrauch tief und leicht inhalierten [27]. Starke Zigarrenraucher (14 oder mehr Zigarren/Woche) zeigten mit 70 % eine statistisch signifikante Erhöhung des Risikos, an einem RCC zu erkranken. Beim Konsum von Pfeifen oder rauchlosem Tabak wurde hingegen kein erhöhtes RCC-Risiko beobachtet [27]. Im Vergleich zu aktiven Rauchern erfuhren diejenigen, die vor 10 oder mehr Jahren mit dem Rauchen aufgehört hatten, eine statistisch signifikante Reduzierung des RCC-Risikos um 30 % [27].
Ovarien und Zervix
Ovar
Bei Frauen in der westlichen Welt ist das Ovarialkarzinom die sechsthäufigste diagnostizierte Krebsart und die sechsthäufigste Krebstodesursache [13]. Das Ovarialkarzinom ist der tödlichste gynäkologische Tumor mit einer 5‑Jahres-Gesamtüberlebensrate von 30–40 % [13]. Eine wachsende Zahl von Studien zeigt das Zigarettenrauchen als potenziellen Risikofaktor für die Entstehung des Ovarialkazinoms [14]. Die stärkste Assoziation scheint mit muzinösen Ovarialtumoren zu bestehen, während die Assoziation mit anderen histologischen Typen weniger gesichert ist [14].
Zervix
Frauen, die rauchen, haben ein etwa doppelt so hohes Risiko, am Zervixkarzinom zu erkranken, wie diejenigen, die nicht rauchen [6]. Mehrere Faktoren scheinen Einfluss auf die zervikale Karzinogenese zu haben, insbesondere durch direkte lokale karzinogene Wirkung und lokale Immunsuppression [6]: Tabaknebenprodukte wurden im Zervixschleim von Raucherinnen gefunden. Forscher glauben, dass diese Substanzen die DNA von Gebärmutterhalszellen schädigen und zur Entstehung von Gebärmutterhalskrebs beitragen können [6]. Zudem vervielfacht das Rauchen das kanzerogene Risiko bei einer Infektion mit dem humanen Papillomvirus (HPV; Abb. 4).
Kolon und Rektum
Dickdarmkrebs (kolorektales Karzinom, CRC) ist weltweit die dritthäufigste Krebsart und die zweithäufigste krebsbedingte Todesursache [3]. Wie bei anderen multifaktoriellen Erkrankungen ist die Entwicklung von CRC das Ergebnis eines komplexen Zusammenspiels zwischen Lebensstil und genetischen Faktoren [8]. Das Rauchen von Zigaretten wird mit der Entstehung von adenomatösen Polypen in Verbindung gebracht [24]. Eine bevölkerungsbezogene Fall-Kontroll-Studie zu Dickdarmkrebs beobachtete sowohl bei Männern als auch bei Frauen eine etwa 50 %ige Erhöhung des CRC-Risikos durch das Rauchen von mehr als einer Packung Zigaretten pro Tag. Diejenigen, die mit dem Rauchen aufgehört hatten, blieben einem erhöhten Risiko ausgesetzt, selbst wenn sie vor über 10 Jahren damit aufgehört haben [24]. Die Ergebnisse dieser Studie deuten darauf hin, dass die gerauchte Menge an Zigaretten ein wichtigerer Faktor sein könnte als die Gesamtzahl der gerauchten Jahre. Interessanterweise war weder das Rauchen von Zigarren noch von Pfeifen mit einem erhöhten Darmkrebsrisiko verbunden [24].
Akute myeloische Leukämie
Die akute myeloische Leukämie (AML) ist eine bösartige hämatologische Erkrankung, gekennzeichnet durch eine blockierte Differenzierung, maligne Proliferation und Apoptose normaler hämatopoetischer Zellen [16]. AML hat multifaktorielle Risikofaktoren, wie Umweltfaktoren, genetische Faktoren, Alter und Ethnie. Zudem zeigten Shi et al. [23] in einer Metaanalyse von 20 Fall-Kontroll-Studien, mit insgesamt 7538 AML-Patienten und 137.924 gesunden Kontrollpersonen, dass die Assoziation zwischen Zigarettenrauchen und der Entstehung einer AML insbesondere in der kaukasischen Bevölkerung erhöht ist. Ferner wurde gezeigt, dass Rauchen während der Schwangerschaft das Risiko der Entstehung einer AML im Kindesalter erhöht [23].
Fazit für die Praxis
Tabakkonsum ist nicht nur Hauptursache für die Entstehung von Lungenkrebs, sondern hat auch einen großen Einfluss auf die Entstehung bösartiger Erkrankungen in anderen Organsystemen.
Als Radiologen sollten wir die Prädilektionsstellen der tabakassoziierten Karzinogenese kennen und bei Personen dieser Risikogruppe ein besonderes Augenmerk auf diese Organsysteme legen, um etwaige Zufallsbefunde nicht zu übersehen.
Das Erkennen des Tabakkonsums als Risikofaktor für die Entstehung verschiedener Tumorentitäten kann einen positiven Einfluss auf die Prävention von solchen Erkrankungen und damit auch auf die öffentliche Gesundheit haben.
Funding
Open access funding provided by University of Zurich
Einhaltung ethischer Richtlinien
Interessenkonflikt
K. Martini gibt an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.American Cancer Society (2014) Tobacco related cancer fact sheet. http://www.cancer.org/cancer/cancercauses/tobaccocancer/tobacco-related-cancer-fact-sheet. Zugegriffen: 3. Februar 2022
- 2.Baris D, Karagas MR, Verrill C, et al. A case-control study of smoking and bladder cancer risk: emergent patterns over time. J Natl Cancer Inst. 2009;101:1553–1561. doi: 10.1093/jnci/djp361. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394–424. doi: 10.3322/caac.21492. [DOI] [PubMed] [Google Scholar]
- 4.El-Zayadi A-R. Heavy smoking and liver. World J Gastroenterol. 2006;12:6098–6101. doi: 10.3748/wjg.v12.i38.6098. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.El-Zayadi A-R, Selim O, Hamdy H, et al. Heavy cigarette smoking induces hypoxic polycythemia (erythrocytosis) and hyperuricemia in chronic hepatitis C patients with reversal of clinical symptoms and laboratory parameters with therapeutic phlebotomy. Am J Gastroenterol. 2002;97:1264–1265. doi: 10.1111/j.1572-0241.2002.05718.x. [DOI] [PubMed] [Google Scholar]
- 6.Fonseca-Moutinho JA. Smoking and cervical cancer. ISRN Obstet Gynecol. 2011;2011:847684. doi: 10.5402/2011/847684. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Freedman ND, Silverman DT, Hollenbeck AR, et al. Association between smoking and risk of bladder cancer among men and women. J Am Med Assoc. 2011;306:737–745. doi: 10.1001/jama.2011.1142. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Heavey PM, McKenna D, Rowland IR. Colorectal cancer and the relationship between genes and the environment. Nutr Cancer. 2004;48:124–141. doi: 10.1207/s15327914nc4802_2. [DOI] [PubMed] [Google Scholar]
- 9.Hoffmann D, Hoffmann I, El-Bayoumy K. The less harmful cigarette: a controversial issue. a tribute to Ernst L. Wynder. Chem Res Toxicol. 2001;14:767–790. doi: 10.1021/tx000260u. [DOI] [PubMed] [Google Scholar]
- 10.Humans IWG on the E of CR to . Tobacco smoke and involuntary smoking. International Agency for Research on Cancer; 2004. [Google Scholar]
- 11.Ilic M, Ilic I. Epidemiology of pancreatic cancer. World J Gastroenterol. 2016;22:9694–9705. doi: 10.3748/wjg.v22.i44.9694. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Jaber MA, Porter SR, Gilthorpe MS, et al. Risk factors for oral epithelial dysplasia—the role of smoking and alcohol. Oral Oncol. 1999;35:151–156. doi: 10.1016/S1368-8375(98)00106-7. [DOI] [PubMed] [Google Scholar]
- 13.Jemal A, Bray F, Center MM, et al. Global cancer statistics. CA Cancer J Clin. 2011;61:69–90. doi: 10.3322/caac.20107. [DOI] [PubMed] [Google Scholar]
- 14.Jordan SJ, Whiteman DC, Purdie DM, et al. Does smoking increase risk of ovarian cancer? A systematic review. Gynecol Oncol. 2006;103:1122–1129. doi: 10.1016/j.ygyno.2006.08.012. [DOI] [PubMed] [Google Scholar]
- 15.Jiang X, Wu J, Wang J, Huang R. Tobacco and oral squamous cell carcinoma: A review of carcinogenic pathways. Tob Induc Dis. 2019;17:29. doi: 10.18332/tid/105844. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Liu K, Zhou F, Fu Z, et al. Coexistence of T-cell lymphoblastic lymphoma and acute myeloid leukemia mimicking acute lymphocytic leukemia. Indian J Pathol Microbiol. 2018;61:464–467. doi: 10.4103/IJPM.IJPM_6_18. [DOI] [PubMed] [Google Scholar]
- 17.Llewelyn J, Mitchell R. Smoking, alcohol and oral cancer in south east Scotland: a 10-year experience. Br J Oral Maxillofac Surg. 1994;32:146–152. doi: 10.1016/0266-4356(94)90098-1. [DOI] [PubMed] [Google Scholar]
- 18.National Center for Chronic Disease Prevention and Health Promotion (US) Office on Smoking and Health . The health consequences of smoking—50 years of progress: a report of the surgeon general. Atlanta: Centers for Disease Control and Prevention; 2014. [PubMed] [Google Scholar]
- 19.Pöschl G, Seitz HK. Alcohol and cancer. Alcohol Alcohol. 2004;39:155–165. doi: 10.1093/alcalc/agh057. [DOI] [PubMed] [Google Scholar]
- 20.Praud D, Rota M, Pelucchi C, et al. Cigarette smoking and gastric cancer in the Stomach Cancer Pooling (StoP) Project. Eur J Cancer Prev. 2018;27:124–133. doi: 10.1097/CEJ.0000000000000290. [DOI] [PubMed] [Google Scholar]
- 21.Sasco AJ, Secretan MB, Straif K. Tobacco smoking and cancer: a brief review of recent epidemiological evidence. Cancer Treat Res. 2004;45(Suppl 2):S3–S9. doi: 10.1016/j.lungcan.2004.07.998. [DOI] [PubMed] [Google Scholar]
- 22.Scherübl H. Tabakrauchen und Krebsrisiko. Dtsch Med Wochenschr. 2021;146:412–417. doi: 10.1055/a-1216-7050. [DOI] [PubMed] [Google Scholar]
- 23.Shi H, Shao X, Hong Y. Association between cigarette smoking and the susceptibility of acute myeloid leukemia: a systematic review and meta-analysis. Eur Rev Med Pharmacol Sci. 2019;23:10049–10057. doi: 10.26355/eurrev_201911_19572. [DOI] [PubMed] [Google Scholar]
- 24.Slattery ML, Potter JD, Friedman GD, et al. Tobacco use and colon cancer. Int J Cancer. 1997;70:259–264. doi: 10.1002/(SICI)1097-0215(19970127)70:3<259::AID-IJC2>3.0.CO;2-W. [DOI] [PubMed] [Google Scholar]
- 25.Wang Q‑L, Xie S‑H, Li W‑T, Lagergren J (2017) Smoking cessation and risk of esophageal cancer by histological type: systematic review and meta-analysis. J Natl Cancer Inst 109:(12). 10.1093/jnci/djx115 [DOI] [PubMed]
- 26.Wynder EL, Hoffmann D. Smoking and lung cancer: scientific challenges and opportunities. Cancer Res. 1994;54:5284–5295. [PubMed] [Google Scholar]
- 27.Yuan JM, Castelao JE, Gago-Dominguez M, et al. Tobacco use in relation to renal cell carcinoma. Cancer Epidemiol Biomarkers Prev. 1998;7:429–433. [PubMed] [Google Scholar]
- 28.Zeegers MP, Tan FE, Dorant E, van Den Brandt PA. The impact of characteristics of cigarette smoking on urinary tract cancer risk: a meta-analysis of epidemiologic studies. Cancer. 2000;89:630–639. doi: 10.1002/1097-0142(20000801)89:3<630::AID-CNCR19>3.0.CO;2-Q. [DOI] [PubMed] [Google Scholar]