Résumé
Historique
Le syndrome inflammatoire multisystémique de l’enfant (SIME) est une complication postinfectieuse de la COVID-19 qui combine des manifestations de la maladie de Kawasaki et du syndrome de choc toxique. En mai 2020, un groupe de travail multidisciplinaire provincial a été mis sur pied en prévision des cas émergents après la première vague de COVID-19.
Méthodologie
Le centre des auteurs a créé un groupe multidisciplinaire pour les cas de SIME en Colombie-Britannique, qui a préparé des lignes directrices inspirées de la définition de cas de SIME de l’Organisation mondiale de la Santé. Il a mis les lignes directrices à jour au moyen de méthodes d’amélioration de la qualité en fonction de la publication de nouveaux rapports et de l’évolution de l’expérience locale. Il a inclus tous les enfants évalués en personne ou dont les échantillons avaient été envoyés au centre afin de confirmer la présence du syndrome entre mai 2020 et avril 2021. Il a procédé à la collecte prospective des caractéristiques démographiques et cliniques, des caractéristiques de laboratoire et des traitements des patients.
Résultats
Au total, 52 enfants ont été évalués, et 11 ont reçu un diagnostic de SIME confirmé. Dix de ces 11 cas ont souffert d’un choc, et les atteintes gastro-intestinales et mucocutanées étaient également courantes. Les résultats de laboratoire fréquents incluaient une élévation de la protéine C-réactive, des D-dimères, de la troponine et du peptide cérébral natriurétique. Quatre des 11 cas (36 %) ont souffert d’un dysfonctionnement myocardique et trois (27 %), d’anomalies des artères coronaires. Les 11 patients ont obtenu des résultats démontrant une infection par le SRAS-CoV-2, et dix d’entre eux (91 %) ont reçu des immunoglobulines et des corticostéroïdes par voie intraveineuse.
Conclusion
La cohorte provinciale de patients atteints d’un SIME confirmé était plus susceptible de présenter un état de choc et un dysfonctionnement cardiaque, d’être admise en soins intensifs et de recevoir un traitement aux corticostéroïdes que les cas écartés. Grâce au processus évolutif privilégié par le groupe de travail, les enfants de la province possédant des caractéristiques du syndrome étaient rapidement dépistés, soumis à une évaluation standardisée et traités de manière appropriée.
Keywords: COVID-19, maladie très grave, sepsis, surveillance, syndrome inflammatoire multisystémique de l’enfant
Le syndrome inflammatoire multisystémique de l’enfant (SIME) est une affection qui a été décrite récemment et qui combine des caractéristiques de la maladie de Kawasaki et du syndrome de choc toxique. Il a émergé dans la foulée de la pandémie de maladie à coronavirus 2019 (COVID-19). En effet, le Royaume-Uni a publié une alerte nationale en avril 2020 à cause d’un groupe d’enfants atteints d’un choc cardiovasculaire, de fièvre et d’hyperinflammation ayant un lien temporel avec l’infection par le coronavirus du syndrome respiratoire aigu sévère 2 (SRAS-CoV-2) (1,2). Même si la physiopathologie du SIME demeure nébuleuse, il est largement accepté qu’il s’agit d’une complication postinfectieuse de la COVID-19 (3).
Au Canada, de nombreux programmes provinciaux et fédéraux assurent un suivi actif du SIME. En réponse à cette entité émergente, le centre pédiatrique quaternaire provincial des auteurs a mis sur pied un groupe de travail multidisciplinaire pour évaluer la prise en charge des cas de SIME en Colombie-Britannique, au Canada, et pour fournir des recommandations à cet égard. Près d’un million de jeunes de zéro à 19 ans habitent en Colombie-Britannique, dans une vaste aire géographique de 944 735 km² (4). Le présent rapport décrit la manière dont le groupe de travail a utilisé le modèle d’amélioration pour privilégier une trajectoire clinique en vue d’évaluer et de prendre en charge les enfants hospitalisés à cause d’une présomption de SIME. Enfin, le groupe de travail décrit les caractéristiques cliniques de 52 cas britanno-colombiens évalués en vue de diagnostiquer un SIME.
Méthodologie
La création d’un groupe de travail multidisciplinaire
Le 8 mai 2020, les professionnels de la santé de diverses spécialités du BC Children’s Hospital (BCCH) et du Surrey Memorial Hospital ont formé le « groupe de travail britanno-colombien sur le SIME » (GTBS) pour établir les trajectoires diagnostiques et thérapeutiques de cette entité émergente. Ils ont pris contact avec des intervenants, y compris la santé publique de la Colombie-Britannique, le BC Centre for Disease Control (BCCDC) et Child Health BC, un réseau de santé provincial. Ils ont invité les pédiatres d’autres communautés britanno-colombiennes à participer, afin de s’assurer que le GTBS réponde aux besoins des enfants de toute la province.
Le GTBS a été aux prises avec des difficultés immédiates : 1) l’absence de test diagnostique propre au SIME, 2) la nécessité de déterminer les cas éventuels rapidement et de manière appropriée, 3) la détermination d’une définition de cas et d’un processus systématique rapide pour signaler les cas éventuels à la santé publique et 4) le besoin urgent de faire des recommandations sur le SIME, à la fois aux cliniciens et au public.
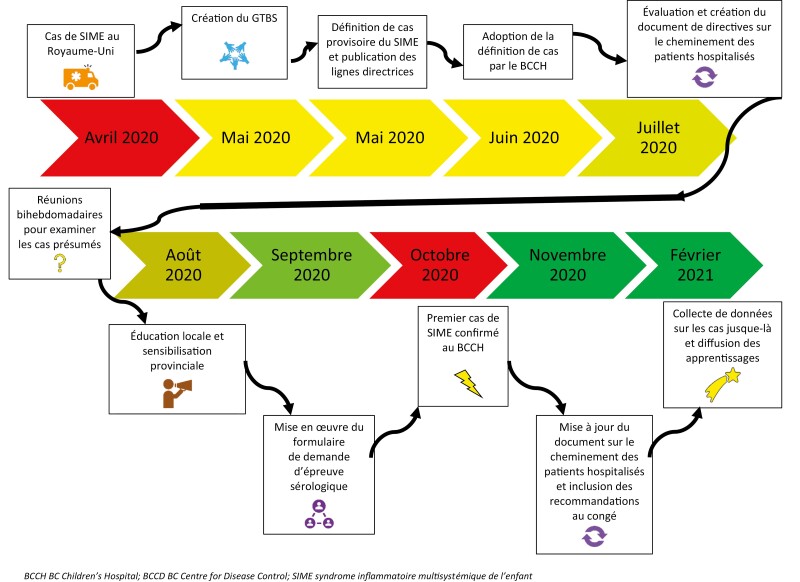
Le groupe de travail a utilisé le modèle d’amélioration afin d’adopter le plus vite possible de nouveaux conseils diagnostiques et thérapeutiques en cas de présomption de SIME. La mesure d’utilisation de l’outil correspondait au nombre d’épreuves sérologiques réclamées et d’envois au GTBS provenant de diverses régions de la province, par rapport au nombre de cas déclarés directement à la santé publique de la Colombie-Britannique. Les changements au processus ou à la consignation au dossier ont été effectués pendant la période de l’étude au moyen de petits cycles rapides du modèle Planifier-Exécuter-Étudier-Agir (figure 1).
Figure 1.
Échéancier des directives fondées sur des données probantes du groupe de travail britanno-colombien sur le SIME
La définition de cas et l’élaboration initiale des directives cliniques
Le GTBS et les intervenants clés se sont d’abord réunis toutes les semaines pour analyser les données probantes sur le SIME et s’entendre sur une définition de cas et des lignes directrices en vue de l’évaluation initiale des cas présumés. Ils ont examiné les publications scientifiques, et certains membres ont participé aux réunions de la Paediatric COVID-19 International Collaborative où les cas mondiaux de SIME étaient examinés en détail. Le groupe de référence clinique provincial de la COVID-19 a approuvé les lignes directrices du GTBS. Ce groupe de référence est une entité provinciale composée de médecins et d’experts de la santé publique qui approuvent les documents de référence destinés au public sur la COVID-19 pour la Colombie-Britannique. Le GTBS a dérivé la définition de cas utilisée en Colombie-Britannique de celle de l’Organisation mondiale de la Santé (2) pour n’inclure que les cas hospitalisés, puis l’a mise à la disposition du public le 10 juin 2020 par l’entremise du site Web du BCCDC, et des médecins le 28 août 2020 par l’entremise du Collège des médecins et chirurgiens de la Colombie-Britannique (5). L’épreuve sérologique était exécutée au moyen du dosage total des anticorps anti-SRAS-CoV-2 d’Ortho T VITROSMD (Ortho IgG; Ortho Clinical Diagnostics, Rochester, New York), un dosage qualitatif autorisé par Santé Canada et la Food and Drug Administration des États-Unis qui détecte les anticorps anti-IgA, anti-IgG et anti-IgM (6).
La détermination et l’analyse des cas
Le groupe de travail a créé une base de données dans le logiciel REDCap en juin 2020 pour retracer tous les cas dirigés en raison d’un SIME présumé. Au moment de demander une épreuve sérologique du SRAS-CoV-2 dans le cadre d’une évaluation du SIME, les professionnels de la santé soumettaient un formulaire de rapport de cas que le personnel infirmier saisissait ensuite dans la base de données REDCap. Ainsi, la santé publique recevait un signalement rapide et précis, et la collecte prospective des caractéristiques des cas était assurée. Le GTBS examinait les données, et chaque patient était classé comme a) personne à l’étude, b) cas de SIME confirmé ou c) cas de SIME écarté. Tout cas saisi dans REDCap comme « personne à l’étude » ou « cas de SIME confirmé » entraînait un signalement automatique à la santé publique. Le comité d’éthique de la recherche du BC Children’s and Women’s Hospital a évalué ce projet, qui a été considéré comme une activité d’amélioration de la qualité et d’assurance qualité, et c’est pourquoi il n’a pas eu besoin de l’analyser.
Le processus d’élaboration de directives cliniques fondées sur des données probantes
Une fois les définitions de cas diffusées, le GTBS s’est rencontré toutes les deux semaines. Ses membres ont analysé les cas saisis dans la base de données REDCap, puis ont procédé à l’analyse des publications les plus pertinentes sur le SIME. Ils ont également rédigé des documents fondés sur des données probantes, y compris une évaluation initiale, des lignes directrices sur la prise en charge des patients hospitalisés à cause du SIME au BCCH et un document de directives provinciales (documentation supplémentaire) (5,7,8). Ils ont mis à l’essai et révisé les modifications au document fondé sur des données probantes avec les intervenants avant d’en faire une vaste diffusion, afin d’améliorer rapidement la trajectoire à grande échelle.
L’analyse statistique
Le groupe de travail a effectué toutes les analyses statistiques à l’aide du logiciel Stata 14 (StataCorp, College Station, Texas, États-Unis). Il a résumé les données sous forme de statistiques descriptives non paramétriques (médiane, écart interquartile). Entre les groupes de « cas de SIME confirmés » et de « cas de SIME écartés », il a utilisé la méthode exacte de Fisher pour comparer les proportions et le test de la somme des rangs de Wilcoxon pour déterminer les variables continues. Il a rendu compte des valeurs p nominales (non corrigées à cause de tests multiples).
Les résultats
Au moyen du modèle d’amélioration, de la schématisation de processus et des cycles rapides du modèle Planifier-Exécuter-Étudier-Agir, le GTBS a adopté et diffusé avec succès les définitions de cas, les documents d’évaluation et de prise en charge et le processus de formulaire de demande d’épreuve sérologique. Entre mai 2020 et avril 2021, le GTBS a examiné 52 patients pédiatriques qui ont été soumis à une évaluation du SIME (figure supplémentaire 1). Au total, 11 enfants (21 %) respectaient les critères diagnostiques de SIME confirmé. Tous les cas confirmés ont été signalés au GTBS, et aucun cas n’a été déclaré directement à la santé publique hors de ce processus. Ainsi, 41 enfants (79 %) ne respectaient pas les critères de cas.
Les caractéristiques cliniques et les issues des patients évalués
Les 52 patients évalués avaient un âge médian de 6,0 ans (plage de trois mois à 16 ans). Au tableau 1 sont exposés les caractéristiques et les résultats cliniques des cas confirmés et écartés. À la figure supplémentaire 2 sont comparées les valeurs de laboratoire quantitatives entre les deux groupes.
Tableau 1.
Caractéristiques démographiques, caractéristiques cliniques, caractéristiques de laboratoire et intervention des patients
| Total (n=52) | Cas de SIME confirmés (n=11) | Cas de SIME écartés (n=41) | Valeur p (cas confirmés ou écartés) | |
|---|---|---|---|---|
| Caractéristiques démographiques | ||||
| Âge (en années) | 6,0 (2,0, 12,5) | 6,0 (1,5, 12,0) | 6,0 (3,0, 13,0) | 0,74 |
| Sexe féminin (n, [%]) | 28 (53,4) | 5 (45,5) | 23 (56,1) | 0,74 |
| Dépistage du SRAS-CoV-2 | ||||
| Résultat positif selon le test PCR | 9 (n=51) |
7 (n=11) |
2 (n=40) |
<0,0001 |
| Résultat positif selon l’épreuve sérologique | 12 (n=52) |
11 (n=11) |
1 (n=41) |
<0,0001 |
| Caractéristiques cliniques (n, [%]) | ||||
| Choc | 25 (48,1) | 10 (90,9) | 15 (36,6) | 0,002 |
| Douleur abdominale aiguë | 24 (47,1) | 6 (54,5) | 18 (45,0) | 0,74 |
| Vomissements | 32 (61,5) | 6 (54,5) | 26 (63,4) | 0,73 |
| Conjonctivite | 30 (57,7) | 6 (54,5) | 24 (58,5) | 0,54 |
| Éruption | 34 (65,4) | 5 (45,5) | 29 (70,7) | 0,16 |
| Changements à la muqueuse orale | 26 (50,0) | 5 (45,5) | 21 (51,2) | 1,0 |
| Érythème, œdème, desquamation des extrémités périphériques | 18 (35,3) | 4 (36,4) | 14 (35,0) | 1,0 |
| Diarrhée | 18 (36,0) | 4 (36,4) | 14 (35,9) | 1,0 |
| Caractéristiques de laboratoire | ||||
| Protéine C-réactive initiale (mg/L) | 126 (53, 176) (n=52) | 88 (78, 157) (n=11) | 131 (50, 176) (n=41) | 0,86 |
| Protéine C-réactive de pointe (mg/L) | 159 (59, 209) (n=52) | 132 (80, 236) (n=11) |
163 (57, 209) (n=41) | 0,89 |
| D-dimères initiales (mcg d’équivalent fibrinogène/L) | 2335 (946, 3 792) (n=45) |
3 339 (2 335, 4 270) (n=10) |
2 050 (860, 3 504) (n=35) |
0,03 |
| D-dimères de pointe (mcg d’équivalent fibrinogène/L) | 2 708 (1 250, 5 058) (n=46) |
4 156 (2 919, 5 958) (n=11) |
2 234 (1 071, 4 575) (n=35) |
0,12 |
| Troponine initiale (mcg/L) | 0 (0,0,06) (n=32) |
0,05 (0,04, 0,47) (n=7) | 0 (0, 0,05) (n=25) | 0,01 |
| Troponine de pointe (mcg/L) | 0,005 (0, 0,21) (n=36) |
0,27 (0,13, 0,80) (n=10) | 0 (0, 0,09) (n=26) | 0,001 |
| Peptide cérébral natriurétique initial (ng/L) | 150 (45, 401) (n=33) | 470 (240, 1 245) (n=10) |
102 (30, 297) (n=23) | 0,004 |
| Peptide cérébral natriurétique de pointe (ng/L) | 346 (61, 1 065) (n=33) |
1 406 (845, 2 049) (n=10) |
102 (30, 401) (n=23) | 0,0002 |
| Résultats échocardiographiques (n, [%]) | ||||
| Dysfonctionnement myocardique | 6 sur 46 (13,0) | 4 sur 11 (36,4) | 2 sur 35 (5,7) | 0,02 |
| Anomalies des artères coronaires | 17 sur 46 (37,0) | 3 sur 11 (27,3) | 14 sur 35 (40) | 0,50 |
| Interventions pharmacologiques (n, [%]) | ||||
| Immunoglobulines intraveineuses | 33 (63,5) | 10 (90,9) | 23 (56,1) | 0,04 |
| Secondes immunoglobulines intraveineuses | 12 (23,1) | 5 (45,5) | 7 (17,1) | 0,1 |
| Corticostéroïde (toute dose) | 25 (48,1) | 10 (90,9) | 15 (36,6) | 0,002 |
| Acide acétylsalicylique | 28 (53,9) | 7 (63,6) | 21 (51,2) | 0,52 |
| Anticoagulation | 6 (11,5) | 3 (27,3) | 3 (7,3) | 0,10 |
| Prophylactique | 4 (7,7) | 3 (27,3) | 1 (2,4) | 0,026 |
| Thérapeutique | 2 (3,85) | 0 (0) | 2 (4,9) | 1,0 |
| Antibiotiques | 33 (63,5) | 10 (90,1) | 23 (56,1) | 0,04 |
| Antiviraux | 2 (3,9) | 0 (0) | 2 (4,9) | 1,0 |
| Interventions en soins intensifs (n, [%]) | ||||
| Inotropes | 12 (23,1) | 5 (45,5) | 7 (17,1) | 0,1 |
| Ventilation invasive | 6 (11,5) | 3 (27,3) | 3 (7,3) | 0,10 |
| Système d’assistance respiratoire extracorporelle | 1 (1,9) | 0 (0) | 1 (2,4) | 1,0 |
| Issues | ||||
| Durée d’hospitalisation (en jours) | 5 (3, 7) | 6 (4, 9) | 5 (3, 7) | 0,19 |
| Admission en soins intensifs (n, [%]) | 13 (25,0) | 7 (63,6) | 6 (14,6) | 0,003 |
| Décès (n, [%]) | 0 (0) | 0 (0) | 0 (0) | 1,0 |
Les données nominales sont présentées sous forme de n (%), et les données continues, sous forme de médiane (écart interquartile). Les valeurs p sont exposées pour comparer les groupes de cas confirmés et écartés au moyen de la méthode exacte de Fisher (variables nominales) et de la somme des rangs de Wilcoxon (variables continues).
Les valeurs en caractères gras sont celles dont la valeur p<0,05.
L litre; mcg microgramme; mg milligramme; n nombre; ng nanogramme; SIME syndrome inflammatoire multisystémique de l’enfant
Les cas de SIME confirmés
Des 11 cas confirmés, sept avaient déjà reçu un résultat positif par test PCR confirmant une COVID-19 aiguë ou un résultat positif à leur admission à cause d’un SIME. Les quatre autres avaient reçu un résultat négatif ou indéterminé au test PCR, mais les 11 patients ont obtenu un résultat positif au SRAS-CoV-2 par épreuve sérologique. Dix patients (91 %) ont présenté une manifestation clinique de choc. Sept enfants (64 %) ont été hospitalisés en soins intensifs pédiatriques, cinq (45 %) d’entre eux ont eu besoin d’un soutien inotrope et trois (27 %), d’une intubation et d’une ventilation.
Dix patients (91 %) ont reçu des immunoglobulines et des stéroïdes par voie intraveineuse et cinq, une deuxième dose d’immunoglobulines par voie intraveineuse. Un enfant n’a pas reçu de traitement, car il était atteint d’une maladie légère qui a guéri rapidement sans intervention. Trois enfants ont reçu des anticoagulants prophylactiques à l’aide d’héparine de faible poids moléculaire conformément aux nouvelles lignes directrices de la Société internationale de thrombose et d’hémostase (9). Dix patients (91 %) ont reçu des antibiotiques empiriques à l’admission.
Les cas de SIME écartés
Deux des 41 cas ont obtenu des résultats positifs au SRAS-CoV-2 par test PCR ou épreuve sérologique. L’un a fini par obtenir un diagnostic d’urosepsis à Escherichia coli non apparenté, et l’autre ne répondait pas aux critères cliniques de SIME. Six cas (15 %) ont dû être admis en soins intensifs. Au total, 23 patients (56 %) ont reçu des immunoglobulines par voie intraveineuse, et 15 (37 %), des stéroïdes systémiques. Ces traitements ont été administrés à cause de la maladie de Kawasaki, du syndrome de choc toxique et du sepsis.
Exposé
Les leçons en matière d’amélioration de la qualité
Le groupe de travail décrit l’expérience d’utilisation des méthodes d’amélioration de la qualité pour établir rapidement la trajectoire clinique de cette nouvelle entité émergente dans leur centre. La participation rapide de multiples intervenants a été essentielle à la réponse coordonnée à cette nouvelle affection qui s’est déclarée pendant une pandémie. Le groupe de travail a révisé les documents fondés sur des données probantes plusieurs fois, à mesure qu’émergeaient de nouvelles données, afin de s’assurer que les patients reçoivent des soins fondés sur des données probantes. Pendant la durée de l’étude, l’un des changements de pratique importants incluait l’administration plus rapide de corticostéroïdes dans les présentations graves. Ainsi, le groupe de travail a fini par arrêter de prescrire une deuxième dose d’immunoglobulines par voie intraveineuse dans les cas réfractaires. Il a également envisagé davantage l’administration d’anticoagulants et d’accroître l’utilisation d’acide acétylsalicylique chez certains patients. Il a invité les cliniciens d’autres régions à participer au GTBS, afin de mieux diffuser les connaissances aux autres régions sociosanitaires, et d’autres cas ont été signalés dans ces régions lorsqu’un porte-parole local s’est mis à en faire partie. L’absence de cas de SIME confirmés signalés directement à la santé publique hors du GTBS corrobore l’excellente adoption de la trajectoire dans une période très courte. Le groupe de travail a également mis au point un nouveau système de déclaration à la santé publique pour faciliter le partage de données provinciales et nationales.
Les caractéristiques cliniques
À la connaissance du groupe de travail, il s’agit de la troisième série de cas publiée sur le SIME au Canada (10,11), et la présentation de la cohorte corrobore les publications existantes (10,12–14). Les patients atteints d’un SIME confirmé éprouvaient souvent des symptômes gastro-intestinaux et mucocutanés, mais à un taux comparable à celui des membres du groupe écarté. C’est probablement à cause de la forte proportion de patients atteints de la maladie de Kawasaki dans le groupe écarté, pour qui l’inflammation mucocutanée est une caractéristique distinctive (15). Le groupe écarté incluait également des patients atteints d’infections bactériennes responsables de fièvre et de symptômes gastro-intestinaux, comme l’E. coli, le Campylobacter jejuni et le Salmonella typhi. Le choc était plus fréquent dans les cas de SIME confirmés que dans ceux du groupe écarté. De même, la cohorte de SIME avait tendance à présenter plus de dysfonctionnement cardiaque, démontré par un taux plus élevé de peptide cérébral natriurétique et de troponine et une plus grande fréquence de dysfonctionnement myocardique à l’échocardiogramme. Un SIME confirmé était également associé à une plus forte fréquence d’admissions en soins intensifs et à des valeurs de D-dimères initiales plus élevées. Qui plus est, les marqueurs inflammatoires (particulièrement la protéine C-réactive) étaient semblables entre les cas de SIME confirmés et écartés, ce qui laisse supposer que ce biomarqueur seul ne permet pas de dépister les cas de SIME.
La forte proportion d’infections bactériennes chez les patients évalués pour diagnostiquer un SIME est une constatation importante, qui fait ressortir la nécessité de toujours envisager le sepsis chez les enfants qui présentent des caractéristiques de SIME, de même que d’éviter les biais cognitifs qui peuvent prédisposer les cliniciens à ignorer les autres causes de choc au potentiel fatal.
Presque tous les patients atteints d’un SIME ont reçu des immunoglobulines par voie intraveineuse et des corticostéroïdes, et cinq ont reçu une deuxième dose d’immunoglobulines par voie intraveineuse. Il est de plus en plus reconnu que l’administration précoce de corticostéroïdes conjuguée à des immunoglobulines par voie intraveineuse peut être efficace pour réduire la durée du séjour en soins intensifs et la gravité clinique de la maladie (16,17). De récentes lignes directrices déconseillent l’administration d’une seconde dose d’immunoglobulines par voie intraveineuse (18), et le groupe de travail a adapté les recommandations en conséquence. Aucun événement thromboembolique n’a été déclaré dans la cohorte, et aucune complication hémorragique n’a été constatée chez les patients sous anticoagulation prophylactique.
Les limites
L’échantillon de cas relativement modeste a limité la capacité de déterminer plus de différences entre les cas de SIME confirmés et écartés. Dans une tentative pour maximiser la sensibilité de l’analyse des différences entre les cas de SIME écartés et confirmés, le groupe de travail n’a pas corrigé son analyse statistique des multiples comparaisons. Cette stratégie productrice d’hypothèses accroît le risque d’erreurs de type 1, et les valeurs p déclarées doivent être considérées comme nominales. Ensuite, même si les données des patients ont été colligées de manière rétrospective, les patients évalués n’avaient pas tous été soumis à un bilan complet de SIME. Le groupe de travail ne croit pas qu’une telle démarche aurait eu des répercussions sur le diagnostic final, parce que d’autres diagnostics ont été posés. Certains paramètres de laboratoire n’ont pas été inclus pour tous les patients, ce qui a réduit la taille de l’échantillon en vue de la comparaison entre les cohortes. Notamment, les valeurs pro-peptides cérébrales natriurétiques et les valeurs de troponine de haute sensibilité, mesurées chez une minorité de patients, ont été exclues de l’analyse, car elles ne peuvent pas être directement comparées aux peptides cérébraux natriurétiques de pointe ni aux valeurs de troponine habituelles, respectivement. La définition était limitée aux patients hospitalisés. Il se peut que des cas légers aient été traités en milieu ambulatoire. Ainsi, 20 des patients qui n’étaient pas atteints d’un SIME, mais qui présentaient un tableau clinique de maladie de Kawasaki ou de maladie de Kawasaki et de syndrome de choc toxique ne répondaient pas aux critères en raison d’un manque de preuve de SRAS-CoV-2 ou de lien épidémiologique avec un cas connu. Certains de ces cas peuvent toutefois avoir un lien épidémiologique non établi avec le SRAS-CoV-2. De plus, le groupe de travail n’a pas repris systématiquement les épreuves sérologiques chez les patients séronégatifs, même si le résultat de l’épreuve sérologique est généralement positif deux semaines après une infection par le SRAS-CoV-2 (19). Enfin, il ne s’est pas doté d’un processus de suivi centralisé à long terme pour les patients atteints d’un SIME, à part le suivi systématique en cardiologie.
Conclusions
Le SIME est une rare séquelle de l’infection par le SRAS-CoV-2 qui peut toucher les enfants de tout âge. La présente étude présente une initiative de qualité adoptée au centre en réponse à cette entité et décrit les cas observés. La surveillance du groupe de travail et son évolution en fonction des publications visaient à garantir que les enfants présentant des caractéristiques de SIME reçoivent le bilan et la prise en charge appropriés dans la province.
Supplementary Material
Contributor Information
Alison A Lopez, Service d’infectiologie, BC Children’s Hospital, Vancouver (Colombie-Britannique), Canada.
Mona Patel, Département de pédiatrie, Université de la Colombie-Britannique, Vancouver (Colombie-Britannique), Canada; Service de soins intensifs, BC Children’s Hospital, Vancouver (Colombie-Britannique), Canada.
Jonathan H Rayment, Département de pédiatrie, Université de la Colombie-Britannique, Vancouver (Colombie-Britannique), Canada; Service de pneumologie, BC Children’s Hospital, Vancouver (Colombie-Britannique), Canada.
Herman Tam, Département de pédiatrie, Université de la Colombie-Britannique, Vancouver (Colombie-Britannique), Canada; Service de rhumatologie, BC Children’s Hospital, Vancouver (Colombie-Britannique), Canada.
Ashley Roberts, Service d’infectiologie, BC Children’s Hospital, Vancouver (Colombie-Britannique), Canada; Département de pédiatrie, Université de la Colombie-Britannique, Vancouver (Colombie-Britannique), Canada.
Samara Laskin, Département de pédiatrie, Université de la Colombie-Britannique, Vancouver (Colombie-Britannique), Canada; Service de pédiatrie générale, BC Children’s Hospital, Vancouver (Colombie-Britannique), Canada.
Lori Tucker, Département de pédiatrie, Université de la Colombie-Britannique, Vancouver (Colombie-Britannique), Canada; Service de rhumatologie, BC Children’s Hospital, Vancouver (Colombie-Britannique), Canada.
Catherine M Biggs, Département de pédiatrie, Université de la Colombie-Britannique, Vancouver (Colombie-Britannique), Canada; Service d’allergies et d’immunologie, BC Children’s Hospital, Vancouver (Colombie-Britannique), Canada.
GTBS:
May A Ahmed, Vilte Barakauskas, Eleni Galanis, David Goldfarb, Jessica Halparin, Kevin C Harris, Niranjan Kissoon, Sally Lawrence, Dominique McGuffin, Garth Meckler, Kirsten Noel, Dewi Schrader, Michelle Sherwood, Avash Singh, and Suzanne Vercauteren
DONNÉES SUPPLÉMENTAIRES
Les données supplémentaires sont accessibles à pxab110 dans le site de Paediatrics & Child Health.
Remerciements
Les auteurs tiennent à remercier leurs collègues pédiatres de la Colombie-Britannique pour leur aide dans le signalement de ces cas. Ils remercient également les infirmières des centres de dépistage de la COVID-19 qui ont contribué à la saisie des données.
FINANCEMENT DU MANUSCRIT
CMB est financée par une bourse de chercheuse professionnelle en santé de la Michael Smith Foundation for Health Research.
FINANCEMENT DU SUPPLÉMENT
Le présent article fait partie d’un supplément spécial sur les effets de la pandémie de COVID-19 chez les enfants et les adolescents. La production de ce supplément a été rendue possible grâce au financement de l’Agence de la santé publique du Canada. Les points de vue exprimés aux présentes ne représentent pas nécessairement ceux de l’Agence de la santé publique du Canada.
CONFLITS D’INTÉRÊTS POTENTIELS
La docteure Catherine Biggs a reçu la bourse de chercheuse professionnelle en santé de la Michael Smith Foundation for Health Research et le prix de chercheuse-clinicienne en début de carrière du Providence Healthcarte Research Institute. Elle a également reçu des honoraires d’AbbVie et de la Société canadienne d’allergie et d’immunologie clinique (SCAIC), est la responsable de projet du groupe de travail britanno-colombien sur le SIME et la responsable du groupe de recherche sur les maladies rares du BC Children’s Hospital Research Institute. La docteure Alison Lopez déclare avoir reçu des honoraires du Langley Memorial Hospital, et le docteur Herman Tam, de l’American College of Rheumatology. Il n’y a pas d’autre divulgation de conflits d’intérêts. Les auteurs ont remis le formulaire de divulgation des conflits d’intérêts potentiels de l’International Committee of Medical Journal Editors. Ils ont divulgué les conflits que les rédacteurs en chef jugent pertinents en fonction du contenu du présent manuscrit.
*Membres du GTBS May A Ahmed1, Vilte Barakauskas2, Eleni Galanis1,3, David Goldfarb2,4, Jessica Halparin5, Kevin C. Harris6, Niranjan Kissoon7, Sally Lawrence8, Dominique McGuffin9, 10, Garth Meckler9,11, Kirsten Noel12, Dewi Schrader9,13, Michelle Sherwood14, Avash Singh14, Suzanne Vercauteren2
1BC Centre for Disease Control, Vancouver (Colombie-Britannique) Canada; 2Département de pathologie et de médecine de laboratoire, Université de la Colombie-Britannique, Vancouver (Colombie-Britannique) Canada; 3École de santé publique et de santé des populations, faculté de médecine, Université de la Colombie-Britannique, Vancouver (Colombie-Britannique) Canada; 4Service d’infectiologie, BC Children’s Hospital, Vancouver (Colombie-Britannique) Canada; 5Service d’hémato-oncologie pédiatrique et de greffe de moelle osseuse, BC Children’s Hospital, Vancouver (Colombie-Britannique) Canada; 6Service de cardiologie, BC Children’s Hospital, Vancouver (Colombie-Britannique) Canada; 7BC Children’s Hospital Research Institute, Vancouver (Colombie-Britannique) Canada; 8Service de gastro-entérologie, BC Children’s Hospital, Vancouver (Colombie-Britannique) Canada; 9Service de pédiatrie, Université de la Colombie-Britannique, Vancouver (Colombie-Britannique) Canada; 10Service de pédiatrie, Royal Columbian Hospital, New Westminster (Colombie-Britannique) Canada; 11Service d’urgentologie, BC Children’s Hospital, Vancouver (Colombie-Britannique) Canada; 12Accès et utilisation des lits, British Columbia’s Children’s Hospital, Vancouver (Colombie-Britannique) Canada; 13Service de neurologie, BC Children’s Hospital, Vancouver (Colombie-Britannique) Canada; 14Département de pédiatrie, Surrey Memorial Hospital, Surrey (Colombie-Britannique)
RÉFÉRENCES
- 1. Riphagen S, Gomez X, Gonzalez-Martinez C, Wilkinson N, Theocharis P.. Hyperinflammatory shock in children during COVID-19 pandemic. Lancet 2020;395(10237):1607–8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2. Organisation mondiale de la Santé. Syndrome inflammatoire multisystémique chez les enfants et les adolescents atteints de COVID-19 : note scientifique, 15 mai 2020. OMS. 2020;10(mai):1–9. https://apps.who.int/iris/bitstream/handle/10665/332190/WHO-2019-nCoV-Sci_Brief-Multisystem_Syndrome_Children-2020.1-fre.pdf?sequence=1&isAllowed=y (consulté le 13 janvier 2022) [Google Scholar]
- 3. Sancho-Shimizu V, Brodin P, Cobat Aet al. SARS-CoV-2–related MIS-C: A key to the viral and genetic causes of Kawasaki disease? J Exp Med. 2021;218(6). [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4. Statistique Canada. Profil du recensement, Recensement de 2016. www12.statcan.gc.ca/census-recensement/2016/dp-pd/prof/index.cfm?Lang=F (consulté le 7 juillet 2021)
- 5. BC Centre for Disease Control. Multi-system Inflammatory Syndrome in Children and Adolescents (MIS-C). 2020. www.bccdc.ca/health-professionals/clinical-resources/case-definitions/covid-19-(novel-coronavirus)/multi-system-inflammatory-syndrome-in-children-and-adolescents-(mis-c) (consulté le 30 novembre 2021)
- 6. Sekirov I, Barakauskas VE, Simons J, Cook D, Bates B, Burns Let al. SARS-CoV-2 serology: Validation of high-throughput chemiluminescent immunoassay (CLIA) platforms and a field study in British Columbia. J Clin Virol. 2021;142:104914. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. BC Children’s Hospital. Multi-system inflammatory syndrome in children temporally associated with COVID-19: Inpatient workflow. 2021. http://shop.healthcarebc.ca/phsa/BCWH_2/BC%20Children’s%20Hospital/C-05-07-60677.pdf (consulté le 13 janvier 2022)
- 8. BC Children’s Hospital. Multisystem inflammatory syndrome in children provisional evaluation algorithm. 2020. http://shop.healthcarebc.ca/phsa/BCWH_2/BC%20Children’s%20Hospital/C-05-01-60667.pdf (consulté le 13 janvier 2022)
- 9. Goldenberg NA, Sochet A, Albisetti Met al.; sous-comité de l’hémostase et de la thrombose pédiatrique et néonatale du comité scientifique et de standardisation de l’International Society on Thrombosis, Inc. Consensus-based clinical recommendations and research priorities for anticoagulant thromboprophylaxis in children hospitalized for COVID-19–related illness. J Thromb Haemost. 2020;18(11):3099–105 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Merckx J, Cooke S, Tal TElet al. Multicenter cohort study of multisystem inflammatory syndrome in children (MIS-C). medRxiv. 2021. https://www.medrxiv.org/content/10.1101/2021.05.14.21257058v1 (consulté le 4 avril 2022) [Google Scholar]
- 11. Tam H, Tal TEl, Go E, Yeung RSM.. Le syndrome inflammatoire multisystémique de l’enfant ayant un lien temporel avec la COVID-19 : multiples visages, multiples appellations. Can Med Assoc J. 2020;192(48):E1686–90. https://www.cmaj.ca/content/192/48/E1686 (consulté le 4 avril 2022) [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Whittaker E, Bamford A, Kenny Jet al. ; groupe d’étude du SIME et des consortiums EUCLIDE et PERFORM. Clinical characteristics of 58 children with a pediatric inflammatory multisystem syndrome temporally associated with SARS-CoV-2. JAMA. 2020;324(3):259–69. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Feldstein LR, Rose EB, Horwitz SMet al. Multisystem inflammatory syndrome in U.S. children and adolescents. N Engl J Med. 2020;383(4):334–46. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. Feldstein LR, Tenforde MW, Friedman KGet al.; chercheurs d’Overcoming COVID-19. Characteristics and outcomes of US children and adolescents with Multisystem Inflammatory Syndrome in Children (MIS-C) compared with severe acute COVID-19. JAMA. 2021;325(11):1074–87. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15. Newburger JW, Takahashi M, Burns JC.. Kawasaki Disease. J Am Coll Cardiol. 2016;67:1738–49. [DOI] [PubMed] [Google Scholar]
- 16. Ouldali N, Toubiana J, Antona Det al.; consortium français d’inflammation pédiatrique par la COVID-19. Association of intravenous immunoglobulins plus methylprednisolone vs immunoglobulins alone with course of fever in multisystem inflammatory syndrome in children. JAMA. 2021;325(9):855–64. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17. Son MBF, Murray N, Friedman Ket al. Multisystem inflammatory syndrome in children — initial therapy and outcomes. N Engl J Med. 2021;385(1):23–34. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18. Comité des soins aigus. Le syndrome inflammatoire multisystémique de l’enfant ayant un lien temporel avec la COVID-19 (mise à jour du printemps 2021). Paediatr Child Health. 2020. https://cps.ca/fr/documents/position/SIME (consulté le 4 avril 2022). [Google Scholar]
- 19. BC Centre for Disease Control. Antibody Testing (Serology). 2020. http://www.bccdc.ca/health-professionals/clinical-resources/covid-19-care/covid-19-testing/antibody-testing-(serology) (consulté le 30 novembre 2021).
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.