Abstract
目的
探讨干扰CTPS基因对川楝素诱导的胃癌MKN-45细胞凋亡的影响。
方法
通过生物信息学分析CTPS基因在人胃癌组织中的表达情况以及CTPS基因高表达的胃癌患者的总生存期。以人胃癌MKN-45细胞为实验材料,构建CTPS基因干扰载体,转染MKN-45细胞48 h后,采用qRT-PCR和Western blot检测CTPS基因mRNA和蛋白表达情况。用80 nmol/L的川楝素处理干扰CTPS基因的MKN-45细胞48 h,使用MTT实验法检测细胞存活率,激光共聚焦显微镜观察细胞形态,免疫荧光法检测γH2AX的表达。
结果
生物信息学分析发现CTPS在人胃癌组织中高表达,CTPS基因高表达的胃癌患者总生存期短。向MKN-45细胞中分别转染Sh-ctrl空载体和Sh-CTPS干扰载体,qRT-PCR和Western blot检测显示,与转染Sh-ctrl空载体相比,转染Sh-CTPS干扰载体的MKN-45细胞中CTPS mRNA和蛋白表达均降低,其中转染ShCTPS-3干扰效果最显著,分别降低了85.21%和53%(P < 0.001)。检测细胞存活率及形态变化显示,与Sh-ctrl组相比,ShCTPS-3组细胞存活率降低(P < 0.01),细胞皱缩,形态不规则,呈现凋亡特征,细胞凋亡率升高(P < 0.05);在此基础上用80 nmol/L的川楝素处理转染Sh-ctrl和ShCTPS-3的MKN-45细胞48 h,与Sh-ctrl+川楝素组相比,ShCTPS-3+川楝素组细胞存活率降低(P < 0.001),细胞出现凋亡小体,细胞凋亡率升高(P < 0.05)。
结论
干扰CTPS基因促进川楝素诱导的胃癌MKN-45细胞凋亡。
Keywords: CTPS基因, 川楝素, 胃癌, MKN-45细胞
Abstract
Objective
To investigate the effect of interference of CTPS gene on toosendanin-induced apoptosis of gastric cancer MKN-45 cells.
Methods
Bioinformatic analysis was used to analyze CTPS gene expression in human gastric cancer tissues and the overall survival of gastric cancer patients with high CTPS gene expression. Human gastric cancer MKN-45 cells were transfected with a short hairpin interfering RNA targeting CTPS gene, and 48 h later, qRT-PCR and Western blotting were used to detect cellular expression CTPS at both the mRNA and protein levels. MKN-45 cells with CTPS knockdown were treated with 80 nmol/L toosendanin for 48 h, and the cell viability was assessed with MTT assay; the cell morphology was observed using laser confocal microscope, and the expression of γH2AX was detected with immunofluorescence assay.
Results
Bioinformatic analysis suggested that CTPS was highly expressed in human gastric cancer tissues, and gastric cancer patients with high CTPS gene expression had a shorter overall survival. MKN-45 cells transfected with Sh-CTPS interference vector showed significantly lowered cell survival rate (P < 0.01) with obvious cell shrinkage, irregular morphology, typical apoptotic changes, and increased cell apoptosis rate (P < 0.05). Treatment of the transfected cells with 80 nmol/L toosendanin for 48 h resulted in further reduction of the cell survival rate (P < 0.001), and the cells showed an increased apoptotic rate (P < 0.05) with appearance of apoptotic bodies.
Conclusion
Interference of CTPS gene can promote TSN-induced apoptosis of gastric cancer MKN-45 cells.
Keywords: CTPS gene, toosendanin, gastric cancer, MKN-45 cells
胞苷三磷酸合酶(CTPS) 是合成CTP途径的关键限速酶,CTP的从头合成以谷氨酸作为N源,UTP和ATP作为原材料,CTPS作为CTP从头合成十步反应中的最后一步,也是限速步骤,来催化CTP合成[1]。CTP在合成DNA和RNA的过程中发挥重要作用,并对磷脂代谢和细胞增殖具有一定的影响[2]。因此,CTP合酶在促进活跃的细胞代谢中起着关键作用,特别是在增殖细胞(如干细胞、如淋巴细胞和癌细胞)中,其表达和活性上调。有研究报道CTPS抑制剂被认为是治疗非洲人类锥虫病(HAT)的潜在药物靶点[3]。CTPS在白血病、肝癌和结肠癌等癌细胞中的活性明显升高[4],且在乳腺癌细胞中CTPS表达水平升高与细胞增殖能力增加有关[5]。还有研究发现,人胃癌HGC-27细胞中CTPS高表达[6],并且本实验室前期研究发现在MKN-45细胞中CTPS高表达且能产生CTPS细胞蛇结构[7]。但CTPS基因在胃癌细胞及胃癌组织中的表达分析尚未见报道。
细胞增殖异常是肿瘤细胞的主要特征之一,抑制细胞异常增殖诱导细胞凋亡是治疗肿瘤的机制之一。川楝素具有抗氧化、抗菌等广泛的药理作用[8]。研究表明川楝素能作用于各种肿瘤细胞,并且通过诱导肿瘤细胞分化及凋亡而发挥抗肿瘤作用[9]。在胶质母细胞瘤中,川楝素通过诱导雌激素受体β(ERβ)和p53高表达发挥抗癌作用[10]。在动物肿瘤模型研究中,川楝素具有良好的耐受性,可抑制骨肉瘤的生长和转移[11]。此外,川楝素还可以通过mir-23a-3p介导的Bcl-2的下调来诱导人胃癌MKN-45细胞凋亡[12]。细胞增殖、分化以及凋亡与细胞内核酸代谢密切相关,川楝素可通过多种机制影响肿瘤细胞增殖和凋亡,但CTPS基因表达变化在川楝素诱导胃癌MKN-45细胞凋亡中的作用仍未知。因此,本实验以人胃癌MKN-45细胞为实验材料,探究干扰CTPS基因对川楝素诱导的胃癌MKN-45细胞凋亡的影响。
1. 材料和方法
1.1. 细胞培养与试剂
1.1.1. 胃癌MKN-45细胞培养
人胃癌MKN-45细胞(北纳创联生物技有限公司)用RPMI 1640完全培养基(10%胎牛血清、50 mg/L青霉素和60 mg/L链霉素),在37 ℃、5%CO2的细胞培养箱中培养。
1.1.2. 抗体
CTPS一抗(武汉三鹰生物技术有限公司)。Anti-gamma H2AX(ab2893)一抗(abcam), Goat anti-Rabbit IRDye800CW二抗(LI-COR)。山羊抗兔Alexa Fluor 488-conjugated-IgG二抗(北京博奥森生物技术有限公司)。
1.1.3. 主要试剂
川楝素(成都植标化纯生物技术有限公司)。Opti-MEM,RPMI 1640培养基(Gibco Invitrogen)。胎牛血清(Biological Industries Israel Beit-Haemek)。ReverTra Ace® qPCR RT Master Mix with gDNA Remover [东洋纺(上海)生物科技有限公司]。Dpn Ⅰ和TB Green® Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)(宝日医生物技术(北京)有限公司)。DAPI、抗荧光淬灭剂和4%-多聚甲醛(碧云天生物技术公司)。BamH Ⅰ、Hind Ⅲ和T4连接酶(ThermoFisher Scientific)。去内毒质粒抽提试剂盒(Omega)。
1.2. 生物信息学分析
使用TNMplot(https://tnmplot.com/analysis/)在线数据库分析CTPS在癌旁组织(n=273)与胃癌组织(n=273)中的表达情况;使用Kaplan-Meier plotter(http://kmplot.com/analysis/index.php?p=service)在线数据库,以患者胃癌组织中CTPS表达量的中位数为界将患者分为CTPS高表达组和低表达组,分析CTPS高表达和低表达患者的总生存期。
1.3. CTPS基因干扰载体的构建及鉴定
首先使用https://rnaidesigner.invitrogen.com/rnaiexpress/网站设计CTPS RNAi干扰片段,将干扰候选位点在NCBI中Blast比对,筛选出3个与其他基因同源性低的片段,根据RNAi干扰载体设计原则,加入Loop环、反向互补序列以及两端分别加上BamH Ⅰ和HindⅢ酶切位点,以上下游的形式送去生物公司合成,合成序列如下:
pRNA-H1.1/Shuttle-RFP-ShCTPS-1,
5’-GATCCGGCGTTAATACCTGTAGATGACGAATCATCTACAGGTATTAACGCCTTTTTTA-3’,
5’-AGCTTAAAAAAGGCGTTAATACCTGTAGATGATTCGTGTTCCTCGAACACCAAATCCG-3’;pRNA-H1.1/Shuttle-RFP-ShCTPS-2,
5’-GATCCGGATTTGGTGTTCGAGGAACACGAATGTTCCTCGAACACCAAATCCTTTTTTA-3’,
5’-AGCTTAAAAAAGGATTTGGTGTTCGAGGAACATTCGTGTTCCTCGAACACCAAATCCG-3’;pRNA-H1.1/Shuttle-RFP-ShCTPS-3,
5’-GATCCGGATGGCAAGATGCCAATTCTCGAAAGAATTGGCATCTTGCCATCCTTTTTTA-3’,
5’-AGCTTAAAAAAGGATGGCAAGATGCCAATTCTTTCGAGAATTGGCATCTTGCCATCCG-3’。
合成的片段退火后与经BamHⅠ、Hind Ⅲ双酶切的pRNA-H1.1/Shutle-RFP质粒相连,将连接好的产物进行转化,琼脂糖凝胶电泳检测,将电泳检测后符合目的条带大小的质粒所对应菌液送出测序,测序结果进行Blast比对,比对成功的菌液进行提取质粒,用于后续细胞转染。
1.4. 荧光定量检测CTPS mRNA表达情况
将CTPS干扰载体转染人胃癌MKN-45细胞48 h后,Trizol法提取总RNA,利用ReverTra Ace® qPCR RT Master Mix with gDNA Remover(东洋纺)反转录试剂盒将RNA反转录成cDNA,以cDNA为模板,进行qRT-PCR检测,以β-actin为内参,反应体系10 μL:TB Green Premix Ex TaqⅡ 5 μL,cDNA样品2 μL,上下游引物各0.5 μL,DEPC-treated H2O 2 μL。反应条件如下:95 ℃预变性30 s,95 ℃ 5 min,60 ℃ 30 s,40个循环,每组实验重复3次,得到每组样品的Ct值,运用2-△△Ct法计算CTPS的相对表达量。引物序列:CTPS基因上游引物为5'- CGACGGATCCATGAAGTACATTCTGGT T- 3',下游引物为5'- CGACCTCGAGTCAGTCATGATTTATTGATGG-3';β-actin基因上游引物为5'- TCACCCACACTGTGCCCCATCTACGA- 3',下游引物为5'-CAGCGGAACCGCTCATTGCCAATGG-3'。
1.5. Western blot检测CTPS蛋白表达情况
将CTPS干扰载体转染人胃癌MKN-45细胞48 h后,提取细胞总蛋白,95 ℃,5 min后,蛋白进行SDSPAGE凝胶电泳,200 mA湿转2 h,将蛋白转移到PVDF膜上,封闭液(含5%的脱脂奶粉的TBST),室温封闭1 h,TBST洗3次(10 min/次),CTPS一抗4 ℃孵育过夜,回收一抗,TBST洗3次,4 ℃条件下二抗避光孵育1 h,TBST洗3次,利用Odyssey仪器扫描检测进行扫膜并进行条带分析。
1.6. MTT法检测细胞存活率
取人胃癌MKN-45细胞按照1×104/mL密度传至96孔板中,转染各干扰载体后继续培养48 h,再加入80 nmol/L川楝素处理细胞48 h。每孔内加入10 μL MTT溶液,37 ℃恒温培养箱避光孵育4 h。弃掉培养基,每孔内加入100 μL DMSO。4 ℃摇床避光孵育10 min,波长为490 nm测A490 nm值,计算细胞存活率,细胞存活率=实验组/对照组×100%
1.7. 激光共聚焦显微镜下观察细胞形态
将人胃癌MKN-45细胞传至已放入细胞爬片的24孔板中,待细胞生长至对数生长期,将CTPS干扰载体转染到细胞中培养48 h,再加入80 nmol/L川楝素作用48 h,预冷的PBS洗1~2次,加入500 μL/孔4%多聚甲醛,4 ℃固定30 min后PBS洗1~2次。加入200 μL/孔吖啶橙(0.5 μg/μL),室温孵育3~5 min,PBS洗1~2次。向无水乙醇泡过的载玻片上滴加10 μL抗荧光淬灭剂,将细胞爬片上带有细胞的一面扣在载玻片上,利用激光共聚焦显微镜观察各组细胞形态结构并拍照。
1.8. 免疫荧光检测γH2AX表达
将人胃癌MKN-45细胞传至已放入细胞爬片的12孔板中,在细胞对数生长期时,将CTPS干扰载体转染到细胞中继续培养48 h,加入80 nmol/L的川楝素作用48 h。弃去培养基,1×PBS洗涤,每孔加入500 μL 4% 多聚甲醛4 ℃固定30 min。弃去固定液,用0.1% 1× PBS-Triton渗透液500 μL在4 ℃摇床上清洗细胞3次,5 min/次。弃去渗透液,加入500 μL的封闭液(1%BSA)37 ℃静置孵育1 h。弃去封闭液,加入Anti-gamma H2AX(ab2893)一抗4 ℃孵育过夜。再用0.1% 1×PBS-Triton溶液清洗细胞3次,5 min/次,加入Alexa Fluor® 488二抗,室温避光孵育1 h。加入500 μL/孔的0.1% 1×PBSTriton清洗细胞3次,5 min/次。然后加入50 μL/孔的DAPI室温孵育3 min。加入500 μL/孔的0.1% 1×PBSTriton清洗细胞3次,5 min/次,将细胞爬片扣放在滴加了抗荧光淬灭封片液的载玻片上,避光保存,在激光共聚焦显微镜下观察并拍照。
1.9. 统计学分析
实验数据采用Graphpad Prism 5软件进行分析处理,计量数据以均数±标准差表示,组间比较采用单因素方差分析;癌旁及胃癌组织表达差异采用箱线图表示,组间比较采用t检验分析;总生存期采用Kaplan-Meier(K-M)曲线表示,组间比较采用logrank检验,P < 0.05为差异有统计学意义。
2. 结果
2.1. CTPS基因在人胃癌组织中表达情况及预后关系
TNMplot在线数据库结果显示,与癌旁组织相比,胃癌组织中CTPS表达升高(图 1A)。Kaplan-Meier plotter在线数据库评估CTPS在胃癌患者中的预后,结果显示,CTPS高表达胃癌患者的总生存期比CTPS低表达胃癌患者的总生存期短(图 1B)。
图 1.

生物信息学分析CTPS在胃癌组织中的表达(A)以及患者的总生存期(B)
Bioinformatics analysis of CTPS expression in gastric cancer tissues (A) and overall survival of the patients (B).
2.2. CTPS干扰载体构建及干扰效率检测
根据GenBank中CTPS基因(NM: 001905.4)CDS区设计3个干扰片段,定向克隆到pRNA-H1.1/ShuttleRFP载体中,经测序鉴定,重组载体的干扰序列与设计的CTPS 3个干扰片段完全匹配(图 2),重组质粒构建成功。
图 2.

pRNA-H1.1/Shuttle-RFP-ShCTPS载体测序图谱
Sequencing results of pRNA-H1.1/Shuttle-RFP-ShCTPS. A: Structure of the CTPS interference fragment. B: Sequencing peak maps.
将构建成功的干扰载体转染MKN-45细胞,qRTPCR和Western blot检测CTPS基因表达情况,转染48 h后,细胞中CTPS mRNA和蛋白表达均降低,其中转染pRNA-H1.1/Shuttle-RFP-ShCTPS-3干扰效率最高,CTPS mRNA和蛋白表达分别降低了85.21%和53%(P < 0.01,图 3)。
图 3.

转染干扰载体后MKN-45细胞中CTPS mRNA(A)和蛋白(B)表达水平
CTPS mRNA (A) and protein (B) expression levels in MKN-45 cells after transfection with the interference vector. **P < 0.01 vs Sh-ctrl, ***P < 0.001 vs Sh-ctrl.
2.3. 干扰CTPS对胃癌MKN-45细胞存活率影响
MTT法检测细胞存活率,与Sh-ctrl组相比,转染ShCTPS-3后细胞存活率降低了41.9%;将转染48 h后的MKN-45细胞再经川楝素处理,与Sh-ctrl+川楝素组相比,ShCTPS-3+川楝素组细胞存活率降低了46%(P < 0.001,图 4)。
图 4.

MTT法检测干扰CTPS后川楝素诱导的MKN-45细胞存活率
Survival rate of MKN- 45 cells induced by TSN after interference of CTPS detected using MTT assay. A: Cell viability in ShCTPS-3 group (**P < 0.01 vs Sh-ctrl). B: Cell viability in ShCTPS-3+TSN group (***P < 0.001 vs Sh-ctrl+TSN).
2.4. 干扰CTPS对胃癌MKN-45细胞凋亡形态的影响
激光共聚焦显微镜下观察细胞形态,与Sh-ctrl组相比,转染ShCTPS-3干扰载体后,细胞皱缩,细胞形态不规则,细胞数量相对减少,呈现凋亡特征;在此基础上,用川楝素处理转染后的细胞,结果显示与Sh-ctrl+川楝素组相比,转染ShCTPS-3 48 h后再用川楝素处理48 h,细胞数量更少,染色质固缩且边缘化,出现凋亡小体(图 5)。
图 5.
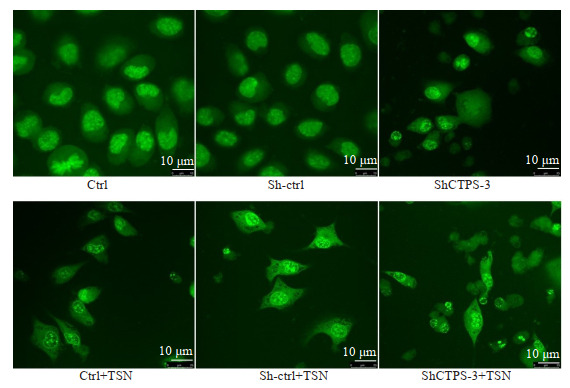
激光共聚焦显微镜下观察干扰CTPS后川楝素诱导的MKN-45细胞凋亡形态
Observation of apoptotic morphology of MKN-45 cells induced by toosendanin after CTPS interference under a laser confocal microscope (scale bar=10 μm).
2.5. 干扰CTPS对细胞凋亡的影响
将CTPS基因的干扰载体转染人胃癌MKN-45细胞48 h后,免疫荧光法检测γH2AX的表达,分析干扰CTPS基因对细胞凋亡率的影响。与Sh-ctrl组相比,转染ShCTPS-3后细胞凋亡率升高了31.76%;在此基础上,用川楝素处理转染后的细胞,结果显示与Sh-ctrl+川楝素组相比,ShCTPS-3+川楝素组细胞凋亡率升高41.10%(P < 0.05,图 6)。
图 6.

干扰CTPS基因对川楝素诱导的MKN-45细胞凋亡的影响
Effect of CTPS gene interference on the apoptosis of MKN- 45 cells induced by toosendanin (scale bar=25 μm). A: Cells transfected with CTPS interference vector for 48 h. B: Quantitative analysis of the rate of γH2AX positive cells (*P < 0.05 vs Sh-ctrl). C: Cells treated with toosendanin for 48 h after transfection with CTPS interference vector. D: Quantitative analysis of the rate of γH2AX positive cells (*P < 0.05 vs Sh-ctrl+TSN).
3. 讨论
癌症形成后细胞会异常增殖,对RNA和DNA的需求增加,从而对组装RNA和DNA的前体物质需求也会增加。然而,胞苷三磷酸(CTP)是合成RNA和DNA的必要前体,CTP合成酶(CTPS)是合成CTP生物合成途径中的关键酶,影响DNA和RNA的合成因而在细胞周期进程中起着重要作用[2]。有研究发现在静息的T细胞中CTPS表达低,但在TCR激活后迅速上调[13],说明在免疫反应过程中CTPS能够使淋巴细胞维持稳定增殖。还有研究报道,在白血病细胞中,CTPS的缺陷有效抑制细胞增殖[14];在果蝇癌症模型中,敲低CTPS可降低肿瘤的形成[15],暗示CTPS活性变化可能与癌症形成有关。因此,探究CTPS表达变化在癌细胞增殖凋亡中的作用具有重要意义。本实验首先利用TNMplot和Kaplan-Meier plotter在线数据库对胃癌组织及癌旁组织中CTPS表达进行分析,发现与正常组织相比,胃癌组织中CTPS表达显著升高。同时CTPS高表达胃癌患者的总生存期较短。因此,推测降低CTPS基因的表达能够使胃癌MKN-45细胞增殖受到抑制。随后构建了CTPS干扰载体,经实验前期验证转染48 h的转染效率最佳,细胞状态最好。因此转染MKN-45细胞48 h,qRT-PCR和Western blot检测细胞中CTPS mRNA和蛋白表达均降低,说明干扰载体构建成功,并且筛选出ShCTPS-3干扰效率最高,用于后续探究降低CTPS基因能否促进川楝素诱导胃癌MKN-45细胞凋亡。
川楝素是一种四环三萜类化合物,它是从楝属植物的皮或果实中提取出来的[16],被作为是一种治疗癌症的潜在药物[3]。川楝素提取物抑制体内和体外癌细胞的增殖并诱导其凋亡,凋亡的机制涉及线粒体途径和死亡受体途径[17]。有研究发现川楝素可以诱导人胃癌MGC-803细胞[18],人卵巢癌A2870细胞[19]和人肺癌A549细胞[20]凋亡,并且川楝素以剂量依赖性方式抑制尤文肉瘤细胞的生长,并触发线粒体凋亡途径以诱导细胞凋亡[21]。本实验室前期研究表明川楝素抑制人胃癌MKN-45、MGC-803、SGC-7901细胞增殖诱导凋亡,同时川楝素能够使MKN-45和MGC-803细胞形态学发生变化,其中MKN-45细胞的变化最为明显,并且80 nmol/L的川楝素作用人胃癌MKN-45细胞48 h能诱导细胞凋亡[7, 18, 23-24],因此,川楝素在很大程度上能够作为一种潜在的抗肿瘤药物来诱导胃癌MKN-45细胞凋亡。本实验选择80 nmol/L的川楝素诱导48 h进行实验。将构建成功的干扰载体转染人胃癌MKN-45细胞48 h,结果发现转染ShCTPS-3后细胞存活率降低了41.9%,且细胞形态不规则,呈现凋亡特征;再加入80 nmol/L的川楝素诱导48 h,与Sh-ctrl+川楝素组相比,细胞存活率降低了46%,凋亡特征更明显,染色质固缩、边缘化,且出现凋亡小体。有研究称,与富含G1期或S期的正常T淋巴细胞样品相比,MOLT-3样品(恶性T淋巴细胞)显示出CTP合成酶的活性增加[25],然而本实验结果表明降低CTPS基因的表达可以使胃癌MKN- 45细胞凋亡,并且促进川楝素诱导的胃癌MKN-45细胞凋亡。
细胞凋亡是将多余的和已完成使命的或异常的细胞按照一定的程序进行生理上的死亡,细胞凋亡的过程维持内环境稳定,并且在机体的生理过程中发挥至关重要的作用[26-29]。细胞凋亡过程中细胞染色质DNA发生损伤,DNA长链断裂成长度为200 bp左右的片段。有研究表明,γH2AX是DNA损伤的标志物,γH2AX的存在与细胞的复制应激、缺氧和细胞凋亡等状态有关[30]。抗癌中的放射疗法就是通过破坏DNA来阻碍细胞增殖和发挥功能的一种方法,当DNA双链断裂发生损伤时组蛋白H2AX被磷酸化为γH2AX,大量的γH2AX会聚集于损伤位点,通过使用针对γH2AX的抗体来测量患者治疗前后的DNA损伤水平从而判断放疗的治疗效果[31-33]。因此为了验证干扰CTPS基因是否促进川楝素诱导的胃癌MKN- 45细胞凋亡,利用免疫荧光方法检测γH2AX的分布情况。实验结果表明,转染ShCTPS-3后细胞核内γH2AX量增多,统计结果表明细胞凋亡率升高了31.76%;在转染ShCTPS-3 48 h的基础上加入80 nmol/L的川楝素诱导48 h,细胞核内γH2AX量显著升高,与Sh-ctrl+川楝素组相比,细胞凋亡率升高了41.10%,说明干扰CTPS基因能够促进川楝素诱导的人胃癌MKN-45细胞凋亡。有研究发现,CTPS还可以减弱顺铂处理的骨髓源性巨噬细胞(原代细胞)中细胞的损伤[34],从而说明CTPS可以减轻化疗药物引起的副作用,因此探究CTPS基因的表达可以为治疗癌症提供新思路。
综上所述,本研究通过生物信息学分析以及体外实验发现,胃癌组织中CTPS高表达且CTPS高表达胃癌患者的总生存期较短。干扰CTPS基因后胃癌MKN-45细胞存活率降低并且呈现凋亡形态。再加入80 nmol/L的川楝素诱导48 h后,细胞存活率以及凋亡程度更显著。上述结果表明干扰CTPS基因能够促进川楝素诱导的人胃癌MKN-45细胞凋亡。因此CTPS可作为癌症的潜在治疗靶点。
Biography
罗海静,在读硕士研究生,E-mail: 837701979@qq.com
Funding Statement
国家青年科学基金(31801148);黑龙江省自然科学基金(LH2021C099);黑龙江省教育厅基本业务专项(135109255);黑龙江省省属高等学校基本科研业务费科研项目(植物性食品加工技术特色学科专项)(YSTSXK201874);2020年齐齐哈尔大学研究生创新科研项目(YJSCX2020045)
Supported by National Youth Science Foundation of China(31801148)
Contributor Information
罗 海静 (Haijing LUO), Email: 837701979@qq.com.
张 伟伟 (Weiwei ZHANG), Email: zww121@163.com.
References
- 1.Levitzki A, Koshland DE Jr. Cytidine triphosphate synthetase. Covalent intermediates and mechanisms of action. Biochemistry. 1971;10(18):3365–71. doi: 10.1021/bi00794a008. [DOI] [PubMed] [Google Scholar]
- 2.Huang Y, Wang JJ, Ghosh S, et al. Critical roles of CTP synthase N-terminal in cytoophidium assembly. Exp Cell Res. 2017;354(2):122–33. doi: 10.1016/j.yexcr.2017.03.042. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Tamborini L, Pinto A, Smith TK, et al. Synthesis and biological evaluation of CTP synthetase inhibitors as potential agents for the treatment of African trypanosomiasis. ChemMedChem. 2012;7(9):1623–34. doi: 10.1002/cmdc.201200304. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Williams JC, Kizaki H, Weber G, et al. Increased CTP synthetase activity in cancer cells. Nature. 1978;271(5640):71–3. doi: 10.1038/271071a0. [DOI] [PubMed] [Google Scholar]
- 5.Beberok A, Wrześniok D, Rok J, et al. Ciprofloxacin triggers the apoptosis of human triple-negative breast cancer MDA-MB-231 cells via the p53/Bax/Bcl-2 signaling pathway. Int J Oncol. 2018;52(5):1727–37. doi: 10.3892/ijo.2018.4310. [DOI] [PubMed] [Google Scholar]
- 6.Feng MY, Wang K, Shi QT, et al. Gene expression profiling in TWIST-depleted gastric cancer cells. Anat Rec (Hoboken) 2009;292(2):262–70. doi: 10.1002/ar.20802. [DOI] [PubMed] [Google Scholar]
- 7.陈 雯, 张 伟伟, 潘 阳, et al. 川楝素对人胃癌细胞MKN-45中CTPS细胞蛇形成的影响及其机制. 中国应用生理学杂志. 2020;36(6):633-6, 647. [Google Scholar]
- 8.李 海波, 马 森菊, 石 丹枫, et al. 川楝子的化学成分、药理作用及其毒性研究进展. 中草药. 2020;51(15):4059–74. doi: 10.7501/j.issn.0253-2670.2020.15.027. [DOI] [Google Scholar]
- 9.王 小娟, 刘 妍如, 肖 炳坤, et al. 川楝素抗肿瘤作用机制研究进展. 科学技术与工程. 2011;11(2):281–5. doi: 10.3969/j.issn.1671-1815.2011.02.013. [DOI] [Google Scholar]
- 10.Zhang S, Cao L, Wang ZR, et al. Anti-cancer effect of toosendanin and its underlying mechanisms. J Asian Nat Prod Res. 2019;21(3):270–83. doi: 10.1080/10286020.2018.1451516. [DOI] [PubMed] [Google Scholar]
- 11.Zhang T, Li J, Yin F, et al. Toosendanin demonstrates promising antitumor efficacy in osteosarcoma by targeting STAT3. Oncogene. 2017;36(47):6627–39. doi: 10.1038/onc.2017.270. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Shao SL, Li SS, Liu C, et al. Toosendanin induces apoptosis of MKN-45 human gastric cancer cells partly through miR-23a-3p-mediated downregulation of BCL2. Mol Med Rep. 2020;22(3):1793–802. doi: 10.3892/mmr.2020.11263. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Martin E, Palmic N, Sanquer S, et al. CTP synthase 1 deficiency in humans reveals its central role in lymphocyte proliferation. Nature. 2014;510(7504):288–92. doi: 10.1038/nature13386. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Martin E, Minet N, Boschat AC, et al. Impaired lymphocyte function and differentiation in CTPS1-deficient patients result from a hypomorphic homozygous mutation. JCI Insight. 2020;5(5):e133880. doi: 10.1172/jci.insight.133880. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Willoughby LF, Schlosser T, Manning SA, et al. An in vivo largescale chemical screening platform using Drosophila for anti-cancer drug discovery. Dis Model Mech. 2013;6(2):521–9. doi: 10.1242/dmm.009985. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.董 庆海, 李 雅萌, 吴 福林, et al. 川楝子的研究进展. 特产研究. 2018;40(1):63–8. [Google Scholar]
- 17.Liu XL, Wang H, Zhang L, et al. Anticancer effects of crude extract from Melia toosendan Sieb. et Zucc on hepatocellular carcinoma in vitro and in vivo. Chin J Integr Med. 2016;22(5):362–9. doi: 10.1007/s11655-015-2084-7. [DOI] [PubMed] [Google Scholar]
- 18.徐 兴军, 李 珊珊, 刘 畅, et al. 川楝素诱导人胃癌MGC-803细胞凋亡及其机制. 中国应用生理学杂志. 2021;37(3):262-5, 292. doi: 10.12047/j.cjap.6108.2021.004. [DOI] [PubMed] [Google Scholar]
- 19.李 雨颖, 邵 喜英, 金 莉婷, et al. 川楝素通过Fas/FasL信号通路诱导人卵巢癌细胞凋亡. 中国中西医结合杂志. 2019;39(9):1089–94. [Google Scholar]
- 20.刘 盛楠, 邵 淑丽, 王 维熠, et al. 川楝素诱导人肺癌A549细胞凋亡. 中国细胞生物学学报. 2015;37(8):1087–94. [Google Scholar]
- 21.Gao T, Xie A, Liu XQ, et al. Toosendanin induces the apoptosis of human Ewing's sarcoma cells via the mitochondrial apoptotic pathway. Mol Med Rep. 2019;20(1):135–40. doi: 10.3892/mmr.2019.10224. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.李 珊珊, 刘 畅, 朱 少伟, et al. 川楝素通过死亡受体途径诱导人胃癌MGC-803细胞凋亡. 基因组学与应用生物学. 2021;40(S2):2883–8. [Google Scholar]
- 23.杜 洋, 邵 淑丽, 刘 畅, et al. 川楝素对人胃癌MGC-803细胞增殖的影响. 基因组学与应用生物学. 2021;40(S3):3337–43. [Google Scholar]
- 24.苗 长久. 川楝素对人胃癌SGC-7901细胞增殖的影响. 基因组学与应用生物学. 2020;39(7):3197–202. [Google Scholar]
- 25.van den Berg AA, van Lenthe H, Kipp JB, et al. Cytidine triphosphate (CTP) synthetase activity during cell cycle progression in normal and malignant T-lymphocytic cells. Eur J Cancer. 1995;31A(1):108–12. doi: 10.1016/0959-8049(94)00442-8. [DOI] [PubMed] [Google Scholar]
- 26.Dai XL, Zhou SL, Qiu J, et al. Correlated expression of Fas, NFkappaB, and VEGF-C in infiltrating ductal carcinoma of the breast. Eur J Gynaecol Oncol. 2012;33(6):633–9. [PubMed] [Google Scholar]
- 27.Dai ZJ, Wang XJ, Li ZF, et al. Scutellaria barbate extract induces apoptosis of hepatoma H22 cells via the mitochondrial pathway involving caspase-3. World J Gastroenterol. 2008;14(48):7321–8. doi: 10.3748/wjg.14.7321. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.曹 慧娟, 贾 永森, 闫 昕, et al. 黄芩素诱导肿瘤细胞凋亡的研究进展. 中华中医药学刊. 2017;35(4):946–8. [Google Scholar]
- 29.王 瑜, 柯 瑞君, 蒋 盼若, et al. 杨芽黄素对前列腺癌细胞凋亡的影响及其机制. 中国应用生理学杂志. 2019;35(3):283–8. doi: 10.12047/j.cjap.5754.2019.059. [DOI] [PubMed] [Google Scholar]
- 30.Shah K, Cornelissen B, Kiltie AE, et al. Can γH2AX be used to personalise cancer treatment? Curr Mol Med. 2013;13(10):1591–602. doi: 10.2174/1566524013666131111124531. [DOI] [PubMed] [Google Scholar]
- 31.王 丽娜, 罗 志, 张 立. DNA损伤及其标志物γ-H2AX检测的研究进展. 分析试验室. 2020;39(10):1131–6. [Google Scholar]
- 32.Shah K, Boghozian RA, Kartsonaki C, et al. γH2AX expression in cytological specimens as a biomarker of response to radiotherapy in solid malignancies. Diagn Cytopathol. 2016;44(2):141–6. doi: 10.1002/dc.23396. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Redon CE, Nakamura AJ, Zhang YW, et al. Histone γH2AX and poly (ADP-ribose) as clinical pharmacodynamic biomarkers. Clin Cancer Res. 2010;16(18):4532–42. doi: 10.1158/1078-0432.CCR-10-0523. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Byun EB, Song HY, Kim WS, et al. Protective effect of polysaccharides extracted from Cudrania tricuspidata fruit against cisplatin-induced cytotoxicity in macrophages and a mouse model. Int J Mol Sci. 2021;22(14):7512–21. doi: 10.3390/ijms22147512. [DOI] [PMC free article] [PubMed] [Google Scholar]


