Abstract
Introduction
Le sexe masculin a été démontré comme étant un facteur de risque d’infection par la COVID-19, et les hommes sont plus susceptibles de développer une maladie grave. L’objectif de cette étude était d’évaluer l’effet de la déprivation androgénique (TDA) sur l’incidence et la sévérité de l’infection au SARS-CoV-2 chez les patients traités pour cancer de prostate.
Méthodes
Nous avons réalisé une revue systématique et une méta-analyse après consultation des bases de données PubMed, Scopus et ClinicalTrial.org pour la période entre janvier 2020 et mars 2022. Les analyses ont été faites par des Forest plots pour les points d’intérêt suivants (infection, hospitalisation, admission à l’USI et décès dus au SARS-CoV-2) avec des modèles aléatoires ou fixes.
Résultats
Quinze articles ont été inclus dans notre revue systématique et dix dans la méta-analyse. Sept études ont évalué le risque d’infection sous TDA : OR = 1,11 (95 % IC : [0,48-2,58] ; p = 0,81). Six études ont évalué le risque d’hospitalisation sous TDA : OR = 1,58 (95 % IC : [0,94-2,64] ; p = 0,08). Sept études ont évalué le risque d’admission à l’USI sous TDA : OR = 0,90 (95 % IC : [0,71-1,13] ; p = 0,37). Neuf études ont évalué le risque de mortalité sous TDA : OR = 1,07 (95 % IC : [0,61-1,87] ; p = 0,82).
Conclusion
La déprivation androgénique chez les patients atteints d’un cancer de la prostate, ne protège ni contre l’infection par le virus SARS-CoV-2, ni contre les formes sévères et la mortalité. Ces résultats doivent être interprêtés avec prudence vue la nature rétrospective de la majorité des études incluses dans notre méta-analyse.
Mots clés: Cancer de prostate, Déprivation androgénique, COVID-19, Risque d’infection, Hospitalisation, Mortalité
Abstract
Introduction
Male gender has been shown to be a risk factor for COVID-19 infection, and men are more likely to develop severe disease. The aim of this study was to evaluate the effect of androgen deprivation therapy (ADT) on the incidence of infection and severity of SARS-CoV-2 in prostate cancer patients.
Methods
A systematic review and meta-analysis were performed after searching PubMed, Scopus, and ClinicalTrial.org databases, between January 2020 and March 2022. Analyses were interpreted through forest plots for the following parameters: risk of infection, hospitalization, intensive care admission, and SARS-CoV-2-related death, with random or fixed-effects models.
Results
Fifteen articles were included in the systematic review and ten in the meta-analysis. Seven studies evaluated risk of infection in patients on ADT: OR = 1.11 (95 % IC : [0.48–2.58] ; P = 0.81). Six studies evaluated the risk of hospitalization in patients on ADT: TDA : OR = 1.58 (95 % IC : [0.94–2.64] ; P = 0.08). Seven studies evaluated risk of ICU admission in patients on ADT: OR = 0.90 (95 % IC : [0.71–1.13] ; P = 0.37). Nine studies evaluated mortality risk in patients on ADT: OR = 1.07 (95 % IC : [0.61–1.87] ; P = 0.82).
Conclusion
ADT does not protect against SARS-CoV-2 in prostate cancer patients, nor does it protect against hospitalization, ICU admission, or mortality. These results remain questionable given the retrospective nature of the majority of studies included in our meta-analysis.
Keywords: Prostate cancer, Androgen deprivation therapy, COVID-19, Risk of infection, Hospitalization, Mortality
Introduction
En mars 2020, l’Organisation Mondiale de la Santé (OMS) annonçait que la maladie à coronavirus 2019 était devenue une pandémie dont l’agent causal était le severe acute respiratory syndrome coronavirus-2 (SARS-CoV-2). En août 2022, 4 466 095 cas ont été confirmés en Belgique, avec plus de 134 231 hospitalisations et 32 436 décès [1], [2]. Plusieurs facteurs de risque de gravité de la maladie ont été identifiés comme le diabète, le cancer, les maladies cardio-vasculaires, les maladies auto-immunes et les maladies pulmonaires [3], [4], [5].
Il a été rapporté dans certaines études que le risque d’infection par la COVID-19 était plus important pour le sexe masculin [6], et que les hommes étaient plus à risque de développer des formes graves de la maladie nécessitant une hospitalisation avec oxygénothérapie, un séjour en Unité de Soins Intensifs (USI) et une augmentation du nombre de décès [3], [4], [6], [7].
Les particularités hormonales propres aux deux sexes ont été démontrées comme cruciales dans la modulation du système immunitaire. La testostérone a un effet immunosuppresseur, alors que les œstrogènes ont plutôt un effet positif sur la médiation humorale avec un meilleur contrôle sur la tempête de cytokines [8], [9].
Cette différence de risque entre les deux sexes pourrait être expliquée par la physiopathologie de l’infection par le SARS-CoV2 lui-même. Afin de pénétrer dans les cellules hôtes, le virus nécessite la liaison de la protéine Spike virale (S) au récepteur de l’enzyme de conversion de l’angiotensine 2 (ACE2) et l’activation de la protéine S par la sérine protéase transmembranaire de type II (TMPRSS2) [9], [10]. TMSPRSS2, présente une sécrétion androgéno-dépendante et son expression est retrouvée au sein des voies génito-urinaires masculines, comme la prostate [9], [10].
Tenant compte de cette différence entre les deux sexes, il est apparu logique de se poser la question de l’influence potentielle d’un traitement par déprivation androgénique (TDA). Le cancer de la prostate étant hormono-dépendant, le rôle du TDA est de supprimer la sécrétion d’androgènes pour les cancers avancés. Le modèle des patients ayant une néoplasie de prostate traités par TDA a été utilisé pour évaluer le risque d’infection et la gravité de la maladie liée à la COVID-19. Les résultats dans la littérature sont conflictuels : bien que des études ont montré un effet bénéfique du TDA [7], [11], [12], d’autres études n’ont pas montré une différence entre les patients ayant un cancer de prostate sous TDA et ceux qui ne sont pas sous TDA [6], [10], [13], [14], [15], [16].
L’objectif de ce travail a été d’effectuer une revue systématique de la littérature et une méta-analyse évaluant l’effet de l’hormonothérapie de déprivation androgénique sur l’incidence et la gravité de l’infection COVID-19, chez les patients atteints de cancer de prostate.
Matériels et méthodes
Recherche bibliographique
Les critères PICO ont été utilisés pour formuler la question clé de recherche.
-
•
P : Patients avec Cancer de la prostate.
-
•
I : sous hormonothérapie/déprivation androgénique.
-
•
C : ceux qui ne sont pas sous hormonothérapie.
-
•
O : risque d’infection COVID-19, et forme grave ou pas de COVID-19 (Hospitalisation, Soins Intensifs, Décès).
Les termes suivants ont été choisis pour l’approche de recherche : ((COVID-19) OR (SARS-CoV-2)) and ((ANDROGEN DEPRIVATION) OR (HORMONAL THERAPY) OR (HORMONE THERAPY)) and (PROSTATE CANCER). Les bases de données PubMed et Scopus, ainsi que clinicaltrials.gov ont été revues entre janvier 2020 et mars 2022. Des articles ont également été trouvés par des références croisées lors de la recherche. Afin d’avoir un spectre large des articles, aucun filtre n’a été utilisé. La gestion des articles a été prise en charge à l’aide du logiciel gestionnaire de références ZOTERO®.
Tout type d’hormonothérapie utilisé dans le cadre du cancer de prostate a été inclus : anti-androgènes, hormonothérapie de première génération (agonistes et antagonistes de la GnRH) et hormonothérapie de deuxième génération (enzalutamide, abiratérone, darolutamide, etc.).
Deux auteurs ont effectué la recherche (NGM et GM). Les divergences ont été résolues par le superviseur de l’étude (TR).
Critères d’inclusion et d’exclusion
L’anglais a été, par défaut, la langue de recherche. Les langues permises pour l’inclusion des articles étaient l’&nglais et le français. Tout type d’articles originaux prospectifs ou rétrospectifs ont été inclus. Nous avons sélectionné la période de janvier 2020 jusqu’à mars 2022. Les méta-analyses, les revues systématiques, les revues narratives, les actes de conférences ainsi que les analyses critiques d’articles ont été exclus. Les articles jugés non éligibles qui n’avaient abordé que partiellement le sujet ont été éliminés après l’analyse de leur abstract et du texte. Les articles sans bras contrôle et ceux avec des données indisponibles n’ont pas été retenus pour la méta-analyse.
Le diagramme PRISMA a été utilisé pour l’inclusion et l’exclusion des articles.
Collecte des données
Les variables collectées étaient les suivantes : le premier auteur, le type d’étude, l’année de publication, le nombre total des patients, le nombre des patients sous TDA/ non sous TDA, type de TDA, OR à l’IC de 95 % des différents points d’intérêt de la recherche: hospitalisation, admission à l’unité de soins intensifs (USI) et décès parmi les 2 groupes. Ces variables ont été regroupées dans un fichier EXCEL, de manière à être analysées par le logiciel « Review Manager 5.4 ».
Statistiques
Une analyse statistique de type Forest plot (sous le modèle Mantel-Haenszel) a été réalisée afin d’analyser le odds ratio (OR) avec un Intervalle de confiance (IC) de 95 % de l’influence du COVID-19 chez les patients sous TDA dans les cas d’infection à SARS-CoV-2, de l’hospitalisation, de l’admission à USI et du décès. L’hétérogénéité statistique des différentes études incluses a été évaluée par I2, Chi2 et Tau2. Un modèle à effets aléatoires (Random effects model) avec une analyse de la sensibilité, a été utilisé pour les études ayant un indice d’hétérogénéité I2 > 50 %, alors qu’un modèle à effets fixe (Fixed effects model) a été utilisé pour les études ayant un I2<50 %. Un intervalle de confiance qui comprenait la valeur 1 et/ou un p > 0,05 a été interprété comme statistiquement non-significatif. Une analyse de sensibilité a également été faite pour les résultats avec une grande hétérogénéité.
Les différents forest plots pour les points d’intérêt : infection, hospitalisation, USI, décès ont été obtenus par Review Manager (Cochrane® v.5.4).
Risque de biais
Le risque de biais pour chaque étude a été évalué à l’aide de l’outil Risk Of Bias In Non-randomized Studies - of Interventions (ROBINS-I tool) téléchargé sur le site https://www.riskofbias.info. Les graphiques (Fig. S1) ont été réalisés sur le site Robvis (https://mcguinlu.shinyapps.io/robvis/). L’outil nous a permis d’avoir une appréciation du risque de biais de chaque étude incluse dans la méta-analyse (Fig. S2), afin de les classer comme bas risque, risque intermédiaire, ou risque sévère. Par ailleurs, cet outil nous a permis d’avoir une appréciation globale de risque de biais de tous les études incluses.
Résultats
Études incluses
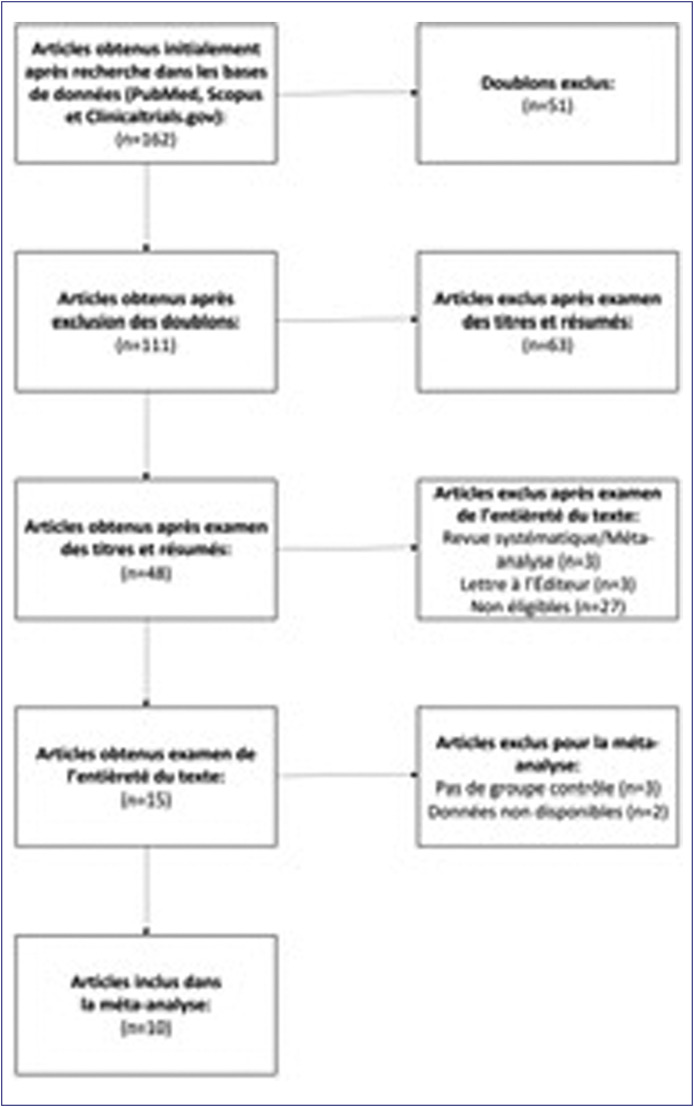
Lors de la première recherche 162 articles ont été retrouvés. Après avoir éliminé les doublons, 111 articles ont été retenus pour notre revue. Une analyse des titres et d’abstracts a été ensuite réalisée; 48 articles ont subi une analyse complète du texte. En éliminant les méta-analyses, les revues systématiques, revues narratives, les actes de conférences ainsi que les analyses critiques d’articles, 15 études (rétrospectives et prospectives) ont été retenues pour l’analyse qualitative dont 10 articles ont été sélectionnés pour l’analyse quantitative (Tableau 1, Tableau 2 ). Trois articles ont été exclus faute de bras contrôle et 2 par manque d’informations (Fig. 1 ).
Tableau 1.
Type de thérapie par déprivation androgénique selon les études incluses.
| Études | Année | Pays | Type d’étude | Type de Déprivation androgénique (TDA) | |
|---|---|---|---|---|---|
| 1 | Montopoli et al.[7] | 2020 | Italie | Rétrospective | ND |
| 2 | Kwon et al. [13] | 2020 | États-Unis | Rétrospective | Agoniste GnRH ou antagoniste GnRH |
| 3 | Koskinen et al.[14] | 2020 | Finlande | Rétrospective | Orchidectomie, agoniste et antagoniste GnRH,enzalutamide,abiraterone |
| 4 | Klein et al.[17] | 2021 | États-Unis | Prospective | ND |
| 5 | Jiménez et al.[6] | 2021 | Espagne | Rétrospective | ND |
| 6 | Patel et al.[12] | 2020 | États-Unis | Rétrospective | Agoniste GnRH ou antagoniste GnRH |
| 7 | Duarte et al.[15] | 2021 | Brésil | Rétrospective | ND |
| 8 | Caffo et al.[18] | 18-06-20 | Italie | Rétrospective | Agoniste GnRH ou antagoniste GnRH |
| 9 | Caffo et al.[19] | 20-09-20 | Italie | Rétrospective | Agoniste GnRH ou antagoniste GnRH |
| 10 | Schmidt et al.[16] | 2021 | États-Unis | Rétrospective | nilutamide, bicalutamide,flutamide,darolutamide,enzalutamide,apalutamide,abiraterone, orchidectomie bilatérale, agoniste GnRH ou antagoniste GnRH |
| 11 | Kazan et al.[5] | 2021 | Turquie | Rétrospective | ND |
| 12 | Gedeborg et al.[20] | 2021 | Suède | Cas-témoins: rétrospective | bicalutamide, agoniste GnRH, abiraterone, enzalutamide,orchidectomie |
| 13 | Di Lorenzo et al.[21] | 2020 | Italie | Rétrospective | Analogues GnRH, enzalutamide, apalutamide,abiraterone |
| 14 | Dalla Volta et al.[22] | 2020 | Italie | Rétrospective | Agoniste GnRH, abiraterone, Enzalutamide |
| 15 | Welén et al.[23] | 2022 | Suède | Rétrospective | Castration chimique ou chirurgicale, abiraterone, enzalutamide |
Tableau 2.
Caractéristiques des études incluses dans la méta-analyse et la revue systématique ainsi que les OR pour chaque point d’intérêt.
| ADT+ | ADT- | OR risque infection | OR risque hospitalisation | OR risque dépendance O2 | OR risque USI | OR risque décès | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Études | Année | Pays | Type d’étude (*1) | SARS-CoV-2 + | SARS-CoV-2 - | SARS-CoV-2 + | SARS-CoV-2 - | ||||||
| 1 | Montopoli et al. [7] | 2020 | Italie | Rétrospective | 4 | 5269 | 114 | 47 | 4,05[1,55–10,59] | 3,93[1,31–11,77] | ND | ND | 4,40[0,76–25,50] |
| 2 | Kwon et al.[13] | 2020 | États-Unis | Rétrospective | 18 | 781 | 79 | 4333 | 1,30[0,78–2,19] | ND | ND | ND | 0,56[0,07–4,88] |
| 3 | Koskinen et al.[14] | 2020 | Finlande | Rétrospective | 6 | 128 | 11 | 207 | 0,88[0,32–2,44] | ND | ND | 0,53[0,04–6,66] | 0,53[0,04–6,66] |
| 4 | Klein et al.[17] | 2021 | États-Unis | Prospective | 17 | 287 | 85 | 1390 | 0,9[0,54–1,61] | 2[0,57–7,32] | ND | 1,3[0,38–4,09] | 2,9[0,86–9,81] |
| 5 | Jiménez et al.[6] (*2)(*3) | 2021 | Espagne | Rétrospective | 11 | 145 | 50 | 1143 | ND | ND | ND | 1,11[0,67–1,85] 1,08[0,64-1,83] (*3) |
0,80[0,28–2,27] 0,67[0,26-1,74] (*3) |
| 6 | Patel et al.[12] | 2020 | États-Unis | Rétrospective | 22 | ND | 36 | ND | ND | 0,23[0,06–0,79] | 0,26[0,07–0,92] | 0,31[0,05–1,81] | 0,37[0,08–1,80] |
| 7 | Duarte et al.[15] | 2021 | Brésil | Rétrospective | 156 | ND | 43 | ND | ND | ND | ND | ND | 0,67[0,27–1,63] |
| 8 | Caffo et al.[18] | 18-06-20 | Italie | Rétrospective | 36 | 1913 | ND | ND | ND | ND | ND | ND | ND |
| 9 | Caffo et al.[19] | 20-09-20 | Italie | Rétrospective | 34 | ND | ND | 1399 | ND | ND | ND | ND | ND |
| 10 | Schmidt et al.[16] | 2021 | États-Unis | Rétrospective | 169 | ND | 308 | ND | ND | 0,98[0,61–1,56] | ND | 0,98[0,61–1,56] | 0,77[0,42–1,42] |
| 11 | Kazan et al.[5] | 2021 | Turquie | Rétrospective | 13 | 125 | 30 | 197 | 0,68[0,343–1,359] | 3,36[0,607–18,582] | ND | 3,36[0,607–18,582] | 3,36[0,607–18,582] |
| 12 | Gedeborg et al.[20] | 2021 | Suède | Cas-témoins: rétrospective | 271 | 5181 | 203 | 18519 | ND | ND | ND | ND | 1,26[0,96-1,67] |
| 13 | Di Lorenzo et al.[21] | 2020 | Italie | Rétrospective | 2 | 70 | ND | ND | ND | ND | ND | ND | ND |
| 14 | Dalla Volta et al.[22] | 2020 | Italie | Rétrospective | 3 | 80 | ND | ND | ND | ND | ND | ND | ND |
| 15 | Welén et al.[23] | 2022 | Suède | Rétrospective | 1688 | ND | 6206 | ND | ND | ND | ND | ND | ND |
(*1) Intervalle de confiance à 95 % pour toutes les OR/RR ; (*2) RR pour l’étude Jiménez et al. ; (*3) Analyse univariée et multivariée.
Figure 1.
PRISMA flow chart of our study.
Caractéristiques des études incluses
Les 15 études ont évalué 50829 patients dont 16429 patients sous TDA, dans différents pays (Brésil, Espagne, Etats-Unis, Finlande, Italie, Suède, Turquie). Presque toutes les études étaient rétrospectives sauf une étude prospective, non randomisée [23]. Les caractéristiques initiales dans la plupart des études étaient comparables ; une seule étude s’est basée sur un matching par une analyse du score de propensité [15]. Les types d’hormonothérapie les plus utilisés dans les études étaient les agonistes et les antagonistes de la GnRH, ainsi que les hormonothérapies de deuxième génération (Tableau 1).
Méta-analyse
Une méta-analyse a été réalisée pour chaque point d’intérêt repris dans le Tableau 2.
Risque d’infection SARS-CoV-2 et thérapie par déprivation androgénique
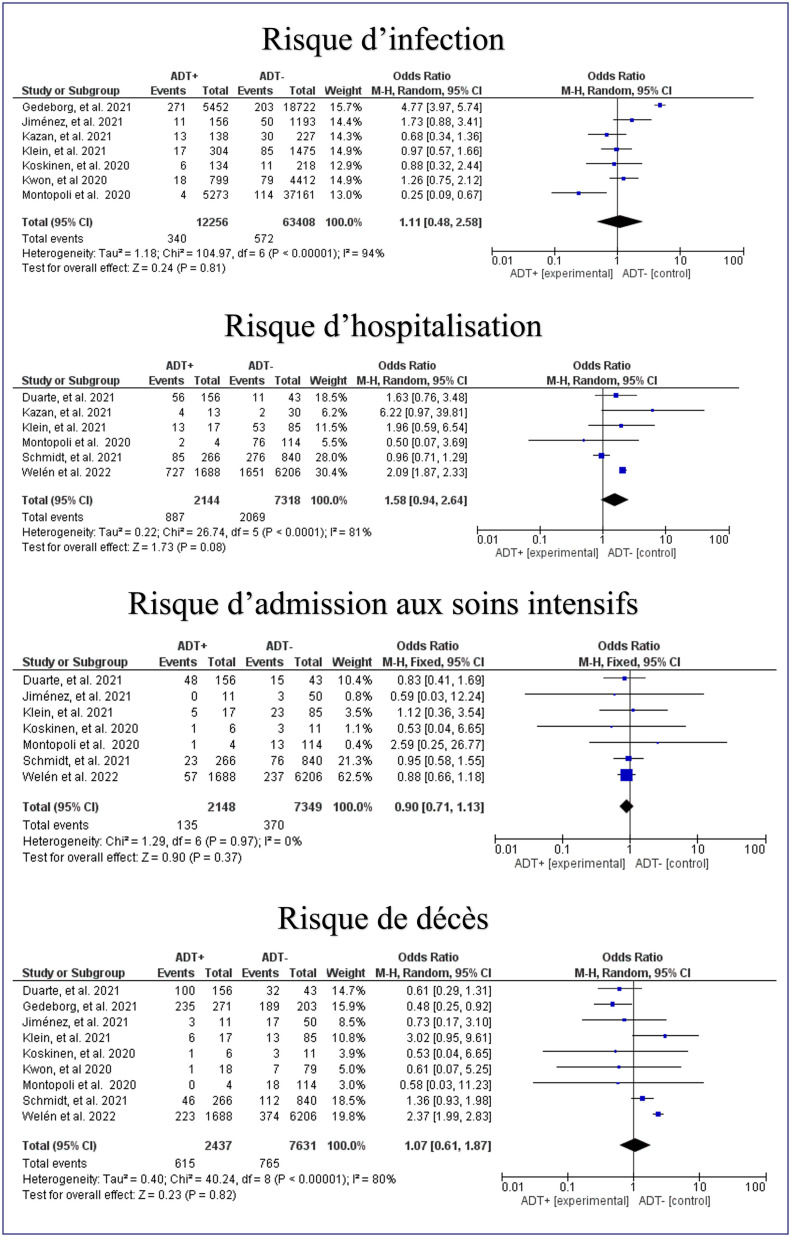
Les sept études prenant en compte le risque d’infection ont été regroupées et le risque de contamination par la COVID-19 entre les groupes TDA et non TDA a été évalué par un Forest Plot.
L’OR résumé pour le risque global d’infection était de 1,11 (95 % IC: [0,48–2,58] ; p = 0,81), mais avec une grande hétérogénéité (I2 = 94 %) (Fig. 2 ). Une analyse de sensibilité a été réalisée. Des modèles d’élimination des études séparément de Montopoli ou de Gedeborg [[7], [20]] puis l’élimination de ces 2 études n’ont pas permis de modifier les résultats, avec respectivement : I2 = 94 % OR = 1,39 (95 % IC :[0,62–3,16] ; p = 0,43), en éliminant les résultats de Montopoli [7], I2 = 61 % OR = 0,90 (95 % IC :[0,57–1,41] ; p = 0,63), en éliminant ceux de Gedeborg [20], et I2 = 6 % OR = 1,06 (95 % IC: [0,80–1,42] ; p = 0,67) en éliminant les résultats des 2 articles à la fois. Les divergences expliquant cette hétérogénéité n’ont pas pu être élucidées.
Figure 2.
Odds Ratio (OR) du risque d’infection, d’hospitalisation, d’admission aux soins intensifs et de décès chez les patients SARS-CoV-2 positifs ayant un cancer de prostate sous traitement par déprivation androgénique (TDA) par rapport à ceux qui ne sont pas sous TDA.
Le TDA n’influence donc pas le risque d’infection par la COVID-19 chez les patients ayant un cancer de prostate.
Risque d’hospitalisation due au SARS-CoV-2 et thérapie par déprivation androgénique
Les six études, prenant en compte le risque d’hospitalisation ont été regroupées et le risque d’hospitalisation lié à la COVID-19 entre les groupes TDA et non TDA a été évalué par un Forest Plot.
L’OR résumé pour le risque global d’hospitalisation était de 1,58 (95 % IC : [0,94–2,64] ; p = 0,08), avec une hétérogénéité (I2 = 81 %), sous l’effet aléatoire (Fig. 2). Compte d’une hétérogénéité supérieure à 50 %, une analyse de sensibilité a été également réalisée. En éliminant les résultats de Welén [23], l’hétérogénéité est devenue (I2 = 40 %) et l’OR résumé de 1,10 (95 % IC: [0,85–1,42]; p = 0,49). Les divergences expliquant cette hétérogénéité n’ont pas pu être élucidées.
Le TDA n’influence donc pas le risque d’hospitalisation lié à la COVID-19 chez les patients ayant un cancer de prostate.
Risque d’admission à l’USI due au SARS-CoV-2 et thérapie par déprivation androgénique
Les sept études, prenant en compte les admissions à l’USI, ont été regroupées et le risque d’admission à l’USI lié à la COVID-19 entre les groupes TDA et non TDA a été évalué par un Forest Plot. Les patients intubés ont été inclus dans les admissions à l’USI.
L’OR résumé pour le risque global d’admission à l’USI était de 0,90 (95 % IC: [0,71–1,13] ; p = 0,37), avec une faible hétérogénéité (I2 = 0 %) sous l’effet fixe (Fig. 2).
Le TDA n’influence donc pas le risque d’admission à l’USI lié à la COVID-19 chez les patients ayant un cancer de prostate.
Risque de décès lié au SARS-CoV-2 et thérapie par déprivation androgénique
Les neuf études, prenant en compte les décès ont été regroupées et le risque de décès au COVID-19 entre les groupes TDA et non TDA a été évalué par un Forest Plot.
L’OR résumé pour le risque global de décès est de 1,07 (95 % IC : [0,61–1,87] ; p = 0,82), avec une hétérogénéité (I2 = 80 %), sous l’effet aléatoire (Fig. 2). Avec une hétérogénéité supérieure à 50 %, une analyse de sensibilité a été réalisée. En éliminant les résultats de Welen et al. [23], l’hétérogénéité est devenue (I2 = 48 %) et l’OR résumé de 0,96 (95 % IC: [0,73–1,27]; p = 0,80). Les divergences expliquant cette hétérogénéité n’ont pas pu être élucidées.
Le TDA n’influence donc pas le risque de décès lié à la COVID-19 chez les patients ayant un cancer de prostate.
Risque de Biais
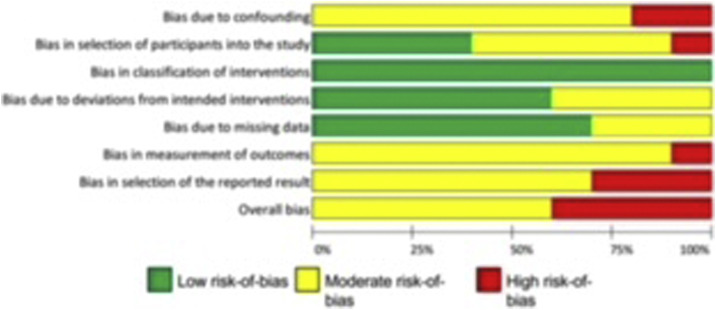
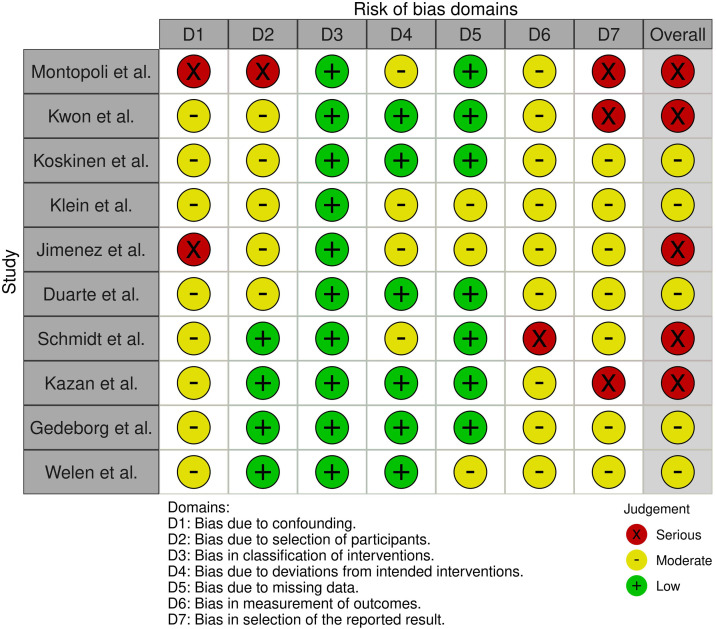
Le risque de biais le plus important était dû à un biais de confusion, et plus modérément aux biais de mesure et de rapports des résultats ainsi que dans une moindre mesure, un biais de sélection des participants (Fig. S1 Fig. S1). Quatre articles ont été évalués comme ayant un risque de biais élevé alors que six articles ont été évalués comme ayant un risque de biais modéré (Fig. S2 Fig. S2).
Discussion
Nous avons pu démontrer dans notre méta-analyse que l’utilisation de la déprivation androgénique pour le traitement du cancer de prostate ne réduisait pas le risque d’infection par le SARS-CoV-2, ni le risque d’hospitalisation, ni le risque d’admission à l’USI, ou le risque de décès lié à la COVID-19.
Concernant le risque d’infection par la COVID-19, nos résultats sont concordants, malgré une forte hétérogénéité, avec ceux de deux autres méta-analyses, Karimi et al. et Motlagh et al. [[24], [25]]. Sur les 7 articles inclus et évaluant si le TDA était bénéfique, notre analyse est cohérente avec les résultats de 6 articles sur 7, un seul article ayant démontré un bénéfice [7]. Sbrana et al. avaient également conclu à des taux d’infection inférieurs à ceux de la population générale mais sans analyses statistiques [11]. Kazan et al. ont démontré que la présence d’un proche infecté par le SARS-CoV-2 était un facteur de risque de contamination très important chez les patients avec et sans TDA [5]. En raison de la fréquence plus élevée des infections à partir de 70 ans [18], certains auteurs ont conclu que le principal facteur de risque était l’âge [[3], [11], [20]]. Le TDA ne peut donc être considéré comme un facteur protecteur contre l’infection par le SARS-CoV-2 même si la physiopathologie fait intervenir les androgènes.
Nos résultats suggèrent aussi que le TDA ne diminue pas le taux d’hospitalisations dû au COVID-19. Ces résultats sont concordants avec les résultats de la méta-analyse faite par Karimi et al.[26]. Motlagh et al. n’ont pas évalué ce risque dans leur méta-analyse [20). Des taux d’hospitalisations élevés (64,7 %) ont été observés chez les patients atteints d’un cancer de prostate métastatique résistant à la castration et infectées par le SARS-CoV-2, ainsi que des admissions à l’USI [19]. La moitié de ces patients étaient sous TDA associé à d’autres traitements pour un cancer de prostate avancé (hormonothérapie de 2e génération par enzalutamide ou abiraterone et chimiothérapie par docetaxel ou cabazitaxel) [19]. Cela témoigne d’une plus grande fragilité de ces patients, et d’une probable plus grande sensibilité (impact négatif du cancer) à une virose. Les patients atteints de cancer sont connus comme ayant une morbi-mortalité liée à la COVID-19 supérieure à la population générale [[6], [7], [19]].
En outre, nos résultats suggèrent que le TDA ne diminue pas le risque d’admission à l’USI due au COVID-19. Ces résultats sont concordants avec ceux des deux autres méta-analyses de Karimi et al. et de Motlagh et al. [[24], [25]]. Cependant, Montopoli et al. ont démontré un effet protecteur du TDA sur l’admission à l’USI [7] et une tendance à un effet protecteur a été rapportée par Patel et al. mais avec une différence non statistiquement significative [12].
Concernant la mortalité, nos résultats suggèrent que le TDA ne diminue pas le risque de décès dû au COVID-19. Ces résultats sont concordants avec ceux des deux autres méta-analyses déjà mentionnées [[26], [27]]. Aucune différence de survie globale n’a été retrouvée dans la littérature en comparant les taux de mortalité des patients sous TDA avant la pandémie et pendant la pandémie [28]. Parmi les 15 études de la revue, celle de Montopoli et al. a conclu à un effet protecteur du TDA à tous les niveaux [7]. Il faut mentionner que différents facteurs de confusion comme le stade du cancer de la prostate, les comorbidités, les traitements spécifiques comparés à la population générale n’ont pas été pris en compte dans cette étude. Patel et al. ont conclu que l’utilisation d’un TDA était associée à une tendance vers un effet protecteur contre le décès, mais non statistiquement significatif [12]. Sbrana et al. dans leur cohorte ont conclu à une incidence et une mortalité assez basses par rapport à la population générale [11].
D’autres études ont évalué la thérapie hormonale dans le cadre de la prévention de la COVID-19 dans la population générale. Dans le bras prospectif (portant le nom de COVIDENZA) de l’étude, Welén et al. n’ont pas retrouvé de bénéfice thérapeutique des anti androgènes dans les 2 sexes chez les patient.es hospitalisé.es pour prévenir la COVID-19, en administrant 160 mg d’Enzalutamide pendant 5 jours en plus de leur traitement standard contre la COVID-19 [23]. Une étude prospective qui n’incluait pas de patients atteints de cancer de prostate a conclu que le proxalutamide, un antagoniste du récepteur aux androgènes, accélérait de manière significative la clairance des infections virales chez les patients atteints de COVID-19 léger à modéré au jour 7 par rapport au placebo [29].
En comparaison avec les 2 autres méta-analyses [[26], [27]], les différences d’OR retrouvées sont liées à un plus grand nombre d’études inclues dans notre analyse. Le point fort de notre méta-analyse, par rapport aux deux autres, est d’avoir pris en compte différents facteurs de confusion en intégrant des études qui s’étaient assurées d’inclure les différents facteurs confondants et avaient réalisé des analyses multivariées ou des analyses de propension. Aucun effet protecteur du TDA n’a été retrouvé par l’ensemble de ces études.
Une autre méta-analyse par Corona et al. a montré qu’un taux bas de testostérone dans la phase aigüe de la COVID-19 est associé à une augmentation du risque à la fois de l’admission à l’USI et du décès [30]. Ceci a été incriminé au fait qu’un taux bas de testostérone provoque la sécrétion des cytokines pro-inflammatoires, favorisant ainsi la tempête des cytokines, et donc le risque d’admission à l’USI et le risque de décès [24]. Ce taux bas de testostérone pourrait être dû aux complications associées à la COVID-19 et touchant l’appareil génito-urinaire, du fait de la physiopathologie de la primo-infection par le virus et son entrée dans les cellules via les récepteurs mentionnés ci-dessus, TMPRSS2 et ACE2, connus comme étant abondants au niveau de cet appareil génito-urinaire [25].
Notre étude a cependant des limites à mentionner. En premier lieu, certaines études présentaient un faible échantillon et certaines avaient pris en compte uniquement les patients SARS-CoV-2 positifs ayant un cancer de prostate, sans inclure les patients SARS-CoV-2 négatifs. Toutes ces études n’avaient pas le même mode de recueil des données : registres nationaux ou régionaux [[7], [12], [13], [14], [15], [17], [20], [23]], multicentriques dans des hôpitaux oncologiques [[5], [18], [19]] ou seulement des données hospitalières [[6], [16], [21], [22]]. La majorité des études incluses étaient des études rétrospectives sauf une, sans randomisation car éthiquement impossibles à réaliser chez des patients ayant un cancer de prostate et nécessitant un traitement par déprivation androgénique. Une autre limite est le fait que la majorité des études n’ont pas rapporté les taux de testostérone plasmatiques afin de vérifier si les patients sous TDA étaient bien à un taux de castration. La durée du TDA n’a été rapportée que par certaines études. Une dernière limite serait le risque de biais modéré à élevé de la plupart des études incluses et l’hétérogénéité significative dans la plupart des critères de jugement analysés.
Conclusion
Malgré la physiopathologie de l’infection par le SARS-CoV2 lié aux récepteurs androgéno-dépendants, la déprivation androgénique chez les patients atteints de cancer de la prostate, ne protège ni de la COVID-19, ni de la sévérité de l’infection. Ce résultat reste discutable vue la nature rétrospective de la majorité des études incluses dans notre méta-analyse.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Footnotes
Matériel complémentaires
Les matériels complémentaires accompagnant la version en ligne de cet article sont disponibles sur doi:10.1016/j.purol.2022.09.005.
Annexe A. Matériels complémentaires
Figure S1.
Graphique de synthèse pour le risque de biais.
Figure S2.
Graphique « traffic light plots » pour le risque de biais dans les études individuelles.
Références
- 1.WHO Director-General's opening remarks at the media briefing on COVID-19-11 March 2020 [Internet]. [cited 2021 Oct 31]. Available from: https://www.who.int/director-general/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19---11-march-2020.
- 2.COVID-19 - Situation épidémiologique | Coronavirus Covid-19 [Internet]. [cited 2022 Mar 15]. Available from: https://covid-19.sciensano.be/fr/covid-19-situation-epidemiologique.
- 3.Richardson S., Hirsch J.S., Narasimhan M., Crawford J.M., McGinn T., Davidson K.W., et al. Presenting characteristics, comorbidities, and outcomes among 5700 patients hospitalized with COVID-19 in the New York City area. JAMA. 2020;323:2052–2059. doi: 10.1001/jama.2020.6775. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Grasselli G., Zangrillo A., Zanella A., Antonelli M., Cabrini L., Castelli A., et al. Baseline characteristics and outcomes of 1591 patients infected With SARS-CoV-2 admitted to ICUs of the Lombardy Region, Italy. JAMA. 2020;323:1574–1581. doi: 10.1001/jama.2020.5394. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Kazan Ö., Çulpan M., Efiloğlu Ö., Atiş G., Yildirim A. The clinical impact of androgen deprivation therapy on SARS-CoV-2 infection rates and disease severity. Turk J Urol. 2021;47:495–500. doi: 10.5152/tud.2021.21278. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Jiménez-Alcaide E., García-Fuentes C., Hernández V., De la Peña E., Pérez-Fernández E., Castro A., et al. Influence of androgen deprivation therapy on the severity of COVID-19 in prostate cancer patients. Prostate. 2021 doi: 10.1002/pros.24232. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Montopoli M., Zumerle S., Vettor R., Rugge M., Zorzi M., Catapano C.V., et al. Androgen-deprivation therapies for prostate cancer and risk of infection by SARS-CoV-2: a population-based study (n = 4532) Ann Oncol. 2020;31:1040–1045. doi: 10.1016/j.annonc.2020.04.479. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Foo Y.Z., Nakagawa S., Rhodes G., Simmons L.W. The effects of sex hormones on immune function: a meta-analysis. Biol Rev. 2017;92:551–571. doi: 10.1111/brv.12243. [DOI] [PubMed] [Google Scholar]
- 9.Mjaess G., Karam A., Aoun F., Albisinni S., Roumeguère T. COVID-19 and the male susceptibility: the role of ACE2, TMPRSS2 and the androgen receptor. Prog Urol. 2020;30:484–487. doi: 10.1016/j.purol.2020.05.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Hoffmann M., Kleine-Weber H., Schroeder S., Krüger N., Herrler T., Erichsen S., et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell. 2020;181 doi: 10.1016/j.cell.2020.02.052. 271-280.e8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Sbrana A., Paolieri F., Bloise F., Nuzzo A., Manacorda S., Sammarco E., et al. 1711P SARS-CoV-2 infection in prostate cancer patients: Data from a high-incidence area in Italy. Ann Oncol. 2020;31:S1007. [Google Scholar]
- 12.Patel V.G., Zhong X., Liaw B., Tremblay D., Tsao C.K., Galsky M.D., et al. Does androgen deprivation therapy protect against severe complications from COVID-19? Ann Oncol. 2020;31:1419–1420. doi: 10.1016/j.annonc.2020.06.023. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Kwon D.H., Vashisht R., Borno H.T., Aggarwal R.R., Small E.J., Butte A.J., et al. Androgen-deprivation therapy and SARS-CoV-2 in men with prostate cancer: findings from the University of California Health System registry. Ann Oncol Off J Eur Soc Med Oncol. 2021;32:678–679. doi: 10.1016/j.annonc.2021.01.067. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Koskinen M., Carpen O., Honkanen V., Seppänen M.R.J., Miettinen P.J., Tuominen J.A., et al. Androgen deprivation and SARS-CoV-2 in men with prostate cancer. Ann Oncol. 2020;31:1417–1418. doi: 10.1016/j.annonc.2020.06.015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Duarte M.B.O., Leal F., Argenton J.L.P., Carvalheira J.B.C. Impact of androgen deprivation therapy on mortality of prostate cancer patients with COVID-19: a propensity score-based analysis. J Clin Oncol. 2021;39:5067. doi: 10.1186/s13027-021-00406-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Schmidt A.L., Tucker M.D., Bakouny Z., Labaki C., Hsu C.Y., Shyr Y., et al. Association between androgen deprivation therapy and mortality among patients with prostate cancer and COVID-19. JAMA Netw Open. 2021;4:e2134330. doi: 10.1001/jamanetworkopen.2021.34330. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Klein E.A. Androgen deprivation therapy in men with prostate cancer does not affect risk of infection with SARS-CoV-2. Reply. J Urol. 2021;206:785. doi: 10.1097/JU.0000000000001884. [DOI] [PubMed] [Google Scholar]
- 18.Caffo O., Zagonel V., Baldessari C., Berruti A., Bortolus R., Buti S., et al. On the relationship between androgen-deprivation therapy for prostate cancer and risk of infection by SARS-CoV-2. Ann Oncol. 2020;31:1415–1416. doi: 10.1016/j.annonc.2020.06.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Caffo O., Gasparro D., Di Lorenzo G., Volta A.D., Guglielmini P., Zucali P., et al. Incidence and outcomes of severe acute respiratory syndrome coronavirus 2 infection in patients with metastatic castration-resistant prostate cancer. Eur J Cancer. 2020;140:140–146. doi: 10.1016/j.ejca.2020.09.018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Gedeborg R, Lindhagen L, Loeb S, Styrke J, Garmo H, Stattin P. Androgen deprivation therapy, comorbidity, cancer stage and mortality from COVID-19 in men with prostate cancer. Scand J Urol [Internet]. 2021; Available from: https://www.scopus.com/inward/record.uri?eid=2-s2.0-85121840785&doi=10.1080 %2f21681805.2021.2019304&partnerID=40&md5=34df9c6e6dbfaeeb65f1b5243d132277. [DOI] [PubMed]
- 21.Di Lorenzo G., Buonerba L., Ingenito C., Crocetto F., Buonerba C., Libroia A., et al. Clinical Characteristics of metastatic prostate cancer patients infected with COVID-19 in South Italy. Oncology. 2020;22:1–5. doi: 10.1159/000509434. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Dalla Volta A., Valcamonico F., Zamboni S., Ferrari V.D., Grisanti S., Simeone C., et al. Is androgen deprivation therapy protective against SARS-CoV-2 infection and related complications in prostate cancer patients? Minerva Urol E Nefrol Ital J Urol Nephrol. 2020;72:778–779. doi: 10.23736/S0393-2249.20.04021-7. [DOI] [PubMed] [Google Scholar]
- 23.Welén K., Rosendal E., Gisslén M., Lenman A., Freyhult E., Fonseca-Rodríguez O., et al. A Phase 2 Trial of the Effect of Antiandrogen Therapy on COVID-19 Outcome: No Evidence of Benefit, Supported by Epidemiology and In Vitro Data. Eur Urol. 2022;81:285–293. doi: 10.1016/j.eururo.2021.12.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Baillargeon J., Kuo Y.F., Westra J., Lopez D.S., Urban R.J., Williams S.B., et al. Association of testosterone therapy with disease progression in older males with COVID-19. Andrology. 2022 doi: 10.1111/andr.13193. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Ebner B., Volz Y., Mumm J.N., Stief C.G., Magistro G. The COVID-19 pandemic - what have urologists learned? Nat Rev Urol. 2022 doi: 10.1038/s41585-022-00586-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Karimi A., Nowroozi A., Alilou S., Amini E. Effects of androgen deprivation therapy on COVID-19 in patients with prostate cancer: a systematic review and meta-analysis. Urol J. 2021;18:577–584. doi: 10.22037/uj.v18i.6691. [DOI] [PubMed] [Google Scholar]
- 27.Sari Motlagh R, Abufaraj M, Karakiewicz PI, Rajwa P, Mori K, Mun DH, et al. Association between SARS-CoV-2 infection and disease severity among prostate cancer patients on androgen deprivation therapy: a systematic review and meta-analysis. World J Urol [Internet]. 2021; Available from: https://www.scopus.com/inward/record.uri?eid=2-s2.0-85114186643&doi=10.1007 %2fs00345-021-03810-6&partnerID=40&md5=2bd672ddc3899adcd12fc3bd842e14d2. [DOI] [PMC free article] [PubMed]
- 28.Gedeborg R., Styrke J., Loeb S., Garmo H., Stattin P. Androgen deprivation therapy and excess mortality in men with prostate cancer during the initial phase of the COVID-19 pandemic. PloS One. 2021;16:e0255966. doi: 10.1371/journal.pone.0255966. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Cadegiani FA, McCoy J, Wambier CG, Vaño-Galván S, Shapiro J, Tosti A, et al. Proxalutamide Significantly Accelerates Viral Clearance and Reduces Time to Clinical Remission in Patients with Mild to Moderate COVID-19: Results from a Randomized, Double-Blinded, Placebo-Controlled Trial. Cureus [Internet]. 2021 Feb 22 [cited 2021 Nov 7];13(2). Available from: https://www.cureus.com/articles/52299-proxalutamide-significantly-accelerates-viral-clearance-and-reduces-time-to-clinical-remission-in-patients-with-mild-to-moderate-covid-19-results-from-a-randomized-double-blinded-placebo-controlled-trial. [DOI] [PMC free article] [PubMed]
- 30.Corona G., Vena W., Pizzocaro A., Pallotti F., Paoli D., Rastrelli G., et al. Andrological effects of SARS-Cov-2 infection: a systematic review and meta-analysis. J Endocrinol Invest. 2022 doi: 10.1007/s40618-022-01801-x. [DOI] [PMC free article] [PubMed] [Google Scholar]