Abstract
Objective
To study the chest CT profile of SARS-CoV-2 pneumonia in patients in the city of Ouagadougou.
Patients and methods
descriptive cross-sectional study with retrospective collection of 1017 patients of both sexes. Included were patients aged 15 and over who had performed a chest CT scan without or with injection of contrast product, suspected or positive for COVID -19. The variables analyzed were: the history, the nature of the examination, the socio-demographic, clinical, CT data including the description of the tomodensitometric lesions and their characteristics, the extent of the parenchymal lesions according to the visual estimate of the French thoracic Imaging Society, complications, other lesions on the chest CT scan and CORADS classification. All parameters (age, sex on the one hand and clinical and CT findings on the other) were subjected to statistical analysis.
Results
The mean age of the patients was 56.95 years, predominantly male (1.47). Dyspnea was the most frequent symptomatology, at 46.26% (n = 506). Diabetes was the most common comorbidity with 29.37% (n = 94). Frosted glass opacity accounted for 90.95% of elementary lesions which were predominantly in plaque in 44.35% (n = 451), bilateral in (82.79%) and peripheral subpleural in (81.51%). The lower lobes were the most affected and postero-basal involvement predominant with greater involvement in the right lung. The extent was severe in 28.42% (n = 289). Thirty-nine point twenty-three (39.23)% or 399 of cases presented with complications dominated by pleural effusion at 56.39% (n = 225) and pulmonary embolism at 34.08% (n = 136 ). The lesions were classified as CORADS type in 815 CT reports. CORADS 5 type lesions were found in 47% of patients. Five hundred and ninety-two (592) PCRs of our patients were undetermined, in 58.21%. The PCR was positive in 342 cases or 33.63%. The bi- and multivariate analysis noted: a statistically significant link between the age and the extent of the lesions, between the extent of the lesions and the clinical context, between the extent of the lesions and comorbidities such as diabetes, Hypertension and renal failure. There was also a link between the PCR result and basic lesions such as ground glass and crazy paving and between the occurrence of pulmonary embolism and the presence of hypertension.
Discussion
The scanographic profile corresponded to that described in the literature. Frosted glass was the most common elementary lesion. The impairment was severe to critical in patients over 65 with comorbidity. CT angiography was the most requested in front of signs such as dyspnea and desaturation
Conclusion
A study on CT specificities with precision on the onset of symptoms and the notion of vaccination would complement these results.
Keywords: COVID-19, CT aspects, Ouagadougou
Résumé
Objectif
Étudier le profil scanographique thoracique de la pneumopathie à SARS-CoV-2 chez les patients dans la ville de Ouagadougou
Patients et méthodes
étude transversale descriptive à collecte rétrospective de 1017 patients des deux sexes. Etaient inclus les patients de 15 ans et plus ayant réalisé un examen scanographique thoracique sans ou avec injection de produit de contraste, suspects ou positifs à la COVID -19. Les variables analysées étaient : les antécédents, la nature de l'examen, les données sociodémographiques, cliniques, scanographiques dont la description des lésions tomodensitométriques et leurs caractéristiques, l’étendue des lésions parenchymateuses selon l'estimation visuelle de la Société Française d'Imagerie thoracique, les complications, les autres lésions au scanner thoracique et la classification de CORADS. Tous les paramètres (âge, sexe d'une part et les constations cliniques et scanographiques d'autre part) ont été soumis à l'analyse statistique.
Résultats
l’âge moyen des patients était de 56,95 ans à prédominance masculine (1,47). La dyspnée constituait la symptomatologie la plus fréquente soit 49,26% (n = 501). Le diabète était la comorbidité la plus fréquente avec 29,37% (n = 94). L'opacité en verre dépoli représentait 90,95% des lésions élémentaires. Ces lésions élémentaires étaient majoritairement en plage dans 44 ,35 % (n = 451), bilatérales dans 82,79 % et périphériques sous pleurale dans 81,51 %. Les lobes inférieurs étaient les plus touchés et l'atteinte postéro basale prédominante avec une plus grande atteinte au poumon droit. L’étendue était sévère dans 28,42 % (n = 289). Trente-neuf virgule vingt-trois (39,23) % soit 399 des cas présentaient des complications dominées par l’épanchement pleural à 56,39% (n = 225) et l'embolie pulmonaire à 34,08% (n = 136). Les lésions étaient classées type CORADS dans 815 comptes rendus scanographiques. Les lésions types CORADS 5 étaient retrouvées chez 47 % des patients. Cinq cent quatre-vingt-douze (592) PCR de nos patients étaient indéterminées soit 58,21%. La PCR était positive dans 342 cas soit 33,63%. L'analyse bi et multi variée notait : un lien statistiquement significatif entre l’âge et l’étendue des lésions, entre l’étendue des lésions et le contexte clinique, entre l’étendue des lésions et les comorbidités comme le diabète, l'HTA et l'insuffisance rénale. Il existait également un lien entre le résultat PCR et les lésions élémentaires à type de verre dépoli et crazy paving et entre la survenue d'embolie pulmonaire et la présence de l'HTA.
Discussion
Le profil scanographique correspondait à celui décrit dans la littérature. Le verre depoli était la lésion élémentaire la plus retrouvée. L'atteinte était sévère à critique chez les patients de plus de 65 ans avec une comorbidité. L'angioscanner était le plus demandé devant des signes tels la dyspnée et la désaturation.
Conclusion
une étude sur les spécificités scanographiques avec une précision sur le début des symptômes et la notion de vaccination serait un complément de ces résultats.
Introduction
Le diagnostic de certitude de la COVID-19 est fourni par le test de Réaction en Chaîne de la Polymérase en Temps Réel (RT-PCR) qui est l'examen de référence [1]. Il est réalisé sur des sécrétions nasopharyngées prélevées par écouvillonnage, et peut être d'emblée faiblement positif lors du premier prélèvement, tel que décrit chez 27,5% des 610 patients hospitalisés à Wuhan [2]. Il s'avère donc souvent nécessaire de répéter les prélèvements en cas de résultat négatif lorsque la suspicion clinique est très forte, ce qui relève la difficulté des cas faussement négatifs [2]. En outre, le résultat de l'examen ne peut être disponible au plus tôt que dans les 6 à 48 heures, avec une sensibilité comprise entre 59 et 83% [3]. Cette attente peut être préjudiciable au vu de l’évolutivité rapide vers les complications des lésions relatives à la COVID-19. Ce délai de diagnostic relativement long pourrait être raccourci par le recours à la tomodensitométrie (TDM) thoracique dont plusieurs études ont également montré l'apport essentiel dans le diagnostic de la COVID-19 [4].
Le but de notre étude était d’étudier le profil scanographique thoracique de la pneumopathie à COVID-19 chez les patients dans notre contexte. Plus spécifiquement il s'agissait de décrire les images scanographiques thoraciques de la pneumopathie à COVID-19, d'identifier les variables cliniques associées aux signes scanographiques thoraciques et d'en évaluer la sévérité selon les images scanographiques dans quatre formations sanitaires de notre ville.
Patients et méthodes
Il s'agissait d'une étude rétrospective transversale multicentrique allant de mars 2021 à août 2021 soit 6 mois. Notre étude a porté sur les comptes rendus de scanners thoraciques de l'ensemble des patients atteints ou suspects de la COVID-19 avec ou sans test PCR au cours de la période d’étude et ayant réalisé un scanner thoracique dans les services d'imagerie cibles.Les variables analysées étaient : les données socio-démographiques : l’âge, le sexe, la profession, la résidence ; les données cliniques des patients, le contexte clinique (toux, douleur thoracique, fièvre, dyspnée, désaturation), les antécédents (HTA, diabète, insuffisance rénale ou créatinine élevée, asthme), les données scanographiques : la nature de l'examen (angioscanner ou scanner thoracique), le prescripteur, l'indication de la demande du scanner (suspicion d'infection à la COVID-19, COVID-19 confirmé par PCR, suspicion d'embolie pulmonaire autre diagnostic suspecté), le protocole tomodensitométrique (avec injection d'emblée de produit de contraste, ou sans injection de produit de contraste, puis après injection de produit de contraste, la description des lésions tomodensitométriques (lésions élémentaires évocatrices de la COVID-19) , l'aspect des lésions, la distribution des lésions, la topographie des lésions, l’étendue des lésions parenchymateuses selon l'estimation visuelle de la Société Française d'Imagerie thoracique, (Imagerie de la pneumonie COVID19), [5] les complications et les autres lésions au scanner thoracique et la classification de CO-RADS (COVID-19 Reporting and Data System), [6] les résultats de la PCR (positive, négative, indéterminée ou non réalisée).Les registres d'imagerie, les images scanographiques, les comptes rendus de scanner thoracique et la base de données des résultats PCR nous ont servi de sources de collecte de données. Les données ont été recueillies sur une fiche de collecte élaborée à cet effet. L'analyse des données a été réalisée à l'aide du logiciel Epi Info dans sa version anglaise 7.3.3 [7]. Les tests statistiques utilisés ont été le test de student pour les variables qualitatives (proportions) [8]. et le Khi carré pour les variables quantitatives (moyennes) [9].
Résultats
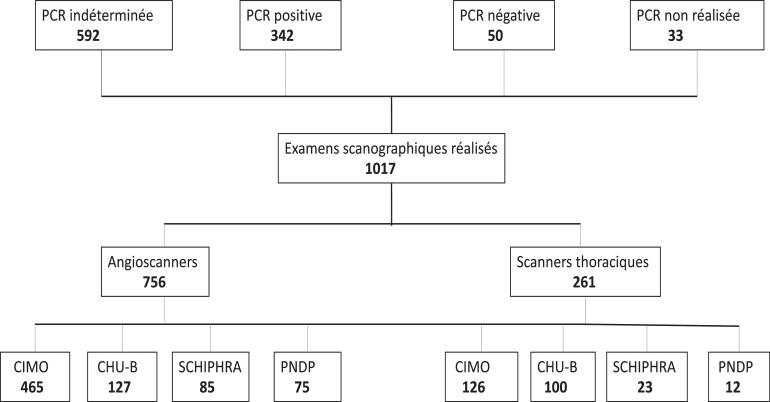
Nous avons examiné 1017 dossiers scanographiques dont 756 angioscanners et 261 scanners thoraciques. Trois cent quarante deux (342) patients avaient une PCR positive.
La répartition de toutes les données de notre étude par site, la nature des examens et le profil PCR sont présentés par la Fig. 1 .
Fig. 1.
Répartition des examens scanographiques.
L’âge moyen était de 56,95 ans avec des extrêmes de 17 et 98 ans.
La tranche d’âge de 45 à 65 ans était représentée à 42,38% (n = 431).
Les hommes représentaient 59,49% (n = 605) de notre échantillon soit un sex ratio de 1,47.
Dans 501 cas, soit 49,26%, la dyspnée constituait un des principaux signes cliniques que présentaient les patients. Elle était suivie par la toux à 41% (417), puis la fièvre à 22,42% (228) et la désaturation dans 20,26% (206). Les autres signes étaient représentés entre autres par le syndrome grippal dans 13,76% (140).
Trois cent vingt (320) patients avaient des comorbidités soit 31,46%. Parmi ces comorbidités, le diabète représentait 94 cas soit 29,37%. L'hypertension artérielle venait en seconde position chez 93 patients (29 ,06%). La troisième comorbidité majoritaire était l'insuffisance rénale à 10% chez 32 patients. Les autres comorbidités étaient l'asthme, la présence d'une néoplasie, l'immunodépression à VIH, la tuberculose, le tabagisme.
L'indication qui motivait la demande de scanner thoracique était la suspicion de l'infection à la COVID-19 dans 36,97% (n = 376). La suspicion d'embolie pulmonaire était l'indication dans 30,19% (n = 307), puis l'exploration scanographique thoracique d'un cas de COVID-19 confirmé dans 13,27% des cas (n = 135) suivie des autres indications dans 19,57% (n = 199).
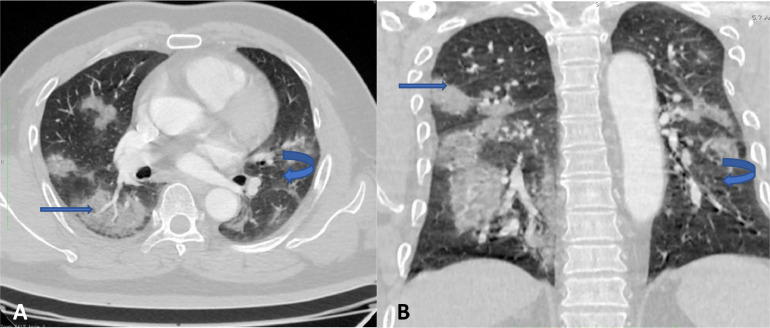
Au niveau de la tomodensitométrie, les lésions élémentaires étaient caractérisées par l'opacité en verre dépoli dans 90,95% et les condensations dans 70,70% (Fig. 2 ). La répartition des patients selon les lésions élémentaires évocatrices de la COVID-19 est illustrée par le Tableau 1 .
Fig. 2.
Angioscanner thoracique en fenêtre parenchymateuse (A) coupe axiale et (B) reconstruction coronale montrant des condensations parenchymateuses (flèche droite) associées à du verre dépoli (flèche courbe).
Tableau 1.
Répartition des patients selon les lésions élémentaires évocatrices de COVID-19.
| Lésions élémentaires | Fréquence (n/1017) | Pourcentage (%) |
|---|---|---|
| Verre dépoli | 925 | 90,95 |
| Condensation | 719 | 70,70 |
| Crazy paving | 605 | 59,49 |
| Signe du halo inversé | 110 | 10,82 |
| Nodule en verre dépoli | 40 | 3,93 |
| Signe du halo | 4 | 0,39 |
Les lésions étaient en plage dans 451 cas, nodulaire dans 386 cas et en bande dans 264 cas soient des pourcentages respectifs de 44,35% ; 37,95% et 25,96%.
La répartition des lésions était bilatérale dans 82,79% et périphérique sous pleurale dans 81,51%.
Les lobes inférieurs étaient les plus touchés et l'atteinte postéro basale était présente chez 140 patients soit 13,77%.
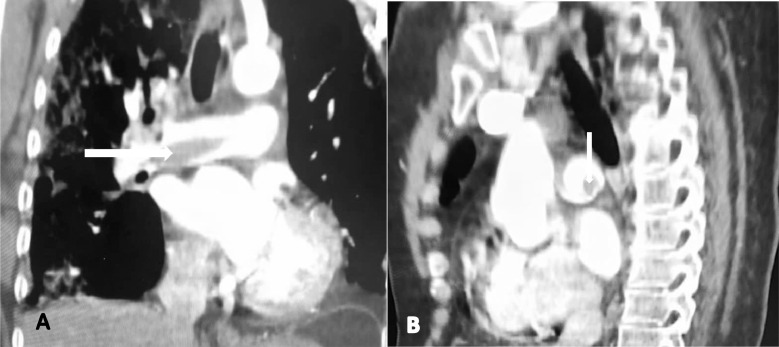
Trente-neuf virgule vingt-trois (39,23) % soit 399 des patients présentaient des complications dominées par l’épanchement pleural à 56,39% (n = 225) et l'embolie pulmonaire à 34,08% (n = 136) (Fig. 3 ).
Fig. 3.
Angioscanner thoracique (A) reconstruction coronale, (B) reconstruction sagittale: embole hypodense non obstructif (flèche) au niveau du tronc de l'artère pulmonaire droite.
Quatre-vingt-treize patients ayant fait une embolie pulmonaire étaient hypertendus et cela de façon significative avec une P value à 0,0016.
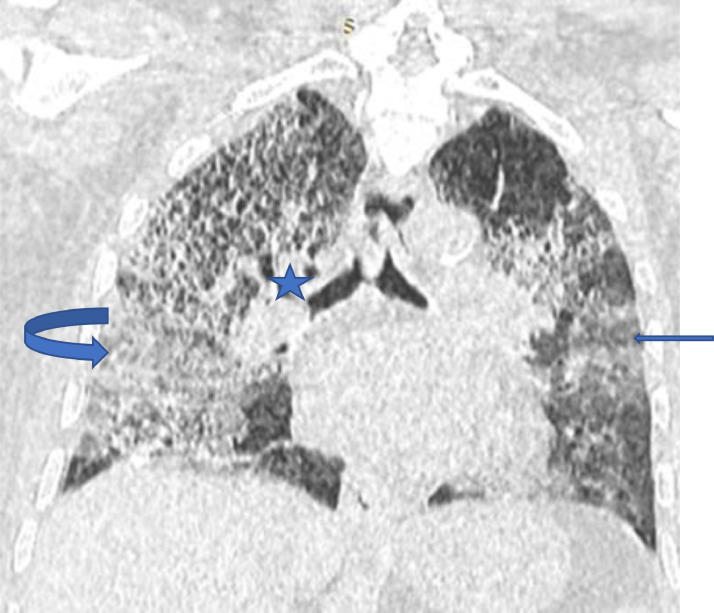
Trois cent quatre-vingt (380) autres lésions pulmonaires ont été observées. Elles étaient dominées par la bronchectasie par traction à 33,68% soit 128 patients, l'emphysème chez 86 patients soit 22,63 %, l'hypertension artérielle pulmonaire chez 75 patients et la fibrose chez 52 patients (Fig. 4 ).
Fig. 4.
Angioscanner thoracique reformation coronale fenêtre parenchymateuse : verre dépoli, réticulations(flèches), condensations sous pleurales (flèche courbe) atteinte sévère avec distorsion bronchique (étoile) évolution vers la fibrose.
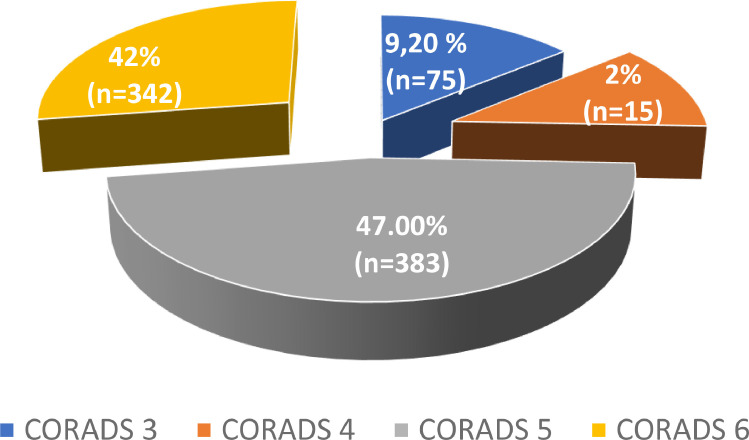
Les lésions étaient classées type CO-RADS dans 815 comptes rendus scanographiques. Les lésions type CORADS 5 représentaient 47% (383). La répartition selon la classification CO-RADS est illustrée par la Fig. 5 .
Fig. 5.
Répartition selon la classification CORADS.
Le contexte clinque, la présence de comorbidité, la suspicion de complication et les résultats PCR avaient motivé la réalisation de l'angioscanner ou du scanner thoracique. Le Tableau 2 représente la répartition des examens scanographiques en fonction de ces variables et l'association qui est retrouvée entre la dyspnée et la prescription de l'angioscanner avec un p significatif. Les patients présentant une dyspnée avaient réalisé un angioscanner thoracique dans 385 cas sur 501 soit 76,84%.
Tableau 2.
Répartition des examens scanographiques en fonction du contexte clinique, de la présence de comorbidité, de la suspicion de complication et des résultats PCR.
| Angioscanner | Scanner thoracique | P value | ||
|---|---|---|---|---|
| Contexte clinique | Dyspnée | 385 | 116 | 0,000 |
| Non | 371 | 145 | 0,587 | |
| Comorbidités | Diabète | 79 | 15 | 0,020 |
| Autres | 677 | 246 | 0,768 | |
| Complication | Embolie pulmonaire | 132 | 00 | 0,006 |
| PCR positive | 334 | 08 | 0,075 | |
| PCR | PCR négative | 40 | 10 | 0,066 |
| PCR indéterminée | 358 | 234 | 0,084 | |
| PCR non réalisée | 24 | 9 | 0,067 |
L'antécédent de diabète avec suspicion de la COVID-19 entrainait à réaliser un angioscanner thoracique et cela de façon significative. La prescription de l'angioscanner s'avérait conforme et cela de façon significative car confirmait les présomptions d'embolie pulmonaire. Les patients avec une PCR positive (334), avaient réalisé autant d'angioscanner que ceux avec une PCR indéterminée (358) soit 44,20% contre 47,35%
Les lésions en verre dépoli et le crazy paving étaient significatives dans cette population d’étude en fonction des résultats de la PCR. trois cent (300) patients avaient du verre dépoli et une PCR indéterminée. Cent (100) patients à PCR indéterminée présentaient des lésions en crazy paving et cela de façon significative. Ces résultats sont présentés dans le Tableau 3 .
Tableau 3.
Répartition des patients en fonction de la PCR et des lésions élémentaires.
| Lésions élémentaires | PCR indéterminée | PCR négative | PCR positive | PCR non-réalisée | P-value |
|---|---|---|---|---|---|
| Verre dépoli | 300 | 20 | 135 | 20 | 0,012 |
| Crazy paving | 100 | 18 | 85 | 2 | 0,005 |
| Condensation | 92 | 12 | 75 | 11 | 0,362 |
| Autres | 100 | 00 | 47 | 00 | 0,827 |
L’étendue des lésions selon les comorbidités et le contexte clinique est illustrée par le Tableau 4 . Le Tableau 5 illustre la classification CO-RADS. Le Tableau 6 matérialise la corrélation entre les résultats PCR et le score CO-RADS. Parmi les patients ayant une PCR indéterminée, trois cent cinquante-neuf (359) étaient classés CO-RADS 5 de façon significative. Une PCR positive était liée au score CO-RADS 6.
Tableau 4.
Répartition des patients en fonction de l’étendue des lésions selon l’âge, les comorbidités et le contexte clinique.
| Étendue des lésions | Minime | Modérée | Importante | Sévère | Critique | P-value |
|---|---|---|---|---|---|---|
| Âge [17-40[ | 80 | 118 | 30 | 8 | 2 | 0,103 |
| [40-65[ | 35 | 70 | 146 | 165 | 69 | 0,012 |
| [65-100[ | 25 | 30 | 50 | 116 | 73 | 0,001 |
| Comorbidité | ||||||
| Diabète | 9 | 13 | 7 | 17 | 48 | 0,016 |
| HTA | 6 | 11 | 17 | 27 | 32 | 0,012 |
| IR | 4 | 7 | 5 | 9 | 6 | 0,007 |
| Autres | 16 | 30 | 25 | 14 | 11 | 0,568 |
| Contexte clinique | ||||||
| Dyspnée | 25 | 120 | 71 | 85 | 200 | 0,000 |
| Désaturation | 15 | 35 | 54 | 6 | 96 | 0,000 |
| Fièvre | 45 | 51 | 48 | 69 | 15 | 0,307 |
| Douleur thoracique | 25 | 50 | 73 | 52 | 150 | 0,047 |
| Toux | 101 | 101 | 85 | 98 | 32 | 0,118 |
| Autres | 26 | 9 | 29 | 14 | 15 | 0,898 |
Tableau 5.
«COVID-19 Reporting and Data System» (CO-RADS) pour la classification structurée des résultats de la tomodensitométrie dans le cadre de la COVID-19 [6].
| CO-RADS | Probabilité d'atteinte pulmonaire | Description |
|---|---|---|
| CO-RADS 0 | Pas d'interprétation possible | Technique tomodensitométrique insuffisante pour l'attribution d'un score |
| CO-RADS 1 | Très faible | Etat normal ou altérations non typiques d'une infection |
| CO-RADS 2 | Faible | Altérations typiques d'autres infections, mais pas d'une pneumonie due au COVID-19 |
| CO-RADS 3 | Non univoque | Signes non univoques d'une atteinte pulmonaire:• Autre pneumonie d'origine virale ou étiologie non infectieuse• Infiltrats en verre dépoli péri-hilaires• Petits infiltrats en verre dépoli non centrolobulaires, sans proximité avec la plèvre viscérale |
| CO-RADS 4 | Elevée | Suspicion de pneumonie due au COVID-19 (identique à CO-RADS 5 mais:• Localisation sans contact avec la plèvre viscérale• Distribution unilatérale et essentiellement péribronchovasculaire • Anomalies se superposant sur des anomalies pulmonaires diffuses sévères préexistantes) |
| CO-RADS 5 | Très élevée | Altérations typiques du COVID-19 |
| CO-RADS 6 | Mise en évidence certaine | Exclusivement possible via une PCR en temps réel positive pour le SARS-CoV-2 |
Tableau 6.
Corrélation entre les résultats PCR et le score CORADS.
| PCR | CO-RADS |
||||||||
|---|---|---|---|---|---|---|---|---|---|
| CO-RADS 3 |
CO-RADS 4 |
CO-RADS5 |
CO-RADS 6 |
P-Value | |||||
| Oui | Non | Oui | Non | Oui | Non | Oui | Non | ||
| Indéterminée | 69 | 54 | 10 | 50 | 359 | 50 | - | - | 0,021 |
| Négative | 18 | 17 | 3 | 00 | 10 | 2 | - | - | 0,100 |
| Non réalisée | 3 | 11 | 2 | 3 | 14 | 00 | - | - | 0,320 |
| Positive | - | - | - | - | - | - | 342 | - | 0,002 |
En fonction de l’étendue des lésions, les patients âgés de plus de 65 ans avaient plus de risque de faire des formes critique de façon significative.
La dyspnée et la désaturation étaient significativement associées à l’évolution vers une forme critique dans respectivement 40% et 46,60%.
Discussion
Notre étude détermine le profil scanographique des patients atteints de la pneumopathie à la COVID-19 dans notre contexte. Cela s'est réalisé avec quelques biais de sélection.
Le défaut de tests PCR, chez tous les patients, constitue une limite à cette étude car cela rend impossible le calcul de la valeur prédictive négative, de la sensibilité et de la spécificité de la TDM. Mais cette indisponibilité des tests PCR est également une raison de plus, pour recourir à la TDM, pour une prise en charge rapide et efficace surtout en cas de forte affluence de patients symptomatiques. Il y avait une prépondérance d'angioscanners thoraciques contrairement aux recommandations [10]. En effet Il n'y a pas de justification à injecter systématiquement les scanners lors du bilan initial sauf dans deux circonstances particulières : Une discordance entre des lésions parenchymateuses pulmonaires absentes ou minimes et un tableau clinique sévère compatible avec une EP. Devant des D-dimères très augmentés. Il n'y a pas de données validant un seuil de D-dimères à partir duquel l'angioscanner est indiqué. Plusieurs publications suggèrent que le risque d'embolie pulmonaire devient très important au-delà d'un seuil de D-dimères à 3000 μg/L 11, 12, 13.
La compréhension des présentations cliniques, biologiques et scanographiques des infections à la COVID-19 est indispensable pour le diagnostic, l'appréciation de la gravité de la pathologie et aussi pour l’évaluation de la réponse du traitement et le suivi.
Dans la présente étude, plus l’âge est élevé, plus l'atteinte est sévère avec un P significatif. La moyenne d’âge était de 56,95 ans et la majorité (42,38% des patients) avaient un âge compris entre 45 et 65 ans. Nos résultats étaient superposables à ceux de Niang à Dakar qui trouvait un âge moyen de 57 ans avec des extrêmes de 22 et 92 ans. La tranche d ´âge de 60-79 ans était la plus représentée avec 42,6% [14]. Ho en Chine retrouvait également un âge moyen de 56 ans dans son étude, une fréquence d’âge assez proche de la nôtre [15].
Les comorbidités sont des facteurs de risque possible d'augmentation de la sévérité de la pneumonie à SARS-CoV-2. Au cours de notre étude, 31,46% des patients avaient une pathologie chronique et le diabète était le plus représenté avec une fréquence de 29,37%, suivi de l'hypertension artérielle (HTA) avec 29,06%. En effet les patients porteurs de comorbidités sont plus fragiles devant les infections virales. Nos données sont similaires aux données tunisiennes de Louhaichi qui trouvait que 80% des patients atteints de la COVID-19 souffraient d'au moins une comorbidité́ et la majorité de ces comorbidités était représentée par l'hypertension artérielle à 68,75%, le diabète à 37,5% et l'insuffisance rénale chronique à 6,25% [16].
D'autres données provenant d'une série de 138 patients hospitalisés dans la région de Wuhan en Chine, ont également montré une forte prévalence d'au moins une comorbidité cardio-métabolique (hypertension artérielle et diabète notamment) chez les patients développant les formes les plus sévères. L'hypertension artérielle (HTA) a été retrouvée chez 58 % des patients, le diabète chez 22 % des patients [17].
Dans notre étude les plaintes étaient dominées par la dyspnée comme dans l’étude de Sahnoun en Algérie [18] qui retrouvait une symptomatologie dominée par la dyspnée à 81%, la toux à 60%, et à ceux de Guan en Chine [17] qui retrouvait également, majoritairement la fièvre (98,6%) et la toux sèche (59,4%). Ces données contrastent avec ceux de Ketfi [19] en Algérie qui notait l'asthénie comme le signe le plus représenté (80,2%) avec la dyspnée en deuxième position (29,1%).
Chez Louhaichi, [16] la fièvre était retrouvée chez tous les patients à 100%, puis la dyspnée et la toux avec une fréquence de 85% chacune. Ces chiffres sont similaires à ceux de Savadogo à Ouagadougou, rapportant également la fièvre (86%), la toux (69%) et la dyspnée (60%) comme symptomatologies majeures [20]. Zaimi à Rabat [21] retrouvait dans son étude comme symptomatologies majeures la toux et la fièvre avec des fréquences respectives de 41,3% et 34,80%. La dyspnée y était représentée dans une proportion de 4,3%. Pour Mesquita dans sa revue systématique, la dyspnée venait en troisième position (30,82%), la toux en deuxième (54,52%) et la fièvre en premier dans 58,66% [22].
Cet état de fait serait dû au caractère prospectif des études où les patients étaient évalués assez précocement, dès le début de la symptomatologie, avant le stade de sévérité clinique. La fièvre pourrait également être le premier signe dans notre étude mais faisait plus évoquer les pathologies parasitaires comme le paludisme fréquent dans notre contexte. Les patients présentant une dyspnée avaient réalisé un angioscanner thoracique dans 385 cas sur 501 soit 76,84%. La présence de ce signe orientait vers la suspicion d'embolie pulmonaire.
La TDM a une place prépondérante dans le diagnostic initial et l’évaluation de l'extension de l'atteinte respiratoire [23].
Les trois lésions élémentaires par ordre de fréquence décroissante étaient celles en verre dépoli, suivies des condensations et du crazy-paving. Nos résultats corroborent ceux de Ruch en France qui notait également une prédominance des lésions en verre dépoli avec 94,4%, [24] ceux de Zaimi à Rabat [21] qui trouvait 63% de lésions en verre dépoli représentant la plus grande majorité des lésions retrouvées dans son étude suivi du crazy paving à 23,9%, des condensations à 19,6%, du signe du halo inversé à 2,2%. Les fréquences des signes notées au cours de notre étude sont intermédiaires avec celles observées dans la littérature [25,26]. En effet dans les études similaires, [25,27] les fréquences des signes radiologiques étaient très variables : verre dépoli (56,4- 97,6%), [25,28,29] foyer de condensation (33,3–63,9%), [25,27] du crazy-paving (25,3%) [31].
L'aspect en plage qui était le plus représenté avec 44,35% a été noté par Ketfi [19] en Algérie avec 60%, l'aspect nodulaire dans son étude représentait 55,3%. En plus de ces deux types d'aspects nous avons noté également un aspect en bande dans 25,96% dans notre étude.
Dans la présente étude, les lésions étaient le plus souvent périphériques sous pleurales (81,51%) et à distribution bilatérale (82,79). Nos données étaient conformes à celles trouvées par Ketfi [19] qui notait les lésions périphériques sous pleurales dans 78,23 % et à majorité bilatérale (80,9%). Nos résultats étaient également superposables à ceux de Onana au Cameroun [29] qui retrouvait des lésions bilatérales dans 72 % des cas et périphériques dans 61,4%.
Des études similaires menées à Strasbourg par Ruch [24] retrouvaient la même tendance avec une fréquence élevée des lésions périphériques (78,5%) et bilatérale avec 85 à 100. Salehi [30] en Californie retrouvait dans sa revue systématique, des opacités en verre dépoli (88,0%), une atteinte bilatérale (87,5%), une distribution périphérique (76%) et multilobaire (plus d'un lobe) dans 78,8%. Les opacités en verre dépoli isolées ou une combinaison de condensation figuraient parmi les résultats les plus courants en tomodensitométrie.
Nos données rapportaient des lésions majoritairement postéro-basales avec une fréquence de 74,43%, ce qui est similaire aux données de Ketfi qui notait une fréquence de 61,2% des lésions postéro-basales [19].
La contradiction a été apportée par Li en chine qui a noté une prédominance de l'atteinte du lobe moyen (73,5%) et du lobe supérieur (61,7%) [31].
L'atteinte était sévère avec une fréquence de 28,42% puis, importante avec 22,22% et modérée avec 21,44%. Nos résultats contrastent avec ceux de Ruch qui notait une atteinte modérée à 39,2% et une atteinte sévère à 14,3% apparaissant en 4è position [24]. Ketfi en Algérie [19] quant à lui retrouvait une prédominance de l'atteinte légère avec 62,3 %, l'atteinte sévère n’était qu’à 11,8%.
La divergence dans les tableaux scanographiques est expliquée en partie, par le délai de réalisation de la TDM par rapport aux premiers symptômes [31]. En effet au stade initial, il y a une prédominance d'images en verre dépoli qui évoluent vers une association de verre dépoli, d'opacités réticulaires ou crazy paving et de foyers de condensation à un stade avancé. L'absence de données sur le début de la symptomatologie pourrait expliquer cet état de fait avec une grande prépondérance de condensation et de crazy paving.
L'embolie pulmonaire était la complication la plus importante dans 34,08%. Cela pourrait être dû au fort taux d'angioscanner réalisé au cours de cette étude. Cui et al. [32] en Chine retrouvait une fréquence de 25% et Ketfi rapportait 22,22% en Algérie et al. [10] Une autre étude chinoise menée par Zhang et al. [33] retrouvait 17% d'embolie pulmonaire. Le caractère thrombotique de cette pathologie virale et le délai de réalisation tardif de l'angioscanner avec une évolution défavorable entrainant la réalisation de l'angioscanner chez la plupart des patients ayant des comorbidités pourrait expliquer également cet état de fait constaté.
Les résultats de la PCR étaient positifs au SARS-COV-2 chez 33,63% (n = 342 cas). Niang à Dakar retrouvait 37,5% [14]. Nos données différaient de ceux de Onana [29] à Douala qui avait noté des tests PCR positifs chez 89,7% des patients au cours de son étude. Cette différence pourrait s'expliquer par le mode de sélection des patients et le fait que plus de la moitié de nos patients (58,21% des cas soit 592) avaient un test PCR indéterminé, devant l’évolution parfois grave ou défavorable, le scanner était demandé avant la confirmation PCR.
Le score CO-RADS [6,34] était précisé dans 80,14% des comptes rendus (n = 815).
Le score CO-RADS 5 était le plus représenté avec 47% des cas. Zaimi retrouvait une prédominance de la classification CORADS 5 avec une fréquence de 34,8% [21]. Par contre Onana à Douala notait une prédominance de la classification CORADS 4 [29]. Cette différence pourrait provenir du fait que les patients n'avaient pas été vus au même stade de la symptomatologie. Le retard de consultation pourrait montrer des lésions pulmonaires à un stade avancé.
Pour identifier tous les facteurs influençant l’évolution de la pneumopathie à la COVID-19, nous avons soumis en analyse statistique les variables : extension des lésions et complications d'une part avec les paramètres tels que l’âge, le motif de consultation, les comorbidités, le type d'examen demandé et les résultats PCR d'autre part.
En effet nous avons noté qu'il existait un lien statistiquement significatif entre l’âge et l’étendue des lésions avec une p-value de 0,0123, ce qui contraste avec les données de Ruch en France [24] qui ne notait pas de différence dans l'atteinte pulmonaire en termes d’âge (p-value=0,69).
Il existait également une influence positive de l'HTA, du diabète et de l'insuffisance rénale avec des p-value respectives de 0,012 ; 0,017 et 0,008. Par contre, l’étude de Ruch n'a noté aucune corrélation entre les comorbidités et l’étendue des lésions: le diabète (p-value= 0,95) l'HTA (p-value=0,93) [24].
Quant à la symptomatologie telle que la dyspnée (p-value < 0,05), la désaturation (p-value <0,05) et la douleur thoracique (p-value=0,0472), elles avaient une influence sur l’étendue de l'atteinte pulmonaire. Nos données diffèrent de celles de Ruch qui ne notait pas de lien entre le contexte clinique (motif de consultation) et l’étendue des lésions (p-value > 0,05) [24].
La corrélation entre le résultat PCR et les lésions élémentaires identifiées notait un lien entre les lésions type verre dépoli et crazy paving et le test positif de la PCR contrairement aux autres lésions élémentaires avec des p-value > 0,05.
La présente étude nous a permis de noter que le contexte clinique influençait sur le choix du type d'examen scanographique. L'angioscanner était l'examen le plus demandé devant la dyspnée (p-value <0,05). Était – ce le retard à la consultation ou à la prise en charge au stade de complication qui motivait cette forte demande d'angioscanner, qui n'est pas le premier examen à demander en cas de suspicion ou même pour évaluer les lésions de la COVID -19?
Conclusion
La cible principale du virus SARS-CoV-2 est le poumon. Cette étude a déterminé dans le contexte pandémique actuel, le profil scanographique des patients reçus ou suspects de la COVID-19.
L'angioscanner thoracique qui ne doit pas être demandé en première intention devant une suspicion de pneumopathie à COVID-19 était majoritaire. Les lésions retrouvées au niveau scanographiques étaient le verre dépoli.
L'attente était majoritairement sévère chez des patients à majorité porteurs d'une comorbidité.
La vaccination n'a pas pu montrer son intérêt dans cette étude mais serait un élement à prendre en compte pour l'évolutivité des lésions scanographiques.
La connaissance des profils de l'infection à la COVID-19 contribuera à faire progresser les stratégies de contrôle de l'infection, d'où la nécessité d’élargir ces études, surtout dans le volet prospectif et de démystifier cette maladie pour mieux la connaitre.
Footnotes
Contributeurs: Tous les auteurs ont contribué à la conception l'ouvrage, à l'acquisition, à l'analyse ou à l'interprétation des données. Tous lesauteurs ont participé à la rédaction et aux commentaires de l'article etont approuvé la version finale.
Financement: Cette étude n'a re..u aucune subvention spécifique d'organismes definancement des secteurs public, commercial ou à but non lucratif.
Intér.¼ts concurrents: Tous les auteurs ont rempli le formulaire de divulgation uniforme del'ICMJE et ne déclarent aucun conflit d'intér.¼ts.
Approbation éthique: Le comité d'éthique national a donné son approbation pour la réalisation de cette étude.
Competing Interest: Les auteurs ne déclaent aucun conflit d'intér.¼t en lien avec cet article.
Références
- 1.Bernheim A., Mei X., Huang M., Yang Y., Fayad Z.A., Zhang N, et al. Chest CT findings in Coronavirus disease-19 (COVID-19): relationship to duration of infection. Radiology. 2020 doi: 10.1148/radiol.2020200463. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Bonny V., Maillard A., Mousseaux C., Plaçais L., Richier Q Q. COVID-19: pathogenesis of a multi-faceted disease. Rev Med Interne. 2020;41(6):375–389. doi: 10.1016/j.revmed.2020.05.003. May 27. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Chen N., Zhou M., Dong X., Qu J., Gong F., Han Y., et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020:507–513. doi: 10.1016/S0140-6736(20)30211-7. Janv S0140673620302117. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Chung M., Bernheim A., Mei X., Zhang N, Huang M., Zeng X., et al. CT imaging features of 2019 novel coronavirus (2019-nCoV) Radiology. 2020;295(1):202–207. doi: 10.1148/radiol.2020200230. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Lodé B., Jalaber C., Orcel T., Morcet-Delattre T., Crespin N., Voisin S., et al. Imagerie de la pneumonie COVID-19 [Imaging of COVID-19 pneumonia] J d’Imag Diagn Interv. 2020;3(4):249–258. doi: 10.1016/j.jidi.2020.04.011. SepFrenchEpub 2020 May 7. PMCID: PMC7203047. [DOI] [Google Scholar]
- 6.Penha D., Pinto E.G., Matos F., Hochhegger B., Monaghan , C., Taborda-Barata L., et al. CO-RADS: coronavirus classification review. J Clin Imag Sci. 2021;11:9. doi: 10.25259/JCIS_192_2020. Feb 15PMID: 33767901; PMCID: PMC7981938. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Division of Health Informatics & Surveillance (DHIS), Center for Surveillance, Epidemiology & Laboratory Services (CSELS) Epi Info™, Page last reviewed: September 16, 2021.
- 8.AuthorAID Team Statistical tools for high-throughput data analysis (STHDA) Student Test. 2020 [Google Scholar]; http://www.sthda.com/english/Oct.20
- 9.Barnier J. Groupe de recherche sur la socialisation CNRS – UMR 5040 tout ce que vous n'avez jamais voulu savoir sur le χ2 sans jamais avoir eu envie de le demander jbarnier@ens-lsh. Fr 15 avril 2008: http://perso.ens-lsh.fr/jbarnier/pdf/khi2.pdf
- 10.Revel M.P., Parkar A.P., Prosch H., Silva M., Sverzellati N., Gleeson F., et al. COVID-19 patients and the radiology department - advice from the European Society of Radiology (ESR) and the European Society of thoracic imaging (ESTI) Eur Radiol. 2020;30:4903–4909. doi: 10.1007/s00330-020-06865-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Tang N., Bai H., Chen X., Gong J., Li D., Sun Z., et al. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost. 2020;18:1094–1099. doi: 10.1111/jth.14817. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Lin L., Lu L., Cao W., Li T. Hypothesis for potential pathogenesis of SARS-CoV-2 infection-a review of immune changes in patients with viral pneumonia. Emerg Microbes Infect. 2020;9:727–732. doi: 10.1080/22221751.2020.1746199. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Bompard F., Monnier H., Saab I., Tordjman M., Abdoul H., Fournier L., et al. Pulmonary embolism in patients with COVID-19 pneumonia. Eur Respir J. 2020;56 doi: 10.1183/13993003.01365-2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Niang I., Diallo I., Diouf J.C.N., Ly M., Touré M.H., Diouf N.K., et al. Tri et détection du COVID-19 par TDM thoracique low-dose chez des patients tout-venant au service de radiologie de l’hôpital de Fann (Dakar- Sénégal) Pan Afr Med J. 2020;37(Supp 1):22. doi: 10.11604/pamj.supp.2020.37.1.26140. 13 Oct. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Ho Y.F.W., Wong H.Y.F., Fong A.H, Leung ST S.T, Chin T.W, Lo C.S.Y, et al. Frequency and distribution of chest radiographic findings in patients positive for COVID-19. Radiology. 2020;296(2):E72–E78. doi: 10.1148/radiol.2020201160. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Louhaichi S., Allouche A., Baili H., Jrad S., Radhouani A., Greb D, et al. Features of patients with 2019 novel coronavirus admitted in a pneumology department: the first retrospective tunisian case series. La Tunis Méd. 2020;98(04):261–265. [PubMed] [Google Scholar]
- 17.Guan W., Ni Z., Hu Y., Liang W., Ou C., He J., et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl JMed. 2020;382(18):1708–1720. doi: 10.1056/NEJMoa2002032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Sahnoun E.A, Bouhadda M., Bouatam S., Dali Youcef N., Lellou S. Profil scanographique des patients atteints de COVID-19. A Propos de 93 CAS en Algérie. RMRA. 2021;13(issue1):140–141. doi: 10.1016/j.rmra.2020.11.296. [DOI] [Google Scholar]
- 19.Ketfi A., Chabati O., Chemali S., Mahjoub M., Gharnaout M., Touahri R., et al. Profil clinique, biologique et radiologique des patients algériens hospitalisés pour COVID-19 : données préliminaires. Pan Afr Med J. 2020;35(suppl 2):77. doi: 10.11604/pamj.supp.2020.35.2.23807. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Savadogo M., Ouattara A., Dahani C.K., Nikiéma O., Traoré S., Nagréongo B., et al. Profil épidémiologique et clinique des cas suspects de COVID-19 reçus au CHU-yalgado ouédraogo du Burkina Faso. Rev Mali d’Infect et de Microbiol. 2021;16(1):03–07. doi: 10.53597/remim.v16i1.1753. [DOI] [Google Scholar]
- 21.Zaimi S. Expérience de l'HMIMV de Rabat: A Propos de 46 cas. Université Mohammed V, Faculté de médecine et de pharmacie, Thèse Méd; Rabat: 2020. Début de la pandémie COVID 19: Quels aspects en imagerie? p. 54. [Google Scholar]
- 22.Da Rosa Mesquita R., Francelino Silva Junior L.C., Santos Santana F.M., Farias de Oliveira T., Campos Alcântara R., Monteiro Arnozo G., et al. Clinical manifestations of COVID-19 in the general population: systematic review. Wien Klin Wochenschr. 2021;133:377–382. doi: 10.1007/s00508-020-01760-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Kanne J.P. Chest CT findings in 2019 novel coronavirus (2019-nCoV) infections from Wuhan, China: key points for the radiologist. Radiology. 2020;295(1):16–17. doi: 10.1148/radiol.2020200241. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Ruch Y., Kaeuffer C., Ohana M., Labani A., Kepka S., Solis M., et al. La quantification scanographique des lésions pulmonaires comme facteur pronostique d’atteinte sévère chez les patients COVID-19 au CHRU de Strasbourg (France) Méd et Mal Infect. 2020;(6):160. doi: 10.1016/j.medmal.2020.06.160. septembre 2020. P 01-2. [DOI] [Google Scholar]
- 25.Wang D., Hu B., Hu C., Zhu F., Liu X., Zhang J., et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus–infected pneumonia in Wuhan, China. JAMA. 2020;323(11):1061–1069. doi: 10.1001/jama.2020.1585. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Lodé B., Jalaber C., Orcel T., Morcet-Delattre T., Crespin N., Voisin S., et al. Imagerie de la pneumonie COVID- 19. J Imag Diagn Interv. 2020;3(4):249–258. doi: 10.1016/j.jidi.2020.04.011. 1 sept. [DOI] [Google Scholar]
- 27.Njonnou S.R.S., Lekpa F.K., Ouankou C.N., Balti E.V., Choukem S.P. United#Covid-19 FT. The challenge of COVID- 19 case identification and ascertainment in sub-Saharan Africa: the case of cameroon. Pan Afr Med J. 2020;35(84) doi: 10.11604/pamj.supp.2020.35.24368. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Li K., Wu J., Wu F., Guo D., Chen L., Fang Z., et al. The clinical and chest CT features associated with severe and critical COVID-19 pneumonia. Invest Radiol. 2020;55(6):327–331. doi: 10.1097/RLI.0000000000000672. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Onana Y.R, Balkissou A.D., Tambe J., Mbozo’o S., Amougou JC.M., Tamchom D.D., et al. Relation entre le stade clinique et les signes scanographiques de la COVID-19 à l’hôpital gynéco obstétrique et pédiatrique de Douala. Health Sci Dis. 2021;22(4):1–8. [Google Scholar]
- 30.Salehi S., Abedi A., Balakrishnan S., Gholamrezanezhad A. Coronavirus disease 2019 (COVID-19): a systematic review of imaging findings in 919 patients. AJR Am J Roentgenol. 2020;215(1):87–93. doi: 10.2214/AJR.20.23034. JulEpub 2020 Mar 14. PMID: 32174129. [DOI] [PubMed] [Google Scholar]
- 31.Li M., Dong Y., Wang H., Guo W., Zhou H., Zhang Z., et al. cardiovascular disease potentially contributes to the progression and poor prognosis of COVID-19. Nutr Metab Cardiovasc Dis. 2020;30(7):1061–1067. doi: 10.1016/j.numecd.2020.04.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Cui S., Chen S., Li X., Liu S, Wang F. Prevalence of venous thromboembolism in patients with severe novel coronavirus pneumonia. J Thromb Haemost. 2020;18:1421–1424. doi: 10.1111/jth.14830. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Zhang R., Ni L., Di X., Wang X., Ma B., Niu S, et al. Systematic review and meta-analysis of the prevalence of venous thromboembolic events in novel coronavirus disease-2019 patients. J Vasc Surg Venous Lymphat Disord. 2021;9(2):289–298.e5. doi: 10.1016/j.jvsv.2020.11.023. Epub 2020 Dec 9. PMID: 33309903; PMCID: PMC7725061. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Prokop M, van Everdingen W, van Rees Vellinga T, Quarles van Ufford H, Stöger L, Beenen L. et al. : For the COVID-19 Standardized Reporting Working Group of the Dutch Radiological Society. CO-RADS: A Categorical CT Assessment Scheme for Patients Suspected of Having COVID-19-Definition and Evaluation. Radiology. 2020 Aug;296(2):E97-E104. doi: 10.1148/radiol.2020201473. Epub 2020 Apr 27. PMID: 32339082; PMCID: PMC7233402. [DOI] [PMC free article] [PubMed]