Abstract
Les infections à poxvirus (PXV) sont fréquemment responsables de manifestations cutanées. En France, certaines poxviroses sont fréquentes et bénignes (molluscum contagiosum), alors que d’autres sont exceptionnelles mais potentiellement graves (cowpoxvirus [CPXV]). Si seuls le virus de la variole et le molluscum contagiosum virus sont à réservoir humain et à transmission interhumaine, la plupart des infections à poxvirus sont des zoonoses avec un réservoir animal distinct. Seule une partie des poxvirus est responsable d’infections humaines, mais l’augmentation du nombre des nouveaux animaux de compagnie, parfois exotiques, et la rapidité des voyages internationaux exposent au risque de transmission de PXV zoonotiques à de nouveaux vecteurs et leur diffusion, à de nouvelles régions du monde. En France, le molluscum contagiosum, l’orf et le nodule du trayeur sont responsables de multiples consultations et sont bien connus des dermatologues. Toutefois d’autres parapoxvirus de présentations proches de l’orf ne doivent pas être méconnus ; ainsi le CPXV ou le monkeypox virus sont considérés comme des virus potentiellement émergents avec un fort risque d’épidémie et de diffusion du fait de l’exacerbation des transports internationaux et de la perte de la protection vaccinale antivariolique. Enfin, malgré une éradication déclarée, la variole fait l’objet d’une surveillance du fait d’un risque potentiel de réintroduction accidentelle ou volontaire par le bioterrorisme.
Mots clés: Poxvirus, Variole, Molluscum contagiosum, Orf, Parapoxvirus, Orthopoxvirus
Abstract
Poxvirus (PXV) infections are a common cause of cutaneous signs. In France, certain forms of poxvirus are frequent and benign (molluscum contagiosum), while others are rare but potentially serious (cowpox virus [CPXV]). Whereas only smallpox and molluscum contagiosum viruses have a human reservoir and are transmitted between humans, most poxvirus infections are zoonoses having only animal reservoirs. Only a small number of poxviruses are responsible for infection in humans, but the increasing number of new pets, some of which are exotic, coupled with the rapid rise in international travel are creating a greater risk of transmission of zoonotic PXV to new vectors and of spread of these diseases to new regions throughout the world. In France, molluscum contagiosum, orf and milkers’ nodule give rise to numerous consultations and are well known to dermatologists. However, dermatologists must also be able to identify other parapoxviruses of similar presentation to orf; thus, CPXV and monkeypox are considered potentially emergent viruses with a high risk of epidemic and spread due to increasing international transport and the loss of the maximum protection against smallpox. Finally, despite its declared eradication, smallpox is currently being monitored because of the potential risk of reintroduction, whether accidentally or deliberately through bioterrorism.
Keywords: Poxvirus, Smallpox, Molluscum contagiosum, Orf, Parapoxvirus, Orthopoxvirus
Introduction
Seule une partie des poxvirus (PXV) est responsable d’infections humaines au cours desquelles les manifestations cutanées dominent souvent le tableau clinique ; certaines, telles que le molluscum contagiosum ou l’orf, sont bénignes mais responsables de consultations fréquentes en dermatologie, tandis que d’autres sont rares ou exceptionnelles mais parfois sévères [1], [2]. Le variola virus (VARV), responsable de la variole, est moins connu du fait de son éradication [3]. Le molluscum contagiosum virus (MCV) est le PXV le plus fréquemment rencontré en dermatologie, les zoonoses à PXV (ZPXV), plus rares, ont une présentation pouvant être confondues avec la varicelle ou la variole dont la réémergence est surveillée du fait d’un risque potentiel de réintroduction accidentelle ou volontaire par le bioterrorisme [4]. D’autre part, l’augmentation du nombre des nouveaux animaux de compagnie, parfois exotiques, et la rapidité des voyages internationaux exposent au risque de transmission de PXV zoonotiques à de nouveaux vecteurs et leur diffusion, à de nouvelles régions du monde.
Généralités
Agents responsables – Physiopathogénie virale
La famille des Poxviridae se compose de deux sous-familles : les Entomopoxvirinae, infectant les insectes, et les Chordopoxvirinae infectant les vertébrés [1]. Le tropisme de ces virus pour les revêtements épithéliaux est à l’origine de lésions fréquemment pustuleuses ; ce qui leur a valu le déterminant « pox » (pustule).
Spectre d’hôte et cycle viral
VARV et MCV ont un réservoir naturel humain ; les autres PXV ont un réservoir naturel animal, parfois non confirmé (Tableau 1 ).
Tableau 1.
Poxvirus responsables d’infections humaines–Épidémiologie.
| Genre | Virus | Répartition mondiale | Réservoir naturel | Transmission interhumaine | Fréquence | Groupe à risque | Cas rapportés en France | Immunité croisée par vaccin variolique |
|---|---|---|---|---|---|---|---|---|
| Orthopoxvirus | Vaccine | – | Inconnu | Possible | – | Vaccinés | – | Oui |
| Variole | – | Humain | Oui | – | – | – | ||
| Cowpox | Royaume-Uni Europe Russie |
Petits rongeurs, chats | Oui | Rare | Propriétaires de rats ou de chats domestiques | Rares | Oui | |
| Monkeypox | RDCCongo | Écureuils/rongeurs | Oui | Extrêmement rare | Enfants | Non | Oui | |
| Buffalopox | Inde | Buffle d’eau | Oui | Rare | Éleveur | Non | Oui | |
| Cantagalo and Araçatuba | Brésil | Bovins, rongeurs | – | Extrêmement rare | Éleveur | Non | Oui | |
| Parapoxvirus | Orf | Mondiale | Mouton, chèvre | Rare | Fréquent | Travailleurs de la filière des ovins et caprins | Fréquents | Non |
| PCPX/SPB | Mondiale | Bovins | Rare | Fréquent | Trayeur/vétérinaires | Fréquents | Non | |
| Deerpox | Colonies de cerfs | Cerf | Non | Très rare | Chasseurs | Non | Non | |
| Sealpox | Colonies de phoques | Phoque | Non | Très rare | Dresseurs, soigneurs | Non | Non | |
| Yatapoxvirus | Tanapox | KenyaRDC | Singe, insecte ? | Non | Très rare | Voyageurs | Non | Non |
RDC : République démocratique du Congo ; PCPX/SPB : pseudocowpox/stomatite papuleuse bovine.
Réponse immunitaire et échappement viral
Les PXV entraînent une activation de l’immunité innée puis adaptative, initialement cellulaire puis humorale, expliquant la gravité de certaines poxviroses chez les patients atteints de déficit immunitaire [5]. Après vaccination par le virus de la vaccine (VACV), un titre élevé d’anticorps, observé dès la fin de la première semaine, persiste pendant plusieurs années [5]. Le tropisme cellulaire est aussi sous la dépendance de mécanismes de survie cellulaire et d’évasion à la réponse immunitaire de l’hôte [6]. À ces fins, les PXV sécrètent des cytokines ou des récepteurs cytokiniques ciblant les médiateurs de l’immunité innée, tels que les interférons (IFN), les interleukines, le complément, le tumor necrosis factor (TNF) et certaines chémokines, ainsi que des serpines [6], [7], [8]. Certains mécanismes empêchent la présentation correcte des antigènes viraux aux lymphocytes et d’autres inhibent l’apoptose [9].
Présentation clinique des poxviroses
Infections spécifiques à l’homme
Variole
Responsable de millions de décès au cours des siècles, l’histoire de la variole comporte certains des pires moments et des plus grandes réussites de l’humanité [10], [11].
L’origine géographique et le réservoir naturel animal du VARV sont inconnus [5]. La variole aurait eu un réservoir animal maintenant disparu. Le réservoir strictement humain a permis la campagne de vaccination mondiale de l’Organisation mondiale de la santé (OMS), débutée en 1967 et son éradication en 1980. Des stocks de virus sont conservés dans deux laboratoires, aux États-Unis et en Russie [5]. Les craintes actuelles portent sur le risque de réémergence naturelle, accidentelle ou intentionnelle (terrorisme, guerre) du VARV.
Vaccine
Le VACV a remplacé le cowpoxvirus (CPXV) pour l’élaboration du vaccin variolique au XIXe siècle. Cette vaccination, qui confère une immunité croisée contre les autres orthopoxvirus (OPXV) (Tableau 1), ne concerne plus en France que les membres de l’équipe d’intervention nationale contre la variole et certains chercheurs des deux laboratoires P4 français [12].
Molluscipoxvirus : molluscum contagiosum virus
Il existe quatre sous-types de MCV, seul membre du genre Molluscipoxvirus [13]. Le MCV-1 (98 %), mondialement distribué, est le plus fréquent chez les enfants [14]. MCV-3 et MCV-4 sont présents en Asie et en Australie ; MCV-2 est le plus souvent retrouvé chez les patients atteints du virus de l’immunodéficience humaine (VIH) [15]. Disposant d’un réservoir strictement humain, le MC survient par foyers de cas sporadiques dans certaines communautés : enfants, immunodéprimés, et jeunes adultes immunocompétents sexuellement actifs mais non immunisés [16], [17].
Le MCV est le plus souvent transmis par contact interhumain direct, parfois lors de rapports sexuels [17], [18]. La transmission est rarement congénitale ou indirecte via des vecteurs passifs, notamment dans les piscines ou lors d’un tatouage [17]. L’auto-inoculation est fréquente lors du grattage ou du rasage [19]. Après un temps d’incubation de 0,5 à 6 mois, le MCV se manifeste par de petites papules translucides ou de couleur chair, fermes, hémisphériques, à surface lisse, de 3 à 5 mm de diamètre, qui contiennent une substance blanchâtre et crémeuse [17]. Une ombilication centrale est évocatrice du diagnostic. De nombreuses présentations sont décrites : grande taille ou pseudotumorale fréquente chez l’immunodéprimé, pédiculée, furonculoïde, verruqueuse, à type de folliculite ou d’érythème polymorphe [17]. Le nombre de lésions est généralement inférieur à 20 chez l’immunocompétent. Les régions les plus souvent atteintes (> 20 %) sont le visage, le tronc, les plis axillaires et les membres inférieurs [20]. L’atteinte génitale n’est pas exceptionnelle chez l’adulte, notamment porteur du VIH [21].
Les formes disséminées (jusqu’à 100 lésions), profondes ou chroniques, atteignent les patients immunodéprimés ou présentant une dermatite atopique (Fig. 1 ) [17], [22], [23]. L’infection est favorisée par l’immunodépression locale induite par certaines tumeurs cutanées ou certains traitements locaux et peut régresser à l’arrêt de la médication [24], [25].
Figure 1.
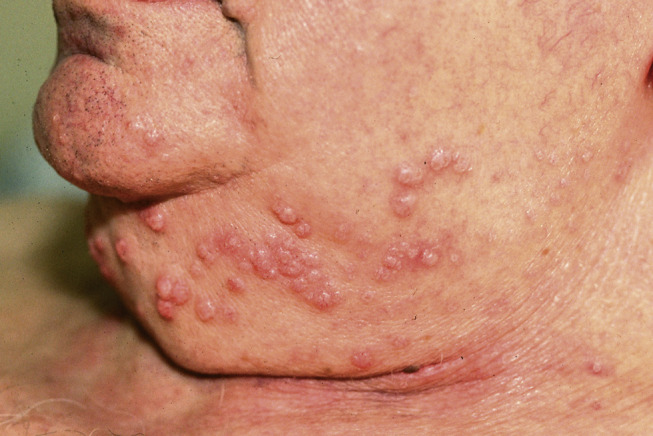
Molluscum contagiosum profus chez un patient immunodéprimé.
Chaque lésion de MC persiste en moyenne deux mois [17]. Chez l’immunocompétent, la guérison spontanée de l’ensemble des lésions de MC survient en moyenne en huit mois, laissant parfois une cicatrice anétodermique [26], [27]. Certaines lésions deviennent eczématiformes lors de la détection par le système immunitaire avant de disparaître rapidement car le MCV est un immunogène puissant. Les complications sont l’impétiginisation, l’abcédation ou l’eczématisation [17].
Anthropozoonoses à poxvirus
Du fait de la dispersion géographique des PXV et de leurs réservoirs respectifs, certaines ZPXV sont endémiques à l’échelle mondiale (orf, pseudocowpoxvirus) ; d’autres sont restreintes à certains continents (CPXV) ou à certaines régions (monkeypoxvirus [MPXV], tanapoxvirus [TPXV]) (Tableau 1) [5], [28]. L’augmentation d’incidence des infections à OPXV est en partie liée à la perte progressive de la couverture vaccinale antivariolique (Tableau 1).
La plupart des ZPVX sont contractées via une plaie cutanée, après un contact direct avec une carcasse ou un animal vivant infectés [28], [29]. Les réservoirs et vecteurs sont généralement des vertébrés, aussi bien des animaux d’élevage, de dressage, que des animaux sauvages (Tableau 1). Ils présentent le plus souvent des lésions évocatrices vésiculopustuleuses puis croûteuses, périmamellaires et buccales [30], [31]. L’inoculation indirecte via des fomites est rare. Les vecteurs de chaque PXV étant restreints à quelques espèces, les ZPXV sont limitées à certains groupes professionnels ou occupationnels (Tableau 1). Toutes présentent un risque d’auto-inoculation.
Les ZPVX sont à l’origine de cas sporadiques et isolés. La transmission interhumaine est possible pour tous les PXV bien que les épidémies humaines soient rares, avec des taux d’attaque secondaire variables [32]. Le risque d’infection nosocomiale est cependant réel [33], [34]. La durée d’incubation est en moyenne d’une semaine (Tableau 2 ).
Tableau 2.
Clinique des zoonoses à poxvirus.
| Virus | Inoculation | Incubation (jours) | Nombre de lésions | Manifestations cutanées | Signes générauxManifestations extracutanées | Complications | Décès | Guérison (semaines) |
|---|---|---|---|---|---|---|---|---|
| Cowpox | Cutanée | 7 | 1 à quelques | Placard érysipéloïde puis vésicobullepuis ulcération croûteuse | Syndrome pseudogrippal initial ADP régionale |
Cicatrices profondes varioliformes | Possible | 3–4 |
| Monkeypox | Cutanée, respiratoire | 7–17 | VariableQuelques à multiples | Rash aigu maculeux puis éruption similaire à la variole | Syndrome pseudogrippal initial Fièvre élevéeSignes respiratoires ADP |
Surinfections respiratoires Surinfections cutanées Cicatrices profondes défigurantes Cécité |
Possible | 2–4 |
| Buffalopox | Cutanée | 7 | 1 à quelques | Vésiculopustules < 1 cm Placard inflammatoire |
Syndrome pseudogrippal initial modéré ADP régionales |
Cicatrices varioliformes Cécité |
Non | 2–3 |
| Cantagalo etAraçatuba | Cutanée | 7 | 1 à quelques | Idem buffalopox | Idem buffalopox | – | Non | 2–3 |
| Orf | Cutanée | 3–7 | 1 à quelques | Nodules violacésmains | Signes généraux rares | Atteinte oculaire Cicatrices mineures |
Non | 4–8 |
| PCPX/SPB* | Idem orf | Idem orf | Idem orf | Idem orf | Idem orf | Cicatrices mineures | Non | Idem orf |
| Deerpox | Idem orf | Idem orf | Idem orf | Idem orf | Idem orf | Cicatrices mineures | Non | Idem orf |
| Sealpox | Idem orf | Idem orf | Idem orf | Idem orf | Idem orf | Cicatrices mineures | Non | Idem orf |
| Tanapox | Cutanée | – | 1–10 | Papule/vésiculeuse ombiliquée Puis ulcération nécrotique Membres inférieurs |
Syndrome pseudogrippal ADP |
Cicatrices | Non | 6 |
PCPX/SPB : pseudocowpox/stomatite papuleuse bovine ; ADP : adénopathies.
Les ZPXV sont responsables de tableaux cliniques proches associant un syndrome pseudogrippal d’intensité variable suivi par l’apparition de manifestations cutanées proches, souvent associées à des adénopathies régionales [2], [5], [28]. Les lésions, souvent peu nombreuses, prédominent sur les zones de contact avec l’environnement (mains, bras, visage) et évoluent selon une histoire naturelle commune. De macules puis papules érythémateuses initiales, les lésions deviennent rapidement des vésiculobulles, souvent ombiliquées, puis des pustules fermes contenant un matériel blanchâtre. L’évolution vers une ulcération escarotique en quelques jours laisse, après une guérison lente, des cicatrices parfois marquées [2], [5]. Seules certaines ZPXV se compliquent de décès ou de manifestations sévères (Tableau 2), qui, comme les atteintes extensives, sont plus fréquentes chez les enfants, les patients immunodéprimés ou ayant une dermatose chronique préexistante [35], [36], [37]. Les modes de transmission, la période d’incubation et les manifestations cliniques des ZPXV sont résumés dans les Tableau 1, Tableau 2 ; seules les particularités sont détaillées ici (cf. infra).
Infections à orthopoxvirus
Cowpoxvirus
L’infection humaine à cowpoxvirus CPXV reste rare, mais son incidence en Europe augmente du fait de la perte de la protection vaccinale antivariolique, faisant craindre des épidémies [26], [38], [39]. Des cas sont rapportés en France depuis 2004 [40], [41], [42], [43]. Moins fréquente que l’orf, une lésion typique siégeant sur les mains ou le visage et la notion de contact avec un chat doivent faire suspecter le diagnostic. Les formes cutanées extensives et les complications respiratoires ou oculaires, parfois fatales, sont rares [36], [39], [44], [45]. La guérison peut prendre jusqu’à 12 semaines.
Monkeypoxvirus
Le premier cas humain d’infection à monkeypoxvirus (MPXV) est rapporté en 1970 [46], [47]. La majorité des cas est rapportée chez des enfants d’Afrique centrale où l’incidence pourrait être sous-évaluée [47], [48], [49]. Le risque d’épidémie maintenue par transmission interhumaine semble peu élevé car les épidémies sont rares bien qu’un taux d’attaque secondaire de 9,3 % soit rapporté [50], [51]. La mondialisation, les transports internationaux et l’essor des animaux de compagnie exotiques, conjugués à l’arrêt de la vaccination antivariolique pourraient changer ces constats. En effet, l’importation d’animaux vecteurs peut introduire le MPXV dans un nouveau biotope, comme l’a montré l’épidémie survenue dans six États des États-Unis en 2003 [52], [53]. Le mode de transmission et les manifestations cliniques sont proches de ceux de la variole avec un syndrome pseudogrippal initial suivi d’une éruption faite d’un nombre variable de lésions à l’évolution varioliforme, siégeant sur les zones découvertes. La sévérité et la mortalité étaient moindres lors de l’épidémie américaine que dans les séries africaines où 70 % des cas avaient plus de 100 lésions et où 9 à 15 % de décès étaient rapportés [48]. Les complications sont similaires à la variole, bien que moins fréquentes et sévères [48]. Des ulcérations orales, des blépharites, des conjonctivites, des manifestations pharyngées ou respiratoires sont observées dans deux tiers des cas [48].
Autres orthopoxvirus : buffalopox (BPXV), virus d’Araçatuba et virus de Cantagalo [54], [55], [56], [57]
Parfois transmis aux animaux par des humains récemment vaccinés pendant la campagne de vaccination de l’OMS, le VACV aurait pu évoluer chez ceux-ci pour aboutir à ces virus émergents, présentant une forte homologie génétique avec le VACV et responsables d’infections peu sévères chez l’homme [5].
Infection à parapoxvirus (PPXV)
Orf, nodule du trayeur et stomatite papuleuse bovine
L’orf virus (ORFV) infecte les ovins et les caprins et est responsable de l’orf chez l’homme. Le pseudocowpoxvirus (PCPXV) et le virus de la stomatite papuleuse bovine sont deux virus distincts infectant le bétail ; le premier est responsable de lésions des mamelles (paravaccine) et le second, de lésions péribuccales [58]. Chez l’homme, ils sont responsables du nodule du trayeur, survenant chez les vétérinaires et les éleveurs laitiers (Fig. 2 ) [59].
Figure 2.
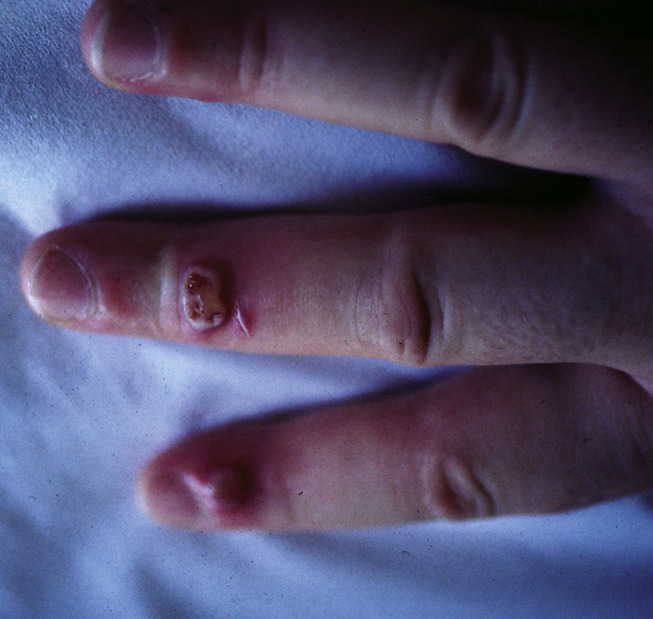
Nodule d’orf.
L’orf et le nodule du trayeur sont deux infections occupationnelles de distribution mondiale touchant les adultes [29], [58], [60]. Contrairement aux OPXV, l’ORFV et le PCPXV n’entraînent pas de signes généraux et d’adénopathie, sauf en cas de surinfection bactérienne. L’ORFV est responsable de petites épidémies annuelles, fréquentes en France à l’automne à la suite des abattages lors des pratiques religieuses de la fête de l’Aïd al-Kébir [61]. La transmission interhumaine est très rare. Des cas atypiques à type d’érythème polymorphe, de nécrolyse épidermique toxique, de dermatose bulleuse auto-immune ont été décrits (Fig. 3 ) [62], [63]. Des formes profuses, géantes ou compliquées d’atteintes muqueuses sont rapportées chez les patients immunodéprimés ou atopiques [35]. L’orf ne présente pas de risque pendant la grossesse [64].
Figure 3.
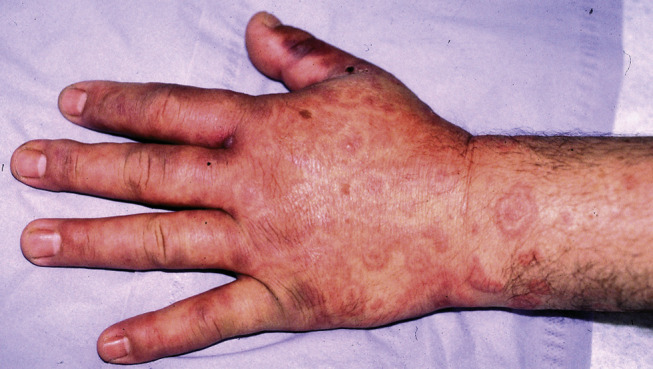
Nodule d’orf du pouce et érythème polymorphe.
Deerpox, sealpox [65], [66], [67]
Le contact plus inhabituel avec des animaux sauvages ou domestiqués est responsable de ces poxviroses à la symptomatologie proche de l’orf.
Yatapoxvirus [68], [69], [70]
Le tanapoxvirus, du genre Yatapoxvirus, pourrait être transmis par la piqûre d’un moustique après contact avec un singe infecté. La symptomatologie, proche du monkeypox, est marquée par la prédominance des lésions aux membres inférieurs.
Diagnostic différentiel et moyens diagnostiques
Le diagnostic de poxvirose est évoqué sur un faisceau d’arguments anamnestiques (contage avec un animal, profession, occupations, voyage en zone d’endémie) et cliniques (fermeté et ombilication centrale des vésicules ou des pustules qui renferment un matériel blanchâtre). L’évolution lente et la résolution spontanée aident au diagnostic rétrospectif ; toutefois la symptomatologie des poxviroses étant proche, il peut être difficile d’identifier le PXV causal. Cette confirmation est néanmoins nécessaire pour différencier les cas importés ou autochtones, ou identifier une orthopoxvirose à déclaration obligatoire (MPXV, CPXV), une réémergence de variole, ou éliminer un autre diagnostic. Devant un tableau varioliforme associant vésicopustules profuses précédées de signes généraux, certains éléments cliniques permettent de s’orienter vers une orthopoxvirose (MPXV, CPXV, VARV) ou vers une varicelle qui est le principal diagnostic différentiel (Tableau 3 ).
Tableau 3.
Diagnostic différentiel entre varicelle et orthopoxviroses disséminées.
| Monkeypox (ou variole) | Varicelle | |
|---|---|---|
| Différence des symptômes initiaux | 2–3 j de syndrome pseudogrippal sévère avant rash maculopapuleux | 0–2 j de syndrome pseudogrippal modéré avant l’éruption |
| Premières lésions buccales puis face puis extrémités | Premières lésions sur le visage puis le tronc | |
| Différences de l’éruption | Lésions de la variole | Lésions de la varicelle |
| Profondes et fermes | Superficielles | |
| Arrondies bien limitées | Mal limitées | |
| Confluentes et ombiliquées | Rarement confluentes ou ombiliquées | |
| Apparues en même temps et au même stade dans une même zone | D’âge différent | |
| Atteinte palmoplantaire fréquente | Atteinte palmoplantaire fréquente | |
| Prédominance face et extrémités | Prédominance tronc | |
| Complications | Cicatrices profondes et défigurantes | Cicatrices peu affichantes |
| Complications respiratoires fréquentes | Complications respiratoires rares sauf chez l’adulte |
Il a été défini trois cadres pratiques s’appuyant sur le nombre de lésions et la présence de signes généraux afin d’aider les cliniciens devant une suspicion de poxvirose (Fig. 4 ).
Point important.
Diagnostics différentiels des poxviroses hors variole :
-
•
Molluscum contagiosum : verrue plane, papillome verruqueux, syringome ou tumeurs annexielles, adénome sébacé, xanthogranulome, autres infections à poxvirus, varicelle, cryptococcose, histoplasmose africaine ;
-
•ZPXV :
-
–si lésion unique : autre infection à OPXV ou ZPXV, HSV1 et 2, granulome pyogénique, syphilis, anthrax, tuberculose cutanée, mycobactériose atypique ;
-
–si lésions multiples : autre poxvirose CPXV, VZV, Bartonella henselae.
-
–
Figure 4.
Arbre décisionnel. Suspicion de poxvirose. MC : molluscum contagiosum ; InVS : Institut de veille sanitaire.
Une à quelques lésions sans signes généraux
Si l’anamnèse et l’examen clinique sont typiques d’une poxvirose commune en France (MC, orf ou nodule du trayeur), le diagnostic ne nécessite pas d’exploration complémentaire hormis à visée épidémiologique ou dans le cadre d’études.
En cas d’atypie, après élimination d’un diagnostic différentiel, il faudra éliminer une poxvirose importée ou émergente, notamment au retour de voyage d’une zone d’endémie d’une autre ZPXV ou de contact avec un animal potentiellement vecteur d’un autre PPXV. La dermoscopie est utile au diagnostic de MC en précisant les structures vasculaires et les orifices lésionnels [71]. L’histologie est utile pour confirmer le diagnostic d’orf, de MC ou d’infection à PXV [58]. En cas de poxvirose, elle met en évidence une hyperplasie épidermique, qui dans le MC forme une masse volumineuse constituée de lobules piriformes convergeant vers un puits central. Il s’y associe une parakératose et une prolifération vasculaire de capillaires dilatés associés à un infiltrat inflammatoire polymorphe à prédominance lymphohistiocytaire. Les kératinocytes vacuolisés et parfois arrondis en massifs ont un cytoplasme rempli d’inclusions virales éosinophiles témoignant de l’effet cytopathogène. Des vésicules puis des pustules sont observées dans la plupart des poxviroses. Les lésions plus tardives mettent en évidence une dégénérescence du derme et une nécrose de l’épiderme. L’immunohistochimie, par l’utilisation d’anticorps polyclonaux antipoxvirus, peut aider au diagnostic notamment pour le MC [72]. La microscopie électronique d’un prélèvement lésionnel (liquide de bulle, biopsie cutanée) peut apporter un diagnostic rapide d’infection à PXV et du genre responsable par la taille du virus et l’identification de structures spécifiques (tubules, corps latéraux). L’identification taxonomique du PXV causal peut être obtenue par culture virale, et surtout par étude de l’acide désoxyribonucléique (ADN) par polymerase chain reaction (PCR) qui est l’outil le plus accessible [73].
Les sérologies virales, généralement utilisées à des fins épidémiologiques et non pas diagnostiques, sont inutiles chez les patients déjà vaccinés du fait de la persistance de l’immunité vaccinale.
Devant quelques lésions associées à des signes généraux modérés
Il faudra rechercher à l’anamnèse des éléments en faveur d’une orthopoxvirose (CPXV ou MPXV). En l’absence d’éléments évocateurs, le diagnostic le plus probable de poxvirose commune compliquée d’une surinfection bactérienne doit être confirmé. La réalisation et l’acheminement des prélèvements sont à organiser avec le centre de référence des OPXV (Institut de recherche biomédicale des Armées, Lyon).
Devant des lésions diffuses associées à des signes généraux sévères
Dans ce cas, le diagnostic différentiel le plus probable est celui d’une varicelle sévère. Bien qu’improbable en France, les diagnostics d’infection à monkeypoxvirus ou de résurgence de variole doivent être évoqués. Le CDC (Centers for Disease Control and prevention) a établi une procédure de prise en charge où la présence de deux critères rend modéré le risque de variole (Fig. 1). Un cas suspect est une urgence médicale de santé publique entraînant une mise en quarantaine et la déclaration immédiate à l’Institut de veille sanitaire (InVS) et au centre de référence, qui organiseront la prise en charge diagnostique (prélèvement par écouvillon sec puis confirmation par microscopie électronique, culture cellulaire ou PCR) et thérapeutique via l’équipe d’intervention nationale [12]. Les suspicions et les cas confirmés d’orthopoxviroses (variole, MPXV et CPXV) nécessitent une déclaration obligatoire à l’InVS.
Traitement
Les infections à PPXV ne nécessitent pas de traitement spécifique. Les antalgiques et antipyrétiques peuvent être nécessaires, tout comme l’utilisation d’antibiotiques en cas de surinfection bactérienne. La prévention passe par l’éviction des contacts avec les animaux infectés et les fomites dans les populations à risque du fait de leur activité professionnelle ou de leurs loisirs.
Des mesures d’isolement de contact doivent être prises pour toutes les poxviroses compte tenu du risque d’infection nosocomiale. L’isolement cutané et respiratoire est obligatoire en cas d’infection à OPXV. L’infection confère aux patients une immunité durable.
La plupart des poxviroses étant rares, peu de traitements ont été testés. Seul le MC, du fait de sa fréquence, présente un éventail thérapeutique large étayé par de nombreuses publications (Tableau 4 ). Les critères décisionnels sont le nombre de lésions, leur localisation, le statut immunitaire et l’âge du patient.
Tableau 4.
Traitement du molluscum contagiosum (d’après [17]).
| Traitement physique | |
| Curetage | Exérèse après anesthésie topique |
| Cryothérapie | 10–20 s à 2 reprises ; répétée à 1 semaine si besoin |
| Laser à colorant pulsé (585 nm) | Un pulse unique, répété à 2–3 semaines si besoin |
| Photothérapie dynamique | Acide 5-aminolévulinique, après 16–24 h application de longueur d’onde courte pendant 16 min |
| Electron beam therapy | 9–12 MeV, 5 fois/semaine (maximum 18 semaines) |
| Traitement chimique destructeur | |
| Phénol 10 % | Papule percée avec bâtonnet imprégné |
| Acide trichloroacétique 100 % | Appliquer un coton imprégné sur la papule, répéter à 2 semaines |
| Traitement chimique non destructeur | |
| Podophyllotoxine 0,5 % crème | 3 j consécutifs par semaine, à répéter 4 semaines si besoin |
| Acide salicylique 12 % gel | 1 à 2 fois/semaine pendant 4 semaines |
| Peroxyde de benzoyle 10 % crème | 2 fois/j pendant 4 semaines |
| Acide rétinoïque 0,5 % crème | 2 fois/j pendant 4 semaines |
| Solution aqueuse d’hydroxyde de potassium | Appliquer avec un coton 2 fois/j jusqu’à ulcération |
| Immunomodulateurs | |
| Imiquimod 5 % crème | Appliquer 8 h puis laver3–5 fois/semaine jusqu’à guérison (maximum 16 semaines) |
| Cimétidine | 40 mg/j en 2 prises pendant 2 mois |
| Diphencyprone | 0,001–2 % sur les lésions 2 fois/semaine jusqu’à 2 mois |
| Traitement antiviral | |
| Cidofovir crème 3 % | 1 fois/j sur les lésions, 5 j/semaine pendant 8 semaines ; sous occlusion en dehors du visage pendant 12 heures |
| Cidofovir crème 1 % | 1 fois/j sur les lésions, 5 j/semaine pendant 2 semaines ; répéter à 1 mois si nécessaire |
| Cidofovir i.v. [45], [46], [47] | 3–5 mg/kg/semaine pendant 1–2 semaines, puis toutes les semaines jusqu’à disparition |
i.v. : par voie intraveineuse.
Molluscum contagiosum (MC)
Du fait des complications des traitements (gêne locale, douleur, cicatrice, hypo- ou hyperpigmentation), l’abstention thérapeutique peut être envisagée chez l’immunocompétent ayant peu de lésions ou des lésions inflammatoires, après une information sur le risque d’auto-inoculation et les moyens de prévention [17]. Quand un traitement est nécessaire, des traitements ablatifs physiques (curetage, cryothérapie) ou chimiques, des topiques immunomodulateurs ou des traitements antiviraux existent. Il n’y a pas de consensus sur le traitement de première intention.
La revue de la Cochrane qui excluait les traitements physiques ablatifs, concluait à l’absence de preuves convaincantes d’efficacité des différents traitements [74]. Le curetage semble plus efficace que les traitements chimiques [75]. Les différents traitements testés dans la littérature publiée sont listés dans le Tableau 4 [17]. Bien que figurant dans ce tableau, l’imiquimod était inefficace chez les enfants dans deux études randomisées non publiées [76]. Certaines lésions peuvent apparaître après traitement et nécessitent parfois de multiples interventions.
Chez les patients immunodéficients, notamment infectés par le virus de l’immunodéficience humaine (VIH), le traitement est souvent difficile et les récidives, fréquentes [17]. Une combinaison de traitement peut être nécessaire et les traitements immunomodulateurs ou antiviraux, notamment le cidofovir, seraient plus efficaces [17].
Variole
En France, la menace bioterroriste a fait établir un plan d’intervention national, révisé en 2006, qui détaille la stratégie de réponse graduée à adopter en fonction de l’importance de la menace de résurgence [12].
Traitement des poxviroses sévères
Les orthopoxviroses (CPXV et MPXV) et plus globalement les poxviroses chez l’immunodéprimé ou l’atopique peuvent être compliquées, diffuses ou chroniques et ainsi faire discuter l’instauration d’une thérapeutique spécifique. Certains traitements sont utilisables en cas d’orthopoxvirose sévère, notamment de variole.
Applications médicales des poxvirus
Les connaissances acquises sur les PXV ont permis d’envisager les PXV comme vecteurs thérapeutiques. Du fait de leur immunogénicité, certaines souches avirulentes ou non réplicatives de VACV sont utilisées comme vecteurs en vaccination [77]. Les PXV, qui ont un génome de grande taille non intégré à l’ADN cellulaire et une absence de restriction à l’entrée cellulaire, constituent des vecteurs prometteurs en thérapie génique [78]. Leur tropisme cellulaire les rend utilisables comme vecteurs d’oncolyse pour infecter un type cellulaire ciblé ou des cellules tumorales, afin d’entraîner leur apoptose [79].
Conclusion
Les PXV infectant l’homme sont multiples. En France, certaines poxviroses telles que le molluscum contagiosum, l’orf et le nodule du trayeur sont fréquentes et pourvoyeuses de nombreuses consultations en dermatologie. Plus rares en Europe, le cowpoxvirus et le monkeypoxvirus sont des virus potentiellement émergents faisant courir un risque d’épidémie dans de nouvelles régions du monde à la suite de l’exacerbation des transports internationaux et de la perte de la protection vaccinale antivariolique.
Points essentiels.
-
•
La variole est éradiquée depuis 1980.
-
•
Le monkeypoxvirus et le coxpoxvirus sont des virus potentiellement émergents à déclaration obligatoire.
-
•
Le molluscum contagiosum est la poxvirose la plus fréquente.
-
•
Les infections à parapoxvirus touchent des groupes professionnels ou occupationnels et sont cliniquement proches.
-
•
L’orf et le nodule du trayeur sont les infections à parapoxvirus les plus fréquentes.
-
•
En cas d’anamnèse atypique, une infection à parapoxvirus émergent doit être évoquée.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Footnotes
Cet article est paru initialement dans l’EMC (Elsevier Masson SAS, Paris), EMC - Dermatologie 2017;12(2):1-9. doi: 10.1016/S0246-0319(16)57606-7. [Article 98-305-A-10]. Nous remercions la rédaction de l’EMC - Dermatologie pour son aimable autorisation de reproduction.
Références
- 1.Moss B. In: Fields virology. Fields B.N., Knipe D.M., Howley P.M., editors. Lippincott-Raven; Philadelphia, PA: 2006. Poxviridae: the viruses and their replication; pp. 2905–2946. [Google Scholar]
- 2.Damon I. In: Fields virology. Fields B.N., Knipe D.M., Howley P.M., editors. Lippincott-Raven; Philadelphia, PA: 2006. Poxviruses; pp. 2947–2976. [Google Scholar]
- 3.Breman J.G., Arita I. The confirmation and maintenance of smallpox eradication. N Engl J Med. 1980;303:1263–1273. doi: 10.1056/NEJM198011273032204. [DOI] [PubMed] [Google Scholar]
- 4.Bugert J.J. In: Encyclopedia of virology. Mahy B.W., Van Regenmortel M.H., editors. Elsevier-Academic Press; Oxford: 2008. Molluscum contagiosum virus; pp. 319–324. [Google Scholar]
- 5.Fenner F., Henderson D.A., Arita I., Jezek Z. WHO; Geneva: 1988. Smallpox and its eradication. [Google Scholar]
- 6.Seet B.T., Johnston J.B., Brunetti C.R., Barrett J.W., Everett H., Cameron C. Poxviruses and immune evasion. Annu Rev Immunol. 2003;21:377–423. doi: 10.1146/annurev.immunol.21.120601.141049. [DOI] [PubMed] [Google Scholar]
- 7.Brunetti C.R., Paulose-Murphy M., Singh R., Qin J., Barrett J.W., Tardivel A. A secreted high-affinity inhibitor of human TNF from Tanapox virus. Proc Natl Acad Sci U S A. 2003;100:4831–4836. doi: 10.1073/pnas.0737244100. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Müllbacher A. Cell-mediated cytotoxicity in recovery from poxvirus infections. Rev Med Virol. 2003;13:223–232. doi: 10.1002/rmv.381. [DOI] [PubMed] [Google Scholar]
- 9.Senkevich T.G., Moss B. Domain structure, intracellular trafficking, and beta2-microglobulin binding of a major histocompatibility complex class I homolog encoded by molluscum contagiosum virus. Virology. 1998;250:397–407. doi: 10.1006/viro.1998.9390. [DOI] [PubMed] [Google Scholar]
- 10.Barquet N., Domingo P. Smallpox: the triumph over the most terrible of the ministers of death. Ann Intern Med. 1997;127:635–642. doi: 10.7326/0003-4819-127-8_part_1-199710150-00010. [DOI] [PubMed] [Google Scholar]
- 11.Klainer A.S. Smallpox. Clin Dermatol. 1989;7:19–22. doi: 10.1016/0738-081x(89)90025-4. [DOI] [PubMed] [Google Scholar]
- 12.Ministère de la Santé et des Solidarités . 2006. Plan national de réponse à la menace variolique - actualisation [Internet]http://www.sante.gouv.fr/IMG/pdf/plan_variole_2006-2.pdf [cité 14 oct 2014] [Google Scholar]
- 13.Buller R.M., Palumbo G.J. Poxvirus pathogenesis. Microbiol Rev. 1991;55:80–122. doi: 10.1128/mr.55.1.80-122.1991. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Smith K.J., Yeager J., Skelton H. Molluscum contagiosum: its clinical, histopathologic, and immunohistochemical spectrum. Int J Dermatol. 1999;38:664–672. doi: 10.1046/j.1365-4362.1999.00677.x. [DOI] [PubMed] [Google Scholar]
- 15.Trama J.P., Adelson M.E., Mordechai E. Identification and genotyping of molluscum contagiosum virus from genital swab samples by real-time PCR and pyrosequencing. J Clin Virol. 2007;40:325–329. doi: 10.1016/j.jcv.2007.09.007. [DOI] [PubMed] [Google Scholar]
- 16.Matis W.L., Triana A., Shapiro R., Eldred L., Polk B.F., Hood A.F. Dermatologic findings associated with human immunodeficiency virus infection. J Am Acad Dermatol. 1987;17:746–751. doi: 10.1016/s0190-9622(87)70257-6. [DOI] [PubMed] [Google Scholar]
- 17.Chen X., Anstey A.V., Bugert J.J. Molluscum contagiosum virus infection. Lancet Infect Dis. 2013;13:877–888. doi: 10.1016/S1473-3099(13)70109-9. [DOI] [PubMed] [Google Scholar]
- 18.Brown S.T., Weinberger J. Molluscum contagiosum: sexually transmitted disease in 17 cases. J Am Vener Dis Assoc. 1974;1:35–36. [PubMed] [Google Scholar]
- 19.Lee B., Kang H.Y. Molluscum folliculitis after leg shaving. J Am Acad Dermatol. 2004;51:478–479. doi: 10.1016/j.jaad.2003.12.047. [DOI] [PubMed] [Google Scholar]
- 20.Cribier B., Scrivener Y., Grosshans E. Molluscum contagiosum: histologic patterns and associated lesions. A study of 578 cases. Am J Dermatopathol. 2001;23:99–103. doi: 10.1097/00000372-200104000-00003. [DOI] [PubMed] [Google Scholar]
- 21.Laxmisha C., Thappa D.M., Jaisankar T.J. Clinical profile of molluscum contagiosum in children versus adults. Dermatol Online J. 2003;9:1. [PubMed] [Google Scholar]
- 22.Mansur A.T., Göktay F., Gündüz S., Serdar Z.A. Multiple giant molluscum contagiosum in a renal transplant recipient. Transpl Infect Dis. 2004;6:120–123. doi: 10.1111/j.1399-3062.2004.00060.x. [DOI] [PubMed] [Google Scholar]
- 23.Osio A., Deslandes E., Saada V., Morel P., Guibal F. Clinical characteristics of molluscum contagiosum in children in a private dermatology practice in the greater Paris area, France: a prospective study in 661 patients. Dermatology. 2011;222:314–320. doi: 10.1159/000327888. [DOI] [PubMed] [Google Scholar]
- 24.Modschiedler K., Altenhoff J., von den Driesch P. Lymphoma molluscatum. Br J Dermatol. 2002;146:529–531. doi: 10.1046/j.1365-2133.2002.46305.x. [DOI] [PubMed] [Google Scholar]
- 25.Wetzel S., Wollenberg A. Eczema molluscatum in tacrolimus treated atopic dermatitis. Eur J Dermatol. 2004;14:73–74. [PubMed] [Google Scholar]
- 26.Gottlieb S.L., Myskowski P.L. Molluscum contagiosum. Int J Dermatol. 1994;33:453–461. doi: 10.1111/j.1365-4362.1994.tb02853.x. [DOI] [PubMed] [Google Scholar]
- 27.Shalders K., Ilchyshyn A., Walzman M. Secondary anetoderma following molluscum contagiosum infection. Acta Derm Venereol. 2003;83:461–462. doi: 10.1080/00015550310013097. [DOI] [PubMed] [Google Scholar]
- 28.Baxby D., Bennett M. Poxvirus zoonoses. J Med Microbiol. 1997;46 [17–2028–33] [PubMed] [Google Scholar]
- 29.Leavell U.W., McNamara M.J., Muelling R., Talbert W.M., Rucker R.C., Dalton A.J. Orf. Report of 19 human cases with clinical and pathological observations. JAMA. 1968;204:657–664. doi: 10.1001/jama.203.8.657. [DOI] [PubMed] [Google Scholar]
- 30.Gaskell R.M., Gaskell C.J., Evans R.J., Dennis P.E., Bennett A.M., Udall N.D. Natural and experimental pox virus infection in the domestic cat. Vet Rec. 1983;112:164–170. doi: 10.1136/vr.112.8.164. [DOI] [PubMed] [Google Scholar]
- 31.Allworth M.B., Hughes K.L., Studdert M.J. Contagious pustular dermatitis (orf) of sheep affecting the ear following ear tagging. Aust Vet J. 1987;64:61–62. doi: 10.1111/j.1751-0813.1987.tb16134.x. [DOI] [PubMed] [Google Scholar]
- 32.Jezek Z., Grab B., Dixon H. Stochastic model for interhuman spread of monkeypox. Am J Epidemiol. 1987;126:1082–1092. doi: 10.1093/oxfordjournals.aje.a114747. [DOI] [PubMed] [Google Scholar]
- 33.Weber D.J., Rutala W.A. Risks and prevention of nosocomial transmission of rare zoonotic diseases. Clin Infect Dis. 2001;32:446–456. doi: 10.1086/318509. [DOI] [PubMed] [Google Scholar]
- 34.Midilli K., Erkiliç A., Kuşkucu M., Analay H., Erkiliç S., Benzonana N. Nosocomial outbreak of disseminated orf infection in a burn unit, Gaziantep, Turkey, October to December 2012. Euro Surveill. 2013;18:20425. doi: 10.2807/ese.18.11.20425-en. [DOI] [PubMed] [Google Scholar]
- 35.Dupre A., Christol B., Bonafe J.L., Lassere J. Orf and atopic dermatitis. Br J Dermatol. 1981;105:103–104. doi: 10.1111/j.1365-2133.1981.tb00890.x. [DOI] [PubMed] [Google Scholar]
- 36.Blackford S., Roberts D.L., Thomas P.D. Cowpox infection causing a generalized eruption in a patient with atopic dermatitis. Br J Dermatol. 1993;129:628–629. doi: 10.1111/j.1365-2133.1993.tb00500.x. [DOI] [PubMed] [Google Scholar]
- 37.Lederman E.R., Green G.M., DeGroot H.E., Dahl P., Goldman E., Greer P.W. Progressive ORF virus infection in a patient with lymphoma: successful treatment using imiquimod. Clin Infect Dis. 2007;44:e100–e103. doi: 10.1086/517509. [DOI] [PubMed] [Google Scholar]
- 38.Vorou R.M., Papavassiliou V.G., Pierroutsakos I.N. Cowpox virus infection: an emerging health threat. Curr Opin Infect Dis. 2008;21:153–156. doi: 10.1097/QCO.0b013e3282f44c74. [DOI] [PubMed] [Google Scholar]
- 39.Baxby D., Bennett M., Getty B. Human cowpox 1969-93: a review based on 54 cases. Br J Dermatol. 1994;131:598–607. doi: 10.1111/j.1365-2133.1994.tb04969.x. [DOI] [PubMed] [Google Scholar]
- 40.Heilbronner C., Harzic M., Ferchal F., Pothier A., Charara O., Beal G. [Cowpox virus infection in a child] Arch Pediatr. 2004;11:335–339. doi: 10.1016/j.arcped.2004.01.016. [DOI] [PubMed] [Google Scholar]
- 41.Ninove L., Domart Y., Vervel C., Voinot C., Salez N., Raoult D. Cowpox virus transmission from pet rats to humans, France. Emerg Infect Dis. 2009;15:781–784. doi: 10.3201/eid1505.090235. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Postma B.H., Diepersloot R.J., Niessen G.J., Droog R.P. Cowpox-virus-like infection associated with rat bite. Lancet. 1991;337:733–734. doi: 10.1016/0140-6736(91)90317-i. [DOI] [PubMed] [Google Scholar]
- 43.Hazel S.M., Bennett M., Chantrey J., Bown K., Cavanagh R., Jones T.R. A longitudinal study of an endemic disease in its wildlife reservoir: cowpox and wild rodents. Epidemiol Infect. 2000;124:551–562. doi: 10.1017/s0950268899003799. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Eis-Hübinger A.M., Gerritzen A., Schneweis K.E., Pfeiff B., Pullmann H., Mayr A. Fatal cowpox-like virus infection transmitted by cat. Lancet. 1990;336:880. doi: 10.1016/0140-6736(90)92387-w. [DOI] [PubMed] [Google Scholar]
- 45.Czerny C.P., Eis-Hübinger A.M., Mayr A., Schneweis K.E., Pfeiff B. Animal poxviruses transmitted from cat to man: current event with lethal end. Zentralbl Veterinarmed B. 1991;38:421–431. doi: 10.1111/j.1439-0450.1991.tb00891.x. [DOI] [PubMed] [Google Scholar]
- 46.Foster S.O., Brink E.W., Hutchins D.L., Pifer J.M., Lourie B., Moser C.R. Human monkeypox. Bull World Health Organ. 1972;46:569–576. [PMC free article] [PubMed] [Google Scholar]
- 47.Mutombo M., Arita I., Jezek Z. Human monkeypox transmitted by a chimpanzee in a tropical rain-forest area of Zaire. Lancet. 1983;1:735–737. doi: 10.1016/S0140-6736(83)92027-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Damon I.K. Status of human monkeypox: clinical disease, epidemiology and research. Vaccine. 2011;29:D54–D59. doi: 10.1016/j.vaccine.2011.04.014. [DOI] [PubMed] [Google Scholar]
- 49.Jezek Z., Grab B., Szczeniowski M., Paluku K.M., Mutombo M. Clinico-epidemiological features of monkeypox patients with an animal or human source of infection. Bull World Health Organ. 1988;66:459–464. [PMC free article] [PubMed] [Google Scholar]
- 50.Breman J.G., Henderson D.A. Poxvirus dilemmas – monkeypox, smallpox, and biologic terrorism. N Engl J Med. 1998;339:556–559. doi: 10.1056/NEJM199808203390811. [DOI] [PubMed] [Google Scholar]
- 51.Hutin Y.J., Williams R.J., Malfait P., Pebody R., Loparev V.N., Ropp S.L. Outbreak of Human Monkeypox, Democratic Republic of Congo, 1996 to 1997. Emerg Infect Dis. 2001;7:434–438. doi: 10.3201/eid0703.010311. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Centers for Disease Control, Prevention (CDC) Multistate outbreak of monkeypox–Illinois, Indiana, and Wisconsin, 2003. MMWR Morb Mortal Wkly Rep. 2003;52:537–540. [PubMed] [Google Scholar]
- 53.Kile J.C., Fleischauer A.T., Beard B., Kuehnert M.J., Kanwal R.S., Pontones P. Transmission of monkeypox among persons exposed to infected prairie dogs in Indiana in 2003. Arch Pediatr Adolesc Med. 2005;159:1022–1025. doi: 10.1001/archpedi.159.11.1022. [DOI] [PubMed] [Google Scholar]
- 54.Damaso C.R., Esposito J.J., Condit R.C., Moussatché N. An emergent poxvirus from humans and cattle in Rio de Janeiro State: Cantagalo virus may derive from Brazilian smallpox vaccine. Virology. 2000;277:439–449. doi: 10.1006/viro.2000.0603. [DOI] [PubMed] [Google Scholar]
- 55.De Souza Trindade G., da Fonseca F.G., Marques J.T., Nogueira M.L., Mendes L.C.N., Borges A.S. Araçatuba virus: a vaccinialike virus associated with infection in humans and cattle. Emerg Infect Dis. 2003;9:155–160. doi: 10.3201/eid0902.020244. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Goyal T., Varshney A., Bakshi S.K., Barua S., Bera B.C., Singh R.K. Buffalo pox outbreak with atypical features: a word of caution and need for early intervention! Int J Dermatol. 2013;52:1224–1230. doi: 10.1111/ijd.12120. [DOI] [PubMed] [Google Scholar]
- 57.Damle A.S., Gaikwad A.A., Patwardhan N.S., Duthade M.M., Sheikh N.S., Deshmukh D.G. Outbreak of human buffalopox infection. J Glob Infect Dis. 2011;3:187–188. doi: 10.4103/0974-777X.81698. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Diven D.G. An overview of poxviruses. J Am Acad Dermatol. 2001;44:1–16. doi: 10.1067/mjd.2001.109302. [DOI] [PubMed] [Google Scholar]
- 59.Cawley E.P., Wheeler C.E. The etiology of Milker's nodules. AMA Arch Dermatol. 1957;75:249–259. doi: 10.1001/archderm.1957.01550140093015. [DOI] [PubMed] [Google Scholar]
- 60.Uzel M., Sasmaz S., Bakaris S., Cetinus E., Bilgic E., Karaoguz A. A viral infection of the hand commonly seen after the feast of sacrifice: human orf (orf of the hand) Epidemiol Infect. 2005;133:653–657. doi: 10.1017/s0950268805003778. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Nougairede A., Fossati C., Salez N., Cohen-Bacrie S., Ninove L., Michel F. Sheep-to-human transmission of Orf virus during Eid al-Adha religious practices, France. Emerg Infect Dis. 2013;19:102–105. doi: 10.3201/eid1901.120421. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Wilkinson J.D. Orf: a family with unusual complications. Br J Dermatol. 1977;97:447–450. doi: 10.1111/j.1365-2133.1977.tb14256.x. [DOI] [PubMed] [Google Scholar]
- 63.White K.P., Zedek D.C., White W.L., Simpson E.L., Hester E., Morrison L. Orf-induced immunobullous disease: a distinct autoimmune blistering disorder. J Am Acad Dermatol. 2008;58:49–55. doi: 10.1016/j.jaad.2007.08.029. [DOI] [PubMed] [Google Scholar]
- 64.Watson W.J., Meyer M.W., Madison D.L. Orf virus infection in pregnancy. S D J Med. 1993;46:423–424. [PubMed] [Google Scholar]
- 65.Clark C., McIntyre P.G., Evans A., McInnes C.J., Lewis-Jones S. Human sealpox resulting from a seal bite: confirmation that sealpox virus is zoonotic. Br J Dermatol. 2005;152:791–793. doi: 10.1111/j.1365-2133.2005.06451.x. [DOI] [PubMed] [Google Scholar]
- 66.Falk E.S. Parapoxvirus infections of reindeer and musk ox associated with unusual human infections. Br J Dermatol. 1978;99:647–654. doi: 10.1111/j.1365-2133.1978.tb07059.x. [DOI] [PubMed] [Google Scholar]
- 67.Roess A.A., Galan A., Kitces E., Li Y., Zhao H., Paddock C.D. Novel deer-associated parapoxvirus infection in deer hunters. N Engl J Med. 2010;363:2621–2627. doi: 10.1056/NEJMoa1007407. [DOI] [PubMed] [Google Scholar]
- 68.Downie A.W., Taylor-Robinson C.H., Caunt A.E., Nelson G.S., Manson-Bahr P.E., Matthews T.C. Tanapox: a new disease caused by a pox virus. Br Med J. 1971;1:363–368. doi: 10.1136/bmj.1.5745.363. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.Jezek Z., Arita I., Szczeniowski M., Paluku K.M., Ruti K., Nakano J.H. Human tanapox in Zaire: clinical and epidemiological observations on cases confirmed by laboratory studies. Bull World Health Organ. 1985;63:1027–1035. [PMC free article] [PubMed] [Google Scholar]
- 70.Stich A., Meyer H., Köhler B., Fleischer K. Tanapox: first report in a European traveller and identification by PCR. Trans R Soc Trop Med Hyg. 2002;96:178–179. doi: 10.1016/s0035-9203(02)90295-6. [DOI] [PubMed] [Google Scholar]
- 71.Ianhez M., Cestari S., da C.P., Enokihara M.Y., Seize M.B. An Bras Dermatol. 2011;86:74–79. doi: 10.1590/s0365-05962011000100009. [DOI] [PubMed] [Google Scholar]
- 72.Penneys N.S., Matsuo S., Mogollon R. The identification of molluscum infection by immunohistochemical means. J Cutan Pathol. 1986;13:97–101. doi: 10.1111/j.1600-0560.1986.tb01508.x. [DOI] [PubMed] [Google Scholar]
- 73.Li Y., Meyer H., Zhao H., Damon I.K. GC content-based pan-pox universal PCR assays for poxvirus detection. J Clin Microbiol. 2010;48:268–276. doi: 10.1128/JCM.01697-09. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 74.Van der Wouden J.C., van der Sande R., van Suijlekom-Smit L.W., Berger M., Butler C.C., Koning S. Interventions for cutaneous molluscum contagiosum. Cochrane Database Syst Rev. 2009;3:CD004767. doi: 10.1002/14651858.CD004767.pub3. [DOI] [PubMed] [Google Scholar]
- 75.Hanna D., Hatami A., Powell J., Marcoux D., Maari C., Savard P. A prospective randomized trial comparing the efficacy and adverse effects of four recognized treatments of molluscum contagiosum in children. Pediatr Dermatol. 2006;23:574–579. doi: 10.1111/j.1525-1470.2006.00313.x. [DOI] [PubMed] [Google Scholar]
- 76.Katz K.A. Imiquimod is not an effective drug for molluscum contagiosum. Lancet Infect Dis. 2014;14:372–373. doi: 10.1016/S1473-3099(14)70728-5. [DOI] [PubMed] [Google Scholar]
- 77.Pastoret P.-P., Vanderplasschen A. Poxviruses as vaccine vectors. Comp Immunol Microbiol Infect Dis. 2003;26:343–355. doi: 10.1016/S0147-9571(03)00019-5. [DOI] [PubMed] [Google Scholar]
- 78.Guo Z.S., Bartlett D.L. Vaccinia as a vector for gene delivery. Expert Opin Biol Ther. 2004;4:901–907. doi: 10.1517/14712598.4.6.901. [DOI] [PubMed] [Google Scholar]
- 79.Thorne S.H. Immunotherapeutic potential of oncolytic vaccinia virus. Immunol Res. 2011;50:286–293. doi: 10.1007/s12026-011-8211-4. [DOI] [PubMed] [Google Scholar]
Pour en savoir plus
Lévy-Bruhl D, Guérin N. Institut de Veille Sanitaire. Utilisation du virus de la variole comme arme biologique : estimation de l’impact épidémiologique et place de la vaccination. Disponible à www.invs.sante.fr/publications/variole_2001/variole_2001.html.