Abstract
Contrairement aux autres émergences virales récentes qui étaient pour la plupart dues à des virus à ARN, le monkeypox est provoqué par un virus à ADN, un orthopoxvirus proche des virus de la vaccine et de la variole, dont il existe deux variants génomiques. Ce virus, isolé inopinément chez des singes asiatiques en captivité, fut d’abord considéré comme une curiosité de laboratoire, mais son pouvoir pathogène pour l’homme a été reconnu en Afrique tropicale, à partir de 1970. Il y provoquait des infections sporadiques de contact avec la forêt pluvieuse (chasse) et plus rarement des épidémies par transmission interhumaine comme celle apparue en 1996 en République démocratique du Congo. Le monkeypox humain, impossible à distinguer cliniquement de la variole (éradiquée de la planète en 1977), faisait seulement l’objet d’une surveillance épidémiologique attentive mais ne semblait pas représenter une menace sérieuse, au plan mondial. Tout a changé en 2003, lorsque le monkeypox a été introduit aux États-Unis par des rongeurs sauvages infectés, provenant d’Afrique et s’est étendu à 11 États de l’Union grâce au commerce des petits animaux sauvages de compagnie. Provoquant 82 infections chez des enfants et des adultes, cette épidémie a permis de prendre conscience des dangers sanitaires liés au trafic international des animaux sauvages et a suscité toute une série de travaux scientifiques qui ont considérablement accru nos connaissances sur cette zoonose.
Mots clés: Monkeypox humain, Zoonose, Orthopoxvirus, Forêts pluviales, Afrique tropicale, États-Unis d’Amérique, Épidémiologie, Rongeurs sauvages, Mesures sanitaires internationales
Abstract
Unlike other recent viral emergences, which were in majority caused by RNA viruses, the monkeypox results from infection by a DNA virus, an orthopoxvirus closely related to both vaccine and smallpox viruses and whose two genomic variants are known. Unexpectedly isolated from captive Asiatic monkeys and first considered as an laboratory curiosity, this virus was recognised in 1970 as an human pathogen in tropical Africa. Here it was responsible for sporadic cases following intrusions (for hunting) into tropical rain forests or rare outbreak with human-to-human transmission as observed in 1996 in Democratic Republic of Congo. As monkeypox in humans is not distinguishable from smallpox (a disease globally eradicated in 1977) it was only subjected to vigilant epidemiological surveillance and not considered as a potential threat outside Africa. This point of view radically changed in 2003 when monkeypox was introduced in the USA by African wild rodents and spread to 11 different states of this country. Responsible for 82 infections in American children and adults, this outbreak led to realize the sanitary hazards resulting from international trade of exotic animals and scientific investigations increasing extensively our knowledge of this zoonosis.
Keywords: Human monkeypox, Zoonosis, Orthopoxvirus, Tropical rain forests, Africa, USA, Epidemiology, Wild rodents, International sanitary regulation
1. Introduction
Parmi les nombreuses zoonoses qui ont émergé chez l’homme depuis une soixantaine d’années [1], le monkeypox occupe une place à part. Il est provoqué par un virus à ADN alors que pratiquement tous les autres virus récemment émergés sont des virus à ARN, génétiquement beaucoup instables. Considérés d’abord comme une curiosité de laboratoire, c’est seulement en 1970 que son caractère pathogène pour notre espèce a été établi en Afrique centrale. Il s’agissait toutefois essentiellement de cas sporadiques, de contact avec la grande forêt pluviale. À partir de 1996, il s’est brusquement montré plus agressif provoquant des épidémies extensives, relativement meurtrières, toujours en Afrique centrale, puis il a émergé aux États-Unis, de façon tout à fait inattendue [2]. Lors de cette extension géographique spectaculaire, sa virulence ne semble pas s’être exacerbée puisqu’aucun décès n’a alors été enregistré. L’intérêt de la communauté scientifique pour le virus du monkeypox (VMP) s’est soudain accru, à la suite du profond sentiment d’insécurité qui s’est développé dans ce pays après les attentats du 11 septembre 2001. En effet, l’éventualité d’une attaque bioterroriste utilisant le virus de la variole [3], [4] a relancé les recherches sur les orthopoxvirus, un groupe viral délaissé depuis que l’OMS a déclaré la variole mondialement éradiquée, en 1980 [5], [6].
2. Historique
Le VMP est un orthopoxvirus, de la famille des Poxviridae, dont le génome est un ADN bicaténaire de 190 Kpb. Il est sérologiquement et génétiquement proche du virus de la vaccine et, à un moindre degré, du Taterapox virus des gerbilles de l’Ouest africain, du Camelpox virus et du virus de la variole [7].
Il fut isolé fortuitement, en 1958, de lots de macaques asiatiques (Macaca fascicularis) importés au Danemark pour les besoins du Statens Serum Institute de Copenhague [8]. Certains de ces animaux étaient malades et présentaient une éruption varioliforme. D’autres incidents du même type furent ensuite observés dans des institutions scientifiques aux États-Unis, aux Pays-Bas et en France, sans qu’il en résulte des contaminations humaines [9]. Ce virus était alors considéré comme une curiosité de laboratoire, encore qu’il puisse constituer un contaminant fâcheux des cultures cellulaires destinées à la préparation de vaccins contre la poliomyélite.
En 1970, le premier cas humain fut décrit en République démocratique du Congo (RDC), chez un enfant âgé de neuf ans, présentant un tableau clinique évoquant la variole, alors que cette maladie avait disparu du pays depuis 1969 [10] (Fig. 1 ). D’autres cas furent ensuite identifiés en Afrique de l’Ouest et du Centre, entre le huitième degré des latitudes N et S, la RDC étant le pays le plus touché, totalisant environ 80 % des cas. Il s’agissait de cas sporadiques plutôt rares, liés à des activités de chasse en forêt et touchant surtout des enfants non vaccinés contre la variole [11].
Fig. 1.
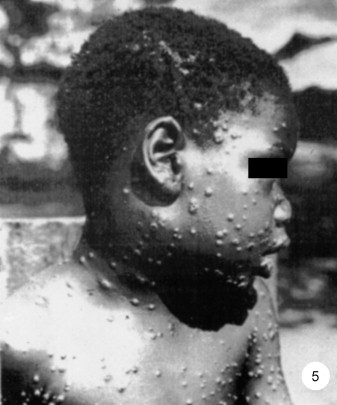
Éruption typique du tronc, de la face et du cuir chevelu. Noter l’existence d’adénopathies cervicales et sous-mandibulaires déformant le bas du visage [11].
Mais c’est lorsque le monkeypox est devenu épidémique, d’abord en RDC, en 1996–1997 [12], puis surtout aux États- Unis, en 2003 [13], qu’il a pris toute son importance sanitaire, au plan mondial (Fig. 2 ).
Fig. 2.
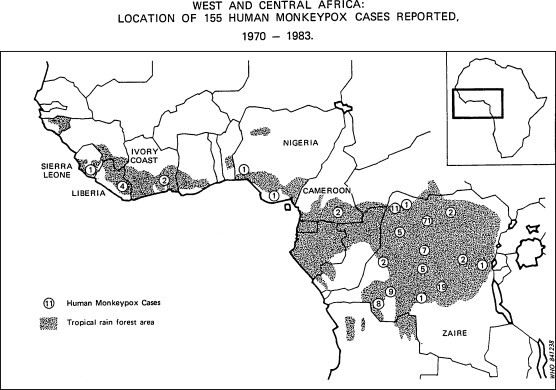
Distribution géographique de 155 cas de monkeypox humain en Afrique de l’Ouest et du Centre, 1970–1980 (Document OMS).
3. Le monkeypox humain est largement répandu en Afrique tropicale
L’observation du premier cas humain [10], faite en 1970 en RDC (ex Zaïre), n’est pas restée longtemps unique. Entre 1970 et 1979, 47 cas nouveaux ont été répertoriés, avec huit décès chez des enfants âgés de sept mois à sept ans non vaccinés contre la variole [11]. Ce taux de létalité (17 %) était nettement inférieur à celui de la variole (25–40 %), mais les adénopathies, cervicales et sous-maxillaires, étaient beaucoup fréquentes dans le monkeypox (38,2 %). À cette nuance près, les deux maladies étaient cliniquement identiques. Les enfants âgés de moins de dix ans représentaient 83 % des malades et le taux d’attaques secondaires (parmi les plus proches parents) était de 7,5 %.
Le VMP fut isolé de 77 % des prélèvements (pustules, croûtes) effectués jusqu’au dix-huitième jour suivant l’éruption. Outre la RDC où 31 cas avaient été enregistrés, la maladie fut également identifiée au Nigeria, en Côte d’Ivoire, au Liberia et au Sierra Leone [14]. À l’époque, le réservoir naturel de cette infection n’était pas formellement identifié, mais on suspectait fortement les animaux sauvages, surtout les singes, abondants dans les régions concernées et activement chassés, comme complément de nourriture.
Le monkeypox humain était alors considéré comme une maladie rare, sporadique, évoluant surtout pendant la saison sèche et touchant de petits villages d’Afrique centrale ou occidentale, mais ce n’était pas un problème de santé publique [11].
Les travaux ultérieurs conduits pour l’essentiel en RDC [15], [16], [17], [18], [19], mais aussi en République centrafricaine [20], [21] et au Gabon [22], [23] ont confirmé les observations antérieures. Toutefois, dans ce dernier pays, le virus a été isolé chez un bébé de neuf mois décédé dont le foie et la rate contenaient des particules virales typiques, en cours de réplication, une observation jamais faite précédemment [22].
À la même époque, une partie du réservoir sauvage du virus du monkeypox a été identifiée [24], [25], [26]. En effet, en 1979, en RDC, de nombreux animaux sauvages furent capturés en forêt (singes, rongeurs arboricoles ou terrestres, chauves souris) et examinés en vue de rechercher la présence d’anticorps anti-orthopoxvirus. L’écureuil arboricole, Funisciurus anerythrus fut trouvé positif et à partir d’un autre spécimen de ce petit mammifère présentant une éruption varioliforme, le virus fut isolé de la peau, des poumons, de la rate et des reins [24]. De plus, une autre enquête sérologique montra qu’une autre espèce d’écureuil arboricole, Heliosciurus rubobrachium pouvait également héberger le virus en RDC [25]. Ces observations sérologiques ont ensuite été étendues à d’autres mammifères forestiers, l’écureuil arboricole de Kuhl (F. congicus), le rat de Gambie (Cricetomys emini) et le rat à trompe tétradactyle (Petrodromus tetradactylus) [26]. Tous ces animaux sont activement chassés en Afrique centrale. Ils représentent une source non négligeable de nourriture, de même que les grands singes [27]. D’ailleurs, un chimpanzé (Pan troglodytes), à la suite d’une chasse, a transmis le monkeypox par morsure, à un bébé de la RDC [28]. Dans cette région d’Afrique, les écureuils arboricoles et les rongeurs sauvages pourraient représenter un réservoir primaire du virus tandis que les singes et les antilopes forestières (Cephalophus sp.) joueraient le rôle d’amplificateur du virus, tous ces animaux pouvant cependant être à l’origine de contaminations humaines directes.
Finalement, entre 1981 et 1986, 338 cas de monkeypox humain ont été étudiés en RDC, dont 245 (72 %) provenaient d’un contact direct avec un animal, alors que 93 résultaient d’une transmission interhumaine, de deuxième, de troisième, voire quatrième génération. Pour les cas d’origine animal, il s’agissait principalement de sujets de sexe masculin (58 %), appartenant à la classe d’âge 5–14 ans [18], [19].
4. La première épidémie extensive, Zaïre (1996–1997)
Elle est apparue brutalement à la mi-février 1996 et s’est étendue ensuite, au moins jusqu’en octobre 1997, dans les régions sanitaires de Katako-Kombé et Lodja, au Kasaï oriental, en RDC. Deux pics épidémiques furent observés, l’un en août 1996 et l’autre en août 1997 [29]. Mais ce qui était entièrement nouveau c’est que le virus était capable de se transmettre directement, d’un malade à un sujet sain à l’intérieur d’une même famille ou d’un clan. Ainsi, un cas index avait été à l’origine de huit cas « en cascade » : l’épidémisation du monkeypox était donc avérée [12], [29]. Parmi les malades, il y avait plus de sujets de sexe masculin (55 %) et la plupart des cas (85 %) concernait des individus âgés de moins de 16 ans [29].
L’étude moléculaire [30] des souches isolées des patients ne montrait que de très faibles variations génétiques par rapport aux souches isolées en 1970–1979, en RDC. On ne pouvait donc pas attribuer à une mutation récente le caractère rapidement extensif de cette épidémie, par transmission interhumaine. Une fois de plus, on pensa que la diminution de l’immunité antivariolique des populations était suffisante pour expliquer les faits [26], [29], [30] mais l’instabilité politique de la région pouvait aussi avoir contribué à la gravité de l’épidémie [30], les populations déplacées entrant plus facilement en contact avec la faune forestière, à la recherche d’un peu de nourriture [27], [31]. De plus, la guerre civile a considérablement gêné les investigations épidémiologiques [26]. Un moment, l’OMS avait envisagé des campagnes de revaccination antivariolique ciblées autour des foyers épidémiques, mais elle y a renoncé devant les risques d’effets secondaires de cette vaccination ou encore de la transmission accidentelle de virus actifs dans la région : VIH, hépatites, Ébola, etc…
Le bilan définitif était de 511 cas authentifiés, avec une très nette prédominance de cas secondaires (jusqu’à 78 %). Toutefois, le taux de létalité restait faible, de l’ordre de 1,5 à 3 % selon les différents villages touchés [29]. De plus, le tableau clinique n’était pas sensiblement différent de ce qui était déjà connu. Cependant, l’intrication avec des cas de varicelle et l’apparition d’infections mixtes avaient rendu souvent délicates les investigations cliniques et biologiques [26], [29].
Pour la première fois, la PCR avec amplification du gène de l’hémagglutinine, couplée à l’emploi de cultures cellulaires, avait été utilisée avec succès pour le diagnostic virologique. Il en était de même pour la recherche des IgG et des IgM spécifiques antivirus du monkeypox, pratiquée par la technique du western blot [30].
La transmission interhumaine du monkeypox a également été observée en République du Congo (Brazzaville), en milieu hospitalier, en 2003 [32].
5. L’épidémie américaine de 2003
C’était la première fois que le monkeypox s’échappait de ses foyers naturels d’infection africains [2].
5.1. Évolution épidémiologique
En mai–juin 2003, principalement dans les États de l’Illinois, de l’Indiana et du Wisconsin, de nombreux cas d’infection fébrile avec éruption varioliforme apparurent chez les amateurs de chiens de prairie (Cynomys sp.), de petits rongeurs sauvages nord-américains très appréciés par le public comme animaux de compagnie [13], [33], [34]. On en avait même exporté au Japon où ils sont vite devenus populaires. Plus d’un quart des malades présentaient un tableau clinique suffisamment sérieux pour nécessiter une hospitalisation [13], [34]. Dans le Wisconsin, on isola le virus responsable chez un malade et chez son petit compagnon. En microscopie électronique on vit qu’il s’agissait d’un poxvirus, classé peu après comme l’orthopoxvirus du monkeypox par le Centers for Disease Control (CDC) [13], [34]. En tout, 11 États furent touchés et 82 cas humains recensés dont 32 confirmés par le laboratoire.
Curieusement, on n’eut à déplorer aucun décès [34], [35] parmi les malades, souvent jeunes et pas forcément vaccinés contre la variole, comme si le virus avait perdu de sa virulence, en franchissant l’Atlantique [2]. On a aussi invoqué une moindre virulence de la souche importée aux États-Unis, du fait qu’elle provenait d’Afrique de l’ouest [36], ou encore un accès plus facile pour les malades américains à des soins de qualité [37].
5.2. Aspects cliniques du monkeypox d’importation
5.2.1. La symptomatologie clinique
La symptomatologie clinique quoique très proche de celle déjà observée en Afrique [13], [34], [35] en différait toutefois légèrement du fait que les lésions cutanées, parfois très hémorragiques [35] pendant la décrustation, siégeaient le plus souvent sur peau claire [35], alors que la maladie n’était jusque là connue que sur peau foncée [37].
Les malades étaient âgés de 3 à 43 ans, avec un sex ratio équilibré. Tous avaient été en contact avec des chiens de prairie ou d’autres rongeurs malades, récemment acquis. Certains étaient des vétérinaires ou des employés de boutiques spécialisées dans la distribution d’animaux de compagnie exotiques.
La contamination avait été assurée par morsure, griffure ou contact avec des sécrétions purulentes provenant des lésions vésiculopustuleuses cutanées, oculaires ou buccales des rongeurs infectés [38]. Les expositions les plus graves associant morsure, griffure et contacts étroits avec des animaux malades provoquèrent des infections à incubation plus courte et d’évolution plus sévère [39]. Dans deux cas, cependant, on pouvait suspecter une contamination inter humaine [13], [34], [40].
La période d’incubation durait de 4 à 24 jours, avec une moyenne de 14,5 jours [34], suivie d’une période prodromique fébrile d’environ 48 h. À la phase d’état, les principaux signes étaient :
-
•
une éruption varioliforme typique (100 % des cas) évoluant en papules, vésicules, pustules, ombilication, croûtes (parfois hémorragiques) et cicatrices inconstantes ;
-
•
une toux persistante (73 %) ;
-
•
une polyadénopathie, moins marquée que dans le monkeypox africain (55 %) ;
-
•
une angine (55 %) ;
-
•
de la diarrhée (18 %) et des nausées (9 %).
L’éruption pouvait être limitée au point de morsure ou de griffure, ou plus étendue, intéressant le visage, le cuir chevelu, les mains, les bras, les jambes, le tronc, le périnée, la conjonctive ou la cavité buccale [34]. Un cas d’encéphalite avait été observé chez une enfant âgée de six ans [13], [34], [37]. Une vaccination antivariolique antérieure n’a eu aucune influence sur la gravité de la maladie [34]. L’existence de rares formes anéruptives ou pauciéruptives pouvait singulièrement compliquer le diagnostic et la prise de décisions de Santé publique [41].
5.2.2. Les constantes biologiques
Les constantes biologiques étaient relativement peu perturbées [35] : élévation des transaminases sériques (50 % des patients), taux faible d’azote uréique sanguin (61 %), hypoalbuminémie (50 %), leucocytose (45 %) et thrombopénie modérée (35 %).
5.3. Diagnostic virologique et traitement
5.3.1. Le diagnostic spécifique
Le diagnostic spécifique du monkeypox humain fut établi par le CDC. en combinant plusieurs méthodes [34] : immunohistochimie pratiquée sur des biopsies cutanées au moyen d’anticorps polyclonaux antipoxvirus, pour la mise en évidence de l’antigène de groupe ; inoculation de tissus provenant de malades ou de rongeurs, dans différents types de cultures cellulaires et microscopie électronique appliquée aux biopsies cutanées mettant en évidence des particules typiques (Fig. 3 ). Mais c’est surtout la PCR qui s’est montrée déterminante pour la mise en évidence du VMP, tant chez l’homme que chez les rongeurs infectés. Enfin, le séquençage du gène de l’hémagglutinine a montré que ce virus était génétiquement très proche de ceux isolés chez l’homme en Afrique de l’Ouest ou de singes en captivité [34].
Fig. 3.
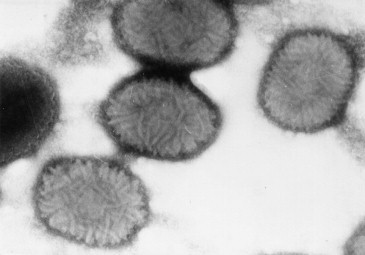
Particules d’orthopoxvirus vues en microscopie électronique à transmission. Coloration négative (Cliché laboratoire de virologie, faculté de médecine, Brest).
5.3.2. le plan thérapeutique
Sur le plan thérapeutique, les malades ont été isolés et ils ont reçu divers antibiotiques et, assez curieusement, des antiviraux comme l’acyclovir ou le valacyclovir, inefficaces sur les poxvirus [34]. Dans les formes graves, il eut été probablement plus indiqué de leur administrer du cidofovir par voie intraveineuse [2].
5.4. Origine de l’épidémie
Le virus du monkeypox n’avait pas été introduit aux États-Unis par un malade récemment rentré d’Afrique, ce qui eut été une voie « normale » d’importation. Son cheminement, tout à fait inattendu, était beaucoup plus rocambolesque [2].
Ce virus exotique était arrivé en Amérique du nord par voie aérienne, avec une cargaison de 800 rongeurs sauvages expédiés du Ghana, via le Texas et le New Jersey. Ces animaux ont été ensuite distribués dans des boutiques spécialisées notamment dans le Wisconsin [34]. Aucune mesure quarantenaire n’avait été prise avant leur embarquement en Afrique de l’Ouest ni à leur arrivée sur le sol américain [2]. Pourtant, certains de ces rongeurs étaient infectés et ils ont contaminé d’autres rongeurs, américains ceux-ci, hébergés dans les mêmes boutiques : des chiens de prairie. Ces derniers ont servi de vecteurs–amplificateurs pour le public américain [42].
Parmi les espèces importées du Ghana, au moins trois étaient porteuses du virus : le rat géant de Gambie (Cricetomys sp.), le loir africain (Graphiurus lorraineus) et un écureuil arboricole (Funisciurus sp.). Comme chez les chiens de prairie ou d’autres petits mammifères contaminés, la PCR s’est révélée être, chez ces animaux, supérieure à l’inoculation en cultures cellulaires, pour la mise en évidence du virus [42].
5.5. Dangers sanitaires majeurs représentés par l’importation d’animaux sauvages destinés à devenir des « animaux de compagnie » et mesures sanitaires
L’intrusion du monkeypox aux États-Unis a fait toucher du doigt un problème sanitaire très préoccupant, lié à la fois à l’inconscience des amateurs (la mode serait maintenant de faire prendre son bain à bébé en compagnie du boa familial !) et à un commerce international très florissant d’animaux sauvages [33], [43], [44], [45]. Quand on a connu, comme simple congressiste, le caractère très soupçonneux des douanes américaines pour tout ce qui vient du reste de la planète et alors que la dangerosité des rongeurs africains, hôtes de plusieurs virus pathogènes, était connue des virologistes américains [46], [47], la rencontre entre un rat de Gambie (Cricetomys sp.) et un chien de prairie (Cynomys sp.) aurait du rester un évènement très aléatoire. Pourquoi s’est-il produit ? Simplement pour de l’argent. Le commerce, plus ou moins licite, des animaux « de compagnie » d’origine exotique est très lucratif. Il est estimé à six millions de dollars américains, par an, à l’échelle planétaire [43].
Certes, des mesures très strictes de régulation des importations et du commerce des rongeurs et autres animaux exotiques ont été prises aux États-Unis, au plan fédéral [48], mais le problème de la cohabitation du monde sauvage avec notre espèce demeure entier [1], [45].
6. Progrès dans la connaissance du monkeypox et de son virus
L’épidémie survenue aux États-Unis en 2003, suivant de peu l’intrusion dans ce même pays du virus West Nile, en 1999, avec des conséquences beaucoup plus graves sur les plans sanitaire et écologique [1] et survenant dans un contexte de bioterrorisme exacerbé par les attentats du 11 septembre 2001, a puissamment relancé les recherches sur les orthopoxvirus.
6.1. Meilleure connaissance du virus
La biologie moléculaire a permis de confirmer ce que l’on suspectait déjà [49], il existe bien deux groupes génomiques distincts de VMT dont la répartition géographique est différente : un groupe ouest-africain, de pathogénicité et de transmissibilité interhumaine semble-t-il plus faibles, et un groupe centre africain, beaucoup plus agressif pour notre espèce. Cette différence de pathogénicité des deux topotypes a d’ailleurs un support moléculaire : les protéines virales responsables de l’immunomodulation et de la pathogénicité exprimées par les différentes souches sont différentes [36].
Le fait que le virus importé aux États-Unis, à partir du Ghana (Afrique de l’Ouest) appartienne au topotype ouest-africain pourrait expliquer la bénignité relative et l’absence de mortalité notées au cours de l’épidémie nord-américaine [34], [36], même si ces conclusions ne sont basées que sur le séquençage de cinq souches : une américaine, une provenant du Liberia et trois isolées en RDC [36].
6.2. Meilleure connaissance de la pathogénie de la maladie
La comparaison des séquences protéiques déduites du génome des différents topotypes a permis de prédire la conservation ou la perte, plus ou moins complètes, de facteurs de virulence déjà identifiés chez d’autres poxvirus. Ainsi la production du facteur de régulation de l’apoptose du virus du myxome ne serait qu’incomplètement exprimé par les souches appartenant au topotype ouest-africain/américain, tandis que les souches provenant du bassin du Congo (topotype centre africain) auraient conservé les fonctions antiapoptose et d’invasivité des lymphocytes de ce poxvirus [36]. Des différences ont également été notées quant aux capacités de certaines souches du virus du monkeypox à inhiber la voie classique d’activation du complément [36], [50]. Par ailleurs, le VMT (souche Zaïre 1973 ; topotype centre africain) exprime une protéine agissant comme un inhibiteur compétitif du récepteur–activateur NKG 2D de la superfamille des protéines du complexe majeur d’histocompatibilité de type I, ce qui constitue un mécanisme nouveau d’interférence virale participant à l’immunité innée contre les orthopoxvirus [51].
6.3. Pouvoir pathogène expérimental
Le modèle animal le plus intéressant pour l’étude expérimentale du monkeypox est celui du singe asiatique Macaca fascicularis infecté par différentes voies, en particulier par des aérosols [9], [52]. La vaccination antivariolique protège cet animal du monkeypox expérimental [9] et son inoculation par voie respiratoire permet de tester l’efficacité des candidats–vaccins antivarioliques de nouvelle génération [53]. Les infections létales, provoquées chez M. fascicularis par l’administration en aérosols de la souche Zaïre 1979, se traduisent par des lésions fibrino-nécrotiques étendues intéressant l’épithélium respiratoire, l’ensemble du système lymphoïde, le tractus intestinal, l’appareil reproducteur, la peau et, inconstamment le foie [52]. Les lésions nécrotiques relèveraient en partie de l’apoptose, mais l’antigène viral et des particules virales en cours de réplication ont été mises en évidence dans les cellules épithéliales, les macrophages, les cellules dendritiques et les fibroblastes des tissus lésés [50].
Par ailleurs, différents modèles expérimentaux utilisant des rongeurs nord-américains ont été utilisés aux États-Unis, malgré tous les risques potentiels que cela pouvait représenter pour la faune sauvage de cette région, un virus pouvant toujours s’échapper d’un laboratoire, accidentellement ou intentionnellement, comme le montrent plusieurs accidents récents de laboratoire dans ce pays [54]. Au laboratoire de Galveston, au Texas, on a inoculé par voie nasale ou intrapéritonéale, le VMT (souche US 2003) à deux petits mammifères sauvages de la faune néarctique, des écureuils terrestres (Spermophilus tridececulineatus) et, surtout, des chiens de prairie (Cynomys ludoviciannus) [55], [56], [57]. Il faut rappeler que ces derniers ont été les principaux vecteurs–disséminateurs du virus pour l’homme, en 2003. L’objectif officiel de cette expérimentation hasardeuse était d’étudier la pathogénie des infections à orthopoxvirus et les résultats ont été spectaculaires : des infections foudroyantes tuant les écureuils en six à neuf jours (55) et les chiens de prairie, en 11 jours [56], lorsqu’ils étaient inoculés par voie intra péritonéale. Les rares chiens de prairie ayant échappé à une inoculation intranasale ont continué à excréter le virus au niveau de leur nez et de leur gorge pendant plusieurs semaines [56]. On ne voit pas très bien l’intérêt de telles expériences, à haut risque écologique puisque le virus du monkeypox n’a pas réussi à s’installer dans la faune sauvage en 2003, alors que les auteurs reconnaissent que la pathologie induite chez les rongeurs est identique à celle réalisée par l’inoculation à M. fascicularis [55]. La même équipe a ensuite utilisé le modèle expérimental du spermophile (S. tridececulineatus) pour confirmer que la souche US 2003 qui appartient au topotype ouest-africain/américain, est moins virulente que les souches classées dans le topotype centre africain [57].
6.4. Progrès dans le diagnostic virologique
Ils sont essentiellement dus à la mise au point de techniques performantes d’amplification génétique. Le risque bioterroriste représenté par le virus de la variole n’est pas étranger à cette évolution rapide [58].
On dispose actuellement de toute une gamme de techniques de PCR permettant de parvenir rapidement au diagnostic d’une infection par un orthopoxvirus, puis de l’un des virus (une dizaine) constituant ce genre, dont le VMT [58], [59], [60], [61], [62], [63], [64]. Pour la détection rapide de ce dernier virus, on peut utiliser la combinaison de deux techniques de PCR en temps réel, une amplifiant les gènes codant l’ADN-polymérase des orthopoxvirus de l’Ancien Monde, à l’exception de celui de la variole, et l’autre amplifiant les gènes codant la protéine d’enveloppe B6R, spécifique du VMP [61]. Les PCR donnent des résultats négatifs avec d’autres virus à ADN, responsables d’infections éruptives chez l’homme comme l’herpes simplex virus ou celui de la varicelle–zona [62]. Posant également un problème de diagnostic différentiel avec le monkeypox, le tanapox, une orthopoxvirose africaine peut également bénéficier des mêmes techniques de PCR [65].
Il va de soi que pour un emploi optimal de ces techniques, il faut disposer de prélèvements convenables : liquide de vésicules ou de pustules ; croûtes ; autres liquides biologiques et, éventuellement, tissus, acheminés au laboratoire dans de bonnes conditions, ce qui n’est pas toujours le cas en milieu tropical. Si l’on ne peut pas mettre en jeu ces techniques, on peut aussi rechercher les anticorps anti-orthopoxvirus au moyen d’un test Elisa, mais celui-ci n’est pas assez spécifique pour pouvoir confirmer une suspicion de monkeypox humain [66].
6.5. Meilleure connaissance de la répartition géographique et de l’écologie du monkeypox en Afrique
On est encore loin d’avoir une connaissance exhaustive de la répartition géographique, de la faune sauvage réservoir et des facteurs environnementaux qui interviennent pour assurer la pérennité de cette zoonose sur le continent africain et sa transmissibilité à l’homme. Pourtant, on dispose déjà d’une quantité non négligeable de travaux réalisés sur place, parfois dans des conditions périlleuses [1].
Ainsi, c’est seulement en 2005 que, grâce à la perspicacité d’un praticien de « Médecins sans Frontières », on a découvert que le monkeypox sévissait dans le Sud du Soudan, une région où l’activité de cette orthopoxvirose n’avait jamais été décelée [67]. Le diagnostic a d’abord été suspecté lorsque des spécialistes du CDC ont eu en main, via Internet, la photo d’un enfant présentant une forme généralisée, pseudovariolique, de la maladie, puis il a été confirmé lorsque des prélèvements adéquats ont été recueillis chez la mère de l’enfant et acheminés, via Khartoum et le Caire, sur le CDC. L’aire de répartition géographique du monkeypox s’étendait, par conséquent, beaucoup plus à l’est de l’Afrique qu’on ne le supposait [67].
Par ailleurs, d’importants travaux de modélisation épidémiologiques ont été réalisés par le CDC, prenant en compte la distribution géographique des cas humains en Afrique et les facteurs environnementaux de risque pour l’homme. Cela a permis de définir des niches écologiques particulières, pratiquement similaires en Afrique de l’Ouest et en Afrique centrale, caractérisées par de fortes précipitations annuelles et des terrains peu élevés, facilement inondables [68]. De telles niches correspondent tout particulièrement aux régions forestières du bassin du fleuve Congo et, à un moindre degré, au bloc forestier ouest-africain s’étendant de la Guinée–Conakry jusqu’au Nigeria [68]. Il est à noter que pour l’Afrique de l’Est et du Sud, les prédictions du modèle incluent la Tanzanie, le Mozambique et Madagascar, mais pas le Sud du Soudan !
6.6. À la recherche d’antiviraux utilisables chez l’homme
La méthisazone (Marboran®), une thio-semi-carbazone active in vitro et in vivo sur les orthopoxvirus, était utilisée pour la chimioprophylaxie de la variole et le traitement des accidents de la vaccination antivariolique jusqu’à la fin des années 1970. Actuellement, elle n’est plus fabriquée par l’industrie pharmaceutique et l’on se trouve très démuni en antiviraux pouvant être administrés à des malades atteints de monkeypox.
L’antiviral moderne le plus prometteur est le cidofovir (Vistide®) qui administré par voie intrapéritonéale, protège efficacement du monkeypox expérimental le singe M. fascicularis, infecté par voie intratrachéale [69]. Toutefois, le cidofovir n’a jamais été utilisé pour le traitement du monkeypox humain et son maniement n’est pas aisé. Il doit être préparé avant usage sous une hotte à flux laminaire, puis administré en perfusion intraveineuse lente. De plus, il est néphrotoxique. Il ne convient donc ni à la prophylaxie de masse ni au traitement de malades en brousse africaine. Il devrait être réservé au traitement des formes graves de la maladie, en milieu hospitalier bien équipé.
D’autres antiviraux prometteurs sont en cours d’évaluation : un antiviral proche du cidofovir, le HPMPO-DApy [69], efficace dans le modèle simien M. fascicularis, et le composé antipoxvirus ST-246. Cet antiviral, développé par la firme américaine SIGA, a l’avantage d’être administrable par voie orale [70].
Il reste à évaluer l’efficacité de ces produits, dans le traitement de la maladie humaine.
7. Conclusions
Le monkeypox humain, dans sa forme sporadique, zoonotique, de contact avec la grande forêt pluviale africaine, ou dans sa forme épidémique, à transmission interhumaine, avait fait l’objet, depuis 1970, de descriptions cliniques et épidémiologiques très complètes. Mais il apparaissait comme une maladie exotique, lointaine, connue des seuls spécialistes et peu menaçante pour le reste de la planète. Tout a changé, en 2003, avec son intrusion sous forme épidémique, en zone tempérée, aux États-Unis Cet épisode rocambolesque par l’aspect inattendu de son introduction dans le pays (l’importation de 800 rongeurs sauvages africains), puis de sa propagation dans 11 États d’un pays médicalement très développé, a eu au moins le mérite de faire prendre conscience des risques sanitaires représentés par le trafic intercontinental des animaux exotiques « de compagnie ». Il a aussi suscité de nombreux travaux qui ont considérablement étendu nos connaissances sur cette zoonose et son virus. En revanche, sur le plan thérapeutique nous manquons cruellement d’antiviraux permettant de traiter les formes les plus graves de la maladie.
Références
- 1.Chastel C. Virus émergents ; vers de nouvelles pandémies ? Paris : Vuibert.ADAPT-SNES ; 2006.
- 2.Chastel C. Quand le monkeypox réussit à s’échapper d’Afrique. Virologie. 2004;8:83–86. [Google Scholar]
- 3.Georges A.J., Georges-Courbot M.C. Les biorisques liés aux orthopoxvirus : faut-il revacciner contre la variole ? Med Trop. 1999;59:483–487. [PubMed] [Google Scholar]
- 4.Enserink M. How devastating would a smallpox attack really be? Science. 2002;296:1592–1595. doi: 10.1126/science.296.5573.1592. [DOI] [PubMed] [Google Scholar]
- 5.Chastel C. L’éradication de la variole : menaces persistantes et développements nouveaux. Virologie. 1998;2:3–16. [Google Scholar]
- 6.Chastel C. Poxvirus. L’Eurobiologiste. 2000;246:75–79. [Google Scholar]
- 7.Douglass N.J., Dumbell K.R. DNA sequence variation as a clue to the phylogenesis of orthopoxvirus. J Gen Virol. 1996;77:947–951. doi: 10.1099/0022-1317-77-5-947. [DOI] [PubMed] [Google Scholar]
- 8.Von Magnus P., Andersen E.K., Petersen K.B., Birch-Andersen A. A pox-like disease in cynomolgus monkey. Acta Pathol Microbiol Scand. 1959;46:156–176. [Google Scholar]
- 9.Arita I., Henderson D.A. Smallpox and monkeypox in non human primates. Bull WHO. 1968;39:277–283. [PMC free article] [PubMed] [Google Scholar]
- 10.Lasnyj L.D., Ziegler P., Kima E. A human infection caused by monkeypox in Basankusu territory. Democratic Republic of Congo. Bull OMS. 1972;46:593–597. [PMC free article] [PubMed] [Google Scholar]
- 11.Breman J.G., Kalisa-Ruti, Steniowski M.V., Zanotto E., Gromyko A.I., Arita I. Human monkeypox, 1970–1979. Bull OMS. 1980;58:165–182. [PMC free article] [PubMed] [Google Scholar]
- 12.WHO. Human monkeypox – Kasaï Oriental. Morb Mortal Wkly Rep 1997; 46: 304-7. [PubMed]
- 13.CDC. Multistate outbreak of monkeypox. Illinois, Indiana, and Wisconsin, 2003. Morb Mortal Wkly Rep 2003; 52: 537-40. [PubMed]
- 14.Foster S.O., Brink E.W., Hutchins D.L., Pifer J.M., Lourie B., Moser C.R., et al. Human monkeypox. Bull OMS. 1972;46:569–576. [PMC free article] [PubMed] [Google Scholar]
- 15.Arita I., Jezek Z., Khodakevich L., Ruti K. Human monkeypox: a newly emerged orthopoxvirus zoonosis in the tropical rain forests of Africa. Am J Trop Med Hyg. 1985;34:781–789. doi: 10.4269/ajtmh.1985.34.781. [DOI] [PubMed] [Google Scholar]
- 16.Jezek Z., Marennikova S.S., Mutombo M., Nakano J.H., Paluku K.M., Szczeniowski M. Human monkeypox: a study of 2,510 contacts of 214 patients. J Infect Dis. 1986;154:551–555. doi: 10.1093/infdis/154.4.551. [DOI] [PubMed] [Google Scholar]
- 17.Ježek Z., Szczeniowski M., Paluku K.M., Mutombo M. Human monkeypox: clinical features of 282 patients. J infect Dis. 1987;156:293–298. doi: 10.1093/infdis/156.2.293. [DOI] [PubMed] [Google Scholar]
- 18.Ježek Z., Grab B., Szczeniowski M., Paluku K.M., Mutombo M. Clinico-epidemiological features of monkeypox patients with an animal or human source of infection. Bull WHO. 1998;66:459–464. [PMC free article] [PubMed] [Google Scholar]
- 19.Ježek Z., Grab B., Szczeniowski M.V., Mutombo M. Human monkeypox: secondary attack rates. Bull WHO. 1988;66:465–470. [PMC free article] [PubMed] [Google Scholar]
- 20.Khodakevich L., Widi-Wirski R., Arita I., Marennikova S.S., Nakano J., Meunier Orthopoxvirose simienne de l’homme en République centrafricaine. Bull Soc Path Exot. 1985;78:311–320. [PubMed] [Google Scholar]
- 21.Herve V.M.A., Belec L., Yayah G., Georges A.J. Actualité du monkeypox en Afrique centrale, à propos de l’isolement de deux souches en République centrafricaine. Med Mal Infect. 1989;19:322–324. doi: 10.1016/S0399-077X(89)80242-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Muller G., Meyer A. Monkeypoxvirus in liver and spleen of child in Gabon. Lancet. 1988;1:769–770. doi: 10.1016/s0140-6736(88)91580-2. [DOI] [PubMed] [Google Scholar]
- 23.Meyer A., Esposito J.J., Gras F., Kolakowoski T., Fatras M., Muller G. Première apparition au Gabon de monkeypox chez l’homme. Med Trop. 1991;51:53–57. [PubMed] [Google Scholar]
- 24.Khodakevich L., Jezek Z., Kinzangka K. Isolation of monkeypox virus from wild squirrel infected in nature. Lancet. 1986;1:98–99. doi: 10.1016/S0140-6736(86)90748-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Khodakevich L., Szczeniowski M., Mambu-ma-disu, Jezek Z., Marennikovo S., Nakano J., et al. The role of squirrels in sustaining monkeypox virus transmission. Trop Geogr Med. 1987;39:115–122. [PubMed] [Google Scholar]
- 26.Hutin Y.J.F., Williams R.J., Malfait P., Pebody R., Loparev V.N., et al. Outbreak of human monkeypox, Democratic Republic of Congo, 1996–1997. Emerg Infect Dis. 2001;7:434–438. doi: 10.3201/eid0703.010311. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Chastel C., Charmot G. Épidémies bactériennes et virales d’origine zoonotique. Rôle de la chasse et de dépeçage d’animaux sauvages. Bull Soc Path Exot. 2004;97:207–212. [PubMed] [Google Scholar]
- 28.Mutombo M.W., Arita I., Jezek Z. Human monkeypox transmitted by a chimpanzee in a tropical rainforest area of Zaïre. Lancet. 1983;1:735–737. doi: 10.1016/S0140-6736(83)92027-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.WHO. Human monkeypox – Kasai Oriental, Democratic Republic of Congo. February-October 1997. Morb Mortal Wkly Rep 1997; 46: 1168-71. [PubMed]
- 30.Mukinda V.B.K., Mwema G., Kilundu M., Heymann D.L., Shan A.S., Esposito J.J., et al. Re-emergence of human monkeypox in Zaïre in 1996. Lancet. 1997;340:1449–1450. doi: 10.1016/S0140-6736(05)63725-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Cohen J. Is an old virus up to new tricks? Science. 1997;277:312–313. doi: 10.1126/science.277.5324.312. [DOI] [PubMed] [Google Scholar]
- 32.Learned L.A., Reynolds M.G., Wassa D.W., Li Y., Olson V.A., et al. Extended interhuman transmission of monkeypox in a hospital community in the Republic of the Congo, 2003. Am J Trop Med Hyg. 2005;73:428–434. [PubMed] [Google Scholar]
- 33.Larkin M. Monkeypox spreads as US public –health system plays catch up. Lancet Infect Dis. 2003;3:461. doi: 10.1016/S1473-3099(03)00713-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Reed K.D., Melski J.W., Graham M.B., Regnery R.L., Sotir M.J., Wegner M.V., et al. The detection of monkeypox in human in the Western hemisphere. N Engl J Med. 2004;350:342–350. doi: 10.1056/NEJMoa032299. [DOI] [PubMed] [Google Scholar]
- 35.Huhn G.D., Baner A.M., Yorita K., Graham M.J., Sejvar J., Likos A., et al. Clinical characteristics of human monkeypox, and risk factors for severe disease. Clin Infect Dis. 2005;41:1742–1751. doi: 10.1086/498115. [DOI] [PubMed] [Google Scholar]
- 36.Likos A.M., Sammons S.A., Olson V.A., Frace A.M., Li Y., Olsen-Rasmussen M., et al. A tale of two clades: monkeypox viruses. J Gen Virol. 2005;86:2661–2672. doi: 10.1099/vir.0.81215-0. [DOI] [PubMed] [Google Scholar]
- 37.Sale T.A., Melski J.W., Stratman E.J. Monkeypox: an epidemiologic and clinical comparison of African and US disease. J Am Acad Dermatol. 2006;56:478–481. doi: 10.1016/j.jaad.2006.05.061. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Reynolds M.G., Davidson W.B., Curns A.T., Conover C.S., Huhn G., Davis J.P., et al. Spectrum of infection and risk factors for human monkeypox. Emerg Infect Dis. 2007;13:1332–1339. doi: 10.3201/eid1309.070175. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Reynolds M.G., Yorita K.L., Kuehnert M.J., Davidson W.B., Huhn G.D., Holman R.C., et al. Clinical manifestations of human monkeypox by route of infection. J Infect Dis. 2006;194:773–780. doi: 10.1086/505880. [DOI] [PubMed] [Google Scholar]
- 40.Frey S.E., Belshe R.B. Poxvirus zoonoses- Putting pocks into context. N Engl J Med. 2004;350:324–327. doi: 10.1056/NEJMp038208. [DOI] [PubMed] [Google Scholar]
- 41.Lewis M.W., Graham M.B., Hammarlund E., Hanifin J., Slifka M.K. Monkeypox without exanthem. N Engl J Med. 2007;356:2112–2114. doi: 10.1056/NEJMc062788. [DOI] [PubMed] [Google Scholar]
- 42.Hutson C.L., Lee K.N., Abel J., Carroll D.S., Montgomery J.M., Olson V.A., et al. Monkeypox zoonotic associations: insights from laboratory evolution of animals associated with the multi-State US outbreak. Am J Trop Med Hyg. 2007;76:757–767. [PubMed] [Google Scholar]
- 43.Check E. Health concerns prompt US review of exotic-pet trade. Nature. 2004;427:277. doi: 10.1038/427277a. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Bernard S.M., Anderson S.A. Qualitative assessment of risk for monkeypox associated with domestic trade in certain animal species. United States. Emerg Infect Dis. 2006;12:1827–1833. doi: 10.3201/eid1212.060454. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Chomel B.B., Belotto A., Meslin F.X. Widlife, exotic pets, and emerging zoonoses. Emerg Infect Dis. 2007;13:6–11. doi: 10.3201/eid1301.060480. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Kemp G.E., Causey O.R., Setzer H.W., Moore D.L. Isolation of viruses from wild mammals in West Africa, 1966–1970. J Wildl Dis. 1974;10:279–293. doi: 10.7589/0090-3558-10.3.279. [DOI] [PubMed] [Google Scholar]
- 47.Karabatsos N. third ed. American Society of Tropical Medicine and Hygiene; San Antonio, Texas: 1985. International catalogue of Arboviruses of vertebrates. [Google Scholar]
- 48.F.D.A. Control of communicable diseases; restriction on African rodents, prairie dogs, and other animals. Fed Register 2007; 72: 7825-6. [PubMed]
- 49.Chen N., Li G., Liszewski M.K., Atkinson J.P., Jahrling P.B., et al. Virulence differences between monkeypox virus isolates from West Africa and the Congo basin. Virology. 2005;340:46–63. doi: 10.1016/j.virol.2005.05.030. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Lizewski M.K., Leung M.K., Hauhart R., Buller R.M.L., Bertram P., Wong X., et al. Structure and regulatory profile of the monkeypox inhibitor of complement: comparison to homologs in vaccinia and variola and evidence for dimer formation. Immunology. 2006;176:2725–2734. doi: 10.4049/jimmunol.176.6.3725. [DOI] [PubMed] [Google Scholar]
- 51.Campbell J.A., Trossman D.S., Yokoyama W.M., Carayannopoulos L.N. Zoonotic orthopoxviruses encode a hight-affinity antagonist of NKG2D. J Exp Med. 2007;204:1311–1317. doi: 10.1084/jem.20062026. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Zancha G.M., Jaheling P.B., Geishert T.W., Swearengen J.R., Hensley L. The pathology of experimental aerosolized monkeypox virus infection in cynomolgus monkeys (Macaca fascicularis) Lab Invest. 2001;81:1581–1600. doi: 10.1038/labinvest.3780373. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Stittelaar K.J., van Amerongen G., Kondora I., Kuiken T., van Lavieten R.F., Pistoor F.H.M., et al. Modified vaccinia virus Ankara protects macaques against respiratory chalenge with monkeypox virus. J Virol. 2005;79:7845–7851. doi: 10.1128/JVI.79.12.7845-7851.2005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Kaiser J. Accidents spur a closer look at risks at biodefense labs. Science. 2007;317:1852–1854. doi: 10.1126/science.317.5846.1852. [DOI] [PubMed] [Google Scholar]
- 55.Tesh R.B., Watts D.M., Sbrana E., Sirin M., Popov V.L., Xia S.Y. Experimental infection of ground squirrels (Spermophilus tridacemlineatus) with monkeypox virus. Emerg Infect Dis. 2004;10:1563–1567. doi: 10.3201/eid1009.040310. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Xiao S.Y., Sbrana E., Watts D.M., Anella P.A., da Rosa T., et al. Experimental infection of prairie dogs with monkeypox virus. Emerg Infect Dis. 2005;11:539–545. doi: 10.3201/eid1104.040907. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Sbrana E., Xiao S.Y., Newman P.C., Tesh R.B. Comparative pathology of north American and central African strains of monkeypox virus in a ground squirrel model of disease. Am J Trop Med Hyg. 2007;76:155–164. [PubMed] [Google Scholar]
- 58.Ropp S.L., Jin Q., Knight J.C., Massung R.F., Esposito J.J. PCR strategy for identification and differentiation of smallpox and other orthopoxviruses. J Clin Microbiol. 1995;33:2069–2076. doi: 10.1128/jcm.33.8.2069-2076.1995. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Loparev V.N., Massung R.F., Esposito J.J., Meyer H. Detection and differentiation of old world orthopoxviruses: restriction fragment length polymorphism of crmB gene region. J Clin Microbiol. 2001;39:94–100. doi: 10.1128/JCM.39.1.94-100.2001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Ibrahim M.S., Kulesh D.A., Saleh S.S., Damon I.K., Esposito J.J., Schmoljohn A.L., et al. Real-time PCR assay to detect smallpox virus. J Clin Microbiol. 2003;41:3835–3839. doi: 10.1128/JCM.41.8.3835-3839.2003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Li Y., Olson V.A., Lane T., Laker M.T., Damon I.K. Detection of monkeypox virus with real-time assays. J Clin Virol. 2006;36:194–203. doi: 10.1016/j.jcv.2006.03.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Ryabinin V.A., Shundrin L.A., Kostina E.B., Laassri M., Chizhikov V., Shchelkunov S.N., et al. Microarray assay for detection and discrimination of Orthopoxvirus species. J Med Virol. 2006;78:1325–1340. doi: 10.1002/jmv.20698. [DOI] [PubMed] [Google Scholar]
- 63.Scaramozzino N., Ferrier-Rembert A., Favier A.L., Rothlisberger C., Richard S., Crance J.M., et al. Real-time PCR to identify variola virus and other human pathogenic Orthopox viruses. Clin Chem. 2007;53:606–613. doi: 10.1373/clinchem.2006.068635. [DOI] [PubMed] [Google Scholar]
- 64.Li Y., Ropp S.L., Zhao H., Damon I.K., Esposito J.J. Orthopoxvirus pan-genomic DNA assay. J Virol Methods. 2007;141:154–165. doi: 10.1016/j.jviromet.2006.12.005. [DOI] [PubMed] [Google Scholar]
- 65.Dhar A.D., Werchniak A.E., Li Y., Brennick J.B., Goldsmith C.S., Kline R., et al. Tanapox infection in a college student. N Engl J Med. 2004;350:361–366. doi: 10.1056/NEJMoa031467. [DOI] [PubMed] [Google Scholar]
- 66.Karem K.L., Reynolds M., Olson V., Li Y., Damon I.K. Monkeypox outbreak diagnostics and implications for vaccine protective effect. Nat Med. 2006;12:495–496. doi: 10.1038/nm0506-495. [DOI] [PubMed] [Google Scholar]
- 67.Damon I.K., Roth C.E., Chowdhary V. Discovery of monkeypox in Sudan. N Engl J Med. 2007;355:962–963. doi: 10.1056/NEJMc060792. [DOI] [PubMed] [Google Scholar]
- 68.Levine R.S., Peterson A.T., Yorita K.L., Damon I.K., Reynolds M.G. Ecologic niche and geographic distribution of human monkeypox in Africa. PLoS Biol. 2007;2:e176. doi: 10.1371/journal.pone.0000176. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.Stittelaar K.J., Neyts J., Naesens L., van Amerongen G., van Lavieren R.F., Holy A., et al. Antiviral is more effective than smallpox vaccination upon lethal monkeypox virus infection. Nature. 2006;439:745–748. doi: 10.1038/nature04295. [DOI] [PubMed] [Google Scholar]
- 70.Sbrana E., Jordan R., Haruby D.E., Mateo R.I., Xiao S.Y., Siirin M., et al. Efficacy of the antipoxvirus compound ST-246 for treatment of severe orthopoxvirus infection. Am J Trop Med Hyg. 2007;76:768–773. [PubMed] [Google Scholar]


