Abstract
目的
探讨激活大麻素受体2(CB2)对大鼠脓毒症急性肺损伤的保护作用及机制。
方法
将48只SD大鼠随机分为对照组、模型组、CB2激动剂组和P38 MAPK抑制剂组(12只/组)。对照组腹腔注射生理盐水,其余3组均腹腔注射脂多糖造模6 h;CB2激动剂组在注射脂多糖前30 min腹腔注射CB2激动剂JWH133(3 mg/kg),P38 MAPK抑制剂组在CB2激动剂组基础上提前30 min腹腔注射P38 MAPK抑制剂SB203580(5 mg/kg)。观察和检测肺组织病理学、含水率、液体清除率、炎症因子的变化情况,肺组织CB2、紧密连接的基因及蛋白表达情况以及P38 MAPK磷酸化情况。
结果
与对照组相比,模型组大鼠的肺泡结构破坏严重,液体清除率、肺组织中CB2、occludin和ZO-1蛋白的mRNA及蛋白表达降低,肺组织含水率、P38 MAPK的磷酸化程度、肺灌洗液中TNF-α、IL-1β均增加,差异有统计学意义(P < 0.05)。与模型组相比,CB2激动剂组肺泡形态有所恢复,但仍有炎性浸润,肺组织含水率、P38 MAPK磷酸化程度、肺灌洗液中TNF-α、IL-1β降低,液体清除率、肺组织CB2、occludin和ZO-1蛋白的mRNA及蛋白表达增加,差异均有统计学意义(P < 0.05)。与CB2激动剂组相比,P38 MAPK抑制剂组肺泡结构有所恢复,肺组织P38 MAPK磷酸化程度、肺灌洗液中TNF-α、IL-1β水平降低,occludin、ZO-1蛋白表达增加,差异均有统计学意义(P < 0.05),而CB2的mRNA及蛋白表达无变化(P > 0.05)。
结论
CB2激活后可通过抑制P38 MAPK信号通路,降低肺组织炎症因子释放,促进紧密连接蛋白表达,对实验性脓毒症大鼠急性肺损伤起到保护作用。
Keywords: 大麻素受体2, P38 MAPK, 紧密连接蛋白, 脓毒症, 大鼠
Abstract
Objective
To investigate the protective effect of cannabinoid receptor 2 (CB2) activation against acute lung injury in rats with lipopolysaccharide (LPS)-induced sepsis and explore the underlying mechanism.
Methods
Forty-eight SD rats were randomly assigned into control group, model group, CB2 agonist group and P38 MAPK inhibitor group (n=12). In the latter 3 groups, the rats received intraperitoneal injection of LPS to induce sepsis, and the control rats were given saline injection. In CB2 agonist group, JWH133 (3 mg/kg) was injected intraperitoneally 30 min before LPS injection; in P38 MAPK inhibitor group, the rats received intraperitoneal injection of SB203580 (5 mg/kg) 30 min prior to JWH133 injection. The changes in lung histopathology, water content, fluid clearance rate, inflammatory factors, pulmonary expressions of CB2 and tight junctionrelated genes, and phosphorylation of P38 MAPK in the lung tissues were examined.
Results
The rat models of sepsis showed severe damage of alveolar structures with significantly decreased fluid clearance rate, lowered pulmonary expressions of CB2, occludin and ZO-1 mRNA and proteins, increased water content in the lung tissue, and increased phosphorylation level of P38 MAPK and TNF-α and IL-1β levels in lung lavage fluid (all P < 0.05). Treatment with JWH133 improved alveolar pathology in the septic rats, but there was still inflammatory infiltration; lung tissue water content, phosphorylation of P38 MAPK, and TNF-α and IL-1β levels in lung lavage fluid were all significantly decreased, and the fluid clearance rate, pulmonary expressions of CB2, occludin and ZO-1 were significantly increased (all P < 0.05). Additional treatment with SB203580 resulted in further improvements of alveolar pathologies, lowered phosphorylation levels of P38 MAPK in the lung tissue and TNF-α and IL-1β levels in lung lavage fluid, and increased the protein expressions of occludin and ZO-1 (P < 0.05) without causing significant changes in mRNA and protein expression of CB2 (P > 0.05).
Conclusion
In rats with LPS-induced sepsis, activation of CB2 can inhibit the p38 MAPK signaling pathway, reduce the release of inflammatory factors in the lung tissues, promote tight junction protein expressions, and thus offer protection against acute lung injury.
Keywords: cannabinoid receptor 2, P38 lightning MAPK, tight junction protein, sepsis, rats
脓毒症所致的急性肺损伤(ALI)/急性呼吸窘迫综合症(ARDS)是重症医学科最常见危重症。脂多糖(LPS)是革兰氏阴性细菌细胞壁的主要成分和致病因素,常用于构建脓毒症模型[1]。肺水肿的发生与肺泡上皮细胞间的屏障结构改变有关,是ALI的重要特征之一[2]。紧密连接(TJs)是一类多功能蛋白复合物,在细胞旁屏障中发挥重要作用[3]。研究发现,增加TJs的表达可以重建内源性人支气管上皮细胞受损的屏障[4]。TJs主要包括跨膜蛋白和胞质蛋白,跨膜蛋白包括闭合蛋白(occludin)、密封蛋白和连接黏附分子等;胞质蛋白包含ZO蛋白家族以及Cingulin。其中,occludin和ZO-1蛋白均是影响肺部屏障结构和功能的重要因素[5]。
内源性大麻素系统由大麻素受体(CB)、内源性配体和酶系统组成。其中CB2受体可以激活多种细胞内信号转导通路,表现出抗炎和免疫抑制作用[6]。已有研究表明,激活CB2受体能抑制脓毒症的发展[7]。JWH133是一种CB2特异性激动剂,常被用于激活CB2。P38 MAPK是MAPK家族中控制炎症反应最重要的成员之一,可被生理性应激等因素激活[8]。SB203580作为一种P38 MAPK特异性抑制剂,可使其失去激酶活性。CB2及P38 MAPK可能在脓毒症ALI中发挥重要作用,其具体机制尚未被完全阐明。
本研究利用LPS诱导大鼠脓毒症ALI模型,并通过CB2激动剂JWH133和P38 MAPK抑制剂SB203580干预实验,观察大鼠肺组织病理学、肺组织含水率、肺泡液体清除率、炎症因子及TJs蛋白表达情况,探讨CB2对实验性脓毒症ALI的作用及可能的机制。
1. 材料和方法
1.1. 材料
1.1.1. 实验动物
健康SPF级SD大鼠48只,6~8周龄,雌雄各半,体质量180±20 g,购自北京华阜康生物科技股份公司[华阜康SCXK(京)2019-0008]。实验动物处理符合实验动物福利伦理原则(LX2019093)。本实验严格遵循动物实验3R原则,遵循动物实验伦理要求。
1.1.2. 主要试剂及仪器
BCA蛋白浓度测定试剂盒(北京索莱宝科技),qPCR Master Mix试剂盒、逆转录试剂盒(Abm),兔抗CB2多克隆抗体(Bioworld),鼠抗GAPDH多克隆抗体、兔抗p-P38 MAPK多克隆抗体、兔抗P38 MAPK多克隆抗体(Affinity),兔抗occludin多克隆抗体/兔抗ZO-1多克隆抗体(Proteintech),JWH133、SB203580(APExBIO)。小动物呼吸机(SAR-830/P),T100TM Thermal Cycler反转录仪器(BioRad),Light Cycler TM 96荧光实时定量PCR仪(Roche)。
1.2. 方法
1.2.1. 动物分组
适应性喂养1周后,将48只SD大鼠随机分为4组:对照组、模型组、CB2激动剂组和P38 MAPK抑制剂组,每组12只,雌雄各半。
1.2.2. 造模及药物干预
大鼠禁食不禁水12 h后,模型组经腹腔注射LPS(10 mg/kg)复制脓毒症模型,模型复制成功的判定依据为:光镜下观察肺组织病理学变化情况;CB2激动剂组在注射LPS前30 min腹腔注射JWH133(3 mg/kg);P38 MAPK抑制剂组在注射CB2激动剂前30 min腹腔注射SB203580(5 mg/kg),后续处理同CB2激动剂组;对照组腹腔注射等量的生理盐水,6 h后处死大鼠,收集标本,具体实验流程见图 1。
图 1.
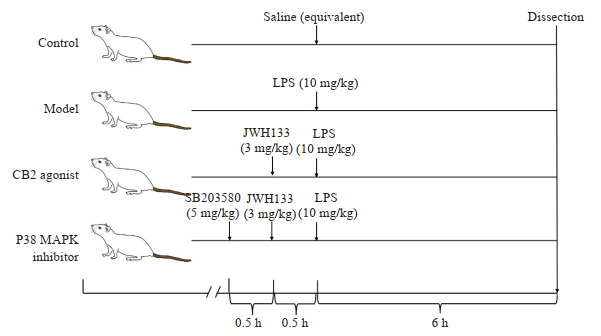
动物实验流程图
Flow chart of animal experiments.
1.2.3. HE染色
摘取大鼠右肺下叶浸泡于4%多聚甲醛固定24 h,常温石蜡包埋5 μm切片,经脱蜡、复水、反蓝、透明操作后,苏木素、伊红染色,然后在光学显微镜下观察并采集图像。
1.2.4. 电镜观察
新鲜右肺下叶组织确定取材部位后,在离体1~3 min内取样,取样组织体积为1 mm3。放于提前准备的装有电镜固定液的培养皿内4 ℃固定保存及运输。经后固定、脱水、聚合、染色后,铜网切片放入铜网盒内室温干燥过夜,透射电子显微镜下观察,采集图像分析。
1.2.5. 肺组织含水率
取右肺中叶,将部分肺组织称量湿重后,置烤箱(80 ℃,24 h)烤至恒重,称量干质量并计算肺组织含水率,计算方法见公式(1)。
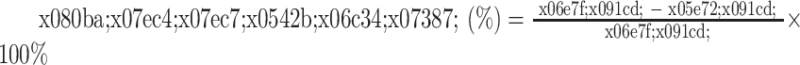 |
1 |
1.2.6. 肺泡液体清除率AFC(%)
腹腔注射1%戊巴比妥麻醉大鼠,钝性分离气管后,进行气管插管,并将0.3 mL生理盐水配制的5%小牛血清白蛋白缓慢灌入大鼠肺内。随后接通小动物呼吸机,进行100% O2的机械通气,期间使用恒温仪使大鼠体温保持在37 ℃。1 h后处死动物,并将肺组织整块取下,回吸肺内液体0.2 mL,计算肺泡液体清除率,计算方法见公式(2)。
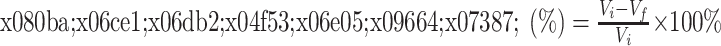 |
2 |
式中:
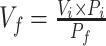 ;Vi为起始注入肺泡内(i)液体体积;Vf为灌注30 min后吸出的肺泡液(f)液体体积;P为白蛋白浓度。
;Vi为起始注入肺泡内(i)液体体积;Vf为灌注30 min后吸出的肺泡液(f)液体体积;P为白蛋白浓度。
1.2.7. 肺泡灌洗液(BALF)中TNF-α、IL-1β
结扎右肺门支气管、血管,经气管导管向左肺注入生理盐水3 mL,反复肺灌洗5次,回收量 > 95%,收集BALF,储存在-80 ℃。取1.5 mL BALF,4 ℃ 2500 r/min离心10 min取上清液,ELISA法检测BALF中TNF-α、IL-1β表达水平。
1.2.8. RT-qPCR法测mRNA表达
用Trizol法提取右肺上叶组织中的RNA,保存于-80 ℃,测定样品的总RNA浓度。按试剂盒说明逆转录合成cDNA,然后按照扩增试剂盒进行PCR扩增,运用2-ΔΔCt法以GAPDH为内参,进行occludin、ZO-1、CB2的相对定量分析。引物由上海生工生物工程股份有限公司合成(表 1)。
表 1.
引物序列表
Primer sequence list
| Gene | Sequence of primer |
| CB2 | 5'-GGAAACCCTCCTGACTCC-3' |
| 5'-TGTGAAGTTGTGGGCAGA-3' | |
| occludin | 5'-CACACTTGCTTGGGACAGAG-3' |
| 5'-TAGCCGTAACCGTAGCCGTA-3' | |
| ZO-1 | 5'-ACCCGAAACTGATGCTATGG-3' |
| 5'-GTTGGACAGAGGCGGAACT-3' | |
| GAPDH | 5'-ATGGCTACAGCAACAGGGT-3' |
| 5'-TTATGGGGTCTGGGATGG-3' |
1.2.9. 蛋白质印迹实验检测相关蛋白表达
按照RIPA∶PMSF∶磷酸酶抑制剂=100∶1∶1的比例配置细胞裂解液,以提取右肺上叶组织中总蛋白,用BCA方法对总蛋白进行定量。每组取等量蛋白提取液(30 μg/10 μL),电泳分离后转至PVDF膜上,用5%脱脂奶粉室温下孵育1 h后加入兔抗ZO-1(1∶1000)多克隆抗体、兔抗occludin(1∶1000)多克隆抗体、兔抗p-P38 MAPK(1∶ 1000)多克隆抗体、兔抗P38 MAPK(1∶1000)多克隆抗体和鼠抗GAPDH(1∶1000)多克隆抗体,在4 ℃孵育过夜。次日,用TBST洗涤3次后,再与孵育二抗1 h,TBST洗涤3次后运用ECL化学发光法对蛋白质进行显影,用Image J软件检测蛋白质水平。以GAPDH为内参计算相对蛋白水平,P38 MAPK磷酸化程度计算见公式(3):
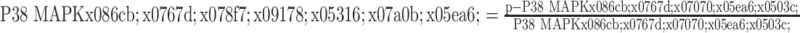 |
3 |
1.3. 统计学方法
采用SPSS 22.0软件进行统计学分析,数据均以均数±标准差表示。各处理组与对照组比较,采用单因素方差分析,进一步进行组间两两比较时,采用SNK检验。以P < 0.05为差异有统计学意义。
2. 结果
2.1. 肺组织形态学变化
对照组肺泡完整,无毛细血管扩张(图 2);模型组的肺泡结构破坏严重,肺泡中发现大量有中性粒细胞浸润,毛细血管扩张,肺泡壁增厚,造模成功(图 2);CB2激动剂组肺泡形态有所恢复,但仍有炎性浸润(图 2);P38 MAPK抑制剂组肺泡结构基本恢复,炎性浸润减少,但仍未恢复至正常(图 2)。
图 2.
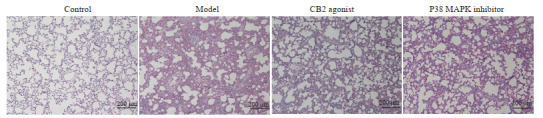
各组大鼠肺组织病理图
Lung histopathology of the rats in each group.
对照组的Ⅱ型肺泡上皮细胞体积较大,相邻细胞接触面的质膜上可见短粗微绒毛,胞质内细胞器丰富,可见特征性板层小体(图 3A、B)。模型组胞质内可见部分内质网扩张,核周隙扩张明显,个别线粒体有水肿(图 3C、D)。CB2激动剂组(图 3E、F)及P38 MAPK抑制剂组细胞器形态结构基本正常(图 3G、H)。
图 3.
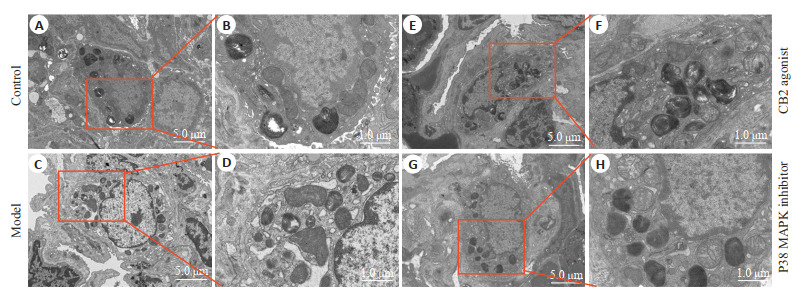
各组大鼠肺组织电镜图
Transmission electron microscopy of the lung tissues of the rats in each group. B, D, F, H is the amplification of A, C, E, G.
2.2. 大鼠肺组织含水率的变化
与对照组比较,模型组大鼠肺组织含水率增加(P < 0.05);与模型组比较,CB2激动剂组大鼠肺组织含水率降低(P < 0.05,表 2)。
表 2.
各组大鼠肺组织含水率情况
Water content in the lung tissues in each group (n=8, Mean±SD)
| Group | Water content (%) |
| F=2.369, P=0.092; aP < 0.05 vs control group, bP < 0.05 vs model group. | |
| Control | 78.70±1.37 |
| Model | 80.92±2.37a |
| CB2 agonist | 78.59±1.22b |
| P38 MAPK inhibitor | 79.37±2.57 |
2.3. 肺组织液体清除率的变化
与对照组比较,模型组大鼠肺组织液体清除率降低(P < 0.05);与模型组比较,CB2激动剂组大鼠肺组织液体清除率升高(P < 0.05);与CB2激动剂组比较,P38 MAPK抑制剂组大鼠肺组织液体清除率有升高趋势,但差异无统计学意义(P > 0.05,表 3)。
表 3.
各组大鼠肺组织液体清除率情况
Fluid clearance rate in the lung tissues in each group(n=6, Mean±SD)
| Group | Fluid clearance rate (%) |
| F=27.363, P < 0.001; aP < 0.05 vs control group, bP < 0.05 vs model group. | |
| Control | 72.67±6.02 |
| Model | 49.47±3.30a |
| CB2 agonist | 69.79±5.72b |
| P38 MAPK inhibitor | 71.29±5.03 |
2.4. 肺灌洗液中炎症因子的变化
与对照组比较,模型组大鼠肺灌洗液中TNF-α、IL-1β水平均上升(P < 0.05);与模型组比较,CB2激动剂组大鼠肺灌洗液中TNF-α、IL-1β水平均降低(P < 0.05);与CB2激动剂组比较,P38 MAPK抑制剂组大鼠肺灌洗液中TNF-α和IL-1β水平降低(P < 0.05,表 4)。
表 4.
大鼠肺泡灌洗液中炎症因子表达情况
Expression of inflammatory factors in alveolar lavage fluid of the rats (n=6, Mean±SD)
| Group | TNF-α | IL-1β |
| TNF-α: F=57.244, P < 0.001; IL-1β: F=43.043, P < 0.001; aP < 0.05 vs control group, bP < 0.05 vs model group, cP < 0.05 vs CB2 agonist group. | ||
| Control | 84.51±8.28 | 25.29±3.74 |
| Model | 207.45±31.92a | 60.53±10.49a |
| CB2 agonist | 138.60±5.87b | 31.38±6.61b |
| P38 MAPK inhibitor | 110.90±7.13c | 22.38±1.68c |
2.5. 肺组织CB2及紧密连接蛋白mRNA表达
与对照组比较,模型组大鼠肺组织的CB2、occludin及ZO-1蛋白mRNA表达降低(P < 0.05);与模型组比较,CB2激动剂组大鼠肺组织CB2、occludin及ZO-1蛋白mRNA表达显著增加(P < 0.05,表 5)。
表 5.
大鼠CB2及紧密连接蛋白的mRNA表达情况
mRNA expression of CB2 and tight junction proteins (n=6, Mean±SD)
| Group | CB2 | occludin | ZO-1 |
| CB2: F=177.114, P < 0.001; occluding: F=46.724, P < 0.001; ZO-1: F=33.225, P=0.001; aP < 0.05 vs control group, bP < 0.05 vs model group. | |||
| Control | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 |
| Model | 0.30±0.10a | 0.21±0.10a | 0.29±0.19a |
| CB2 agonist | 0.46±0.04b | 0.61±0.16b | 0.54±0.12b |
| P38 MAPK inhibitor | 0.44±0.04 | 0.68±0.13 | 0.59±0.11 |
2.6. 肺组织CB2、紧密连接蛋白表达及P38MAPK磷酸化程度
与对照组比较,模型组的大鼠肺组织CB2、occludin和ZO-1蛋白表达降低,而P38 MAPK磷酸化程度增加(P < 0.05);与模型组比较,CB2激动剂组CB2、occludin及ZO-1蛋白表达增加,P38 MAPK磷酸化程度降低(P < 0.05);与CB2激动剂组比较,P38 MAPK抑制剂组大鼠肺组织occludin、ZO-1蛋白表达增加,P38 MAPK磷酸化程度降低(P < 0.05),CB2蛋白表达无变化(P > 0.05,图 4)。
图 4.
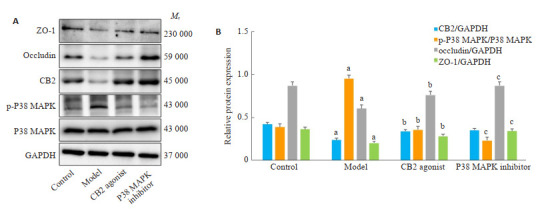
大鼠肺组织CB2、紧密连接蛋白及P38 MAPK蛋白表达情况
Expression of CB2, tight junction proteins and P38 MAPK protein in the lung tissues of the rats. A: Western blots of CB2, p-P38 MAPK, P38 MAPK, occludin, and ZO-1. B: Quantitative analysis of the protein expressions. aP < 0.05 vs control group, bP < 0.05 vs model group, cP < 0.05 vs CB2 agonist group.
3. 讨论
脓毒症以病理机制复杂、高重症率、高死亡率为特征。ALI在脓毒症并发的器官损伤中出现最早、发病率高。因而,治疗或缓解患者ALI是降低脓毒症死亡率一大关键[9]。本研究中LPS腹腔注射6 h后,大鼠的肺组织出现大量炎症细胞浸润,明显肺泡结构破坏、肺泡壁增厚等特征,同时肺水肿程度与肺通透性均增加,提示脓毒症大鼠模型建立成功。
在百草枯所致ALI[10]、Th-17介导的中性粒细胞哮喘[11]、烟草烟雾所致支气管哮喘[12]中,CB2受体的激活均被显示可抑制炎症细胞因子的表达,发挥抗炎作用。张彬等[13]发现在小鼠发生脓毒症肺损伤时, 其肺组织炎症程度均与CB2的mRNA表达水平呈高度正相关,说明CB2可能参与了脓毒症急性肺损伤的调节过程。JWH133作为一种具有高度CB2选择性的合成激动剂,它具有CB2介导的抗氧化、抗炎、抗癌、保护机体器官和免疫调节活性[14, 15]。因此,本研究选择JWH133作为CB2激动剂干预实验。本研究结果显示,JWH133作用后脓毒症大鼠的肺组织损伤减轻,炎症因子TNF-α、IL-1β表达及肺组织含水率降低,而肺组织液体清除率增加。提示激活CB2可以降低脓毒症大鼠肺组织炎症因子表达、减轻大鼠肺水肿,对大鼠脓毒症ALI起到保护作用,与先前研究结果相似[16, 17],但具体机制仍需进一步探索。
有研究发现,ALI的发生发展与肺组织的通透性密切相关[18]。TJs是肺泡通透性屏障的重要结构和功能基础,其主要成分occludin和ZO-1的表达与脓毒症的严重程度密切相关[19]。因此,调节TJs的表达可能对ALI的治疗是至关重要的。CB2已被报道可以改善机体多种屏障功能。比如,白藜芦醇可以调节大鼠结肠CB2的表达,增加肠道紧密连接蛋白(occludin、ZO-1和claudin1)的表达,进而改善肠道屏障功能[20]。CB2介导了远程缺血预处理对大鼠脊髓缺血再灌注损伤延迟相中血-脊髓屏障的保护作用[21]。Δ9-四氢大麻酚可通过激活CB2受体抑制细胞因子诱导的气道上皮通透性增加,其中TNF-α可降低occludin和ZO-1的表达[22]。因此,CB2可能是预防气道上皮功能障碍的治疗靶点[23]。因此,本实验通过激活CB2检测TJs的表达情况,验证实验假设。研究结果发现,与模型组相比,CB2激动剂可使occludin、ZO-1蛋白的mRNA及蛋白表达增加。提示,激活CB2可以促进大鼠脓毒症ALI肺组织中TJs的恢复,这可能是CB2对脓毒症大鼠ALI的保护作用的机制之一。
P38 MAPK信号通路作为MAPK家族中的重要组成部分,在炎症、细胞应激、细胞周期等多种生理病理过程中具有重要作用[8]。P38 MAPK信号通路的靶向药物可降低炎症因子的表达水平,进而减轻ALI[24, 25]。此外,P38 MAPK信号通路与内源性CB系统之间也存在密切联系[26]。李飞等[27]研究发现艾灸可通过调控大鼠脊髓CB2表达,抑制P38 MAPK通路而对佐剂性关节炎产生镇痛作用。CB2可通过P38 MAPK信号通路参与调控氧化型低密度脂蛋白诱导的RAW264.7巨噬细胞活性氧等的产生[28]。可见,激活CB2可能会影响P38 MAPK通路的活性使机体产生相应的健康效应。推测P38 MAPK信号通路可参与CB2保护脓毒症大鼠ALI过程。因此,本实验应用P38 MAPK抑制剂SB203580在JWH133之前干预实验。实验结果发现,与CB2激动剂组比较,SB203580使脓毒症大鼠肺灌洗液中TNF-α、IL-1β水平降低。提示抑制P38 MAPK信号通路可减轻脓毒症大鼠肺组织的炎症反应。
P38 MAPK的表达与TJs的表达密切相关,如藤椒甲醇提取物[29]可抑制大小鼠P38 MAPK/NF-κB信号通路活性,增加结肠组织occludin、ZO-1的表达,修复肠道黏膜屏障功能。此外,P38 MAPK抑制剂SB203580可阻断三氧化二砷诱导的人正常肺上皮细胞BEAS-2B细胞中occludin减少[30]。在人肺微血管内皮细胞(HPMECs)中抑制P38 MAPK可以进一步维持其内皮屏障的完整性[31]。本研究发现,与CB2激动剂组比较,P38 MAPK抑制剂组大鼠肺组织occludin和ZO-1蛋白表达增加,与以上研究结果一致。而CB2的mRNA及蛋白表达均无明显变化(P > 0.05)。由此可见,在实验性脓毒症大鼠ALI发生过程中,P38 MAPK可能是在CB2之后被激活,进而抑制TJs的表达。这提示在脓毒症ALI过程中,大鼠肺组织中CB2被抑制后可能激活P38 MAPK信号通路,进一步增加炎症因子表达,抑制TJs表达,增加大鼠脓毒症ALI程度。
综上所述,激活CB2可通过抑制P38 MAPK信号通路以及炎症因子表达,进而促进TJs的形成,从而减轻实验性脓毒症大鼠ALI。这一发现可能给脓毒症ALI治疗提供新的靶点和思路。
Biography
康惠文,在读硕士研究生,E-mail: kanghui_wen@163.com
Funding Statement
浙江省基础公益研究计划项目(LGD19H150001); 金华市科技计划项目(2017-3-012)
Contributor Information
康 惠文 (Huiwen KANG), Email: kanghui_wen@163.com.
章 义利 (Yili ZHANG), Email: seasune@163.com.
References
- 1.Sergio LPS, Lucinda LMF, Reboredo MM, et al. Emphysema induced by elastase alters the mRNA relative levels from DNA repair genes in acute lung injury in response to Sepsis induced by lipopolysaccharide administration in Wistar rats. Exp Lung Res. 2018;44(2):79–88. doi: 10.1080/01902148.2017.1422158. [DOI] [PubMed] [Google Scholar]
- 2.Mokra D, Kosutova P. Biomarkers in acute lung injury. Respir Physiol Neurobiol. 2015;209:52–8. doi: 10.1016/j.resp.2014.10.006. [DOI] [PubMed] [Google Scholar]
- 3.武 勰, 晏 馥霞. 紧密连接对肺通透性影响的研究进展. 基础医学与临床. 2021;41(2):272–6. doi: 10.3969/j.issn.1001-6325.2021.02.023. [DOI] [Google Scholar]
- 4.Wawrzyniak P, Wawrzyniak M, Wanke K, et al. Regulation of bronchial epithelial barrier integrity by type 2 cytokines and histone deacetylases in asthmatic patients. J Allergy Clin Immunol. 2017;139(1):93–103. doi: 10.1016/j.jaci.2016.03.050. [DOI] [PubMed] [Google Scholar]
- 5.Heinemann U, Schuetz A. Structural features of tight-junction proteins. Int J Mol Sci. 2019;20(23):6020. doi: 10.3390/ijms20236020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Soethoudt M, Stolze SC, Westphal MV, et al. Selective photoaffinity probe that enables assessment of cannabinoid CB2 receptor expression and ligand engagement in human cells. J Am Chem Soc. 2018;140(19):6067–75. doi: 10.1021/jacs.7b11281. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Tschöp J, Kasten KR, Nogueiras R, et al. The cannabinoid receptor 2 is critical for the host response to Sepsis. J Immunol. 2009;183(1):499–505. doi: 10.4049/jimmunol.0900203. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Bai J, Bai Y, Wang XP, et al. Carbon monoxide-releasing molecule-3 ameliorates acute lung injury in a model of hemorrhagic shock and resuscitation: roles of p38MAPK signaling pathway. Shock. 2020;55(6):816–26. doi: 10.1097/SHK.0000000000001684. [DOI] [PubMed] [Google Scholar]
- 9.Auriemma CL, Zhuo HJ, Delucchi K, et al. Acute respiratory distress syndrome-attributable mortality in critically ill patients with Sepsis. Intensive Care Med. 2020;46(6):1222–31. doi: 10.1007/s00134-020-06010-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.刘 振宁, 韩 军, 郑 强, et al. CB2受体激动剂JWH133对百草枯中毒致急性肺损伤大鼠的保护作用. 中国病理生理杂志. 2014;30(12):2179–84. doi: 10.3969/j.issn.1000-4718.2014.12.011. [DOI] [Google Scholar]
- 11.莫 濡冰, 黄 琳惠, 蒙 冲, et al. 基于CB2受体活化探讨CD4+T细胞分化缓解中性粒细胞大鼠哮喘模型的作用机制. 安徽医科大学学报. 2021;56(7):1057–63. [Google Scholar]
- 12.蔡 兴俊, 郑 亚妹, 黄 奕江. 烟草烟雾暴露对支气管哮喘小鼠肺组织CB2受体mRNA及其蛋白表达的影响. 国际呼吸杂志. 2018;38(2):86–90. doi: 10.3760/cma.j.issn.1673-436X.2018.02.002. [DOI] [Google Scholar]
- 13.张 彬, 杨 宗斌, 李 祯, et al. 脓毒症急性肺损伤模型中肺组织细胞焦亡与大麻素2型受体的相关性分析. 中华急诊医学杂志. 2022;31(2):185–90. doi: 10.3760/cma.j.issn.1671-0282.2022.02.009. [DOI] [Google Scholar]
- 14.Hashiesh HM, Sharma C, Goyal SN, et al. Pharmacological properties, therapeutic potential and molecular mechanisms of JWH133, a CB2 receptor-selective agonist. Front Pharmacol. 2021;12:702675. doi: 10.3389/fphar.2021.702675. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Meza A, Lehmann C. Betacaryophyllene-A phytocannabinoid as potential therapeutic modality for human sepsis? Med Hypotheses. 2018;110:68–70. doi: 10.1016/j.mehy.2017.10.025. [DOI] [PubMed] [Google Scholar]
- 16.Gui H, Sun Y, Luo ZM, et al. Cannabinoid receptor 2 protects against acute experimental Sepsis in mice. Mediat Inflamm. 2013;2013:741303. doi: 10.1155/2013/741303. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Mangiatordi GF, Intranuovo F, Delre P, et al. Cannabinoid receptor subtype 2(CB2R) in a multitarget approach: perspective of an innovative strategy in cancer and neurodegeneration. J Med Chem. 2020;63(23):14448–69. doi: 10.1021/acs.jmedchem.0c01357. [DOI] [PubMed] [Google Scholar]
- 18.Du XQ, Liu H, Yue YH, et al. Anisodamine hydrobromide protects glycocalyx and against the lipopolysaccharide-induced increases in microvascular endothelial layer permeability and nitric oxide production. Cardiovasc Eng Technol. 2021;12(1):91–100. doi: 10.1007/s13239-020-00486-8. [DOI] [PubMed] [Google Scholar]
- 19.Ni JJ, Lü L, Chen H, et al. Plasma ZO-1 proteins predict the severity and outcome of Sepsis: a prospective observational study. Clin ChimicaActa. 2020;510:691–6. doi: 10.1016/j.cca.2020.09.003. [DOI] [PubMed] [Google Scholar]
- 20.Chen MT, Hou PF, Zhou M, et al. Resveratrol attenuates high-fat diet-induced non-alcoholic steatohepatitis by maintaining gut barrier integrity and inhibiting gut inflammation through regulation of the endocannabinoid system. Clin Nutr. 2020;39(4):1264–75. doi: 10.1016/j.clnu.2019.05.020. [DOI] [PubMed] [Google Scholar]
- 21.Jing N, Fang B, Wang ZL, et al. Remote ischemia preconditioning attenuates blood-spinal cord barrier breakdown in rats undergoing spinal cord ischemia reperfusion injury: associated with activation and upregulation of CB1 and CB2 receptors. Cell Physiol Biochem. 2017;43(6):2516–24. doi: 10.1159/000484460. [DOI] [PubMed] [Google Scholar]
- 22.Shang VCM, Kendall DA, Roberts RE. Δ9-Tetrahydrocannabinol reverses TNFα-induced increase in airway epithelial cell permeability through CB2 receptors. Biochem Pharmacol. 2016;120:63–71. doi: 10.1016/j.bcp.2016.09.008. [DOI] [PubMed] [Google Scholar]
- 23.Chen M, Yan XT, Ye L, et al. Dexmedetomidine ameliorates lung injury induced by intestinal ischemia/reperfusion by upregulating cannabinoid receptor 2, followed by the activation of the phosphatidylinositol 3-kinase/Akt pathway. Oxidative Med Cell Longev. 2020;2020:6120194. doi: 10.1155/2020/6120194. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Feng Y, Fang ZC, Liu BY, et al. p38MAPK plays a pivotal role in the development of acute respiratory distress syndrome. Clinics. 2019;74:e509. doi: 10.6061/clinics/2019/e509. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Chen XF, Hu JT, Pan YP, et al. Novel noncoding RNAs biomarkers in acute respiratory distress syndrome. Expert Rev Respir Med. 2020;14(3):299–306. doi: 10.1080/17476348.2020.1711736. [DOI] [PubMed] [Google Scholar]
- 26.Feng YJ, Li YY, Lin XH, et al. Anti-inflammatory effect of cannabinoid agonist WIN55, 212 on mouse experimental colitis is related to inhibition of p38MAPK. World J Gastroenterol. 2016;22(43):9515. doi: 10.3748/wjg.v22.i43.9515. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.李 飞, 王 艳, 吴 生兵, et al. 隔三七饼灸对佐剂诱导型RA大鼠脊髓AST大麻素受体及P38MAPK表达的影响及机制探讨. 中医药临床杂志. 2020;32(4):681–4. [Google Scholar]
- 28.郝 明秀, 焦 昆立. CB2通过p38MAPK通路调控RAW264.7细胞ROS和NO的产生. 中国热带医学. 2016;16(8):758-61, 765. [Google Scholar]
- 29.林 梦娴, 王 文林, 蒋 佳洛, et al. 藤椒对小鼠肠粘膜屏障的影响及其抗化疗性腹泻作用机制研究. 中药药理与临床. 2021;37(5):68–74. [Google Scholar]
- 30.Liu YQ, Tang J, Yuan JM, et al. Arsenite-induced downregulation of occludin in mouse lungs and BEAS-2B cells via the ROS/ERK/ELK1/MLCK and ROS/p38 MAPK signaling pathways. Toxicol Lett. 2020;332:146–54. doi: 10.1016/j.toxlet.2020.07.010. [DOI] [PubMed] [Google Scholar]
- 31.Luan ZG, Hu B, Wu L, et al. Unfractionated heparin alleviates human lung endothelial barrier dysfunction induced by high mobility group box 1 through regulation of P38-GSK3β-snail signaling pathway. Cell Physiol Biochem. 2018;46(5):1907–18. doi: 10.1159/000489375. [DOI] [PubMed] [Google Scholar]


