Abstract
目的
探讨降糖三黄片对db/db小鼠血糖调节和胰岛细胞损伤的影响以及糖脂毒性诱导的胰岛细胞内质网应激和自噬初期的保护机制。
方法
40只db/db小鼠随机分为db/db、db/db+JT(L)(1.32 g/kg)、db/db+JT(H)(2.64 g/kg)、db/db+Met(0.225 g/kg),以C57BL/6J小鼠为正常组(n=10)。干预8周,检测血糖血脂等代谢指标,观察胰岛细胞形态变化。体外培养小鼠胰岛细胞(MIN6),将其分为4组:Control组(5 mmol/L葡萄糖),HH组(22 mmol/L葡萄糖+0.1 mmol/L棕榈酸),HH+JT组(高脂高糖组条件基础上+5%降糖三黄片含药血清)和HH+JT+SP600125组(降糖三黄片组条件基础上+20 μmol/lSP600125)。流式术检测MIN6凋亡,RT-qPCR和Western blot检测内质网应激与自噬初期水平。
结果
与对照组相比,中药有效改善糖脂代谢水平(P<0.05),延缓体质量持续增长(P<0.05),但对饮水量改善效果不明显(P>0.05)。HE染色发现降糖三黄片可修复胰岛细胞损伤。体外实验中,流式检验发现HH组胰岛细胞凋亡率显著升高(P<0.05),HH+JT组可以减缓其凋亡(P<0.05)。Western blot结果显示降糖三黄片含药血清会显著减低由高脂高糖引起的内质网应激相关蛋白以及自噬初期相关蛋白的高表达(P<0.05)。干扰内质网应激可显著降低降糖三黄片含药血清对高脂高糖诱导的MIN6损伤的保护作用以及对胰岛细胞凋亡和自噬的抑制作用(P<0.05)。
结论
降糖三黄片对MIN6有保护作用,其机制可能通过抑制内质网应激和自噬实现。
Keywords: 降糖三黄片, 糖尿病, 胰岛细胞, 内质网应激, 自噬
Abstract
Objective
To investigate effects of Jiangtang Sanhuang tablet (JTSHT) for regulating blood glucose and alleviating islet cell damage in db/db mice and its protective effects against endoplasmic reticulum stress (ERS) and autophagy induced by glycolipid toxicity.
Methods
Forty db/db mice were randomized into 4 groups for daily intragastric administration of saline, JTSHT of 2.64 and 1.32 g/kg, and metformin at 0.225g/kg for 8 weeks, using 10 C57BL/6J mice as the normal control. After the treatments, the metabolic indexes of the mice were measured, and morphological changes of the islet cells were observed. A mouse islet cell line (MIN6) was exposed to high glucose (22 mmol/L glucose) and 0.1 mmol/L palmitic acid, followed by treatment with the sera from JTSHT- or saline- treated SD rats, alone or in combination with SP600125, and the changes in cell apoptosis, ERS and autophagy were evaluated using flow cytometry, RT-qPCR and Western blotting.
Results
In db/db mice, treatment with JTSHT significantly improved glucose and lipid metabolism (P < 0.05) and suppressed progressive weight gain (P < 0.05) without significant effect on drinking water volume (P > 0.05). JTSHT was also found to promote repair of islet cell injuries. In the cell experiments, high glucose exposure significantly increased apoptosis rate of MIN6 cells (P < 0.05), which was obviously lowered by treatment with JTSHT-treated rat serum (P < 0.05). Western blotting showed that JTSHT significantly reduced the level of ERS and autophagy caused by glycolipid toxicity in MIN6 cells (P < 0.05). Interference with ERS using SP600125 significantly attenuated the protective effect of JTSHT against MIN6 cell injury, apoptosis and autophagy induced by glycolipid toxicity (P < 0.05).
Conclusion
JTSHT has protective effects against glycolipid toxicity in MIN6 cells possibly by inhibiting ERS and autophagy.
Keywords: Jiangtang Sanhuang tablets, diabetes, islet cells, endoplasmic reticulum stress, autophagy
2型糖尿病病理机制是胰岛素抵抗和胰岛细胞的损伤。正常情况下,胰岛细胞数量维持在相对稳定的状态,每天约有0.5%的胰岛细胞凋亡,同时有相同数量的胰岛细胞再生补充。少量或初期高营养状态对胰岛细胞有一定促进作用,胰岛细胞代偿性分泌胰岛素,或能激发胰岛细胞的代偿和修复机制。但是长期高脂高糖环境,会影响胰岛细胞结构功能并造成不可逆的损伤[1]。其损伤机制包括内质网应激[2],氧化应激[3],自噬[4-8],炎症反应[9],线粒体结构功能失调[10-12],晚期糖基化终末产物,O-GlcNAc修饰[13],低氧状态[14],胰岛细胞分化表型的丧失[15]。故探讨高脂高糖诱发胰岛细胞损伤的关键机制具有研究价值。
中医专家[16]在临床时发现部分糖尿病患者除多饮多食多尿,体质量减轻“,三多一少”症状外,还有便秘的情况。中医认为,阴虚阳亢蒸腾水液,大便干结,故排便困难。舌诊发现舌质暗红,发紫甚至有瘀斑。现代医学认为糖尿病日久不控制血糖,容易出现血管并发症,都可解释为患病日久,气血津亏,湿热瘀互结。治疗上用《伤寒杂病论》经典名方-桃核承气汤加味。组方在通腑泄热基础上加益气生津,活血散结之品。后面制成中成药--降糖三黄片,降糖疗效显著应用广泛。前人发现降糖三黄片抑制氧化应激和炎症反应进而缓解糖尿病肾病[17],抑制AGEs对糖尿病大血管的损伤[18]。临床研究发现,降糖三黄片具有调节餐后血糖和防止双下肢血管硬化的作用[19]。研究证明该药物可以通过调节自噬保护胰岛细胞,但是在内质网应激机制方面却鲜有涉及。故本研究一方面探索降糖三黄片对糖尿病代谢调控以及对胰岛细胞保护作用;另一方面探索降糖三黄片含药血清对糖脂毒性诱导的胰岛细胞内质网应激和自噬的影响,为糖尿病胰岛细胞损伤的治疗提供理论基础。
1. 材料和方法
1.1. 动物模型分组与干预
SPF级8周龄雄性正常小鼠C5BL小鼠10只,体质量20~25 g,购买于广州中医药大学实验动物中心。SPF级8周龄雄性自发2型糖尿病db/db小鼠40只,体质量40~60 g,购买于南京大学南京生物医药研究院。盐酸二甲双胍片(格华止)由中美上海施贵宝制药有限公司生产。规格:0.5 g/片,20片/盒。使用方法:0.5 g/次,3次/d,口服。降糖三黄片由广州中医药大学第一附属医院生产。组成:大黄、芒硝、桃仁、桂枝、生地、麦冬、玄参、黄芪、甘草。规格:0.25g/片,100片/瓶。使用方法:6~8片/次,3次/d,口服。
适应性喂养1周后,db/db小鼠空腹8h尾静脉血糖大于16.7 mmol/L,糖尿病模型成功。随机分为4组(n=10):db/db,db/db+JTH(2.64 g/kg灌胃qd),db/db+JTL(1.32 g/kg灌胃qd),db/db+Me(t 0.225 g/kg灌胃qd)。C57BL/6J小鼠为正常组(n=10),将药片碾碎溶于生理盐水,混匀配置成浑浊液备用。干预1次/d,干预8周。每只动物灌胃前都会重新抽取药物;在灌胃器抽取“药物浑浊液”之前,会上下摇动容器,尽量使药物分布均匀。每日灌胃量是依据《药理实验方法学》人与小鼠体表面积等效剂量折算所得。灌胃方式参考《实验动物学》,1次/4周测体质量,根据体质量调整灌胃药量。
观察记录小鼠的精神状态、毛发量、毛发光泽度的变化。分别于实验开始前,干预第4周末,干预第8周末监测体质量、饮水量、进食量、空腹尾尖血糖、口服葡萄糖(2 g/kg)耐量试验。禁食不禁水12 h,测尾静脉血糖作为0 min血糖。葡萄糖(20%)灌胃,分别测30、60、90、120 min尾静脉血糖。用Graphpad prism软件绘制OGTT曲线,并计算曲线下面积AUC=1/4×(BG0)+1/2×(BG30)+3/4×(BG60)+1/2×(BG120)。异氟烷吸入麻醉,摘除眼球取血,室温静置4 h,3000 r/min离心取上清液,-80 ℃冰箱冻存;提取胰腺组织,部分浸泡于4%多聚甲醛24 h,部分保存于-80 ℃冰箱。该研究已通过广州中医药大学动物实验伦理审查(伦理审批号:20180910001)。
1.2. 生化指标检测
参照说明书,利用酶标仪测定血脂(TG,CHOL,FFA)含量。
1.3. HE染色
胰腺组织脱水,石蜡包埋,赛默飞切片机切片,使用二甲苯脱蜡,浓度梯度递减的乙醇(100、90、80、70、50%)和PBS以脱水透明,苏木精染色1~3 min,索莱宝分化液分化20 s,PBS冲洗,伊红染色1 min,二甲苯浸泡10 min烘干,封片。光镜下观察胰岛细胞形态和病理学变化。
1.4. 含药血清的制备
SPF级雄性SD大鼠30只,体质量250~300 g,购于广州中医药大学动物实验中心。适应性喂养1周后。随机分为空白组和中药组。中药组按照1 mL/100 g灌胃给药,1次/d,连续7 d。空白组给予等体积的蒸馏水。末次给药1 h后,异氟烷吸入麻醉,腹主动脉取血,37 ℃静置4 h后离心,3000 r/min,5 min;取上清,56 ℃水浴灭活20 min,以除去可能对实验产生干扰的生物活性物质,经2.22 μm微孔滤膜过滤除菌,分装密封,置于-80 ℃冰箱保存备用。该研究已通过广州中医药大学动物实验伦理审查(20180910001)。
1.5. 细胞培养建模与分组
胰岛β细胞瘤细胞系(MIN6)购自上海富衡细胞库。将其接种于完全培养液(RPMI 1640+10%热灭活胎牛血清+50 μmol/L巯基乙醇),放入于37 ℃,5% CO2恒温培养箱培,细胞贴壁后,2 d/次更换培养液,当细胞生长至培养基底面积的80%时,弃培养基,用含0.25% EDTA的胰酶,置于显微镜下观察细胞形态,待细胞收缩变圆时加入完全培养基终止消化。并吹打成单细胞悬液,按1∶10传代于底面积为25 mm2培养瓶中。复苏细胞为第1代,第5~10代的细胞应用于本次实验。
分组如下:正常组(Control):5.5 mmol/L葡萄糖;模型组(HH):22 mmol/L葡萄糖+0.1 mmol/L棕榈酸;降糖三黄片组(HH+JT):模型组基础上+5% 降糖三黄片含药血清和抑制剂组(HH+JT+SP600125):降糖三黄片组基础上+20 μmol/lSP600125。SP600125为JNK抑制剂,购买于MCE公司,是一种细胞渗透性的,可逆的,ATP竞争性的JNK抑制剂;有效抑制JNK1,JNK2和JNK3。
1.6. 细胞凋亡
流式细胞术检测细胞凋亡:各组细胞培养24 h后加入2.5%胰酶细胞消化液,PBS洗涤细胞,800 r/min离心5 min,洗涤2次后弃上清,每样本加200 μL Binding Buffer重悬细胞后加入10 μL AnnexinV-FITC,轻轻混匀,置室温避光孵育15 min,加入5 μL碘化丙啶(PI),置相同条件下孵育5 min,1 h内入流式细胞仪检测凋亡细胞和正常细胞比率。
1.7. RT-qPCR和Western blot
将细胞采用离心柱法提取RNA。检测其浓度、纯度及完整性:取1 µL RNA样品,在微量分光光度计上测定A值,A260/A280的比值在1.8~2.2时,表明纯度较高,同时测定浓度并计算后续实验中RNA的上样体积。反转录,扩增。引物序列见表 1。
表 1.
PCR引物序列信息
Primer sequences for PCR amplification of the target genes
| Target gene | Sense primer (5'-3') | Anti-sense primer (5'-3') |
| GRP78 | GCCGAGGAGGAGGACAAGAAGG | GCGGTTGCCCTGATCGTTGG |
| CHOP | GCCCAGGAGGAAGAGGAGGAAG | GCCACTTTCCGCTCGTTCTCC |
| JNK | GCAGAAGCCCCACCACCAAAG | ACGGCTGCCCTCTTATGACTCC |
| Beclin1 | AGGCCCATGTGGAGACAGAT | GGGAACCAGTCTTGCCTACC |
| β-actin | TGGAATCCTGTGGCATCCATGAAAC | TAAAACGCAGCTCAGTAACAGTCCG |
裂解液提取细胞蛋白后,BCA法测定蛋白浓度,上样蛋白于SDS聚丙烯酰胺凝胶,电泳分离,转膜至PVDF膜,5% BSA封闭,一抗4 ℃过夜,二抗30孵育1 h,化学发光显影,采用Image Lab 3.0软件对各条带进行灰度值测定。
1.8. 统计分析
采用SPSS 21.0软件进行统计,符合正态分布的计量资料,采用均数±标准差描述,多组间均数比较采用单因素方差分析,服从方差齐性时,两两均数比较采用LSD方法检验;不符合正态分布的计量资料,采用中位数±四分位数间距描述,组间中位数比较采用秩和检验,P<0.05为差异有统计学意义。
2. 结果
2.1. 一般状态及糖脂代谢状态
实验过程中,C57BL/6J小鼠与db/db小鼠相比,精神状态良好,活泼好动,动作敏捷,反应灵敏,毛色鲜亮有光泽。Db/db小鼠精神状态一般,疲懒萎顿,毛色油腻,个别甚至出现腹部皮肤溃烂,溃烂年后伤口难以愈合。均出现“三多”症状,即多饮多食多尿。干预第3周时,模型组小鼠死亡1只。干预第8周时,模型组小鼠死亡1只。降糖高剂量组死亡1只。死亡原因不明,疑似高血糖毒性引起。8周时,4组db/db小鼠间一般状态没有太大变化。精神状态一般,慵懒少动,毛色油腻,垫料潮湿,排泄物味道大。C57BL/6J小鼠精神状态可,活泼好动,毛色浅灰干净明亮。排泄物味道小。
干预4周时,后4组较正常组体质量明显升高。模型组与中药高剂量组有统计学差异(P<0.05),中药高剂量组体质量明显低于模型组(P<0.05)。干预8周时,模型组与中药高剂量组有统计学差异(P<0.05),中药高剂量组明显体质量低于模型组。预4周时,阳性对照药组FBG明显低于模型组(P<0.05),模型组与中药高低剂量组均没有统计学差异(P>0.05)。干预8周时,后4组明显FBG高于正常组(P<0.05)。中药高低剂量组以及西药组FBG明显低于模型组(P<0.05)。干预4周时,4组较正常组饮水量明显增加(P<0.05)后。干预8周时,后4组较正常组饮水量明显增加(P<0.05)。后4组AUC面积明显高于正常组(P<0.05)。中药低剂量组和阳性对照组AUC明显高于模型组(P<0.05)。中药高剂量组较模型组TG明显降低(P<0.05)。后4组较正常组CHOL明显升高(P<0.05)。后两组较正常组FFA明显升高(P<0.05,图 1)。
图 1.

降糖三黄片改善糖尿病模型小鼠一般情况和糖脂代谢
Jiangtang Sanhuang tablet improves the general condition and glucose and lipid metabolism of the diabetic mice. A: Changes of body weight. B: Changes of drinking water volume. C: Changes of fasting blood glucose. D: Results of oral glucose tolerance test. E: Levels of fasting blood lipids. *P < 0.05, **P < 0.01 vs c57; #P < 0.05, ##P < 0.01 vs db/db.
2.2. 光镜下胰岛细胞结构
光镜下,正常组小鼠胰腺组织,胰岛细胞团数量较多,形态规则,呈圆形或卵圆形。边缘清晰,排列规则,胞浆淡染呈白色或浅粉红色,胞质丰富,胞核清晰呈卵圆形、深染。腺管结构清晰。模型组小鼠,胰岛数量减少,分布稀疏且不均匀。胰岛细胞中度到重度肿胀、空泡变性,局部细胞溶解坏死,细胞排序不齐,形状不规则,胞质边界不清,核淡染。腺管结构不清晰。西药组小鼠,胰岛数量减少较轻,胰岛萎缩,边缘较清晰,排列较规则,胞浆淡染呈白色或浅粉红色,胞质较丰富,胞核较清晰呈卵圆形、较深染。腺管结构较清晰。中药两组相差不多,胰岛数量稍减少,部分胰岛细胞稍萎缩,部分细胞肿胀、空泡变性。细胞较排序不齐,形状稍不规则,胞质边界稍不清,核淡染。腺管结构稍不清晰(图 2)。
图 2.
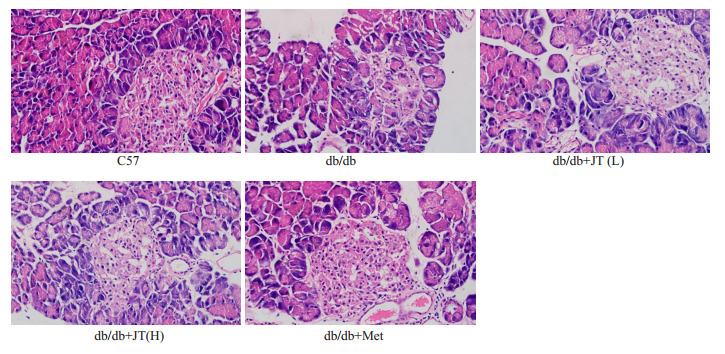
降糖三黄片改善糖尿病模型小鼠胰岛细胞结构
Jiangtang Sanhuang tablet improves the structure of islet cells in diabetic mice (HE, original magnification: ×400).
2.3. 凋亡率
与control组相比,HH组凋亡率显著升高(P<0.01);与HH组相比,HH+JT组明显降低(P<0.01);与HH + JT组相比,HH + JT + SP600125组明显降低(P<0.01,图 3)。
图 3.
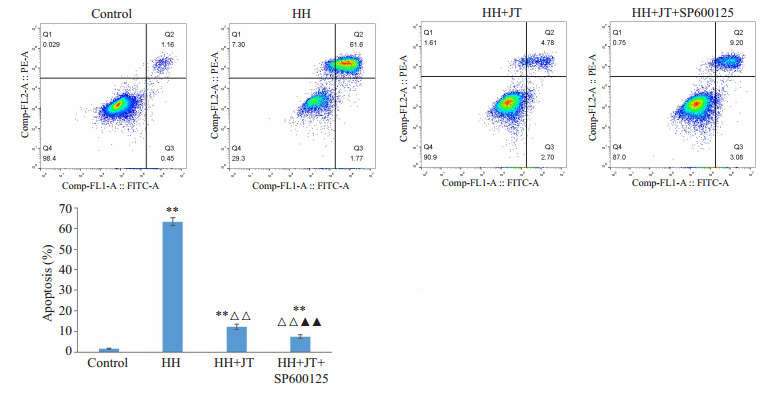
降糖三黄片改善高脂高糖诱导的细胞凋亡
Jiangtang Sanhuang tablet improves apoptosis induced by high-fat and high glucose. **P < 0.01 vs control group; △△P < 0.01 vs HH group; ▲▲P < 0.01 vs HH+ JT group.
2.4. RT-qPCR
与Control相比,HH组细胞GRP78,CHOP,Beclin1 mRNA相对表达均明显升高(P<0.01),JNK mRNA相对表达有升高趋势,但无显著性变化(P>0.05);与HH组相比,HH+JT组CHOP,Beclin1 mRNA相对表达均明显降低(P<0.05),GRP78,JNK mRNA相对表达有降低趋势,但无显著性变化(P>0.05)。与HH+ JT组相比,HH+JT+SP600125组GRP78,CHOP,JNK,Beclin1 mRNA相对表达均明显降低(P<0.05,图 4)。
图 4.

降糖三黄片含药血清对高脂高糖诱导的胰岛细胞内质网应激和自噬初期相关基因表达的影响
Effects of serum from SD rats treated with Jiangtang Sanhuang tablet on expressions of genes related with endoplasmic reticulum stress and early autophagy in islet cells induced by high fat and high glucose. *P < 0.05, **P < 0.01 vs control group; △P < 0.05, △△P < 0.01 vs HH group; ▲P < 0.05 vs HH+JT group.
2.5. Western blot
与对照组相比,模型组内质网应激相关蛋白(GRP78,CHOP,pJNK/JNK)和自噬初期相关蛋白(Beclin1)表达显著升高(P<0.05);与模型组相比,中药组内质网应激相关蛋白(GRP78,CHOP,pJNK/JNK)和自噬初期相关蛋白(Beclin1)表达显著降低(P<0.05);与中药组相比,抑制剂组内质网应激相关蛋白(GRP78,CHOP,pJNK/JNK)和自噬初期相关蛋白(Beclin1)表达显著降低(P<0.05,图 5)。
图 5.

降糖三黄片含药血清对高脂高糖诱导的胰岛细胞内质网应激和自噬初期相关蛋白表达的影响
Effects of serum from SD rats treated with Jiangtang Sanhuang tablet on expressions of ER stress- and autophagy-related proteins in islet cells induced by high fat and high glucose. *P < 0.05, **P < 0.01 vs control group; △△P < 0.01 vs HH group; ▲▲P < 0.01 vs HH+JT group.
3. 讨论
T2DM是一种代谢紊乱性疾病[20],尽管生活方式干预配合多种治法均可减缓糖尿病发生发展。但未能解决根本问题,传统中医药在临床实践中治疗糖尿病疗效显著。其作用机制的研究有利于我们正确理解和应用中药。本文动物模型采用自发糖尿病模型db/db小鼠,细胞模型采用高脂高糖模拟糖脂诱导细胞损伤,通过两种模型对糖尿病治疗机制进行研究。
降糖三黄片是由桃核承气汤加黄芪、生地、玄参、麦冬等组成,方中:桃仁、大黄、芒硝、甘草共用有活血行瘀、泻热破结之功。桂枝温经通络,宣阳行气,使血得热则行。玄参,麦冬和生地滋阴清热,增液生津,可养阴润燥,通利大便。黄芪可益气升阳。全方泄热逐瘀、益气养阴。熊曼琪教授认为通过益气养阴、活血祛瘀、润肠通下三者协同作用,改善了机体胃肠胰系统的功能,调整了内分泌失调和代谢紊乱,推陈致新,安和五脏,使机体阴阳渐趋平衡。
其降糖效果在基础研究中也得到广泛验证。该药物通过提高Cajal间质细胞数量和功能进而提高糖尿病胃轻瘫大鼠模型胃肠蠕动速度[21];改善IRS1/PI3K/Akt介导肾脏组织胰岛素信号传导障碍导致胰岛素抵抗;改善胰腺组织炎性因子TGF-β1、NF-κB,P65增多诱导的胰腺组织损伤[22],进一步调节血糖水平。但目前其在缓解胰岛细胞内质网应激的机制尚未报道。本研究通过动物实验证明了降糖三黄片对糖尿病的糖脂代谢异常具有改善作用,对胰岛细胞损伤具有修复作用;通过细胞实验证明了降糖三黄片含药血清可以促进细胞增殖,抑制其凋亡,进而达到保护胰岛细胞的作用。其次证明了抑制内质网应激可以拮抗高脂高糖对胰岛细胞产生的损伤,进一步推断出内质网应激可以促进细胞发生凋亡。
qPCR和westernblot结果显示高脂高糖诱导内质网应激相关基因(GRP78, CHOP, JNK)增加,降糖三黄片含药血清可降低其增加。说明该中药可以缓解糖脂毒性导致的胰岛细胞内质网应激,进而保护胰岛细胞。此外Beclin1 mRNA表达与蛋白表达一致,这反映了高脂高糖诱导胰岛细胞自噬启动,但是降糖三黄片含药血清减弱了该自噬启动,说明该中药可以抑制糖脂毒性诱导的细胞自噬。
ER为自噬小体的形成提供了膜来源[23, 24],并且自噬对ER的动态平衡至关重要[25, 26]。在内质网应激时,未折叠蛋白质在ER中积聚,并通过蛋白酶体参与的ER相关降解系统清除[27]。当该系统饱和时,自噬会同时去除可溶性和聚集形式的未折叠蛋白。即使面对不断积累的未折叠蛋白质,自噬也能帮助细胞保持ER丰度和细胞存活的新稳态水平[28]。未折叠蛋白质调节因子和ER伴侣GRP78是应激诱导自噬必要分子[29, 30]。在下调GRP78表达的细胞中,激活了未折叠蛋白质途径,内质网应激和营养缺乏诱导的自噬体形成均会受到抑制[31]。在GRP78敲除的细胞中,电镜观察ER数和ER内腔膨胀急剧增加。作为一种可能的自噬体双层膜的膜源,被大量扩张和破坏。所以,被内质网应激激活的自噬已经成为一种防御机制[32]。
本研究通过抑制JNK介导的内质网应激,抑制了自噬的启动。说明内质网应激是自噬的上游机制之一。创新点在于研究两种机制,即内质网应激、自噬现象及其关系。利用内质网应激抑制剂,发现细胞自噬发生也随之减少,一定程度上说明内质网应激是自噬的上游机制。降糖三黄片对糖脂毒性诱导的胰岛细胞损伤具有修复作用,其机制可能与改善内质网应激以及修复自噬有关。降糖三黄片与SP600125协同保护糖脂毒诱导的胰岛细胞损伤,这为保护胰岛细胞药物的开发带来了希望。
Biography
张文婧,博士,E-mail: 294351531@qq.com
Funding Statement
国家自然科学基金(81873190);南方医科大学第三附属医院青年启动项目(QN2020003)
Supported by National Natural Science Foundation of China (81873190)
Contributor Information
张 文婧 (Wenjing ZHANG), Email: 294351531@qq.com.
胡 兆霆 (Zhaoting HU), Email: dragonting@126.com.
References
- 1.Maedler K, Størling J, Sturis J, et al. Glucose- and interleukin-1beta-induced beta-cell apoptosis requires Ca2+ influx and extracellular signal-regulated kinase (ERK) 1/2 activation and is prevented by a sulfonylurea receptor 1/inwardly rectifying K + channel 6.2 (SUR/Kir6.2) selective potassium channel opener in human islets. Diabetes. 2004;53(7):1706–13. doi: 10.2337/diabetes.53.7.1706. [DOI] [PubMed] [Google Scholar]
- 2.Oakes SA, Papa FR. The role of endoplasmic Reticulum stress in human pathology. Annu Rev Pathol. 2015;10:173–94. doi: 10.1146/annurev-pathol-012513-104649. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.任 春久, 张 瑶, 崔 为正, et al. 氧化应激在2型糖尿病发病机制中的作用研究进展. 生理学报. 2013;65(6):664–73. doi: 10.13294/j.aps.2013.06.008. [DOI] [PubMed] [Google Scholar]
- 4.Legøy TA, Ghila L, Vethe H, et al. In vivo hyperglycaemia exposure elicits distinct period-dependent effects on human pancreatic progenitor differentiation, conveyed by oxidative stress. Acta Physiol (Oxf) 2020;228(4):e13433. doi: 10.1111/apha.13433. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Yu Q, Yang S, Li ZQ, et al. The relationship between endoplasmic Reticulum stress and autophagy in apoptosis of BEAS-2B cells induced by cigarette smoke condensate. Toxicol Res (Camb) 2021;10(1):18–28. doi: 10.1093/toxres/tfaa095. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Qi ZH, Chen LX. Endoplasmic Reticulum stress and autophagy. Adv Exp Med Biol. 2019;1206:167–77. doi: 10.1007/978-981-15-0602-4_8. [DOI] [PubMed] [Google Scholar]
- 7.Ji S, Zhu CC, Gao SK, et al. Morus alba leaves ethanol extract protects pancreatic islet cells against dysfunction and death by inducing autophagy in type 2 diabetes. Phytomedicine. 2021;83:153478. doi: 10.1016/j.phymed.2021.153478. [DOI] [PubMed] [Google Scholar]
- 8.Klionsky DJ, Cuervo AM, Seglen PO. Methods for monitoring autophagy from yeast to human. Autophagy. 2007;3(3):181–206. doi: 10.4161/auto.3678. [DOI] [PubMed] [Google Scholar]
- 9.合湫. 炎症细胞因子IL-1β、IFN-γ对小鼠胰岛葡萄糖刺激下胰岛素分泌反应的影响[D]. 昆明: 昆明医科大学, 2012.
- 10.林 帆, 张 宏利, 王 晓, et al. 检测线粒体通透性转换孔道评价胰岛β细胞线粒体功能. 福建医科大学学报. 2011;45(2):83–7. doi: 10.3969/j.issn.1672-4194.2011.02.002. [DOI] [Google Scholar]
- 11.Sarparanta J, García-Macia M, Singh R. Autophagy and mitochondria in obesity and type 2 diabetes. Curr Diabetes Rev. 2017;13(4):352–69. doi: 10.2174/1573399812666160217122530. [DOI] [PubMed] [Google Scholar]
- 12.Schultz J, Warkus J, Wolke C, et al. MiD51 is important for maintaining mitochondrial health in pancreatic islet and MIN6 cells. Front Endocrinol (Lausanne) 2020;11:232. doi: 10.3389/fendo.2020.00232. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.孙 红, 马 晓峰, 任 飞飞, et al. N-乙酰氨基葡萄糖转移酶(OGT)研究进展. 生命科学. 2011;23(7):643–7. doi: 10.13376/j.cbls/2011.07.009. [DOI] [Google Scholar]
- 14.周锋. 维生素D对Ⅱ型糖尿病胰岛铁过载和β细胞凋亡的影响[D]. 武汉: 华中科技大学, 2019.
- 15.刘雅娟. 骨髓间充质干细胞体外定向诱导成胰岛样细胞及其对大鼠胰腺损伤的修复作用[D]. 长春: 吉林大学, 2006.
- 16.张 国梁, 熊 曼琪. 加味桃核承气汤降糖作用机制的初步探讨. 中国医药学报. 1991;6(2):28-31, 64. doi: 10.3321/j.issn:1673-1727.1991.02.019. [DOI] [Google Scholar]
- 17.曾绘域. 降糖三黄片对糖尿病肾病大鼠TLR4/NF-κB信号通路的研究[D]. 广州: 广州中医药大学, 2017.
- 18.许帅. 基于AGEs-RAGE加味桃核承气汤防治T2DM大血管病变大鼠的实验研究[D]. 广州: 广州中医药大学, 2017.
- 19.潘 莹莹, 赵 萍, 梁 诗莹. 超声评价降糖三黄片对糖尿病患者足背动脉血管的影响. 新中医. 2016;48(8):102–4. [Google Scholar]
- 20.Huang FY, Deng T, Meng LX, et al. Dietary ginger as a traditional therapy for blood sugar control in patients with type 2 diabetes mellitus: a systematic review and meta-analysis. Medicine. 2019;98(13):e15054. doi: 10.1097/MD.0000000000015054. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.谢欣颖. 基于ICC降糖三黄片防治DGP的机制探讨及中药干预的循证研究[D]. 广州: 广州中医药大学, 2015.
- 22.Pyrko P, Kardosh A, Liu YT, et al. Calcium-activated endoplasmic Reticulum stress as a major component of tumor cell death induced by 2, 5-dimethyl-celecoxib, a non-coxib analogue of celecoxib. Mol Cancer Ther. 2007;6(4):1262–75. doi: 10.1158/1535-7163.MCT-06-0629. [DOI] [PubMed] [Google Scholar]
- 23.Galluzzi L, Green DR. Autophagy-independent functions of the autophagy machinery. Cell. 2019;177(7):1682–99. doi: 10.1016/j.cell.2019.05.026. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Liu YN, Mu YD, Wang H, et al. Endoplasmic Reticulum stress pathway mediates T-2 toxin-induced chondrocyte apoptosis. Toxicology. 2021;464:152989. doi: 10.1016/j.tox.2021.152989. [DOI] [PubMed] [Google Scholar]
- 25.Zhao TJ, Ma J, Li LL, et al. MKP-5 relieves lipotoxicity-induced islet β-cell dysfunction and apoptosis via regulation of autophagy. Int J Mol Sci. 2020;21(19):7161. doi: 10.3390/ijms21197161. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Li ZC, Zhang LY, Gao MQ, et al. Endoplasmic Reticulum stress triggers Xanthoangelol-induced protective autophagy via activation of JNK/c-Jun Axis in hepatocellular carcinoma. J Exp Clin Cancer Res. 2019;38(1):8. doi: 10.1186/s13046-018-1012-z. [DOI] [PMC free article] [PubMed] [Google Scholar] [Retracted]
- 27.Snyder JT, Darko C, Sharma RB, et al. Endoplasmic Reticulum stress induced proliferation remains intact in aging mouse β-cells. Front Endocrinol (Lausanne) 2021;12:734079. doi: 10.3389/fendo.2021.734079. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Wernersson A, Sarmiento L, Cowan E, et al. Human enteroviral infection impairs autophagy in clonal INS(832/13) cells and human pancreatic islet cells. Diabetologia. 2020;63(11):2372–84. doi: 10.1007/s00125-020-05219-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Li J, Ni M, Lee B, et al. The unfolded protein response regulator GRP78/BiP is required for endoplasmic Reticulum integrity and stress-induced autophagy in mammalian cells. Cell Death Differ. 2008;15(9):1460–71. doi: 10.1038/cdd.2008.81. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Zhang C. Roles of Grp78 in female mammalian reproduction. Adv Anat Embryol Cell Biol. 2017;222:129–55. doi: 10.1007/978-3-319-51409-3_7. [DOI] [PubMed] [Google Scholar]
- 31.Pan YX, Ren AJ, Zheng J, et al. Delayed cytoprotection induced by hypoxic preconditioning in cultured neonatal rat cardiomyocytes: role of GRP78. Life Sci. 2007;81(13):1042–9. doi: 10.1016/j.lfs.2007.08.015. [DOI] [PubMed] [Google Scholar]
- 32.Ren ZK, Hu YM, Guo DF, et al. Increased miR-187-3p expression after cerebral ischemia/reperfusion induces apoptosis via initiation of endoplasmic Reticulum stress. Neurosci Lett. 2021;759:135947. doi: 10.1016/j.neulet.2021.135947. [DOI] [PubMed] [Google Scholar]


