Abstract
Die Small-Fiber-Neuropathie (SFN) ist eine Erkrankung des peripheren Nervensystems aufgrund einer isolierten oder vorwiegenden Schädigung dünn myelinisierter Aδ-Fasern und/oder unmyelinisierter C‑Fasern. Für die sichere Diagnose einer SFN ist neben der klinischen Symptomatik mit Schmerzen und Sensibilitätsstörungen, typischerweise mit distal betonter Ausbreitung, der apparative Nachweis einer Rarefizierung oder einer Funktionsstörung der dünn myelinisierten Aδ-Fasern und/oder der unmyelinisierten C‑Fasern gefordert. Im vorliegenden Beitrag wird eine Übersicht über die diagnostischen Verfahren zum Nachweis einer SFN sowie über mögliche Ursachen und Behandlungsoptionen gegeben.
Schlüsselwörter: Hautbiopsie, Intraepidermale Nervenfaserdichte, Quantitativ Sensorische Testung, Nozizeptiv evozierte Potentiale, Korneale konfokale Mikroskopie
Abstract
Small fiber neuropathy (SFN) is a disease of the peripheral nervous system characterized by isolated or predominant damage to the thinly myelinated Aδ-fibers and/or the unmyelinated C‑fibers. In addition to the clinical symptoms of pain and sensory disturbances that are typically more pronounced distally, the reliable diagnosis of SFN requires evidence of rarefication or dysfunction of the thinly myelinated Aδ-fibers and/or unmyelinated C‑fibers. The present article provides an overview of the diagnostic procedures for detecting SFN, its possible underlying causes, as well as the available treatment options.
Keywords: Skin biopsy, Intraepidermal nerve fiber density, Quantitative sensory testing, Nociceptive evoked potentials, Corneal confocal microscopy
Lernziele
Nach der Lektüre dieses Beitrags …
sind Ihnen die diagnostischen Kriterien der Small-Fiber-Neuropathie (SFN) bekannt,
können Sie die Wertigkeit der Methoden zur Diagnostik einer SFN einordnen,
sind Ihnen mögliche Ursachen einer SFN geläufig,
kennen Sie die kausalen und symptomatischen Therapiemöglichkeiten einer SFN.
Epidemiologie und klinische Symptomatik
Fallbeispiel
Der 60-jährige Patient berichtet über seit 3 Jahren bestehende Beschwerden beider Füße. Erstsymptom sei ein intermittierendes, unangenehmes Kribbeln, „wie Ameisenlaufen“, in den Fußballen gewesen. Dies habe sich im Verlauf auf den gesamten Fuß ausgebreitet, sei nun permanent vorhanden und von einem brennenden Gefühl sowie wenige Sekunden anhaltenden Schmerzen in den Füßen „wie Nadelstiche“ begleitet. Seit ca. 1 Jahr nehme er zudem beim Duschen die Wassertemperatur an den Füßen nicht mehr so gut wahr. Unabhängig hiervon bemerke er in letzter Zeit bei raschem Aufrichten aus dem Liegen gehäuft einen Schwindel. An Vorerkrankungen berichtet der Patient über einen Diabetes mellitus Typ 2, der diätetisch eingestellt worden sei. Die Familienanamnese sei leer. Die klinisch-neurologische Untersuchung ergibt außer der Angabe sockenförmiger Dysästhesien und einem herabgesetzten Temperaturempfinden an den Füßen keine Auffälligkeiten.
Die Small-Fiber-Neuropathie ist eine Erkrankung des peripheren Nervensystems
Peripheres Nervensystem
, verursacht durch eine isolierte oder vorwiegende Schädigung dünn myelinisierter Aδ-Fasern
Aδ-Faser
und/oder unmyelinisierter C‑Fasern
C‑Faser
. Diese Nervenfaserklassen sind sowohl für die Weiterleitung von Schmerz- und Temperaturempfinden als auch für autonome Funktionen zuständig. Epidemiologische Studien zur Häufigkeit der SFN sind selten und die Ergebnisse z. T. inkongruent, mit Prävalenzen zwischen 53 und 132 Fällen pro 100.000 in 2 europäischen Studien [1, 2]. Insgesamt ist davon auszugehen, dass die Häufigkeit in den nächsten Jahren aufgrund der zunehmenden Beachtung („awareness“) ansteigen wird.
Durch Schädigung sowohl somatischer als auch vegetativer Nervenfasern ist die klinische Präsentation der SFN vielgestaltig. Ein häufiges Symptom sind neuropathische Schmerzen
Neuropathischer Schmerz
, die oftmals als brennend, einschießend oder nadelstichartig beschrieben werden, sowie unangenehme, kribbelnde Missempfindungen
Kribbelnde Missempfindung
. Daneben besteht eine Störung des Temperaturempfindens
Temperaturempfinden
, welche entweder in Kombination mit den Schmerzen oder isoliert als schmerzlose SFN auftreten kann. Typischerweise folgt die sensible Symptomatik einem socken- bzw. handschuhförmigen Verteilungsmuster mit von distal nach proximal aufsteigenden, d. h. längenabhängigen, sensiblen Defiziten. Seltener ist die nichtlängenabhängige Form mit Symptomen, die asymmetrisch und diffus auftreten und neben den proximalen Extremitäten auch den Thorax oder das Gesicht betreffen können und bei der eine Ganglionopathie als ursächlich angenommen wird [3, 4].
Neben den Schmerzen und sensiblen Defiziten können betroffene Patienten auch unter einer autonomen Dysfunktion
Autonome Dysfunktion
leiden [5]. Mögliche Symptome umfassen:
Palpitationen,
eine orthostatische Dysregulation,
vasomotorische Störungen mit Veränderungen des Hautkolorits und des Haar‑/Nagelwachstums,
eine Sicca-Symptomatik,
Obstipation/Diarrhö,
Urininkontinenz,
verändertes Schwitzen,
gestörte Sexualfunktion oder
Sehstörungen (Lichtempfindlichkeit; Verschwommensehen).
Merke
Die Small-Fiber-Neuropathie ist charakterisiert durch Symptome und klinische Zeichen einer isolierten oder vorwiegenden Schädigung der dünn myelinisierten Aδ-Fasern und/oder der unmyelinisierten C‑Fasern.
Diagnosekriterien
Die sog. Besta-Kriterien
Besta-Kriterium
basieren auf der Kombination von mindestens 2 Auffälligkeiten aus den 3 folgenden:
-
I.
klinische Zeichen einer Affektion der kleinkalibrigen Fasern (Sensibilitätsverlust und/oder Allodynie und/oder Hyperalgesie für Pin-Prick- und thermische Reize);
-
II.
auffällige Warm- und/oder Kaltwahrnehmungsschwellen in der Quantitativ Sensorischen Testung (QST) im Bereich der Füße und
-
III.
reduzierte intraepidermale Nervenfaserdichte (IENFD) am distalen Unterschenkel [6].
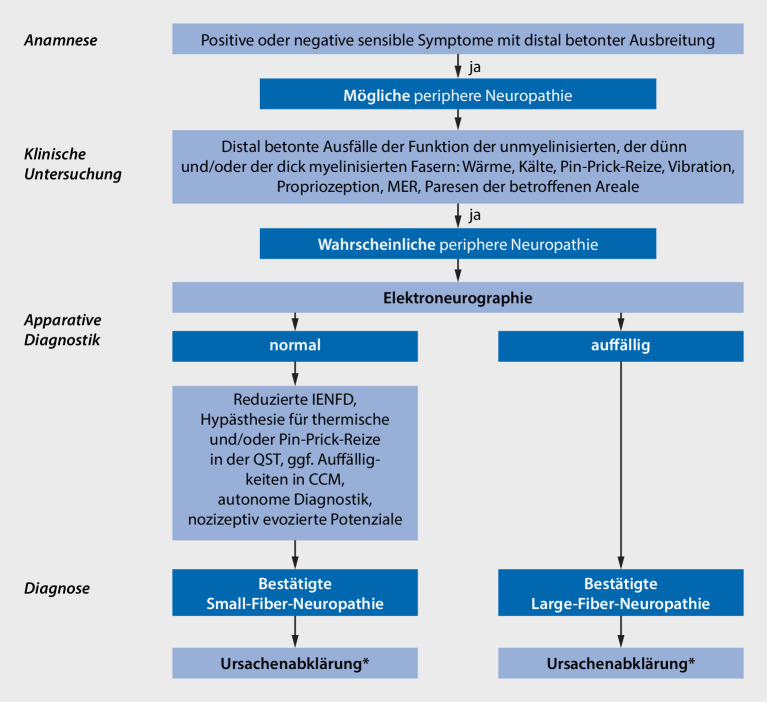
Basierend auf den im Jahr 2010 veröffentlichten NEURODIAB-Kriterien zur Klassifikation der SFN [7], die auch die Wahrscheinlichkeit einer SFN bewerten, wurde ein stufenweiser diagnostischer Algorithmus
Diagnostischer Algorithmus
vorgeschlagen, um insbesondere längenabhängige Polyneuropathien zu untersuchen und einzuteilen (Abb. 1; [8]). Anzumerken ist, dass die unterschiedlichen Diagnosekriterien für eine SFN teilweise zu unterschiedlichen Ergebnissen in bisherigen Studien führen [9, 10].
Die Diagnosestellung einer SFN basiert auf der Anamnese
Anamnese
und klinischen Untersuchung
Klinische Untersuchung
, die durch apparative Diagnostik ergänzt werden. Charakteristische Symptome aus der Anamnese wie neuropathische Schmerzen oder Missempfindungen und typische Zeichen in der klinischen Untersuchung wie trophische Störungen der Haut, Veränderungen des Hautkolorits, eine gestörte Wahrnehmung von Kälte, Wärme oder eine pathologische Spitz-stumpf-Diskrimination deuten auf das Vorliegen einer SFN hin. Klinisch-neurologisch ist die SFN durch ein Nebeneinander von Unter- (Hypalgesie, Hypästhesie) und Überempfindlichkeit (Hyperalgesie, Hyperästhesie, Allodynie) gegenüber spitzen und Temperaturreizen charakterisiert. Das Vibrationsempfinden ist hingegen, anders als bei einer (begleitenden) Schädigung der dicken Nervenfasern, bei einer isolierten SFN intakt.
Der Verdacht auf eine SFN wird im nächsten Schritt durch apparative Zusatzuntersuchungen
Apparative Zusatzuntersuchung
abgeklärt. In der konventionellen Elektroneurographie zeigt sich bei der SFN ein Normalbefund. Die Hautbiopsie
Hautbiopsie
gilt als sog. Goldstandard in der Diagnostik der Small-Fiber-Neuropathie, wenngleich mit gewissen Einschränkungen (v. a. bei hereditären paroxysmalen Schmerzsyndromen durch eine Hyperexzitabilität der Neuronen ohne Rarefizierung der intraepidermalen Nervenfasern, [12]). Die QST und die nozizeptiv evozierten Potenziale sind etablierte Verfahren zur Untersuchung der Nervenfaserfunktion, deren Einsatz allerdings auf spezialisierte Zentren beschränkt ist. Die nichtinvasive korneale konfokale Mikroskopie (CCM) kann ebenfalls Aussagen über morphologische Veränderungen der dünnen Nervenfasern liefern. Eine begleitend vorliegende autonome Dysregulation kann z. B. mithilfe der Kipptischuntersuchung, der Herzfrequenzanalyse oder dem quantitativen sudomotorischen Axonreflextest nachgewiesen werden [13].
Merke
Für die sichere Diagnose einer SFN ist neben der klinischen Symptomatik der apparative Nachweis einer Rarefizierung oder einer Funktionsstörung der dünn myelinisierten Aδ-Fasern und/oder der unmyelinisierten C‑Fasern gefordert.
Quantitativ Sensorische Testung
Bei der QST wird mittels verschiedener schmerzhafter und nichtschmerzhafter Reize die Sensibilität der Haut und tiefer liegender Strukturen semiquantitativ gemessen. Hierbei kann nicht nur die Funktion der dick myelinisierten Aβ-Fasern, sondern auch die der kleinkalibrigen Aδ- und C‑Fasern untersucht werden [14]. Das standardisierte QST-Protokoll
Standardisiertes QST-Protokoll
des Deutschen Forschungsverbunds Neuropathischer Schmerz (DFNS e. V.) prüft in 7 Tests 13 thermische und mechanische Parameter [15]. Durch den Vergleich mit alters-, geschlechts- und arealentsprechenden („matched“) Normwerten eines gesunden Kontrollkollektivs kann für jeden Patienten ein individuelles Sensibilitätsprofil
Individuelles Sensibilitätsprofil
erstellt werden, welches eine Aussage über die zugrunde liegende Nervenfaserfunktion erlaubt [16, 17]. Die Wahrnehmungs- und Schmerzschwellen für Kälte und Wärme, die mechanische Schmerzschwelle und die Schmerzintensität überschwelliger Nadelreize bilden hierbei die Funktion der kleinkalibrigen Nervenfasern ab, weswegen die QST im klinischen Alltag zum Screening und zur Verlaufskontrolle der SFN eingesetzt werden kann. Die Anwendung des DFNS-QST-Protokolls ist allerdings aufgrund der notwendigen Schulung der Untersucher, des teuren Equipments und des Zeitaufwandes auf zertifizierte Zentren beschränkt.
Um diese Limitationen zu umgehen, wurden in den letzten Jahren Bedside-Verfahren
Bedside-Verfahren
entwickelt, die standardisiert ähnliche Qualitäten wie das DFNS-QST-Protokoll abprüfen, jedoch mit wesentlich einfacheren und schneller durchzuführenden Untersuchungen [18, 19, 20, 21]. Diese Protokolle könnten zukünftig dazu beitragen, eine SFN einfacher zu detektieren und hiervon Betroffene anhand ihres Sensibilitätsprofils Subgruppen entsprechend der anzunehmenden zugrunde liegenden Pathomechanismen zuzuordnen.
Neben den oben genannten Vorteilen hat die sensorische Testung entscheidende Limitationen
Entscheidende Limitation
, die bei der Interpretation der Ergebnisse berücksichtigt werden müssen. Eine Unterscheidung zwischen peripherer und zentraler Schädigung ist nicht möglich, und das exakte räumliche Ausmaß der Funktionsstörung kann nicht bestimmt werden. Des Weiteren ist die QST von der Mitarbeit des Patienten abhängig, und die Ergebnisse sind daher bei kognitiven oder Aufmerksamkeitsdefiziten nur eingeschränkt auswertbar.
Merke
Insbesondere eine Hypästhesie und/oder verändertes Schmerzempfinden für thermische Reize und Hypalgesie/Hyperalgesie für spitze mechanische Reize in der QST weisen auf eine SFN hin.
Hautstanzbiopsie
Mittels einer minimal-invasiven ca. 3–5 mm großen Hautstanzbiopsie kann immunhistochemisch die Anzahl der intraepidermalen, unmyelinisierten C‑Nervenfasern bestimmt werden, zu denen die nozizeptiven Afferenzen gehören. Dies erlaubt die Bestimmung der intraepidermalen Nervenfaserdichte
Intraepidermale Nervenfaserdichte
(IENFD, [22]), für welche verschiedene Normwerte publiziert wurden [23, 24, 25]. Der standardisierte Einsatz der Hautbiopsie (Standardisierung u. a. bezüglich Entnahmeort und -art, Färbetechnik, Technik der IENFD-Quantifizierung) mit Nachweis einer erniedrigten IENFD wird als sog. Goldstandard
Goldstandard
in der Diagnostik bei vermuteter SFN empfohlen [26]. Andere Parameter wie die axonale Schwellung und die Größe und Innervation der Schweißdrüsen sind für die klinische Routine noch nicht etabliert [27, 28]. Auch bei einem Normalbefund kann eine SFN nicht sicher ausgeschlossen werden, da z. B. bei hereditären SFN mit einer „gain-of-function mutation“ die IENFD nicht zwingend reduziert ist. Interessanterweise kann sich eine verminderte IENFD nach kausaler Therapie einer Neuropathie (z. B. Hormonsubstitution bei Hypothyreoidismus [29] oder steroidsensitiver Neuropathie [30] und nach Verbesserung des metabolischen Zustands bei der prä- oder diabetischen Neuropathie [31]) über Monate wieder regenerieren. Als invasive Methode
Invasive Methode
sind wiederholte Hautbiopsien im Verlauf jedoch für die klinische Routine weniger gut geeignet.
Eine reduzierte IENFD wurde auch in einer Subgruppe von Patienten mit einem Fibromyalgiesyndrom
Fibromyalgiesyndrom
festgestellt, aber auch bei Menschen mit anderen Krankheitsentitäten, wie der amyotrophen Lateralsklerose, der Friedreich-Ataxie oder dem Parkinsonsyndrom (Übersicht in [32]).
Merke
Der Nachweis einer reduzierten IENFD gilt aktuell als Goldstandard in der Diagnostik einer SFN bei entsprechender klinischer Symptomatik.
Nozizeptiv evozierte Potenziale
Die nozizeptiv evozierten Potenziale ermöglichen aufgrund der besonderen Stimulationsart mit einer selektiven bzw. nichtselektiven Aktivierung der C‑ und Aδ-Fasern deren objektive Beurteilung, im Gegensatz zu den somatosensibel evozierten Potenzialen, die nur die Funktion der myelinisierten Nervenfasern abbilden [33]. Sowohl die laserevozierten (LEP, [34]) als auch die schmerzassoziierten elektrisch evozierten (PREP, [35]), die kontakthitze- oder -kälteevozierten Potenziale [36] werden nach Reizung eines peripheren sensiblen Nervs kortikal abgeleitet. Diese Verfahren werden derzeit jedoch nur in spezialisierten Zentren
Spezialisiertes Zentrum
angewandt.
Korneale konfokale Mikroskopie
Die in vivo durchgeführte korneale konfokale Mikroskopie (CCM) ist ein nichtinvasives Verfahren
Nichtinvasives Verfahren
zur quantitativen Untersuchung der Fasern des kornealen subbasalen Plexus, der Aδ- und C‑Fasern mit niederschwelligen polymodalen Rezeptoren für nozizeptive, mechanische und Kältereize aus dem N. ophthalmicus
N. ophthalmicus
enthält [37]. Die CCM-Parameter, die in der Diagnostik einer Affektion der kleinkalibrigen Nervenfasern üblicherweise herangezogen werden, sind
die korneale Nervenfaserlänge (CNFL),
die Nervenfaserdichte (CNFD) und
die Anzahl der Verästelungspunkte der Nerven (CNBD, [8, 38]).
Die meisten Studien wurden bei Patienten in verschiedenen Stadien des Diabetes mellitus
Diabetes mellitus
durchgeführt [39, 40]. Jedoch wurde mittels CCM eine Affektion der kleinkalibrigen Nervenfasern mittlerweile auch bei anderen SFN-Entitäten nachgewiesen [41], sodass die CCM als diagnostische Methode trotz einiger Einschränkungen empfohlen werden kann [13]. Dabei sind geschulte Untersucher
Geschulter Untersucher
und ggf. die Abklärung ophthalmologischer Auffälligkeiten, die zu Veränderungen des kornealen subbasalen Plexus führen, essenziell (z. B. Syndrom des trockenen Auges, Kontaktlinsenträger, Keratokonus, Keratopathie, Keratitis, ophthalmologische operative Eingriffe, [38]). Aktuell steht eine CCM-Diagnostik nur in wenigen spezialisierten Zentren zur Verfügung.
Untersuchungen autonomer Nervenfasern
Der Axonreflex
Axonreflex
beruht auf einer C‑Faser-Reizung, chemisch, beispielsweise mit Histamin oder Acetylcholin, mechanisch, durch Hitze oder elektrisch, und kann in cholinergen vasomotorischen Fasern eine Vasodilatation
Vasodilatation
induzieren. Durch die Ausbreitung der Aktionspotenziale in der Haut und Ausschüttung des Neuropeptids „calcitonin gene-related peptide“ (CGRP) mit der Folge einer Vasodilatation und sichtbaren Rötung (neurogener Flare) kann diese apparativ quantifiziert werden [42]. Das Flare-Areal ist ein definierter Bereich erhöhter Durchblutung in der indirekten Region einer axonreflexvermittelten erhöhten Durchblutung. Das Axonreflexerythem
Axonreflexerythem
wird bei C‑Faser-Degeneration oder schlechter Weiterleitung der Aktionspotenziale im Rahmen einer SFN kleiner. Die Untersuchung wird aktuell jedoch nur in speziellen Zentren im Rahmen wissenschaftlicher Studien durchgeführt [43].
Zudem kann der sudomotorische Axonreflex
Sudomotorischer Axonreflex
in cholinergen sudomotorischen Fasern ausgelöst werden, um Schwitzen
Schwitzen
zu induzieren (QSART [„quantitative sudomotor axon reflex sweat test“]). Weitere Methoden zur Erfassung der sudomotorischen Dysfunktion im Rahmen einer SFN umfassen u. a. die Messung der elektrischen Hautleitfähigkeit
Elektrische Hautleitfähigkeit
mittels Sudoscan oder die sympathische Hautantwort
Sympathische Hautantwort
(SSR [„sympathetic skin response“], [44]).
Daneben können Hinweise auf eine autonome Dysregulation mittels weiterer Verfahren wie Orthostase-Blutdruck-Test oder Herzfrequenzanalyse detektiert werden.
Ursachen
Erworbene Ursachen
Die Ursachen einer SFN sind ebenso wie das klinische Erscheinungsbild vielfältig. Man unterscheidet die primäre (genetisch-bedingte) und sekundäre (erworbene) SFN [8, 45]. Letztere umfasst metabolische, infektiöse, autoimmunvermittelte, toxische sowie (para-)neoplastische Ursachen (Tab. 1). Die häufigste sekundäre Ursache der SFN sind der Diabetes mellitus bzw. eine gestörte Glukosetoleranz
Gestörte Glukosetoleranz
, oft tritt sie auch als Frühsymptom einer solchen auf. Auch eine zu rasche Senkung des HbA1c-Wertes (HbA1c: Glykohämoglobin) um mindestens 2 Prozentpunkte über 3 Monate kann zum Auftreten einer SFN führen. Diese therapieinduzierte Neuropathie
Therapieinduzierte Neuropathie
bei Diabetes (TIND) geht mit stärksten, therapierefraktären Schmerzen einher [46]. Immunvermittelte Ursachen
Immunvermittelte Ursache
wurden insgesamt häufiger bei der nichtlängenabhängigen Verlaufsform nachgewiesen [47]. Auch eine multifaktorielle Genese
Multifaktorielle Genese
ist möglich, so konnte bei 27 % der Betroffenen mit bekannter Ätiologie eine weitere mögliche Ursache identifiziert werden [48]. Demzufolge sollten auch Patienten mit einer bekannten Ursache auf das Vorhandensein zumindest der häufigsten SFN-assoziierten Erkrankungen untersucht werden (autoimmunvermittelt, [Prä-]Diabetes, Vitamin‑B12-Mangel, Natriumkanalerkrankungen).
| Durchzuführende Untersuchungen | Kausale Therapie | |
|---|---|---|
| Primäre (hereditäre) SFN | ||
| Erythromelalgie, Natriumkanalerkrankungen | Anamnese, Gentest | – |
| ATTRv-Amyloidose | Nachweis von Amyloid in der Biopsiec, Gentest | TTR-Stabilisator, Medikamente zum „gene-silencing“ |
| M. Fabry | Alpha-Galaktosidase-Aktivität aus Blut, Gentest | Enzymersatztherapie, Chaperontherapie |
| HSAN I | Familienanamnese, Elektroneurographie, Gentest | L‑Serin |
| Sekundäre (erworbene) SFN | ||
| Metabolisch | ||
| Diabetes, pathologische Glukosetoleranz | Blutzuckertagesprofil, HbA1c, oGTT | Antidiabetika |
| Hypothyreose | TSH, fT3, fT4 | L‑Thyroxin |
| Vitamin‑B12-Mangel | Vitaminspiegel | Vitamin B12 |
| Vitamin‑B6-Überdosierung | Anamnese, Vitaminspiegel | Vitaminkarenz |
| Infektiös | ||
| Hepatitis C | Hepatitisserologie | Antivirale Medikation |
| Aids/HIV | HIV-Test | Antivirale Medikation |
| Borreliose | Borrelienserologie | Antiinfektiva |
| Toxisch | ||
| Alkohol | Anamnese, γGT, MCV, CDT, klinische Zeichen | Karenz |
| Chemotherapeutika | Anamnese | |
| Antibiotika (z. B. Nitrofurantoin) | Anamnese | |
| Autoimmunvermittelt | ||
| Sjögren-Syndrom | Spezifische Antikörper, Lippenbiopsie | Immunsuppression |
| Sarkoidose | Biopsie betroffenes Gewebe, BAL, weiterführende Diagnostik | Immunsuppression |
| Lupus erythematodes | Spezifische Antikörper, klinische Symptomatik und Labortests | Immunsuppression |
| Monoklonale Gammopathie | Immunfixationselektrophorese, Urinuntersuchung, Knochenmarkzytologie | Chemotherapie, Stammzelltransplantation |
| Zöliakie | IgA-Antikörper gegen Transglutaminase, gegen deamidiertes Gliadin, endomysiale Antikörper | Diätetisch |
| SFN-GBS | Liquoruntersuchung, Elektrophysiologie, klinische Zeichen | Steroide, IVIG, Plasmapherese |
| (Para‑)Neoplastisch | Spezifische Antikörper, Tumorsuche | Chemotherapie |
| Idiopathische SFN | Nach Ausschluss aller alternativen Differenzialdiagnosen, Verlaufskontrolle! | – |
Aids erworbenes Immundefektsyndrom („acquired immune deficiency syndrome“), ATTRv-Amyloidose hereditäre Transthyretin-Amyloidose, BAL bronchoalveoläre Lavage, CDT kohlenhydratdefizientes Transferrin („carbohydrate-deficient transferrin“), fT3 freies Trijodthyronin, fT4 freies Thyroxin, GBS Guillain-Barré-Syndrom, γGT Gamma-Glutamyltransferase, HbA1c Glykohämoglobin, HIV menschliches Immunschwächevirus („human immunodeficiency virus“), HSAN I hereditäre sensible und autonome Neuropathie Typ 1, IgA Immunglobulin A, IVIG i.v. Immunglobuline, MCV mittleres Erythrozytenvolumen („mean corpuscular volume“), oGTT oraler Glukosetoleranztest, SFN Small-Fiber-Neuropathie, TSH Thyreotropin, TTR Transthyretin
aDie Tabelle erhebt keinen Anspruch auf Vollständigkeit!
bBei allen Ätiologien sollten die Möglichkeiten der symptomatischen Therapie mit den Patienten besprochen werden
cEin unauffälliger Befund in der Biopsie schließt das Vorliegen einer Amyloidose nicht aus
In ca. 1/3 der Fälle verbleibt die Ursache der SFN jedoch unklar. Diese Gruppe der sog. idiopathischen Small-Fiber-Neuropathien
Idiopathische Small-Fiber-Neuropathie
umfasst bisher unerkannte genetische und noch nicht erkannte erworbene Formen. Hierbei wird der Ausschluss folgender Erkrankungen empfohlen: gestörter Glukosestoffwechsels, Paraproteinämie, HIV-Infektion (HIV: menschliches Immunschwächevirus [„human immunodeficiency virus“]), Vitamin‑B12-Mangel, Sjögren-Syndrom und andere Bindegewebserkrankungen, vaskulitische Neuropathie, chronische inflammatorische demyelinisierende Neuropathie (CIDP), sensible Neuropathien, Exposition zu neurotoxischen Substanzen und hereditäre Neuropathien [49]. Ergeben sich aus der Anamnese und der klinischen Symptomatik folgend weitere Hinweise, sollten zudem weitere Untersuchungen entsprechend der DGN-Leitlinie Diagnostik bei Polyneuropathien, AWMF-Registernummer: 030/067, ergänzt werden.
Die Datenlage zum Auftreten von SFN im Zusammenhang mit einer SARS-CoV-2-Infektion
SARS-CoV-2-Infektion
(SARS-CoV-2: „severe acute respiratory syndrome coronavirus 2“) ist immer noch nicht einheitlich. In der Akut- und Postakutphase konnten Funktionsstörungen peripherer Nerven wie Schmerzen und Parästhesien erfasst werden, die jedoch in den meisten Fällen innerhalb von einigen Monaten rückläufig waren [50]. Einige kleinere nicht kontrollierte Fallserien ergaben Hinweise auf eine SFN bei Patienten mit einem Post-COVID-19-Syndrom
Post-COVID-19-Syndrom
(COVID-19: „coronavirus disease 2019“), die anhand unterschiedlicher Methoden untersucht wurden [51, 52, 53]. Jedoch erlauben diese noch keine sichere ursächliche Zuordnung der SFN, und bei entsprechender Symptomatik sollten konkurrierende Ursachen zwingend abgeklärt werden.
Merke
Die häufigste sekundäre Ursache der SFN sind der Diabetes mellitus bzw. eine gestörte Glukosetoleranz, oft tritt sie auch als Frühsymptom einer solchen auf. Auch Patienten mit einer bekannten Ursache einer SFN sollten auf das Vorhandensein zumindest der häufigsten SFN-assoziierten Erkrankungen untersucht werden (autoimmunvermittelt, [Prä-]Diabetes, Vitamin‑B12-Mangel, Natriumkanalerkrankungen). In ca. 1/3 der Fälle verbleibt die Ursache der SFN unklar.
Genetische Ursachen
Genetische Ursachen der SFN umfassen u. a. Kanalopathien (z. B. Natriumkanalmutationen), die hereditäre Transthyretin-Aamyloidose (ATTRv-Amyloidose) und den M. Fabry (Tab. 1). Auch wenn diese Erkrankungen im Allgemeinen selten sind, ist ihre Kenntnis essenziell, da sie z. T. rasch progredient verlaufen können und daher eine frühzeitige Therapie
Frühzeitige Therapie
erfordern und die zugrunde liegenden Pathomechanismen genutzt werden können, um neue, spezifische Therapieansätze
Spezifischer Therapieansatz
auch für häufigere SFN zu entwickeln.
Kanalopathien
Die spannungsabhängige Natriumkanäle
Spannungsabhängiger Natriumkanal
Nav1.7, Nav1.8 und Nav1.9 befinden sich auf peripheren nozizeptiven Nervenfasern. Mutationen in den für diese Kanäle kodierenden Genen (SCN9A, SCN10A, SCN11A) können eine Vielzahl unterschiedlicher Phänotypen bedingen, darunter auch eine SFN [54]. Während „loss-of-function mutations“ in den Genen eine Schmerzunempfindlichkeit verursachen können, gehen „gain-of-function mutations“ mit einer gesteigerten Genexpression/-aktivität und Schmerzen einher [55]. Die genetisch bedingte, autosomal-dominante Erythromelalgie
Autosomal-dominante Erythromelalgie
(IEM) entsteht beispielsweise durch Mutationen im SCN9A-Gen mit konsekutiver Erniedrigung der Aktivierungsschwelle und Hyperexzitabilität des Nav1.7-Kanals [56]. Durch körperliche Belastung, Hitze oder Stress kommt es typischerweise zu einer anfallsweise auftretenden Hautrötung und brennenden Schmerzen der Hände und Füße. Kühlung
Kühlung
kann den Schmerz lindern. Auch wenn die Symptome eine Dysfunktion der dünnen Nervenfasern vermuten lassen, ist die IEM typischerweise nicht durch eine verminderte IENFD charakterisiert [57]. Mutationen in den kodierenden Genen SCN9A, SCN10A und SCN11A ließen sich in Studien in ca. 10–20 % der SFN nachweisen [48, 58]. Die klinische Symptomatik der natriumkanalassoziierten Small-Fiber-Neuropathie
Natriumkanalassoziierte Small-Fiber-Neuropathie
kann je nach zugrunde liegender Mutation stark variieren und sich in Form von neuropathischen Schmerzen, aber auch einer schweren autonomen Dysfunktion manifestieren. Insgesamt sollten insbesondere neu beschriebene Mutationen aber immer im Kontext mit der klinischen Symptomatik bewertet werden [59].
Weitere Kanalopathien sind durch autosomal-dominant vererbte Mutationen der Kanäle TRPA1 („transient receptor potential ankyrin“) und TRPV („transient receptor potential vanillin“) bedingt und manifestieren sich ebenfalls durch eine Hyperexzitabilität
Hyperexzitabilität
nozizeptiver Neuronen. Das auf einer TRPA1-Mutation beruhende familiäre episodische Schmerzsyndrom 1 (FEPS1) präsentiert sich klinisch typischerweise durch episodische intensive Schmerzen der oberen Körperregion [11].
Hereditäre sensible und autonome Neuropathie Typ 1
Sie ist durch Mutationen der Gene SPTLC1 und SPTLC2 („serin palmitoyltransferase, long-chain subunit“ 1 und 2) bedingt. Neben den dominierenden autonomen Störungen
Autonome Störung
überwiegen, zumindest zu Beginn der Erkrankung, Parästhesien, Schmerzen sowie eine gestörte Schmerz- und Temperaturwahrnehmung, während Störungen der Large-Fiber-Funktionen (Berührungsempfindung, Tiefenwahrnehmung) auch im weiteren Verlauf zumeist milde bleiben [11].
Transthyretin-Amyloidose
Die autosomal-dominant vererbte ATTRv-Amyloidose ist eine progredient verlaufende Multisystemerkrankung
Multisystemerkrankung
, die unbehandelt rasch letal endet, daher sind eine frühzeitige Diagnose und Therapie essenziell. Mutationen im Transthyretin-Gen
Transthyretingen
(TTR-Gen) führen zu einer Destabilisierung des tetrameren TTR-Proteins in Monomere, welche sich als extrazelluläre Amyloidfibrillen ablagern und so zu einer Organschädigung führen [41]. Hauptmanifestationen sind das Herz und die peripheren Nerven mit resultierender kardialer Dysfunktion
Kardiale Dysfunktion
bzw. chronisch-progredienter sensomotorischer und autonomer Polyneuropathie, jedoch können grundsätzlich alle Organsysteme betroffen sein. Das typische Krankheitsbild der sich früh manifestierenden („early-onset“) endemischen Verlaufsform beginnt um das 30. Lebensjahr und manifestiert sich initial als reine SFN. Im Gegensatz dazu betrifft die in Deutschland vorherrschende, sich spät manifestierende („late-onset“) sporadische Verlaufsform mit Erkrankungsbeginn nach dem 50. Lebensjahr häufig bereits zu Beginn sowohl die dünnen als auch die dicken Nervenfasern. Warnhinweise („red flags“
„Red flag“
) für das Vorliegen einer ATTRv-Amyloidose sind eine rasch progrediente Neuropathie plus mindestens einer der folgenden Punkte: positive Familienanamnese, frühe autonome Funktionsstörung, gastrointestinale Beschwerden, unerklärter Gewichtsverlust, bilaterales Karpaltunnelsyndrom, kardiovaskuläre Manifestationen, Nephropathie, Glaskörpertrübungen [60].
Morbus Fabry
Der M. Fabry ist eine X‑chromosomale lysosomale Speicherkrankheit aufgrund von Mutationen im GLA-Gen, welche zu einer verminderten bis fehlenden Funktion des Enzyms α‑Galaktosidase A
α‑Galaktosidase A
führen und in einer Akkumulation von Glykosphingolipiden in verschiedenen Organen resultieren. Das klinische Bild kann variieren und reicht von leichten Verläufen bei heterozygoten weiblichen Patientinnen bis zu früher und schwerer betroffenen hemizygoten männlichen Patienten (klassischer Verlauf). Erstsymptome treten bereits im Kindesalter
Kindesalter
auf, in Form brennender, einschießender oder stechender Schmerzen sowie Missempfindungen in Händen und Füßen. Die sog. Fabry-Krisen
Fabry-Krise
sind akute Attacken generalisierter stärkster Schmerzen, welche durch einen Anstieg der Umgebungs- und Körpertemperatur im Rahmen fieberhafter Infektionen oder körperlicher Belastung ausgelöst werden [61]. Als ursächlich für die Schmerzen wird eine SFN vermutet – hierfür sprechen der Nachweis von Globotriaosylceramid
Globotriaosylceramid
(Gb3) in Spinalganglien, eine verminderte IENFD und auffällige thermische Detektionsschwellen [62]. Im Erwachsenenalter treten die Schmerzen in den Hintergrund, und andere, lebenslimitierende Organdysfunktionen (Niereninsuffizienz, Kardiomyopathie, Schlaganfälle) dominieren das Erkrankungsbild [61]. Das Auftreten einer isolierten SFN im Erwachsenenalter ohne Hinweis auf weitere Organmanifestation macht daher das Vorliegen eines M. Fabry als Ursache für die SFN unwahrscheinlich [63].
Weitere hereditäre Erkrankungen mit Veränderungen der kleinkalibrigen Nervenfasern
Auffälligkeiten in der Funktion oder Morphologie der kleinkalibrigen Nervenfasern wurden inzwischen auch bei anderen hereditären Erkrankungen beschrieben, u. a. bei Bindegewebsstörungen
Bindegewebsstörung
wie dem Ehlers-Danlos-Syndrom [64], aber auch bei anderen Stoffwechselerkrankungen
Stoffwechselerkrankung
wie dem M. Pompe [65].
Merke
Mutationen in den kodierenden Genen SCN9A, SCN10A und SCN11A sind die häufigste Ursache einer hereditären SFN. Es ist jedoch essenziell, kausal behandelbare Ursachen einer hereditären SFN wie den X‑chromosomal vererbten M. Fabry und die autosomal-dominant vererbte ATTRv-Amyloidose bei entsprechenden klinischen Hinweisen abzuklären, um die erforderliche Therapie frühzeitig einleiten zu können.
Behandlung
Kausale Therapie
Die effektivste Therapie der SFN ist die Behandlung der zugrunde liegenden Ätiologie, sofern bekannt, wie beispielsweise eine adäquate Blutzuckerspiegeleinstellung
Adäquate Blutzuckerspiegeleinstellung
bei Vorliegen eines Diabetes mellitus oder eine Vitaminsubstitution
Vitaminsubstitution
bei Hypovitaminosen.
Bei autoimmunbedingten Ursachen einer SFN wurden in Fallserien und Kohortenstudien positive Effekte der immunmodulierenden Therapie
Immunmodulierende Therapie
beobachtet, z. B. bei Anwendung von Mykophenolatmofetil oder i.v. Immunglobulinen (IVIG) bei Patienten mit SFN und Sjögren-Syndrom [66, 67] oder durch IVIG und Anti-TNF-Therapie (TNF: Tumor-Nekrose-Faktor) bei sarkoidoseassoziierter SFN [68]. In einer doppelblinden randomisierten placebokontrollierten Studie bei Patienten mit idiopathischer SFN konnten jedoch keine positiven Effekte einer IVIG-Therapie weder auf die Schmerzintensität noch auf autonome Symptome oder auf andere Outcomeparameter nachgewiesen werden [69].
Spezifischere Ansätze, die ggf. auch auf andere, häufigere Erkrankungen übertragen werden können, wurden in den letzten Jahren für verschiedene genetisch bedingte SFN entwickelt: Für die Behandlung der ATTRv-Amyloidose
ATTRv-Amyloidose
mit Polyneuropathie sind in Deutschland derzeit 3 Medikamente zugelassen, welche die Krankheitsprogression verlangsamen bzw. sogar stoppen können. Das seit 2011 zugelassene Tafamidis
Tafamidis
ist ein selektiver TTR-Stabilisator (TTR: Transthyretin), der das TTR-Tetramer stabilisiert und dessen Dissoziation in Monomere verhindert. Aus Langzeitdaten bis zu 6 Jahren geht hervor, dass die Therapie so früh wie möglich begonnen werden sollte, um die beste Wirksamkeit zu erzielen [70]. Seit 2018 sind 2 weitere, innovative Präparate zur Behandlung der ATTRv-Amyloidose mit Polyneuropathie zugelassen, die über verschiedene Mechanismen eine Stilllegung des TTR-Gens in der Leber bewirken und so zu einer dauerhaften Reduktion des Serumspiegels führen: die „small-interfering ribonucleic acid“ (siRNA) Patisiran
Patisiran
[71] und das einzelsträngige Antisenseoligonukleotid Inotersen
Inotersen
[72].
Für die Behandlung des M. Fabry steht seit 2001 eine Enzymersatztherapie zur Verfügung. Die rekombinanten Agalsidasen
Rekombinante Agalsidase
alfa und beta übernehmen die Funktion der defekten α‑Galaktosidase A, sodass anfallende Stoffwechselprodukte wieder abgebaut werden können. Unter dieser Behandlung wurden eine Linderung neuropathischer Schmerzen sowie eine Verbesserung der thermischen Detektion und der sudomotorischen Funktion nachgewiesen [73], jedoch ohne Hinweis auf eine Regeneration der Nervenfaserdichte [74]. Das seit 2016 zugelassene Migalastat
Migalastat
zielt auf einen anderen Mechanismus ab. Als erster pharmakologischer Faltungshelfer (Chaperon) bindet es selektiv an bestimmte mutierte Formen der α‑Galaktosidase und erleichtert so deren Transport zu den Lysosomen, wo die Enzymfunktion durch Dissoziation des Migalastats teilweise wiederhergestellt wird [75].
Bei Nav1.7-assoziierter SFN wurden für Lacosamid
Lacosamid
, ein Antikonvulsivum, welches selektiv an spannungsabhängige Natriumkanäle bindet, in einer doppelblinden randomisierten placebokontrollierte Studie eine signifikante Schmerzreduktion, Schlafqualitätsverbesserung sowie insgesamt eine Verbesserung des Wohlbefindens nachgewiesen [76]. Bei den auf die Therapie Ansprechenden fanden sich im Vergleich zu denjenigen, die nicht auf die Behandlung ansprachen, eine Hyperpolarisierung und somit Inaktivierung der spannungsabhängigen Natriumkanälen [77].
Symptomatische Therapie
Bezüglich der symptomatischen pharmakologischen Therapie der im Rahmen einer Small-Fiber-Neuropathie häufig auftretenden neuropathischen Schmerzen wird auf die Leitlinie der DGN Diagnose und nicht interventionelle Therapie neuropathischer Schmerzen, AWMF-Registernummer: 030/114 (AWMF: Arbeitsgemeinschaft der wissenschaftlichen Medizinischen Fachgesellschaften, DGN: Deutsche Gesellschaft für Neurologie), verwiesen [13].
Fazit für die Praxis
Die Small-Fiber-Neuropathien (SFN) betreffen die Funktion der kleinen dünn und nicht myelinisierten Nervenfasern, wie Schmerz‑, Temperaturwahrnehmung und autonome Regulation.
Die Diagnose basiert auf Anamnese, klinischer Untersuchung, unauffälliger Elektroneurographie in Kombination mit pathologischen Befunden in der Hautbiopsie und/oder funktioneller Beurteilung kleiner Fasern mit psychophysikalischen und autonomen Untersuchungen.
Erworbene Ursachen wie Stoffwechselstörungen, entzündliche und neurotoxische Ursachen sind häufig.
Hereditäre Ursachen schließen Mutationen in für Ionenkanäle, Transportproteine und Enzyme kodierenden Genen ein.
Kausal behandelbare Ursachen müssen zwingend abgeklärt werden.
Oft ist zusätzlich eine symptomatische Schmerztherapie notwendig.
Beim langfristigen Management der SFN sind regelmäßige Verlaufskontrollen erforderlich, um eine Progredienz der isolierten SFN zur gemischten Polyneuropathie und, bei einer idiopathischen SFN, mögliche sekundäre, sich erst später manifestierende Ursachen zu erfassen.
Acknowledgments
Danksagung
Elena Enax-Krumova hat eine Juniorprofessur für neuronale Regenerationsforschung (2020–2026) an der Neurologischen Klinik des Berufsgenossenschaftlichen Universitätsklinikums Bergmannsheil gGmbH Bochum inne, gefördert durch die Deutsche Gesetzliche Unfallversicherung (DGUV), und erhielt eine Forschungsförderung von der Georgius Agricola Stiftung Ruhr.
CME-Fragebogen
Welches Symptom findet sich bei einer isolierten Small-Fiber-Neuropathie nicht?
Brennende Schmerzen beider Fußsohlen und Handinnenflächen
Verminderte Temperaturwahrnehmung im Bereich der Füße
Atrophie der kleinen Fußmuskeln
Orthostatische Dysregulation
Erektile Dysfunktion
Welches apparative Verfahren ist bei einer vermuteten Small-Fiber-Neuropathie geeignet, eine Affektion der dünn und nicht myelinisierten Nervenfasern nachzuweisen?
Somatosensorisch evozierte Potenziale
Konventionelle Elektroneurographie
Hautstanzbiopsie
Elektromyographie
Magnetresonanztomographie des Myleons
Bei der Diagnostik einer Small-Fiber-Neuropathie kommt die Quantitativ Sensorische Testung (QST) zum Einsatz. Welche Aussage über die QST trifft zu?
Die QST ist eine invasive komplikationsreiche Untersuchungsmethode.
Anhand der QST lässt sich eine Aussage über die Funktion der kleinkalibrigen Nervenfaser treffen.
Mittels QST können gut zentrale und periphere Läsionsorte differenziert werden.
Für die Durchführung der QST braucht man keine besondere Vorerfahrung oder apparative Ausstattung.
Die QST ist unabhängig von der Aufmerksamkeit des zu Untersuchenden oder möglicherweise vorliegenden kognitiven Störungen.
Bei Verdacht auf eine Small-Fiber-Neuropathie veranlassen Sie eine Hautbiopsie und klären Ihren Patienten darüber auf. Welche Aussage über die Hautstanzbiopsie trifft dabei nicht zu?
Anhand der Hautbiopsie lässt sich eine Aussage über morphologische Veränderungen der kleinkalibrigen Nervenfasern ableiten.
Die Hautbiopsie ist ein minimal-invasives Untersuchungsverfahren.
Verschiedene Normwerte für die intraepidermale Nervenfaserdichte wurden publiziert.
Ein Normalbefund schließt eine hereditäre Small-Fiber-Neuropathie aufgrund einer Ionenkanalmutation sicher aus.
Eine verminderte intraepidermale Nervenfaserdichte kann sich nach kausaler Therapie der Small-Fiber-Neuropathie prinzipiell regenerieren.
Welche der folgenden Ätiologien gilt als häufigste Ursache einer Small-Fiber-Neuropathie nach heutigem Wissensstand?
Diabetogene Stoffwechsellage
Sjögren-Syndrom
Sarkoidose
Erythromelalgie
M. Fabry
Welche der folgenden Erkrankungen verursacht keine Small-Fiber-Neuropathie?
Monoklonale Gammopathie
Sarkoidose
Nichtdystrophe Myotonie
HIV (menschliches Immunschwächevirus [„human immunodeficiency virus“])
Vitaminmangelsyndrome
Bei einem 30-jährigen Mann mit einer rasch progredienten Neuropathie und unauffälligem Befund in der konventionellen Neurographie vermuten Sie eine hereditäre Small-Fiber-Neuropathie. Welche Aussage trifft diesbezüglich zu?
Männer können von hereditären Small-Fiber-Neuropathien praktisch nicht betroffen sein.
Eine Beteiligung anderer Organe (z.B. eine Niereninsuffizienz oder eine Kardiomyopathie) spricht gegen eine hereditäre Ursache
Akute Schmerzexazerbationen nach Anstieg der Umgebungs- und Körpertemperatur im Rahmen von fieberhaften Infektionen oder körperlicher Belastung weisen möglicherweise auf das Vorliegen eines M. Fabry hin.
Die Abklärung hereditärer Ursachen hat keine Auswirkung auf das therapeutische Vorgehen.
Eine isolierte Small-Fiber-Neuropathie im Erwachsenenalter ohne Hinweis auf weitere Organmanifestation spricht für einen wahrscheinlichen M. Fabry.
Sie haben bei einem 54-jährigen Mann die Diagnose einer Small-Fiber-Neuropathie gestellt. Sie veranlassen laborchemische Untersuchungen, um erworbene Ursachen abzuklären. Welcher Parameter ist am wenigsten aussagekräftig dabei?
Blutzuckertagesprofil
Kreatinkinase.
Hepatitis-Serologie.
Vitamin B12.
Antikörperdiagnostik bei Verdacht auf SarkoidoseLupus erythematodes.
Genetisch bedingte Kanal-Erkrankungen können die Ursache von Small-Fiber-Neuropathien sein. Welche Aussage bezüglich dieser Erkrankungen trifft zu?
Hereditäre Kanal-Erkrankungen präsentieren sich klinisch sehr homogen.
Mutationen in den kodierenden Genen SCN9A, SCN10A und SCN11A gehören zu den seltensten Ursache einer hereditären Small-Fiber-Neuropathie.
Kanalopathien durch Mutationen des TRPA1- und des TRPV-Kanals sind praktisch nie mit einer Small-Fiber-Neuropathie assoziiert.
Autonome Funktionsstörungen schließen eine durch Natrium-Kanal-Erkrankung verursachte Small-Fiber-Neuropathie aus.
Lacosamid kann zu einer Schmerzreduktion bei Small-Fiber-Neuropathie führen, wenn diese mit Natrium-Kanal-Mutationen assoziiert ist.
Welche Aussage zum diagnostischen Algorithmus bei Small-Fiber-Neuropathie trifft nicht zu?
Die apparative Diagnostik sollte bei entsprechenden Hinweisen in der Anamnese und in der klinischen Untersuchung eingeleitet werden.
Insbesondere eine Hypästhesie für thermische und spitze mechanische Reize in der Quantitativ Sensorischen Testung weist auf eine Small-Fiber-Neuropathie hin.
Autonome Funktionsstörungen sollten ebenfalls erfasst werden.
Bei einem Normalbefund in der konventionellen Elektroneurographie muss keine weitere Diagnostik erfolgen.
Die Hautbiopsie gilt aktuell als Goldstandard in der Diagnostik einer Small-Fiber-Neuropathie bei entsprechender klinischer Symptomatik.
Einhaltung ethischer Richtlinien
Interessenkonflikt
Gemäß den Richtlinien des Springer Medizin Verlags werden Autoren und Wissenschaftliche Leitung im Rahmen der Manuskripterstellung und Manuskriptfreigabe aufgefordert, eine vollständige Erklärung zu ihren finanziellen und nichtfinanziellen Interessen abzugeben.
Autoren
J. Sachau: A. Finanzielle Interessen: Alnylam Pharmaceuticals Inc. (Kostenerstattung für Reise- und Übernachtungskosten, bezahlte Teilnehmergebühren), Pfizer (Kostenerstattung für Reise- und Übernachtungskosten), Grünenthal GmbH (Vortragshonorar), Alnylam Germany GmbH (Vortragshonorar). – Pfizer Pharma GmbH (Beratertätigkeit). – B. Nichtfinanzielle Interessen: Angestellte Assistenzärztin für Neurologie, Klinik für Neurologie, Universitätsklinikum Schleswig-Holstein, Campus Kiel | Mitgliedschaften: IASP (International Association for the Study of Pain), DFNS (Deutscher Forschungsverbund Neuropathischer Schmerz). E. Enax-Krumova: A. Finanzielle Interessen: Forschungsförderung zur persönlichen Verfügung: Georg-Agricola-Stiftung. – DGN (Referentenhonorar), Ärztekammer Westfalen-Lippe (Referentenaufwandsentschädigung), Novartis GmbH (Referentenhonorar). – Omega Pharma GmbH (Beratung im Rahmen eines „advisory boards“). – B. Nichtfinanzielle Interessen: Juniorprofessur für neuronale Regenerationsforschung, gefördert durch die DGUV | Mitgliedschaften: Deutsche Gesellschaft für Neurologie, Deutsche Gesellschaft für Schmerztherapie, Deutsche Migräne- und Kopfschmerzgesellschaft, Deutsche Gesellschaft für klinische Neurophysiologie (DGKN), IASP, Vorstandsmitglied im DFNS.
Wissenschaftliche Leitung
Die vollständige Erklärung zum Interessenkonflikt der Wissenschaftlichen Leitung finden Sie am Kurs der zertifizierten Fortbildung auf www.springermedizin.de/cme.
Der Verlag
erklärt, dass für die Publikation dieser CME-Fortbildung keine Sponsorengelder an den Verlag fließen.
Für diesen Beitrag wurden von den Autor/-innen keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.Bitzi LM, Lehnick D, Wilder-Smith EP. Small fiber neuropathy: Swiss cohort characterization. Muscle Nerve. 2021;64:293–300. doi: 10.1002/mus.27340. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Peters MJH, Bakkers M, Merkies ISJ, et al. Incidence and prevalence of small-fiber neuropathy: a survey in the Netherlands. Neurology. 2013;81:1356–1360. doi: 10.1212/WNL.0b013e3182a8236e. [DOI] [PubMed] [Google Scholar]
- 3.Gemignani F. Epidemiology and features of non-length-dependent small fiber neuropathy. Muscle Nerve. 2022;65:E1. doi: 10.1002/mus.27433. [DOI] [PubMed] [Google Scholar]
- 4.Gemignani F, Bellanova MF, Saccani E, Pavesi G. Non-length-dependent small fiber neuropathy: not a matter of stockings and gloves. Muscle Nerve. 2022;65:10–28. doi: 10.1002/mus.27379. [DOI] [PubMed] [Google Scholar]
- 5.Levine TD. Small fiber neuropathy: disease classification beyond pain and burning. J Cent Nerv Syst Dis. 2018;10:1179573518771703. doi: 10.1177/1179573518771703. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Devigili G, Tugnoli V, Penza P, et al. The diagnostic criteria for small fibre neuropathy: from symptoms to neuropathology. Brain. 2008;131:1912–1925. doi: 10.1093/brain/awn093. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Tesfaye S, Boulton AJM, Dyck PJ, et al. Diabetic neuropathies: update on definitions, diagnostic criteria, estimation of severity, and treatments. Diabetes Care. 2010;33:2285–2293. doi: 10.2337/dc10-1303. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Terkelsen AJ, Karlsson P, Lauria G, et al. The diagnostic challenge of small fibre neuropathy: clinical presentations, evaluations, and causes. Lancet Neurol. 2017;16:934–944. doi: 10.1016/S1474-4422(17)30329-0. [DOI] [PubMed] [Google Scholar]
- 9.Haroutounian S, Todorovic MS, Leinders M, et al. Diagnostic criteria for idiopathic small fiber neuropathy: a systematic review. Muscle Nerve. 2020 doi: 10.1002/mus.27070. [DOI] [PubMed] [Google Scholar]
- 10.Itani M, Gylfadottir SS, Krøigård T, et al. Small and large fiber sensory polyneuropathy in type 2 diabetes: influence of diagnostic criteria on neuropathy subtypes. J Peripher Nerv Syst. 2020 doi: 10.1111/jns.12424. [DOI] [PubMed] [Google Scholar]
- 11.Dohrn MF, Lampert A, Üçeyler N, Kurth I. Neuropathic pain syndromes and channelopathies. Internist (Berl) 2019;60:90–97. doi: 10.1007/s00108-018-0535-x. [DOI] [PubMed] [Google Scholar]
- 12.Verdugo RJ, Matamala JM, Inui K, et al. Review of techniques useful for the assessment of sensory small fiber neuropathies: report from an IFCN expert group. Clin Neurophysiol. 2022;136:13–38. doi: 10.1016/j.clinph.2022.01.002. [DOI] [PubMed] [Google Scholar]
- 13.Schlereth T. Guideline “diagnosis and non interventional therapy of neuropathic pain” of the German society of neurology (deutsche Gesellschaft für Neurologie) Neurol Res Pract. 2020;2:16. doi: 10.1186/s42466-020-00063-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Backonja MM, Attal N, Baron R, et al. Value of quantitative sensory testing in neurological and pain disorders: NeuPSIG consensus. Pain. 2013;154:1807–1819. doi: 10.1016/j.pain.2013.05.047. [DOI] [PubMed] [Google Scholar]
- 15.Rolke R, Baron R, Maier C, et al. Quantitative sensory testing in the German research network on neuropathic pain (DFNS): standardized protocol and reference values. Pain. 2006;123:231–243. doi: 10.1016/j.pain.2006.01.041. [DOI] [PubMed] [Google Scholar]
- 16.Magerl W, Krumova EK, Baron R, et al. Reference data for quantitative sensory testing (QST): refined stratification for age and a novel method for statistical comparison of group data. Pain. 2010;151:598–605. doi: 10.1016/j.pain.2010.07.026. [DOI] [PubMed] [Google Scholar]
- 17.Pfau DB, Krumova EK, Treede R-D, et al. Quantitative sensory testing in the German research network on neuropathic pain (DFNS): reference data for the trunk and application in patients with chronic postherpetic neuralgia. Pain. 2014;155:1002–1015. doi: 10.1016/j.pain.2014.02.004. [DOI] [PubMed] [Google Scholar]
- 18.Koulouris AE, Edwards RR, Dorado K, et al. Reliability and validity of the Boston bedside quantitative sensory testing battery for neuropathic pain. Pain Med. 2020;21:2336–2347. doi: 10.1093/pm/pnaa192. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Reimer M, Forstenpointner J, Hartmann A, et al. Sensory bedside testing: a simple stratification approach for sensory phenotyping. Pain Rep. 2020;5:e820. doi: 10.1097/PR9.0000000000000820. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Wasan AD, Alter BJ, Edwards RR, et al. Test-retest and inter-examiner reliability of a novel bedside quantitative sensory testing battery in postherpetic neuralgia patients. J Pain. 2020;21:858–868. doi: 10.1016/j.jpain.2019.11.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Zhu GC, Böttger K, Slater H, et al. Concurrent validity of a low-cost and time-efficient clinical sensory test battery to evaluate somatosensory dysfunction. Eur J Pain. 2019;23:1826–1838. doi: 10.1002/ejp.1456. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Wang L, Hilliges M, Jernberg T, et al. Protein gene product 9.5-immunoreactive nerve fibres and cells in human skin. Cell Tissue Res. 1990;261:25–33. doi: 10.1007/BF00329435. [DOI] [PubMed] [Google Scholar]
- 23.Lauria G, Bakkers M, Schmitz C, et al. Intraepidermal nerve fiber density at the distal leg: a worldwide normative reference study. J Peripher Nerv Syst. 2010;15:202–207. doi: 10.1111/j.1529-8027.2010.00271.x. [DOI] [PubMed] [Google Scholar]
- 24.Provitera V, Gibbons CH, Wendelschafer-Crabb G, et al. A multi-center, multinational age- and gender-adjusted normative dataset for immunofluorescent intraepidermal nerve fiber density at the distal leg. Eur J Neurol. 2016;23:333–338. doi: 10.1111/ene.12842. [DOI] [PubMed] [Google Scholar]
- 25.Provitera V, Gibbons CH, Wendelschafer-Crabb G, et al. The role of skin biopsy in differentiating small-fiber neuropathy from ganglionopathy. Eur J Neurol. 2018;25:848–853. doi: 10.1111/ene.13608. [DOI] [PubMed] [Google Scholar]
- 26.Lauria G, Hsieh ST, Johansson O, et al. European federation of neurological societies/peripheral nerve society guideline on the use of skin biopsy in the diagnosis of small fiber neuropathy. Report of a joint task force of the European federation of neurological societies and the peripheral nerve society. Eur J Neurol. 2010;17:903–912. doi: 10.1111/j.1468-1331.2010.03023.x. [DOI] [PubMed] [Google Scholar]
- 27.Chen X, Graham J, Dabbah MA, et al. Small nerve fiber quantification in the diagnosis of diabetic sensorimotor polyneuropathy: comparing corneal confocal microscopy with intraepidermal nerve fiber density. Diabetes Care. 2015;38:1138–1144. doi: 10.2337/dc14-2422. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Loavenbruck A, Wendelschaefer-Crabbe G, Sandroni P, Kennedy WR. Quantification of sweat gland volume and innervation in neuropathy: correlation with thermoregulatory sweat testing. Muscle Nerve. 2014;50:528–534. doi: 10.1002/mus.24185. [DOI] [PubMed] [Google Scholar]
- 29.Penza P, Lombardi R, Camozzi F, et al. Painful neuropathy in subclinical hypothyroidism: clinical and neuropathological recovery after hormone replacement therapy. Neurol Sci. 2009;30:149–151. doi: 10.1007/s10072-009-0026-x. [DOI] [PubMed] [Google Scholar]
- 30.Nodera H, Barbano RL, Henderson D, Herrmann DN. Epidermal reinnervation concomitant with symptomatic improvement in a sensory neuropathy. Muscle Nerve. 2003;27:507–509. doi: 10.1002/mus.10336. [DOI] [PubMed] [Google Scholar]
- 31.Singleton JR, Marcus RL, Jackson JE, et al. Exercise increases cutaneous nerve density in diabetic patients without neuropathy. Ann Clin Transl Neurol. 2014;1:844–849. doi: 10.1002/acn3.125. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Üçeyler N. Small fiber pathology—a culprit for many painful disorders? Pain. 2016;157(1):S60–S66. doi: 10.1097/j.pain.0000000000000411. [DOI] [PubMed] [Google Scholar]
- 33.Merkies ISJ, Faber CG, Lauria G. Advances in diagnostics and outcome measures in peripheral neuropathies. Neurosci Lett. 2015;596:3–13. doi: 10.1016/j.neulet.2015.02.038. [DOI] [PubMed] [Google Scholar]
- 34.Valeriani M, Pazzaglia C, Cruccu G, Truini A. Clinical usefulness of laser evoked potentials. Neurophysiol Clin. 2012;42:345–353. doi: 10.1016/j.neucli.2012.05.002. [DOI] [PubMed] [Google Scholar]
- 35.Siedler G, Sommer C, Üçeyler N. Pain-related evoked potentials in patients with large, mixed, and small fiber neuropathy. Clin Neurophysiol. 2020;131:635–641. doi: 10.1016/j.clinph.2019.12.006. [DOI] [PubMed] [Google Scholar]
- 36.Hüllemann P, Nerdal A, Sendel M, et al. Cold-evoked potentials versus contact heat-evoked potentials-methodological considerations and clinical application. Eur J Pain. 2019;23:1209–1220. doi: 10.1002/ejp.1389. [DOI] [PubMed] [Google Scholar]
- 37.Müller LJ, Marfurt CF, Kruse F, Tervo TMT. Corneal nerves: structure, contents and function. Exp Eye Res. 2003;76:521–542. doi: 10.1016/s0014-4835(03)00050-2. [DOI] [PubMed] [Google Scholar]
- 38.Cruzat A, Qazi Y, Hamrah P. In vivo confocal microscopy of corneal nerves in health and disease. Ocul Surf. 2017;15:15–47. doi: 10.1016/j.jtos.2016.09.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Jiang M-S, Yuan Y, Gu Z-X, Zhuang S-L. Corneal confocal microscopy for assessment of diabetic peripheral neuropathy: a meta-analysis. Br J Ophthalmol. 2016;100:9–14. doi: 10.1136/bjophthalmol-2014-306038. [DOI] [PubMed] [Google Scholar]
- 40.Perkins BA, Lovblom LE, Bril V, et al. Corneal confocal microscopy for identification of diabetic sensorimotor polyneuropathy: a pooled multinational consortium study. Diabetologia. 2018;61:1856–1861. doi: 10.1007/s00125-018-4653-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Adams D, Koike H, Slama M, Coelho T. Hereditary transthyretin amyloidosis: a model of medical progress for a fatal disease. Nat Rev Neurol. 2019;15:387–404. doi: 10.1038/s41582-019-0210-4. [DOI] [PubMed] [Google Scholar]
- 42.Weidner C, Klede M, Rukwied R, et al. Acute effects of substance P and calcitonin gene-related peptide in human skin—a microdialysis study. J Invest Dermatol. 2000;115:1015–1020. doi: 10.1046/j.1523-1747.2000.00142.x. [DOI] [PubMed] [Google Scholar]
- 43.Namer B, Pfeffer S, Handwerker HO, et al. Axon reflex flare and quantitative sudomotor axon reflex contribute in the diagnosis of small fiber neuropathy. Muscle Nerve. 2013;47:357–363. doi: 10.1002/mus.23543. [DOI] [PubMed] [Google Scholar]
- 44.Buchmann SJ, Penzlin AI, Kubasch ML, et al. Assessment of sudomotor function. Clin Auton Res. 2019;29:41–53. doi: 10.1007/s10286-018-0530-2. [DOI] [PubMed] [Google Scholar]
- 45.Finsterer J, Scorza FA. Small fiber neuropathy. Acta Neuro Scandinavica. 2022;145:493–503. doi: 10.1111/ane.13591. [DOI] [PubMed] [Google Scholar]
- 46.Gibbons CH, Freeman R. Treatment-induced neuropathy of diabetes: an acute, iatrogenic complication of diabetes. Brain. 2015;138:43–52. doi: 10.1093/brain/awu307. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Khan S, Zhou L. Characterization of non-length-dependent small-fiber sensory neuropathy. Muscle Nerve. 2012;45:86–91. doi: 10.1002/mus.22255. [DOI] [PubMed] [Google Scholar]
- 48.de Greef BTA, Hoeijmakers JGJ, Gorissen-Brouwers CML, et al. Associated conditions in small fiber neuropathy—a large cohort study and review of the literature. Eur J Neurol. 2018;25:348–355. doi: 10.1111/ene.13508. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Freeman R, Gewandter JS, Faber CG, et al. Idiopathic distal sensory polyneuropathy: ACTTION diagnostic criteria. Neurology. 2020;95:1005–1014. doi: 10.1212/WNL.0000000000010988. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Odozor CU, Kannampallil T, Ben Abdallah A, et al. Post-acute sensory neurological sequelae in patients with severe acute respiratory syndrome coronavirus 2 infection: the COVID-PN observational cohort study. Pain. 2022 doi: 10.1097/j.pain.0000000000002639. [DOI] [PubMed] [Google Scholar]
- 51.Abrams RMC, Simpson DM, Navis A, et al. Small fiber neuropathy associated with SARS-CoV-2 infection. Muscle Nerve. 2022;65:440–443. doi: 10.1002/mus.27458. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Novak P, Mukerji SS, Alabsi HS, et al. Multisystem involvement in post-acute sequelae of Coronavirus disease 19. Ann Neurol. 2022;91:367–379. doi: 10.1002/ana.26286. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Oaklander AL, Mills AJ, Kelley M, et al. Peripheral neuropathy evaluations of patients with prolonged long COVID. Neurol Neuroimmunol Neuroinflamm. 2022;9:e1146. doi: 10.1212/NXI.0000000000001146. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Sopacua M, Hoeijmakers JGJ, Merkies ISJ, et al. Small-fiber neuropathy: expanding the clinical pain universe. J Peripher Nerv Syst. 2019;24:19–33. doi: 10.1111/jns.12298. [DOI] [PubMed] [Google Scholar]
- 55.Dib-Hajj SD, Geha P, Waxman SG. Sodium channels in pain disorders: pathophysiology and prospects for treatment. Pain. 2017;158(1):S97–S107. doi: 10.1097/j.pain.0000000000000854. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.McDonnell A, Schulman B, Ali Z, et al. Inherited erythromelalgia due to mutations in SCN9A: natural history, clinical phenotype and somatosensory profile. Brain. 2016;139:1052–1065. doi: 10.1093/brain/aww007. [DOI] [PubMed] [Google Scholar]
- 57.Mantyh WG, Dyck PJB, Dyck PJ, et al. Epidermal nerve fiber quantification in patients with erythromelalgia. JAMA Dermatol. 2017;153:162–167. doi: 10.1001/jamadermatol.2016.4404. [DOI] [PubMed] [Google Scholar]
- 58.Eijkenboom I, Sopacua M, Hoeijmakers JGJ, et al. Yield of peripheral sodium channels gene screening in pure small fibre neuropathy. J Neurol Neurosurg Psychiatry. 2019;90:342–352. doi: 10.1136/jnnp-2018-319042. [DOI] [PubMed] [Google Scholar]
- 59.Waxman SG, Merkies ISJ, Gerrits MM, et al. Sodium channel genes in pain-related disorders: phenotype-genotype associations and recommendations for clinical use. Lancet Neurol. 2014;13:1152–1160. doi: 10.1016/S1474-4422(14)70150-4. [DOI] [PubMed] [Google Scholar]
- 60.Conceição I, González-Duarte A, Obici L, et al. “Red-flag” symptom clusters in transthyretin familial amyloid polyneuropathy. J Peripher Nerv Syst. 2016;21:5–9. doi: 10.1111/jns.12153. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Üçeyler N, Ganendiran S, Kramer D, Sommer C. Characterization of pain in fabry disease. Clin J Pain. 2014;30:915–920. doi: 10.1097/AJP.0000000000000041. [DOI] [PubMed] [Google Scholar]
- 62.Biegstraaten M, Hollak CEM, Bakkers M, et al. Small fiber neuropathy in Fabry disease. Mol Genet Metab. 2012;106:135–141. doi: 10.1016/j.ymgme.2012.03.010. [DOI] [PubMed] [Google Scholar]
- 63.de Greef BTA, Hoeijmakers JGJ, Wolters EE, et al. No Fabry disease in patients presenting with isolated small fiber neuropathy. PLoS ONE. 2016;11:e0148316. doi: 10.1371/journal.pone.0148316. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Ghasemi M, Rajabally YA. Small fiber neuropathy in unexpected clinical settings: a review. Muscle Nerve. 2020;62:167–175. doi: 10.1002/mus.26808. [DOI] [PubMed] [Google Scholar]
- 65.Enax-Krumova EK, Dahlhaus I, Görlach J, et al. Small fiber involvement is independent from clinical pain in late-onset Pompe disease. Orphanet J Rare Dis. 2022;17:177. doi: 10.1186/s13023-022-02327-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Gaillet A, Champion K, Lefaucheur J-P, et al. Intravenous immunoglobulin efficacy for primary Sjögren’s syndrome associated small fiber neuropathy. Autoimmun Rev. 2019;18:102387. doi: 10.1016/j.autrev.2019.102387. [DOI] [PubMed] [Google Scholar]
- 67.Pereira PR, Viala K, Maisonobe T, et al. Sjögren sensory neuronopathy (Sjögren ganglionopathy): long-term outcome and treatment response in a series of 13 cases. Medicine. 2016;95:e3632. doi: 10.1097/MD.0000000000003632. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.Tavee JO, Karwa K, Ahmed Z, et al. Sarcoidosis-associated small fiber neuropathy in a large cohort: clinical aspects and response to IVIG and anti-TNF alpha treatment. Respir Med. 2017;126:135–138. doi: 10.1016/j.rmed.2017.03.011. [DOI] [PubMed] [Google Scholar]
- 69.Geerts M, de Greef BTA, Sopacua M, et al. Intravenous immunoglobulin therapy in patients with painful idiopathic small fiber neuropathy. Neurology. 2021 doi: 10.1212/WNL.0000000000011919. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70.Barroso FA, Judge DP, Ebede B, et al. Long-term safety and efficacy of tafamidis for the treatment of hereditary transthyretin amyloid polyneuropathy: results up to 6 years. Amyloid. 2017;24:194–204. doi: 10.1080/13506129.2017.1357545. [DOI] [PubMed] [Google Scholar]
- 71.Adams D, Gonzalez-Duarte A, O’Riordan WD, et al. Patisiran, an RNAi therapeutic, for hereditary transthyretin amyloidosis. N Engl J Med. 2018;379:11–21. doi: 10.1056/NEJMoa1716153. [DOI] [PubMed] [Google Scholar]
- 72.Benson MD, Waddington-Cruz M, Berk JL, et al. Inotersen treatment for patients with hereditary transthyretin amyloidosis. N Engl J Med. 2018;379:22–31. doi: 10.1056/NEJMoa1716793. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 73.Schiffmann R, Floeter MK, Dambrosia JM, et al. Enzyme replacement therapy improves peripheral nerve and sweat function in Fabry disease. Muscle Nerve. 2003;28:703–710. doi: 10.1002/mus.10497. [DOI] [PubMed] [Google Scholar]
- 74.Schiffmann R, Hauer P, Freeman B, et al. Enzyme replacement therapy and intraepidermal innervation density in Fabry disease. Muscle Nerve. 2006;34:53–56. doi: 10.1002/mus.20550. [DOI] [PubMed] [Google Scholar]
- 75.Germain DP, Hughes DA, Nicholls K, et al. Treatment of Fabry’s disease with the pharmacologic chaperone migalastat. N Engl J Med. 2016;375:545–555. doi: 10.1056/NEJMoa1510198. [DOI] [PubMed] [Google Scholar]
- 76.de Greef BTA, Hoeijmakers JGJ, Geerts M, et al. Lacosamide in patients with Nav1.7 mutations-related small fibre neuropathy: a randomized controlled trial. Brain. 2019;142:263–275. doi: 10.1093/brain/awy329. [DOI] [PubMed] [Google Scholar]
- 77.Labau JIR, Estacion M, Tanaka BS, et al. Differential effect of lacosamide on Nav1.7 variants from responsive and non-responsive patients with small fibre neuropathy. Brain. 2020;143:771–782. doi: 10.1093/brain/awaa016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78.Heuß D. et al. (2019) Diagnostik bei Polyneuropathien, S1-Leitlinie. Deutsche Gesellschaft für Neurologie (Hrsg.), Leitlinien für Diagnostik und Therapie in der Neurologie. https://www.dgn.org/leitlinien. Zugegriffen: 15. Aug.2022