Abstract
目的
分析中国汉族人群遗传性周围神经病(hereditary peripheral neuropathy,HPN)致病基因的分布特点,探讨HPN与相关疾病的潜在发病机制和治疗前景。
方法
收集2007年1月到2022年5月在北京大学第三医院和中日友好医院诊治的HPN先证者666个,用多重连接探针扩增技术确定PMP22重复和缺失突变后,用二代测序基因包或全外显子组测序,Sanger法进行一代验证,分析比较结果。
结果
腓骨肌萎缩症(Charcot-Marie-Tooth,CMT)在HPN中所占比例最高,为74.3%(495/666),其中69.1%(342/495)的患者获得基因确诊。最常见的基因突变为PMP22重复、MFN2和GJB1突变,占CMT总体确诊患者的71.3%(244/342)。遗传性运动神经病(hereditary motor neuropathy,HMN)所占比例为16.1%(107/666),43%(46/107)为基因确诊,最常见的基因突变为HSPB1、t-RNA合成酶相关基因(aminoacyl-tRNA synthetases)和SORD突变,占HMN总体确诊患者的50%(23/46)。HMN的部分基因可以合并多种临床表型,如HSPB1、GARS、IGHMBP2可同时引起HMN和CMT,HMN叠加综合征的患者与肌萎缩侧索硬化(KIF5A、FIG4、DCTN1、SETX、VRK1)、遗传性痉挛性截瘫(KIF5A、ZFYVE26、BSCL2)和脊肌萎缩症(MORC2、IGHMBP2、DNAJB2)有共同的致病基因。遗传性感觉自主神经病(hereditary sensory and autosomal neuropathy,HSAN)在HPN中所占的比例较小,为2.6%(17/666),最常见的致病基因为SPTLC1突变。引起遗传性淀粉样周围神经病的基因主要是TTR,本研究中最常见的基因突变位点是p.A117S和p.V50M,表现为晚发和比较突出的自主神经受累。
结论
CMT和HMN是最常见的HPN,HMN与CMT2的致病基因有很多交叉,部分HMN致病基因与肌萎缩侧索硬化、遗传性痉挛性截瘫和脊肌萎缩症有重叠,提示不同疾病之间可能存在潜在的共同致病通路。
Keywords: 遗传性感觉和运动神经病, 基因, 中国
Abstract
Objective
To analyze the distribution characteristics of hereditary peripheral neuropathy (HPN) pathogenic genes in Chinese Han population, and to explore the potential pathogenesis and treatment prospects of HPN and related diseases.
Methods
Six hundred and fifty-six index patients with HPN were enrolled in Peking University Third Hospital and China-Japan Friendship Hospital from January 2007 to May 2022. The PMP22 duplication and deletion mutations were screened and validated by multiplex ligation probe amplification technique. The next-generation sequencing gene panel or whole exome sequencing was used, and the suspected genes were validated by Sanger sequencing.
Results
Charcot-Marie-Tooth (CMT) accounted for 74.3% (495/666) of the patients with HPN, of whom 69.1% (342/495) were genetically confirmed. The most common genes of CMT were PMP22 duplication, MFN2 and GJB1 mutations, which accounted for 71.3% (244/342) of the patients with genetically confirmed CMT. Hereditary motor neuropathy (HMN) accounted for 16.1% (107/666) of HPN, and 43% (46/107) of HPN was genetically confirmed. The most common genes of HMN were HSPB1, aminoacyl tRNA synthetases and SORD mutations, which accounted for 56.5% (26/46) of the patients with genetically confirmed HMN. Most genes associated with HMN could cause different phenotypes. HMN and CMT shared many genes (e.g. HSPB1, GARS, IGHMBP2). Some genes associated with dHMN-plus shared genes associated with amyotrophic lateral sclerosis (KIF5A, FIG4, DCTN1, SETX, VRK1), hereditary spastic paraplegia (KIF5A, ZFYVE26, BSCL2) and spinal muscular atrophy (MORC2, IGHMBP, DNAJB2), suggesting that HMN was a continuum rather than a distinct entity. Hereditary sensor and autosomal neuropathy (HSAN) accounted for a small proportion of 2.6% (17/666) in HPN. The most common pathogenic gene was SPTLC1 mutation. TTR was the main gene causing hereditary amyloid peripheral neuropathy. The most common types of gene mutations were p.A117S and p.V50M. The symptoms were characterized by late-onset and prominent autonomic nerve involvement.
Conclusion
CMT and HMN are the most common diseases of HPN. There is a large overlap between HMN and motor-CMT2 pathogenic genes, and some HMN pathogenic genes overlap with amyotrophic lateral sclerosis, hereditary spastic hemiplegia and spinal muscular atrophy, suggesting that there may be a potential common pathogenic pathway between different diseases.
Keywords: Hereditary sensory and motor neuropathy, Genes, China
遗传性周围神经病(hereditary polyneuropathy,HPN)是一大类临床和遗传异质性很高的以远端周围神经受损为主要表现的疾病,包括腓骨肌萎缩症(Charcot-Marie-Tooth,CMT)、遗传性压迫易感性神经病(hereditary neuropathy with liability to pressure palsies,HNPP)、遗传性运动神经病(hereditary motor neuropathy,HMN)、遗传性感觉自主神经病(hereditary sensory and autosomal neuropathy,HSAN)、家族性淀粉样周围神经病(familiar amyloid neuropathy,FAP)、遗传性共济失调伴周围神经病(植烷酸贮积症,heredopathia atactica polyneuritis, Refsum’ s di-sease)等[1]。HPN患者常常为儿童和青少年起病,表现为肢体远端的运动和/或感觉异常,伴有弓形足和锤状趾,复杂的临床表型还可以合并中枢神经系统损害,如锥体束征、小脑病变、认知功能障碍等[2]。除PMP22基因重复突变外,大部分HPN是由单个基因错义、无义突变和小的缺失、插入突变引起。
随着基因检测技术的提高和新基因不断被发现,HPN的诊断日益受到重视。由于HPN临床表现的复杂性和基因多效性,其分类标准和命名尚未完全统一,如CMT是最常见的HPN,有学者曾将HPN的不同类型如HNPP、HMN和HSAN都归为CMT及其相关疾病[3]。但越来越多的研究表明,不同的HPN类型之间可以有广泛的联系和交叉,比如HMN与肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)、遗传性痉挛性截瘫(hereditary spastic hemiplegia,HSP)存在共同的致病基因[4-5],同时某些HPN也可能作为系统性遗传病的一部分共同构成复杂而多变的HPN疾病谱[6],这些都增加了HPN基因诊断的复杂性。新的HPN命名系统建议将其命名为: 不同的疾病名称(如CMT或HMN)+电生理分型[如脱髓鞘型(demyelinating,De)、轴索型(axonal,Ax)或中间型(intermediate,In)]+遗传方式[如常染色体显性遗传(autosomal dominant inheritance,AD)、常染色体隐性遗传(autosomal recessive inheritance,AR)或X连锁遗传(X-linkage inheritance,XL)]+基因名称[7],如CMT-Ax-AD- HSPB1,遗传性共济失调也有类似的命名方式[8]。因此,对于HPN的认识应突破既往观念,从不同基因和发病机制的交叉和联系出发,进一步加深对HPN的了解。目前,关于HPN不同类型的分类、基因诊断和分布,在中国汉族人群中还未见系统报道,本文通过总结HPN较大队列的基因检测结果和临床-基因型相关性,分析基因的多效性和潜在致病机制,为基因治疗的研究和发展提供遗传学基础。
1. 资料与方法
1.1. 研究对象
收集2007年1月至2022年5月在北京大学第三医院和中日友好医院神经内科门诊及住院收治的HPN先证者,详细记录患者的起病形式、发病年龄、病情进展情况、家族史、康复治疗情况,以及每位患者的神经功能量表评分(第2版)(Charcot-Marie-Tooth neuropathy score version 2,CMTNS-v2)[9]、总体神经功能限制评分(overall neuropathy limitation scale,ONLS)和四肢神经电图检查结果。本研究已通过北京大学第三医院医学科学研究伦理委员会评审(编号: 2019-005-02)。
1.2. 基因检测方法
1.2.1. 基因检测策略
对脱髓鞘病变为主(上肢传导速度 < 38 m/s)的HPN型患者,首先采用多重连接依赖探针扩增技术(multiplex ligation-dependent probe amplification,MLPA)检测,明确有无PMP22重复和缺失突变,之后进行包含165个HPN致病基因的基因包或全外显子组测序,如基因包未检出阳性致病突变,则进一步行全外显子组测序,最终结果由Sanger法进行一代验证。对轴索型为主(上肢传导速度>38 m/s)的HPN型患者,可直接进行基因包或外显子组测序,方法同上。
1.2.2. 检测方法
取受试者外周血2 mL,常规提取DNA后,二代测序基因按照Illumina规范执行。DNA库的准备工作采用KAPA库试剂盒(Kapa Biosystems,KR0453),使用美国Agilent SureSelectXT2进行目标基因富集杂交。采用覆盖165CMT及其相关基因的定制基因包(gene panel)进行检测。二代测序使用HiSeq2500平台(200 bp)。全外显子组测序采用美国Agilent公司人全外显子V6试剂盒,在HiSeq2500平台上进行全外显子测序[10]。二代测序结果经由ABI 3730XL DNA分析仪(Applied Biosystems,Waltham,MA,USA)进行Sanger一代测序验证。
1.2.3. 致病性分析
患者的基因诊断是基于临床表型、遗传方式和电生理结果,参考人类基因遗传数据库(human gene mutation database,HGMD)报道过的已知致病基因突变和临床表型,进行家系验证后得出的。如果是未报道的突变位点,则查询单核苷酸多态性数据库(http://www.ncbi.nlm.nih.gov/projects/SNP)、1000基因组(http://1000genomes.org/)、GnomAD数据库(http://gnomad-public/rea-liease/3.0)的突变携带情况,并经SIFT(http://sift.jcvi.org/www/SIFT_enst_submit.html)、Polyphen (http://genetics.bwh.harvard.edu/pph2/index)及Mutation taster (http://www.mutationtaster.org/)的软件预测后,根据2015年美国医学遗传学学会推荐的致病性评级[11],将评级为致病(pathogenic)或很可能致病(likely pathogenic)的突变归于基因明确诊断的患者。
1.3. 统计学方法
所有数据均由SPSS 22.0 for Windows软件包计算完成。计量资料符合正态分布者以均数±标准差表示,不符合正态分布者采用中位数(最小值~最大值)表示,计量资料符合正态分布者采用t检验,非正态分布者采用非参数检验的Kruskal-Wallis H检验;计数资料以例(%)表示,组间率的比较采用卡方检验,如四方格中任一数值的期望值< 5,则采用精确概率法计算P值,P < 0.05表示差异有统计学意义。
2. 结果
2.1. 流行病学资料
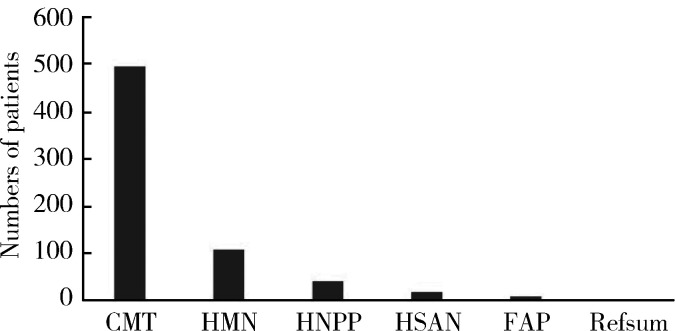
截至2022年5月,共有HPN家系666个,其中CMT家系占74.3%(495/666),HMN家系占16.0% (107/666),HNPP家系占5.9%(39/666),HSAN家系占2.6%(17/666),FAP家系占1.1%(7/666),植烷酸贮积症家系1个(图 1),其他共济失调伴有周围神经病的患者暂未归入HPN队列。其中有家族史的家系为388个,包括常染色体显性遗传家系202个、常染色体隐性遗传家系142个、X连锁显性遗传家系44个,余278例为散发患者。
图 1.
遗传性周围神病的疾病构成分布
Constitute distribution of different types of hereditary peripheral neuropathy
CMT, Charcot-Marie-Tooth; HMN, hereditary motor neuropathy; HNPP, hereditary neuropathy with liability to pressure palsies; HSAN, hereditary sensory and autosomal neuropathy; FAP, familiar amyloid neuropathy.
HPN患者的发病年龄(24.9±17.6)岁(0~65)岁,就诊年龄(34.3±17.8)岁,病程(9.0±9.4)年(2个月至65年),CMTNS-v2为(11.3±5.3)分(1~28分)。CMT和HMN是HPN的最常见的两个类型,其中CMT发病年龄(24.6±18.0)岁(1~77岁),就诊年龄(33.4±17.2)岁(1~79岁),病程(8.7±9.0)年(2个月至65年),CMTNS-v2为(12.2±5.6)分(1~36分)。HMN患者的发病年龄(25.6±17.0)岁(1~70岁),就诊年龄(35.4±18.2)岁(2~73岁),病程(9.4±9.5)年(2个月至44年),CMTNS-v2为(8.9±5.0)分(1~15分)。CMT和HMN的发病年龄、就诊年龄和病程差异均无统计学意义(t分别为-1.638、-1.471、0.598,P均>0.05),提示二者有很大的相似性。与CMT患者相比,HMN患者CMTNS-v2评分明显偏低,差异有统计学意义(t=4.909,P < 0.01),当去除CMTNS-v2评分中的感觉评分,仅记录运动评分时,二者差异无统计学意义(t=-1.583,P>0.05)。
HNPP患者平均发病年龄(23.3±10.5)岁(7~37岁),平均就诊年龄(26.1±10.6)岁(11~38岁),平均病程(2.9±2.7)年(1个月至7年),平均CMTNS-v2为(8.4±2.9)分(4~13分)。HSAN患者平均发病年龄(31.5±11.0)岁(11~78岁),平均就诊年龄(38.4±15.2)岁(2~63岁),平均病程(10.4±9.5)年(1个月至20年),平均CMTNS-v2为(11.8±9.4)分(4~24分)。FAP患者的发病年龄和就诊年龄普遍偏大,中位发病年龄52岁(11~78岁),中位就诊年龄55岁(12~83岁),平均病程(5.4±2.5)年(1个月至10年),平均CMTNS- v2为(16.8±9.5)分(5~28分)。Refsume病仅确诊1例患者,发病年龄为25岁,就诊年龄为35岁,病程为10年, CMTNS-v2评分为16分。HPN及其各亚类的流行病学资料详见表 1。
表 1.
HPN各临床类型的流行病学资料
Epidemiological data of clinical types of HPN
| Phenotype | n (%) | Age of onset/years | Age of examination/years | Disease course/years | CMTNS-v2 |
| HPN, hereditary polyneuropathy; CMTNS-v2, Charcot-Marie-Tooth neuropathy score version 2. Other abbreviations as in Figure 1. Data are shown as x±s or median (range). | |||||
| HPN | 666 (100) | 24.9±17.6 | 34.3±17.8 | 9.0±9.4 | 11.3±5.3 |
| CMT | 495 (74.3) | 24.6±18.0 | 33.4±17.2 | 8.7±9.0 | 12.2±5.6 |
| HMN | 107 (16.1) | 25.6±17.0 | 35.4±18.2 | 9.4±9.5 | 8.9±5.0 |
| HNPP | 39 (5.9) | 27.6±11.0 | 32.4±12.2 | 4.4±2.5 | 8.4±2.9 |
| HSAN | 17 (2.6) | 31.5±11.0 | 38.4±15.2 | 10.4±9.5 | 11.8±9.4 |
| FAP | 7 (1.1) | 52 (11-78) | 55 (12-83) | 5.4±2.5 | 16.8±9.5 |
| Refsum | 1 | 25 | 35 | 10 | 16 |
2.2. 基因检测结果
CMT、HMN、HNPP患者的基因诊断确诊率分别为69.1%(342/495)、43%(46/107)和77%(30/39);HSAN由于家系较少,且临床症状比较复杂,基因确诊比例仅为35.3%(6/17);FAP均为TTR基因明确家系,基因确诊比例为100%(7/7)。植烷酸贮积症的1个家系是由PHYH基因突变所致,患者周围神经病的症状比较突出,伴有共济失调和视网膜色素变性,因此归于HPN。
2.2.1. CMT
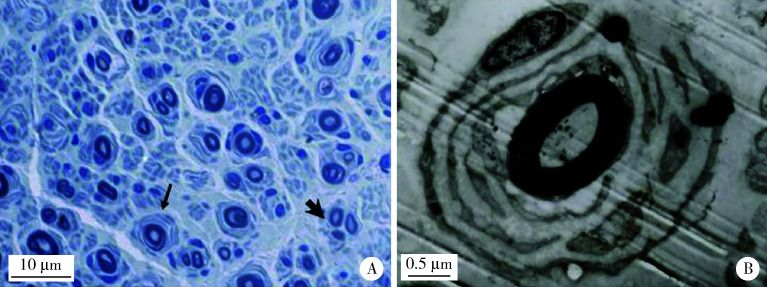
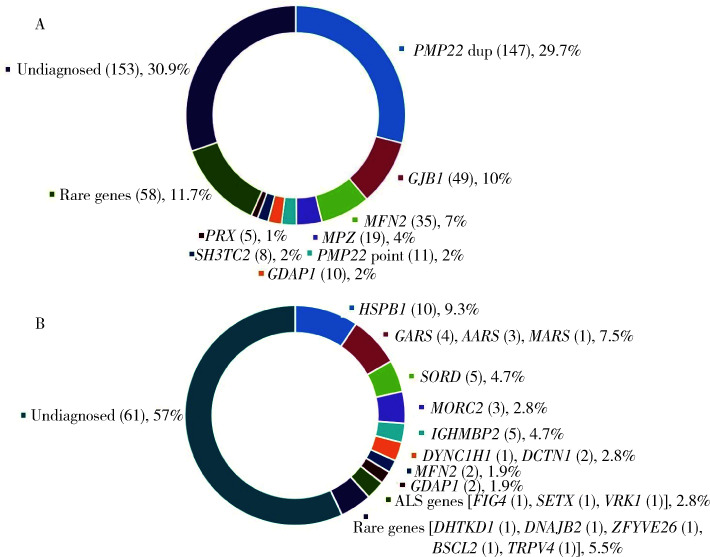
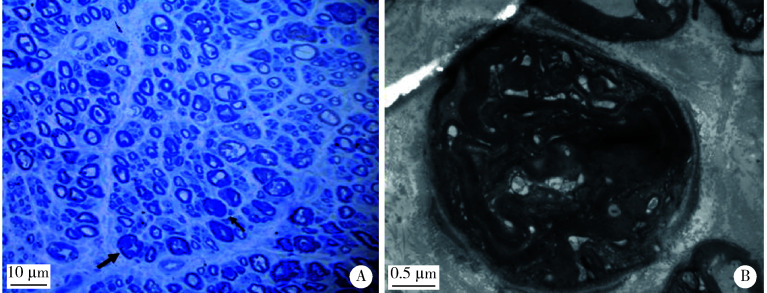
495个CMT先证者中,CMT1型291个,CMT2型146个,CMTX型58个,基因诊断确诊率分别为75.3%(219/291)、50.7%(74/146)和84.5%(49/58)。最常见的致病基因依次为PMP22重复突变、GJB1突变和MFN2突变,这三种基因突变占CMT总体确诊患者的71.3%(244/342),其中PMP22重复突变家系(CMT1A)147个,占CMT的29.7%(147/495)和CMT1的50.5%(147/291)。75%的CMT1A患者临床表现符合经典型CMT,即长度依赖性周围神经病,伴有弓形足,电生理表现为均一的传导速度下降,病理表现为典型的髓鞘再生,呈洋葱头样表现(图 2),但不同患者之间在发病年龄、病情严重程度和进展速度等方面呈现很大差异。GJB1是CMT第二常见的致病基因(CMTX1),占CMT的9.9%(49/495)和CMTX的84.5%(49/58)。GJB1最常见的是错义突变,但也可以有GJB1基因的整体缺失突变和5′UTR区的突变(-103 T>C),临床表现均为经典型CMT,部分患者还可以有中枢神经系统的白质病变。MFN2是CMT2最常见的致病基因(CMT2A),占CMT的7%(35/495)和CMT2的24%(35/146),CMT2A患者分为早发型和晚发型,除典型周围神经病变外,还可以表现为视神经萎缩和锥体束征。如按CMT亚型分类,CMT1最常见的基因突变依次为PMP22重复突变、PMP22点突变、MPZ和SH3TC2突变等,而CMT2最常见的致病基因依次为MFN2、GDAP1和MORC2等,各个致病基因在全部CMT患者中的分布详见图 3A。
图 2.
CMT1A患者的神经活检
Sural nerve biopsy in a patient with CMT1A
A, the number of normal myelinated nerve fibers is reduced, and some myelin are lost and regenerated, showing a typical "onion" like structure (thin arrow), and occasionally regenerative cluster like structure (thick arrow, semi-thin sections, toluidine blue staining ×200); B, the concentric round collagen layer structure formed by Schwann cell proliferation, namely the "onion" structure (electron micrography). CMT, Charcot-Marie-Tooth.
图 3.
CMT(A)和HMN(B)的基因分布图
Genetic distribution of CMT (A) and HMN (B)
The number of examples is in the bracket, followed by the percentage. CMT, Charcot-Marie-Tooth; HMN, hereditary motor neuropathy.
2.2.2. HMN
根据患者的临床表型分为纯HMN、运动为主的HMN(又称运动型CMT2)和HMN叠加综合征(HMN叠加认知功能障碍、锥体束征、小脑体征、胼胝体发育不良等)。HMN在HPN中所占比例为16.3%(107/656),基因诊断确诊率为43%(46/107),最常见的突变基因为HSPB1 (10/107,9.3%)、t-RNA合成酶相关基因(aminoacyl-tRNA synthetases)GARS+MARS+AARS(8/107,7.5%)和SORD(5/107,4.7%),占HMN总体基因确诊患者的50%(23/46)(图 3B)。HMN患者在临床上可伴有轻微感觉受累,但电生理的感觉神经传导速度和波幅是正常的,腓肠神经活检也往往表现为正常,部分有髓纤维脱失,无明显炎性细胞浸润和淀粉样物质沉积(图 4)。我们把临床上轻微感觉障碍的患者归类为运动为主的HMN,这部分患者中除已知的HMN和CMT重叠的基因(HSPB1、HSPB8和GARS等)外,CMT的其他基因(MFN2、GDAP1)也被发现与HMN相关。HMN叠加患者的致病基因较为复杂,5个基因(KIF5A、FIG4、DCTN1、SETX、VRK1)与ALS相关,3个基因(MORC2、IGHMBP2、DNAJB2)与脊肌萎缩症(spinal muscular atrophy, SMA)相关,3个基因(KIF5A、ZFYVE26、BSCL2)与HSP为相关表型(图 3B)。
图 4.
HMN患者的神经活检
Sural nerve biopsy in a patient with HMN
A, mild loss of large myelinated fibers, unmyelinated nerves had thinned axons (HE ×40); B, patial loss of large myelinated fibers, some Schwann cells showed swollen cytoplasm and degeneration (electron micrography). HMN, hereditary motor neuropathy.
2.2.3. HNPP
30例HNPP基因确诊患者中90%(27/30)由PMP22缺失突变引起,10%(3/30)由PMP22点突变引起。HNPP的临床症状为肢体受压部位反复出现麻木、无力,表现为腕管综合征、肘管综合征和腓骨小头腓神经受压后出现的足下垂等,电生理检查可见受压部位的运动和感觉传导速度改变,病理表现为腊肠样神经增生(图 5)。
图 5.
HNPP患者的神经活检
Sural nerve biopsy in a patient with HNPP
A, Part of the fiber myelin sheath is folded and thickened (semi-thin sections, toluidine blue staining ×100); B, Concentric myelin thickening formed a "sausage like" structure, named tomaculum (electron micrography). HMN, hereditary motor neuropathy.
2.2.4. HSAN
本组引起HSAN的突变基因是SPTLC1 (3例)、SCN9A (2例)和SCN11A (1例),临床表现为感觉丧失,容易被烫伤和自主神经功能障碍,尤其是疼痛是SCN9A突变患者的常见主诉。
2.2.5. FAP
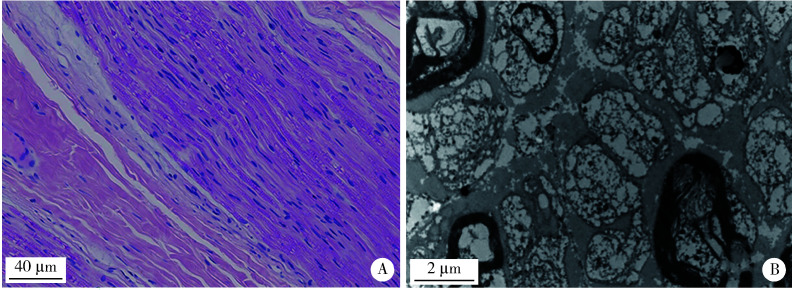
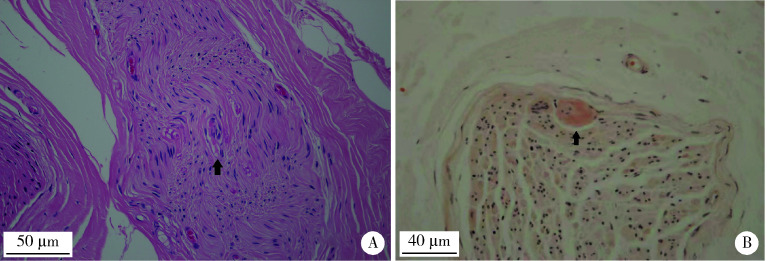
神经疼痛是FAP的典型临床表现,本研究中FAP均是由TTR基因突变引起的,累及的基因类型包括p.A117S和p.V50M。本研究7个家系的先证者均表现为晚发和比较突出的自主神经受累,腓肠神经活检可见淀粉样物质沉积(图 6)。
图 6.
FAP患者的神经活检
Sural nerve biopsy in a patient with FAP
A, homogeneous eosinophilic deposit has been found in sural nerve (arrow, HE staining ×40); B, amyloid deposition (arrow, Congo red staining ×100). FAP, familiar amyloid neuropathy.
2.3. 疾病之间的交叉和联系
2.3.1. CMT疾病之间类型的交叉
本研究中PMP22重复突变可引起CMT1A;PMP22点突变可引起CMT3(早期起病的严重脱髓鞘神经病,又称Dejerine-Sottas neuropathies,突变位点分别为p.S72W、p.S79P、p.G150V以及PMP22缺失与p.R157W复合杂合、PMP22缺失与c.320-1 G>A复合杂合)、CMT1E(p.W39C和p.G107V)或HNPP(c.434del T);MPZ突变可引起CMT1B(p.H81Y、p.G93E、p.R98H、p.R98C、p.I135T、p.T143R、p.S233Rfs*18)、CMT3(p.I30N、p.R98C、c.521_557 del37)、CMT2I(p.T124M、p.W101G、p.V102E)、CMT2J(伴有听觉障碍和瞳孔改变的CMT2、A121N)和CMTDID(p.*249Qext*64)。
2.3.2. CMT和HMN的交叉
HSPB1突变可同时引起CMT2F和HMN2B,最常见的两个位点是p.R127W和p.S135F,患者的感觉障碍大多比较轻微;GARS突变可引起CMT2D(p.E333D)和HMN5A(c.1809+2_1809+3 insT、p.S53G)等;IGHMBP2突变(c.1537+1 G>C、c.1305-1310del)可引起CMT2S和HMN6。文献报道HSPB8是CMT2L和HMN2A的致病基因,但本研究未发现HSPB8突变(表 2)。
表 2.
可以引起多种临床表型的基因
Multiple disease-causing gene with divergent phenotypes
| Gene | CMT1 | CMT2 | HMN | ALS | HSP | SMA |
| ALS, amyotrophic lateral sclerosis; HSP, hereditary spastic hemiplegia; SMA, spinal muscular atrophy; DSS, Dejerine-Sottas syndrome. Other abbreviations as in Figure 1. √ indicates that it can cause the disease phenotype, but there is no clear phenotype sequence number. | ||||||
| PMP22 | CMT1A, CMT1E, DSS, HNPP | |||||
| MPZ | CMT1B, DSS | CMT2J | ||||
| HSPB1 | CMT2F | HMN2B | ||||
| GARS | CMT2D | HMN5A | ||||
| IGHMBP2 | CMT2S | HMN6 | ||||
| HSPB8 | CMT2L | HMN2A | ||||
| KIF5A | √ | √ | √ | |||
| DCTN1 | √ | √ | ||||
| FIG4 | CMT4J | √ | ||||
| MORC2 | CMT2Z | √ | √ | |||
| DYNC1H1 | CMT2O | √ | ||||
| SPTLC1 | HSAN1 | √ | ||||
2.3.3. CMT/HMN和ALS/HSP的交叉
KIF5A的C端剪切位点附近的突变(c.2993-1 G>A、c.3020+ 1 G>A、c.3020+2 T>C)可引起ALS;KIF5A的N端错义突变可引起HSP或CMT(p.L13P、p.S189P);DCTN1 (p.G59R)可引起HMN和ALS;FIG4杂合突变可引起ALS,而纯合或复合杂合突变可引起CMT4J。本研究SETX(p.T952A)和VRK1(p.W375*)的突变均表现为HMN叠加综合征,但此两个基因同时也是ALS的致病基因。
2.3.4. CMT/HMN和SMA的交叉
本研究MORC2突变可以引起CMT2Z(p.R252W、p.D466G、p.C407Y)和SMA(p.S87L),DYNC1H1突变可引起SMA和CMT2O。
2.3.5. HSAN和ALS的交叉
SPTLC1突变可引起HSAN1(p.C133W和p.C133Y)和青年型ALS(p. L38R)。
3. 讨论
HPN中CMT占比最大,国外报道CMT的发病率为每10万9.7~84.0人,中国尚缺乏大规模的流行病学数据。在人类孟德尔遗传病在线(online Mendelian Inheritance in Man,OMIM)数据库中的853个HPN中,CMT占118个[6]。本研究将HMN、HSAN、HNPP作为独立疾病从CMT分出后,发现CMT仍是最常见的HPN类型(占75.5%)。CMT发病率较高的原因,可能与基因外显率和新发突变(de novo)较高有关[6]。CMT中69.5%的患者获得基因确诊,最常见的仍为PMP22重复突变及GJB1、MFN2和MPZ突变,占CMT基因确诊患者的73.1%,其他的CMT致病基因各自所占比例不及2%,这与国内另一较大的CMT研究中心张如旭教授团队报道的70.7%的CMT基因诊断确诊率和基因分布频率相似[12],反映了我国CMT患者的基因频率分布状况。欧美国家报道的PMP22重复突变的比例相对较高,占CMT的50%~65%,CMT1型的70%[1, 13],这种差异可能和遗传背景、地理因素、基因检测技术或患者的就诊意愿有关。另外,既往报道的欧美国家这4种常见基因突变占基因诊断确诊患者的90%,这一比例在二代基因检测技术推出后有所下降,说明虽然筛查常见基因可以对大部分患者做出基因诊断,但也可能造成10%~20%患者的某些少见致病基因被漏诊[13]。本团队基于14年队列研究的数据表明,基因检测技术提高后,少见基因的确诊率提高了16%[14],更多的新发基因(如SORD、MORC2)[15-16]和常染色体隐性基因(如GDAP1、SH3TC2、IGHMBP2)的确诊患者被发现,一定程度地改变了CMT基因确诊的构成比。
CMT和HMN队列的发病年龄、就诊年龄和病程之间无显著差异,HMN患者CMTNS-v2评分偏低是因为该评分包括了运动和感觉两部分内容,其中感觉评分占量表总分的16/36,而HMN中的患者大多没有或仅有轻度的感觉障碍,感觉神经传导检查往往是正常的,因此造成了HMN患者的CMTNS-v2评分略低,若仅就运动评分来说,二者的程度是相似的,提示CMT和HMN的临床特征有很大的相似性。同时,CMT和HMN之间有很多共同致病基因,如HSPB1、IGHMBP2、GARS等,反映了HMN和CMT存在广泛的共同致病基础。但是,HMN的基因诊断确诊率明显比CMT低(43.0% vs. 69.5%),国外报道HMN的基因诊断确诊率大多在30%~40%[1-2, 6],说明HMN除了与CMT共享基因之外,还有很大一部分的基因诊断不明确,可能存在其他的发病机制。
HMN的临床表现根据是否存在中枢神经系统损害分为纯HMN、CMT2运动为主型和HMN叠加综合征[2, 17]。本研究发现HMN最常见的致病基因是HSPB1,该基因2004年于数名CMT2家族中首次被发现,作为一个重要的陪伴蛋白,突变基因在轴浆转运、RNA代谢、蛋白折叠和自噬方面均有影响[1, 18]。RNA合成酶相关基因(GARS、MARS、AARS)也是常见的HMN致病基因。目前已知有6个RNA合成酶相关基因可引起CMT2/HMN,分别为GARS、MARS、AARS、WARS1、HARS和YARS1,其各有各的临床特点,如GARS突变患者更多表现为上肢起病的周围神经病,伴或不伴有感觉障碍[19];AARS突变患者可伴有不同程度的感觉神经性聋[20];MARS和HARS突变患者大多表现为晚发性周围神经病[21-22];WARS1突变可引起青春期发病的运动轴索性神经病[23]。2020年报道的常染色体隐性遗传的SORD基因[15]是HMN第三常见病因,最常见的致病位点是c.757delG(p.Ala253fsTer27),目前发现的与SORD突变相关的周围神经病均和该位点有关,或者是纯合突变,或者是该位点与另一条染色体上存在其他致病位点引起的复合杂合突变,临床表现为经典的远端依赖性运动轴索病变,如青春期起病、下肢受累为主、病情进展速度缓慢等,部分可伴有植物神经受损[24]。综上,HMN最常见的致病基因均是与CMT共享的基因,临床表现也更趋向于CMT2/HMN的表现,这部分患者临床更容易识别,基因诊断确诊率不低。但HMN叠加综合征患者的致病基因则更加复杂,很多基因与HSP和ALS相关[25-26],Bansagi等[2]报道HMN叠加综合征的基因诊断确诊率仅为26%,直接影响到HMN的整体基因诊断确诊率。
HMN的很多致病基因具有多效性,即同一致病基因可以出现多种临床表型,给基因诊断和基因型-临床型的相关分析带来很大困难,而HMN的致病基因具有多效性的占比很大,在已知的32个HMN致病基因中仅3个表现为纯HMN表型(FBXO38、HSPB3、WARS)[5],一定程度上说明HMN是独立性疾病还是一大类以运动轴索损害为主要表现的临床综合征还有待探讨。HMN中部分基因与ALS有关,如KIF5A、DCTN1、FIG4、SETX等;与SMA有关的基因有MORC2、HSPB1、DYNC1H1等;与HSP相关的基因有ZFYVE26、SPG11和KIF5A等。虽然基因多效性的机制尚不完全清楚,但已经明确的是,基因突变的位置和种类可引起基因的功能获得或功能丧失,从而出现完全不同的疾病表型,如KIF5A作为驱动蛋白家族的重要成员,其N端球状结构域(马达区,氨基酸位置9~327)和α螺旋卷曲螺旋结构域(氨基酸位置331~906)的错义突变与HPN和HSP相关,而C端货物结合区的27号外显子附近缺失突变或剪切突变(c.2993-1 G>A、c.3020+1 G>A、c.3020+2 T>C)与ALS密切相关[27-28]。目前已知与HMN相关的5个机制分别为轴浆转运、tRNA合成酶相关、DNA和RNA代谢、离子通道和内质网功能。除tRNA合成酶相关基因大多引起CMT2/HMN外,其他大部分基因突变都可以有中枢神经系统的表现,如:轴浆转运的基因还可以分为陪伴蛋白为主的HSPB1和DNAJB2,以顺向和逆向转运为主的KIF5A、DCTN1和DYNC1H1,以分子骨架为主的SPTAN1及以囊泡吞吐为主的SYT2和PLEKHG5,对上述基因下游的共同机制的探讨有助于HPN治疗的深入研究[29]。
本研究HSAN的构成比仅占HPN的2.6%,基因诊断确诊率也仅为35.3%。HSAN的临床表现除了感觉丧失,导致容易烫伤并引起截肢外,其自主神经功能障碍,尤其是疼痛是HSAN患者的常见主诉。文献报道50%的神经痛性周围神经病与糖尿病相关,其余与遗传相关。引起HSAN的基因很多,分为HSANⅠ~Ⅵ型,而且有部分基因与HSP的致病基因叠加,如ATL1 (痉挛性截瘫3A型,spastic paraplegia 3A,SPG3A)、KIF1A (SPG30)、DNMT1和CCT5等。本研究发现的SPTLC1、SCN9A、SCN11A突变分属HSAN的Ⅰ型,其中SPTLC1是2003年发现的最常见的HSAN致病基因[30],该基因最常见的致病位点是C133W和C133Y,由于它影响了丝氨酸棕榈酰转移酶(serine palmitoyl-transferase,CPT),从而使酶的作用底物从丝氨酸变为甘氨酸或丙氨酸,导致脱氧鞘脂或脱氧甲基鞘脂等毒性代谢产物的堆积,出现感觉为主的周围神经病[31]。目前,补充丝氨酸治疗HSAN已经进入三期临床试验[32],但近期研究表明SPTLC1同样是青年型ALS的致病基因[33],而且不同于HSAN的发病机制,是由于第2外显子区域功能障碍引起CPT酶活性的负反馈作用减弱,相应CPT酶作用增强,产生大量的神经酰胺,导致运动神经元病的发生[33],这种情况补充丝氨酸可能进一步加重病情变化。
FAP是一组常染色体显性遗传病,是淀粉样变性前体蛋白沉积导致的多系统疾病,致病基因包括转甲状腺素(transthyroxine,TTR)、载脂蛋白A1(apolipoprotein A1,APOA1)和凝胶蛋白(gel protein,GSN)。本研究中的所有FAP患者均携带TTR突变,突变位点是V50M和A117S,其中A117S是亚洲比较常见的以晚发和进展缓慢为主要表现的基因类型[34]。本组患者的发病年龄均明显晚于一般的HPN患者。TTR突变引起的FAP的典型表现为长度依赖性小纤维的对称性感觉运动性多发性神经病,可伴痛觉过敏,自主神经功能障碍可出现心力衰竭和心律失常。目前超过100个TTR基因突变位点已被报道。北欧血统患者p.V30M突变多在60岁左右发病,而在葡萄牙患者中,通常在30岁左右出现症状[6]。口服氯苯唑酸(tafamidis)防止蛋白质的错误折叠和沉积已在欧洲和美国被批准用于治疗TTR相关周围神经病变和心肌病。基因疗法——小干扰RNA(patisiran)和反义寡核苷酸(inotersen)药物现已获得FDA批准[35]。部分野生型TTR也可以出现淀粉样沉积,主要表现为心肌损害,伴有轻度的周围神经病变[36]。
综上所述,HPN的遗传型和临床型比较复杂,HMN与CMT2型致病基因有很大交叉,部分HMN致病基因与ALS、HSP和SMA都有重叠,HSAN与HSP,甚至ALS基因也有部分重叠,对基因多效性的研究有助于理解不同疾病之间潜在的共同致病通路。
Biography
樊东升,北京大学第三医院神经内科主任,北京大学医学部神经病学系主任,神经退行性疾病生物标志物研究及转化北京市重点实验室主任,国家卫生健康委员会神经科学重点实验室副主任及学术委员会副主任,神经科学教育部重点实验室学术委员会副主任,国家神经系统疾病医疗质量控制中心运动神经元疾病医疗质量工作组组长,中国残疾人康复协会罕见病康复专业委员会主任委员,《中华脑血管病杂志(电子版)》总编辑。 曾获教育部科技进步一等奖、自然科学二等奖等,所承担的北京大学《神经病学》获“国家精品课程”。发表论文600余篇,H指数46,被引9 321次;其中SCI论文总影响因子1 010.5。2017年当选第八届国家卫生和计划生育委员会(现为国家卫生健康委员会)突出贡献专家,2022年当选美国科学家荣誉学会(Sigma Xi)会员。荣获第四届“国之名医·卓越建树奖”(2020)、第六届“荣耀医者·人文情怀奖”(2021)、国家卫生健康委员会脑卒中防治工程委员会“杰出贡献奖”(2021)、中国微循环学会“中国神经变性病领域特殊贡献奖”(2021)等
Funding Statement
北京大学临床医学+X青年专项(PKU2021LCXQ019)和北京大学第三医院队列建设项目(BYSYDL2021007)
Supported by Peking University Clinical Medicine Plus X-Youth Scholars Project (PKU2021LCXQ019) and Peking University Third Hospital Cohort Study Project (BYSYDL2021007)
References
- 1.Ghosh S, Tourtellotte WG. The complex clinical and genetic landscape of hereditary peripheral neuropathy. Annu Rev Pathol. 2021;16:487–509. doi: 10.1146/annurev-pathol-030320-100822. [DOI] [PubMed] [Google Scholar]
- 2.Bansagi B, Griffin H, Whittaker RG, et al. Genetic heterogeneity of motor neuropathies. Neurology. 2017;88(13):1226–1234. doi: 10.1212/WNL.0000000000003772. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Rossor AM, Polke JM, Houlden H, et al. Clinical implications of genetic advances in Charcot-Marie-Tooth disease. Nat Rev Neurol. 2013;9(10):562–571. doi: 10.1038/nrneurol.2013.179. [DOI] [PubMed] [Google Scholar]
- 4.Previtali SC, Zhao E, Lazarevic D, et al. Expanding the spectrum of genes responsible for hereditary motor neuropathies. J Neurol Neurosurg Psychiatry. 2019;90(10):1171–1179. doi: 10.1136/jnnp-2019-320717. [DOI] [PubMed] [Google Scholar]
- 5.Beijer D, Baets J. The expanding genetic landscape of hereditary motor neuropathies. Brain. 2020;143(12):3540–3563. doi: 10.1093/brain/awaa311. [DOI] [PubMed] [Google Scholar]
- 6.Klein CJ. Charcot-Marie-Tooth disease and other hereditary neuropathies. Continuum (Minneap Minn) 2020;26(5):1224–1256. doi: 10.1212/CON.0000000000000927. [DOI] [PubMed] [Google Scholar]
- 7.Magy L, Mathis S, Le Masson G, et al. Updating the classification of inherited neuropathies: Results of an international survey. Neurology. 2018;90(10):e870–e876. doi: 10.1212/WNL.0000000000005074. [DOI] [PubMed] [Google Scholar]
- 8.Beaudin M, Klein CJ, Rouleau GA, et al. Systematic review of autosomal recessive ataxias and proposal for a classification. Cerebellum Ataxias. 2017;4:3. doi: 10.1186/s40673-017-0061-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Murphy SM, Herrmann DN, McDermott MP, et al. Reliability of the CMT neuropathy score (second version) in Charcot-Marie-Tooth disease. J Peripher Nerv Syst. 2011;16(3):191–198. doi: 10.1111/j.1529-8027.2011.00350.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Padilha JPD, Brasil CS, Hoefel AML, et al. Diagnostic yield of targeted sequential and massive panel approaches for inherited neuropathies. Clin Genet. 2020;98(2):185–190. doi: 10.1111/cge.13793. [DOI] [PubMed] [Google Scholar]
- 11.Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants: A joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med. 2015;17(5):405–424. doi: 10.1038/gim.2015.30. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Xie Y, Lin Z, Liu L, et al. Genotype and phenotype distribution of 435 patients with Charcot-Marie-Tooth from central south China. Eur J Neurol. 2021;28(11):3774–3783. doi: 10.1111/ene.15024. [DOI] [PubMed] [Google Scholar]
- 13.Vaeth S, Christensen R, Dunϕ M, et al. Genetic analysis of Charcot-Marie-Tooth disease in Denmark and the implementation of a next generation sequencing platform. Eur J Med Genet. 2019;62(1):1–8. doi: 10.1016/j.ejmg.2018.04.003. [DOI] [PubMed] [Google Scholar]
- 14.刘 小璇, 孙 阿萍, 段 晓慧, et al. 中国人群腓骨肌萎缩症的致病基因分布对比研究——14年队列观察. 中华神经科杂志. 2022;55(5):481–489. doi: 10.3760/cma.j.cn113694-20211102-00762. [DOI] [Google Scholar]
- 15.Cortese A, Zhu Y, Rebelo AP, et al. Biallelic mutations in SORD cause a common and potentially treatable hereditary neuropathy with implications for diabetes. Nat Genet. 2020;2(5):473–481. doi: 10.1038/s41588-020-0615-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Sevilla T, Lupo V, Martínez-Rubio D, et al. Mutations in the MORC2 gene cause axonal Charcot-Marie-Tooth disease. Brain. 2016;139(Pt 1):62–72. doi: 10.1093/brain/awv311. [DOI] [PubMed] [Google Scholar]
- 17.Liu X, Duan X, Zhang Y, et al. Molecular analysis and clinical diversity of distal hereditary motor neuropathy. Eur J Neurol. 2020;27(7):1319–1326. doi: 10.1111/ene.14260. [DOI] [PubMed] [Google Scholar]
- 18.Evgrafov OV, Mersiyanova I, Irobi J, et al. Mutant small heat-shock protein 27 causes axonal Charcot-Marie-Tooth disease and distal hereditary motor neuropathy. Nat Genet. 2004;36(6):602–606. doi: 10.1038/ng1354. [DOI] [PubMed] [Google Scholar]
- 19.Antonellis A, Ellsworth RE, Sambuughin N, et al. Glycyl tRNA synthetase mutations in Charcot-Marie-Tooth disease type 2D and distal spinal muscular atrophy type Ⅴ. Am J Hum Genet. 2003;72(5):1293–1299. doi: 10.1086/375039. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Latour P, Thauvin-Robinet C, Baudelet-Mery C, et al. A major determinant for binding and aminoacylation of tRNA (Ala) in cytoplasmic Alanyl-tRNA synthetase is mutated in dominant axonal Charcot-Marie-Tooth disease. Am J Hum Genet. 2010;86(1):77–82. doi: 10.1016/j.ajhg.2009.12.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Gonzalez M, McLaughlin H, Houlden H, et al. Exome sequencing identifies a significant variant in methionyl-tRNA synthetase (MARS) in a family with late-onset CMT2. J Neurol Neurosurg Psychiatry. 2013;84(11):1247–1249. doi: 10.1136/jnnp-2013-305049. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Vester A, Velez-Ruiz G, McLaughlin HM, et al. A loss-of-function variant in the human histidyl-tRNA synthetase (HARS) gene is neurotoxic in vivo. Hum Mutat. 2013;34(1):191–199. doi: 10.1002/humu.22210. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Tsai PC, Soong BW, Mademan I, et al. A recurrent WARS mutation is a novel cause of autosomal dominant distal hereditary motor neuropathy. Brain. 2017;140(5):1252–1266. doi: 10.1093/brain/awx058. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Yuan RY, Ye ZL, Zhang XR, et al. Evaluation of SORD mutations as a novel cause of Charcot-Marie-Tooth disease. Ann Clin Transl Neurol. 2021;8(1):266–270. doi: 10.1002/acn3.51268. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Scarlino S, Domi T, Pozzi L, et al. Burden of rare variants in ALS and axonal hereditary neuropathy genes influence survival in ALS: Insights from a next generation sequencing study of an Italian ALS cohort. Int J Mol Sci. 2020;21(9):3346. doi: 10.3390/ijms21093346. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Montecchiani C, Pedace L, Giudice TL, et al. ALS5/SPG11/KIAA1840 mutations cause autosomal recessive axonal Charcot-Marie-Tooth disease. Brain. 2016;139(Pt 1):73–85. doi: 10.1093/brain/awv320. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Brenner D, Yilmaz R, Muller K, et al. Hot-spot KIF5A mutations cause familial ALS. Brain. 2018;141(3):688–697. doi: 10.1093/brain/awx370. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.He J, Liu X, Tang L, et al. Whole-exome sequencing identified novel KIF5A mutations in Chinese patients with amyotrophic lateral sclerosis and Charcot-Marie-Tooth type 2. J Neurol Neurosurg Psychiatry. 2020;91(3):326–328. doi: 10.1136/jnnp-2019-320483. [DOI] [PubMed] [Google Scholar]
- 29.Stavrou M, Sargiannidou I, Georgiou E, et al. Emerging Therapies for Charcot-Marie-Tooth Inherited Neuropathies. Int J Mol Sci. 2021;22(11):6048. doi: 10.3390/ijms22116048. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Bejaoui K, Wu C, Scheffler MD, et al. SPTLC1 is mutated in hereditary sensory neuropathy, type 1. Nat Genet. 2001;27(3):261–262. doi: 10.1038/85817. [DOI] [PubMed] [Google Scholar]
- 31.Eichler FS, Hornemann T, McCampbell A, et al. Overexpression of the wild-type SPT1 subunit lowers desoxysphingolipid levels and rescues the phenotype of HSAN1. J Neurosci. 2009;29(46):14646–14651. doi: 10.1523/JNEUROSCI.2536-09.2009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Fridman V, Suriyanarayanan S, Novak P, et al. Randomized trial of l-serine in patients with hereditary sensory and autonomic neuropathy type 1. Neurology. 2019;92(4):e359–e370. doi: 10.1212/WNL.0000000000006811. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Mohassel P, Donkervoort S, Lone MA, et al. Childhood amyotrophic lateral sclerosis caused by excess sphingolipid synthesis. Nat Med. 2021;27(7):1197–1204. doi: 10.1038/s41591-021-01346-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Zhang Y, Liu Z, Zhang Y, et al. Corneal sub-basal whorl-like nerve plexus: A landmark for early and follow-up evaluation in transthyretin familial amyloid polyneuropathy. Eur J Neurol. 2021;28(2):630–638. doi: 10.1111/ene.14563. [DOI] [PubMed] [Google Scholar]
- 35.Buxbaum JN. Oligonucleotide drugs for transthyretin amyloidosis. N Engl J Med. 2018;379(1):82–85. doi: 10.1056/NEJMe1805499. [DOI] [PubMed] [Google Scholar]
- 36.Visser AC, Klein CJ. Wild-type TTR neuropathy with cardiomyo-pathy presenting with burning feet. Neurology. 2017;88(11):1101–1102. doi: 10.1212/WNL.0000000000003721. [DOI] [PubMed] [Google Scholar]