由人类免疫缺陷病毒(human immunodeficiency virus 1, HIV-1)、丙型肝炎病毒(hepatitis C virus, HCV)、甲型流感病毒(influenza A virus, IAV)及重症急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus, SARS-CoV)等导致的传染性疾病时刻威胁着人类的健康。病毒的生命周期大致可以分为进入、复制和释放三个阶段。传统的抗病毒小分子药物主要针对病毒感染的复制和释放阶段,通过占据病毒蛋白的活性位点而发挥抑制功能。然而,由于病毒基因容易产生突变,从而出现耐药性,因此亟需研发不同于当前靶向病毒复制为主要机制的新型抗病毒药物。鉴于病毒-宿主相互作用在病毒生命周期中的关键作用,靶向病毒的进入及释放的药物不仅可以扩大当前抗病毒药物的种类,而且还可以减少病毒入胞后产生突变的可能性; 而利用靶向蛋白降解技术(proteolysis targeting chimera,PROTAC)则可以针对复制阶段产生的子代病毒蛋白发挥抗病毒活性,相比传统小分子的抑制能力更强,同时有望解决耐药性问题。
五环三萜是一大类植物次生代谢产物,由异戊二烯(2-甲基丁二烯)单元构成,广泛存在于柴胡、甘草等民间中药中[1]。与从土壤微生物中发现的天然氨基糖苷类抗生素相似,植物中的三萜类天然产物经过大自然数百万年乃至数千万年的选择和进化,通常被认为是植物用以防御外来病原体感染的重要化学成分[2-3]。通过对三萜类天然物的提取分离、结构优化以及作用机制的研究,可以获得结构新颖、作用机制独特的新型抗病毒药物分子,这一自然进化而来的天然产物可用以护佑人类的健康。三萜的C-28位糖基化衍生物可与多种包膜病毒共有且保守的七肽重复(heptad repeat,HR)结构HR2结合,阻碍了病毒-细胞膜融合所依赖的、HR1-HR2亲和导致三聚体发夹状结构的形成,从而使得该类化合物表现出了广谱的抗病毒进入细胞的活性[4-6]。将C-28位糖基化修饰替换成E3连接酶配体,则可以将三萜的细胞外抗病毒进入活性转化为细胞内抗病毒复制活性[7]。三萜C-3位修饰的衍生物对于病毒成熟具有抑制活性,候选化合物GSK2838232及bevirimat曾进入二期临床实验[8-9]。构效关系明确、作用机制多样化的三萜衍生物有助于我们更好地认识和操控病毒,特别是其与宿主细胞的识别及膜融合过程,从而实现多样化的抗病毒药物设计。
本文围绕五环三萜类抗病毒抑制剂的发现这一命题,结合本课题组和其他科研团队关于五环三萜的结构修饰、机制探索、临床应用等最新研究结果,重点阐述五环三萜类衍生物抗病毒进入、降解病毒膜蛋白及抑制子代病毒释放等多角度的作用机制,并对五环三萜衍生物抗病毒未来的研究方向和应用前景进行展望。
1. 作用于病毒进入阶段的五环三萜类抑制剂
病毒-宿主膜融合是病毒进入细胞的关键步骤,其中涉及到病毒表面负责融合的糖蛋白与宿主细胞受体的识别、结合、微胞饮等方式的内吞、低pH下融合蛋白构象变化等[10-11]。病毒融合蛋白主要由两部分构成: 外侧与宿主细胞受体结合的亚基,内侧铆钉在病毒膜上负责宿主和病毒膜融合的亚基。根据融合蛋白的不同,可以将包膜病毒主要分为Ⅰ~Ⅲ三种亚型,其中HIV-1的包膜蛋白(envelope protein,Env)、IAV的血凝素蛋白(hemagglutinin,HA)、Ebola的糖蛋白(glycoprotein,GP)等Ⅰ型包膜病毒负责膜融合的亚基大多数含有一段HR1-HR2串联的三聚体发夹结构。该结构具有较强的疏水性,并且在酸性pH条件下可发生翻折,形成六股螺旋束结构,拉近了细胞膜和病毒膜之间的距离,从而导致两侧的宿主细胞膜和病毒膜发生膜融合[12-15],相似的结构基础使得融合蛋白的HR1-HR2结构域成为了一个潜在的抗病毒进入药物的作用靶点。
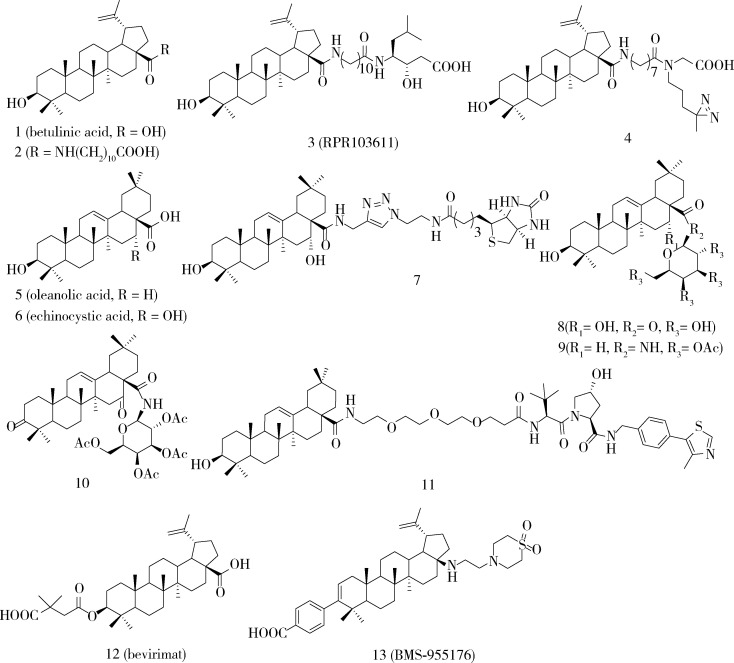
图 1总结了具有代表性的五环三萜及其衍生物的结构。白桦脂酸(betulinic acid,BA)1具有抗HIV-1进入的活性[16],Evers研究小组在白桦脂酸C-28位的羧基上偶联了不同碳原子数的烷酸,发现该系列衍生物中化合物2的抗HIV-1活性最强,半数抑制浓度达到了230 nmol/L[17]。在化合物2的末端羧基上进一步修饰,发现氨基烷酸衍生物3(RPR103611)的抗HIV-1活性又增强了7倍(IC50 = 30 nmol/L)[18-19],说明末端羧基仍具有一定的修饰空间。由于五环三萜结构作为HIV-1进入抑制剂具有很强的新颖性,进一步发现其作用机制和作用靶点对于阐明传统中药的抗病毒作用具有重要的意义。结合文献对该系列化合物构效关系进行研究[20-21],将紫外光照激活具有共价结合能力的双吖丙啶结构引入到活性分子末端甘氨酸的胺基上,得到了探针分子4。通过蛋白质谱分析发现,该探针分子共价结合在一段含有23个氨基酸长度的肽段上,而该肽段位于HIV-1的膜融合蛋白gp41的HR2结构域内[4]。进一步通过表面等离子共振技术(surface plasmon resonance,SPR)发现探针4与HIV-1的HR2结构域具有较强的结合能力而不结合HR1,分子对接实验表明,白桦酯酸类三萜的疏水性骨架和脂肪链与病毒膜蛋白的HR2结构域的疏水性表面存在多种结合作用,这也是该系列分子可以发挥抗HIV-1进入活性的结构基础。
图 1.
代表性五环三萜及其衍生物的结构
The chemical structures of representative pentacyclic triterpenoid derivatives
板蓝根(Isatidis radix)、川续断(Dipsacus asperoides)等传统中药具有抗病毒的功效。本课题组通过活性导向的分离,从川续断的正丁醇/水体系提取物中发现了一类极性大、紫外吸收弱的皂苷类天然产物具有抗HCV进入的活性,进而发现五环三萜类化合物齐墩果酸5(oleanolic acid,OA)对HCV的进入具有一定的抑制活性(IC50= 10 μmol/L)[22]; 而较OA的C-16位增加了羟基的同系物刺囊酸(echinocystic acid,EA)6的抗HCV进入活性提高了10倍(IC50= 1.4 μmol/L)。进一步的构效关系研究发现,三萜分子的A环、B环及E环相对保守,修饰后抗HCV活性明显下降,而C-28位羧基修饰甲酯、氨基酸、糖等均会提高活性,说明C-28位羧基是比较理想的修饰位点。在C-28位生物素修饰得到探针7,通过靶蛋白垂钓实验可以富集得到HCV病毒的E2蛋白,进一步的SPR实验发现EA与E2蛋白的结合亲和力常数KD为24 μmol/L,同时探针分子7可使E2与细胞表面受体CD81的结合能力下降到原来的1.33%,这也解释了EA分子通过阻断HCV病毒与宿主细胞的吸附来发挥抗病毒进入活性的机制[6]。
受到BA衍生物抗HIV及齐墩果酸衍生物抗HCV进入细胞活性的启发,我们推测五环三萜衍生物是否对其他的包膜病毒也具有抑制活性?通过对五环三萜化合物库的筛选,我们发现EA半乳糖苷8具有一定的抗流感病毒活性。基于此先导化合物构效关系的研究,发现了OA乙酰化半乳糖苷9具有较强的抑制流感病毒复制的活性(IC50= 14.2 μmol/L)[5]。综合运用加药时间点实验、血凝抑制实验及结合竞争实验发现化合物9可以阻碍流感病毒血凝素蛋白与细胞表面唾液酸受体的结合,进而发挥抗流感病毒进入细胞的活性。将化合物9半乳糖取代基的6位乙酰基替换为双吖丙啶基团,通过光照交联及蛋白质谱技术分析,发现了探针分子结合在血凝素蛋白上的HR2结构域,因此化合物9很有可能是通过同时抑制流感病毒的吸附和融合来发挥其抗病毒进入的活性[4]。类似的,通过对五环三萜化合物库抗埃博拉假病毒抑制活性的筛选,发现C-3及C-16氧化、C-28乙酰化半乳糖基修饰的刺囊酸衍生物10显示出了较强抗埃博拉病毒(Ebola virus,EBOV)进入的活性(IC50= 59.2 nmol/L),进一步在HeLa细胞上对活病毒的抑制活性(IC50)达到460 nmol/L,与Nature期刊发表的小分子抑制剂活性相当[23]。基于化合物10结构的探针分子可与埃博拉病毒GP膜蛋白的627位异亮氨酸发生共价结合,该结合位点同样位于GP蛋白的HR2结构域[4]。
由此可以看出,病毒膜蛋白HR2结构域天然的疏水性、长链的α螺旋结构与五环三萜疏水性、刚性骨架相匹配,实现五环三萜衍生物对多种包膜病毒HR2结构域的结合,从而产生广谱的抗病毒进入的活性。鉴于Ⅰ型包膜病毒大都具有相似的结构基础,因此五环三萜类化合物具有十分广阔的抗包膜病毒进入细胞的应用前景。
2. 作用于病毒复制阶段的五环三萜类PROTAC分子
传统的抗流感病毒药物(如金刚烷胺、奥司他韦等)通过竞争性结合在病毒蛋白的活性口袋而发挥抑制功能,然而因结合诱发突变带来的耐药性一直困扰着抗病毒新药的发现,因此发展作用模式多样的抗病毒药物是未来的研究方向之一[24-25]。PROTAC技术利用具有双结合能力的分子,将靶标蛋白和细胞内E3泛素连接酶拉近,从而实现靶蛋白的泛素化降解,由于其不需要结合在蛋白的活性口袋,并且与靶蛋白位点占据相比,靶蛋白降解对蛋白功能的抑制更加彻底,因此,有望解决目前抗流感药物的耐药性问题和抑制不可成药蛋白的功能问题[26-28]。
在对五环三萜抗流感病毒进入构效关系的研究过程中,我们发现OA乙酰化半乳糖苷9抑制率较强,然而不含乙酰半乳糖修饰的骨架分子OA虽然在50 μmol/L下对流感病毒没有抑制活性,但仍然表现出了对血凝素蛋白具有较好的结合能力(KD= 34 μmol/L),与活性分子9的结合能力相差大约6倍(KD= 6 μmol/L),这提示两种分子在血凝素HA蛋白上的结合位点可能不同[5]。利用分子量更小、氢键受体给体更少但保留了对HA具有结合力的OA分子,如果能够实现细胞内的子代蛋白降解将可极大拓展五环三萜抗病毒的新的机制和应用。首先在齐墩果酸分子C-28位引入含有1~10个不同乙二醇长度的连接臂,然后分别与CRBN和VHL两种E3连接酶小分子配体进行偶联,即可得到两种系列的五环三萜PROTAC分子[7]。两种系列的分子保留了对血凝素靶蛋白和E3连接酶的结合能力,分子和细胞水平对血凝素的降解实验发现VHL系列活性较强,其中V3(11)分子的降解血凝素的效果明显(DC50= 1.44 μmol/L),选择指数高。综合运用免疫共沉淀、蛋白酶体抑制和VHL酶敲除等实验确证了该系列PROTAC分子降解血凝素蛋白依赖于蛋白酶体-E3连接酶途径。进一步运用光交联探针及蛋白质谱技术发现了齐墩果酸分子可与血凝素蛋白的Asn15、Asn27以及Thr31附近的非功能区的保守位点结合,这一发现扩展了五环三萜类分子和病毒包膜蛋白潜在的结合作用,同时解释了齐墩果酸分子为何可与血凝素蛋白结合却不具备抗病毒进入的活性。V3对A/WSN/33(H1N1)、A/California/08/2009(H1N1)病毒的EC50约为5 μmol/L,而对结合位点附近存在N56Q、A58E突变的A/Aichi/2/68(H3N2)毒株同样具有明显的抑制活性(EC50= 8.98 μmol/L),提示了该类PROTAC分子可以一定程度上抵抗耐药病毒突变。体内药物代谢动力学实验显示V3具有一定的口服生物利用度(6.84%); 静脉注射20 mg/kg可以有效保护小鼠体质量下降,同时可降低病毒感染的死亡率。该研究结果[7]将抗病毒抑制剂拓展到了不具备功能抑制活性的五环三萜母核,同时将五环三萜抗病毒作用的应用场景由细胞外抗病毒进入拓展到细胞内抗病毒复制,对于进一步开发五环三萜天然产物的药用价值,发现新作用机制的抗病毒药物具有重要意义。
3. 作用于病毒释放阶段的五环三萜类抑制剂
包膜病毒的成熟和出芽由病毒跨膜蛋白和病毒内部组分之间的相互作用驱动,例如HIV-1的Gag多聚蛋白经蛋白酶切割后才能产生成熟的子代病毒[28]。不同于其他靶向天门冬酰胺蛋白酶阻碍Gag-Pol多聚蛋白的切割,五环三萜类成熟抑制剂结合在多聚蛋白上的衣壳前体(capsid precursor,CA)——间隔肽(spacer peptide 1,SP1),从而阻碍蛋白酶对这一区域的切割[29]。
化合物bevirimat(12)属于第一代HIV-1成熟抑制剂,由BA的C-3位修饰羧酸获得,微晶电子衍射实验发现bevirimat可以结合在CA-SP1形成的六股螺旋之间,CA和SP1交界点的L363和M367形成的狭窄疏水孔道很好地容纳并结合了三萜骨架,而bevirimat的C-3位羧基与K359通过氢键相互作用增强了三萜小分子和蛋白的结合[30]。然而由于HIV-1病毒突变株(V362I,Q369H,V370A,V370M,T371A,V370Δ和T371Δ)的出现、高血浆蛋白结合率(99%)及三萜小分子的低水溶解性(< 1 mg/L)等限制了bevirimat的临床应用[31]。为了解决上述问题,Liu等[32]和Swidorski等[33]课题组设计了一系列C-3位芳基及杂环取代,同时在C-28以酰胺键等偶联烷烃二甲胺的衍生物,在一定程度上降低了其抗耐药,并可减少血浆结合率。在此基础上,第二代HIV-1成熟抑制剂BMS-955176(GSK-3532795,13)显示出了良好的药代动力学性质,并且对野生型和bevirimat耐药的HIV-1毒株也均有抑制活性,临床试验中可以减少患者血浆中病毒RNA含量[34-36]。
4. 总结与展望
五环三萜分子具有刚性和疏水的骨架结构,对HIV-1、HCV、IAV、EBOV等包膜病毒均具有抑制活性。从蛋白质-小分子作用模式上来看,五环三萜独特的药效团三维结构能与靶蛋白中疏水且狭长的口袋相互作用,如病毒膜蛋白HR2疏水域、HIV-1的CA-SP1疏水孔道等,通过不同的五环三萜母核骨架的微调来适应不同病毒的疏水性蛋白,同时辅以亲水基团(如糖基、羧基、二氧化硫代吗啉等)来增加氢键相互作用,从而实现对某一类蛋白的特异性结合,这或许也是其发挥其他抗炎、抗感染、抗肿瘤活性的结构基础; 而从作用场景而言,除了直接抑制靶蛋白的功能,通过与新的技术(如PROTAC等)的联用,可以进一步扩大五环三萜抗病毒的适用范围,扩展五环三萜类天然物的药用价值。
对于五环三萜未来的研究方向,主要包括以下几个方面: (1) 改善五环三萜的药代动力学。与剂量相关的低溶解度、有限的肠通透性和较差的口服生物利用度是阻碍三萜类候选抑制剂进一步进行药物开发的瓶颈。未来可以通过纳米乳液、脂质体、凝胶以及固体分散体等剂型来提高其溶解度、生物利用度,甚至口服生物利用度。(2)探索除了HR2以外的抗病毒进入作用机制。HCV的E2不同于EBOV、IAV和HIV-1的包膜蛋白,是一种Ⅱ类融合蛋白,不含HR1-HR2肽结构域,因此,三萜阻断HCV融合的机制不同于三萜阻断Ⅰ类融合蛋白的作用方式,在Ⅰ类融合以外的机制中发现和探索抑制性三萜衍生物将会有助于我们发现能抵抗更多类型病毒感染的五环三萜类抑制剂。(3)发现具有潜在抗冠状病毒感染的三萜类小分子抑制剂。冠状病毒的进入是由附着在细胞表面受体血管紧张素转换酶2 (angiotensin converting enzyme 2,ACE2)上的病毒刺突(spike,S)糖蛋白介导的,而S蛋白负责膜融合并且含有HR1-HR2结构域,因此,针对该位点有助于发现潜在的具有广谱抗冠状病毒的三萜类小分子抑制剂。
Biography
周德敏,天然药物及仿生药物国家重点实验室主任,北京大学药学院院长,北京大学宁波海洋药物研究院院长; 教育部长江学者、基金委员会创新群体/国家创新药物重大专项牵头科学家、科技部973首席科学家、“万人计划”科技创新领军人才。长期从事基于化学-生物学交叉的新药发现新技术、新方法研究,聚焦病毒动态修饰介导的免疫治疗和基因治疗新策略方向。曾担任美国化学会Mol Pharm期刊副主编、J Med Chem等期刊国际编委,获得药明康德生命化学研究奖杰出成就奖、国际疫苗学会年度突破论文。在Science、Sci Adv、PNAS等期刊发表论文百余篇,十多项专利进入开发阶段,疫苗研究成果获评“中国科学十大进展”
References
- 1.Ruzicka L. The isoprene rule and the biogenesis of terpenic compounds. Experientia. 1953;9(10):357–367. doi: 10.1007/BF02167631. [DOI] [PubMed] [Google Scholar]
- 2.Joshi RK. Role of natural products against microorganisms. Am J Clin Microbiol Antimicrob. 2018;1(1):1005. [Google Scholar]
- 3.Papadopoulou K, Melton RE, Leggett M, et al. Compromised disease resistance in saponin-deficient plants. Proc Natl Acad Sci USA. 1999;96(22):12923–12928. doi: 10.1073/pnas.96.22.12923. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Si L, Meng K, Tian Z, et al. Triterpenoids manipulate a broad range of virus-host fusion via wrapping the HR2 domain prevalent in viral envelopes. Sci Adv. 2018;4(11):eaau8408. doi: 10.1126/sciadv.aau8408. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Yu M, Si L, Wang Y, et al. Discovery of pentacyclic triterpenoids as potential entry inhibitors of influenza viruses. J Med Chem. 2014;57(23):10058–10071. doi: 10.1021/jm5014067. [DOI] [PubMed] [Google Scholar]
- 6.Yu F, Wang Q, Zhang Z, et al. Development of oleanane-type triterpenes as a new class of HCV entry inhibitors. J Med Chem. 2013;56(11):4300–4319. doi: 10.1021/jm301910a. [DOI] [PubMed] [Google Scholar]
- 7.Li H, Wang S, Ma W, et al. Discovery of pentacyclic triterpenoid PROTACs as a class of effective hemagglutinin protein degraders. J Med Chem. 2022;65(10):7154–7169. doi: 10.1021/acs.jmedchem.1c02013. [DOI] [PubMed] [Google Scholar]
- 8.DeJesus E, Harward S, Jewell RC, et al. A phase Ⅱ a study evaluating safety, pharmacokinetics, and antiviral activity of GSK2838232, a novel, second-generation maturation inhibitor, in participants with human immunodeficiency virus type 1 infection. Clin Infect Dis. 2020;71(5):1255–1262. doi: 10.1093/cid/ciz938. [DOI] [PubMed] [Google Scholar]
- 9.Margot NA, Gibbs CS, Miller MD. Phenotypic susceptibility to bevirimat in isolates from HIV-1-infected patients without prior exposure to bevirimat. Antimicrob Agents Chemother. 2010;54(6):2345–2353. doi: 10.1128/AAC.01784-09. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Vigant F, Santos NC, Lee B. Broad-spectrum antivirals against viral fusion. Nat Rev Microbiol. 2015;13(7):426–437. doi: 10.1038/nrmicro3475. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Harrison SC. Viral membrane fusion. Nat Struct Mol Biol. 2008;15(7):690–698. doi: 10.1038/nsmb.1456. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Rennie ML, Chaugule VK, Walden H. Modes of allosteric regulation of the ubiquitination machinery. Curr Opin Struct Biol. 2020;62:189–196. doi: 10.1016/j.sbi.2020.02.003. [DOI] [PubMed] [Google Scholar]
- 13.Weissenhorn W, Hinz A, Gaudin Y. Virus membrane fusion. FEBS Lett. 2007;581(11):2150–2155. doi: 10.1016/j.febslet.2007.01.093. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Russell RJ, Gamblin SJ, Haire LF, et al. H1 and H7 influenza haemagglutinin structures extend a structural classification of haemagglutinin subtypes. Virology. 2004;325(2):287–296. doi: 10.1016/j.virol.2004.04.040. [DOI] [PubMed] [Google Scholar]
- 15.Bressanelli S, Stiasny K, Allison SL, et al. Structure of a flavivirus envelope glycoprotein in its low-pH-induced membrane fusion conformation. Embo J. 2004;23(4):728–738. doi: 10.1038/sj.emboj.7600064. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Fujioka T, Kashiwada Y, Kilkuskie RE, et al. Anti-AIDS agents, 11. betulinic acid and platanic acid as anti-HIV principles from Syzigium claviflorum, and the anti-HIV activity of structurally related triterpenoids. J Nat Prod. 1994;57(2):243–247. doi: 10.1021/np50104a008. [DOI] [PubMed] [Google Scholar]
- 17.Evers M, Poujade C, Soler F, et al. Betulinic acid derivatives: a new class of human immunodeficiency virus type 1 specific inhibitors with a new mode of action. J Med Chem. 1996;39(5):1056–1068. doi: 10.1021/jm950670t. [DOI] [PubMed] [Google Scholar]
- 18.Kashiwada Y, Hashimoto F, Cosentino LM, et al. Betulinic acid and dihydrobetulinic acid derivatives as potent anti-HIV agents. J Med Chem. 1996;39(5):1016–1017. doi: 10.1021/jm950922q. [DOI] [PubMed] [Google Scholar]
- 19.Mayaux JF, Bousseau A, Pauwels R, et al. Triterpene derivatives that block entry of human immunodeficiency virus type 1 into cells. Proc Natl Acad Sci USA. 1994;91(9):3564–3568. doi: 10.1073/pnas.91.9.3564. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Dang Z, Lai W, Qian K, et al. Betulinic acid derivatives as human immunodeficiency virus type 2 (HIV-2) inhibitors. J Med Chem. 2009;52(23):7887–7891. doi: 10.1021/jm9004253. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Soler F, Poujade C, Evers M, et al. Betulinic acid derivatives: a new class of specific inhibitors of human immunodeficiency virus type 1 entry. J Med Chem. 1996;39(5):1069–1083. doi: 10.1021/jm950669u. [DOI] [PubMed] [Google Scholar]
- 22.Yang JP, Zhou D, Wong-Staal F. Screening of small-molecule compounds as inhibitors of HCV entry. Methods Mol Biol. 2009;510:295–304. doi: 10.1007/978-1-59745-394-3_22. [DOI] [PubMed] [Google Scholar]
- 23.Côté M, Misasi J, Ren T, et al. Small molecule inhibitors reveal Niemann-Pick C1 is essential for Ebola virus infection. Nature. 2011;477(7364):344–348. doi: 10.1038/nature10380. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Hu Y, Lu S, Song Z, et al. Association between adverse clinical outcome in human disease caused by novel influenza A H7N9 virus and sustained viral shedding and emergence of antiviral resistance. Lancet. 2013;381(9885):2273–2279. doi: 10.1016/S0140-6736(13)61125-3. [DOI] [PubMed] [Google Scholar]
- 25.Takashita E. Influenza polymerase inhibitors: mechanisms of action and resistance. Cold Spring Harb Perspect Med. 2021;11(5):a038687. doi: 10.1101/cshperspect.a038687. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Burslem GM, Crews CM. Proteolysis-targeting chimeras as therapeutics and tools for biological discovery. Cell. 2020;181(1):102–114. doi: 10.1016/j.cell.2019.11.031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Chamberlain PP, Hamann LG. Development of targeted protein degradation therapeutics. Nat Chem Biol. 2019;15(10):937–944. doi: 10.1038/s41589-019-0362-y. [DOI] [PubMed] [Google Scholar]
- 28.Bushweller JH. Targeting transcription factors in cancer: from undruggable to reality. Nat Rev Cancer. 2019;19(11):611–624. doi: 10.1038/s41568-019-0196-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Li F, Goila-Gaur R, Salzwedel K, et al. PA-457: a potent HIV inhibitor that disrupts core condensation by targeting a late step in Gag processing. Proc Natl Acad Sci USA. 2003;100(23):13555–13560. doi: 10.1073/pnas.2234683100. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Purdy MD, Shi D, Chrustowicz J, et al. MicroED structures of HIV-1 Gag CTD-SP1 reveal binding interactions with the maturation inhibitor bevi-rimat. Proc Natl Acad Sci USA. 2018;115(52):13258–13263. doi: 10.1073/pnas.1806806115. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Jacob J, Richards J, Augustine J, et al. Liquid bevirimat dosage forms for oral administration: WO2009042166A1[P/OL]. 2010-08-26[2022-08-20]. https://patents.google.com/patent/WO2009042166A1/en?oq=WO2009042166A1.
- 32.Liu Z, Swidorski JJ, Nowicka-Sans B, et al. C-3 benzoic acid derivatives of C-3 deoxybetulinic acid and deoxybetulin as HIV-1 maturation inhibitors. Bioorg Med Chem. 2016;24(8):1757–1770. doi: 10.1016/j.bmc.2016.03.001. [DOI] [PubMed] [Google Scholar]
- 33.Swidorski JJ, Liu Z, Sit SY, et al. Inhibitors of HIV-1 maturation: development of structure-activity relationship for C-28 amides based on C-3 benzoic acid-modified triterpenoids. Bioorg Med Chem Lett. 2016;26(8):1925–1930. doi: 10.1016/j.bmcl.2016.03.019. [DOI] [PubMed] [Google Scholar]
- 34.Regueiro-Ren A, Dicker IB, Hanumegowda U, et al. Second generation inhibitors of HIV-1 maturation. ACS Med Chem Lett. 2019;10(3):287–294. doi: 10.1021/acsmedchemlett.8b00656. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Regueiro-Ren A, Liu Z, Chen Y, et al. Discovery of BMS-955176, a second generation HIV-1 maturation inhibitor with broad spectrum antiviral activity. ACS Med Chem Lett. 2016;7(6):568–572. doi: 10.1021/acsmedchemlett.6b00010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Hwang C, Schürmann D, Sobotha C, et al. Antiviral activity, safety, and exposure-response relationships of GSK3532795, a second-generation human immunodeficiency virus type 1 maturation inhibitor, administered as monotherapy or in combination with atazanavir with or without ritonavir in a phase 2a randomized, dose-ranging, controlled trial (AI468002) Clin Infect Dis. 2017;65(3):442–452. doi: 10.1093/cid/cix239. [DOI] [PMC free article] [PubMed] [Google Scholar]