Abstract
담도폐쇄증은 신생아 담즙 정체의 드물지만 중요한 원인이다. 적절한 치료와 예후를 위해서는 정확한 조기 진단이 중요하다. 본 종설에서는 초음파 검사, MRI, 간담도 핵의학스캔, 담관조영술 등의 영상 검사에서 담도폐쇄증의 영상 소견을 검토하였다. 지금까지 알려진 주요 영상의학적 소견들은 담낭의 비정상적인 모양과 크기, 간문맥 주변의 비후를 나타내는 ‘triangular cord’ sign, 총담관이 보이지 않고, 간동맥 혈류가 증가하는 소견 등과 함께 동반된 기형의 유무들을 보이는 것이다. 담도폐쇄증의 진단을 위해 초음파 검사, MRI, 간담도 핵의학스캔, 담관조영술 등의 여러 영상 검사들을 시행하며, 1차 영상 검사로 초음파 검사가 중요하다. 본 종설에서는 각 영상 검사들에서 지금까지 알려진 담도폐쇄증의 소견들과 함께 조기 신생아기에서 담도폐쇄증 진단의 어려움, 그리고 간 섬유화를 예측하기 위한 영상의 역할도 검토하였다. 본 종설이 담도폐쇄증 진단에 도움이 되길 바란다.
Keywords: Biliary Atresia, Ultrasonography, Magnetic Resonance Imaging, Cholangiography
Abstract
Biliary atresia is a rare but significant cause of neonatal cholestasis. An early and accurate diagnosis is important for proper management and prognosis. To diagnose biliary atresia, various imaging studies using ultrasonography, MRI, hepatobiliary scans, and cholangiography can be performed, although ultrasonography is more important for initial imaging studies. In this article, we review the findings of biliary atresia from various imaging modalities, including ultrasonography, MRI, hepatobiliary scans, and cholangiography. The known key imaging features include abnormal gallbladder size and shape, periportal thickening visible as a ‘triangular cord’ sign, invisible common bile duct, increased hepatic arterial flow, and combined anomalies. Aside from the imaging findings of biliary atresia, we also reviewed the diagnostic difficulty in the early neonatal period and the role of imaging in predicting hepatic fibrosis. We hope that this review will aid in the diagnosis of biliary atresia.
서론
생후 4주 이후까지 황달이 지속되는 경우 무담즙변(acholic stool)과 결합형 고빌리루빈혈증 등이 나타날 수 있고, 이러한 경우 신생아 간염과 담도폐쇄증이 가장 흔한 원인으로 알려져 있다. 담도폐쇄증은 진행성 섬유화 및 간외 및 간내 담관의 소멸을 유발하여 조기 수술을 하지 않는 경우 담관간경화로 진행한다. 따라서 이 질환을 조기에 발견하고 Kasai portoenterostomy로 담즙 배출을 유도하여 간 손상을 막아야 하므로, 정확하고 신속한 진단은 치료와 예후 결정에 매우 중요하다. 이 질환을 진단하기 위해 영상 검사에서는 담낭의 형태와 기능, 간외 담관의 개존 유무, 간문부에 남아있는 섬유화된 담도잔여물(fibrous ductal remnant), 그리고 동반 기형 유무를 확인한다. 이러한 진단을 위한 영상의학적 검사에는 초음파 검사, MR 담관조영술(MR cholangiopancreatography; 이하 MRCP), 간담도 핵의학스캔, 그리고 담관조영술이 포함되며, 초음파 검사가 1차 영상 검사로 매우 중요하다.
본 종설에서는 이러한 다양한 영상 검사에서 전형적인 담도폐쇄증의 소견을 알아보고자 한다. 또한 조기 신생아에서는 전형적인 소견이 보이지 않을 수 있어 이에 대해 간략히 알아보고, 담도폐쇄증 수술 전 간섬유화 예측에서의 영상의 역할도 검토해 보고자 한다.
담도폐쇄증의 초음파 검사 소견
초음파 검사는 담낭을 비롯한 간외 담관의 이상 소견을 실시간으로 잘 보여줄 수 있어 담도폐쇄증의 진단에 매우 중요한 검사이다. 정확한 진단을 위해서는 4시간 이상의 금식이 필요하며, 검사 부위에 따라 영유아용의 작은 볼록형 탐촉자(convex probe)와 고주파수의 선형 탐촉자(linear probe)를 적절히 사용하는 것이 필요하다. 영유아에서 정상 담낭은 타원형으로 관찰되며, 길이가 1.5–3 cm로 측정되고(1), 매끈한 점막을 가지며, 수유 후 수축 소견을 보인다. 정상 총담관은 신생아의 경우 1 mm 미만, 1세까지 영아의 경우 2 mm 미만으로 측정된다.
증후군성 담도폐쇄증은 다비장증 또는 무비장, 혈관 이상(십이지장 전 간문맥 등), 역위증, 심장 이상 등을 포함한 일련의 특이한 이상 징후를 가진다(2). 담도폐쇄증은 담관의 폐쇄 부위 및 낭종의 존재 유무에 따라 다양한 아형이 존재하므로 영상 검사도 다양하게 보일 수 있다. 전형적인 담도폐쇄증 환자에서 간문부에 남아 있는 폐쇄된 간외 담관은 삼각형 깔때기 모양의 섬유조직으로 관찰되며 이는 섬유화된 담도잔여물로, 초음파 검사상 ‘triangular cord’ sign (이하 TC sign)으로 알려져 있다. 종축스캔에서는 우간문맥의 앞쪽 벽을 따라 4 mm 이상의 고에코성의 띠로, 횡축스캔에서 양쪽 간문맥 사이에서 삼각형의 고에코성 병변으로 나타난다(Figs. 1, 2) (3). 담낭은 내강이 보이지 않거나, 작은 담낭(< 15 mm), 불규칙한 모양으로 보이고, 내강이 보이더라도 내벽이 불규칙하게 관찰된다. 또한 정상 담낭의 모양을 보일 수도 있으나, 수유 후 정상적인 수축 반응이 보이지 않는다. 영상 검사에서 간외 담관의 부재는 담도폐쇄증을 시사하는 소견이지만, 정상 신생아에서 초음파 검사상 간외 담관이 잘 안 보일 수 있고, 담도폐쇄증의 아형에 따라 일부 간외 담관이 보일 수도 있어 진단에 어려움이 있다(Fig. 3) (4,5). 그 외 간외 담관이 낭의 형태라면 간문부에 낭종으로 관찰되는데 이는 총담관낭과의 감별을 요하는 소견으로 낭종의 크기가 작고(≤ 22 mm), TC sign, 불규칙한 담낭 점막, 총담관의 부재가 함께 보인다면 담도폐쇄증을 더 시사한다(6,7). 그외 동반한 소견으로는 간 동맥의 크기가 1.5 mm보다 증가하거나(8), 간 피막하 혈류가 증가할 수 있다(9). 한 메타분석 연구에서 담도폐쇄증 진단을 위한 16개의 초음파 검사 연구(1135명 환자 포함)를 분석하여 74.9% (범위: 70.4%–79.1%)의 민감도, 93.4% (범위: 91.4%–95.1%)의 특이도, 72.56 (범위: 27.34–192.58)의 진단 오즈비를 보고했다(Table 1) (10).
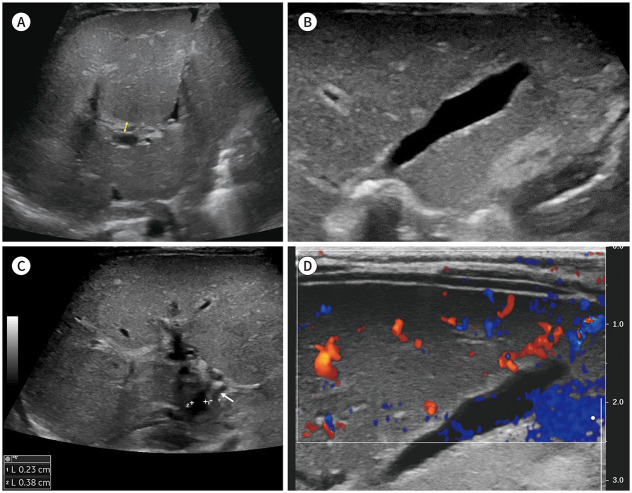
Fig. 1. US of biliary atresia in a 9-week-old infant.
A. Longitudinal US image shows a TC sign as a hyperechoic area (double arrow) measured against the anterior wall of the anterior branch of the right portal vein, including the right hepatic artery.
B. Oblique US image shows a normal-sized gallbladder with lobular contour and irregular echogenic mucosal lining.
C. Transverse US image shows a relatively enlarged hepatic artery (arrow; 2.3 mm) and periportal echogenic thickening (TC sign at axial image).
D. Oblique color Doppler US shows subcapsular hepatic arterial flow extending to the hepatic surface.
TC = triangular cord, US = ultrasonography
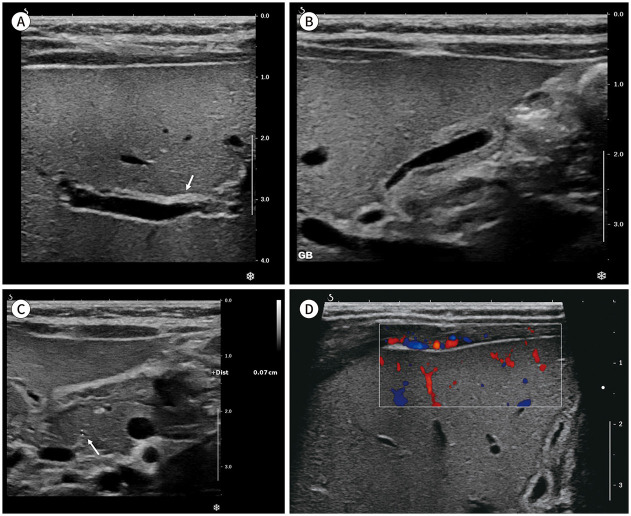
Fig. 2. US of neonatal hepatitis in a 3-month-old infant.
A. Transverse US image shows minimal periportal echogenic thickening (arrow) along the anterior wall of the anterior branch of the right portal vein.
B. Oblique US image shows a partially collapsed gallbladder with mild wall thickening due to submucosal edema with smooth inner mucosal lining.
C. Transverse US image shows visualization of distal common bile duct (arrow) at the level of the pancreas head.
D. Oblique color Doppler US shows no subcapsular hepatic arterial flow.
US = ultrasonography
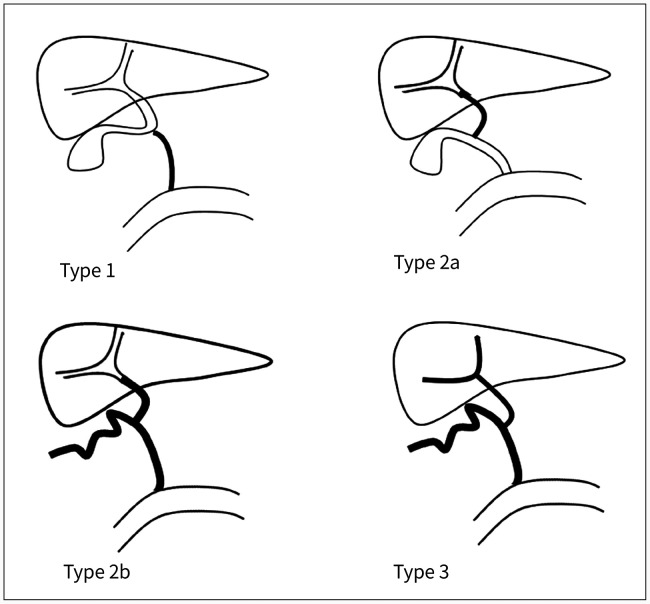
Fig. 3. Schematic diagram of the types of biliary atresia, depicting the types of extrahepatic biliary atresia, based on a classification established by Kasai.
Type 1: Occlusion of the common bile duct without cystic duct involvement. Type 2a: Obliteration of the common hepatic duct. Type 2b: Obliteration of the common bile duct, cystic duct, and hepatic duct with retained patency at portal hepatis. Type 3: Obliteration of the common bile duct, cystic duct, and hepatic duct up to the porta hepatis.
Table 1. Diagnostic Performance of Various Imaging Modalities for Biliary Atresia.
| Sensitivity (%) (95% CI) | Specificity (%) (95% CI) | Odds Ratio (95% CI) | |
|---|---|---|---|
| Ultrasonography | 74.9 (70.4–79.1) | 93.4 (91.4–95.1) | 72.56 (27.3–192.58) |
| MR cholangiopancreatography | 89.7 (84.8–93.4) | 64.7 (58.0–71.0) | 32.48 (8.22–128.29) |
| Hepatobiliary scan | 99.3 (98.3–99.8) | 75.1 (72.2–77.9) | 60.1 (31.6–114.3) |
최근 간 탄성도 검사가 담도폐쇄증 진단에 도입되고 있으며, 다른 황달의 원인이 있는 환아들과 비교하였을 때 담도 폐쇄가 있는 환아에서 간 탄성도가 유의하게 높았다(11,12). 하지만 두 군 간의 값의 중첩도 관찰되므로, 정상값이 담도폐쇄증을 배제할 수는 없으며, 회색조 초음파 검사 영상과 함께 사용했을 때 진단능이 증가하여, 담도폐쇄증의 진단에 도움이 될 것으로 생각된다(13).
담도폐쇄증의 MRI 소견
MR 담관조영술(MRCP)을 포함한 MRI는 소아에서 진정 마취가 필요할 수 있고, 초음파 검사보다 비용효율면에서 떨어져 초음파 검사만큼 많이 사용되지는 않는다(14). 하지만 초음파 검사에 MRCP를 추가하여 보면 진단능을 높일 수 있어(15), 초음파 검사 결과가 명확하지 않을 때 도움을 받을 수 있다. 단, 3개월 이내 영아에서는 정상에서도 담도가 약 반수(62.5%)에서 잘 보이지 않을 수 있어(16), MRCP를 이용한 담도폐쇄증 진단에 주의가 필요하다.
MRI에서는 초음파 검사와 마찬가지로 간외 담관이 보이지 않고, 비정상적인 담낭의 모양을 확인할 수 있으며, 간문맥 주변의 T2 고신호강도와 비후를 확인할 수 있다(Figs. 4, 5) (17,18). 또한 MRI에서도 초음파 검사처럼 TC sign 두께를 측정할 수 있는데, 초음파 검사에서는 우측 간문맥 앞에서 측정하는 것과 달리, MRI에서는 T2 축상면 영상에서 가장 두꺼운 부분을 측정하게 되며, 5.1 mm 이상의 두께는 담도폐쇄증을 의심할 수 있다(19). 이전에 메타분석 연구에서 담도폐쇄증 진단을 위한 7개의 MRCP 연구(연령 범위: 1–15일)는 89.7% (범위: 84.8%–93.4%)의 민감도, 64.7% (범위: 58.0%–71.0%)의 특이도, 32.48 (범위: 8.22–128.29)의 진단 오즈비를 보고했다(10). 간 MRI의 확산 강조 영상 또는 확산 텐서 영상도 담도폐쇄증 진단에 도움이 될 수 있다(20,21,22).
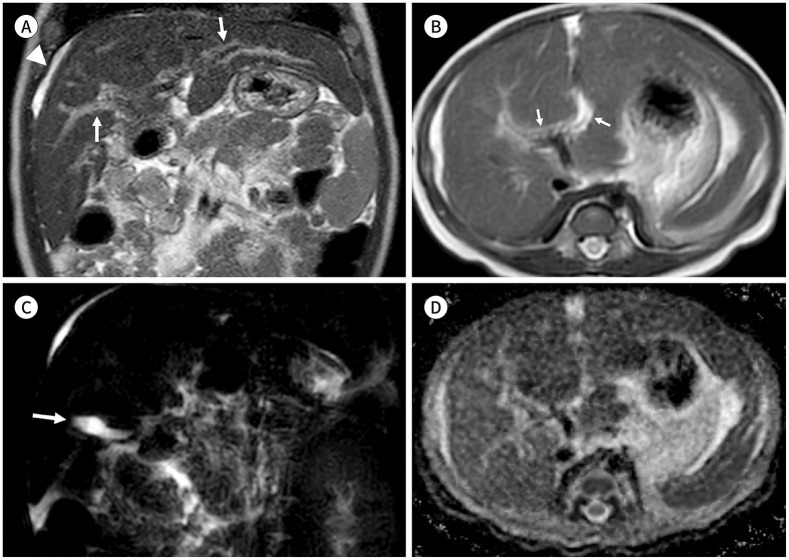
Fig. 4. MRI of biliary atresia in a 9-week-old infant.
A, B. T2-weighted (A) coronal and (B) axial images show diffuse periportal thickening (arrows) as high signal intensity and small perihepatic ascites (arrowhead).
C. Three-dimensional MR cholangiopancreatography shows tubular gallbladder (arrow) without visible intra- and extrahepatic bile ducts.
D. The ADC map of the liver shows a decreased ADC value of 0.860 × 10-3 mm2/s in this patient.
ADC = apparent diffusion coefficient
Fig. 5. MRI findings in a 5-week-old infant with Alagille syndrome.
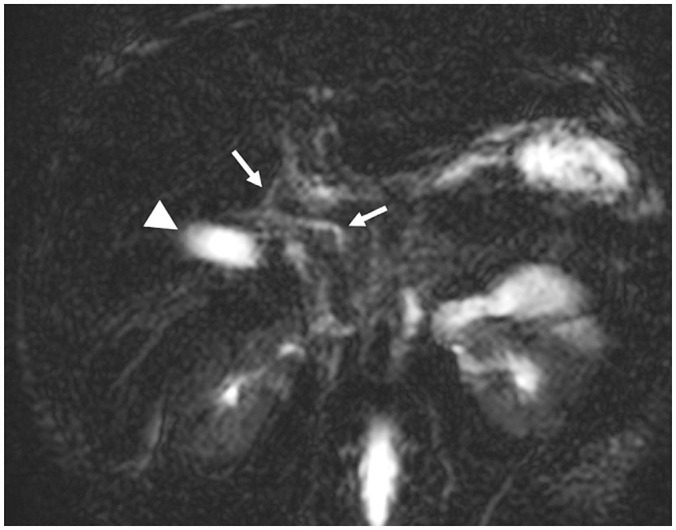
Three-dimensional MR cholangiopancreatography demonstrates a grossly normal gallbladder (arrowhead) and intra- and extrahepatic bile ducts (arrows). The girl was diagnosed with Alagille syndrome.
담도폐쇄증의 핵의학 검사
간담도 핵의학스캔에서 24시간 지연영상까지 담즙이 소장 내로 집적되지 않으면 담도폐쇄증을 시사하는 소견이 될 수 있다(Fig. 6). 하지만, 심한 신생아 간염, 미숙아, 경정맥 영양을 실시하는 환아에서도 담즙 배출이 지연될 수 있다. 또한 신장계로 배설되는 방사능 추적자를 장으로 통과하는 것으로 오인하지 않는 것이 중요하다(17).
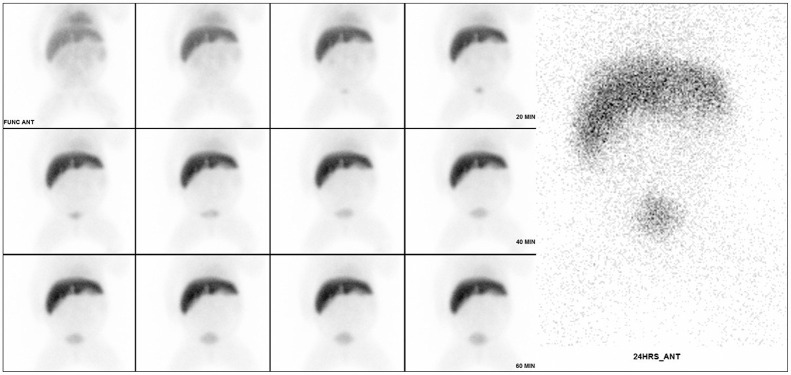
Fig. 6. Hepatobiliary scintigraphy of biliary atresia in a 9-week-old infant.
Hepatobiliary scintigraphy shows retention of the tracer within the liver parenchyma and no visible tracer excretion into the gallbladder, extrahepatic bile ducts, and intestine.
담도폐쇄증 진단에 있어 간담도 핵의학스캔은 높은 민감도를 가지나 특이도는 낮아, 이전처럼 검사가 많이 진행되지는 않는다. 이전 메타분석 연구에서 담도폐쇄증 진단을 위한 81개의 핵의학 연구(연령 범위: 4–180일)는 99.3% (범위: 98.3%–99.8%)의 민감도, 75.1% (범위: 72.2%–77.9%)의 특이도, 60.1 (범위: 31.6–114.3)의 진단 오즈비를 보고했다(23).
수술 중 담관조영술
수술 중 담관조영술(operative cholangiography)은 담도폐쇄증 진단을 위한 참조표준이다. 이는 개복술 또는 경피적으로 수행될 수 있다. 가능하면 조영제를 담낭에 주사하여 담낭의 모양과 담도의 조영 유무를 확인한다. 정상적으로는 담낭과 총담관이 조영되면서 조영제가 십이지장으로 배출되고, 위로 총간관을 통해 간내 담도도 정상적으로 조영된다(17). 담도폐쇄증을 시사하는 소견으로는 담낭 내강이 작거나 없는 경우, 그리고 조영제가 전체 담관을 조영시키지 못하고 소장으로 넘어가지 못하는 것이다(Fig. 7) (19). 담도폐쇄증의 아형에 따라 조영되는 담도 부위가 다를 수 있다. 최근에는 초음파 조영제를 이용한 피부경유 경담낭 담관조영술도 소개되었다(24). 이 연구에서는 담낭이 1.5 cm 이상이고 초음파 검사 소견에서 담도폐쇄증이 명확하지 않은 경우에 검사를 시행하였으며, 조영제 주입이 가능한 담낭이 있는 경우에는 100%의 민감도와 특이도를 보였다. 내시경 역행성 담관조영술도 담도폐쇄증 진단을 위해 사용될 수 있다(17,25).
Fig. 7. Operative cholangiography of biliary atresia in a 9-week-old infant.
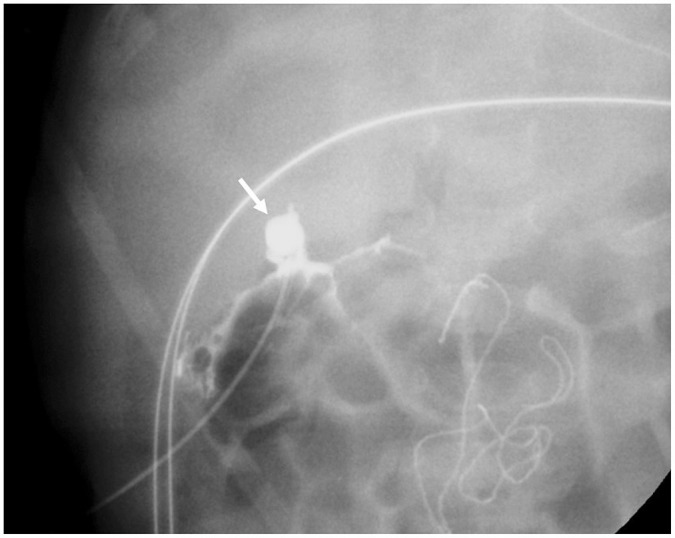
Operative cholangiography shows a small, irregular gallbladder (arrow) and contrast leakage without visible intra- or extrahepatic bile ducts or contrast excretion to the duodenum.
조기 신생아에서 담도폐쇄증 진단
신생아에서는 일반적으로 알려진 담도폐쇄증의 초음파 검사 소견이 나타나지 않는 경우가 많아 나이가 어릴수록 진단의 민감도가 낮다(26,27). 담도폐쇄증에 높은 특이도를 보이는 초음파 검사 소견인 TC sign의 경우에도 생후 30일 이전 신생아 때에는 잘 보이지 않을 수 있고(17%), TC sign이 보이더라도 두께가 적게 측정되었다(27). 초기 단계의 담도폐쇄증의 경우 간문맥 주변부 섬유화가 충분히 발달되기 전이기 때문에 fibrotic ductal remnant를 보는 TC sign이 잘 나타나지 않는 것으로 생각된다.
담낭의 이상은 신생아에서도 많이 관찰되었으며(92%), 담낭벽의 불규칙한 모양(91%)이 제일 특이도가 높은 소견이었고, 그 외로 작은 담낭(73%), 담낭이 보이지 않는 경우(8%) 등이 나타났다(27,28). 간동맥이 늘어난 경우는 약 25%에서 보였고, 평균 직경은 1.2 ± 0.4 mm로 1.5 mm보다 작은 경우도 많았다. 이는 간동맥의 직경 증가가 간문맥 주변부 염증섬유화 반응이 계속되며 진행되는 담관간경화(biliary cirrhosis)를 보상하기 위한 변화이기 때문으로 생각된다(8,27,29). 문맥 고혈압을 나타내는 비장비대나 복수도 적었다(Fig. 8). 하지만, 조기 신생아 시기에 담도폐쇄증의 초음파 검사 소견이 보이지 않더라도, 약 2–4주 간격으로 추가적인 초음파 검사를 시행하였을 때 이전엔 보이지 않던 TC sign (29%), 간동맥 직경증가(20%), 비장비대(38%)가 생긴 것이 확인되었다(27). 따라서, 환아가 고빌리루빈혈증이 있으면서 담낭의 이상 소견이 있을 경우, 초음파 검사를 약 2–4주 후 다시 촬영하여 담도폐쇄증의 소견이 새롭게 나타나지는 않는지 확인하는 것이 담도폐쇄증의 진단을 높이는 방법이다.
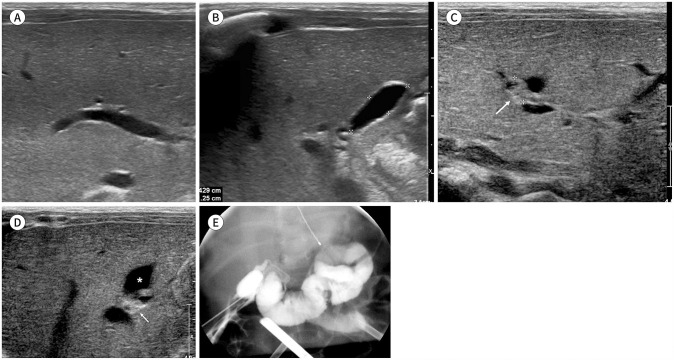
Fig. 8. Serial US findings of biliary atresia (type 2a) in a neonate.
A, B. On the 12th day after birth, US shows (A) minimal periportal thickening and (B) a small gallbladder (length: 1.3 cm).
C, D. On the 28th day after birth, follow-up (C) transverse and (D) oblique US images show a positive TC sign (arrows) and small gallbladder lumen (asterisk). There was no splenomegaly, and the mean liver elasticity was 5.4 kPa (the image is not shown).
E. Operative cholangiography shows a small gallbladder and common bile duct without visible common and intrahepatic bile ducts.
US = ultrasonography
담도폐쇄증 환아에서 Kasai Portoenterostomy 전 간 섬유화 병기 단계의 예측
담도폐쇄증은 빠른 진단과 수술적 치료에도 불구하고 담즙 정체가 해소되지 않을 수 있고, 담관간경화로 진행하게 되면 결국 간이식을 필요로 하게 된다(5,30). Kasai portoenterostomy 이후 간 섬유화 정도에 대해서는 여러 보고들이 있는데, 간 섬유화 정도는 담도폐쇄증 환아의 독립적인 생존 예측인자로, 간 섬유화가 심한 영아에서는 Kasai portoenterostomy 시행 연령과 상관없이 전체 생존기간(overall survival)이 유의하게 짧았다(30). 따라서, 담도폐쇄증 환아에서 수술 전 및 수술 후 추적 검사에서 간 섬유화 정도를 평가하는 것은 예후를 예측하고 궁극적으로 치료 계획을 결정하는 데 중요한 요소가 될 수 있다.
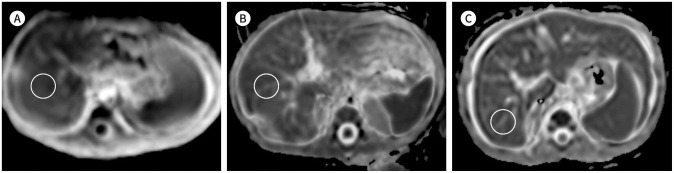
간 섬유화의 병기 단계를 평가하는 데 있어 표준은 간 조직 생검을 통한 병리 진단이지만 영상을 통해 간 섬유화를 예측하는 비침습적인 방법도 많은 연구가 진행되어 왔으며 그중 하나가 MRI를 이용하는 방법이다. 이는 초음파 검사에 비해 공간해상도는 떨어지지만 높은 작업자 독립성, 재현성 및 넓은 시야를 제공한다(31). 초음파 검사에서처럼 triangular cord thickness (이하 TCT)로 측정되는 간문맥 섬유화 종괴는 담도폐쇄증 환아에서 연령과 두께 간에 양의 상관관계를 보여 담도의 섬유화 폐쇄의 진행 및 진행성 섬유화를 의미하는 것으로 생각된다(Fig. 9) (19). 또한 연령에 의한 영향을 배제하고도 담즙 정체가 있는 환아들에서 간 섬유화의 병기 단계와 MR-TCT간 유의한 양의 상관관계가 있음이 보고되었다(32).
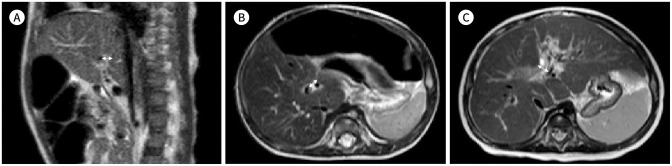
Fig. 9. Examples of MR TCT measured in three patients with or without biliary atresia, with histologic grades of hepatic fibrosis derived from intraoperative or percutaneous biopsy.
A. MR-TCT (double arrow) in a 12-week-old boy diagnosed with non-syndromic paucity of intrahepatic bile duct measures 3.1 mm on the sagittal T2-weighted image, and the fibrosis grade was 0.
B. MR-TCT (double arrow) in a 9-week-old boy diagnosed with biliary atresia measures 5.3 mm on the axial T2-weighted image, and the fibrosis grade was 2.
C. MR-TCT (double arrow) in a 4-month-old girl diagnosed with biliary atresia measures 9.2 mm on the axial T2-weighted image, and the fibrosis grade was 4.
TCT = triangular cord thickness
확산강조 자기공명영상(diffusion weighted image) 또한 간 섬유화와 관련된 영상의 정량적 평가방법이다(33). 담도폐쇄증이 있는 경우 신생아 간염 등 담즙 정체가 있는 대조군에 비해 유의하게 낮은 현성 확산 계수(apparent diffusion coefficient)를 보인다(Fig. 10) (20,34,35). 성인 만성간질환 환자에서 간 섬유화가 진행됨에 따라 현성 확산 계수 값이 낮아짐을 이용하여 간 섬유화의 병기 단계를 예측할 수 있다(36,37). 마찬가지로 담도폐쇄증 환아들에서도 간 섬유화의 병기 단계와 현성 확산 계수 간에 유의한 음의 상관관계가 있었다(21,22).
Fig. 10. Examples of ADC measurement in three patients diagnosed with biliary atresia.
A. In a 6-week-old girl, the ADC value in the right hepatic lobe measures 1.190 × 10-3 mm2/s, and the fibrosis grade was 0.
B. In another 6-week-old girl, the ADC value in the right hepatic lobe measures 1.038 × 10-3 mm2/s, and the fibrosis grade was 2.
C. In a third 6-week-old girl, the ADC value in the right hepatic lobe measures 0.867 × 10-3 mm2/s, and the fibrosis grade was 4.
ADC = apparent diffusion coefficient
이렇듯 담도폐쇄증 환아의 수술 전 간 섬유화 병기 단계를 예측하는 데 있어 MR-TCT와 확산강조 자기공명영상과 같은 방법이 도움이 될 수 있으며 앞으로 더 많은 환아들을 대상으로 한 연구가 필요할 것이다.
간 탄성도 검사를 이용한 수술 전 간 섬유화 병기 예측 관련하여서는 현재까지 한 개의 논문만 발표되었으며(38), 이에 대해서도 추가 연구가 필요하다.
결론
본 종설에서는 담도폐쇄증 진단의 특징적인 영상 소견을 영상 검사별로 알아보고, 조기 신생아의 진단과 간 섬유증 예측에 대해 알아보았다. 모든 담도폐쇄증 환자들이 전형적인 소견을 보이지는 않지만, 담도폐쇄증을 의심할 수 있는 소견들을 알고, 이 조합으로 진단 정확도를 높일 수 있으며, 여러 영상 검사의 소견을 종합하여 보다 정확한 진단을 할 수 있을 것이다. 또한 조기 신생아의 경우 전형적인 소견을 보이지 않을 수 있으므로, 임상 증상과 영상 소견이 일치하지 않을 경우의 심하고 추적하는 것이 중요하겠다. 보다 정확한 진단과 간 섬유화 예측을 위해서는 앞으로도 많은 연구가 필요할 것으로 생각된다.
Footnotes
- Conceptualization, L.M., Y.H.
- data curation, all authors.
- formal analysis, all authors.
- funding acquistion, L.M.
- investigation, L.M., K.J.
- methodology, all authors.
- project administration, L.M.
- resources, L.M.
- software, L.M.
- supervision, L.M.
- validation, L.M., Y.H., K.J.
- visualization, all authors.
- writing—original draft, all authors.
- writing—review & editing, all authors.
Conflicts of Interest: Mi-Jung Lee has been a Section Editor of the Journal of the Korean Society of Radiology since 2022; however, she was not involved in the peer reviewer selection, evaluation, or decision process of this article. Otherwise, no other potential conflicts of interest relevant to this article were reported.
Funding: None
References
- 1.Gubernick JA, Rosenberg HK, Ilaslan H, Kessler A. US approach to jaundice in infants and children. Radiographics. 2000;20:173–195. doi: 10.1148/radiographics.20.1.g00ja25173. [DOI] [PubMed] [Google Scholar]
- 2.Lakshminarayanan B, Davenport M. Biliary atresia: a comprehensive review. J Autoimmun. 2016;73:1–9. doi: 10.1016/j.jaut.2016.06.005. [DOI] [PubMed] [Google Scholar]
- 3.Lee HJ, Lee SM, Park WH, Choi SO. Objective criteria of triangular cord sign in biliary atresia on US scans. Radiology. 2003;229:395–400. doi: 10.1148/radiol.292020472. [DOI] [PubMed] [Google Scholar]
- 4.Napolitano M, Franchi-Abella S, Damasio MB, Augdal TA, Avni FE, Bruno C, et al. Practical approach to imaging diagnosis of biliary atresia, part 1: prenatal ultrasound and magnetic resonance imaging, and postnatal ultrasound. Pediatr Radiol. 2021;51:314–331. doi: 10.1007/s00247-020-04840-9. [DOI] [PubMed] [Google Scholar]
- 5.Hartley JL, Davenport M, Kelly DA. Biliary atresia. Lancet. 2009;374:1704–1713. doi: 10.1016/S0140-6736(09)60946-6. [DOI] [PubMed] [Google Scholar]
- 6.Kim WS, Kim IO, Yeon KM, Park KW, Seo JK, Kim CJ. Choledochal cyst with or without biliary atresia in neonates and young infants: US differentiation. Radiology. 1998;209:465–469. doi: 10.1148/radiology.209.2.9807575. [DOI] [PubMed] [Google Scholar]
- 7.Shin HJ, Yoon H, Han SJ, Ihn K, Koh H, Kwon JY, et al. Key imaging features for differentiating cystic biliary atresia from choledochal cyst: prenatal ultrasonography and postnatal ultrasonography and MRI. Ultrasonography. 2021;40:301–311. doi: 10.14366/usg.20061. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Kim WS, Cheon JE, Youn BJ, Yoo SY, Kim WY, Kim IO, et al. Hepatic arterial diameter measured with US: adjunct for US diagnosis of biliary atresia. Radiology. 2007;245:549–555. doi: 10.1148/radiol.2452061093. [DOI] [PubMed] [Google Scholar]
- 9.Lee MS, Kim MJ, Lee MJ, Yoon CS, Han SJ, Oh JT, et al. Biliary atresia: color doppler US findings in neonates and infants. Radiology. 2009;252:282–289. doi: 10.1148/radiol.2522080923. [DOI] [PubMed] [Google Scholar]
- 10.He JP, Hao Y, Wang XL, Yang XJ, Shao JF, Feng JX. Comparison of different noninvasive diagnostic methods for biliary atresia: a meta-analysis. World J Pediatr. 2016;12:35–43. doi: 10.1007/s12519-015-0071-x. [DOI] [PubMed] [Google Scholar]
- 11.Zhou LY, Jiang H, Shan QY, Chen D, Lin XN, Liu BX, et al. Liver stiffness measurements with supersonic shear wave elastography in the diagnosis of biliary atresia: a comparative study with grey-scale US. Eur Radiol. 2017;27:3474–3484. doi: 10.1007/s00330-016-4710-y. [DOI] [PubMed] [Google Scholar]
- 12.Wang X, Qian L, Jia L, Bellah R, Wang N, Xin Y, et al. Utility of shear wave elastography for differentiating biliary atresia from infantile hepatitis syndrome. J Ultrasound Med. 2016;35:1475–1479. doi: 10.7863/ultra.15.08031. [DOI] [PubMed] [Google Scholar]
- 13.Duan X, Peng Y, Liu W, Yang L, Zhang J. Does supersonic shear wave elastography help differentiate biliary atresia from other causes of cholestatic hepatitis in infants less than 90 days old? Compared with grey-scale US. Biomed Res Int. 2019;2019:9036362. doi: 10.1155/2019/9036362. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Brahee DD, Lampl BS. Neonatal diagnosis of biliary atresia: a practical review and update. Pediatr Radiol. 2022;52:685–692. doi: 10.1007/s00247-021-05148-y. [DOI] [PubMed] [Google Scholar]
- 15.Sung S, Jeon TY, Yoo SY, Hwang SM, Choi YH, Kim WS, et al. Incremental value of MR cholangiopancreatography in diagnosis of biliary atresia. PLoS One. 2016;11:e0158132. doi: 10.1371/journal.pone.0158132. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Siles P, Aschero A, Gorincour G, Bourliere-Najean B, Roquelaure B, Delarue A, et al. A prospective pilot study: can the biliary tree be visualized in children younger than 3 months on magnetic resonance cholangiopancreatography? Pediatr Radiol. 2014;44:1077–1084. doi: 10.1007/s00247-014-2953-9. [DOI] [PubMed] [Google Scholar]
- 17.Napolitano M, Franchi-Abella S, Damasio BM, Augdal TA, Avni FE, Bruno C, et al. Practical approach for the diagnosis of biliary atresia on imaging, part 2: magnetic resonance cholecystopancreatography, hepatobiliary scintigraphy, percutaneous cholecysto-cholangiography, endoscopic retrograde cholangiopancreatography, percutaneous liver biopsy, risk scores and decisional flowchart. Pediatr Radiol. 2021;51:1545–1554. doi: 10.1007/s00247-021-05034-7. [DOI] [PubMed] [Google Scholar]
- 18.Kim MJ, Park YN, Han SJ, Yoon CS, Yoo HS, Hwang EH, et al. Biliary atresia in neonates and infants: triangular area of high signal intensity in the porta hepatis at T2-weighted MR cholangiography with US and histopathologic correlation. Radiology. 2000;215:395–401. doi: 10.1148/radiology.215.2.r00ma04395. [DOI] [PubMed] [Google Scholar]
- 19.Kim YH, Kim MJ, Shin HJ, Yoon H, Han SJ, Koh H, et al. MRI-based decision tree model for diagnosis of biliary atresia. Eur Radiol. 2018;28:3422–3431. doi: 10.1007/s00330-018-5327-0. [DOI] [PubMed] [Google Scholar]
- 20.Kim J, Yoon H, Lee MJ, Kim MJ, Han K, Han SJ, et al. Clinical utility of mono-exponential model diffusion weighted imaging using two b-values compared to the bi- or stretched exponential model for the diagnosis of biliary atresia in infant liver MRI. PLoS One. 2019;14:e0226627. doi: 10.1371/journal.pone.0226627. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Liu B, Cai J, Zhu J, Zheng H, Zhang Y, Wang L. Diffusion tensor imaging for evaluating biliary atresia in infants and neonates. PLoS One. 2016;11:e0168477. doi: 10.1371/journal.pone.0168477. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Kim J, Shin HJ, Yoon H, Han SJ, Koh H, Kim MJ, et al. Diffusion-weighted imaging for differentiation of biliary atresia and grading of hepatic fibrosis in infants with cholestasis. Korean J Radiol. 2021;22:253–262. doi: 10.3348/kjr.2020.0055. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Kianifar HR, Tehranian S, Shojaei P, Adinehpoor Z, Sadeghi R, Kakhki VR, et al. Accuracy of hepatobiliary scintigraphy for differentiation of neonatal hepatitis from biliary atresia: systematic review and meta-analysis of the literature. Pediatr Radiol. 2013;43:905–919. doi: 10.1007/s00247-013-2623-3. [DOI] [PubMed] [Google Scholar]
- 24.Zhou L, Xie J, Gao P, Chen H, Chen S, Wang G, et al. Percutaneous ultrasound-guided cholecystocholangiography with microbubbles combined with liver biopsy for the assessment of suspected biliary atresia. Pediatr Radiol. 2022;52:1075–1085. doi: 10.1007/s00247-022-05280-3. [DOI] [PubMed] [Google Scholar]
- 25.Koot BGP, Kelly DA, Hadzic N, Gonzales E, Hierro L, Davenport M, et al. Endoscopic retrograde cholangiopancreatography in infants: availability under threat: a survey on availability, need, and clinical practice in Europe and Israel. J Pediatr Gastroenterol Nutr. 2020;71:e54–e58. doi: 10.1097/MPG.0000000000002752. [DOI] [PubMed] [Google Scholar]
- 26.Lee SY, Kim GC, Choe BH, Ryeom HK, Jang YJ, Kim HJ, et al. Efficacy of US-guided percutaneous cholecystocholangiography for the early exclusion and type determination of biliary atresia. Radiology. 2011;261:916–922. doi: 10.1148/radiol.11110665. [DOI] [PubMed] [Google Scholar]
- 27.Hwang SM, Jeon TY, Yoo SY, Choe YH, Lee SK, Kim JH. Early US findings of biliary atresia in infants younger than 30 days. Eur Radiol. 2018;28:1771–1777. doi: 10.1007/s00330-017-5092-5. [DOI] [PubMed] [Google Scholar]
- 28.Zhou LY, Wang W, Shan QY, Liu BX, Zheng YL, Xu ZF, et al. Optimizing the US diagnosis of biliary atresia with a modified triangular cord thickness and gallbladder classification. Radiology. 2015;277:181–191. doi: 10.1148/radiol.2015142309. [DOI] [PubMed] [Google Scholar]
- 29.Mittal V, Saxena AK, Sodhi KS, Thapa BR, Rao KL, Das A, et al. Role of abdominal sonography in the preoperative diagnosis of extrahepatic biliary atresia in infants younger than 90 days. AJR Am J Roentgenol. 2011;196:W438–W445. doi: 10.2214/AJR.10.5180. [DOI] [PubMed] [Google Scholar]
- 30.Weerasooriya VS, White FV, Shepherd RW. Hepatic fibrosis and survival in biliary atresia. J Pediatr. 2004;144:123–125. doi: 10.1016/j.jpeds.2003.09.042. [DOI] [PubMed] [Google Scholar]
- 31.Liu B, Cai J, Xu Y, Peng X, Zheng H, Huang K, et al. Three-dimensional magnetic resonance cholangiopancreatography for the diagnosis of biliary atresia in infants and neonates. PLoS One. 2014;9:e88268. doi: 10.1371/journal.pone.0088268. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Lee MH, Shin HJ, Yoon H, Han SJ, Koh H, Lee MJ. Periportal thickening on magnetic resonance imaging for hepatic fibrosis in infantile cholestasis. World J Gastroenterol. 2020;26:2821–2830. doi: 10.3748/wjg.v26.i21.2821. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Lewin M, Poujol-Robert A, Boëlle PY, Wendum D, Lasnier E, Viallon M, et al. Diffusion-weighted magnetic resonance imaging for the assessment of fibrosis in chronic hepatitis C. Hepatology. 2007;46:658–665. doi: 10.1002/hep.21747. [DOI] [PubMed] [Google Scholar]
- 34.Mo YH, Jaw FS, Ho MC, Wang YC, Peng SS. Hepatic ADC value correlates with cirrhotic severity of patients with biliary atresia. Eur J Radiol. 2011;80:e253–e257. doi: 10.1016/j.ejrad.2010.11.002. [DOI] [PubMed] [Google Scholar]
- 35.Peng SS, Jeng YM, Hsu WM, Yang JC, Ho MC. Hepatic ADC map as an adjunct to conventional abdominal MRI to evaluate hepatic fibrotic and clinical cirrhotic severity in biliary atresia patients. Eur Radiol. 2015;25:2992–3002. doi: 10.1007/s00330-015-3716-1. [DOI] [PubMed] [Google Scholar]
- 36.Tosun M, Inan N, Sarisoy HT, Akansel G, Gumustas S, Gürbüz Y, et al. Diagnostic performance of conventional diffusion weighted imaging and diffusion tensor imaging for the liver fibrosis and inflammation. Eur J Radiol. 2013;82:203–207. doi: 10.1016/j.ejrad.2012.09.009. [DOI] [PubMed] [Google Scholar]
- 37.Seo N, Chung YE, Park YN, Kim E, Hwang J, Kim MJ. Liver fibrosis: stretched exponential model outperforms mono-exponential and bi-exponential models of diffusion-weighted MRI. Eur Radiol. 2018;28:2812–2822. doi: 10.1007/s00330-017-5292-z. [DOI] [PubMed] [Google Scholar]
- 38.Chen H, Zhou L, Liao B, Cao Q, Jiang H, Zhou W, et al. Two-dimensional shear wave elastography predicts liver fibrosis in jaundiced infants with suspected biliary atresia: a prospective study. Korean J Radiol. 2021;22:959–969. doi: 10.3348/kjr.2020.0885. [DOI] [PMC free article] [PubMed] [Google Scholar]