Abstract
In den letzten Jahren hat die Charakterisierung der Speicheldrüsenkarzinome einen großen Wandel durchlebt. Morphologisch definierte Entitäten konnten zu einem Großteil auch molekular mit einem oftmals distinkten Genotyp charakterisiert werden. Der erste Teil des Artikels gibt einen Überblick über die Fortschritte der molekularen Charakteristiken des Mukoepidermoidkarzinoms, adenoid-zystischen Karzinoms, Azinuszellkarzinoms, des sekretorischen und intraduktalen Karzinoms sowie des hyalinisierenden klarzelligen Karzinoms. Der molekulare Genotyp kann dabei insbesondere bei der Klassifizierung ungewöhnlicher morphologischer Varianten von großem Nutzen sein. Rekurrente NTRK- oder RET-Genfusionen können dabei nicht nur als diagnostisches Hilfsmittel, sondern auch für eine potenzielle gezielte Therapie genutzt werden.
Schlüsselwörter: Klassifikation, Morphologische und mikroskopische Befunde, Speicheldrüsenneoplasien, Genfusion, Mutation
Abstract
In recent years, the characterization of salivary gland tumors has undergone a major transformation. Morphologically defined entities could to a large extent also be characterized molecularly with an often distinct genotype. The first part of this article reviews the advances in the molecular characteristics of mucoepidermoid carcinoma, adenoid cystic carcinoma, acinic cell carcinoma, secretory carcinoma, intraductal carcinoma, and hyalinizing clear cell carcinoma. The molecular genotype can be particularly useful in classifying unusual morphologic variants. Recurrent NTRK or RET gene fusions can be used not only as a diagnostic tool but also for potential targeted therapy.
Keywords: Classification, Morphological and microscopic findings, Salivary gland neoplasms, Gene fusion, Mutation
Lernziele
Nach Lektüre dieses Beitrags …
können Sie relevante molekularen Alterationen in Speicheldrüsenkarzinomen benennen;
können Sie die immunhistochemischen Surrogatmarker der beschriebenen molekularen Alterationen sicherer evaluieren;
kennen Sie die spezifischen molekularen Alterationen des Mukoepidermoidkarzinoms und des adenoid-zystischen Karzinoms;
kennen Sie die molekularen Spektren zur Differenzialdiagnose des Azinuszellkarzinoms, sekretorischen Karzinoms und intraduktalen Karzinoms.
Hintergrund
Speicheldrüsenkarzinome sind seltene Neoplasien, die aufgrund überlappender morphologischer Muster insbesondere an bioptischem und zytologischem Material herausfordernd sind. In den letzten Jahren konnten zahlreiche, oftmals spezifische molekulare Alterationen identifiziert werden, die insbesondere bei ungewöhnlichen morphologischen Varianten oder limitiertem Material diagnostisch sehr hilfreich sein können. Weiterhin sind rekurrente Genfusionen
rekurrente Genfusionen
nicht nur von diagnostischem Nutzen, sondern können potenziell auch gezielt therapeutisch angegangen werden. Diese Arbeit soll einen Überblick über den aktuellen Stand der morphomolekularen Typisierung von Speicheldrüsenkarzinomen geben.
Fallbeispiel
Sie erhalten das laterale Parotidektomiepräparat
Parotidektomiepräparat
eines 58-jährigen Patienten. Histologisch zeigt sich eine relativ scharf umgrenzte Speicheldrüsenneoplasie von maximal 1,8 cm Durchmesser. Diese besteht aus ausschließlich zytologisch blanden, morphologisch onkozytär aufgebauten Zellen mit voluminösem eosinophilem Zytoplasma und rundlichen Kernen mit feinen Nukleolen. Stellenweise zeigen sich fibröse Bänder, die die Läsion durchziehen. Es finden sich praktisch keine Mitosefiguren, keine Nekrosen und keine Perineuralscheideninfiltration. Die breite Differenzialdiagnose
Differenzialdiagnose
umfasst benigne und „low grade“ maligne onkozytär differenzierte Speicheldrüsenneoplasien.
Molekulare Eigenschaften etablierter Entitäten
Mukoepidermoidkarzinom
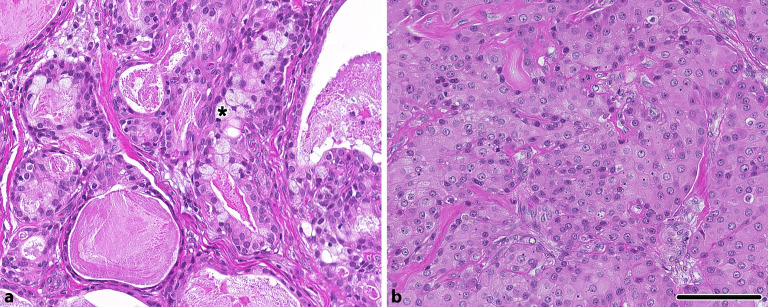
Das Mukoepidermoidkarzinom zeigt typischerweise ein triphasisches Muster unter Einschluss squamoider (epidermoider), intermediärer (zumeist heller) Zellen und Mukozyten (Abb. 1; [1]). Die klassischen Varianten lassen sich in der Regel ohne größere Schwierigkeiten diagnostizieren, jedoch besteht auch eine Reihe ungewöhnlicher Varianten
ungewöhnlicher Varianten
. Diese umfassen unter anderem die onkozytäre Variante (OMEC; Abb. 1), die sklerosierende, ziliierte oder auch Warthin-ähnliche Variante sowie das kürzlich beschriebene mukoazinäre Karzinom [2, 3, 4, 5]. Diese Varianten haben gemeinsam, dass sie häufig molekular eine Genfusion im MAML2-Gen, zumeist mit dem Fusionspartner CRTC1 oder seltener CRTC3, zeigen (Tab. 1) und die klassischen morphologischen Eigenschaften praktisch vollständig fehlen können. Diese Genfusionen sind hochspezifisch und im Kontext eines Speicheldrüsentumors molekular praktisch beweisend für das Spektrum der Mukoepidermoidkarzinome ([6]; cave: auch Adnextumoren der Haut wie das Hidradenom
Hidradenom
können identische Fusionen zeigen [7]). In einer kürzlich publizierten Studie konnten auch andere molekulare Alterationen, wie z. B. HRAS- oder KRAS-Mutationen detektiert werden, wobei diese ohne zusätzlichen Nachweis einer MAML2-Umlagerung
MAML2-Umlagerung
naturgemäß für die Entitätsdiagnose aufgrund fehlender Spezifität weniger hilfreich sind [8]. Das vorgestellte Fallbeispiel lässt sich durch den molekularen Nachweis einer CRTC3-MAML2-Genfusion einer onkozytären Variante eines Mukoepidermoidkarzinoms (OMEC) zuordnen.
| Entität | Molekulare Alteration | Quelle |
|---|---|---|
| Mukoepidermoidkarzinom | CRTC1-MAML2- und CRTC3-MAML2-Genfusion | [4] |
| Adenoid-zystisches Karzinom | MYB-NFIB-, MYBL1-NFIB-Genfusion; NOTCH1-Mutation | [9, 10] |
| Azinuszellkarzinom |
NR4A3-Hochregulierung („enhancer hijacking“); HTN3-MSANTD3-Genfusion |
[11, 12] |
| Sekretorisches Karzinom | ETV6-NTRK3-, ETV6-RET-, ETV6-MET-, VIM-RET-Genfusion | [13, 14, 15, 16] |
| Intraduktales Karzinom | NCOA4-RET-, TRIM27-RET- und TRIM33-RET-Genfusion; BRAF(V600E)-Mutation | [17, 18] |
| Hyalinisierendes klarzelliges Karzinom | EWSR1-ATF1-Genfusion, EWSR1-CREM-Genfusion | [19, 20] |
Merke
Der Nachweis einer MAML2-Genfusion kann die Diagnose eines Mukoepidermoidkarzinoms, insbesondere in ungewöhnlichen Varianten, molekular untermauern.
Adenoid-zystisches Karzinom
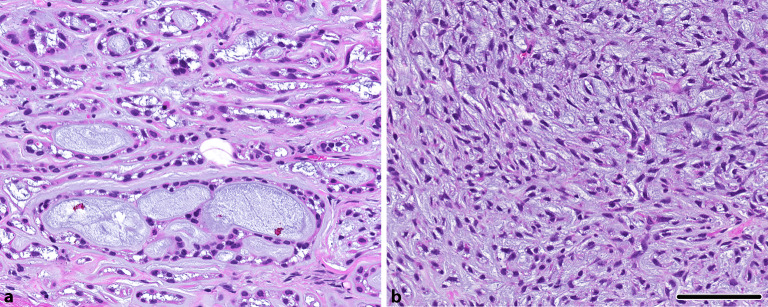
Das adenoid-zystische Karzinom zeigt klassischerweise einen biphasischen Aufbau
biphasischen Aufbau
mit peripheren myoepithelialen Zellen und zentralen duktal bzw. epithelial differenzierten Zellformationen. Das klassische Bild umfasst dabei eine tubuläre und kribriforme Differenzierung mit intra(pseudo)luminalem myxoidem Material (Abb. 2) neben Inklusionen
Inklusionen
hyalinisierter Basallamina. Bei ausgedehnter solider Komponente ist die Diagnostik erschwert, da die biphasische Differenzierung unter Umständen nicht mehr nachvollzogen werden kann. Außerdem können ungewöhnliche Varianten, wie eine sklerosierende Variante, eine spindelzellige Differenzierung (Abb. 2) oder das sog. metatypische adenoid-zystische Karzinom die eigentliche Tumorentität verschleiern [21, 22, 23]. Insbesondere Feinnadelpunktionen können diagnostisch sehr herausfordernd sein und eine Menge relevanter Differenzialdiagnosen umfassen. Hier kann der molekulare Nachweis einer MYB- oder MYBL1-Genfusion
MYBL1-Genfusion
, typischerweise mit dem Fusionspartner NFIB, diagnostisch beweisend sein [9]. Diese molekulare Alteration ist bisher in anderen Speicheldrüsentumoren nicht beschrieben. Eine weitere, seltenere Subgruppe mit häufiger solider Differenzierung zeigt pathogene NOTCH1-Mutationen, typischerweise ohne Nachweis einer MYB- oder MYBL1-Genfusion [10]. Gelegentlich kann ebenfalls der fehlende Nachweis einer immunhistochemischen Biphasizität verwirrend sein. Eine Negativität für p40 bzw. p63 ist dabei in etwa 10 % der Fälle beschrieben [24]. Ein weiterer relevanter Punkt ist die Diagnose einer „high grade“ Transformation
Transformation
, die typischerweise mit einer nuklearen Anaplasie, einer desmoplastischen Stromareaktion, Mikropapillen mit squamoider Differenzierung sowie einem deutlich erhöhten Ki-67-Proliferationsindex, Komedonekrosen und einem aberranten p53 Muster einhergeht [25]. Diese sollten von der soliden Variante
soliden Variante
(> 30 % solide Anteile gemäß Weltgesundheitsorganisation, WHO; [1]) abgegrenzt werden, da diese typischerweise einen nochmals aggressiveren biologischen Verlauf zeigen können.
Merke
Der Nachweis einer MYB-NFIB- oder MYBL1-NFIB-Genfusion kann die Diagnose eines adenoid-zystischen Karzinoms, insbesondere in ungewöhnlichen Varianten, molekular untermauern.
Azinuszellkarzinom
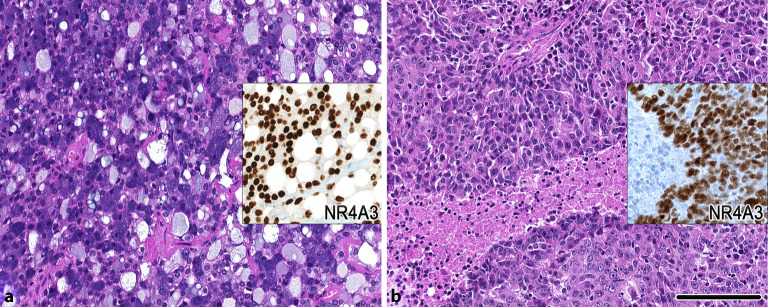
Das Azinuszellkarzinom bereitet bei klassischer Morphologie in der Regel wenige diagnostische Schwierigkeiten, wobei in limitiertem Material, insbesondere in Feinnadelpunktionen der Zytologie, die Abgrenzung zum normalen azinären Speicheldrüsengewebe herausfordernd sein kann. In Einzelfällen kann auch die Abgrenzung zum sekretorischen Karzinom schwierig sein, was erklärt, dass vor Charakterisierung des sekretorischen Karzinoms diese typischerweise als Azinuszellkarzinome klassifiziert wurden [13]. Kürzlich konnte eine in hohem Maße rekurrente molekulare Alteration, das „enhancer hijacking“ des NR4A3(NOR‑1)-Gens
NR4A3(NOR-1)-Gens
, identifiziert werden [11]. Dabei kommt es zur Translokation von Enhancerabschnitten des SCPP-Genclusters vor das NR4A3-Gen, was konsekutiv zu einer starken Überexpression
Überexpression
des NR4A3-Gens bzw. der entsprechenden mRNA und des Proteins führt. Dieses kann sowohl mittels quantitativer mRNA-Analyse sowie mittels spezifischer NR4A3-Immunhistochemie nachgewiesen werden ([22, 26]; Abb. 3). Die Fluoreszenz-in-situ-Untersuchung (FISH) von NR4A3 kann ein positives Break-apart-Muster
Break-apart-Muster
zeigen, sofern die Region des Bruchpunkts über das Sondendesign abgedeckt ist [11]. Am besten diagnostisch verwertbar ist jedoch die „downstream“ gelegene NR4A3-Überexpression: Die Immunhistochemie kann auch erfolgreich an Zellblockmaterial von Feinnadelpunktionen mit sehr hoher Sensitivität und Spezifität (≥ 90 %) durchgeführt werden [27]. Auch Azinuszellkarzinome mit „high grade“ Transformationen, die die typische Morphologie verlieren können, sind oftmals mittels NR4A3-Expression zu überführen (Abb. 3). In sehr seltenen Fällen sind HTN3-MSANTD3-Genfusionen beschrieben [12].
Merke
Eine positive immunhistochemische Expression von NR4A3 kann die Diagnose eines Azinuszellkarzinoms, insbesondere bei ungewöhnlicher Morphologie, untermauern.
Sekretorisches Karzinom
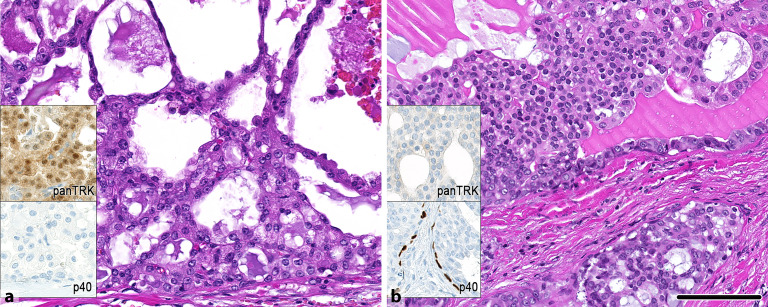
Das sekretorische Karzinom ist mittlerweile gut charakterisiert und kann verschiedene morphologische Varianten zeigen, darunter z. B. die makrozystische Variante [13, 28]. Morphologisch gemeinsam haben sekretorische Karzinome typischerweise ein voluminöses Zytoplasma mit „hobnail“-artigen Kernen und blasigen Sekretionen (Abb. 4). Die Immunhistochemie zeigt charakteristisch eine Positivität für Mammaglobin
Mammaglobin
, S‑100 und MUC4 [29]. In den meisten Fällen (> 90 %) findet sich molekular eine ETV6–NTRK3-Genfusion, in selteneren Fällen sind auch ETV6-RET-, ETV6-MET- und VIM–RET-Genfusionen beschrieben [14, 15, 16]. Typischerweise zeigen die NTRK3-translozierten sekretorischen Karzinome eine immunhistochemische, nukleäre Expression von panTRK (Abb. 4), sodass diese in Zusammenschau mit der Morphologie und dem übrigen Immunphänotyp diagnostisch verwendet werden kann [30].
Merke
Eine nukleäre panTRK-Expression kann auf die für sekretorische Karzinome typische ETV6-NTRK3-Genfusion hinweisen.
Intraduktales Karzinom
Das sog. intraduktale Karzinom (IDC) ist neben dem Azinuszellkarzinom die wichtigste Differenzialdiagnose zum sekretorischen Karzinom. Je nach Subtyp des IDC teilt es sich das Immunprofil (S‑100- und Mammaglobinexpression) mit dem sekretorischen Karzinom. Es zeigt jedoch zusätzlich klassischerweise eine zweite, myoepithelial differenzierte Zellpopulation (Abb. 4), ist negativ für MUC4 bzw. panTRK und weist je nach morphologischem Subtyp ein molekular distinktes Spektrum auf (u. a. NCOA4-RET-, TRIM27-RET-, TRIM33-RET-Genfusion, BRAF(V600E)-Mutation; [17, 18]).
Hyalinisierendes klarzelliges Karzinom
Das hyalinisierende klarzellige Karzinom (HCCC) ist eine in der klassischen Form langsam wachsende Entität und findet sich üblicherweise in der oralen Mukosa. Es weist einen hyalinisierten Hintergrund mit trabekulären und strangförmigen Tumorzellproliferationen mit eosinophil- bis klarzelligem, optisch leerem Zytoplasma auf [31]. Immunhistochemisch exprimieren die Zellen typischerweise squamoide Marker
squamoide Marker
, wie p63, p40 oder CK5/6 [1], was gleichzeitig als Abgrenzung zu einer Metastase eines klarzelligen Nierenzellkarzinoms hilfreich sein kann. Molekular finden sich rekurrente Genfusionen im EWSR1-Gen, am häufigsten EWSR1-ATF1-Translokationen [19], seltener EWSR1-CREM-Translokationen [20]. Das HCCC zeigt ein überlappendes morphologisches und molekulares Profil mit dem klarzelligen odontogenen Karzinom (CCOC) des Kiefers [31].
Fazit für die Praxis
Speicheldrüsenkarzinome zeigen häufig typische molekulare Alterationen.
Genfusionen zeigen dabei in der Regel eine hohe Spezifität.
Molekulare Alterationen können im Kontext mit der Morphologie zur Diagnoseunterstützung bzw. Entitätseinordnung verwendet werden.
Immunhistochemische Surrogatmarker, wie NR4A3 und panTRK, können diagnostisch hilfreich sein.
Die NTRK- oder RET-Genfusionen können als potenzielles molekulares Ziel dienen.
CME-Fragebogen
Welche ist die typische und diagnostische molekulare Alteration in Mukoepidermoidkarzinomen der Speicheldrüse?
CRTC1-MAML2-Genfusionen
MYB-NFIB-Genfusionen
MYBL1-NFIB-Genfusionen
EWSR1-ATF1-Genfusionen
HTN3-MSANTD3-Genfusionen
Welche sind typische und diagnostische molekulare Alterationen in adenoid-zystischen Karzinomen?
HRAS-Punktmutationen
MYB-NFIB- und MYBL1-NFIB-Genfusionen
ETV6-RET-Genfusionen
BRAF-Punktmutationen
HTN3-MSANTD3-Genfusionen
Mit welchem molekularem Mechanismus wird die NR4A3-Expression in Azinuszellkarzinomen am besten erklärt?
Punktmutation von Enhancer-Elementen
Translokation von Enhancer-Elementen
Genamplifikation von Enhancer-Elementen
Fehlender proteolytischer Abbau von Enhancer-Elementen
Deletion von Enhancer-Elementen
Sie sehen eine überwiegend solide und fokal kribriforme, biphasische maligne Neoplasie in der Parotis. Molekular findet sich eine pathogene NOTCH1-Mutation. Zu welcher Entität passt diese Konstellation am besten?
Adenoid-zystisches Karzinom
Sekretorisches Karzinom
Intraduktales Karzinom
Mukoepidermoidkarzinom
Azinuszellkarzinom
Mit welcher Methodik ist die typische molekulare Alteration im Azinuszellkarzinom am besten zu erkennen?
NR4A3-Fluoreszenz-in-situ-Hybridisierung
NR4A3-DNA-Sequenzierung
NR4A3-Immunhistochemie
NR4A3- Fragmentlängenanalyse
NR4A3-Chromogen-in-situ-Hybridisierung
Sie sehen ein partiell zystisches Karzinom der Speicheldrüsen mit voluminösem Zytoplasma und fokalen blasigen Sekretionen. Welche immunhistochemischen Untersuchungen helfen Ihnen vor allem in der Differenzialdiagnose zwischen sekretorischem und intraduktalem Karzinom?
p40 und MUC4
p40 und NR4A3
RASQ61R und NR4A3
HER2/neu und panTRK
Androgenrezeptor und HER2/neu
Gegen welche molekularen Alterationen besteht die grundsätzliche Möglichkeit einer gezielten Therapie?
RET- und NTRK-Genfusionen
MYB- und MYBL1-Genfusionen
MAML2- und MYB-Genfusionen
NR4A3- und ETV6-Genfusionen
EWSR1- und HTN3-Genfusionen
Sie haben in der oralen Mukosa ein eosinophiles bis klarzelliges Karzinom mit EWSR1-ATF1-Genfusion diagnostiziert. Welche der Aussagen trifft zu?
Hyalinisierende klarzellige Karzinome sind typischerweise hochaggressiv
Eine klinisch-radiologische Korrelation ist anzuraten
Hyalinisierende klarzellige Karzinome zeigen typischerweise eine zusätzliche BRAF(V600E)-Mutation
Seltenere Genfusionen im hyalinisierenden klarzelligen Karzinom umfassen EWSR1 und FLI1
Das klarzellige Nierenzellkarzinom als Differenzialdiagnose zeigt häufig ebenfalls EWSR1-ATF1‑Genfusionen
Etwa wie viel Prozent der sekretorischen Karzinome zeigen eine ETV6-NTRK3-Genfusion?
< 10 %
Ca. 20–30 %
Ca. 40–50 %
Ca. 60–70 %
> 90 %
Welche beiden immunhistochemischen Surrogatmarker können Ihnen insbesondere in der Differenzialdiagnose zwischen einem sekretorischen Karzinom und einem Azinuszellkarzinom helfen?
Androgenrezeptor und NR4A3
HER2/neu und panTRK
panTRK und NR4A3
Androgenrezeptor und HER2/neu
RASQ61R und NR4A3
Funding
Open access funding provided by University of Zurich
Einhaltung ethischer Richtlinien
Interessenkonflikt
Gemäß den Richtlinien des Springer Medizin Verlags werden Autoren und wissenschaftliche Leitung im Rahmen der Manuskripterstellung und Manuskriptfreigabe aufgefordert, eine vollständige Erklärung zu ihren finanziellen und nichtfinanziellen Interessen abzugeben.
Autoren
N. Rupp: A. Finanzielle Interessen: Forschungsförderung zur persönlichen Verfügung: Das SalvGlandDx-NGS-Panel wurde mithilfe eines Zuschusses der Iten-Kohaut-Stiftung entwickelt. – Eingeladener Referent, Schnittseminare und Jahrestagungen der IAP Schweiz/Schweizerischen Gesellschaft für Pathologie (Reise‑/Übernachtungskosten und bezahlte Teilnehmergebühren); Eingeladener Referent, Europäischer Kongress für Pathologie (ECP; bezahlte/reduzierte Teilnehmergebühren); Teilnahme als eingeladener Referent beim DGHNO-Jahreskongress 2022 in Hannover (Reise‑/Übernachtungskosten und bezahlte Teilnehmergebühren). – Teilnahme am Advisory Board der F. Hoffmann-La Roche AG (Honorar). – B. Nichtfinanzielle Interessen: Oberarzt mit erweiterter Verantwortung, Institut für Pathologie und Molekularpathologie, Universitätsspital Zürich, Zürich, Schweiz; Assistenzprofessor für Theragnostische Tumorpathologie, Universität Zürich, Zürich, Schweiz; Lehrauftrag „Tumorpathologie“ an der Eidgenössischen Technischen Hochschule (ETH) Zürich, Schweiz | Mitgliedschaften: Deutsche Gesellschaft für Pathologie (DGP); Sprecher der Arbeitsgruppe Kopf-Hals-Pathologie der DGP; Schweizerische Gesellschaft für Pathologie; Coautor IARC-WHO-Klassifikation „Head & Neck Tumours, 5th Edition“. S. N. Freiberger-Rupp: A. Finanzielle Interessen: S. N. Freiberger-Rupp gibt an, dass kein finanzieller Interessenkonflikt besteht. – B. Nichtfinanzielle Interessen: wissenschaftliche Mitarbeiterin, Institut für Pathologie und Molekularpathologie, Universitätsspital Zürich, Zürich, Schweiz | Mitgliedschaft: Deutsche Gesellschaft für Pathologie (DGP).
Wissenschaftliche Leitung
Die vollständige Erklärung zum Interessenkonflikt der wissenschaftlichen Leitung finden Sie am Kurs der zertifizierten Fortbildung auf www.springermedizin.de/cme.
Der Verlag
erklärt, dass für die Publikation dieser CME-Fortbildung keine Sponsorengelder an den Verlag fließen.
Für diesen Beitrag wurden von den Autor/-innen keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.WHO Classification of Tumours Editorial Board. Head and neck tumours [Internet]. (WHO classification of tumours series, 5th ed.; vol. 9). Lyon (France); 2022 [cited 2022 May 1]. Available from: https://tumourclassification.iarc.who.int/chapters/52
- 2.Bundele M, Weinreb I, Xu B, Chiosea S, Faquin W, Dias-Santagata D, et al. Mucoacinar carcinoma: a rare variant of mucoepidermoid carcinoma. Am J Surg Pathol. 2021;45(8):1028–1037. doi: 10.1097/PAS.0000000000001752. [DOI] [PubMed] [Google Scholar]
- 3.Skálová A, Agaimy A, Stanowska O, Baneckova M, Ptáková N, Ardighieri L, et al. Molecular profiling of salivary oncocytic mucoepidermoid carcinomas helps to resolve differential diagnostic dilemma with low-grade oncocytic lesions. Am J Surg Pathol. 2020;44(12):1612–1622. doi: 10.1097/PAS.0000000000001590. [DOI] [PubMed] [Google Scholar]
- 4.Nakano S, Okumura Y, Murase T, Nagao T, Kusafuka K, Urano M, et al. Salivary mucoepidermoid carcinoma: histological variants, grading systems, CRTC1/3-MAML2 fusions, and clinicopathological features. Histopathology. 2022;80(4):729–735. doi: 10.1111/his.14586. [DOI] [PubMed] [Google Scholar]
- 5.Bishop JA, Cowan ML, Shum CH, Westra WH. MAML2 rearrangements in variant forms of mucoepidermoid carcinoma: ancillary diagnostic testing for the ciliated and warthin-like variants. Am J Surg Pathol. 2018;42(1):130–136. doi: 10.1097/PAS.0000000000000932. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Skálová A, Vanecek T, Simpson RHW, Vazmitsel MA, Majewska H, Mukensnabl P, et al. CRTC1-MAML2 and CRTC3-MAML2 fusions were not detected in metaplastic Warthin tumor and metaplastic pleomorphic adenoma of salivary glands. Am J Surg Pathol. 2013;37(11):1743–1750. doi: 10.1097/PAS.0000000000000065. [DOI] [PubMed] [Google Scholar]
- 7.Kyrpychova L, Kacerovska D, Vanecek T, Grossmann P, Michal M, Kerl K, et al. Cutaneous hidradenoma: a study of 21 neoplasms revealing neither correlation between the cellular composition and CRTC1-MAML2 fusions nor presence of CRTC3-MAML2 fusions. Ann Diagn Pathol. 2016;23:8–13. doi: 10.1016/j.anndiagpath.2016.04.006. [DOI] [PubMed] [Google Scholar]
- 8.Morita M, Murase T, Okumura Y, Ueda K, Sakamoto Y, Masaki A, et al. Clinicopathological significance of EGFR pathway gene mutations and CRTC1/3–MAML2 fusions in salivary gland mucoepidermoid carcinoma. Histopathology. 2020;76(7):1013–1022. doi: 10.1111/his.14100. [DOI] [PubMed] [Google Scholar]
- 9.Togashi Y, Dobashi A, Sakata S, Sato Y, Baba S, Seto A, et al. MYB and MYBL1 in adenoid cystic carcinoma: diversity in the mode of genomic rearrangement and transcripts. Mod Pathol. 2018;31(6):934–946. doi: 10.1038/s41379-018-0008-8. [DOI] [PubMed] [Google Scholar]
- 10.Ferrarotto R, Mitani Y, Diao L, Guijarro I, Wang J, Zweidler-McKay P, et al. Activating NOTCH1 mutations define a distinct subgroup of patients with adenoid cystic carcinoma who have poor prognosis, propensity to bone and liver metastasis, and potential responsiveness to notch1 inhibitors. J Clin Oncol. 2017;35(3):352–360. doi: 10.1200/JCO.2016.67.5264. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Haller F, Bieg M, Will R, Körner C, Weichenhan D, Bott A, et al. Enhancer hijacking activates oncogenic transcription factor NR4A3 in acinic cell carcinomas of the salivary glands. Nat Commun. 2019 doi: 10.1038/s41467-018-08069-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Andreasen S, Varma S, Barasch N, Thompson LDR, Miettinen M, Rooper L, et al. The HTN3-MSANTD3 fusion gene defines a subset of Acinic cell carcinoma of the salivary gland. Am J Surg Pathol. 2019;43(4):489–496. doi: 10.1097/PAS.0000000000001200. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Skálová A, Vanecek T, Sima R, Laco J, Weinreb I, Perez-Ordonez B, et al. Mammary analogue secretory carcinoma of salivary glands, containing the ETV6-NTRK3 fusion gene: a hitherto undescribed salivary gland tumor entity. Am J Surg Pathol. 2010;34(5):599–608. doi: 10.1097/PAS.0b013e3181d9efcc. [DOI] [PubMed] [Google Scholar]
- 14.Rooper LM, Karantanos T, Ning Y, Bishop JA, Gordon SW, Kang H. Salivary secretory carcinoma with a novel ETV6-MET fusion: expanding the molecular spectrum of a recently described entity. Am J Surg Pathol. 2018;42(8):1121–1126. doi: 10.1097/PAS.0000000000001065. [DOI] [PubMed] [Google Scholar]
- 15.Skalova A, Vanecek T, Martinek P, Weinreb I, Stevens TM, Simpson RHW, et al. Molecular profiling of mammary analog secretory carcinoma revealed a subset of tumors harboring a novel ETV6-RET translocation: report of 10 cases. Am J Surg Pathol. 2018;42(2):234–246. doi: 10.1097/PAS.0000000000000972. [DOI] [PubMed] [Google Scholar]
- 16.Skálová A, Baneckova M, Thompson LDR, Ptáková N, Stevens TM, Brcic L, et al. Expanding the molecular spectrum of secretory carcinoma of salivary glands with a novel VIM-RET fusion. Am J Surg Pathol. 2020;44(10):1295–1307. doi: 10.1097/PAS.0000000000001535. [DOI] [PubMed] [Google Scholar]
- 17.Skálová A, Ptáková N, Santana T, Agaimy A, Ihrler S, Uro-Coste E, et al. NCOA4-RET and TRIM27-RET are characteristic gene fusions in salivary Intraductal carcinoma, including invasive and metastatic tumors: is “Intraductal” correct? Am J Surg Pathol. 2019;43(10):1303–1313. doi: 10.1097/PAS.0000000000001301. [DOI] [PubMed] [Google Scholar]
- 18.Bishop JA, Nakaguro M, Whaley RD, Ogura K, Imai H, Laklouk I, et al. Oncocytic Intraductal carcinoma of salivary glands: a distinct variant with TRIM33-RET fusions and BRAF V600E mutations. Histopathology. 2020 doi: 10.1111/his.14296. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Tanguay J, Weinreb I. What the EWSR1-ATF1 fusion has taught us about hyalinizing clear cell carcinoma. Head Neck Pathol. 2013;7(1):28–34. doi: 10.1007/s12105-013-0427-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Chapman E, Skalova A, Ptakova N, Martinek P, Goytain A, Tucker T, et al. Molecular profiling of hyalinizing clear cell carcinomas revealed a subset of tumors harboring a novel EWSR1-CREM fusion: report of 3 cases. Am J Surg Pathol. 2018;42(9):1182–1189. doi: 10.1097/PAS.0000000000001114. [DOI] [PubMed] [Google Scholar]
- 21.Albores-Saavedra J, Wu J, Uribe-Uribe N. The sclerosing variant of adenoid cystic carcinoma: a previously unrecognized neoplasm of major salivary glands. Ann Diagn Pathol. 2006;10(1):1–7. doi: 10.1016/j.anndiagpath.2005.07.010. [DOI] [PubMed] [Google Scholar]
- 22.Freiberger SN, Brada M, Fritz C, Höller S, Vogetseder A, Horcic M, et al. SalvGlandDx—a comprehensive salivary gland neoplasm specific next generation sequencing panel to facilitate diagnosis and identify therapeutic targets. Neoplasia. 2021;23(5):473–487. doi: 10.1016/j.neo.2021.03.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Mathew EP, Todorovic E, Truong T, Dickson BC, Enepekides D, Poon I, et al. Metatypical adenoid cystic carcinoma: a variant showing prominent squamous differentiation with a predilection for the Sinonasal tract and skull base. Am J Surg Pathol. 2021 doi: 10.1097/PAS.0000000000001850. [DOI] [PubMed] [Google Scholar]
- 24.Rooper L, Sharma R, Bishop JA. Polymorphous low grade adenocarcinoma has a consistent p63+/p40− immunophenotype that helps distinguish it from adenoid cystic carcinoma and cellular pleomorphic adenoma. Head Neck Pathol. 2015;9(1):79–84. doi: 10.1007/s12105-014-0554-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Seethala RR. An update on grading of salivary gland carcinomas. Head Neck Pathol. 2009;3(1):69–77. doi: 10.1007/s12105-009-0102-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Haller F, Skálová A, Ihrler S, Märkl B, Bieg M, Moskalev EA, et al. Nuclear NR4A3 immunostaining is a specific and sensitive novel marker for acinic cell carcinoma of the salivary glands. Am J Surg Pathol. 2019;43(9):1264–1272. doi: 10.1097/PAS.0000000000001279. [DOI] [PubMed] [Google Scholar]
- 27.Viswanathan K, Beg S, He B, Zhang T, Cantley R, Lubin DJ, et al. NR4A3 Immunostain is a highly sensitive and specific marker for acinic cell carcinoma in cytologic and surgical specimens. Am J Clin Pathol. 2022;157(1):98–108. doi: 10.1093/ajcp/aqab099. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Hernandez-Prera JC, Holmes BJ, Valentino A, Harshan M, Bacchi CE, Petersson F, et al. Macrocystic (mammary analogue) secretory carcinoma: an unusual variant and a pitfall in the differential diagnosis of cystic lesions in the head and neck. Am J Surg Pathol. 2019;43(11):1483–1492. doi: 10.1097/PAS.0000000000001309. [DOI] [PubMed] [Google Scholar]
- 29.Taverna C, Baněčková M, Lorenzon M, Palomba A, Franchi A, Skalova A, et al. MUC4 is a valuable marker for distinguishing secretory carcinoma of the salivary glands from its mimics. Histopathology. 2021;79(3):315–324. doi: 10.1111/his.14251. [DOI] [PubMed] [Google Scholar]
- 30.Bell D, Ferrarotto R, Liang L, Goepfert RP, Li J, Ning J, et al. Pan-Trk immunohistochemistry reliably identifies ETV6-NTRK3 fusion in secretory carcinoma of the salivary gland. Virchows Arch. 2020;476(2):295–305. doi: 10.1007/s00428-019-02640-7. [DOI] [PubMed] [Google Scholar]
- 31.Weinreb I. Hyalinizing clear cell carcinoma of salivary gland: a review and update. Head Neck Pathol. 2013;7(Suppl 1):S20–S29. doi: 10.1007/s12105-013-0466-8. [DOI] [PMC free article] [PubMed] [Google Scholar]