Résumé
Introduction. La fermeture percutanée des communications interventriculaires congénitales (CIV) constitue une alternative prometteuse à la chirurgie avec un taux de complications moindre et une durée de séjour hospitalier plus courte. Sa principale limite réside dans le choix de la prothèse appropriée pour chaque type de communication.
But. Rapporter l’expérience de l’équipe de cardiologie de l’hôpital Sahloul (Sousse, Tunisie) dans la fermeture percutanée des CIV congénitales par la prothèse Amplatzer Duct Occluder II (ADOII).
Méthodes. Il s’agissait d’une étude rétrospective, mono centrique, menée depuis janvier 2013 jusqu’à décembre 2017, incluant les patients traités par fermeture percutanée de CIV congénitales par la prothèse ADOII.
Résultats. Douze patients (6 garçons, 6 filles) étaient inclus dans l’étude. Les moyennes d’âge et de poids étaient, respectivement, de 65±41 mois et 2±10 kg. Les CIV étaient périmembraneuses (n=9) et trabéculées (n=3), restrictives (n=11) et non restrictives (n=1). La taille moyenne (minimum-maximum) des CIV était de 4,72 (3-6) mm. Onze prothèses type ADOII étaient implantées avec succès. Une première procédure était compliquée par la migration de la prothèse dans l’artère pulmonaire. Un deuxième enfant suivi pour une CIV périmembraneuse a développé un bloc auriculo-ventriculaire transitoire. Aucun décès n’a été noté.
Conclusion . Cette expérience débutante montre que la fermeture percutanée des CIV périmembraneuses et trabéculées par la prothèse ADOII est une procédure sure et efficace.
Mots Clés: Communication interventriculaire, congénitale, dispositif d’occlusion septale Amplatzer, fermeture par prothèse
Abstract
Introduction . Percutaneous closure of congenital ventricular septal defects (VSDs) represents a promising alternative to surgery with lower rate of complications and shorter hospital stay. Its main limitation is the choice of the appropriate device for each type of defect.
Aim. To report the experience of the service of cardiology (Sahloul hospital, Sousse, Tunisia) in percutaneous closure of congenital VSDs with Amplatzer Duct Occluder II (ADOII).
Methods. This was a retrospective, monocentric study, conducted from January 2013 to December 2017. The study included patients treated by percutaneous closure of congenital VSDs with the ADOII device.
Results. Twelve patients (6 boys; 6 girls) were included. The mean±SD of patients’ age and weight were 65±41 months and 23±10 kg, respectively. VSDs were peri-membranous (n=9) and muscular (n=3), and defects were restrictive (n=11) and non-restrictive (n=1). The mean (minimum-maximum) size of VSDs was 4.72 (3-6) mm. Eleven ADOII prostheses were successfully implanted. One failure procedure was noted with migration of the device into the pulmonary artery. A second child with perimembranous defect developed transient atrioventricular block. No deaths occurred.
Conclusion. The present early experience shows that percutaneous closure with ADOII device of perimembranous and trabecular VSDs is safe and effective.
Keywords: Amplatzer septal occluder, congenital, device closure, ventricular septal defect
INTRODUCTION
La réparation chirurgicale à cœur ouvert était considérée comme la seule thérapeutique pour les communications interventriculaires congénitales (CIV) pendant plusieurs décennies jusqu’à l’introduction du cathétérisme interventionnel en 1988 par l’équipe de Lock à Boston (1 ). Une multitude de prothèses ont été utilisées, mais les résultats étaient initialement décevants, avec un taux important de shunts résiduels et d’interférence avec les valves aortiques et tricuspides. L’apparition des prothèses Amplatzer, les premières spécifiquement conçues pour la fermeture des CIV musculaires à la fin des années 90, a représenté une véritable révolution permettant ainsi l’amélioration de la technique et des résultats (2 ). Cependant, l’utilisation des prothèses Amplatzer Duct Occluder II (ADOII) reste encore controversée pour les CIV périmembraneuses à cause du risque accru de bloc auriculo-ventriculaire et de lésions valvulaires aortique.
L’objective de la présente étude a été d’apporter un élément de réponse concernant l’efficacité et la sûreté de l’utilisation des prothèses ADOII dans la fermeture percutanée des CIV congénitales.
METHODES
Il s’agissait d’une étude rétrospective monocentrique qui a été réalisé entre janvier 2013 et décembre 2017 dans le service de cardiologie (hôpital Sahloul, Sousse, Tunisie). Un consentement écrit et éclairé était signé par les parents des patients.
Population de l’étude
Au total, 12 patients ont bénéficié d’une fermeture percutanée de CIV par des prothèses ADOII dans notre service durant la période d’étude.
Les critères d’inclusion étaient: i) CIV de siège trabéculé (mid-septales) ou périmembraneux suffisamment éloignées de la valve aortique (distance ≥ 2 mm par rapport à l’aorte) ; ii) diamètre maximal des CIV de 6 mm (car la taille maximale disponible des dispositifs ADOII étant de 6 mm) ; iii) CIV non restrictives avec des résistances vasculaires pulmonaires réversibles; et iv) CIV restrictives avec un shunt gauche droit significatif. L’importance du shunt était déterminée à l’aide des données de l’examen clinique (intolérance à l’effort, stagnation pondérale, surinfections broncho-pulmonaires à répétition) et de l’échographie cardiaque (dilatation des cavités cardiaques gauches).
Les critères de non-inclusion étaient: i) CIV d’admission ou de siège infundibulaire; ii) CIV périmembraneuses proches de la valve aortique (distance par rapport à la valve ≤ 2 mm) ; iii) CIV non restrictives avec augmentation irréversible des résistances vasculaires pulmonaires ; iv) CIV de type IV ; v) présence d’une fuite aortique associée gradée II ou plus ; et vi) CIV entrant dans le cadre d’une cardiopathie complexe (tels que la tétralogie de Fallot ; un canal atrioventriculaire complet ou une transposition des gros vaisseaux...).
Les données des patients dont les dossiers sont incomplets ou perdus de vue ont été exclues de l’analyse statistique.
Déroulement des procédures
La fermeture percutanée des CIV était réalisée sous anesthésie locale ou générale avec un monitorage continu des paramètres hémodynamiques, respiratoires et de l’électrocardiogramme associé à un contrôle par échographique transthoracique et fluoroscopie. Une ponction fémorale artérielle et veineuse était réalisée avec un cathétérisme cardiaque droit et gauche. Toutes les procédures étaient réalisées par voie fémorale rétrograde.
À l’aide d’une sonde queue de cochon, une angiographie du ventricule gauche en incidence oblique antérieure gauche crâniale, était réalisée afin de déterminer la taille et le siège de la communication et s’assurer de la faisabilité de la technique (Figure 1).
Figure 1. Angiographie du ventricule gauche, incidence obliqueantérieure gauche crâniale, opacification d’une communicationinterventriculaire périmembraneuse avec shunt gauche droit.

Une héparinothérapie intraveineuse était prescrite à la dose de 0,5 mg/kg. Une dose supplémentaire était administrée en cas de nécessité afin de maintenir un temps de céphaline activé efficace.
La CIV était abordée par voie gauche et le guide était positionné dans l’artère pulmonaire. La CIV était franchie à l’aide d’une sonde Judkins Right 3,5 ou 4 introduite par un désilet 5 Fr et montée sur un guide hydrophile 0.032/150 cm droit ou à petit J poussé par voie rétrograde dans l’aorte, le ventricule gauche, le ventricule droit puis dans l’artère pulmonaire successivement.
Le cathéter porteur (AMPLATZER™ TorqVue™ LP Catheter, AGA medical corporation) a été passé sur le guide, et la prothèse ADOII (AMPLATZERTM Duct Occluder II, AGA medical corporation) a été ensuite poussée jusqu’à son extrémité. La prothèse ADOII était introduite par voie gauche sans le support de la boucle artérioveineuse. La taille de la prothèse était choisie de façon qu’elle soit 1 à 2 mm plus large que le diamètre de la CIV. En cas de discordance entre les mesures échographiques et angiographiques, le plus grand des diamètres était retenu.
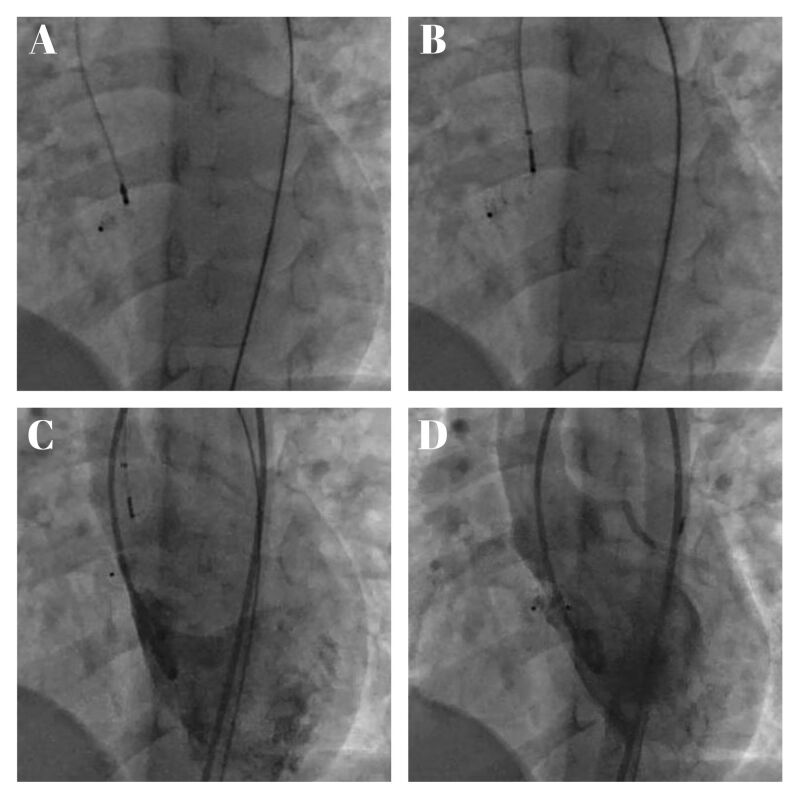
Après vérification du bon positionnement (absence de shunt résiduel significatif, de bloc auriculoventriculaire et de dysfonction des structures voisines en particulier les valves aortique et tricuspide), toutes les prothèses étaient larguées par voie rétrograde, sans support de la boucle artérioveineuse, en commençant par le disque distal dans le ventricule droit puis le disque proximal dans le ventricule gauche (Figure 2).
Figure 2. Largage de la prothèse Amplatzer Duct Occluder II®, incidence oblique antérieure gauche crâniale.
A. Libération du disque droit. B. Libération du disque gauche. C. Angiographie du ventricule gauche et vérification du bon positionnement de la prothèse avec absence de shunt résiduel. D. Largage de la prothèse avec angiographie du ventricule gauche.
Le succès procédural était défini par l’implantation de la prothèse dans la position appropriée sans avoir besoin d’intervention chirurgicale. Les complications étaient considérées comme majeures si elles engageaient le pronostic vital des patients.
Un contrôle échographique était réalisé chez tous les patients immédiatement, 24 heures et trois mois après la procédure.
Analyse statistique
Les résultats étaient exprimés en moyenne avec les deux extrêmes pour les données quantitatives et en nombre et pourcentage pour les données catégoriques. L’étude statistique a été réalisée à l’aide du logiciel de statistiques SPSS 21.0.
RESULTATS
Le Tableau 1 résume les principaux résultats de cette étude. Quatorze cathétérismes étaient réalisés pour 12 patients (6 garçons et 6 filles). Il y avait 9 CIV périmembraneuses et 3 CIV musculaires. La moyenne de la taille des CIV était de 4,72. Les CIV étaient restrictives dans 11 cas et non restrictives dans un cas.
Tableau 1. Récapitulatif des résultats de l’étude (n=12).
|
Tableau 1. Récapitulatif des résultats de l’étude (n=12). | ||
|
Données |
Unité/catégorie |
Moyenne±écart-type [minimum-maximum] ou nombre |
|
Age |
(mois) |
65±41 [6-120] |
|
Sexe |
(garçons) |
6 |
|
Poids |
(kg) |
23±10 [9-43] |
|
Circonstances de découverte |
Infections pulmonaires à répétition |
5 |
|
Souffle systolique |
7 |
|
|
Taille CIV |
(mm) |
4,72 mm [3-6] |
|
Siège CIV |
Périmembraneux |
9 |
|
Trabéculé |
3 |
|
|
Type physiopathologique |
Restrictive |
11 |
|
Non restrictive |
1 |
|
|
PAPS |
(mmHg) |
28 [15-75] |
|
Lésions associées |
CIA os |
2 |
|
CAP |
1 |
|
|
Membrane sous aortique non obstructive |
1 |
|
|
Taille prothèse |
(mm) |
5,5 [4-6] |
|
Taux de succès |
(%) |
11/12= 92% |
|
Complications |
Embolisation de la prothèse |
1 |
|
BAV complet transitoire |
1 |
|
|
Suivi à 3 mois |
Shunts résiduels |
3 |
|
Insuffisance tricuspide grade I |
1 |
|
|
Insuffisance aortique grade I |
1 |
|
BAV: bloc auriculo-ventriculaire. CAP: canal artériel persistant. CIA os: communication inter-auriculaireostium secundum. CIV: communication interventriculaire. PAPS: pression artérielle pulmonaire systolique.
Onze prothèses type ADOII d’une taille moyenne de 5,5 [4-6] mm étaient implantées. Le taux de succès procédural était de 91,66%. Aucun décès n’était noté.
Deux complications majeures étaient constatées. La première est la survenue d’une embolisation de la prothèse dans l’artère pulmonaire gauche lors de deux tentatives distinctes de fermeture d’une CIV périmembraneuse de 6 mm par des prothèses ADOII 6/6. Il s’agissait d’un nourrisson de sexe masculin âgé de 20 mois et pesant 10,5 kg. L’indication de fermeture de son déficit était une dilatation marquée du ventricule gauche. L’extraction de la prothèse par un système lasso s’est passée sans incidents. Le nourrisson n’a pas gardé de séquelles et une fermeture chirurgicale de son déficit a été indiquée. La taille du dispositif n’était pas adaptée aux dimensions du déficit. Une deuxième procédure de fermeture d’une CIV périmembraneuse a été interrompue après la survenue d’un bloc auriculoventriculaire complet compliquée d’asystolie récupérée après réanimation cardiorespiratoire. La procédure était refaite deux semaines plus tard avec succès d’implantation de la prothèse sans incident.
Un shunt résiduel était constaté immédiatement chez cinq patients. Tous ces shunts étaient non significatifs. Une patiente a gardé une fuite aortique minime après fermeture de sa CIV périmembraneuse. Enfin, une insuffisance tricuspide résiduelle grade I était constatée également chez une patiente. L’insuffisance tricuspide était secondaire à un discret déplacement du feuillet septal de la tricuspide par le bord droit de la prothèse.
Au contrôle échographique réalisé à trois mois, la persistance de l’insuffisance valvulaire aortique et tricuspide ainsi que trois shunts résiduels minimes étaient notés. Tous les patients étaient stables sur le plan clinique.
DISCUSSION
La fermeture percutanée des CIV congénitales par la prothèse ADOII montre un taux élevé de succès procédural (92%) et un faible taux de complications (une embolisation de la prothèse et un bloc auriculoventriculaire complet transitoire).
En 1988, l’équipe de Lock à Boston a publié les premières fermetures de CIV musculaires, utilisant la prothèse Rashkind de fermeture du canal artériel (1 ). Depuis, diverses tentatives étaient réalisées en utilisant la prothèse Rashkind, le Clamshell, le Cardioseal, Starflex, Sideris, le coil et finalement les prothèses Amplatzer avec des taux de succès qui variaient de 77 à 100% (2, 3, 4, 5, 6). Les indications de fermeture étaient les mêmes que pour la chirurgie: CIV non restrictives avec résistances vasculaires pulmonaires réversibles ou CIV restrictives avec un shunt gauche-droit significatif (débit pulmonaire/débit systémique > 1,5/1).
Jusqu’au 2022, la fermeture percutanée des CIV congénitales est caractérisée par des taux de succès procédural élevés, 87 à 100% selon les plus larges séries (7, 8, 9, 10, 11, 12). La survenue d’un bloc auriculoventriculaire complet précoce ou tardif représente la principale complication de cette technique et concerne essentiellement les CIV de siège périmembraneux. La fréquence du bloc auriculoventriculaire était faible dans certaines études (0 à 1,6%) et élevé (3 à 20%) dans d’autres (12, 13, 14, 15, 16, 17). Les blocs auriculoventriculaires précoces sont généralement transitoires et secondaires à une lésion mécanique directe du tissu de conduction par le cathéter ou bien par la prothèse. Quant à ceux de survenue tardive, ils sont plutôt permanents et en rapport avec le processus inflammatoire et la fibrose qui surviennent après l’implantation d’un matériel étranger.
Les troubles du rythme (10%), les atteintes valvulaires représentées principalement par les insuffisances aortique et tricuspide (4%), et l’embolisation de la prothèse (0,4 à 2,5%) étaient rapportés également dans la littérature (9, 11, 12). L’embolisation itérative du dispositif dans notre cas était essentiellement expliquée par sa taille insuffisante et la difficulté de son positionnement du côté droit. Un poids < 15 kg était signalé également par certains auteurs comme un facteur de risque de migration des prothèses lors des tentatives de fermeture des CIV périmembraneuses (17 ). Les taux de mortalité étaient très faibles (0 à 0,23%) et dans la majorité des cas, les causes étaient plutôt d’origine extracardiaque (7, 11, 12). Bien que les taux rapportés de shunts résiduels étaient importants dans les différentes séries (6,7 à 50%), ils étaient souvent petits et hémodynamiquement non significatifs et se fermaient souvent secondairement tout au long du suivi (7, 8, 11, 12).
Malgré la faisabilité et la sûreté de cette technique, la difficulté réside dans le choix de la prothèse idéale pour chaque patient, qui change en fonction de la taille, la forme et le siège de la CIV. Dans cette étude, les auteurs ont opté pour les prothèses ADOII, spécifiquement conçues pour la fermeture du canal artériel, mais qui semblent aussi efficace dans la fermeture des CIV musculaires et périmembraneuses en particulier chez les nouveau-nés et les nourrissons. Les prothèses ADOII sont constituées de deux disques de rétention reliés par un corps central et articulés. Cette conception symétrique ainsi que leur caractère flexible permet de minimiser l’interférence avec le tissu de conduction (18 ). Le dispositif est largué à l’aide d’une gaine souple et disponible en 4 et 5 french (19, 20). Ceci réduit le risque de lésions vasculaires fémorales et permet un largage plus facile par voie artérielle ou veineuse. Leur principale limite est leur taille avec un diamètre maximal de 6 mm.
Dans cette étude; le taux de succès était satisfaisant (92%), avec des complications minimes et sans décès. Les shunts résiduels étaient présents immédiatement chez environ 40% des patients, mais ils avaient tendance à disparaître au fil du temps. Nos résultats sont superposables aux données publiées par de nombreuses études (20, 21, 22, 23).
Limites de l’étude
Le caractère rétrospectif et monocentrique de l’étude, la petite taille de l’échantillon, ainsi que l’absence de suivi à long terme ne permettent pas d’en tirer des conclusions définitives. Une étude prospective multicentrique incluant une centaine de patients, avec un suivi sur cinq ans sont recommandés.
Conclusion
L’expérience débutante de l’équipe de cardiologie de Sahloul (Sousse, Tunisie) réconforte la faisabilité et la sécurité de la fermeture percutanée des CIV musculaires et périmembraneuses par les prothèses ADOII. Un suivi à long terme reste cependant requis.
References
- Lock J E, Block P C, Mckay R G, Baim D S, Keane J F. Circulation. 2. Vol. 78. Ovid Technologies (Wolters Kluwer Health); 1988. Transcatheter closure of ventricular septal defects. pp. 361–368. [DOI] [PubMed] [Google Scholar]
- Thanopoulos Basil (Vasilios) D, Tsaousis George S, Konstadopoulou Georgia N, Zarayelyan Armine G. Journal of the American College of Cardiology. 5. Vol. 33. American College of Cardiology Foundation Washington, DC; 1999. Transcatheter closure of muscular ventricular septal defects with the Amplatzer ventricular septal defect occluder: initial clinical applications in children; pp. 1395–1399. [DOI] [PubMed] [Google Scholar]
- Janorkar Satej, Goh Tiow, Wilkinson James. Catheterization and Cardiovascular Interventions. 1. Vol. 46. Wiley; 1999. Transcatheter closure of ventricular septal defects using the Rashkind device: Initial experience; pp. 43–48. [DOI] [PubMed] [Google Scholar]
- Sideris Eleftherios B, Walsh Kevin P, Haddad Jorge L, Chen Chuan-Rong, Ren Seng Gen, Kulkarni H. Heart. 3. Vol. 77. BMJ Publishing Group Ltd; 1997. Occlusion of congenital ventricular septal defects by the buttoned device." Buttoned device" Clinical Trials International Register. pp. 276–279. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Bridges Nancy D, Perry Stanton B, Keane John F, Goldstein Steven A N, Mandell Valerie, Mayer John E, Jonas Richard A, Casteneda Aldo R, Lock James E. New England Journal of Medicine. 19. Vol. 324. Massachusetts Medical Society; 1991. Preoperative Transcatheter Closure of Congenital Muscular Ventricular Septal Defects; pp. 1312–1317. [DOI] [PubMed] [Google Scholar]
- Knauth Alison L, Lock James E, Perry Stanton B, Mcelhinney Doff B, Gauvreau Kimberlee, Landzberg Michael J, Rome Jonathan J, Hellenbrand William E, Ruiz Carlos E, Jenkins Kathy J. Circulation. 5. Vol. 110. Ovid Technologies (Wolters Kluwer Health); 2004. Transcatheter Device Closure of Congenital and Postoperative Residual Ventricular Septal Defects; pp. 501–507. [DOI] [PubMed] [Google Scholar]
- Carminati M, Butera G, Chessa M, De Giovanni J, Fisher G, Gewillig M, Peuster M, Piechaud J F, Santoro G, Sievert H, Spadoni I, Walsh K. European Heart Journal. 19. Vol. 28. Oxford University Press (OUP); 2007. Transcatheter closure of congenital ventricular septal defects: results of the European Registry; pp. 2361–2368. [DOI] [PubMed] [Google Scholar]
- Butera Gianfranco, Chessa Massimo, Carminati Mario. Journal of Cardiovascular Medicine. 1. Vol. 8. Ovid Technologies (Wolters Kluwer Health); 2007. Percutaneous closure of ventricular septal defects. State of the art; pp. 39–45. [DOI] [PubMed] [Google Scholar]
- Carminati Mario, Butera Gianfranco, Chessa Massimo, Drago Manuela, Negura Diana, Piazza Luciane. The American Journal of Cardiology. 12. Vol. 96. Elsevier; 2005. Transcatheter closure of congenital ventricular septal defect with Amplatzer septal occluders; pp. 52–58. [DOI] [PubMed] [Google Scholar]
- Butera Gianfranco, Piazza Luciane, Saracino Antonio, Chessa Massimo, Carminati Mario. Transcatheter Closure of Membranous Ventricular Septal Defects-Old Problems and New Solutions. Interventional Cardiology Clinics. 2012;2(1):85–91. doi: 10.1016/j.iccl.2012.09.003. [DOI] [PubMed] [Google Scholar]
- Yang Linqi, Tai Bee-Choo, Khin Lay Wai, Quek Swee Chye. Journal of Interventional Cardiology. 3. Vol. 27. Wiley; 2014. A Systematic Review on the Efficacy and Safety of Transcatheter Device Closure of Ventricular Septal Defects (VSD) pp. 260–272. [DOI] [PubMed] [Google Scholar]
- Santhanam Haripriya, Yang Linqi, Chen Zhaojin, Tai Bee-Choo, Rajgor Dimple D, Quek Swee-Chye. International Journal of Cardiology. Vol. 254. Elsevier BV; 2018. A meta-analysis of transcatheter device closure of perimembranous ventricular septal defect; pp. 75–83. [DOI] [PubMed] [Google Scholar]
- Cinteză E E, Butera G. Complex ventricular septal defects. Romanian J Morphol Embryol Rev Roum Morphol Embryol. 2016;57(4):60177–60178. [PubMed] [Google Scholar]
- Narin Nazmi, Baykan Ali, Pamukcu Ozge, Argun Mustafa, Ozyurt Abdullah, Mese Timur, Yilmazer Murat Muhtar, Gunes Isin, Kazım Uzum. Journal of Interventional Cardiology. 5. Vol. 28. Wiley; 2015. ADO II in Percutaneous VSD Closure in Pediatric Patients; pp. 479–484. [DOI] [PubMed] [Google Scholar]
- Fischer Gunther, Apostolopoulou Sotiria C, Rammos Spyros, Schneider Martin B, Bjørnstad Per G, Kramer Hans Heiner. Cardiology in the Young. 5. Vol. 17. Cambridge University Press (CUP); 2007. The Amplatzer<sup>®</sup> Membranous VSD Occluder and the vulnerability of the atrioventricular conduction system; pp. 499–504. [DOI] [PubMed] [Google Scholar]
- Predescu Dragos, Chaturvedi Rajiv R, Friedberg Mark K, Benson Lee N, Ozawa Akira, Lee Kyong-Jin. The Journal of thoracic and cardiovascular surgery. 5. Vol. 136. Elsevier; 2008. Complete heart block associated with device closure of perimembranous ventricular septal defects; pp. 1223–1228. [DOI] [PubMed] [Google Scholar]
- Bentham James R, Gujral Arjun, Adwani Satish, Archer Nick, Wilson Neil. Cardiology in the Young. 3. Vol. 21. Cambridge University Press (CUP); 2011. Does the technique of interventional closure of perimembranous ventricular septal defect reduce the incidence of heart block? pp. 271–280. [DOI] [PubMed] [Google Scholar]
- Vijayalakshmi IB1, Narasimhan Chitra, Singh Bhupinder, Manjunath CN. Catheterization and Cardiovascular Interventions. 6. Vol. 89. Wiley Online Library; 2017. Treatment of congenital non-ductal shunt lesions with the amplatzer duct occluder II; pp. 185–193. [DOI] [PubMed] [Google Scholar]
- Ovaert Caroline, Kammache Issam, Bonello Béatrice, Habib Gilbert, Fraisse Alain. Archives of Cardiovascular Diseases Supplements. 2. Vol. 3. Elsevier; 2011. Occlusion percutanée des communications intercardiaques; pp. 154–162. [Google Scholar]
- Tahlawi Mohammad El, Kammache Issam, Fraisse Alain. Catheterization and Cardiovascular Interventions. 2. Vol. 77. Wiley Online Library; 2011. Ventricular septal defect closure in a small children with the Amplatzer Duct Occluder II; pp. 268–271. [DOI] [PubMed] [Google Scholar]
- Tan Christopher A, Levi Daniel S, Moore John W. Catheterization and Cardiovascular Interventions. 3. Vol. 66. Wiley; 2005. Percutaneous closure of perimembranous ventricular septal defect associated with a ventricular septal aneurysm using the Amplatzer ductal occluder; pp. 427–431. [DOI] [PubMed] [Google Scholar]
- Dilawar Muhammad, Numan Mohammed, El-Sisi Amal, Gendi Salwa Morcos, Ahmad Zaheer. Pediatric Cardiology. 2. Vol. 29. Springer Science and Business Media LLC; 2008. Percutaneous Closure of Ventricular Septal Defect Associated with Tunnel-Shaped Aneurysm Using the Amplatzer Duct Occluder; pp. 366–370. [DOI] [PubMed] [Google Scholar]
- Kanaan M, Ewert P, Berger F, Assa S, Schubert S. Pediatric Cardiology. 2. Vol. 36. Springer Science and Business Media LLC; 2015. Follow-Up of Patients with Interventional Closure of Ventricular Septal Defects with Amplatzer Duct Occluder II; pp. 379–385. [DOI] [PubMed] [Google Scholar]