









L’influenza rappresenta un problema di sanità pubblica con un considerevole impatto dal punto di vista epidemiologico, clinico, economico e sociale. Ciò è riconducibile a più fattori, quali: l’ubiquità e la contagiosità della malattia, la variabilità antigenica dei virus, l’andamento epidemico (e talvolta pandemico) e stagionale, la possibilità di complicanze gravi specialmente in alcune categorie di soggetti (bambini, anziani, persone con comorbosità e malattie croniche), i costi di gestione in caso di complicanze e i costi sociali (giorni lavorativi persi, perdita di produttività, ecc.) [1-4].
Globalmente, ogni anno, il virus influenzale colpisce tra il 5 e il 15% della popolazione adulta (vale a dire da 350 milioni a 1 miliardo di persone) [5], un’incidenza che sale al 20-30% nella popolazione pediatrica [6, 7], in cui il rischio di infezione è maggiore a causa della limitata immunità preesistente dei bambini [8]. Tra i 3 e i 5 milioni di casi di influenza riportati annualmente evolvono in complicanze che causano il decesso in circa il 10% dei casi (vale a dire da 250 a 500 mila persone), soprattutto tra i gruppi di popolazione a rischio (bambini sotto i 5 anni, anziani e persone affette da malattie croniche) [5, 9]. Le infezioni del tratto respiratorio inferiore e superiore sono le principali conseguenze dell’influenza stagionale. È stato stimato che circa 290.000-650.000 decessi per cause respiratorie sono attribuibili all’influenza ogni anno [10]. Inoltre, diverse complicazioni extra-respiratorie, come quelle del sistema cardiovascolare e nervoso, hanno un impatto importante, soprattutto nei pazienti più vulnerabili [10].
In Europa, l’influenza provoca 4-50 milioni di casi sintomatici all’anno, circa 15.000-70.000 decessi [11] e 150.000 ricoveri ospedalieri correlati all’influenza [12]. Specifici gruppi vulnerabili (anziani, pazienti con malattie croniche e comorbosità, bambini di età inferiore ai 5 anni e donne in gravidanza) sono maggiormente a rischio di sviluppare malattie gravi, complicanze e morire a causa dell’influenza [13].
Gli effetti del virus influenzale non sono uguali nel mondo. Nei Paesi industrializzati l’influenza si rivela fatale soprattutto tra le persone di età superiore ai 65 anni. L’impatto nei Paesi in via di sviluppo non è noto con certezza, tuttavia si stima che l’influenza causi un’elevata percentuale di decessi tra i bambini [5]. Infatti, ogni anno circa 870.000 bambini sotto i 5 anni di età, ricevono un ricovero attribuibile all’influenza e si stima che tra i 28.000 e i 111.500 decessi in questa fascia di età siano attribuibili a cause legate all’influenza, la stragrande maggioranza dei quali si verifica nei paesi in via di sviluppo [14].
La frequenza con cui insorgono casi di influenza, pur essendo assai diversa da stagione a stagione, si aggira mediamente intorno al 9% (range: 4-15%) della popolazione generale ogni anno, mentre nella fascia d’età 0-14 anni, che è quella più colpita, l’incidenza è pari in media al 26% (12-40%) [15]. Come evidenziano i dati nazionali e internazionali, l’influenza è un problema che interessa tutta la popolazione, indipendentemente dall’età e dal sesso. Tuttavia, esistono alcune tipologie di soggetti, definiti fragili, che presentano un rischio maggiore di contrarre l’influenza, di trasmetterla e di sviluppare complicanze a essa correlate. L’Organizzazione Mondiale della Sanità (OMS) ha suddiviso questi soggetti in cinque diverse categorie a rischio, ovvero i bambini al di sotto dei 5 anni di età, le donne in gravidanza, i soggetti over 65, i pazienti cronici e gli operatori sanitari [5]. L’epidemia influenzale stagionale, inoltre, è responsabile di buona parte dell’eccesso di mortalità che ogni inverno viene registrato dai sistemi di sorveglianza di tutto il mondo e che colpisce per oltre il 90% i soggetti di età superiore ai 65 anni, specialmente quelli con condizioni cliniche croniche preesistenti [16].
Vaccinarsi, dunque, rappresenta il modo migliore di prevenire e combattere l’influenza, sia perché aumenta notevolmente la probabilità di non contrarre la malattia sia perché, in caso di sviluppo di sintomi influenzali, questi sono molto meno gravi e, generalmente, non seguiti da ulteriori complicanze. Inoltre, la vaccinazione antinfluenzale (in tutte le età) rappresenta un’importante misura di protezione non solo individuale ma anche per la collettività, riduce la probabilità di complicanze e di conseguenza l’impatto in termini di carico assistenziale (ospedalizzazioni, visite ambulatoriali, farmaci) [17] e l’impatto per le famiglie e per la società (assenze scolastiche dei bambini e giornate lavorative perse, sia a causa di una malattia secondaria in un caregiver che per la necessità di cure per un bambino malato o per un paziente fragile; perdita di produttività per i lavoratori ecc.) [6, 18]. Ad esempio, i bambini più piccoli svolgono un ruolo importante nella trasmissione dell’influenza alle loro famiglie e alla comunità [19] e, pertanto, la vaccinazione antinfluenzale in questa popolazione target può ridurre, a livello comunitario, i tassi di malattia negli individui non immunizzati [20].
Tuttavia, nonostante il valore e i benefici reali e tangibili della vaccinazione antinfluenzale siano riconosciuti a livello globale e molte siano state le iniziative introdotte a sostegno di questa vaccinazione negli ultimi anni, in molti Paesi europei e anche in Italia, si continuano a registrare valori non ottimali di coperture vaccinali, sia in età pediatrica che in età adulta, con importanti ricadute a livello sanitario, sociale ed economico.
In Italia, le coperture non hanno ancora raggiunto le soglie del 75 e del 95% indicate dall’OMS e dal Piano Nazionale di Prevenzione Vaccinale (PNPV) 2017-2019 [21]. I dati relativi alla popolazione generale per la stagione 2020/2021 mostrano un sensibile aumento delle coperture vaccinali che passano da 16,8% della stagione precedente al 23,7% dell’ultima stagione disponibile (dati aggiornati 24 luglio 2021). Negli anziani si osserva, a partire dalla stagione 2015-2016, un costante aumento della copertura, che si attesta al 65,3% dell’ultima stagione. La copertura degli anziani è aumentata di circa 11 punti percentuali rispetto alla stagione precedente (54,6), verosimilmente anche a causa della pandemia da COVID-19. Tuttavia, è importante sottolineare che, proprio negli anziani (categoria di persone a rischio), il valore di copertura (65,3%) si discosta ancora sia dai livelli di copertura ottimali (95%) sia da quelli minimi (75%) [22].
Pertanto, in Italia, il livello di immunizzazione non risulta ancora sufficiente a garantire la protezione della popolazione, in particolar modo delle fasce più deboli e più suscettibili, determinando un incremento considerevole del burden di malattia.
Il livello non ottimale dei tassi di copertura vaccinale può essere in parte attribuibile alla cosiddetta Vaccine Hesitancy (“esitazione vaccinale”), definita dallo Strategic Advisory Group of Experts (SAGE) on Immunization dell’OMS come la tendenza a ritardare o rifiutare la vaccinazione pur in presenza della disponibilità di tale servizio [23]. La Vaccine Hesitancy oggi rappresenta una vera minaccia per la salute e il benessere dei cittadini, determinando effetti rilevanti sull’efficacia dei programmi di immunizzazione all’interno dei Paesi europei.
Un fattore determinante che ha portato all’aumento dello scetticismo nei confronti dei vaccini risiede, infatti, nella divulgazione di informazioni prive di fondamento scientifico, amplificate dall’utilizzo dei social media e del web. Pertanto è urgente e necessario sviluppare competenze organizzative a livello locale, nazionale e globale al fine di identificare, monitorare e contrastare proattivamente l’esitazione vaccinale e rispondere tempestivamente ai movimenti anti-vaccinazione in caso di disinformazione o di potenziali eventi avversi [24].
Una survey dell’Eurobarometro del 2019 [25] ha messo in luce come in Europa soltanto l’85% dei cittadini ritiene che i vaccini siano efficaci nella prevenzione delle malattie infettive (la percentuale scende al 78% per la popolazione italiana). Sono preoccupanti i dati che riguardano l’Italia: quasi la metà della popolazione (48% vs il 29% degli europei) ritiene che le vaccinazioni siano importanti solo per i bambini. Un terzo della popolazione è convinto che i vaccini indeboliscano il sistema immunitario o che possano causare la malattia da cui proteggono (34%). Un quarto della popolazione ritiene che non sia importante ricevere le vaccinazioni raccomandate (il dato complessivo europeo è 15%).
Un altro dato allarmante riguarda gli operatori sanitari: la vaccinazione antinfluenzale, oltre a essere efficace per prevenire l’influenza stagionale, riduce il burden di malattia e l’assenteismo del personale nonché i costi derivanti dalla perdita di produttività. Nonostante l’efficacia della vaccinazione antinfluenzale, la copertura stagionale tra gli operatori sanitari continua a essere generalmente bassa [26].
Patologie prevenibili con vaccino come l’influenza hanno un impatto rilevante non solo sul sistema sanitario e socio-assistenziale, ma anche sul sistema produttivo ed economico. La vaccinazione antinfluenzale, infatti, contribuisce alla sostenibilità della spesa sanitaria pubblica grazie ai possibili risparmi generati in termini di riduzione di: numero di ricoveri, spese per le cure mediche per la malattia e le eventuali complicanze, recrudescenze ed epidemie. Riduce, inoltre, la mancata produttività per assenza dal lavoro così come dimostrato in uno studio osservazionale retrospettivo pubblicato nel 2019 su Plos One [26]. Lo studio ha analizzato il tasso di copertura vaccinale tra tutti i dipendenti (operatori sanitari e personale amministrativo) di un grande policlinico universitario romano, durante la stagione influenzale 2017-2018, al fine di effettuare un’analisi economica sulla vaccinazione antinfluenzale (valutando l’assenteismo dovuto alla malattia nel periodo epidemico) e valutando l’impatto della vaccinazione in termini sia di costi che di giorni di malattia.
Il tasso di copertura della vaccinazione antinfluenzale è stato del 9,8% tra 4631 operatori sanitari e 852 impiegati amministrativi. È stata stimata una perdita di produttività pari a 297,06 € per ciascun lavoratore vaccinato e 517,22 € per ciascun lavoratore non vaccinato (rapporto costo-outcome: 120,07 €/giorno di malattia). Applicando il metodo del friction cost, è stata riscontrata una perdita di produttività pari a 237,65 € per ciascun lavoratore vaccinato e 413,78 € per ciascun lavoratore non vaccinato (rapporto costo-outcome: 104,19 € /giorno di malattia). Questi risultati hanno confermato i benefici della vaccinazione antinfluenzale per la società e per l’azienda [26].
Un altro recente lavoro italiano ha valutato l’impatto economico e fiscale dei vaccini contro l’influenza, lo pneumococco e l’Herpes-Zoster in Italia e nell’analisi costi-benefici condotta gli autori hanno riportato che investire nella vaccinazione antinfluenzale comporta benefici che equivalgono a 1,8 volte il valore dell’investimento in termini di impatto fiscale e 11,1 volte in termini di perdita di produttività [27].
Purtroppo, la crisi economica che ha investito i Paesi industrializzati ci induce a una necessaria razionalizzazione della spesa anche in ambito sanitario, con la conseguente minore propensione all’acquisto e all’implementazione di nuovi vaccini, pur nell’evidenza di una loro sempre maggiore sicurezza ed efficacia. Di fatto l’attenzione dei decisori tende a orientarsi più verso un’ottica di contenimento piuttosto che verso una di investimento, con il risultato che le vaccinazioni vengono prese in considerazioni immediatamente solo se generatrici di risparmio dal punto di vista del Servizio Sanitario e se il ritorno dell’investimento è a breve termine. Tuttavia, programmi di vaccinazione efficaci possono generare risparmi per i sistemi sanitari, liberando risorse da reinvestire per sostenere l’innovazione in sanità. Rispetto ad altri settori, investire in vaccinazione garantisce un notevole ritorno: per 1 dollaro speso se ne risparmiano da 16$, per i costi della malattia evitati, a 44$, se si considerano anche l’aumento delle risorse da reinvestire a disposizione dei sistemi sanitari e l’aumento della durata e qualità della vita della popolazione [28].
Peraltro, ai valori clinico-epidemiologico ed economico delle vaccinazioni dovrebbe essere aggiunto anche il valore sociale della pratica vaccinale.
Il fenomeno della protezione comunitaria ottenibile per molti vaccini, a seguito del raggiungimento di un’elevata copertura immunitaria nella popolazione bersaglio, più comunemente nota come” immunità di gregge”, ha rappresentato da sempre il valore aggiunto della vaccinazione a livello sociale [29].
Per la maggior parte delle malattie, ottenere elevate coperture vaccinali permette, infatti, di contenere la circolazione del microrganismo responsabile e, conseguentemente, garantisce una protezione alla comunità, cioè anche ai non vaccinati. L’impatto sulla salute della popolazione risulta, dunque, notevole in termini di contenimento dei danni della malattia o delle sue complicanze (morbosità, mortalità, ricorso a cure mediche, ospedalizzazioni) e di riduzione dei costi sia diretti che indiretti [29, 30].
Le malattie infettive non riconoscono confini geografici e/o politici e tutte, ma in particolare quelle prevenibili da vaccino, richiedono un approccio globale e non localistico per la loro prevenzione e il loro controllo. Tali strategie richiedono necessariamente l’abbattimento di barriere ideologiche e politiche, ma anche di ostacoli economici e culturali, a favore di un approccio collettivo e globale a difesa della salute delle popolazioni.
In Italia, il PNPV 2017-2019 [21] rappresenta un importante contributo per la tutela della salute pubblica nel nostro Paese. È uno strumento all’avanguardia che rende l’Italia il Paese europeo con il più completo piano vaccinale, grazie al quale sono messe gratuitamente a disposizione del cittadino tutte le vaccinazioni.
Le vaccinazioni rappresentano un intervento importante di Sanità Pubblica, uno strumento da sostenere con ogni mezzo per scongiurare a tutta la popolazione l’ombra e il peso di malattie infettive che sono, invece, potenzialmente facilmente contrastabili come l’influenza.
Per affrontare le sfide attuali dell’assistenza sanitaria mondiale occorre riorganizzare il “sistema salute” tenendo in considerazione le esigenze di tutti gli stakeholder e ponendo al centro il “valore”. Il concetto di valore non deve riferirsi solo agli esiti di salute (outcome) relativi ai costi, ma deve tener conto di quanto bene le risorse siano distribuite a differenti gruppi di popolazione (valore allocativo), di quanto queste risorse siano appropriatamente usate per raggiungere risultati di salute, relativamente a individui con specifici bisogni, presenti nella popolazione (valore tecnico) e di quanto questi risultati di salute siano allineati al sistema valoriale di ciascun individuo e alle sue preferenze (valore personale).
Recentemente (luglio 2019) anche l’Expert Panel on Effective Ways of Investing in Health (EXPH) istituito dalla Commissione Europea, ha pubblicato un importante documento dal titolo “Opinion on Defining value in Value-Based Healthcare” [31]. Il gruppo di esperti propone il modello di “quadruple value”, aggiungendo una quarta dimensione del valore: il valore sociale o societal value.
L’EXPH propone, quindi, l’assistenza sanitaria basata sul valore come un concetto completo fondato su quattro value-pillars: un’assistenza adeguata per raggiungere gli obiettivi personali dei pazienti (valore personale), il conseguimento di migliori risultati possibili con le risorse disponibili (valore tecnico), un’equa distribuzione delle risorse tra tutti i gruppi di pazienti (valore allocativo) e il contributo dell’assistenza sanitaria alla partecipazione e alla connessione sociale (valore sociale). Queste quattro dimensioni del “valore” assicurano i pilastri fondamentali dei sistemi sanitari basati sulla solidarietà: il principio di equità può essere assicurato da un’equa allocazione delle risorse; un’equa distribuzione può essere assicurata dal contributo dell’assistenza sanitaria alla coesione sociale; l’efficienza può essere garantita da un’ottimale allocazione delle risorse; la centralità del paziente e la qualità dell’assistenza possono essere garantite da un’interazione, mirata su benefici e danni per la salute, tra medici e pazienti.
Una riallocazione delle risorse da interventi sanitari di basso valore a interventi di alto valore è percepita dall’Expert Panel come la principale necessità dei sistemi sanitari europei sostenibili e resilienti. Una strategia a lungo termine, promossa da un solido sistema di Governance, è raccomandata al fine di realizzare un cambiamento culturale che consenta di reinvestire risorse in un’assistenza sanitaria di alto valore [31].
Sulla base di quanto descritto, risulta evidente l’esigenza di prendere in esame una Strategia value-based di Immunizzazione contro l’influenza, con l’obiettivo di mettere concretamente il cittadino/paziente al “centro”. Questa esigenza è strettamente collegata all’evidente impatto sociale delle vaccinazioni e alle difficoltà crescenti di Sistemi Sanitari che, seppur attraversati da profonde trasformazioni organizzative e stretti nella morsa di una crescita esponenziale dei bisogni di salute, a fronte di una dotazione essenzialmente isorisorse, sono chiamati ad assicurare una gestione unitaria e integrata delle patologie prevenibili da vaccino.
Questo approccio value(S)-based si sposa perfettamente con l’agenda promossa nel settembre 2019 dalla Commissione Europea e dall’OMS che hanno pubblicato il documento “Dieci azioni verso la vaccinazione per tutti” [32], definendo un vero e proprio decalogo per garantire la vaccinazione per tutti e contrastare, e laddove possibile eliminare, le malattie prevenibili con vaccino. Il documento rappresenta un importante atto per rinforzare l’implementazione delle strategie vaccinali già in atto.
Il successo delle vaccinazioni dipende non solo dalle scelte del Paese, ma anche dall’impegno di tutti gli stakeholder per le rispettive competenze. Per promuovere il benessere dei cittadini e migliorare la buona salute è necessario utilizzare un approccio olistico e definire una visione strategica intersettoriale e multisettoriale. In questa ottica occorre armonizzare il sistema della Prevenzione in ogni Paese, secondo i principi della Salute in tutte le politiche, al fine di ridurre le disuguaglianze e i costi sanitari e sociali e garantire uno sviluppo sostenibile, come previsto dall’Agenda 2030 delle Nazioni Unite [33]. L’attuale quadro epidemiologico, caratterizzato dall’invecchiamento della popolazione, dalla elevata prevalenza delle malattie croniche non trasmissibili, dall’emergenza e ri-emergenza di malattie infettive, dai numerosi rischi per la salute correlati a fattori ed esposizioni ambientali, richiede una forte focalizzazione della programmazione strategica sulla prevenzione e sulla promozione della salute.
È necessario, pertanto, che gli operatori sanitari (in particolare professionisti di Sanità Pubblica, Pediatri, Medici di Medicina Generale), l’intera comunità scientifica, le Istituzioni e i decisori si impegnino, ciascuno per le proprie competenze e responsabilità, per favorire il corretto utilizzo dei vaccini e nel salvaguardare l’indiscusso valore sociale delle vaccinazioni, patrimonio di tutti i cittadini, indipendentemente dallo stato sociale e dal luogo di residenza.
L’influenza è una malattia respiratoria acuta determinata da un Orthomyxoviridae ad RNA a singolo filamento, noto come “virus influenzale” e classificato in tre tipologie principali: Influenzavirus A, Influenzavirus B e Influenzavirus C. Sebbene il virus dell’influenza sia “compagno di viaggio” dell’umanità da millenni, ancora oggi è responsabile di un numero consistente di decessi annui, stimati globalmente tra i 250.000 e i 500.000. Dei tre tipi di virus influenzale esistenti, il tipo A è quello dotato di maggior virulenza e attore principale delle tipiche epidemie invernali delle regioni temperate. Si tratta del tipo più diffuso in natura, circolante sia nell’uomo che in altre specie animali e ulteriormente caratterizzabile in sottotipi a seconda delle proteine di superficie (HA, emoagglutinina, e NA, neuraminidasi), che rappresentano i principali antigeni virali, ovvero “l’aspetto” del microrganismo agli occhi del sistema immunitario. Caratteristica peculiare del virus è il suo potenziale epidemico-pandemico, determinato da meccanismi di deriva (drift) e commutazione (shift) antigenica, responsabili rispettivamente dell’acquisizione di mutazioni puntiformi o del totale sovvertimento a carico degli antigeni di superficie (HA e NA). Il fenomeno di drift riguarda sia il sottotipo A sia il sottotipo B, nonostante quest’ultimo abbia una ridotta possibilità di mutazione; invece, lo shift si verifica unicamente nel sottotipo A [1].
Nel corso degli ultimi due secoli di storia naturale del virus, alcune mutazioni a carico degli antigeni di superficie del sottotipo A, originate dal riassortimento genetico con ceppi albergati nel serbatoio animale, hanno originato tre sottotipi antigenici distinti, che hanno provocato altrettante pandemie: H1N1, H2N2 e H3N2 [2].
Ripercorrendo gli avvenimenti storici, al virus influenzale si possono imputare le tre grandi pandemie del novecento, caratterizzate da un aumento di morbilità e mortalità dovute all’assenza di memoria immunologica della popolazione colpita nei confronti di nuovi ceppi virali o di sottotipi non più circolanti da tempo.
La prima pandemia, nota come uno degli eventi più letali della modernità, risale al biennio 1918-1919 ed è passata alla storia come “la Spagnola”. Una delle peculiarità della “Spagnola” risiede nella distribuzione della maggiore mortalità: infatti, se generalmente l’influenza miete il maggior numero di vittime nell’infanzia e nella vecchiaia, questa provocò una mortalità maggiore negli individui di età compresa tra 25 e 44 anni e, per la prima volta nella storia conosciuta, il 99% dei morti si contò tra persone di età inferiore ai 65 anni [3].
A provocare l’infezione che, secondo le stime, interessò circa un terzo della popolazione mondiale e causò oltre 50 milioni di decessi, fu il virus dell’influenza A, sottotipo H1N1, sequenziato negli anni Novanta grazie a materiale autoptico conservato [4]. Dai dati disponibili si evince che si trattava di un virus completamente nuovo per l’umanità, originato da un ospite sconosciuto. Il virus ha continuato a circolare tra gli esseri umani negli anni successivi al biennio pandemico, provocando epidemie stagionali fino agli anni Cinquanta, quando emerse un nuovo ceppo pandemico A, sottotipo H2N2, responsabile nel 1957 dell’influenza “Asiatica” [5].
In quell’occasione, gli scienziati furono in grado di caratterizzare il virus responsabile della malattia, poiché negli anni ‘30 i progressi scientifici avevano consentito l’isolamento e lo studio del primo virus influenzale umano (H0N1). Per quanto riguarda la mortalità, questa volta le vittime furono per lo più persone fragili con patologie croniche [6].
Il virus A H2N2 scomparve in un decennio, fino alla comparsa del nuovo ceppo H3N2 responsabile della pandemia “Hong Kong” nel 1968, che determinò tassi di mortalità differenti nei diversi continenti [7].
Ci furono altri due momenti storici, forse meno noti, durante i quali si prospettò l’avvento di una nuova pandemia: il primo risale al 1947, quando un virus noto come “Influenza A prime”, per caratteristiche strutturali peculiari, si diffuse in estremo Oriente tra i soldati americani e poi in basi militari americane, provocando fortunatamente un numero limitato di morti. La seconda minaccia di pandemia, invece, si verificò nel 1977 quando ricomparve il virus A H1N1: originata nella Cina nord-orientale, l’epidemia si diffuse rapidamente in Unione Sovietica assumendo il nome di “Influenza Russa”. Fu caratterizzata da un quadro clinico lieve e si diffuse in soggetti giovani di età inferiore ai 25 anni, probabilmente perché questi erano scoperti da qualunque sorta di protezione contro i ceppi circolanti nella prima metà del Novecento, strutturalmente simili al ricomparso virus A H1N1. Più recentemente, si sono verificate alcune stagioni influenzali di maggiore intensità, come quella del 2003-2004, caratterizzata dalla diffusione di un virus A, sottotipo H3N2, particolarmente aggressivo.
Un’ulteriore minaccia pandemica è rappresentata dai ceppi influenzali di origine animale: infatti, dal 1997 sono attenzionate sindromi influenzali umane determinate da clade virali aviari. Nel 2006 il ceppo di influenza aviaria A H5N1 fu responsabile di un focolaio di infezioni tra il personale dedicato all’allevamento di volatili nel Sud-Est asiatico, con un elevatissimo tasso di mortalità. Nonostante l’indagine epidemiologica non abbia documentato trasmissione interumana, l’evento provocò un allarme generale per la possibile futura comparsa di una variante virale originata dalla commistione tra un ceppo aviario letale e un ceppo umano, che rappresenterebbe una grave minaccia aggravata dall’assenza di trattamenti farmacologici efficaci contro di essa.
Eventi come quelli finora descritti evidenziano come la sorveglianza delle malattie infettive acute è strumento necessario e imprescindibile per il loro controllo. In particolare, identificare precocemente ciò che può rappresentare un pericolo per la collettività rappresenta il “primum movens” per la risoluzione del problema, o per lo meno per la sua gestione. Come risultato, è possibile ottenere una riduzione della morbosità e mortalità per la patologia, oltre che apportare un contributo alla conoscenza della stessa con dati utili per la ricerca [8].
Per le sue caratteristiche epidemiologiche e virologiche e per l’importanza che assume nel setting della gestione delle infezioni respiratorie soprattutto nei soggetti più vulnerabili (per età o per patologie concomitanti), il virus influenzale è stato ed è a tutt’oggi oggetto di una vasta rete di sistemi di sorveglianza che monitora in maniera costante e a livello globale il suo andamento. L’obiettivo è rilevare la distribuzione geografica dei diversi tipi e sottotipi virali durante la stagione epidemica e al di fuori della stessa, effettuare un confronto sierologico e molecolare tra i ceppi epidemici e i ceppi vaccinali, valutare la suscettibilità dei virus circolanti agli antivirali e fornire alle autorità sanitarie le informazioni ottenute in modo da guidare la composizione dei vaccini anti-influenzali futuri adattandoli alle variazioni antigeniche del virus.
Storicamente, la nascita dei sistemi di sorveglianza risale al 1946, quando le Nazioni Unite istituirono una Commissione per lo sviluppo di un programma di tutela della salute pubblica, che poi sarebbe diventata l’Organizzazione Mondiale della Sanità (OMS). La Commissione, conscia del pericolo pandemico rappresentato dall’influenza e reduce dall’evento epidemico del 1947, decise di finanziare un Centro mondiale per l’influenza sotto l’egida del Medical Research Council nel Regno Unito. Questa importante decisione è oggi considerata come la nascita del Global Influenza Program (GIP). Il GIP è ancora oggi una piattaforma globale per la segnalazione, l’analisi e la diffusione delle informazioni sulla sorveglianza dell’influenza. In seguito, nel 1952 l’OMS istituì il sistema di sorveglianza integrata globale che prende il nome di Global Influenza Surveillance and Response System (GISRS). All’interno del GISRS, cui partecipano 110 Paesi, operano quattro Centri di Collaborazione dell’OMS (CC) e sette Essential Regulatory Laboratories (ERL). Ruolo fondamentale nell’Organizzazione è svolto dai Centri Nazionali per l’Influenza (NIC), istituzioni designate dai Ministeri della Salute nazionali e riconosciute dall’OMS. I NIC si occupano della raccolta di campioni virali, svolgendo su di essi alcune analisi preliminari; successivamente, i campioni clinici selezionati vengono inviati ai CC dell’OMS, che si occuperanno delle analisi genetiche e antigeniche avanzate. La condivisione tempestiva dei campioni biologici reputati significativi è fondamentale per mettere in atto misure preventive su larga scala. La diffusione delle informazioni ottenute da parte del GISRS e delle istituzioni epidemiologiche nazionali avviene tramite gli strumenti FluNet e FluID: il primo fu lanciato nel 1997 come strumento Web di sorveglianza virologica per tracciare la diffusione del virus a livello globale e interpretare i dati epidemiologici, mentre il secondo crea un collegamento tra i vari database esistenti e contiene dati qualitativi e quantitativi che semplificano il monitoraggio dell’andamento virale. Per entrambe le piattaforme, i dati vengono forniti dai NICs del GISRS e dai laboratori nazionali di riferimento sull’influenza che collaborano con essi. Inoltre, una terza piattaforma è a disposizione della comunità scientifica: FluMart, ossia un supporto sviluppato per favorire l’integrazione dei dati disponibili sull’influenza e la loro archiviazione. Le tre piattaforme fanno capo all’OMS.
Nel panorama europeo, l’European Centre for Disease Prevention and Control (ECDC) e l’Ufficio regionale per l’Europa dell’OMS rappresentano i principali organismi della sorveglianza della sindrome influenzale. In particolare, l’ECDC coordina la Rete europea di sorveglianza dell’influenza (EISN), che opera attraverso la Rete europea di laboratori di riferimento per l’influenza umana (ERLI-Net). I dati raccolti dai diversi paesi afferiscono settimanalmente a livello centrale attraverso la banca dati del sistema europeo di sorveglianza (TESSy) [9], che dalla stagione 2014-2015 pubblica un bollettino congiunto, “FluNews Europe”, dove vengono evidenziate le caratteristiche epidemiologiche e virologiche della stagione influenzale settimana per settimana. La sorveglianza può essere universale, ovvero operata da tutte le strutture sanitarie, oppure campionaria, organizzata in reti sentinella che prevedano l’inclusione di almeno l’1,5% della popolazione. La raccolta dei dati è organizzata autonomamente dai diversi stati, ed è svolta a livello territoriale dai medici di assistenza primaria, che vengono affiancati dalle strutture ospedaliere nel caso della sorveglianza universale. A seconda della nazione, sono annoverati nella conta dei dati pazienti presentanti sindrome simil-influenzale (Influenza like illness, ILI), infezione respiratoria acuta (Acute respiratory infection, ARI), o entrambe.
Per quanto riguarda l’Italia, dalla stagione 1999-2000 è attivo Influnet, il sistema nazionale di sorveglianza epidemiologica e virologica dell’influenza, coordinato dal Dipartimento Malattie Infettive dell’Istituto Superiore di Sanità (ISS) con la partecipazione del Ministero della Salute. In particolare, la sorveglianza virologica è svolta dal Centro Nazionale Influenza (NIC) dell’ISS, che partecipa alla rete europea coordinata dall’ECDC collaborando con una rete di laboratori regionali localizzati su tutto il territorio nazionale, nell’ambito dei Programmi OMS/GISRS [10].
Ogni anno, la sorveglianza epidemiologica viene eseguita nel periodo compreso tra la quarantaduesima settimana e la diciassettesima dell’anno successivo; invece, la sorveglianza virologica ha luogo tra la quarantaseiesima settimana di ogni anno e la diciassettesima dell’anno successivo. Le analisi di laboratorio indagano i ceppi virali circolanti nella stagione influenzale sottolineando le mutazioni del virus utili alla formulazione dei vaccini. La caratterizzazione avviene attraverso l’analisi molecolare di campioni prelevati dalle vie respiratorie dei pazienti selezionati. A segnalare e raccogliere i campioni biologici per le analisi sono gli operatori sanitari operanti nel territorio e negli ospedali. In particolare, un gruppo di Medici di Medicina Generale (MMG) e di Pediatri di Libera scelta (PLS), che vengono reclutati dalle singoli regioni e che aderiscono al progetto in maniera volontaria, i cosiddetti “medici sentinella”, sono incaricati di segnalare i casi di ILI giunti alla loro attenzione. Lo scopo di Influnet è costituire una banca dati per valutare l’andamento dell’incidenza delle ILI nel corso degli anni. Nello specifico, si tratta di descrivere i casi di sindrome influenzale giunti all’attenzione dei medici della rete, stimando i tempi delle epidemie influenzali (inizio, durata e intensità) e i tassi di incidenza per età e per settimana; inoltre, i risultati ottenuti sono utilizzati per la creazione di modelli matematici che stimino l’impatto dell’infezione e delle misure di contenimento adottate e condivisi con l’ECDC nel sistema europeo TESSy. In aggiunta, è attivo il sistema di sorveglianza InfluWeb, dotato di relativa piattaforma (influweb.it), cui partecipano volontariamente i cittadini italiani con segnalazione spontanea, permettendo di rilevare quei casi di sindrome influenzale che per la loro entità lieve non richiedono accesso ai servizi di assistenza medica territoriale o ospedaliera. Merita una menzione particolare InfluNet-Epi, sistema di sorveglianza epidemiologica della sindrome influenzale coordinata dall’ISS, in collaborazione con il Centro interuniversitario per la ricerca sull’influenza (CIRI) di Genova e con la partecipazione del Ministero della Salute. Il sistema si avvale dell’operato di circa mille medici sentinella (MMG e PLS), i cui assistiti costituiscono un campione rappresentativo del 2% circa della popolazione italiana. Il CIRI genovese fa parte di un gruppo di centri di ricerca istituito nel 2010, il Centro Interuniversitario per la Ricerca sull’Influenza e le altre Infezioni Trasmissibili (CIRI-IT), che ha l’obiettivo di sorvegliare a livello nazionale e regionale l’influenza e le altre infezioni respiratorie acute. La nascita del primo centro CIRI risale al 1999: il progetto è stato poi ampliato a livello interregionale nel 2010, quando le sue attività di ricerca furono implementate per comprendere le principali malattie trasmissibili prevenibili tramite programmi di vaccinazione. Il Centro, oltre a partecipare alla rete InfluNet e ai sistemi di sorveglianza europei, programma, organizza e gestisce reti interregionali di sorveglianza clinico-epidemiologica e collabora a livello nazionale con Società Scientifiche ed Enti di Ricerca che contribuiscono alla raccolta dati, tra cui l’ISS, la Società Italiana di Igiene Medicina Preventiva e Sanità Pubblica (SITI), la Società Italiana di Medicina Generale (SIMG). Oltre alle attività di sorveglianza, si occupa di promuovere e programmare, a livello nazionale e internazionale, studi sull’influenza e sulle infezioni respiratorie acute e studi interventistici e osservazionali per valutare l’efficacia e l’effectiveness di vaccini e farmaci per le infezioni respiratorie. Inoltre, coordina progetti di Health Technology Assessment (HTA) in ambito preventivo [11].
Parallelamente alle forme di sorveglianza citate, dalla stagione 2009-2010, l’Italia ha introdotto il monitoraggio riguardo l’andamento delle forme gravi e complicate di influenza stagionale [12] che prevede che le Regioni e le province autonome segnalino al Ministero della Salute e all’ISS i casi gravi di influenza stagionale (per i quali è previsto il ricovero in Unità di terapia intensiva e/o la somministrazione di Ossigenazione extracorporea a membrana, ECMO) che abbiano ricevuto una conferma di laboratorio. Tutti i pazienti con diagnosi di SARI (severe acute respiratory infections) e con ARDS (acute respiratory distress syndrome) devono essere inoltre sottoposti a indagini di laboratorio che prevedono la sottotipizzazione per i virus A H1N1 e A H3N2.
Nell’ambito della sorveglianza delle malattie infettive acute va poi collocata la “sorveglianza sindromica”, uno strumento meno specifico ma altamente sensibile e tempestivo che riguarda i casi clinici per i quali non è possibile effettuare una diagnosi di certezza ma che presentano segni e sintomi caratteristici di determinate patologie infettive. Per quanto riguarda le sindromi respiratorie, sono diversi i centri che si occupano della loro sorveglianza: un esempio è rappresentato dal Dipartimento di Scienze della Salute (DiSSal) dell’Università degli Studi di Genova, che dal luglio 2007 mette in atto un progetto della Regione Liguria per l’implementazione di un sistema di sorveglianza in grado di rilevare tempestivamente, attraverso l’analisi dei dati di accettazione dei Pronto Soccorso dell’ospedale di riferimento regionale per adulti “San Martino” e dell’ospedale di riferimento regionale per bambini “Gaslini” di Genova, la presenza di cluster di ILI e di ARI. Il sistema di sorveglianza sindromica si è rivelato un valido mezzo di sorveglianza e analisi dell’andamento delle epidemie regionali, che fornisce dati utili a indirizzare gli interventi sanitari di tipo preventivo volti a mitigare il diffondersi dell’infezione a livello territoriale.
Nello scenario descritto si inseriscono innovativi progetti di ricerca condotti in diversi paesi europei, che coniugano la sorveglianza epidemiologica e virologica con la sorveglianza dell’efficacia vaccinale: il progetto DRIVE e il progetto I-MOVE.
Il progetto I-MOVE (Influenza Monitoring Vaccine Effectiveness) [13] è stato avviato nel 2007 per monitorare l’efficacia del vaccino contro l’influenza stagionale e pandemica nell’Unione europea. Ad esso aderiscono 29 partners, tra cui l’ECDC, l’Ufficio Regionale Europeo dell’OMS, gli istituti di sanità pubblica regionali e nazionali, gli ospedali e le Università di 15 stati membri dell’Unione Europea. Dalla stagione 2008-2009 i team di questo progetto conducono studi multicentrici caso-controllo e di coorte nell’ambito degli esistenti sistemi di sorveglianza per l’influenza, i cui risultati consentono di stabilire l’effectiveness vaccinale nei confronti dei casi gravi di influenza permettendo di orientare la campagna vaccinale a livello europeo e delle singole nazioni [14].
Successivamente, nel luglio 2017 è stato avviato il progetto DRIVE (Development of Robust and Innovative Vaccines Effectiveness) [15], anch’esso volto a promuovere la cooperazione europea negli studi sull’efficacia dei vaccini antinfluenzali e a creare una rete in grado di generare stime di efficacia specifiche per tutte le tipologie di vaccino utilizzate in Unione Europea. I dati così generati permettono di aumentare la comprensione dell’efficacia vaccinale e di migliorarne il monitoraggio da parte degli Istituti di Sanità Pubblica. Per quanto riguarda la stagione 2021-2022 partecipano al progetto ospedali e centri di assistenza primaria di 8 paesi europei: oltre all’Italia la rete comprende Austria, Finlandia, Germania, Islanda, Romania, Spagna e Regno Unito.
Nel corso degli anni ai sistemi di sorveglianza tradizionali si sono affiancati strumenti sempre più tecnologici basati sull’utilizzo della rete internet, che già più di 10 anni fa è stata sfruttata per ottenere dati utili ai sistemi di sorveglianza. Infatti, nel 2008 fu lanciato il progetto Google Flu Trends (GFT), un servizio web gestito da Google per fornire stime e aiutare a prevenire focolai di influenza in oltre 25 Paesi. Il sistema si basava sul monitoraggio delle query di ricerca di Google Search relative a sintomi simil-influenzali e confrontava i risultati di ogni regione con l’attività media di ricerca dell’influenza misurata in più anni. In alcune stagioni le stime ottenute sono risultate coerenti con i dati di sorveglianza raccolti dalle agenzie sanitarie, sia a livello nazionale che regionale, mentre in altre sono state molto imprecise, sovrastimando l’impatto dell’influenza [16]. Uno dei problemi di questo progetto era rappresentato dall’aggregazione di query relative a diverse condizioni di salute, ad esempio le sindromi simil-influenzali o altre virosi: ciò falsava i risultati. Nonostante le stime di GFT non siano più pubblicate da agosto 2015, questo servizio web ha rappresentato un esperimento di raccolta di dati tramite motori di ricerca estremamente utile, in quanto capace di fornire informazioni sui bisogni non filtrati della popolazione [17, 18].
Il valore dei dati in Sanità è emerso vigorosamente negli ultimi anni, soprattutto con l’avvento della pandemia COVID-19. Infatti, la diffusione di un virus sconosciuto e altamente contagioso e virulento come SARS-CoV-2 ha fatto sì che il mondo attuale sperimentasse un evento di portata storica, che ha indotto profondi cambiamenti nella società contemporanea. La pandemia ha avuto forti ripercussioni in tutto il mondo a livello sanitario, economico, politico e sociale. Infatti, nella prima fase la diffusione del virus ha determinato il collasso delle strutture ospedaliere di diversi Stati, con la necessità da parte dei Governi di imporre drastiche misure di contenimento operando restrizioni della libertà personale e imponendo l’utilizzo di dispositivi di protezione individuale (mascherine filtranti) per arginare i contagi. La drammaticità dell’evento ha indotto i Paesi a unire le proprie risorse per creare una rete efficace di sorveglianza epidemiologica e strumenti utili per il controllo dell’infezione, oltre che per fronteggiare la crisi che invadeva diversi settori.
In Italia, il dilagare di SARS-CoV-2 ha reso necessario istituire un sistema di sorveglianza dedicato, che ha preso il nome di “Sistema di sorveglianza integrata COVID-19”, frutto della collaborazione continua tra l’ISS, il Ministero della Salute e le autorità sanitarie regionali e locali.
Il sistema si fonda sull’utilizzo di una piattaforma web che raccoglie informazioni epidemiologiche (informazioni anagrafiche, informazioni su domicilio e residenza, diagnosi di laboratorio, ricovero, stato clinico, fattori di rischio ed esito della malattia) dei soggetti infettati da SARS-CoV-2. I dati raccolti vengono pubblicati periodicamente sul sito dell’ISS e comunicati alle autorità. Parallelamente al flusso dei dati della Sorveglianza integrata, il Ministero della Salute, congiuntamente alla Protezione Civile, fornisce un flusso giornaliero di dati aggregati che esita in una dashboard (infografica) realizzata dalla Protezione Civile, oltre che in un report settimanale. Scopo di questo sistema è quello di inquadrare le fluttuazioni dell’epidemia, le caratteristiche dei casi e il rischio di diffusione dell’infezione al fine di fornire strumenti di programmazione e contrasto alla pandemia [19].
L’urgenza di contrastare l’infezione da SARS-CoV-2 ha spinto i ricercatori di tutto il mondo a utilizzare ogni strumento disponibile per creare collegamenti fra loro, in modo tale da ridurre i tempi di diffusione delle più recenti scoperte e ampliare gli scambi di informazioni. Sono stati così sfruttati ampiamente social networks, media e motori di ricerca web. La possibilità di servirsi della funzione di geolocalizzazione di piattaforme fruibili sul web si è rivelata una risorsa utile per il monitoraggio della mobilità della popolazione, soprattutto nella fase del lockdown. Infatti, con l’entrata in vigore di misure contumaciali che ponevano come divieto la frequentazione di luoghi pubblici e gli assembramenti a favore del distanziamento sociale, è stato possibile adoperare la grande mole di dati aggregati e anonimizzati forniti da smartphone e dispositivi elettronici a uso personale. L’elaborazione dei dati ottenuti ha poi fornito report dettagliati di mappatura della mobilità impiegabili dalle istituzioni locali per decisioni di natura politica finalizzate a limitare la diffusione dei contagi. Il governo degli Stati Uniti, ad esempio, ha utilizzato i dati Gps forniti dal social network Facebook per controllare l’aderenza alle misure di distanziamento sociale; invece, la Corea del Sud ha utilizzato le piattaforme disponibili come mezzo di verifica del rispetto dell’obbligo di isolamento dei soggetti notificati come “casi confermati di infezione”. Un ulteriore esempio è rappresentato dalla Cina, dove è stata sviluppata un’applicazione di notifica di vicinanza a “casi confermati” in grado anche di valutare la densità di casi di malattia in determinate aree della città, permettendo così agli utenti di individuare le aree più rischiose. Analogamente, in Italia gli strumenti di geolocalizzazione sono stati sfruttati per lo sviluppo di un’applicazione di tracciamento dei contatti, la app Immuni, messa appunto e poi lanciata a livello nazionale con lo scopo di supportare la sorveglianza dei casi di infezione da SARS-CoV-2. Immuni, rispettando la normativa sulla privacy, utilizza un sistema di notifica sfruttando la tecnologia bluetooth degli smartphone per avvertire i contatti dei casi confermati che siano stati localizzati nei pressi del caso indice nel periodo presunto di contagiosità [20].
Questo tipo di tecnologia non è stata sperimentata solo in Italia: diversi Stati si sono dotati di strumenti analoghi (TousAntiCovid in Francia, Nhsx app in Inghilterra, CoronaMelder nei Paesi Bassi, Radar Covid in Spagna, etc.) [21].
Immuni rappresenta uno strumento innovativo che va ad affiancare e potenziare il “Contact Tracing” tradizionale. Da anni i Dipartimenti di prevenzione svolgono ampiamente l’attività di Contact Tracing per le malattie infettive acute a notifica obbligatoria, svolgendo interviste ai casi confermati e ai loro contatti (telefonicamente o tramite visite domiciliari). L’identificazione degli individui che, a seconda del contesto di esposizione, sono a rischio di sviluppo dell’infezione permette di istruire gli interessati circa i comportamenti preventivi da adottare (ad es. monitoraggio dell’insorgenza di sintomi suggestivi della patologia, utilizzo di dispositivi di protezione individuale, etc.) e di applicare misure di quarantena o isolamento mirate. Negli ultimi anni si è sviluppato quindi quello che può essere definito “Contact Tracing digitale”, un sistema che si avvale di tecnologie basate sul digital health, ossia electronic-health (e-health) e mobile-health (m-health). Questo innovativo tipo di tracciamento limita i contatti personali fra gli operatori di sanità pubblica e i cittadini e utilizza tecnologie di accesso a database telematici e di rintracciamento di prossimità con tecnologie Bluetooth o GPS. Tra le due modalità di tracciamento non esiste alcuna differenza nella gestione della sorveglianza epidemiologica, se non nella modalità di messa in atto della stessa [22].
Negli ultimi anni, il web è diventato sempre più importante per fornire strumenti utili all’epidemiologia e al mondo della ricerca in generale. Già nel 2015, per migliorare la comprensione epidemiologica della diffusione e dell’evoluzione dei patogeni e preparare la risposta a eventuali epidemie emergenti, ha preso forma un progetto atto a sfruttare il potenziale dei dati sul genoma dei microrganismi. Il progetto, intitolato “Nexstrain”, nasce dalla collaborazione di ricercatori statunitensi e svizzeri come progetto open source disponibile al pubblico: fornisce istantanee in tempo reale di popolazioni di agenti patogeni in evoluzione come influenza, SARS-CoV-2 ed Ebola. Sono utilizzate visualizzazioni interattive che consentono l’esplorazione di set di dati e analisi continuamente aggiornati ogni qualvolta siano riconosciuti nuovi genomi. Pertanto, la piattaforma offre un potente strumento di sorveglianza dei patogeni, fruibile da virologi, epidemiologi, funzionari di sanità pubblica e scienziati della comunità. Tutte queste figure possono liberamente modificare le analisi pubblicate, crearne di nuove e comunicare approfondimenti scientifici [23].
Nello scenario contemporaneo, un ruolo importante è stato acquisito dai social network, che sono stati in grado di accorciare le distanze tra i comunicatori e i riceventi della divulgazione scientifica, estendendo la platea dei fruitori dai soli “addetti ai lavori” a un pubblico “laico”. In questo contesto, il social network Twitter merita un’attenzione particolare. Rispettando le previsioni dei ricercatori, che già nel periodo prepandemico pronosticavano la possibilità della contaminazione tra social e divulgazione scientifica, sotto la pressione pandemica Twitter ha assunto le connotazioni di una vera e propria rete che permette di collegare in maniera estemporanea individui e notizie del mondo della scienza [24, 25].
La piattaforma è diventata quindi un punto di riferimento per la diffusione di studi e pareri sull’andamento della pandemia. A testimonianza di ciò, la rivista scientifica Science ha commentato il peso dell’ascesa del social network in campo scientifico come mezzo di divulgazione di scoperte e opinioni di ricercatori di tutto il mondo, che hanno formato una vera e propria comunità virtuale. Ogni nuova informazione è stata “rimbalzata” tra i diversi autori tralasciando i tempi di pubblicazione scientifica canonici e generando una condivisione in tempo reale dei nuovi dati disponibili. Se da una parte ciò ha favorito il progresso scientifico, la mancanza di revisione dei messaggi e la facilità di confusione ha sortito l’effetto di generare talvolta “caos comunicazionale”, soprattutto per coloro che non appartengono ad ambienti scientifici ma che hanno comunque accesso al dialogo. Per lungo tempo, soprattutto nelle prime fasi pandemiche, gli argomenti di tendenza discussi sulla piattaforma hanno riguardato la pandemia. Probabilmente, tale strumento, con le opportune modifiche del caso, potrà essere utilizzato a favore della ricerca scientifica sfruttando le sue caratteristiche di tempestività e facilità di collegamento. Anche grazie a questi strumenti, la pandemia ha modificato la percezione della figura degli scienziati tra il pubblico “laico”, avvicinandoli: in particolare, la divulgazione è diventata molto più semplice e il linguaggio scientifico è diventato più fruibile con profonde influenze sugli atteggiamenti quotidiani della popolazione.
Tra le trasformazioni indotte dalla pandemia, grazie alle nuove tecnologie disponibili sta scaturendo sempre più interesse nei confronti dell’Intelligenza Artificiale (AI) e del Machine Learning, potenti strumenti di calcolo in grado di fornire modelli predittivi, ovvero proiezioni che potrebbero essere usate per migliorare le politiche sanitarie e la gestione della salute globale. Si tratta di strumenti in fase embrionale, per cui la loro applicazione nella gestione delle politiche nazionali e internazionali è ancora lontana nonostante si stiano verificando rapidi progressi. Infatti, è stato recentemente dimostrato il miglioramento della precisione degli algoritmi guidati dalla AI: un esempio è costituito dai modelli predittivi generati dalle aziende BlueDot e Metabiota, che hanno anticipato la modalità di diffusione di SARS-CoV-2 al di fuori della Cina. Tali aziende analizzano le condizioni specifiche dei diversi paesi, quali ad esempio la densità di popolazione, il clima e la diffusione degli insetti vettori, e raccolgono dati provenienti da fonti ufficiali e social media per creare i modelli predittivi. A supporto della loro funzionalità, già nel 2009 BlueDot era riuscita a prevedere correttamente l’andamento globale della pandemia di influenza H1N1 utilizzando i dati sul traffico aereo mondiale. Ulteriore successo dell’azienda è stata la previsione della diffusione di Ebola in Africa occidentale nel 2014 e del virus Zika in Florida nel 2016. In un contesto di rapida condivisione dei dati raccolti dai sistemi di sorveglianza e di miglioramento delle tecnologie informatiche, in futuro potrebbero rendersi disponibili strumenti predittivi di AI capaci di preannunciare con accuratezza l’emergere e la diffusione di patogeni, consentendo una sempre migliore gestione delle epidemie [26].
Tutte le lezioni impartite dalla pandemia COVID-19, unite allo sviluppo delle nuove tecnologie necessarie alla sua gestione, hanno reso disponibili una varietà di strumenti utili per la Sanità Pubblica: oggi, non siamo solo più abili a comunicare nuove scoperte, ma siamo in possesso di una rete di contatti molto più sviluppata di quanto non lo fosse a inizio 2020, oltre che di strumenti di notifica e di sorveglianza epidemiologica fortemente innovativi. Tutti questi mezzi, utilizzati al di là di SARS-CoV-2, possono contribuire al miglioramento della gestione delle malattie infettive acute, alla limitazione della loro diffusione e alla corretta educazione della popolazione.
L’influenza stagionale è una infezione respiratoria acuta causata dai virus influenzali, che sono endemici e circolano in tutte le parti del mondo. Dal punto di vista virologico si indentificano 4 tipi di virus: A, B, C e D. Le epidemie stagionali sono sostenute dai virus influenzali di tipo A e B. Come noto, i virus di tipo A possono essere classificati in sottotipi in base alla struttura delle loro proteine di superficie: emoagglutinina (HA) e neuroaminidasi (NA). Negli ultimi anni stanno co-circolando i sottotipi A(H1N1) e A(H3N2). In particolare, dal 2009 si è diffuso il sottotipo pandemico A(H1N1)pdm09, che ha sostituito il virus A(H1N1) circolante negli anni precedenti. I sottotipi A sono gli unici che possono andare incontro sia a variazioni maggiori (acquisendo, in caso di capacità di trasmissione interumana, un potenziale pandemico) sia a variazioni minori. I virus di tipo B non vengono classificati in sottotipi, ma vengono distinti in due sottofamiglie o lineages: B/Yamagata e B/Victoria. I virus B possono andare incontro solo a variazioni minori, e quindi possono causare esclusivamente epidemie stagionali [1].
Dal punto di vista clinico, l’influenza stagionale è caratterizzata da un’insorgenza improvvisa di febbre, tosse (solitamente secca), cefalea, mialgie e artralgie, malessere generale, faringodinia e rinorrea, e nella maggior parte dei casi i soggetti affetti guariscono entro una settimana senza richiedere cure mediche. Tuttavia l’influenza può causare forme clinicamente gravi o decessi soprattutto nelle persone ad alto rischio. Si stima che globalmente le epidemie annuali provochino da 3 a 5 milioni di casi gravi e 290.000-650.000 decessi. Nei paesi industrializzati la maggior parte dei decessi influenza-correlati si verifica nelle persone ≥65 anni di età; inoltre, le epidemie stagionali comportano alti livelli di assenteismo lavorativo/scolastico, perdite di produttività e sovraccarico delle strutture sanitarie. Nei paesi in via di sviluppo i decessi coinvolgono soprattutto bambini <5 anni di età con infezioni delle basse vie respiratorie [2].
Dal punto di vista epidemiologico, tutti i gruppi di età possono essere potenzialmente infettati. Esistono tuttavia alcuni gruppi di soggetti definiti a maggiore rischio di forme cliniche complicate/severe quali le donne in gravidanza, bambini piccoli (<5 anni di età), anziani, soggetti affetti da comorbosità (cardiovascolari, respiratorie, renali, metaboliche, neurodegenerative, epatiche ed ematologiche), pazienti immunocompromessi (HIV-infetti, trattati con chemioterapici o steroidi, affetti da tumori). Anche gli operatori sanitari vengono considerati soggetti ad alto rischio sia di infezione, in rapporto all’alto livello di esposizione a soggetti malati/infetti, che di trasmissione, in particolare a soggetti fragili [2].
Se si analizzano le dinamiche di trasmissione dei virus influenzali è evidente che la diffusione del patogeno è particolarmente efficace in caso di affollamento, in ambito scolastico e nelle case di riposo, e che la fascia di età pediatrica ha un ruolo fondamentale. I tassi di attacco di influenza sono particolarmente elevati nei bambini, che rappresentano la principale sorgente di infezione all’interno delle comunità e delle famiglie. I bambini trasmettono l’influenza più a lungo degli adulti, possono essere infettivi per >10 giorni e possono diffondere il virus (tipo A) fino a 8 giorni prima della comparsa dei sintomi [3].
La prevenzione primaria mediante vaccinazione rappresenta il modo più efficace per prevenire l’influenza. Vaccini sicuri ed efficaci sono disponibili e utilizzati da più di 60 anni. Una criticità operativa è rappresentata dal fatto che l’immunità da vaccinazione tende a decadere nel tempo e questo, oltre alla grande variabilità antigenica superficiale del virus, impone la raccomandazione per la vaccinazione annuale.
In relazione a quanto sopra riportato, sia sulle dinamiche di trasmissione, sia sull’impatto della patologia, l’Organizzazione Mondiale della Sanità (OMS) raccomanda la vaccinazione annuale, per le donne in gravidanza in qualsiasi fase della gestazione (gruppo con il più elevato grado di priorità), i bambini di età compresa tra 6 mesi e 5 anni, gli anziani (≥65 anni di età), i soggetti con co-morbosità, gli operatori sanitari.
L’efficacia ottimale della vaccinazione è direttamente correlata e tanto più efficace quanto più i ceppi vaccinali risultano corrispondenti antigenicamente con i virus circolanti (matching). Per questo motivo è operativo il sistema globale di sorveglianza e risposta all’influenza dell’OMS (GISRS) che include una rete di centri nazionali e centri collaborativi in tutto il mondo, e che monitora continuamente i virus che circolano permettendo l’aggiornamento della composizione dei vaccini influenzali due volte l’anno (rispettivamente, per l’emisfero nord e per l’emisfero sud). A partire dalla stagione influenzale dell’emisfero settentrionale 2013-2014, è stato supportato lo sviluppo e l’uso del vaccino quadrivalente, che oltre ai virus A(H1N1), A(H3N2) contiene i due lineages dei virus B al fine di garantire la più ampia protezione possibile verso i ceppi virali circolanti [4].
Il 13 maggio 2022 l’OMS ha pubblicato un aggiornamento del proprio position paper sull’influenza continuando a raccomandare che tutte le nazioni implementino l’utilizzo della vaccinazione influenzale stagionale tenendo conto dell’impatto e dell’epidemiologia della patologia, delle considerazioni di ordine farmaco-economico, delle priorità di Sanità Pubblica e della fattibilità operativa.
Alcuni punti distintivi di questo aggiornamento sono i seguenti:
i paesi che desiderano avviare o espandere i programmi di vaccinazione contro l’influenza stagionale dovrebbero considerare di dare la priorità ai seguenti gruppi target (elenco non in ordine di priorità): operatori sanitari, individui con co-morbosità e condizioni di base, anziani e donne in gravidanza. Anche i bambini sono un gruppo target importante;
esistono numerosi nuovi vaccini antinfluenzali che sono approvati e sono efficaci e sicuri in popolazioni specifiche. Nel caso di risorse limitate, l’OMS raccomanda che i paesi cerchino di ottenere il massimo impatto sulla popolazione, che può essere perseguito in modo più equo utilizzando vaccini influenzali tradizionali, meno costosi e più ampiamente disponibili;
le evidenze dimostrano che la vaccinazione nella stagione corrente e in quella precedente fornisce una protezione migliore rispetto alla sola vaccinazione nella stagione precedente o al non essere vaccinato affatto. L’OMS continua a raccomandare la vaccinazione influenzale annuale prima dell’inizio della stagione influenzale;
la co-somministrazione di vaccini contro l’influenza stagionale inattivati e qualsiasi dose dei vaccini COVID-19 è accettabile e può aumentare l’efficienza del programma [5].
I dati italiani sull’influenza sono in linea con quelli riportati a livello globale. Anche nel nostro Paese è stato evidente l’impatto dei periodi di lock-down e delle norme di distanziamento conseguenti alla pandemia da COVID-19. Nella stagione 2020-21 in particolare è stato stimato un totale di circa 2.431.000 casi mentre nella stagione 2021-2022 il totale di casi stimati è stato pari a 6.539.000 [6, 7].
Le coperture vaccinali in Italia sono migliorate soprattutto negli anziani. Infatti le coperture nella stagione 2020/2021 (aggiornate al 24 luglio 2021) sono salite al 23,7% rispetto al 16,8% della stagione 2019/2020; negli anziani >65 anni di età la copertura è incrementata raggiungendo il 65,3% (rispetto al 54,6% della stagione precedente) [8].
Il Ministero della Salute già per la stagione 2020-2021 aveva evidenziato l’importanza di incrementare le coperture vaccinali per influenza anche in relazione al fatto che COVID-19 e influenza presentano sintomatologie simili. Questo aspetto è stato ribadito nella circolare ministeriale per la stagione influenzale 2021-2022 sottolineando come la prevenzione di casi di influenza contribuisca a semplificare la diagnosi differenziale e la gestione dei casi sospetti. Permanendo la situazione pandemica COVID-19, la vaccinazione influenzale è stata raccomandata anche nella fascia di età 6 mesi - 6 anni con l’obiettivo di ridurre la circolazione del virus influenzale fra gli adulti e gli anziani. Altro aspetto importante è la possibilità di co-somministrare nella stessa seduta vaccinazione influenzale e vaccinazione COVID-19 [9].
Sebbene la pandemia da COVID-19 abbia generalmente favorito l’accettazione della vaccinazione influenzale, l’incremento delle coperture vaccinali rimane una criticità essendo molto distanti dall’obiettivo, sia quello minimo (75%) che quello ottimale (95%), per tutti i gruppi target [10].
Il reale impatto dell’influenza sulla salute pubblica è sottostimato. La percezione nei confronti di questa malattia infettiva è quella di una malattia banale mentre il reale impatto (burden) medico, sociale, economico è notevole. L’influenza è spesso causa silente di complicanze gravi, non solo a carico dell’apparato respiratorio, potendo essere causa scatenante (trigger) di problematiche cardiovascolari (infarto miocardico acuto, malattia ischemica, malattia cerebrovascolare, disordini renali e dismetabolici) [11].
Ad esempio, il rischio di infarto miocardico acuto, di ictus e di polmonite è aumentato di 10, 8 e 100 volte, rispettivamente, nel periodo immediatamente successivo a un episodio influenzale in persone sane >40 anni di età [12-14].
Un altro aspetto rilevante deriva dal fatto che solo una piccola parte dei ricoveri per complicanze cardio-respiratorie è effettivamente attribuito all’influenza: il reale impatto sulla salute e sull’utilizzo di risorse del Servizio Sanitario Nazionale (SSN) rimane nascosto [15].
In questo contesto la vaccinazione rimane la forma più efficace di prevenzione dell’influenza e, come indicato dal Ministero della Salute, gli obiettivi della campagna vaccinale stagionale contro l’influenza sono la riduzione del rischio individuale di malattia, ospedalizzazione e morte, la riduzione del rischio di trasmissione a soggetti ad alto rischio di complicanze o ospedalizzazione e la riduzione dei costi sociali connessi con morbosità e mortalità.
I vaccini influenzali disponibili in Italia sono stati autorizzati dall’Agenzia Europea del Farmaco (EMA) e/o dall’Agenzia Italiana del Farmaco (AIFA) e possono essere classificati come inattivati o vivi attenuati. A prescindere dalla diversa tipologia, sul sito AIFA sono riportate specifiche dettagliate sulla composizione dei singoli prodotti. I bambini di età <9 anni mai vaccinati dovrebbero ricevere 2 dosi a distanza di 4 settimane; per i soggetti di qualsiasi età precedentemente già vaccinati è indicata una singola dose. Nell’ambito dei vaccini inattivati rientrano quelli ottenuti su uova embrionate di pollo, su colture cellulari o ricombinanti.
La composizione dei vaccini per l’emisfero nord per la stagione 2022-2023 è stata recentemente pubblicata dall’OMS [16] ed è la seguente:
Vaccini ottenuti da uova embrionate di pollo:
A/Victoria/2570/2019 (H1N1)pdm09-like virus;
A/Darwin/9/2021 (H3N2)-like virus;
B/Austria/1359417/2021 (B/Victoria lineage)-like virus;
B/Phuket/3073/2013 (B/Yamagata lineage)-like virus.
Vaccini ottenuti su colture cellulari o ricombinanti:
A/Wisconsin/588/2019 (H1N1)pdm09-like virus;
A/Darwin/6/2021 (H3N2)-like virus;
B/Austria/1359417/2021 (B/Victoria lineage)-like virus;
B/Phuket/3073/2013 (B/Yamagata lineage)-like virus.
I vaccini influenzali inattivati attualmente autorizzati per l’uso in Italia sono a virus split o subunità [9].
Nei primi, il virus è inattivato mediante un trattamento con un detergente; nei secondi gli antigeni emoagglutinina (HA) e neuraminidasi (NA) vengono purificati rimuovendo altri componenti virali non rilevanti per elicitare la risposta protettiva. In ogni caso si fa riferimento a vaccini quadrivalenti che contengono 2 virus di tipo A (H1N1 e H3N2) e 2 virus di tipo B.
L’uso dei vaccini inattivati ottenuti da uova embrionate di pollo è previsto a partire dai 6 mesi di età e nelle donne in gestazione (in qualsiasi periodo della stessa). Il vaccino inattivato ottenuto su colture cellulari è indicato a partire dai 2 anni di età.
Il vaccino inattivato ad alto dosaggio è un vaccino split quadrivalente contenente 60 mcg di emoagglutinina (HA) per ciascun ceppo virale per garantire una maggiore risposta immunitaria e quindi una maggiore efficacia, indicato nei soggetti di età pari o superiore a 65 anni (dal 7 maggio 2021 è entrata in vigore la nuova indicazione per la popolazione ≥60 anni di età).
Anche il vaccino inattivato quadrivalente adiuvato con MF59 ha lo scopo di facilitare l’adeguata risposta immunitaria partendo da una minore quantità di antigene ed è specificatamente indicato negli ultra 65enni.
Il vaccino quadrivalente prodotto tramite la tecnologia del DNA ricombinante è indicato dai 18 anni di età.
Il vaccino vivo attenuato (LAIV) quadrivalente viene somministrato per via intranasale, è autorizzato per l’uso in persone di età compresa tra 2 e 18 anni ed è stato introdotto per la prima volta in Italia nell’ambito della campagna antinfluenzale 2020-2021. È stato somministrato ai bambini tra 2 e 6 anni e, in seguito anche ai bambini e adolescenti da 6 anni compiuti fino ai 18 anni. La scheda tecnica prevede che ai bambini che non sono stati vaccinati precedentemente contro l’influenza stagionale debba essere somministrata una seconda dose ad almeno 4 settimane di intervallo dalla prima. Tuttavia nel corso della pandemia COVID-19, l’AIFA ha espresso parere positivo alla somministrazione in singola dose per la popolazione pediatrica [17].
Tutti i vaccini autorizzati rispondono ai requisiti richiesti in termini di sicurezza, tollerabilità, efficacia ed effectiveness. Tuttavia, in base alla loro composizione, alle indicazioni di uso riportate in scheda tecnica e alla diversa capacità di elicitare la risposta immunitaria devono essere utilizzati in modo appropriato.
Se infatti l’OMS ha recentemente raccomandato di vaccinare con qualsiasi prodotto (anche trivalente) nei Paesi a risorse limitate con l’obiettivo di massimizzare le coperture, in un contesto come quello italiano caratterizzato da una ampia quota di popolazione anziana e con patologie croniche preesistenti, il tema dell’uso dei vaccini più appropriati per ogni gruppo ha assunto crescente rilievo.
Come già richiamato, l’immunosenescenza rende il soggetto anziano meno rispondente ai vaccini tradizionali, che potrebbero non esplicare tutte le proprie potenzialità preventive.
In questo contesto, la valutazione dell’efficacia relativa dei vaccini indirizzati specificamente alla popolazione anziana (quadrivalente adiuvato, quadrivalente ad alto dosaggio, ricombinante) rispetto ai vaccini quadrivalenti ‘classici’, costituisce un’utile indicazione all’efficacia di campo (effectiveness) aggiuntiva che si può ottenere dall’utilizzo dei vaccini più appropriati.
È evidente come tale parametro sia soggetto ad ampie variazioni da stagione a stagione, in funzione dell’andamento epidemiologico dell’influenza, dei ceppi circolanti prevalenti, e della corrispondenza (matching) tra ceppi vaccinali e isolati durante l’epidemia invernale; è altrettanto evidente come il dato dell’efficacia relativa debba essere più correttamente considerato su un orizzonte pluriennale.
Tuttavia, numerosi studi testimoniano una pressoché costante maggiore efficacia dei vaccini adiuvati e ad alto dosaggio rispetto ai vaccini quadrivalenti standard. In uno studio italiano riguardante l’effectiveness del vaccino trivalente adiuvato rispetto al trivalente non adiuvato per 15 stagioni influenzali successive, è stata registrata un’efficacia relativa del vaccino adiuvato pari al 39% in più nel prevenire le ospedalizzazioni per polmonite e per eventi cerebro/cardiovascolari [18].
Analogamente, in 10 stagioni influenzali consecutive negli Stati Uniti, il vaccino influenzale ad alto dosaggio trivalente ha dimostrato un’efficacia relativa del 15,9% nei confronti delle sindromi influenzali, dell’8,4%, per le ospedalizzazioni da tutte le cause, del 27% da polmonite e del 17,9%, da eventi cardio-respiratori, e riduzioni della mortalità da polmonite/influenza (efficacia relativa 39,9%) e da cause cardiorespiratorie (27,7%) [19].
Inoltre, va considerato che l’organizzazione dei programmi di immunizzazione, che prevede spesso la corresponsione di incentivi ai medici vaccinatori di importo comparabile a quello del costo di ciascuna dose, rende le differenze di prezzo tra vaccini adiuvati/alto dosaggio e vaccini standard meno rilevanti in termini farmaco-economici, a fronte di una superiore efficacia clinica relativa, fatto che determina un favorevole profilo di costo-utilità dei vaccini più adatti alla popolazione anziana rispetto ai vaccini standard nei gruppi di età più avanzata [20-22].
Tra le motivazioni di una più bassa efficacia sul campo dei vaccini anti-influenzali in alcune stagioni rispetto ad altre vi è il fenomeno del mismatch (mancata corrispondenza). Esso può derivare da un fenomeno di ‘scivolamento antigenico’ (drift) dei virus circolanti più marcato di quanto previsto al momento della identificazione dei ceppi virali da inserire nel vaccino della stagione successiva, ma anche della possibilità che, al momento dell’adattamento all’uovo embrionato di pollo dei ceppi candidati a entrare nella composizione del vaccino, si verifichino modificazioni antigeniche del virus di origine umana per crescere in un substrato cellulare aviario (fenomeno rilevante soprattutto per i virus A/H3N2).
I vaccini prodotti in colture cellulari di mammifero (cellule MDCK di origine canina), oltre a rappresentare con ogni probabilità i vaccini del futuro per una minore dipendenza dal substrato uova e una possibile maggiore scalabilità della produzione, permettono anche di evitare il mismatch derivante da tale adattamento alle uova [19, 23].
Il Calendario Vaccinale per la Vita, nella proposta del 2019 ha particolarmente sottolineato il tema dell’appropriatezza d’uso dei vaccini anti influenzali, con precise indicazioni per l’uso dei vaccini adiuvati nella popolazione ultra-settantenne (all’epoca il vaccino ad alto dosaggio non era ancora disponibile in Italia) [24]. Lo stesso sottolineava anche altri aspetti molto importanti per ottimizzare l’impatto di sanità pubblica della vaccinazione anti-influenzale per la popolazione: allargamento delle indicazioni alla vaccinazione, che vada oltre le tradizionali categorie a rischio, abbassamento progressivo a 50 anni dell’età di offerta attiva e gratuita della vaccinazione, promozione della cruciale importanza di diffondere la pratica vaccinale tra le donne in gravidanza, e considerazione della fascia di età pediatrica come ulteriore target. Il razionale della raccomandazione di questi interventi di allargamento dell’offerta della vaccinazione anti-influenzale sono brevemente delineati a seguire.
L’abbassamento dell’età di offerta attiva e gratuita della vaccinazione anti-influenzale prima ai 60 anni e successivamente ai 50 anni consentirebbe di incrementare le coperture nei gruppi a rischio per patologia senza bisogno di identificare ciascun fattore di rischio individuale. Va infatti ricordato che nella popolazione ultra-cinquantenne, da 1/5 a 1/4 degli appartenenti a tale fascia di età soffre di almeno una patologia cronica. Inoltre, le coperture vaccinali nella popolazione a rischio, secondo le Indagini PASSI, non superano nella migliore delle ipotesi il 30-35%, rappresentando un grave fallimento di sanità pubblica.
Il rischio elevato per prodotto del concepimento, donna in gravidanza e neonato di pochi mesi derivante da un’influenza in gravidanza, coniugato con la ottima sicurezza del vaccino, rende ragione della raccomandazione di vaccinare la donna in epoca autunnale a prescindere dalla fase di gravidanza in cui si trovi.
Infine, i bambini con età inferiore ai 2 anni sono considerati un target prioritario per la vaccinazione, in quanto hanno un elevato rischio di sviluppare un’influenza severa, tanto che l’ospedalizzazione per influenza del bambino sotto i 2 anni avviene con le stesse proporzioni del paziente anziano. I bambini con età compresa tra i 2 e i 5 anni hanno un elevato carico di malattia associato all’influenza, ma inferiore a quello dei bambini più piccoli, e rappresentano però anche i maggiori diffusori del virus nella popolazione, come dimostrato dal fatto che la vaccinazione in età scolare in Giappone ha ridotto la extra-mortalità dell’anziano per cause respiratorie durante la stagione influenzale. Più recentemente, la vaccinazione in età scolare con vaccino LAIV nel Regno Unito ha determinato una riduzione significativa di visite mediche e chiamate fuori orario di servizio per influenza/ILI in tutte le fasce d’età dall’avvio del programma [25].
In conclusione, il rilievo del carico di malattia che ogni anno il nostro Paese soffre a causa delle epidemie influenzali stagionali, insieme alle difficoltà a incrementare le coperture vaccinali nelle categorie a rischio basandosi sulla identificazione del rischio individuale, indicano la non differibilità di un allargamento e incremento quantitativo dell’offerta della vaccinazione ai soggetti di età al di sopra dei 50 anni, alle donne in gravidanza e alla popolazione pediatrica tra i 6 mesi e i 6 anni di età, utilizzando nel modo più appropriato e costo-efficace i numerosi prodotti che abbiamo oggi sul mercato, e che via via saranno messi a disposizione della sanità pubblica dalla ricerca scientifica e tecnologica.
Nonostante l’influenza sia una patologia infettiva che ogni anno determina in Italia milioni di casi di malattia, il suo andamento annuale risulta “prevedibilmente imprevedibile” come sottolineato da Kathleen M. Neuzil, direttrice del Center for Vaccine Development presso la University of Maryland School of Medicine.
Fortunatamente tale imprevedibilità si stempera grazie alla presenza di una pratica vaccinale che le evidenze scientifiche suggeriscono essere lo strumento di prevenzione più efficace contro l’infezione da virus influenzali e, soprattutto, contro forme severe di malattia.
Proprio alla luce di tali evidenze la vaccinazione antinfluenzale ormai da oltre un ventennio risulta essere inserita nell’offerta di salute del nostro sistema sanitario in qualità di livello essenziale di assistenza (LEA).
Nello specifico, già il Piano Sanitario Nazionale 1998-2000 “Un patto di solidarietà’ per la salute”, approvato con decreto del Presidente della Repubblica 23 luglio 1998 (Gazzetta Ufficiale supplemento ordinario n. 228 del 10 dicembre 1998) individua, tra le aree prioritarie di intervento, la prevenzione mediante vaccini delle malattie infettive per cui i programmi di vaccinazioni di massa mostrano un rapporto rischio-beneficio e costo-beneficio favorevole [1].
Sulla base di tali considerazioni tra gli obiettivi specifici definiti viene inserita la copertura vaccinale contro l’influenza per la popolazione al di sopra dei 64 anni, fissando un obiettivo minimo pari al 75% degli aventi diritto. Il Piano Sanitario Nazionale 1998-2000 individua, pertanto, nei livelli essenziali di assistenza l’ambito delle garanzie che il Servizio Sanitario Nazionale (SSN) si impegna ad assicurare in condizioni di uniformità sul territorio nazionale alla totalità dei cittadini [2]. Proprio in tal senso, la copertura vaccinale antinfluenzale degli over-64 anni diventa uno degli indicatori cardini della griglia di valutazione ministeriale basata sul monitoraggio dei LEA (indicatore 1.3 Copertura vaccinale per vaccinazione antinfluenzale nell’anziano ≥ 65 anni) [3]. Ad ulteriore conferma dell’importanza della vaccinazione antinfluenzale, il Ministero della Sanità aveva inserito proprio tale vaccinazione anche nella prima versione del “Nuovo calendario delle vaccinazioni obbligatorie e raccomandate per l’età evolutiva” pubblicato in Gazzetta Ufficiale nel 1999 [4], predisponendo che entro il primo anno di attuazione del PSN si sarebbero dovuti definire programmi di intervento per le più importanti condizioni cliniche, individuando tra tali programmi di intervento la vaccinazione antiinfluenzale. In linea con quanto raccomandato dall’Organizzazione Mondiale della Sanità (OMS) a livello globale, l’obiettivo del Ministero della Salute prevedeva il raggiungimento di una copertura vaccinale nelle categorie a rischio del 75% come valore minimo o del 95% come valore ottimale [5].
Dal momento della introduzione della vaccinazione antinfluenzale nell’offerta sanitaria, le coperture vaccinali antinfluenzali sono state, pertanto, oggetto di continuo monitoraggio, per quanto il flusso dei dati relativi alle dosi somministrate sia cambiato nel corso del tempo. Nello specifico, dal 1999 al 2009 i dati sono stati raccolti dal Ministero della Salute attraverso moduli riepilogativi delle dosi somministrate dalle singole Regioni/PA. Diversamente, dalla stagione pandemica 2009-2010, i dati vengono raccolti dall’Istituto Superiore di Sanità (ISS) attraverso una scheda di segnalazione informatizzata. Regioni e PA provvedono all’inserimento dei dati relativi al numero di dosi somministrate distinte per fascia di età, categoria target e tipo di vaccino [5].
In Figura 1 viene rappresentato il trend delle coperture vaccinali antinfluenzali nella popolazione over 64 anni dalla stagione 1999-2000 fino a quella 2020-2021 [6].
Risulta immediatamente evidente come l’andamento sia fondamentalmente scomponibile in 5 diversi momenti:
dalla stagione 1999-2000 alla stagione 2005-2006: incremento rapido di copertura vaccinale mediamente del 4,4% per anno (dal 40 al 68%);
dalla stagione 2005-2006 alla stagione 2011-2012: lieve decremento delle coperture vaccinali mediamente dello 0,8% per anno (dal 68 al 62,7%);
dalla stagione 2011-2012 alla stagione 2014-2015: rapido decremento delle coperture vaccinali mediamente del 4,1% per anno (dal 62,7 al 48,6%);
dalla stagione 2014-2015 alla stagione 2019-2020: lieve incremento delle coperture vaccinali mediamente del 1,1% per anno (dal 48,6 al 54,6%);
dalla stagione 2019-2020 alla stagione 2020-2021: rapido incremento delle coperture vaccinali del 10,7% (dal 54,6 al 65,3%).
Scomponendo l’andamento delle coperture vaccinali sulle tre macroaree italiane (Fig. 2), si può notare come gli andamenti siano assolutamente concordanti ma con migliori coperture mediamente nel Centro Italia rispetto a Nord e Meridione e Isole.
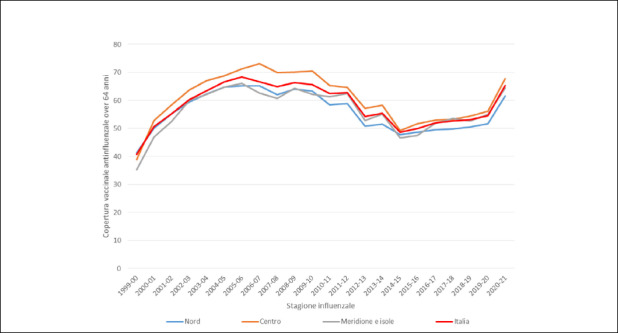
Andamento della copertura vaccinale antinfluenzale nella popolazione over 64 anni dalla stagione 1999-2000 fino a quella 2019-2020 stratificata per macroarea (Nord, Centro, Meridione e Isole).
I due grafici riportati precedentemente aiutano a comprendere come gli andamenti delle coperture vaccinali antinfluenzali nella popolazione over 64 anni siano probabilmente legate a fattori ugualmente distribuiti nei vari territori italiani, escludendo quindi la possibilità che alcune regioni contribuiscano da sole o in modo preponderante al determinismo del complessivo trend nazionale.
Se si esclude il picco di incremento di copertura vaccinale rilevato nella stagione 2020-2021, ogni trend si è mantenuto per diversi anni lasciando ipotizzare il ruolo di fattori di lunga durata piuttosto che legati alla contingenza della singola stagione influenzale. Questa osservazione sembra quindi suggerire che la copertura vaccinale antinfluenzale rilevata in Italia tenda a non avere sbalzi repentini su base delle singole annualità (almeno se si esclude l’episodio della stagione 2020-2021) ma a imboccare trend, crescenti o decrescenti, che si prolungano per diversi anni.
Altro elemento sicuramente caratterizzante è il fatto che, a livello nazionale, in nessuna annualità dal 1999-2000 al 2020-2021 si sia raggiunto l’obiettivo minimo previsto dal Ministero e pari al 75% di copertura. Tale target è stato raggiunto/superato saltuariamente e limitatamente ad alcune stagioni, soltanto in 7 differenti ambiti regionali: Emilia-Romagna (2005-2006, 2006-2007), Umbria (2009-2010, 2010-2011, 2020-2021), Abruzzo (2006-2007), Campania (2002-2003), Puglia (2005-2006), Calabria e Sicilia (entrambe nel 2020-2021). Come già evidenziato precedentemente, tutte regioni del centro-sud.
In Figura 3 vengono riportate le coperture vaccinali raggiunte nelle diverse regioni italiane nel 2020-2021 e come media nel periodo 1999-2021.
La descrizione delle coperture vaccinali antinfluenzali nella popolazione over 64 anni, non permette di definire con precisione i fattori determinanti i trend descritti, ma offre comunque l’opportunità di avanzare alcune ipotesi su possibili elementi che abbiano avuto un impatto o abbiano contribuito in tal senso. In particolare, in ordino cronologico, sembra opportuno segnalare come primo evento di interesse la stagione influenzale 2009-2010 dominata dalla emergenza dell’influenza H1N1 (o influenza suina). Ebbene, la stagione influenzale appena indicata non è stata caratterizzata da quell’importante incremento di coperture vaccinali che si prevedeva alla luce del paventato rischio pandemico. Non solo, le coperture delle stagioni successive hanno fatto registrare un continuo decremento dei vaccini somministrati. Riduzione per altro attribuita, almeno in parte, proprio alle difficoltà e incomprensioni comunicative che avevano caratterizzato la campagna vaccinale della stagione 2009-2010 [7, 8].
L’altro momento degno di particolare interesse è relativo alla stagione 2014-2015, caratterizzata invece dal ritiro cautelativo di due lotti di vaccino trivalente adiuvato [9]. Il provvedimento era scattato in seguito alla segnalazione di tre anziani - dell’età di 87, 79 e 68 anni - morti entro pochi giorni dalla vaccinazione. Le successive indagini hanno stabilito che il vaccino era conforme agli standard di qualità, non era contaminato e non conteneva sostanze tossiche e che le morti segnalate avevano un nesso temporale con la vaccinazione ma nessun nesso causale con la stessa. In tal senso, bisogna evidenziare che, da stime della Società Italiana di Igiene (SItI) si registrino quasi quotidianamente, e per solo effetto del caso, circa 15-20 decessi entro 2 giorni dalla vaccinazione [10].
Ebbene il ritiro dei due lotti vaccinali, e l’amplificazione mediatica che ne è derivata, sembrerebbe avere avuto un impatto importante non solo nella stagione in questione, ovvero la 2014-2015 che per altro è risultata quella con le coperture più basse del decennio, ma anche nelle stagioni influenzali successive caratterizzate da coperture vaccinali stentate e solo in lieve ripresa rispetto al quinquennio precedente [11].
Infine, l’ultimo breakpoint osservato è quello relativo alla annualità 2020-2021 in cui le coperture vaccinali antinfluenzali hanno fatto registrare un +10,7% in una sola annualità. L’importante risultato è chiaramente riconducibile al timore nei confronti di infezioni respiratorie simil-COVID-19 che proprio in tale anno aveva determinato picchi di mortalità e sovraffollamenti di pronto-soccorsi, reparti ospedalieri e terapie intensive. Bisogna inoltre notare che non vi era ancora la disponibilità di vaccini anti COVID-19 (subentreranno solo a Dicembre 2021 e limitatamente a fasce di priorità di servizi pubblici essenziali) e che, nonostante l’importante balzo in alto, le coperture vaccinali sono comunque risultate inferiori rispetto al target ministeriale (75%) in quasi tutte le regioni Italiane (eccetto Umbria, Calabria e Sicilia) (Tab. I).
Coperture vaccinali in soggetti over 64 anni, in Italia stratificate per regione di residenza e per stagione influenzale (Dati Ministero della Salute).
| Regione | 1999-00 | 2000-01 | 2001-02 | 2002-03 | 2003-04 | 2004-05 | 2005-06 | 2006-07 | 2007-08 | 2008-09 | 2009-10 | 2010-11 | 2011-12 | 2012-13 | 2013-14 | 2014-15 | 2015-16 | 2016-17 | 2017-18 | 2018-19 | 2019-20 | 2020-21 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Piemonte | 33,8 | 44,7 | 48,3 | 51,5 | 55,7 | 55,9 | 58,8 | 59,3 | 58,9 | 60,7 | 60,6 | 57,3 | 55 | 51,6 | 51,1 | 46,3 | 46,9 | 48,2 | 47,9 | 49 | 51 | 62,4 | |
| Valle d’Aosta | 35,8 | 56,6 | 54,5 | 56 | 55,3 | 54,4 | 63,1 | 54,2 | 61 | 54,5 | 58,9 | 55,6 | 56,2 | 47 | 48,2 | 43,5 | 42,2 | 44,4 | 44,1 | 45,2 | 45,4 | 52,6 | |
| Lombardia | 39,6 | 46,7 | 53,8 | 58,7 | 60,9 | 65,3 | 64 | 63,1 | 58,6 | 61,7 | 63,1 | 54,2 | 57,9 | 48,2 | 48,6 | 46,3 | 47,7 | 47,5 | 47,7 | 48,2 | 49,9 | 60,6 | |
| PA Bolzano | 43,3 | 38,8 | 46,8 | 51,1 | 52 | 55,2 | 48 | 50,5 | 50,8 | 47,7 | 44,5 | 42,5 | 35,8 | 33,9 | 36,6 | 37,8 | 37,3 | 35,3 | 38,3 | 32,5 | 41,1 | ||
| PA Trento | 42,4 | 48,3 | 50,5 | 54,6 | 57,8 | 60 | 67,6 | 69,2 | 64,6 | 68 | 67 | 61,8 | 62,2 | 56,3 | 55,8 | 51,9 | 50,2 | 53,2 | 53,5 | 54,8 | 55,2 | 65,9 | |
| Veneto | 47,3 | 60,7 | 63,5 | 70,9 | 73,2 | 74,1 | 70,3 | 71,6 | 71,2 | 67,8 | 67,1 | 58,9 | 58,5 | 53,4 | 54 | 55,8 | 55,1 | 55,6 | 53,9 | 59,6 | |||
| FVG | 63,5 | 70 | 71,1 | 72,2 | 72,4 | 72,5 | 72,1 | 64,4 | 68,1 | 49,7 | 62,4 | 61,8 | 55,2 | 56,1 | 49 | 51,1 | 54,1 | 55,7 | 57,7 | 60,7 | 66,5 | ||
| Liguria | 37,7 | 42,3 | 54,2 | 59,6 | 62,5 | 66,1 | 65,3 | 67,5 | 65,6 | 65,7 | 65,7 | 58 | 55,6 | 41,6 | 50,4 | 46,6 | 45,7 | 47,3 | 50,1 | 50,1 | 53 | 68,4 | |
| Emilia-Romagna | 46,2 | 58,4 | 61,9 | 66,5 | 70,3 | 73 | 75,1 | 76,1 | 73,6 | 73,7 | 73,8 | 63,4 | 64,7 | 56,3 | 57,2 | 50 | 51,9 | 52,7 | 53,3 | 54,7 | 57,4 | 70,1 | |
| Toscana | 36 | 51,9 | 51,7 | 56,7 | 61,5 | 62,2 | 67,6 | 70,3 | 68,5 | 69,5 | 71,1 | 68,8 | 67,8 | 58,9 | 60,2 | 49,9 | 52,2 | 54,8 | 55,3 | 56 | 56,4 | 65,5 | |
| Umbria | 45,5 | 51,7 | 58,1 | 59,3 | 62,2 | 61,9 | 65,9 | 69 | 70,5 | 74,7 | 77,5 | 75,2 | 74 | 67,9 | 68,8 | 61,8 | 62,8 | 63,1 | 63,4 | 64,8 | 64,3 | 77,4 | |
| Marche | 53,5 | 60,8 | 62,9 | 65,3 | 67,1 | 68 | 68 | 67,1 | 65,4 | 66,9 | 66,5 | 63,9 | 62,2 | 54,9 | 57,5 | 46,2 | 50,1 | 51 | 50 | 51,6 | 56,9 | 65 | |
| Lazio | 26,7 | 46,5 | 60,5 | 67,5 | 69,5 | 71,5 | 73,3 | 74,1 | 68 | 67,9 | 67,7 | 64,1 | 62,2 | 56,8 | 56,8 | 49,5 | 51 | 51,5 | 51,8 | 52,3 | 52,7 | 67,7 | |
| Abruzzo | 42,5 | 50,2 | 53,7 | 64 | 67,9 | 70 | 69,9 | 78,1 | 72,8 | 68,4 | 67,1 | 60,9 | 59,7 | 50,3 | 54,6 | 38,5 | 45,7 | 48,6 | 49,1 | 52,4 | 55,3 | 64,1 | |
| Molise | 46,7 | 61,4 | 61,4 | 66,9 | 73,7 | 72,3 | 71,4 | 72,6 | 73,3 | 72,3 | 73,7 | 65,6 | 60,5 | 49,4 | 59,5 | 49 | 43,8 | 52,4 | 61 | 61,7 | 65,4 | 62,3 | |
| Campania | 38,1 | 62,3 | 75,6 | 72,3 | 71,9 | 72,9 | 73,2 | 68,2 | 72,2 | 63,4 | 68,8 | 73,1 | 61,4 | 61,3 | 52,9 | 52,8 | 56,7 | 57,4 | 60,3 | 62,1 | 66,1 | ||
| Puglia | 38 | 49 | 62,9 | 64,8 | 68,4 | 70,5 | 75,4 | 71,5 | 68,7 | 73,8 | 73 | 71,7 | 69 | 57,2 | 61 | 48,6 | 50,8 | 57,4 | 59,4 | 51,4 | 51,4 | 61,1 | |
| Basilicata | 45,6 | 42,3 | 46,7 | 61,8 | 69,9 | 66,4 | 64,5 | 71,2 | 70,7 | 72,2 | 72,6 | 63,6 | 63,1 | 58,6 | 58 | 45,6 | 47,9 | 49,8 | 53,2 | 66,6 | 60,7 | 56,4 | |
| Calabria | 23,6 | 29,7 | 43,9 | 55,1 | 59,9 | 66,3 | 68,4 | 65,6 | 69,8 | 63 | 55,8 | 65,6 | 49,8 | 56,5 | 53,3 | 51,7 | 57,9 | 61,2 | 59,8 | 61,8 | 79 | ||
| Sicilia | 41,4 | 47,8 | 47,4 | 61,2 | 63,8 | 69,7 | 67,5 | 56,4 | 61 | 64,1 | 61,3 | 60,2 | 54 | 56,5 | 47,4 | 49,5 | 52,9 | 54,3 | 53 | 59,4 | 75,3 | ||
| Sardegna | 30 | 39,4 | 46,9 | 52,4 | 43,9 | 59,2 | 56,1 | 49,3 | 39,8 | 49,6 | 60,9 | 59,6 | 57 | 47,3 | 46 | 40,6 | 40 | 41,6 | 44 | 46,5 | 46,2 | 61 | |
| Italia | 40,7 | 50,7 | 55,2 | 60,3 | 63,4 | 66,6 | 68,3 | 66,6 | 64,9 | 66,3 | 65,6 | 62,4 | 62,7 | 54,2 | 55,4 | 48,6 | 49,9 | 52 | 52,7 | 53,1 | 54,6 | 65,3 |
Chiaramente la descrizione dei trend di coperture vaccinali con andamenti spesso altalenanti ed eventi di particolare interesse (influenza H1N1, caso Fluad, Pandemia COVID-19) permettono alcune ulteriori riflessioni sui fattori che potrebbero avere impatto sulle campagne vaccinali.
Innanzitutto, bisogna evidenziare che, come riportato dalla letteratura, i possibili determinanti della vaccinazione antinfluenzale sono spesso molteplici e che quindi l’approccio di Sanità Pubblica deve essere parimenti poliedrico ma sempre corale. Proprio quest’ultimo punto risulta essere strategico e supportato da quanto osservato, come già detto precedentemente, parlando di influenza H1N1, caso Fluad, Pandemia COVID-19. Questi ultimi eventi hanno lasciato in eredità la consapevolezza che la comunicazione istituzionale può avere un ruolo strategico ma che deve, per raggiungere tale obiettivo, partire da evidenze scientifiche ed essere coerente, credibile, efficace e ben coordinata tra i diversi attori del mondo della salute pubblica. Diversamente, i risultati potrebbero essere assolutamente negativi con impatti, per altro, destinati a mantenersi in diverse annualità.
Altro elemento caratterizzante è il fatto che le regioni del centro Italia e del mezzogiorno riportino dati di copertura più robusti e, per quanto le ragioni di tali risultati non siano perfettamente delineabili, è verosimile che siano frutto di una maggiore attenzione a livello regionale e di una maggiore capacità di “engagement” della popolazione interessata. Dimostrazione ne sarebbe il fatto che le coperture più alte si siano registrate in Regioni in cui sono state realizzate campagne vaccinali di grande impatto, come testimoniato dalla rilevante crescita delle coperture negli ultimi anni in realtà come Basilicata, Abruzzo, Molise, Friuli Venezia Giulia [12].
Non si può tuttavia trascurare anche il possibile ruolo della vaccine hesitancy nel determinismo delle coperture registrate. Per quanto lo studio degli andamenti di copertura non permetta pienamente di identificare il peso di tale fattore tuttavia recenti studi ne sottolineano l’importanza complessiva che pertanto si ritiene opportuno ribadire [13].
Infine, ma non per ultimo, da evidenziare l’importante contributo territoriale fornito dalla medicina generale sia in termini di somministrazioni vaccinali in sé sia in merito al raggiungimento degli obiettivi target. È tuttavia evidente che proprio in tale ambito si debba incentivare una maggiore integrazione delle attività di prevenzione affidate tanto ai medici di medicina generale quanto agli specialisti del territorio e ospedalieri (oncologi, pneumologi, internisti, cardiologi, diabetologi etc). In tal senso si auspica che una significativa spinta provenga dalla informatizzazione delle anagrafi vaccinali, a livello regionale e nazionale, che potrebbero consentire di integrare tra di loro fonti sanitarie molteplici (notifiche, anagrafe assistiti SSN, eventi avversi etc) garantendo uno strategico supporto alla promozione delle pratiche vaccinali tutte, inclusa quella della vaccinazione antinfluenzale nella popolazione a rischio e anziana.
Rimane da comprendere, alla luce di quanto detto, come far tesoro di oltre 20 anni di campagne vaccinali antinfluenzali e, soprattutto, della recentissima campagna vaccinale anti-COVID-19.
Chiaramente proprio quest’ultima esperienza ha fornito un esempio mirabile di come si possa riuscire, anche su territori regionali molto diversi, a organizzare offerte vaccinali assolutamente di altissima qualità e omogenee. Punti strategici dei risultati raggiunti sono derivati dal forte coordinamento centrale a partire dalla fase di approvvigionamento vaccinale, nella logistica di conservazione, distribuzione e somministrazione e nella gestione della fase rendicontativa. Da non trascurare poi l’identificazione di diversi setting vaccinali (territoriali, ospedalieri, ambulatoriali, farmacie etc) che devono rappresentare un modello e un esempio perseguibile anche nell’offerta vaccinale antinfluenzale.
Chiaramente se l’offerta vaccinale antinfluenzale dei prossimi anni prenderà spunto da questi importanti momenti di crescita a livello nazionale e regionale allora si potrà ben sperare nell’agognato raggiungimento di quei target di copertura vaccinali che da anni proviamo a perseguire senza tuttavia essere stati in grado di raggiungere l’obiettivo.
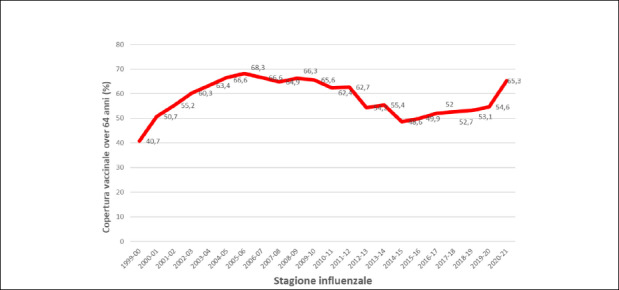
Andamento della copertura vaccinale antinfluenzale nella popolazione italiana over 64 anni dalla stagione 1999-2000 fino a quella 2020-2021.
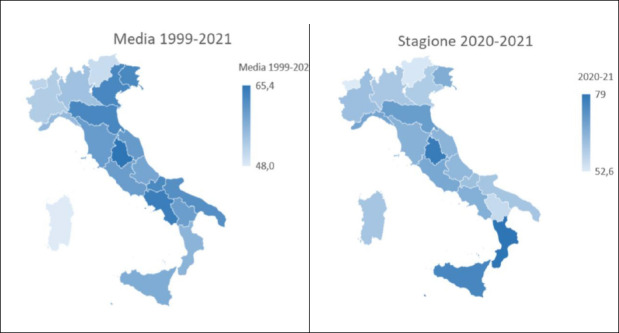
Coperture vaccinali antinfluenzali nella popolazione over 64 anni medie per le stagioni 1999-2021 e relative alla stagione 2020-2021.
La vaccinazione è uno degli interventi di sanità pubblica più costo-efficaci e lo strumento principale per la prevenzione primaria delle malattie infettive. Tuttavia, il valore complessivo delle vaccinazioni, ivi compresa quella antinfluenzale, a oggi non risulta essere del tutto riconosciuto.
Nel 2022 è stato pubblicato uno studio [1] che aveva l’obiettivo di sistematizzare le evidenze scientifiche disponibili sui valori della vaccinazione e che potessero supportare la definizione di un nuovo approccio di immunizzazione basato sul valore [2]. Lo studio riportava i risultati di una revisione sistematica della letteratura condotta applicando, per la prima volta, i quattro pilastri del valore proposti dall’Expert Panel on Effective Ways of Investing in Health (EXPH) (valori personale, allocativo, tecnico e sociale) [3] all’ambito delle vaccinazioni.
Sulla base della metodologia applicata nel nostro precedente lavoro [1], è stata condotta una nuova revisione sistematica di letteratura applicando i quattro pilastri del valore proposti dall’EXPH alla vaccinazione antinfluenzale e considerando le seguenti dimensioni per ciascun pilastro:
valore personale: outcomes clinici, outcomes riportati direttamente dai pazienti (Patients reported outcome, PRO), misure di esperienza riportate dai pazienti (Patient-Reported Experience Measures, PREMs), coinvolgimento ed empowerment dei cittadini;
valore allocativo: accesso alla vaccinazione, equità nell’offerta, appropriateness, variazioni ingiustificate, innovazione;
valore tecnico: valutazione delle tecnologie sanitarie e modelli per la valutazione economica di vaccini/vaccinazioni;
valore sociale: impatto sul benessere della popolazione e sulla produttività; protezione indiretta e comunitaria; processo decisionale condiviso.
Sono stati definiti eleggibili tutti gli studi contenenti dati sul concetto di valore associato alla vaccinazione antinfluenzale, condotti a livello internazionale, scritti in lingua inglese e pubblicati dal 24 dicembre 2010 (data successiva alla pubblicazione del primo articolo sul valore in Sanità, scritto da M. Porter [4]) al 5 luglio 2022, data di lancio delle stringhe di ricerca. Dopo la rimozione dei duplicati, la selezione per titolo e abstract, e la lettura dei full-text, sono stati inclusi nella nostra revisione 40 articoli.
Dai risultati preliminari della nostra revisione è emerso che i valori personale, tecnico, allocativo e sociale, della vaccinazione antinfluenzale sono stati affrontati, negli ultimi anni, da un numero limitato di articoli scientifici e solo il 7,5% di quelli inclusi nella nostra revisione ha affrontato il valore complessivo della vaccinazione antinfluenzale. Il tema del valore della vaccinazione antinfluenzale è stato affrontato dalla comunità scientifica soprattutto a livello europeo. Per quanto concerne, invece, la popolazione target della vaccinazione antinfluenzale e indagata negli articoli inclusi, la maggior parte di questi si è concentrata sulla vaccinazione nella popolazione generale e negli anziani, sottolineando il valore della vaccinazione antinfluenzale in questa fascia di età.
Considerando il focus sul valore della vaccinazione antinfluenzale, dai nostri risultati preliminari è emerso che oltre il 65% degli studi inclusi ha indagato aspetti relativi ai quattro pilastri del valore (personale, allocativo, tecnico e sociale), mentre oltre il 35% ha affrontato il tema del valore della vaccinazione antinfluenzale in modo più generale.
Il pilastro del valore maggiormente indagato (circa il 70% degli studi) è stato quello tecnico. Questo risultato è in linea con quanto documentato anche nel nostro precedente lavoro sul valore delle vaccinazioni [1]. Gli studi che hanno indagato questo pilastro del valore sono soprattutto modelli economici sui vaccini antinfluenzali, sviluppati sia secondo la prospettiva del sistema sanitario sia secondo quella sociale. Diversi studi hanno sottolineato l’importanza di includere nelle valutazioni economiche dei vaccini antinfluenzali anche la prospettiva sociale, proprio alla luce del valore sociale di questa vaccinazione. Dati interessanti sono emersi dallo studio di Wilder-Smith et al. [5] in cui, secondo gli autori, l’impatto economico della vaccinazione antinfluenzale dovrebbe incorporare i benefici sanitari e non sanitari della vaccinazione, sia nella popolazione vaccinata che in quella non vaccinata, consentendo così di stimare anche il valore sociale della vaccinazione. I benefici completi della vaccinazione, secondo gli autori, vanno oltre la prevenzione diretta delle malattie confermate eziologicamente e spesso si estendono per tutto il corso della vita di una persona vaccinata, prevengono gli esiti nella comunità, stabilizzano i sistemi sanitari, promuovono l’equità sanitaria e determinano benefici anche per le economie locali e nazionali. Gli autori, inoltre, hanno sottolineato che per la valutazione economica dei vaccini antinfluenzali, così come degli altri vaccini, i modelli economici di tipo dinamico dovrebbero avere la priorità rispetto ai modelli statici poiché questi ultimi solitamente sottostimano l’efficacia e il rapporto di costo-efficacia dei programmi di immunizzazione, in quanto ne sottovalutano gli effetti indiretti. Ancora, secondo Annemans et al. [6] i decisori sanitari e i responsabili politici dovrebbero essere informati dei limiti delle valutazioni economiche classiche per valutare il valore dei vaccini. Le future valutazioni economiche, inoltre, dovrebbero prestare maggiore attenzione all’effetto della vaccinazione sulla prevenzione delle complicanze, sulla generazione di vantaggi per la salute degli operatori sanitari e sui benefici per la comunità al di là della protezione individuale. Sempre secondo gli autori, sono necessarie linee guida per la valutazione economica del pieno valore delle vaccinazioni e le valutazioni economiche dovrebbero essere condotte tenendo anche conto della prospettiva sociale oltre che di quella del sistema sanitario, al fine di sottolineare e documentare il pieno valore dei vaccini. Le valutazioni economiche, inoltre, dovrebbero considerare in che modo i costi e gli esiti sanitari associati alla vaccinazione, contribuiscano a obiettivi più ampi di equità sociale e garanzia di un guadagno in salute per l’intera popolazione. Secondo Rappuoli et al. [7] è necessario lo sviluppo di nuovi modelli economici in grado di catturare non solo il mero rapporto costo-beneficio della vaccinazione antinfluenzale, ma il valore completo della vaccinazione come investimento in salute. Mentre Ruggeri et al. [8], hanno sottolineato che nel valutare il valore economico dei vaccini, i decisori dovrebbero adottare una prospettiva sociale completa che tenga anche conto dell’impatto fiscale della malattia infettiva prevenibile da vaccino. I metodi tradizionali volti a stimare il costo della malattia da una prospettiva sociale possono essere migliorati considerando anche l’impatto fiscale, che spiega la diminuzione delle entrate fiscali dovute alla malattia. La potenziale riduzione dell’impatto fiscale associata alle strategie di immunizzazione dovrebbe essere inclusa nella valutazione degli effetti dei nuovi vaccini, aggiungendo questa nuova dimensione alla loro valorizzazione. Gli autori, inoltre, hanno valutato l’impatto economico e fiscale dei vaccini antinfluenzali in Italia e nell’analisi condotta hanno riportato che investire nella vaccinazione antinfluenzale comporta benefici che equivalgono a 1,8 volte il valore dell’investimento in termini di impatto fiscale e 11,1 volte in termini di perdita di produttività [8].
Un altro dato interessante è emerso dalla nostra revisione sistematica, ossia che ben oltre il 60% degli studi inclusi ha affrontato il tema del valore sociale della vaccinazione antinfluenzale. Il valore sociale è stato indagato, soprattutto, come benessere per la popolazione e come protezione indiretta della collettività. Solo uno studio ha affrontato il tema del valore sociale legato alla dimensione del processo decisionale condiviso [9].
Rispetto alla nostra precedente revisione sistematica [1], in cui era emerso che il valore sociale delle vaccinazioni era ancora poco indagato dalla comunità scientifica, in questa attuale revisione, invece, è stato uno dei principali valori riconosciuti e associati alla vaccinazione antinfluenzale.
Secondo Macias et al. [10] riconoscere le conseguenze più ampie dell’infezione influenzale, anche tendendo conto delle conseguenze per la società e per la popolazione generale, è essenziale per determinare l’intero burden dell’influenza nelle diverse sottopopolazioni e per valutare il valore complessivo degli interventi di prevenzione, ivi compresa la vaccinazione. Inoltre, secondo la prospettiva del valore sociale della vaccinazione antinfluenzale particolare attenzione è stata posta alla protezione dei più fragili. McElhaney et al. [11], ad esempio, hanno sottolineato l’importanza della vaccinazione dei soggetti più giovani e in salute, prima che diventino fragili, e anche per la protezione dei più fragili. Inoltre, anche l’implementazione della vaccinazione antinfluenzale degli operatori sanitari e delle persone che sono in contatto con gli anziani è stata indicata come azione fondamentale per migliorare la protezione della collettività. Infatti, secondo gli autori, gli operatori sanitari e i decisori in materia di salute pubblica dovrebbero comprendere più a fondo il valore della vaccinazione antinfluenzale e considerarla un importante strumento preventivo per la promozione di un invecchiamento in salute. Pertanto, così come proposto nello studio di Boey et al. [12], è necessario pianificare adeguatamente campagne contro l’influenza stagionale, nelle quali vengano promosse l’educazione alla vaccinazione, la comunicazione dei benefici dei vaccini e del valore della vaccinazione e l’implementazione di una vaccinazione facilmente accessibile. È importante, inoltre, non solo concentrarsi sul valore per i pazienti ma anche sui vantaggi personali per gli stessi operatori sanitari.
Per Lorenc et al. [13], il valore sociale della vaccinazione antinfluenzale si correla soprattutto alla protezione degli altri da parte degli operatori sanitari vaccinati, anche se, purtroppo, anche in questa categoria non vengono riportate coperture vaccinali adeguate. Invece, secondo Ortiz et al. [14] il valore sociale della vaccinazione si correla perfettamente con la prevenzione vaccinale dell’influenza nelle donne in gravidanza, in quanto l’immunizzazione materna previene la malattia in due gruppi ad alto rischio: le madri e i loro bambini durante i primi mesi di vita. Fondamentale, secondo gli autori, è il rafforzamento dell’immunizzazione materna, soprattutto nei paesi in via di sviluppo, in quanto questo intervento di prevenzione potrebbe migliorare i sistemi sanitari per l’assistenza prenatale, potrebbe favorire la costruzione di una piattaforma per la produzione di altri vaccini da utilizzare durante la gravidanza, e potrebbe rafforzare, aumentando la distribuzione dei vaccini antinfluenzali, i sistemi sanitari nella risposta a eventuali future pandemie.
Altro valore fondamentale della vaccinazione antinfluenzale è quello personale, affrontato in oltre il 35% degli studi inclusi nella nostra revisione sistematica. Il valore personale è stato sottolineato, soprattutto, in rapporto ai benefici individuali sugli outcome clinici legati alla vaccinazione e al coinvolgimento/ empowerment dei cittadini. Infine, solo in circa il 22% degli studi inclusi è stato affrontato il tema del valore allocativo, in termini di accessibilità ed equità di accesso alla vaccinazione antinfluenzale. Questo risultato è in linea con quanto documentato anche nel nostro precedente lavoro sul valore delle vaccinazioni [1] e richiama l’attenzione sulla necessità di sviluppare ulteriori ricerche su questa dimensione del valore, rilevante sia per i sistemi sanitari che per i cittadini.
E’ interessante notare come nella valutazione del valore generale della vaccinazione antinfluenzale, non direttamente indagato secondo i quattro pilastri del valori proposti dall’EXPH, siano state affrontate tematiche come il valore culturale e i benefici sociali della vaccinazione sia dalla prospettiva dei cittadini sia da quella dei professionisti sanitari, così come il valore della vaccinazione in popolazioni “speciali” come gli anziani, i pazienti con patologie cardiovascolari e oncologici, e anche gli studenti delle professioni sanitarie. Inoltre, negli studi che hanno affrontato più in generale il tema del valore della vaccinazione antinfluenzale è stata posta particolare attenzione all’importanza del valore complessivo di questa vaccinazione e della necessità di una metodologia appropriata per valutarne il pieno valore e supportare un processo decisionale basato sull’evidenza [15], anche grazie a strumenti evidence-based come l’HTA [16]. Inoltre, una migliore interpretazione dell’influenza vaccine effectiveness (IVE) [15] e l’uso di appropriate metodiche per misurare l’immunogenicità dei vaccini antinfluenzali [17] potrebbero contribuire a una più ampia valutazione del valore della vaccinazione antinfluenzale, così come ulteriori informazioni sui diversi fattori che possono modificare la risposta immunitaria indotta dai vaccini antinfluenzali potrebbero essere utili per comprendere meglio il valore più ampio della vaccinazione, soprattutto in particolari gruppi a rischio [18].
È stato, inoltre, sottolineato il valore della sorveglianza dell’influenza e la necessità di applicare metodi innovativi di sorveglianza anche attraverso i social media [19]. Ancora, altro aspetto del valore proposto dalla letteratura scientifica è stato quello del valore degli interventi educativi in ambito di vaccinazione antinfluenzale per gli studenti in infermieristica [20] ma anche di literacy per i cittadini [21]. Infine, è stato sottolineato come sia necessaria una pianificazione coordinata a livello globale per implementare la vaccinazione antinfluenzale in tutto il mondo, e guidata da un’alleanza di stakeholders internazionali, che includa rappresentanti di organizzazioni governative e non governative, cittadini, industria, organizzazioni internazionali ed esperti in sicurezza sanitaria e influenza [22].
Sulla base di quanto descritto e di quanto emerso dalla nostra revisione di letteratura è evidente come la conoscenza e la comunicazione del valore complessivo della vaccinazione antinfluenzale sia fondamentale e necessaria per guidare politiche sanitarie in ambito di immunizzazione evidence-based e value-based. Tuttavia, diverse sono le barriere da superare per aumentare le coperture vaccinali contro l’influenza a livello internazionale. Un documento dell’EXPH, pubblicato nel 2018 [23], ha identificato i principali fattori (barriere e fattori abilitanti) che influenzano l’adozione della vaccinazione nell’Unione Europea e ha valutato le misure necessarie per migliorare le coperture vaccinali. Secondo gli esperti, le barriere per il raggiungimento di una copertura vaccinale universale includono le preoccupazioni o le paure degli individui sulla sicurezza dei vaccini e sui loro eventi avversi, la mancanza di fiducia nelle vaccinazioni, le norme sociali, l’esposizione a falsi miti che minano la fiducia nei vaccini, l’incapacità di alcuni operatori sanitari di contrastare questi miti e fornire prove e un'adeguata consulenza informata, barriere all’accesso (ad es. scarsa disponibilità, copayments) e incapacità di comprendere i meccanismi sottostanti che riducono la fiducia nelle vaccinazioni. I fattori abilitanti includono, invece, fonti di informazioni affidabili sulla vaccinazione, esposizione a messaggi mediatici positivi, creazione di fiducia nelle istituzioni e nei fornitori, creazione di fiducia nella vaccinazione, facile accesso e disponibilità ai servizi sanitari, facilità di somministrazione, coinvolgimento attivo e impegno da parte degli operatori sanitari e gruppi ad alto rischio [23]. Pertanto, le azioni da implementare per aumentare le coperture vaccinali dovrebbero focalizzarsi su strategie di comunicazione inerenti i benefici della vaccinazione e su un maggior dialogo – con un approccio partecipativo - con i gruppi più esitanti su vaccini e vaccinazioni [23]. Inoltre, le politiche sanitarie dovrebbero essere guidate dal raggiungimento dell’immunità di gregge. La vaccinazione può essere obbligatoria o raccomandata purché si ottengano tassi di copertura elevati per ottenere l’immunità di gregge [23]. È necessario un maggior coinvolgimento dei medici di prossimità (medici di medicina generale e pediatri di libera scelta) per migliorare i tassi di copertura vaccinale in tutte le fasce di età. Tuttavia, un migliore accesso alle vaccinazioni potrebbe essere ottenuto con il coinvolgimento di altri operatori sanitari adeguatamente formati (ad es. infermieri, farmacisti ecc.), garantendo, in tal modo, maggiore equità di accesso. Ovviamente, gli operatori sanitari dovrebbero essere adeguatamente formati anche sulle migliori modalità di comunicazione e dovrebbero avere una formazione specifica per affrontare le preoccupazioni sui vaccini da parte dei cittadini esitanti, in particolare in relazione alla sicurezza e agli effetti collaterali dei vaccini. Un’altra priorità di azione consiste nel rafforzare i sistemi di monitoraggio e sorveglianza a livello internazionale, nazionale e locale, al fine di garantire dati aggiornati per guidare la politica e la pianificazione sanitaria e implementare, in tal modo, le coperture vaccinali [23].
Inoltre, così come evidenziato dalla letteratura [2], la comprensione del valore complessivo delle vaccinazioni e la traduzione effettiva di questa conoscenza a tutte le parti interessate è fondamentale per rafforzare le politiche sanitarie e le strategie di immunizzazione a livello globale, nonchè per contrastare la disinformazione sui vaccini e l’esitazione vaccinale. Recentemente, in collaborazione con un gruppo internazionale di esperti, abbiamo proposto alcune raccomandazioni su ricerca, processo decisionale ed engagement dei cittadini al fine di rafforzare l’utilizzo delle evidenze sul valore, nel processo decisionale sulle vaccinazioni [2].
Nello specifico, le raccomandazioni per l’area della ricerca [2] sono:
sviluppare un consenso multi-stakeholder sui quattro pilastri del valore applicati/da applicare ai vaccini e alle vaccinazioni;
analizzare le barriere esistenti per la valutazione del valore complessivo delle vaccinazioni;
estendere la ricerca scientifica al valore complessivo dei vaccini e delle vaccinazioni con l’obiettivo di quantificare meglio il loro ampio impatto sociale;
rafforzare le prove scientifiche e la generazione di dati al fine di implementare strategie vaccinali basate sull’evidenza e garantire la valutazione del loro impatto a posteriori;
implementare e sviluppare modelli/strumenti per supportare l’HTA o altri frameworks di valutazione, al fine di riconoscere il valore complessivo della vaccinazione;
sviluppare partenariati pubblico-privati positivi e collaborativi per garantire incentivi sostenibili per lo sviluppo di innovazioni di alto valore nell’ecosistema dei vaccini.
Per l’area relativa all’engagement dei cittadini sono state proposte, invece, le seguenti raccomandazioni [2]:
identificare le leve per migliorare la conoscenza e la comprensione degli individui e della comunità sul valore complessivo dei vaccini e delle vaccinazioni;
ottenere una migliore alfabetizzazione sul valore della vaccinazione per gli operatori sanitari e per i cittadini;
sviluppare strategie efficaci per coinvolgere attivamente le comunità nella vaccinazione.
Infine, per il processo decisionale si raccomanda di [2]:
sviluppare iniziative di capacity building sul valore complessivo delle vaccinazioni, sia per i ricercatori che per i decisori;
avviare iniziative per incorporare i quattro pilastri del valore nel processo decisionale su vaccini e vaccinazioni a livello sovranazionale, nazionale e regionale;
migliorare la governance del processo decisionale relativo ai vaccini costruendo una collaborazione efficace e aperta tra autorità, operatori sanitari, scienziati, cittadini e industria;
incoraggiare processi decisionali condivisi sulla vaccinazione tra le diverse parti interessate.
La raccolta e la sintesi delle evidenze scientifiche sul valore delle vaccinazioni rappresenta un primo e fondamentale tassello per promuovere un nuovo approccio di immunizzazione basato sul valore. Aumentare la consapevolezza sul valore delle vaccinazioni è inoltre di grande importanza fintanto che l’esitazione e il sottoutilizzo dei vaccini potranno portare al rischio di gravi epidemie.
Nel mondo sanitario, l’avanzamento tecnologico sta consentendo l’acquisizione crescente di nuovi strumenti, sia per la prevenzione che per il trattamento di molteplici malattie.
Nel 2021, la disponibilità di nuove tecnologie (“piattaforme”) ha reso possibile disporre rapidamente di vaccini per il contrasto alla pandemia di COVID-19. Lo studio e l’utilizzo di nuove tecnologie per la produzione dei vaccini sono stati tuttavia al centro dell’attenzione anche negli anni precedenti alla pandemia, con l’obiettivo di consentire lo sviluppo di prodotti per contrastare malattie che ancora oggi non possiamo annoverare tra quelle vaccino-prevenibili (es. HIV) o per migliore il controllo di quelle che sono già tali (es. influenza, malattie pneumococciche, malattie meningococciche, herpes zoster).
L’influenza in particolare ha rappresentato un campo di sviluppo importante per svariate ragioni. In primis occorre ricordare come nel 1918-19 la pandemia da influenza spagnola abbia determinato perdite ingenti di vite umane, richiamando l’attenzione del mondo intero, in particolare quello della ricerca e sanitario, nei confronti dello sviluppo e dell’utilizzo di strumenti idonei a proteggere la popolazione. In secondo luogo, la tendenza dei virus influenzali a mutare con conseguente acquisizione di capacità di sfuggire all’immunità acquisita e, nei casi di mutazioni di maggiori entità, di potere pandemico [1], ha imposto al mondo produttivo dei vaccini influenzali l’esigenza, da una parte, di aggiornare costantemente la composizione dei prodotti e, dall’altra, di studiare e impiegare nuovi sistemi di produzione. Questi ultimi in particolare sono di grande interesse perché possono impedire, nel corso della produzione, cambiamenti del virus in grado di portare a una riduzione dell’efficacia vaccinale (mutazioni egg-adaptive) [2] e consentire anche un “risparmio antigenico”, utile ai fini delle capacità produttive, importanti nel caso di una nuova pandemia influenzale.
Alla luce di questo, si sono delineati due percorsi, entrambi importanti, che hanno visto progressivamente aumentare la valenza dei vaccini influenzali, fino ad arrivare agli attuali prodotti quadrivalenti in uso in Italia, e immettere sul mercato vaccini prodotti su nuove piattaforme, come quello da coltura cellulare e ricombinante. Non va altresì dimenticato che, considerando il target della vaccinazione influenzale, l’industria ha anche sviluppato prodotti potenziati pensati per l’immunizzazione dei soggetti anziani nei quali, per il fenomeno dell’immunosenescenza, si verifica una ridotta risposta immunitaria [3].
Ci troviamo pertanto di fronte a uno scenario caratterizzato dalla disponibilità di molteplici tecnologie, in cui la governance delle stesse diviene un elemento cruciale per conseguire il massimo valore dall’utilizzo dei diversi prodotti.
Proprio in tale prospettiva si colloca l’Health Technology Assessment (HTA) che, stando alla definizione congiunta rilasciata dal network delle agenzie di HTA (INAHTA), dalla società internazionale di HTA (HTAi) e dai networks di HTA europeo (EUnetHTA), asiatico (HTAsiaLink) e americano (RedETSA), viene definito come “a multidisciplinary process that uses explicit methods to determine the value of a health technology at different points in its lifecycle” [4].
L’HTA, con un approccio multidisciplinare che richiede il coinvolgimento di diverse competenze e di tutti i portatori di interesse, mira a valutare il valore della tecnologia attraverso la disamina di diversi domini che sono stati descritti, nei contenuti e nelle modalità di analisi, dallo European Network for Health Technology Assessment (EUnetHTA) [5]. Alcuni di questi domini, definiti anche “clinici”, riguardano aspetti legati al problema di salute, tecnologici, e riferiti all’efficacia e alla sicurezza della tecnologia, mentre altri, come quelli economico, organizzativo, legale, sociale, etico, hanno una stretta relazione col contesto specifico di analisi.
Indipendentemente dal dominio considerato e dai metodi specifici che la sua valutazione richiede, le evidenze scientifiche rivestono un ruolo centrale nell’ambito della produzione di un report di HTA. Infatti, l’HTA si basa sulla raccolta sistematica e trasparente di evidenze e dati utili a consentire l’analisi dei diversi domini col fine di informare i decisori sanitari [6].
La produzione di evidenze scientifiche costituisce già un tassello imprescindibile nell’iter regolatorio di approvazione dei vaccini, dal momento che gli stessi vengono valutati sotto il profilo della qualità, della sicurezza e dell’efficacia dall'European Medicine Agency (EMA) prima dell’autorizzazione all’immissione in commercio. Le evidenze sottoposte a valutazione tecnico-regolatoria provengono dagli studi clinici, in particolare quelli di fase III che, in ragione delle caratteristiche metodologiche, sono considerati studi estremamente rigorosi e robusti in grado di rilasciare risultati accurati, ossia corrispondenti a realtà, dell’efficacia ma anche della reattogenicità e della sicurezza dei vaccini [7].
Le evidenze relative agli effetti delle tecnologie sanitarie sugli esiti di salute saranno anche oggetto delle valutazioni cliniche congiunte (Joint Clinical Assessment, JCA) previste dal nuovo regolamento europeo sulla valutazione delle tecnologie sanitarie, il 2021/2282, che è stato adottato a dicembre 2021. Il regolamento, risultato della strategia farmaceutica europea, si propone di migliorare l’accesso ai farmaci e ai dispositivi medici da parte dei cittadini e dei pazienti degli stati membri dell’Unione Europea attraverso l’adozione di nuove regole per la valutazione delle tecnologie sanitarie che ridurranno le duplicazioni, garantiranno l’adeguamento a standard qualitativi e permetteranno una cooperazione sostenibile e duratura in materia di HTA a livello europeo [8]. In particolare, i JCA si baseranno sull’analisi dei dati scientifici degli effetti della tecnologia sanitaria rispetto a esiti di salute selezionati e sulla disamina del grado di certezza degli stessi alla luce dei punti di forza e dei limiti delle evidenze disponibili [9].
Da quanto detto emerge quindi chiaramente come le evidenze scientifiche disponibili, e la loro qualità, diventeranno fondamentali nel processo di valutazione congiunta delle tecnologie a livello europeo. Occorre tuttavia specificare come nel regolamento si faccia riferimento alla valutazione relativa delle tecnologie rispetto ai competitor esistenti, cosa che richiama l’attenzione sul ruolo delle evidenze di natura osservazionale che il regolamento stesso non esclude, pur dando indicazione preferenziale alla raccolta e all’analisi di studi di comparazione diretta, randomizzati e in cieco [9].
L’uso di evidenze provenienti da studi non randomizzati costituisce un argomento di grandissimo interesse e attualità nell’HTA, dal momento che i dati di comparazione diretta sono genericamente scarsi e che l’obiettivo dell’HTA è definire il valore aggiunto di una tecnologia sanitaria rispetto ad altre, anche considerandone l’efficacia e la sicurezza relative.
Nell’ambito del progetto “Improved methods and actionable tools for enhancing HTA” (IMPACT-HTA), finanziato dal programma di ricerca europeo Horizon 2020, sono state sviluppate delle raccomandazioni rispetto all’utilizzo delle evidenze di questo tipo. Accanto ad aspetti più squisitamente metodologici che hanno a che vedere con l’impianto, la conduzione, l’analisi e il reporting di tali evidenze, sono state rilasciate anche delle raccomandazioni per le agenzie di HTA che riguardano: a) la necessità di rafforzare i meccanismi di consultazione scientifica non solo rispetto agli studi controllati randomizzati ma anche a quelli osservazionali; b) l’esigenza di promuovere interventi di capacity building nell’ambito della progettazione, conduzione, analisi, reporting e interpretazione degli studi non randomizzati; c) l’importanza di definire raccomandazioni e standard metodologici per la progettazione, conduzione, analisi, reporting e interpretazione degli studi non randomizzati; d) il bisogno di investire nella generazione di evidenze post-marketing e nella loro analisi anche nell’ottica dell’adozione di sistemi di autorizzazione condizionata [10].
Accanto a questa riflessione riguardo la valutazione relativa degli effetti sulla salute delle tecnologie sanitarie ne va fatta un’altra rispetto al ruolo che le evidenze hanno nella valutazione globale del valore aggiunto delle tecnologie sanitarie che lo stesso regolamento europeo sull’HTA demanda ai singoli Stati Membri. È infatti a essi che spetta la responsabilità di definire la politica sanitaria e l’organizzazione dell’assistenza sanitaria e, quindi, di stabilire come allocare le risorse sulla base dell’esame del valore delle diverse tecnologie sanitarie. Tali compiti possono essere assolti solamente attraverso la contemporanea valutazione di aspetti contestuali, a partire da quelli epidemiologico-sanitari per passare a quelli finanziari-economici, organizzativi e sociali. Le evidenze scientifiche, ma anche i dati sanitari disponibili a livello nazionale, costituiscono materiale prezioso per una disamina chiara e attuale di questi aspetti, nell’obiettivo di definire lo stato attuale delle cose e i relativi margini di miglioramento.
Per tornare a parlare di influenza, appare in questo senso dirimente la raccolta e l’analisi dei dati di copertura vaccinale per comprendere quali siano i target sui quali lavorare più alacremente per il raggiungimento degli obiettivi di copertura, presupposto indispensabile per ottenere i benefici attesi della campagna vaccinale. Diventa quindi doveroso constatare come nel nostro sistema sanitario si sconti ancora una certa carenza di dati, anche di copertura vaccinale, dal momento che se disponiamo di informazioni relative all’intera popolazione anziana, altrettanto non si può dire per la popolazione adulta a rischio che rientra nel target della campagna vaccinale. La stessa cosa può dirsi rispetto alla valutazione del burden clinico ed economico dell’influenza di cui abbiamo ancora una rappresentazione frammentaria a livello nazionale. Eppure, tanto il burden quanto la copertura vaccinale rappresentano, insieme all’efficacia vaccinale e ai dati epidemiologici, elementi di estrema importanza nelle modellizzazioni dell’impatto sanitario ed economico dell’utilizzo dei diversi prodotti vaccinali. Ne deriva quindi l’importanza di investire sulla raccolta capillare, puntuale, accurata e tempestiva di dati e sulla produzione di evidenze al fine di garantire che i processi di valutazione delle tecnologie rilascino proiezioni quanto più realistiche. A tal riguardo, un aspetto cruciale che è già stato richiamato in precedenza ma che viene ora a essere contestualizzato all’influenza, è rappresentato dalla disponibilità di evidenze circa l’efficacia relativa dei diversi vaccini influenzali, elemento che sta acquisendo importanza sempre più crescente alla luce anche della disponibilità di più prodotti con indicazione di uso nelle diverse fasce di età. Non a caso l'European Centre for Disease Prevention and Control (ECDC) ha recentemente raccolto e sistematizzato i dati di efficacia teorica e reale nei confronti dell’influenza dei vaccini prodotti su coltura cellulare, ricombinanti e potenziati (adiuvato e ad alto dosaggio) nella popolazione adulta, giungendo tuttavia alla conclusione che le evidenze disponibili sono scarse e non consentono di trarre conclusioni definitive rispetto alla loro efficacia relativa [11]. L’attuale difficoltà a fare una valutazione dell’efficacia relativa, oltre che a essere imputabile alla scarsità di prove, si lega anche ad altri aspetti, come quello del potenziale mismatch dei vaccini influenzali nei confronti dei virus circolanti, fenomeno che si presenta in maniera variabile da stagione a stagione, con inevitabili ripercussioni sui dati di efficacia. Un’altra considerazione importante riguarda gli endpoint valutati e valutabili per l’analisi dell’efficacia relativa. Infatti, l’estensione della valutazione a endpoint secondari correlati all’influenza potrebbe consentire di ottenere una panoramica più ampia dei benefici della vaccinazione influenzale in sé e dell’efficacia relativa dei diversi vaccini. A tal proposito la revisione sistematica con metanalisi di Coleman del 2021 ha prodotto interessanti risultati sull’efficacia assoluta e relativa dei vaccini adiuvati nei confronti di diversi endpoint, quali le visite mediche e le ospedalizzazioni correlate all’influenza negli anziani sopra i 64 anni di età [12].
Rimane tuttavia aperta la questione di come valorizzare le evidenze provenienti da studi non randomizzati real world nell’ambito del processo valutativo a supporto delle decisioni. Indubbiamente il rigore metodologico delle evidenze riveste un ruolo imprescindibile, benché sia da affiancare ad altre considerazioni, quali quelle proposte dal metodo GRADE (Grading of Recommendations Assessment, Development, and Evaluation) che riguardano la trasferibilità dei risultati al quesito decisionale di interesse, la coerenza dei risultati dei diversi studi e la precisione delle stime di effetto. Questi aspetti vanno chiaramente oltre la valutazione dell’appropriatezza del disegno e della conduzione dello studio e sono volti a comprendere la rilevanza dei risultati prodotti rispetto alle decisioni da prendere [13]. Certamente, potrebbe essere auspicabile una declinazione del metodo GRADE rispetto al mondo vaccinale, considerato che molte malattie prevenibili da vaccino condividono aspetti degni di considerazione, quali la variabilità stagionale e dei ceppi responsabili di malattia nonché la disponibilità di prove di efficacia che possono basarsi anche esclusivamente sull’analisi del profilo di immunogenicità [14]. Questi aspetti non possono che rendere il processo di valutazione dei vaccini più articolato e complesso e richiamare quindi l’attenzione sull’importanza di armonizzare l’analisi delle evidenze disponibili e di rafforzare la raccolta dei dati, anche in fase post-marketing, per consentire la rivalutazione del valore aggiunto dei diversi prodotti vaccinali durante il loro intero ciclo vitale. Un altro tassello imprescindibile è infine quello della trasparenza del processo di elaborazione delle raccomandazioni. A tal proposito si ritiene opportuno menzionare l’Advisory Committee on Immunization Practices (ACIP), organo consultivo delle vaccinazioni statunitense, che ha recepito il framework Evidence to Recommendations (EtR) per la formulazione delle proprie raccomandazioni [15]. Tale framework consente di contemplare diversi criteri – quali la rilevanza del problema di salute, il rapporto benefici/rischi, i valori, la richiesta di risorse, l’equità, l’accettabilità e la fattibilità – guidando nella formulazione di un parere basato sulle evidenze, a riprova del fatto che le stesse non sono utili solamente nella valutazione delle dimensioni classiche di efficacia e sicurezza, ma anche di altri aspetti anch’essi rilevanti nel processo decisionale.
La vaccinazione è uno dei più grandi successi della medicina moderna, infatti, l’immunizzazione attiva contro le malattie infettive permette, ogni anno, di evitare 4-5 milioni di morti [1] e, durante la pandemia da COVID-19, ha salvato 20 milioni di vite [2]. In generale, si tratta di uno degli interventi di Salute Pubblica più efficaci ed economici. Infatti, la riduzione dei casi di malattia permette di evitare visite mediche ambulatoriali, esami diagnostici e di laboratorio, ricoveri e morti determinando una diminuzione delle spese sanitarie e una riduzione dei costi indiretti a carico dell’intera società. Pertanto, le vaccinazioni contribuiscono a garantire la sostenibilità dei sistemi sanitari e a sostenere la crescita economica di una Nazione [1].
Tra le malattie infettive prevenibili con la vaccinazione troviamo l’influenza stagionale che, per la sua elevata incidenza e la rilevante probabilità di complicanze in alcune categorie a rischio, comporta per la popolazione mondiale un pesante burden clinico e socioeconomico. Secondo le stime ufficiali, nel mondo, il tasso di attacco annuale dell’influenza è di circa il 20-30% nei bambini e del 5-10% negli adulti [3]. In Europa, lo studio BCoDE (Burden of Communicable Diseases in Europe) ha attribuito all’influenza il 30% del carico totale di malattia associato a 31 malattie infettive, per un totale di 81,8 Disability-adjusted life years (DALYs) per 100.000 abitanti/anno [4].
Sebbene l’influenza colpisca soggetti di tutte le fasce d’età, alcune categorie presentano un maggior rischio di infezione come i bambini e gli adolescenti e altre una probabilità maggiore di sviluppare complicanze (bambini di età < 5 anni, soggetti con patologie croniche e anziani). Nella fascia pediatrica l’influenza causa circa il 10% delle ospedalizzazioni per cause respiratorie [5] e la frazione di morti per lower respiratory tract infection (LRTI) attribuibile all’influenza tra i bambini < 5 anni è del 2,9% (IC95%: 2,0-4,0) [6]. L’altra categoria a rischio sono gli anziani che, nonostante un’ampia memoria immunologica generata dalla vaccinazione e dai ripetuti contatti con i virus influenzali che permettono di mantenere bassi tassi di incidenza [6], hanno un’aumentata probabilità di decorso clinico grave della malattia per l’immunosenescenza e le condizioni mediche sottostanti [7]. Infatti, nei soggetti over 65 si osserva un tasso di ospedalizzazione per influenza di 437/100,000 persone (IC 95%: 265-612) rispetto a un tasso pari a 80/100,000 (IC 95%: 44-139) negli adulti < 65 anni [7, 8]. Questi dati si traducono in un eccesso medio di mortalità di 2,9-44,0/100,000 persone nella fascia di età fra i 65 e 74 anni e di 17,9-223,5/100,000 nella fascia di età > 75 anni [8]. Altre categorie, invece, sono considerate a rischio per esposizione al virus come gli operatori sanitari (contatti con i pazienti o con materiale infettivo). Alcuni studi, infatti, hanno osservato, tassi più elevati di malattia simil-influenzale e di sieroconversione in questo gruppo di individui rispetto alla popolazione generale [9-11].
Come precedentemente sottolineato la vaccinazione è lo strumento prioritario per il contenimento dell’influenza, infatti, le categorie a elevato rischio (anziani, soggetti con patologie croniche, bambini < 5 anni, operatori sanitari, donne in gravidanza) sono inserite nelle raccomandazioni internazionali per l’offerta gratuita con la priorità di raggiungere coperture vaccinali adeguate. In tale contesto, il Consiglio europeo, seguendo le raccomandazioni del Centro Europeo per la Prevenzione e il Controllo delle Malattie (ECDC) e dell’Organizzazione Mondiale della Sanità (OMS), ha indicato come livello di copertura minima il 75% in tutti i Paesi dell’Unione Europea [12]. In Italia, la vaccinazione antinfluenzale è gratuita e fortemente raccomandata nei gruppi a rischio come da Circolare Ministeriale [13, 14].
Negli ultimi anni la ricerca ha portato allo sviluppo di numerosi vaccini con l’obiettivo di avere a disposizione prodotti sempre più sicuri ed efficaci (vaccino prodotto su coltura cellulare, vaccino ricombinate), appositamente studiati per le diverse fasce di età (vaccino vivo attenuato per la popolazione pediatrica, vaccino adiuvato con MF59 e vaccino ad alto dosaggio per la popolazione anziana). Ciò ha evidenziato la necessità di condurre studi sulle strategie di immunizzazione per utilizzare le risorse disponibili in modo efficace e sostenibile con l’obiettivo di massimizzare i risultati in termini di salute e qualità di vita, di risparmio economico e assicurare un’adeguata protezione per l’intera collettività [7, 15-23].
Poiché i virus dell’influenza si evolvono continuamente, i vaccini stagionali sono aggiornati ogni anno per cercare di ottenere una buona corrispondenza tra i ceppi vaccinali e i ceppi circolanti. Proprio questo fattore è uno dei principali parametri che condiziona l’efficacia del vaccino influenzale stagionale. Infatti, dati di letteratura riportano stime di efficacia in stagioni con un ottimale match tra i ceppi vaccinali e i ceppi circolanti comprese tra il 70-90% e stime di assenza di efficacia in stagioni caratterizzate da un totale mismatch [15-19, 24, 25]. Inoltre, occorre tenere conto che la circolazione dei virus influenzali non è uniforme, ma varia in base al tempo e al luogo. Due volte l’anno, infatti, l’OMS esamina i dati degli studi di sorveglianza epidemiologica, di laboratorio e clinici e formula raccomandazioni sui ceppi che comporranno i vaccini antinfluenzali per la stagione successiva [26].
Data la variazione dei vaccini stagionali è necessario condurre su base annuale studi per valutare le perfomance dei vaccini stessi.
Per essere clinicamente efficaci, i vaccini devono essere in grado di stimolare un'adeguata risposta immunitaria. Infatti, il raggiungimento di un valore soglia di anticorpi, valutato attraverso test di laboratorio standardizzati, è considerato una misura proxy dell’efficacia vaccinale, andando a determinare il cosiddetto “correlato di protezione” (CoP) [27]. Il test dell’inibizione dell’emoagglutinazione (HAI) è considerato il gold standard per i vaccini inattivati; infatti, tale metodica è quella richiesta dall’ente regolatorio statunitense per soddisfare i criteri CBER (Center for Biologics Evaluation and Research) relativi all’immunogenicità dei vaccini antinfluenzali [28, 29] e quello indicato anche dalle linee guida del CHMP (Committee for Medicinal Products for Human Use) [15-19, 29]. Nel secolo scorso le evidenze scientifiche hanno portato a definire che titoli anticorpali determinati tramite il test HAI ≥1:40 potessero essere associati a una riduzione del 50% del tasso di infezione in adulti. Tuttavia, è ancora dibattuto se tale titolo possa fornire protezione sufficiente anche negli adulti più anziani, nei bambini e in altri gruppi ad alto rischio. Un’altra questione riguardante l’uso del test HAI è dovuta alla sua bassa sensibilità nei confronti dei ceppi B e dei virus aviari [30]. Infine, va considerato che per il vaccino vivo attenuato (LAIV) (autorizzato per la popolazione pediatrica) non è attualmente disponibile un correlato di protezione specifico. Infatti, Randomized Clinical Trials (RCTs) di efficacia hanno dimostrato che i titoli HI sottostimano la protezione del vaccino, probabilmente a causa della risposta immune più ampia determinata dalla stimolazione di risposte IgA locali e cellule T, le quali non sono misurate con il test HAI. Di conseguenza, i correlati di protezione usati per i vaccini inattivati potrebbero non correlare con la protezione dopo la vaccinazione con il vaccino LAIV. Inoltre, sembrerebbe che il cut-off di 1:40, ritenuto il valore di riferimento negli adulti, non sia appropriato quando si valutano i vaccini antinfluenzali nei bambini [18]. Per questi, sebbene un limite di 1:110 possa essere utilizzato per prevedere il tasso di protezione clinica convenzionale del 50%, un titolo di 1:330 potrebbe predire un livello di protezione dell’80%, che potrebbe essere più desiderabile dal punto di vista della salute pubblica [18]. Solo pochi studi considerano test sierologici alternativi come la microneutralizzazione (NT) e l’emolisi singola radiale (SRH). Quest’ultimo test riconosce come correlato di protezione la zona di emolisi ≥ 25 mm2 [29]. Generalmente, la valutazione della risposta immunitaria è effettuata a distanza di 3-4 settimane dalla somministrazione del vaccino, tuttavia alcuni studi considerano tempi di osservazione più lunghi al fine di valutare la persistenza dei titoli anticorpali.
Le evidenze a sostegno dell’immunogenicità, dell’efficacia e della sicurezza dei vaccini antinfluenzali sono basate su RCTs e studi osservazionali condotti in condizioni reali.
Le autorità regolatorie, Agenzia Europea per i Medicinali (EMA) in Europa e la Food and Drug Administration (FDA) negli Stati Uniti, richiedono la conduzione di RCTs per dimostrare i benefici protettivi di un nuovo vaccino.
In un RCT, i volontari sono assegnati in modo casuale a ricevere un vaccino antinfluenzale o un placebo o un trattamento non attivo. Il disegno dello studio tende a minimizzare i possibili bias, ovvero errori sistematici non intenzionali (selezione e inclusione dei partecipanti, misurazione e analisi dei dati, ecc.) per rendere i risultati i più attendibili possibili. Ad esempio, l’assegnazione del vaccino è in cieco (singolo o doppio), ciò determina l’assenza di condizionamento del soggetto e del ricercatore. Inoltre, i RCTs sono effettuati in “condizioni ideali” in cui la conservazione e la somministrazione del vaccino sono monitorate e i partecipanti generalmente godono di buona salute o sono selezionati per uno specifico stato di salute. L’outcome “malattia influenzale confermata in laboratorio” è considerato il gold standard per valutare l’efficacia teorica del vaccino. Tuttavia, una delle principali criticità dei RCTs riguarda la popolazione di studio. I gruppi ad alto rischio di complicanze come bambini di età < 5 anni, individui con specifiche condizioni croniche, soggetti in politerapia, donne in gravidanza e in allattamento sono solitamente esclusi, determinando una sovrastima della reale efficacia dell’intervento. Inoltre, i RCTs tendono a indagare un solo vaccino in stagioni influenzali definite (1 o 2 stagioni). Relativamente a questo fattore, a causa dell’elevata variabilità dei ceppi influenzali circolanti nelle diverse stagioni, è difficile confrontare i risultati ottenuti in RCTs condotti in differenti stagioni. In sintesi, occorre valutare con attenzione i risultati derivanti da RCTs considerando i punti di forza e le criticità. I primi sono associati alla validità delle informazioni raccolte, comparabilità tra i soggetti appartenenti ai diversi gruppi di studio (vaccinati vs non vaccinati/placebo), accuratezza della codifica dell’outcome prescelto (caso confermato in laboratorio, ospedalizzazione per ICD specifici, ecc.) e controllo delle informazioni raccolte dal ricercatore. Contrariamente le principali criticità sono correlate con: la popolazione di studio coinvolta (popolazione sana o con patologie specifiche) che in alcuni casi non rispecchia la totalità della popolazione, area geografica di studio, stagioni influenzali comprese nel periodo di studio, caratteristiche dei ceppi influenzali circolanti nella popolazione, numerosità del campione, costi elevati, dati non sempre disponibili tempestivamente e similarità alle pratiche cliniche correnti (strategie di vaccinazione).
Per questo motivo, è necessario integrare i risultati dei RCTs con i dati collezionati “nel mondo reale” per dimostrare l’efficacia della vaccinazione nella popolazione generale e in sottogruppi specifici [31-35].
Le linee guida sui vaccini antinfluenzali messe appunto da EMA [36] richiedono, infatti, che gli studi di efficacia sul campo (effectiveness) osservazionali siano condotti come parte dei requisiti post-licenza dai produttori di vaccini. In particolare, ai produttori viene richiesto di sostituire le prove cliniche annuali di immunogenicità (senza chiare correlazioni di protezione) con l’efficacia del vaccino sul campo. Per raggiungere questo obiettivo, i produttori sono incoraggiati a collaborare con organizzazioni, istituzioni e autorità sanitarie pubbliche [32].
Gli studi osservazionali (studi di coorte retrospettivi e prospettici, caso-controllo, caso controllo con disegno test-negative) raccolgono i dati durante le campagne di vaccinazione e permettono di valutare l’effectiveness in stagioni e contesti diversi. Pertanto, forniscono gli strumenti necessari per il monitoraggio continuo dell’efficacia e assicurano la sorveglianza post-marketing dei vaccini. Occorre sottolineare che questi studi, essendo condotti nel “mondo reale”, sono facilmente oggetto di bias.
Il primo aspetto da considerare è il disegno dello studio, poiché alcuni errori metodologici si verificano più frequentemente in alcune tipologie [37].
Tra gli studi osservazionali, gli studi di coorte sono quelli che offrono maggiori garanzie al fine di raggiungere risultati qualitativamente migliori. Questa tipologia di studi può essere condotta prospettivamente e retrospettivamente. Nello specifico, gli studi prospettici permettono al ricercatore di seguire, per l’intero periodo di studio (generalmente l’intera stagione influenzale), un campione di popolazione che differisce per esposizione (vaccinati vs non vaccinati). Questi studi presentano dei punti di forza e delle criticità. I principali punti di forza sono: l’eterogeneità della popolazione in studio (rilevante importanza ha la scelta dei criteri di inclusione ed esclusione per ottenere una rappresentatività della popolazione), la validità dell’informazione, il controllo delle informazioni raccolte da parte del ricercatore, l’accuratezza della codifica in base all’outcome prescelto e l’osservazione della strategia vaccinale in vigore. Contrariamente, le criticità sono legate a: costi elevati, bias correlati al tempo di osservazione (studi di lunga durata sono associati a un numero significativo di abbandoni e di insorgenza di fattori di confondimento), dati non disponibili in tempi brevi e modifica dell’esposizione durante il periodo di studio. Relativamente a quest’ultimo parametro, generalmente si assume che l’esposizione (la vaccinazione) sia la stessa per ogni persona del gruppo esposto. Tuttavia, lo stato vaccinale può cambiare durante il periodo di studio (gli individui appartenenti alla coorte possono essere sottoposti a vaccinazione in momenti diversi), modificando lo stato di immunizzazione e di conseguenza l’esposizione del soggetto.
In riferimento agli studi di coorte retrospettivi i principali vantaggi sono associati al minor costo, alla possibilità di seguire un numero elevato di soggetti utilizzando anche database elettronici e a periodi di studio relativamente brevi. Tra le criticità occorre segnalare la possibile presenza di fattori di confondimento (fattori di rischio e altre condizioni di salute) e l’eventuale incompletezza dei dati di esposizione.
Negli studi caso-controllo, un gruppo di soggetti malati e un gruppo di soggetti sani sono retrospettivamente confrontati sulla base della loro esposizione (vaccinazione antinfluenzale). La scelta dei controlli è un aspetto fondamentale, infatti, una selezione inadeguata può determinare un bias di selezione e portare a conclusioni non valide condizionate dall’errore metodologico [37]. Per cercare di limitare questa problematica, il disegno test-negative è sempre più utilizzato per studiare l’effectiveness dei vaccini antinfluenzali [38]. In questo tipo di studio, tutti i partecipanti sono arruolati secondo la stessa definizione di “caso clinico”. Pertanto, a differenza del disegno classico, sono i risultati di laboratorio che definiscono la suddivisione tra casi (soggetti positivi per influenza) e controlli (individui negativi) e solo successivamente è ricercata l’informazione di vaccinazione. Non essendoci una discriminazione iniziale, il bias di selezione è minimizzato, poiché entrambi i gruppi sono selezionati indipendentemente dallo stato di vaccinazione e sulla base di uno stesso criterio iniziale. Inoltre, i controlli includono sia soggetti positivi per altri patogeni (other respiratory virus positive controls), sia soggetti in cui non viene rilevata alcuna positività (soggetti pan-negativi) [39]. Tuttavia, anche in questo caso, è necessario valutare con attenzione tutti i possibili bias, ad esempio, l’errata classificazione della malattia (definizione di caso) potrebbe determinare o una sottostima o una sovrastima dell’effectiveness.
Alcune criticità sono comuni a tutti gli studi caso-controllo. Ad esempio, un tipico fattore di confondimento è rappresentato dalle condizioni mediche croniche dei soggetti arruolati che possono confondere l’associazione tra vaccinazione antinfluenzale e outcome clinico. Per questo motivo, è sempre necessario utilizzare tecniche statistiche di analisi che permettano di “aggiustare” i risultati e supportare il ricercatore nella corretta interpretazione del dato. Altro aspetto da considerare sono i bias di informazione che si verificano negli studi retrospettivi quando le informazioni (vaccinazione o fattori di rischio) si basano su fonti potenzialmente non attendibili, in particolare, quelle riferite dal soggetto in studio (inesattezza o incompletezza di eventi o esperienze passate).
I punti di forza degli studi caso-controllo sono principalmente associati ai costi contenuti, alla numerosità del campione, all’eterogeneità della popolazione in studio e alla possibilità di avere a disposizione dati quasi in tempo reale.
È importante sottolineare che la valutazione dell’effectiveness dei vaccini antinfluenzali è condizionata anche da fattori non riconducibili al disegno di studio. I principali sono: gli outcome di riferimento, le tecniche di laboratorio utilizzate per rilevare la presenza del virus e il cut-off di riferimento, il match tra ceppi vaccinali e circolanti, la predominanza stagionale dei diversi ceppi, l’andamento epidemiologico della circolazione del virus che condiziona il declino intrastagionale della protezione conferita dalla vaccinazione antinfluenzale e l’età dei soggetti vaccinati e le loro precedenti esposizioni.
Relativamente agli esiti potenzialmente riconducibili all’influenza il gold standard per valutare l’effectiveness dei vaccini antinfluenzali è il caso di influenza confermato in laboratorio [40]. La valutazione di esiti meno specifici come: Influenza-Like Illness (ILI), visite ambulatoriali per influenza/ILI e/o polmonite, ospedalizzazione per patologie respiratorie, ospedalizzazione per sindrome simil-influenzale/influenza e/o polmonite, ospedalizzazione per eventi cardiovascolari acuti, mortalità per polmonite/influenza e per tutte le cause potrebbe portare a una sottostima dell’efficacia del vaccino.
Un’ulteriore problematica riguarda l’utilizzo delle tecniche laboratorio utilizzate per la rilevazione del virus. Test con una bassa sensibilità e specificità possono portare a una sottostima dell’effectiveness. Di conseguenza, è fondamentale utilizzare tecniche accurate come la Real Time PCR (RT-PCR). In particolare, una bassa specificità causa maggiori distorsioni rispetto a una bassa sensibilità [41]. Un altro fattore da considerare è il cut-off di positività selezionato dal ricercatore. In generale, campioni con valori di soglia di ciclo (Ct) (metodica RT-PCR) inferiori a un limite di rilevazione prestabilito ≤40 sono considerati positivi [42]. Tuttavia, il team di ricerca può stabilire un cut-off differente e considerare negativi campioni con Ct compresi tra 35 e 40.
Il grado di protezione conferito dalla vaccinazione dipende dalla similitudine dei ceppi vaccinali con quelli circolanti, in particolare, questo è ancora più vero quando si conducono studi durante stagioni ad alta intensità con predominanza di A/H3N2 mutati [43, 44]. Inoltre, i vaccini influenzali non offrono lo stesso livello di protezione verso tutti i ceppi influenzali, ad esempio, la principale problematica legata all’efficacia sub-ottimale dei vaccini a dosaggio standard non adiuvati nella popolazione anziana è dovuta alla scarsa performance verso A/H3N2 [17, 19, 43].
Un ulteriore fattore legato all’andamento epidemiologico stagionale dell’influenza è il periodo di maggiore circolazione del virus che varia da stagione a stagione. Solitamente il picco epidemico si raggiunge a fine dicembre-gennaio; tuttavia, condizioni esterne possono modificare questa tendenza, ad esempio, nell’ultima stagione (2021/22) i primi casi di influenza sono stati registrati in febbraio. Questo parametro condiziona il declino intrastagionale della protezione conferita dalla vaccinazione antinfluenzale. Tanto più è lungo il periodo tra la data di immunizzazione (la campagna di vaccinazione inizia generalmente tra la terza, quarta settimana di ottobre e termina a fine dicembre) e il picco epidemico tanto minore sarà la protezione (declino della sieroprotezione nel tempo) [45]. Inoltre, anche il tipo di vaccino antinfluenzale utilizzato potrebbe avere un effetto sul declino intrastagionale. Si ritiene, infatti, che i vaccini adiuvati siano più immunogenici e in grado di conferire una durata di protezione maggiore rispetto ai vaccini non adiuvati a dosi standard [17, 19, 43].
È noto che l'età dei soggetti vaccinati sia uno dei principali parametri da considerare, infatti, generalmente la valutazione statistica dei dati comprende analisi di sensibilità che considerano l’età come un fattore confondente. Ad esempio, negli anziani l’immunosenescenza determina un’efficacia non ottimale dei vaccini influenzali, infatti, per questa categoria di soggetti sono stati sviluppati preparati specifici in grado di migliorare la risposta immunitaria [46]. Attualmente, due vaccini per la popolazione anziana sono disponibili in Italia: il vaccino quadrivalente prodotto su uova adiuvato con MF59 [17, 19, 47] e il vaccino quadrivalente prodotto su uova ad alto dosaggio [20, 48]. Relativamente a questo fattore (età) è necessario, per una corretta interpretazione del dato di efficacia o effectiveness, tenere conto del tipo di vaccino somministrato. Inoltre, il fattore “età” è correlato a precedenti esposizioni al virus [44]. Quest’ultimo parametro deve considerare che anche i non vaccinati possono essere stati esposti al virus e ottenere naturalmente una protezione o un rafforzamento dell’immunità preesistente cross-protettiva e di lunga durata.
Infine, occorre evidenziare che, come sottolineato recentemente dall’Advisory Committee on Immunization Practices (ACIP) [49], per una corretta interpretazione dei risultati di effectiveness è necessario considerare sia l’effectiveness assoluta (riduzione dei casi di influenza nei soggetti vaccinati rispetto a quelli non immunizzati) sia quella relativa (riduzione di casi di influenza nei soggetti vaccinati con il vaccino di interesse rispetto ai soggetti immunizzati con un competitor) poiché effectiveness relativa cambia considerevolmente in base all’effectiveness assolua del comparatore a sua volta influenzata dall’esito valutato, dal tipo di virus circolante e dalla risposta dell’ospite alla vaccinazione. Pertanto, sia i valori assoluti che quelli relativi devono essere presi in considerazione per comprendere appieno il beneficio del vaccino sull’outcome analizzato [50].
In conclusione, a causa dei molteplici fattori che possono condizionare l’efficacia teorica e sul campo di un vaccino influenzale e di una strategia di immunizzazione, per un’appropriata valutazione dei benefici dei vaccini influenzali sulla popolazione è necessario integrare i dati efficacia ottenuti attraverso la conduzione di RCTs con le informazioni raccolte tramite studi osservazionali condotti in stagioni sequenziali.
Solo il dato integrato, valutato criticamente, può riflettere il reale beneficio dei vaccini sul carico globale di malattia (visite ambulatoriali, test diagnostici e strumentali, ospedalizzazioni, morti) tenendo conto anche delle variazioni nel tempo in termini di impatto epidemiologico e di implementazione di strategie di vaccinazione permettendo ai ricercatori di fornire informazioni, basate sul valore, ai policy makers per un’efficace ed efficiente allocazione delle risorse disponibili in ambito preventivo.
Le pressioni sui budget sanitari hanno portato a un crescente interesse per la definizione del rapporto qualità-prezzo delle tecnologie sanitarie. In diversi Paesi viene richiesto come requisito formale, la presenza di prove economiche come parte del processo decisionale nella determinazione dei prezzi, nel rimborso o nelle Linee Guida ufficiali per l’uso delle tecnologie sanitarie. Ad esempio, nel Regno Unito, l’Istituto nazionale per la salute e l’eccellenza clinica (NICE) pubblica linee guida sull’uso delle tecnologie sanitarie nel Servizio Sanitario Nazionale sulla base di valutazioni cliniche e di costo-efficacia [1].
I vaccini rappresentano un importante gruppo di tecnologie sanitarie e, a prima vista, ci si aspetterebbe che vengano valutati, in termini di rapporto costo-efficacia, allo stesso modo delle tecnologie sanitarie in generale. Tuttavia, Beutels [2], Brisson ed Edmunds [3] hanno evidenziato le sfide metodologiche sollevate dalla valutazione dei vaccini che spesso non possono essere applicate ad altre tecnologie sanitarie, come l’importanza di considerare l’immunità di “comunità” (“herd immunity”).
Nonostante le difficoltà, le valutazioni economiche dei nuovi programmi di vaccinazione sono fondamentali nel fornire informazioni utili ai decisori politici responsabili della prevenzione delle malattie infettive.
I programmi di prevenzione dell’influenza comprendono programmi di vaccinazione con vaccini diversi progettati per la popolazione generale o per diversi sottogruppi di popolazione a rischio [4]. Tuttavia, una valutazione economica completa richiede un compromesso tra un’ampia gamma di risultati economici e sanitari e risultati non sanitari per tutte le possibili combinazioni di strategie di prevenzione di interesse [5]. Negli ultimi anni si è iniziato a utilizzare un modello computazionale detto di equilibrio economico generale (CGE), un metodo usato per includere la vasta gamma di impatti di un programma vaccinale contro l’influenza stagionale in cui l’impatto della malattia è ampio e concentrato in un periodo ben definito della stagione invernale, che si somma alle altre malattie respiratorie acute e sindromi simil influenzali che si verificano nello stesso periodo. Un esempio di tale modello è quello sviluppato da Smith et al. [6] per l’influenza pandemica nel 2011 e sono attualmente in fase di sviluppo modelli CGE per la malattia da SARS-CoV-2.
Un metodo più semplice per presentare una gamma più ampia di carico di malattia e non dei programmi di vaccinazione è l’uso di un “inventario di impatto” come proposto dal Secondo Panel di “Cost-Effectiveness in Health and Medicine” nel 2016 [7]
Tuttavia, come viene descritto in un articolo di Standaert et al. [8] su come valutare il pieno valore economico dei vaccini, la valutazione economica dei programmi di vaccinazione si è evoluta negli ultimi 50 anni. Inizialmente un’analisi costi-benefici tipicamente utilizzata per i programmi vaccinali finanziati con fondi pubblici è stata utilizzata per i programmi di vaccinazione integrati da analisi di ottimizzazione vincolata (CO) per determinare la strategia di vaccinazione più efficiente. Nel tempo, i contesti decisionali e gli obiettivi politici per i diversi finanziatori dei programmi di vaccinazione sono cambiati. La Task Force ISPOR per la valutazione economica dei vaccini [9] ha presentato le linee guida per l’esecuzione di 3 tipi di valutazioni economiche dei programmi di vaccinazione che possono essere utili in questi diversi contesti decisionali per i decisori con diversi obiettivi politici:
analisi costo-efficacia (CEA), per stimare un rapporto costo-efficacia incrementale e confrontandolo con un valore soglia che potrebbe rappresentare il costo/opportunità associato a un budget fisso o alla disponibilità della società a pagare per la salute aggiuntiva che si otterrebbe;
il modello sanitario fiscale (FHM), per presentare stime dell’impatto del programma di vaccinazione ai decisori (ad es. Ministero dell’Economia) utilizzando misure a loro familiari, come il ritorno sull’investimento o il valore attuale netto;
CO, per presentare il mix ottimale di tutti gli interventi sulla malattia soggetti a vincoli, come vincoli di budget o di fattibilità.
Il CEA calcola convenzionalmente il rapporto costo-efficacia incrementale (ICER) che valuta se il pagamento extra per il beneficio sanitario aggiuntivo ottenuto con il nuovo intervento ha un buon rapporto qualità-prezzo, principalmente dal punto di vista del contribuente sanitario. Ciò si esprime attraverso un valore di soglia massimo che idealmente non dovrebbe essere superato. Il denaro extra dovrebbe provenire da attività di valore inferiore spostate all’interno del budget sanitario definito, se possibile [10] con l’obiettivo finale di migliorare l’efficienza del Sistema Sanitario.
Come accennato sopra queste valutazioni svolgono un ruolo fondamentale nell’allocare le scarse risorse sanitarie [11] e la scelta di un modello appropriato è cruciale per arrivare a risultati validi di costo-efficacia che possano rappresentare al meglio il valore aggiunto, anche economico, di un programma vaccinale sulla popolazione generale [12, 13]. Alla base dei modelli sopra descritti ci sono dati relativi all’impatto (ad es. incidenza della malattia, probabilità di complicanze, rischio di ospedalizzazione o accesso alle cure primarie, esiti permanenti e non della malattia, decesso) della malattia prevenibile da vaccino in una popolazione specifica (ad es per fascia di età o condizione di rischio) usando il vaccino che si vuole valutare rispetto a nessun intervento o alla presenza di un programma vaccinale pre-esistente.
Per generare queste stime i modelli più utilizzati sono, a oggi, i modelli ad albero decisionale e i modelli di Markov [14-16] che assumono che la probabilità di esposizione alla malattia non sia influenzata da un intervento contro di essa, e quindi la probabilità di esposizione alla malattia non cambi nel tempo. Questa presunta probabilità costante di esposizione è realistica per malattie non trasmissibili e può essere stimata con i cosiddetti modelli statici. L’approccio più semplice per valutare il rapporto costo-efficacia della vaccinazione antinfluenzale consiste nell’applicare un modello di “albero decisionale”. In questi modelli ogni percorso attraverso l’ ”albero” rappresenta una sequenza di eventi, e sono associati costi e conseguenze [17]. Gli alberi decisionali vengono spesso utilizzati quando i costi e le conseguenze di un intervento si verificano in un breve periodo di tempo, come nel caso della vaccinazione antinfluenzale. Questo perché i modelli dell’albero decisionale non possono tenere conto esplicitamente del tempo. Tuttavia, ciò potrebbe non essere essenziale nei modelli influenzali poiché l’impatto delle conseguenze a lungo termine della mortalità può essere incorporato attraverso un pay-off scontato collegato a endpoint specifici, ove necessario. Tuttavia, ci sono alcune situazioni in cui potrebbe essere necessario tenere conto del tempo in modo esplicito modellando le variazioni inter-anno dei costi o delle conseguenze. Ad esempio, nel caso di programmi di vaccinazione rivolti a bambini al di sotto dei 9 anni di età, possono essere necessarie due dosi di vaccinazione antinfluenzale per i bambini non vaccinati che potrebbero richiedere solo una dose negli anni successivi [18].
Nella maggior parte dei casi, i modelli “Markov” di transizione dello stato con una forza di infezione statica (fissa) indipendentemente dalla proporzione della popolazione infettiva, hanno vantaggi limitati rispetto ai modelli ad albero decisionale nel contesto delle valutazioni dell’influenza. Questo tipo di modello di transizione dello stato consente, infatti, di specificare le probabilità di transizione dipendenti dal tempo o dall’età ed è quindi spesso appropriato quando i costi e le conseguenze si verificano su un periodo esteso (ad es. come nelle malattie croniche) [18]. Tuttavia, la durata della protezione del vaccino antinfluenzale è generalmente modellata con una durata di una singola stagione a causa dei cambiamenti di ceppo che si verificano di stagione in stagione e dell’efficacia sul campo del vaccino antinfluenzale che non sembra superare i 6 mesi [19]. Inoltre, le conseguenze dell’infezione influenzale (a eccezione della mortalità) sono generalmente di breve durata e durano solo per un certo numero di giorni o settimane. Un vantaggio dei modelli di transizione di stato con cicli brevi (ad es. settimane) è che possono essere utilizzati per esplorare opzioni per la tempistica della vaccinazione, in cui l’adozione della vaccinazione può essere modellata come un processo graduale nell’arco di diversi mesi.
Per le malattie infettive trasmissibili l’indipendenza tra l’esposizione alla malattia e gli interventi non è realistica ed è necessaria un’altra classe di modelli. Gli interventi contro le malattie trasmissibili non solo riducono la probabilità che l’individuo trattato sviluppi la malattia, ma riducono anche l’esposizione dell’infezione agli altri. Sono quindi preferibili modelli che tengano conto di questi effetti di trasmissione non lineare nel tempo come sono i modelli dinamici. La non linearità sorge perché la probabilità di infezione nei suscettibili dipende dal numero di individui infetti. Il modello dinamico più noto per la diffusione dell’infezione è il modello SEIR (Susceptible-Exposed-Infectious-Removed) [20, 21].
I modelli di trasmissione dinamica sono in grado di incorporare la protezione della “comunità” nelle valutazioni economiche facendo variare il rischio (forza) di infezione (essendo dinamico anziché statico) sulla base della proporzione della popolazione che è infettiva nel tempo [22, 23]. Questi modelli sono sempre più applicati nelle valutazioni economiche della vaccinazione antinfluenzale [24-28]. Tuttavia, i modelli dinamici sono spesso più complessi, dispendiosi in termini di tempo e costosi da produrre rispetto ai modelli statici e necessitano di dati aggiuntivi [22] (ad es. informazioni sulle matrici di contatto tra individui). In breve, i modelli SEIR, mimano una popolazione reale dove gli individui si spostano dai compartimenti suscettibili a quelli esposti in base alla forza dell’infezione, che è una funzione dei tassi di contatti effettivi tra individui suscettibili e non suscettibili nella popolazione. Il contatto efficace è una funzione della matrice di contatto specifica per età e della trasmissibilità del virus per contatto. Il tempo trascorso nei compartimenti esposti e infetti è una funzione della durata dei periodi latenti e infettivi associati all’influenza. Ciascuno dei compartimenti è stratificato in gruppi di età (da 15 a 80 a seconda del metodo utilizzato) e per rischio di complicanze da infezione (basso o a rischio). Ogni stagione influenzale viene trattata in modo indipendente, così come le infezioni da influenza causate dai virus influenzali A e B. Gli input del modello per la trasmissibilità, la suscettibilità e la percentuale di casi infetti con sintomi clinici sono derivati solitamente attraverso un processo di calibrazione che produce una stagione influenzale media A e una stagione media in cui l’influenza A e B co-circolano utilizzando dati provenienti dai Sistemi di Sorveglianza nazionali e regionali (InfluNet; InfluVir e Flunews).
Recentemente l’Organizzazione Mondiale della Sanità (OMS) ha pubblicato delle Linee Guida per la standardizzazione delle valutazioni economiche dei programmi di immunizzazione inserendo i modelli dinamici a pieno titolo fra le opzioni disponibili e fornendo un diagramma decisionale informativo che può essere utilizzato per aiutare a decidere quale tipo di modello può essere più appropriato applicato nelle diverse circostanze fornendo informazioni sulla validazione e interpretazione del modello [29].
Molti paesi hanno migliorato la loro organizzazione dei programmi di immunizzazione istituendo NITAG e comitati consultivi indipendenti come proposto dall’OMS. Tali organizzazioni locali devono disporre di dati adeguati in modo che possano prendere in considerazione e formulare valide raccomandazioni. Presentare i dati sulle malattie infettive con l’impatto della vaccinazione li aiuta a giudicare le loro decisioni e raccomandazioni, ed è importante fornire un quadro generale da diverse angolazioni. La disponibilità di diversi metodi di valutazione offre una gamma più ampia di informazioni per valutare il valore dei vaccini in modo più accurato. Aiuta a ottenere un quadro più equilibrato dell’impatto della malattia e dell’effetto della prevenzione a diversi livelli della società. Ad esempio, se un nuovo vaccino è considerato conveniente ma richiede un investimento netto che non è disponibile, l’identificazione di potenziali fonti di bilancio alternative (come maggiori entrate fiscali dovute alla migliore produttività di una popolazione più sana) sarebbe un’informazione utile. Allo stesso modo, un alto costo sanitario potrebbe essere compensato da una riduzione dell’assenteismo al lavoro con conseguente aumento del benessere sociale. A questo proposito è fondamentale arricchire il curriculum formativo dei nuovi economisti sanitari con questi nuovi approcci che necessitano di stretta collaborazione e lavoro multidisciplinare tra le diverse categorie coinvolte come medici specialisti, esperti di sanità pubblica, modellisti e decisori politici [8].
Oggigiorno, la sfida più grande per i policy maker dei sistemi sanitari è rappresentata dalla necessità di mantenere la sostenibilità del sistema e allo stesso tempo garantire ai pazienti l’accesso all’innovazione. Il concetto di “valore”, dunque, deve essere basato da un lato sull’impatto economico delle nuove tecnologie sanitarie e dall’altro sui benefici clinici che ne derivano cercando di caratterizzare l’incertezza degli esiti tramite delle analisi di sensibilità. Recenti studi hanno dimostrato che i decisori sono inclini a considerare il concetto di “valore” in modo molto ampio e diverso, il che comporta considerare varie combinazioni di aspetti clinici, economici, politici, sociali, e considerazioni etiche; combinazioni coerenti con l’approccio dell’Health Technology Assessment (HTA) [1]. Nel caso della vaccinazione o delle campagne vaccinali in generale, i medici, i ricercatori della sanità pubblica e gli economisti sanitari hanno dimostrato la rilevanza di una definizione più ampia di “valore” che mira ad acquisire i molteplici aspetti e i benefici generati dagli interventi in sanità pubblica [1, 2]. La maggior parte della letteratura di economia sanitaria mostra che i decisori che valutano il valore economico di un vaccino dovrebbero adottare una prospettiva sociale completa che comporta considerazioni che vanno al di là dei costi sanitari diretti (ad es. trattamenti, visite e ricoveri), e che comprendono, ad esempio, le perdite di produttività e i costi dell’assistenza informale in relazione al minor numero di giorni lavorativi persi generati da tali interventi [3]. Di fatto, le valutazioni economiche in ambito sanitario dovrebbero tener conto di una duplice prospettiva [4]: quella del Servizio Sanitario Nazionale (SSN), in cui vengono considerati esclusivamente i costi diretti, e quella sociale in cui i giorni di lavoro perso a causa della condizione oggetto dell’analisi vengono valorizzati economicamente. Tale approccio viene definito “human capital approach” [5]. Tuttavia, la perdita di produttività e i costi dell’assistenza informale sono raramente presi in considerazione [3]. Le ragioni principali sono probabilmente legate alla difficoltà di raccogliere dati sulle perdite di produttività, che differiscono in maniera eterogenea tra le categorie professionali. Inoltre, la maggior parte della letteratura non riesce a fornire le evidenze necessarie e per avere una stima puntuale della perdita di produttività spesso devono essere incorporate informazioni specifiche sulla giurisdizione e fare determinate assunzioni che possono minare la robustezza dell’analisi. Anche le linee guida sulle valutazioni economiche in sanità variano sostanzialmente tra paese e paese [3]. L’approccio al capitale umano, come sopramenzionato, è tra i più comuni metodi usati. La sua ipotesi di base è che l’individuo “produce” in proporzione equa al reddito ricevuto e che il salario dell’individuo riflette l’effettivo contributo del lavoratore all’attività produttiva. Questo approccio spesso presuppone che il mercato del lavoro sia caratterizzato da piena occupazione, e quindi, all’aumentare della produttività aumenteranno gli investimenti nella salute dei potenziali lavoratori e dunque la quantità di lavoro disponibile sul mercato [5]. Poiché l’attenzione è rivolta alla perdita di produttività dovuta all’assenza temporanea di un lavoratore malato, il periodo di riferimento si estende dall’occorrenza di un evento patologico alla pensione. Per ottenere una misura del reddito, si può fare riferimento a una stima campionaria dei pazienti o una classificazione dei salari per settore e categoria di attività, ottenuto da indagini nazionali (ISTAT). L’approccio al capitale umano può anche essere utilizzato per estendere la prospettiva sociale e considerare oltre gli effetti della perdita di produttività sugli individui, anche quelli sull’assicurazione sociale e i datori di lavoro [5]. A nostra conoscenza, tuttavia, nessuno studio, eccezion fatta per il framework di Ruggeri et al. 2019 [5], descrive l’uso di questo approccio per la stima dell’impatto fiscale nel contesto sanitario Italiano.
Definiamo, dunque, l’impatto fiscale di una malattia come la diminuzione del gettito fiscale derivante dalla riduzione dei redditi individuali dovuti alla condizione oggetto dell’analisi [5]. Le entrate fiscali sono in genere derivate dai redditi individuali, che aumentano con la produttività, e la produttività dipende fortemente dallo stato di salute delle persone. Pertanto, la sostenibilità dei servizi sanitari nazionali potrebbe dipendere dalla loro capacità di garantire alti livelli di produttività attraverso il mantenimento o il miglioramento della salute della popolazione generale [5].
La vaccinazione, come quella antinfluenzale ad esempio, contribuisce alla sostenibilità della spesa sanitaria pubblica grazie ai possibili risparmi generati in termini di riduzione di numero di ricoveri, spese per le cure mediche per la malattia e per le eventuali complicanze, assenteismo del personale nonché costi derivanti dalla perdita di produttività [6]. Ruggeri et al., hanno recentemente valutato l’impatto economico e fiscale dei vaccini contro l’influenza, lo pneumococco e l’Herpes-Zoster in Italia e nell’analisi condotta gli autori hanno riportato che investire nella vaccinazione antinfluenzale comporta benefici che equivalgono a 1,8 volte il valore dell’investimento in termini di impatto fiscale e 11,1 volte in termini di perdita di produttività [5]. Gli autori hanno sottolineato che, nel valutare il valore economico dei vaccini, i decisori dovrebbero adottare una prospettiva sociale completa che tenga anche conto dell’impatto fiscale della malattia infettiva prevenibile da vaccino. I metodi tradizionali, volti a stimare il costo della malattia da una prospettiva sociale, possono essere migliorati considerando anche l’impatto fiscale che spiega la diminuzione delle entrate fiscali dovute alla malattia. La potenziale riduzione dell’impatto fiscale associata alle strategie di immunizzazione dovrebbe, pertanto, essere inclusa nella valutazione degli effetti dei nuovi vaccini, aggiungendo questa nuova dimensione alla loro valorizzazione [5].
Recentemente, il nostro gruppo di lavoro ha finalizzato un progetto di ricerca sull’impatto economico e fiscale di un programma vaccinale contro l’influenza diretto ai professionisti sanitari. La nostra valutazione è in linea con il background del framework teorico di Ruggeri et al. [5], che ha precedentemente stimato l’impatto globale (diretto, indiretto e fiscale) di un programma vaccinale per i professionisti sanitari in Italia, insieme con altre vaccinazioni. Secondo questa prospettiva, i governi dovrebbero investire in nuove tecnologie sanitarie, come i vaccini, al fine di aumentare la salute della popolazione, migliorando così la crescita produttiva. L’aumento della produttività aumenta i redditi e quindi i consumi e le entrate fiscali, che a loro volta possono essere utilizzate per aumentare gli investimenti in salute [5]. Questo processo può essere semplificato con la seguente formula di causa-effetto:
 |
dove H rappresenta il numero di individui sani, y rappresenta produttività dei datori di lavoro, W rappresenta il reddito dei dipendenti, T rappresenta il gettito fiscale totale e G rappresenta la spesa pubblica per la salute [5].
Nella nostra analisi sono stati presi in considerazione solo dipendenti (operatori sanitari) a tempo indeterminato iscritti al regime di previdenza sociale pubblica in Italia. In questo caso, è stata stimata una riduzione delle perdite individuali di produttività dovute alla condizione influenzale e contestualmente l’importo totale del reddito soggetto a tassazione. Nel nostro modello è stato ipotizzato un incremento della copertura vaccinale tra gli operatori sanitari a partire da un valore del 30% di copertura, ipotizzando incrementi annuali del 10% L’obiettivo della simulazione era, quindi, stimare la riduzione dei costi indiretti derivanti dal minor numero di professionisti colpiti dall’influenza (espresso in giornate lavorative perse), e dall’aumento delle entrate fiscali che la riduzione delle giornate lavorative perse dovute ai sintomi influenzali era in grado di produrre (impatto fiscale). Dai risultati cumulativi della nostra analisi è emerso che, ipotizzando un incremento della copertura vaccinale tra gli operatori sanitari del 10% annuo su un orizzonte temporale di 5 anni, si otterrebbe un risparmio totale in termini di riduzione delle perdite di produttività espresse in giorni di lavoro perso per sindrome influenzale, pari a -€ 4.475.497,16. In termini di incremento delle entrate fiscali, il risultato cumulato ha stimato un valore di € 327.158,84.
Come si evince dall’analisi effettuata, un aumento della copertura vaccinale da un lato comporterebbe un aumento del gettito fiscale derivante dal minor numero di professionisti colpiti dal virus influenzale, e allo stesso tempo comporterebbe una riduzione dei costi indiretti (perdite di produttività) dovuti al fatto che i professionisti perdono in media meno giornate di lavoro.
Il modello non ha considerato i costi sanitari diretti legati all’acquisizione e alla somministrazione della vaccinazione antinfluenzale. Inoltre, nell’ambito della simulazione è stata ipotizzata un’efficacia del vaccino nella prevenzione dei casi di influenza pari al 100%. Tuttavia, alla luce dei risultati ottenuti, è possibile ritenere che un’estensione della campagna vaccinale tra gli operatori sanitari possa rappresentare una strategia di contenimento dei costi nell’ottica dell’efficienza allocativa delle risorse a disposizione del SSN. Questo perché è probabile che i costi sanitari diretti vengano compensati utilizzando una prospettiva più ampia. Riteniamo pertanto che il risparmio in termini di costi indiretti e i maggiori benefici derivanti dall’aumento delle entrate fiscali possano ampiamente compensare i costi di acquisto e somministrazione dei vaccini antinfluenzali tra la popolazione target della nostra simulazione.
Il framework economico convenzionale per la valutazione degli effetti delle condizioni subottimali di salute, così come dei trattamenti volti al loro miglioramento, è orientato prevalentemente all’indagine dei costi diretti dell’assistenza sanitaria. In questo modo, però, si corre il rischio di tralasciare alcuni effetti (diretti e indiretti) che ricadono sul settore pubblico che vanno al di là del sistema sanitario, anche quando i programmi sanitari sono, in definitiva, finanziati con risorse pubbliche. Se si guarda agli effetti della salute dalla prospettiva del decisore pubblico, è possibile quantificare in che misura lo stato subottimale di salute che grava su alcuni individui vada a impattare sull’intero settore pubblico non solo tramite il consumo di servizi sanitari, ma anche per via della spesa legata all’indennizzo della disabilità e alla predisposizione di servizi sociali, nonché la perdita di produttività degli individui in età lavorativa che impatta negativamente sul gettito fiscale in maniera più o meno mediata dalla propensione al consumo [5]. Le innovazioni tecnologiche in ambito sanitario, come i vaccini, hanno infatti implicazioni economiche che vanno ben al di là dell’impatto generato sulla spesa sanitaria (in senso positivo o negativo). L’impatto si amplia negli altri capitoli del bilancio dello stato (es. sistema previdenziale). In modo ancora più ampio l’innovazione può impattare sulla produzione della ricchezza da parte dei lavoratori e delle imprese (e sui costi) e questo, a sua volta, incide sul gettito fiscale. Le decisioni allocative nel sistema sanitario raramente sono supportate da una analisi che combini gli effetti sulla salute delle innovazioni e che tenga in considerazione tutte le conseguenze che questo porta nel sistema economico. La valutazione economica di ampi programmi di sanità pubblica o comunque di politiche sanitarie in grado di impattare sulla salute degli adulti in età lavorativa passa attraverso l’analisi del rapporto tra gli investimenti in salute e l’effetto delle conseguenti variazioni di morbilità e mortalità sui conti pubblici. In particolare, si tratta di determinare il ritorno sugli investimenti in termini di entrate fiscali future nette attualizzate, secondo la prospettiva del decisore pubblico e a seguito dell’implementazione di programmi sanitari di salute pubblica.
Nella nostra analisi, abbiamo dimostrato che aumentando la copertura vaccinale antinfluenzale tra gli operatori sanitari è possibile ottenere una riduzione delle perdite di produttività e un aumento delle entrate fiscali che potrebbero essere utilizzate per finanziare altri interventi sanitari come l’attuazione di strategie di immunizzazione contro l’influenza tra gli stessi operatori sanitari. Questi risultati sono fondamentali in vista della sostenibilità dei sistemi sanitari e di un’allocazione basata sul valore delle risorse sanitarie.
Inoltre, i nostri risultati sottolineano l’importanza di investire e utilizzare vaccini antinfluenzali più efficaci. Infatti solo utilizzando vaccini più efficaci è possibile ottenere un maggiore impatto della vaccinazione anche in termini di risparmio economico per il sistema sanitario e per la società.
Pertanto, risulta evidente che promuovere strategie di vaccinazione antinfluenzale tra gli operatori sanitari è una priorità da attuare per aumentare la copertura vaccinale in questa popolazione target, garantire benefici sanitari per gli stessi operatori sanitari e per i loro pazienti e contribuire alla sostenibilità dei sistemi sanitari attraverso un’allocazione di valore delle risorse sanitarie.
In conclusione, i decisori sanitari e i responsabili politici dovrebbero essere informati dei limiti delle valutazioni economiche classiche per valutare il valore dei vaccini. Le future valutazioni economiche dovrebbero prestare maggiore attenzione all’effetto della vaccinazione sulla prevenzione delle complicanze, sulla generazione di vantaggi per la salute degli operatori sanitari e sui benefici per la comunità al di là della protezione individuale [3]. Sono necessarie, quindi, linee guida per la valutazione economica del pieno valore delle vaccinazioni e le valutazioni economiche future dovranno essere condotte tenendo anche conto della prospettiva sociale oltre che di quella del sistema sanitario, al fine di sottolineare e documentare il pieno valore dei vaccini [1]. Le valutazioni economiche dovrebbero considerare, inoltre, in che modo i costi e gli esiti sanitari associati alla vaccinazione, contribuiscano a obiettivi più ampi di equità sociale e garanzia di un guadagno in salute per l’intera popolazione [3].
Tra le tecnologie sanitarie, i vaccini rappresentano una delle più grandi conquiste dell’era contemporanea. L’innovazione tecnologica può comportare costi elevati e una forte pressione finanziaria sui sistemi sanitari. Tuttavia, i sistemi sanitari non possono rinunciare a questa innovazione, ma devono tenere conto del punto di vista di tutti gli stakeholder: ai cittadini e ai pazienti dovrebbe essere garantito un accesso rapido ed equo a tecnologie sanitarie più efficaci; gli sforzi di ricerca e sviluppo dovrebbero essere incoraggiati quando sono orientati alla produzione di tecnologie di alto valore; i decisori politici dovrebbero sostenere l’innovazione utilizzando strumenti basati sull’evidenza per la loro valutazione; e i sistemi sanitari dovrebbero promuovere l’innovazione tecnologica garantendone al contempo la sostenibilità [7].
Inoltre, alla luce degli importanti progressi scientifici degli ultimi anni e delle innumerevoli esigenze di salute della popolazione, sarà necessario puntare su una prevenzione valoriale ma anche personalizzata. In effetti, i principi della medicina personalizzata sono già stati applicati alla vaccinologia per comprendere bene le variazioni interindividuali nelle risposte immunitarie indotte dal vaccino e gli eventi avversi correlati al vaccino [8]. Le nuove conoscenze in questi ambiti aiuteranno anche a determinare il tipo o la dose “giusta” di vaccino per la persona “giusta”, e quindi anche questi aspetti dovranno essere inclusi nella valutazione di un valore più ampio dei vaccini.
L’influenza è una malattia respiratoria che può manifestarsi in forme di diversa gravità che, in alcuni casi, possono comportare anche gravi complicanze, come polmonite virale, polmonite batterica secondaria, soprattutto in alcune fasce di popolazione, non solo a rischio per patologie, ma anche per età, come a esempio i bambini piccoli sani.
A fronte delle suddette ripercussioni cliniche non bisogna assolutamente sottovalutare l’impatto di tale malattia infettiva anche sui costi per la gestione delle eventuali complicanze, cosi come su quelli sociali, quali a esempio: giorni lavorativi persi, perdita di produttività, ecc.
I virus influenzali che causano epidemie risultano essere prevalentemente di tipo A e B; quello di tipo C provoca solo casi sporadici e lievi nel bambino, motivo per cui non viene inserito negli specifici vaccini, mentre quello di tipo D colpisce principalmente i bovini e non è noto il suo ruolo in una eventuale infezione umana. Tali tipi di virus insieme ai loro specifici sottotipi (tipo A) o lignaggi (tipo B), con la loro circolazione stagionale, possono incidere annualmente sul numero dei ricoveri e dei decessi.
I virus influenzali di tipo A sono classificati in sottotipi in base alle combinazioni di due proteine di superficie: emoagglutinina (HA) e neuraminidasi (NA). Due sottotipi di HA (H1 e H3) e due sottotipi di NA (N1 e N2) sono riconosciuti tra i virus dell’influenza A come causa di malattia umana diffusa nel corso degli ultimi decenni. L’immunità verso le proteine HA e NA permette di ridurre la probabilità di infezione e, insieme all’immunità alle proteine virali interne, riduce la gravità della malattia in caso d’infezione.
I virus di tipo B non sono classificati in sottotipi, ma possono essere suddivisi in “lineaggio” e attualmente quelli maggiormente circolanti appartengono al lignaggio B/Yamagata o B/Victoria, la cui circolazione stagionale impatta in maniera diversificata sulla malattia influenzale.
L’incidenza annuale dell’influenza dipende dall’immunità sviluppata dai precedenti contatti (tramite infezione o vaccinazione) con il ceppo circolante o con ceppi correlati ed è particolarmente per l’assenza di questo tipo di “biblioteca immunologica” che i bambini potrebbero essere maggiormente esposti al rischio di contagio.
I virus influenzali si trasmettono prevalentemente per via aerea e si diffondono molto facilmente attraverso le goccioline di saliva che il malato produce tossendo, starnutendo o semplicemente parlando, soprattutto negli ambienti affollati e chiusi. La trasmissione avviene, particolarmente tra soggetti in comunità e in gruppi chiusi quali scuole e asili, ma anche per contatto diretto con persone infette (a esempio attraverso le mani contaminate sugli occhi, sul naso o sulla bocca) o attraverso utensili o oggetti, dato che il virus dell’influenza può persistere molto a lungo e penetrare nell’organismo attraverso le mucose.
I pazienti infetti risulterebbero essere contagiosi da uno o due giorni prima della comparsa dei sintomi, mentre la presenza dello stesso virus influenzale nelle loro secrezioni nasali, correlata con l’entità della febbre, cessa generalmente entro sette giorni dall’inizio della malattia, ma può anche persistere più a lungo nei bambini più piccoli e nei pazienti immunodepressi, rendendoli più contagiosi.
Durante l’epidemia influenzale i più colpiti risultano essere anche i bambini in età scolare, i quali, oltre ai classici sintomi influenzali, quali: insorgenza improvvisa di febbre alta, tosse, inappetenza etc., possono manifestare anche nausea, vomito e diarrea.
Nei climi temperati le epidemie stagionali si verificano principalmente durante l’inverno, mentre nelle regioni tropicali l’influenza può verificarsi durante tutto l’anno, causando focolai più irregolari [1].
A livello globale le stime delle epidemie annuali riportano circa un miliardo di casi di influenza, da circa 3 a 5 milioni di casi di malattia grave e circa 290.000-650.000 decessi, con tassi stimati di mortalità più elevati nell’Africa subsahariana (2,8-16,5 per 100.000 individui), nel sud-est asiatico (3,5-9,2 per 100.000 individui) e tra le persone di età pari o superiore a 75 anni (51,3-99,4 per 100.000 individui) [2].
Nei soggetti in età inferiore ai 18 anni l’influenza stagionale è responsabile di circa il 10% di tutti i ricoveri per malattie respiratorie; 6% di quelli <1 anno, 7% di quelli <5 anni e 16% in età compresa tra 5 e 17 anni [3].
Negli USA l’influenza e le sue complicanze sono responsabili di un aumento del 10-30% delle prescrizioni di antibiotici che, nonostante la possibilità di coinfezioni batteriche con numerosi patogeni, sono spesso usati impropriamente. Tra i batteri che aumentano il rischio di infezione delle basse vie aeree ed essere alla base di una complicanza dell’infezione influenzale, predominano lo Pneumococco e lo Stafilococco. Polmoniti comunitarie da stafilococco meticillino resistente, con rapida progressione ed elevata mortalità, sono state descritte in bambini sani e adulti con influenza. La frequenza di ricoveri e la morbosità da complicanze come bronchite e polmonite risultano essere in ogni caso superiori nei bambini con co-morbilità quali: emoglobinopatie, displasia broncopolmonare, asma, fibrosi cistica, tumori, diabete mellito, malattia cronica renale, cardiopatia congenita, immunodepressione, disturbi neurologici e dello sviluppo neurologico. Dati USA riportano che dal 40 al 50% di tutti i bambini ricoverati in ospedale con l’influenza non presentano co-morbilità e che quasi la metà dei bambini che muoiono per influenza non risulta essere nota una pregressa condizione patologica ad alto rischio. Negli stessi USA i casi annuali di decessi pediatrici per influenza sia tra i bambini con patologie croniche e sia per quelli senza apparenti fattori di rischio, varia solitamente tra i 35 e i 188 casi, con numeri più alti segnalati in alcune stagioni [4].
A livello globale più della metà dei circa 870.000 ricoveri di bambini correlati all’influenza si verificano in Africa e nel sud-est asiatico. In 92 paesi, tra i bambini di età inferiore ai 5 anni, si verificano ogni anno 9.243-105.690 decessi associati all’influenza [5]. Sebbene gli effetti delle epidemie di influenza stagionale nei Paesi in via di sviluppo non siano completamente noti, alcuni dati riportano che il 99% dei decessi nei bambini < 5 anni di età con infezioni delle basse vie respiratorie correlate all’influenza si trovino in tali territori [6]. I tassi annuali di ospedalizzazione pediatrica associata all’influenza risultano essere più di 3 volte superiori nei Paesi in via di sviluppo rispetto a quelli industrializzati (150/100.000 bambini contro 48/100.000) [7].
Dati su popolazione pediatrica, maggiormente in Paesi ad alto reddito, riportano nel 2017 un maggiore numero di casi di infezioni delle basse vie aeree (LRTI) nei bambini di età inferiore ai 10 anni, a fronte di una percentuale di mortalità maggiore nella fascia di età anziana [8].
La vaccinazione pediatrica, oltre a un buon profilo di sicurezza, fra i 2 e i 16 anni, ridurrebbe il rischio di influenza confermata e di sindrome simil-influenzale (ILI), rispettivamente del 11-30% e del 20-28% [9], cosi come contribuirebbe in maniera efficace a ridurre la trasmissione virale anche tra i gruppi di pazienti fragili. Un recente studio in Paesi ad alto-medio reddito rileva che il maggiore impatto sulla diffusione dei virus influenzali tra la popolazione risulterebbe essere raggiunto particolarmente con la vaccinazione dei bambini e in misura maggiore in quelli in età scolare [10].
Da non sottovalutare l’impiego delle misure “non farmacologiche”, riconosciute dalla OMS [11] quale intervento preventivo di prima scelta per il contrasto e il contenimento della diffusione del virus influenzale e che si sono rilevate molto efficaci nel prevenire anche la diffusione del virus pandemico SARS-CoV-2 [12]: lavaggio delle mani (in assenza di acqua l’uso di gel alcolici), buona igiene respiratoria (coprire bocca e naso quando si starnutisce o tossisce, trattare i fazzoletti e lavarsi le mani), isolamento volontario a casa delle persone con malattie respiratorie febbrili specie in fase iniziale; a tali misure di prevenzione si aggiunge anche il corretto uso delle mascherine che rappresentano una misura complementare per il contenimento della trasmissione del virus e non possono in alcun modo sostituire il distanziamento fisico, l’igiene delle mani e l’attenzione scrupolosa nel non toccare il viso, il naso, gli occhi e la bocca.
Grazie all’impiego delle suddette misure di prevenzione, il sistema di sorveglianza influenzale Europeo, nella sola stagione 2020-2021, a fronte di un numero di campioni testati da fonti sentinella e non sentinella che risultava essere sovrapponibile a quelli delle stagioni precedenti, ha rilevato una (positività di soli 10 su 21442 campioni sentinella e 158 su 577476 non sentinella) una sostanziale riduzione dei casi settimanali di influenza sovrapponibile ai periodi inter stagionali; inoltre, in tale stagione, non sono stati segnalati casi di ricovero ospedaliero, né decessi per influenza [13].
Nel nostro Paese, mediamente, le sindromi simil-influenzali colpiscono ogni anno il 9% della popolazione italiana, con un minimo del 4% osservato nella stagione 2005-06 e un massimo, del 15%, registrato nella stagione 2017-18. Si sottolinea che l’incidenza dell’influenza potrebbe essere sottostimata poiché la malattia può essere confusa con altre malattie virali e molte persone con sindrome simil-influenzale non cercano assistenza medica.
Nel mondo, per quanto attiene l’offerta vaccinale antinfluenzale nella fascia pediatrica, esistono diversi tipi di raccomandazioni. L’Organizzazione Mondiale della Sanità (OMS) raccomanda la vaccinazione stagionale a una serie di soggetti che risultano essere a grave rischio di contagio e/o complicanze influenzali; tra questi rientrano: bambini sotto i 5 anni di età, pazienti <18 anni in trattamento a lungo termine con aspirina o salicilati e pazienti affetti da patologie croniche: cardiache, asmatiche, polmonari, renali, epatiche, metaboliche, endocrine (es. diabete), neurologiche e dello sviluppo neurologico, ematologiche e immunosoppressive (es. HIV/AIDS) [7]. È possibile garantire anche ai neonati di essere protetti contro l’influenza attraverso un’adeguata immunità acquisita passivamente dalla madre per i primi 6-9 mesi di vita [14].
Negli USA tutta la popolazione, senza specifiche controindicazioni, a partire dai sei mesi di vita, deve essere vaccinata annualmente contro l’influenza, preferibilmente entro la fine di ottobre o in base alle annuali raccomandazioni dell’Advisory Committee on Immunization Practices (ACIP) (https://www.cdc.gov/flu/). Data l’imprevedibilità della circolazione dei virus influenzali viene raccomandato di continuare a offrire il vaccino fino alla data di scadenza dello stesso (in genere il 30 Giugno data che segna la fine della stagione influenzale).
La vaccinazione antinfluenzale viene consigliata annualmente, in quanto non solo l’immunità specifica potrebbe diminuire nei mesi successivi, ma anche perché nel corso degli anni bisogna modificare la composizione antigenica dello stesso vaccino in rapporto alle mutazioni dei ceppi circolanti nella specifica stagione.
In caso di scarsa disponibilità delle dosi di vaccino antinfluenzale, tra le categorie che bisogna considerare prioritarie rientrano anche: tutti i bambini tra i 6 e i 59 mesi, cosi come i bambini con patologie: polmonari croniche (incluso l’asma), cardiovascolari (esclusa l’ipertensione isolata), renali, epatiche, neurologiche, ematologiche o metaboliche (incluso il diabete mellito), cosi come bambini e adolescenti (di età compresa tra 6 mesi e 18 anni) che stanno assumendo farmaci contenenti aspirina o salicilato e che potrebbero essere a rischio di contrarre la sindrome di Reye dopo l’infezione da virus dell’influenza [15].
In Italia anche se i dati attualmente indicano che i bambini, in particolare quelli di età inferiore ai 5 anni vengono considerati quale gruppo prioritario per l’offerta della vaccinazione antinfluenzale, in quanto viene attribuita a tale fascia di età, in particolare quelli di età compresa tra i 6 mesi e i due anni, un implicito rischio di sviluppare forme gravi di influenza.
In merito al modello organizzativo, inerente all’offerta vaccinale antinfluenzale sul territorio italiano, la stessa vaccinazione viene offerta attivamente e gratuitamente ai soggetti che per le loro condizioni personali corrono un maggior rischio di complicanze nel caso dovessero contrarre l’influenza.
Premesso che allo stato attuale esistono, sul territorio nazionale, più Regioni che offrono gratuitamente, su richiesta, la vaccinazione antinfluenzale ai bambini e agli adolescenti sani a partire dai 6 mesi di età, in collaborazione con i medici di medicina generale (MMG) e i pediatri di libera scelta (PLS), il Ministero della Salute, considerata la permanenza di una situazione pandemica COVID-19, rappresenta l’opportunità di raccomandare la vaccinazione antinfluenzale nella fascia di età 6 mesi-6 anni, sia per proteggere questa fascia di età a rischio maggiore di ospedalizzazione e/o forme gravi e/o decesso, sia al fine di ridurre la circolazione del virus influenzale fra gli adulti e gli anziani.
Come riportato anche nell’ultima Edizione del “Calendario per la vita” [16], sebbene per il SSN il carico della malattia influenzale risulti essere essenzialmente legato ai casi che si verificano in età avanzata, esistono numerosi fattori finalizzati a considerare l’età pediatrica, come target la fascia di popolazione di interesse per la vaccinazione contro l’influenza e in particolare considerando che:
il bambino da 0 a 4 anni si ammala d’influenza circa 10 volte più di frequente dell’anziano e circa 5 volte più dell’adulto;
il bambino da 5 a 14 anni si ammala d’influenza circa 8 volte più di frequente dell’anziano e circa 4 volte più dell’adulto;
i bambini rappresentano i principali soggetti responsabili della trasmissione dell’influenza nella popolazione;
l’ospedalizzazione per influenza del bambino sotto i 2 anni avviene con le stesse proporzioni del paziente anziano;
la vaccinazione in età scolare in Giappone ha ridotto la extra-mortalità dell’anziano per cause respiratorie durante la stagione influenzale;
la vaccinazione in età scolare con vaccino influenzale vivo attenuato (LAIV) nel Regno Unito ha determinato una riduzione significativa di visite mediche e chiamate fuori orario di servizio per influenza/ILI, in tutte le fasce d’età, dall’avvio del programma.
Sebbene la vaccinazione pediatrica è una delle strategie più efficaci per ridurre il carico sanitario ed economico dell’influenza a livello di popolazione [17], nel corso degli anni i livelli di copertura vaccinale pediatrica risultano essere costantemente bassi.
Questo è un dato rilevante in quanto le coperture vaccinali rappresentano l’indicatore per eccellenza delle strategie vaccinali poiché forniscono informazioni in merito alla loro reale implementazione sul territorio e sull’efficienza dello stesso sistema vaccinale. Per ridurre significativamente morbosità, complicanze e mortalità per influenza, è necessario raggiungere coperture vaccinali elevate, soprattutto nei gruppi di popolazione bersaglio come gli anziani >65 anni e i soggetti ad alto rischio di tutte le età, compresa quella pediatrica, nella quale la vaccinazione contro l’influenza è diventata ancora più importante durante la pandemia SARS-CoV-2 [18] sia perché i sintomi influenzali risultano essere sovrapponibili a quelli del COVID-19, per cui risulterebbe difficile una diagnosi differenziale su base sintomatologica, sia per scongiurare eventuali co-infezioni dei due virus che potrebbero essere correlate a peggiori esiti, cosi come a un rischio, più che raddoppiato, di mortalità rispetto pazienti affetti da solo COVID-19 [19].
Per i suddetti motivi la stessa OMS raccomanda di riconsiderare la priorità dei gruppi (inclusi i bambini <5 anni) a rischio per la vaccinazione antinfluenzale durante la pandemia COVID-19, al fine di assicurare un controllo ottimale dell’influenza tra i gruppi ad alto rischio di forme gravi di malattia COVID-19 e di influenza (il ricovero in strutture sanitarie potrebbe aumentare il rischio di esposizione a SARS-CoV-2 e il successivo sviluppo di forme gravi di COVID-19), cosi come quello di diminuire gli accessi al Pronto Soccorso e i ricoveri per influenza [20].
In merito alla copertura vaccinale antinfluenzale nella popolazione pediatrica italiana un recente studio [21] ha valutato l’andamento della copertura vaccinale antinfluenzale, nazionale e regionale, nella popolazione pediatrica a partire dalla stagione 2010/11 a quella 2020/21, correlandola con le specifiche incidenze delle malattie simil-influenzali (ILI).
Da tale studio emerge che nel periodo 2010/11-2019/20 il livello di copertura vaccinale antinfluenzale più alto è stato del 4,5% nella fascia di età 2-4 anni (stagione 2010/11) e 5-8 anni (stagione 2011/12), mentre il livello di copertura vaccinale più basso, pari all’1,1%, appartiene a il gruppo < 2 anni (stagione 2015/16). Questi dati sono espressione del fallimento delle campagne vaccinali per l’influenza in Italia in età pediatrica.
Nella stagione 2020/21 tutte le fasce d’età hanno riportato un aumento sostanziale delle coperture vaccinali rispetto alla stagione precedente. Il valore più alto, pari a 19,0% è stato riportato nel gruppo di età 2-4 anni, seguito dal 13,1% del gruppo 5 anni e 9,2% del gruppo < 2 anni. Considerando i tassi sul totale delle ILI annuali, lo studio riporta una percentuale di casi maggiore nella stagione 2011/12 per la fascia di età 0-4 anni pari al 18,5%, mentre per la fascia di età 5-14 anni la percentuale più alta, pari al 27,7% è stata registrata nella stagione 2010/11.
Questi bassissimi livelli di copertura vaccinale antinfluenzale nella popolazione pediatrica, dimostrano chiaramente la scarsa conoscenza delle famiglie del valore della prevenzione vaccinale contro l’influenza, rispetto alle ben note evidenze scientifiche dalle quali si evince chiaramente che i benefici dell’intervento vaccinale risultano essere nettamente superiori ai rischi della stessa malattia, senza sottovalutare un valore aggiunto derivante dal miglioramento della stessa qualità della vita dei bambini e delle loro famiglie, alla riduzione dei costi sociali in termini di accesso al Pronto Soccorso, ricoveri e visite ambulatoriali, assenteismo lavorativo dei genitori e scolastico dei bambini.
La Società Italiana di Pediatria raccomanda la somministrazione del vaccino antinfluenzale nella fascia pediatrica in occasione delle visite presso il proprio Pediatra di libera scelta e/o presso il Centro di riferimento per la cura delle patologie croniche; raccomanda inoltre la messa in atto di tutte le opportune strategie finalizzate a rendere il più possibile agevole l’accesso ai vaccini, quali ad esempio: avvisi periodici (email, canali social, scuola, etc.) alle famiglie circa la disponibilità degli stessi vaccini, centri vaccinali che possono estendere i loro orari di apertura per la vaccinazione stagionale, vaccinazioni nelle scuole, attraverso delle specifiche campagne di sensibilizzazione all’interno delle stesse.
In particolare, la Società Italiana di Pediatria, al fine di favorire il contrasto e il contenimento della diffusione dei virus influenzali, sostiene qualunque strategia di Sanità Pubblica, finalizzata a proteggere “direttamente” o “indirettamente” in primis i pazienti “fragili”. La protezione diretta deve prevedere annualmente l’obiettivo del raggiungimento e mantenimento di alti livelli di copertura vaccinale antinfluenzale, attraverso la messa in atto di specifici piani d’azione e di politiche finalizzate a garantire un’offerta attiva a tutti i pazienti che risultano essere esposti a maggiori probabilità di sviluppare gravi complicanze post infettive. A fronte di una protezione diretta, la Società Italiana di Pediatria sostiene tutte le strategie finalizzate a garantire ai pazienti fragili anche una protezione “indiretta” caratterizzata dalla immunizzazione di coloro con i quali i bambini stanno a stretto contatto, come ad esempio i familiari e il personale del SSN che ha in cura lo stesso paziente. Con tale tipo di protezione è possibile proteggere indirettamente anche i soggetti che, per rarissimi, motivi non possono beneficiare della protezione indotta dal vaccino antinfluenzale, quali a esempio i soggetti con una storia anamnestica di pregressa reazione anafilattica alla somministrazione dello stesso vaccino (non si conoscono casi documentati da decenni) e nei lattanti <6 mesi di età per i quali il vaccino antinfluenzale non è indicato.
La Società Italiana di Pediatria, in linea con le esperienze di alcuni Paesi dell’UE/SEE, tra cui Austria, Finlandia, Lettonia, Slovacchia, incluso il Regno Unito e in linea con quanto riportato nel “Calendario per la vita” [16], oltre alle esperienze di alcune Regioni Italiane che già offrono gratuitamente, su richiesta, la vaccinazione antinfluenzale ai bambini e agli adolescenti sani a partire dai 6 mesi di età, ritiene opportuno di mettere in atto i vari modelli organizzativi sul territorio finalizzati a garantire in maniera capillare, a tali fasce di età, un’adeguata protezione sia nei confronti dello stesso contagio, sia nei confronti di eventuali gravi complicanze post infettive da influenza.
La Società Italiana di Pediatria, attraverso campagne di sensibilizzazione verso le Famiglie (continuo aggiornamento sito societario, utilizzo dei propri canali social Facebook, Twitter, Instagram, etc.) e verso il personale del SSN (#IoMiVaccino, Io mi vaccino! Tu ti vaccini? etc.) è particolarmente attiva nel sostenere il messaggio della riduzione globale della stessa influenza, con la promozione della vaccinazione particolarmente nei bambini che frequentano gli asili nido e quelli in età scolare, in maniera tale da impedire non solo la circolazione dei virus influenzali in queste specifiche realtà, ma soprattutto per ridurre la trasmissione complessiva dell’influenza e proteggere indirettamente i pazienti fragili.
Al fine di garantire la migliore protezione della popolazione pediatrica contro l’influenza, la Società Italiana di Pediatria si rende parte attiva nell’individuare e integrare modelli organizzativi per l’offerta vaccinale su tutto il territorio nazionale al fine di consentire a ogni Regione, a cui è stata assegnata dalla nostra Costituzione la responsabilità per l’organizzazione dei Servizi Sanitari, di adattare gli specifici modelli proposti alle realtà e necessità locali, come a esempio l’esperienza di immunizzazione attuata in ambito scolastico, in alcune realtà locali, messa in atto con eccellenti risultati (regione Puglia), potrebbe essere esportata in altre realtà Regionali.
Partendo da quella che possiamo definire la filosofia della professione, appare evidente che, nell’ambito della prevenzione vaccinale, il Medico di Medicina Generale (MMG), garante clinico delle cure primarie dei cittadini nel Servizio Sanitario Nazionale (SSN), ha un ruolo in cui le conoscenze e le competenze cliniche e manageriali, maturate nello specifico percorso formativo post laurea, sono esplicate nell’ambito del consolidato rapporto di fiducia con l’assistito, grazie alla conoscenza dei bisogni di salute e socioassistenziali del singolo paziente e della specifica popolazione di riferimento [1].
La necessità di prevenire anche nell’adulto patologie infettive la cui ricorrenza e rilevanza ha significative ripercussioni sulla salute dei singoli e della comunità, ha valorizzato, nel tempo, il ruolo del Medico di Famiglia nella gestione complessiva della strategia vaccinale e, da semplice esecutore della vaccinazione, si è affermato come referente della prevenzione vaccinale per i propri assistiti, con modelli organizzativi specifici per la gestione dell’attività vaccinale nel suo complesso: dal counseling personalizzato alla programmazione delle campagne vaccinali, dalla selezione e chiamata alle sedute vaccinali in sicurezza.
La conoscenza del paziente, della storia clinica, dello stato vaccinale, della stratificazione del rischio, unitamente al suo contesto sociale e assistenziale (l’inserimento in un nucleo familiare o in una struttura residenziale o l’eventuale stato di abbandono), consolidano la capacità del MMG di individuare per ciascun soggetto un piano di prevenzione personalizzato, che porti alla proposta delle vaccinazioni più appropriate.
Grazie alla triade virtuosa che la caratterizza -rapporto di fiducia, prossimità, domiciliarità- la Medicina Generale è in grado di assicurare in modo stabile e omogeneo su tutto il territorio italiano una offerta vaccinale equa e facilmente accessibile grazie alla presenza capillare degli studi di medicina generale, presenti, in media nella misura di uno ogni 5 km2.
L’approccio personalizzato del medico di famiglia, dovuto alla conoscenza e alla prossimità, consente di attuare una “prevenzione di precisione” conformata ai bisogni del singolo paziente, adeguata nel tempo, al mutare della sua condizione clinico assistenziale (gravidanza, insorgenza di patologie croniche, fragilità, senilità etc.), riuscendo a portare anche al domicilio dei pazienti fragili o anziani attività legate alla prevenzione oltre che al trattamento delle patologie croniche e/o intercorrenti.
Gli elementi propri dell’assetto organizzativo e operativo che la Medicina Generale può mettere a disposizione della prevenzione vaccinale in tutta Italia sono:
capillare presenza sul territorio: 43.000 MMG e almeno 60.000 studi medici;
prossimità ai luoghi di vita del paziente;
accesso rapido e gratuito alle cure;
gestione clinica e assistenziale di tutte le fasce di età della nostra popolazione di assistiti;
costanti e continue possibilità di contatto, attraverso sia un’attività ambulatoriale estesa per un lungo arco di ore nel corso della giornata, sia con attività domiciliare programmata, che consente di portare atti di prevenzione ai pazienti allettati;
capillare informatizzazione per una gestione efficiente e rapida dell’attività clinica attraverso programmi specifici e cartelle cliniche dematerializzate utilizzate dalla totalità dei MMG a cui si aggiungono sistemi informatizzati di analisi dei dati per la ricerca e il self audit, uso del cloud con capacità di aggiornamento della cartella clinica anche al domicilio del paziente. Considerato che la legge 119/2017 prevede l’istituzione di un’anagrafe vaccinale informatizzata, la dotazione informatica di cui ogni MMG già oggi si avvale, rappresenta un valore aggiunto alla prevenzione, purché adeguatamente utilizzata dalle Regioni di appartenenza, a cui spetta la gestione dei sistemi di raccolta dei dati;
presenza di forme associative territoriali avanzate, in aumento in tutte le Regioni, le quali consentono lo svolgimento di attività preventiva, clinica, diagnostica di primo livello, per 12 ore al giorno, con il supporto di personale di studio e infermieristico;
protocolli validati dalle associazioni scientifiche e professionali della Medicina Generale che hanno consentito, anche in epoca pandemica, di realizzare la programmazione, l’organizzazione, la gestione della campagna vaccinale in tutte le realtà della Medicina Generale: dallo studio del singolo medico, alle forme associative più avanzate, alle aggregazioni funzionali territoriali.
La partecipazione dei MMG alla campagna di vaccinazione antinfluenzale in Italia è storicamente codificata già dal 1978 grazie al primo atto negoziale della Medicina Generale definito in attuazione della legge istitutiva del SSN (L.883/78) che aveva previsto la collaborazione del MMG con il Dipartimento di Prevenzione. Il coinvolgimento dei MMG è stato confermato anche nelle successive leggi istitutive del SSN (D. Lgs 502/92 e s.m.i.), fino alla Legge 119/2017 che ha ulteriormente messo in risalto il ruolo del MMG nella prevenzione vaccinale, prevedendo in modo diretto il coinvolgimento dei MMG e Pediatri di Libera Scelta (PLS).
Parallelamente tale compito è stato ratificato in tutti gli Accordi Collettivi della Medicina Generale dal 1978 in avanti ma è stato svolto dai MMG con gradi diversi di coinvolgimento sulla base delle diverse scelte adottate dalle Regioni, nella cui responsabilità il cambiamento del Titolo V ha di fatto portato le linee di indirizzo organizzative della prevenzione vaccinale.
Tale responsabilità è ribadita anche nelle norme contrattuali della Medicina Generale: “Le Regioni sono impegnate a individuare il modello organizzativo necessario a garantire l’erogazione e la piena fruibilità delle vaccinazioni inserite nel calendario vaccinale e nell’ambito degli Accordi Collettivi Nazionali (AAIIRR) prevedono una attiva partecipazione dei medici di medicina generale nelle vaccinazioni e nelle relative attività collegate” [2].
La copertura vaccinale di una popolazione è funzione di diversi elementi, tra i quali rivestono un ruolo determinante:
le politiche finanziarie da cui derivano: la scelta di un modello organizzativo sostenibile sia in termini di risorse umane che economiche, le tipologie di vaccini offerte e la loro disponibilità in tempi e modi che facilitino l’azione degli attori;
l’organizzazione, ovvero la scelta e l’implementazione del modello organizzativo, il coinvolgimento e la formazione degli attori, la scelta dei setting, la filiera logistica che renda disponibili vaccini e DPI in tempi ottimali per lo svolgimento delle sedute vaccinali programmate nei diversi setting, la sorveglianza sanitaria di operatori e setting;
la diffusione della cultura di prevenzione che comporta da un lato attenzione ai meccanismi comunicativi finalizzati a favorire l’adesione della popolazione e il superamento dell’esitazione vaccinale e, dall’altro lato, a interventi volti a mantenere la motivazione degli attori, la formazione comune di tutte le figure coinvolte nelle campagne vaccinali a qualunque titolo e a tutti i livelli: dal management, ai medici, al personale sanitario non medico, al personale non sanitario tra cui, primi fra tutti, gli addetti degli uffici relazioni con il pubblico per garantire una uniformità di messaggi a sostegno della vaccinazione.
Attribuire però solo alla “vaccine hesitancy” il mancato raggiungimento delle coperture vaccinali per l’influenza, in assenza di una seria valutazione degli aspetti organizzativo/gestionali, sarebbe riduttivo.
Alla valutazione delle coperture raggiunte, unico indicatore oggi considerato, e solo per i pazienti anziani, nelle Schede tecniche degli indicatori del Nuovo sistema di garanzia per il monitoraggio dell’assistenza sanitaria (NSG) [3], andrebbe associata l’analisi sistematica e comparata dei modelli organizzativi applicati nelle diverse Regioni per individuarne gli elementi di valore da implementare in tutte le realtà e i fattori che rendono il sistema inefficiente e impediscono il raggiungimento degli obiettivi di copertura richiesti dal PNPV per la vaccinazione antinfluenzale.
Le normi vigenti, non prevedendo valutazione dei risultati né tempistiche attuative, consentono di fatto alle Regioni flessibilità nella definizione degli obiettivi di copertura della campagna stagionale e nella declinazione organizzativa degli stessi.
Ciò ha determinato una estrema variabilità di modelli organizzativi, che ha visto in passato un incostante coinvolgimento dei MMG da parte delle diverse Aziende Sanitarie anche all’interno della stessa Regione, e, conseguentemente, una disomogenea offerta, in termini di accessibilità e capillarità, di un LEA alla popolazione. Infatti, in alcuni contesti, il medico di famiglia non veniva coinvolto nella campagna vaccinale antinfluenzale, relegando il suo ruolo a quello di mero segnalatore di pazienti. In altre AASSLL, invece, il MMG è stato coinvolto costantemente nel processo, dalla definizione delle strategie e degli obiettivi alla realizzazione e gestione delle sedute vaccinali. Quest’ultima scelta sembra essere quella più efficiente, come testimoniano le coperture raggiunte nelle Regioni che hanno adottato tale modello o, più recentemente, le coperture [4], tornate ai livelli della stagione 2004-2005, della campagna di vaccinazione antinfluenzale della stagione 2020-2021 nella quale la massima parte delle vaccinazioni antinfluenzali degli adulti è stata svolta dai MMG, essendo i Dipartimenti di Prevenzione impegnati nella gestione dell’emergenza Covid 19. L’emergenza Covid 19 ha determinato l’esigenza di nuovi modelli erogativi e, a partire dalla successiva campagna 2021/2022, è stato previsto, prima in maniera provvisoria [5] e successivamente in via definitiva [6], il coinvolgimento delle farmacie nella campagna vaccinale antinfluenzale.
L’analisi dei dati di coperture raggiunte nella campagna 2021/2022 [7] mostra che, nonostante sia stata estesa anche alle farmacie la possibilità di somministrare la vaccinazione antinfluenzale, si è realizzata una riduzione del numero di dosi somministrate di circa 1,5 milioni. L’aumento dei setting in grado di offrire vaccinazioni, quindi, non solo non ha prodotto miglioramento delle coperture, ma addirittura non ha mantenuto stabile il valore raggiunto nella precedente campagna 2020/2021 [4].
La volontà del Legislatore di ampliare la platea degli attori nasceva dall’esigenza di determinare non una azione competitiva dei vari setting bensì un’attività integrativa e contributiva alla realizzazione di migliori obiettivi e percentuali di copertura.
Alla luce del calo registrato in questo primo anno di esperienza, sarebbe necessario attivare un monitoraggio da parte dei Dipartimenti di Prevenzione e Cure Primarie – ciascuno per le proprie competenze – che vada:
ad analizzare le motivazioni della diminuzione delle adesioni;
a verificare se i vaccinati siano soggetti naive o già fidelizzati e vaccinati precedentemente in altri setting;
a valutare efficacia ed efficienza delle innovazioni introdotte dalle nuove norme legislative, in termini di appropriatezza terapeutica, organizzativa e amministrativa.
La realizzazione della campagna della vaccinazione antinfluenzale prevede il coinvolgimento in maniera consequenziale di 3 diversi livelli decisionali e organizzativi – Ministero della Salute, Regione, Azienda Sanitaria territoriale – e un percorso che, per quanto riguarda il setting della Medicina Generale, può essere schematizzato come in Figura 1.
L’analisi del percorso evidenzia: la presenza di numerosi variabili organizzative/gestionali che condizionano direttamente o indirettamente la performance e, conseguentemente, le coperture raggiunte; l’esigenza di individuare indicatori di processo, oltre che di esito, per monitorare e correggere le criticità e i blocchi di sistema.
L’attivazione del percorso avviene con la pubblicazione annuale della Circolare del Ministero della Salute recante le raccomandazioni per la successiva stagione influenzale. Nella Tabella I sono descritte le tempistiche di emanazione negli ultimi anni.
È auspicabile anticipare ai primi mesi dell’anno la pubblicazione della Circolare Ministeriale in maniera tale da consentire il tempestivo avvio delle successive procedure, prime fra tutte le gare regionali per l’attribuzione delle forniture vaccinali. La filiera produttiva dei vaccini richiede tempi rigorosi e pertanto è cruciale, per l’efficienza del sistema distributivo, la tempistica delle gare indette per l’approvvigionamento delle dosi vaccinali dalle singole Regioni. Come hanno dimostrato esperienze recenti, il tardivo completamento delle procedure può mettere a rischio la tempestiva disponibilità dei vaccini, indispensabile per il puntuale inizio e svolgimento della campagna vaccinale.
La frammentarietà di tale attività, condotta in modo autonomo e non coordinato da parte delle singole Regioni, determina competitività non solo tra le diverse regioni italiane ma, soprattutto, tra ciascuna di esse e intere nazioni europee concorrenti all’acquisto delle dosi vaccinali. Andrebbero pertanto individuate anche per i vaccini antinfluenzali, analogamente a quanto avvenuto per i vaccini anti SARS-CoV-2, modalità di acquisto centralizzate a livello nazionale o, in alternativa, andrebbe prevista la possibilità di definire accordi/protocolli tra Regioni, finalizzati a permettere la cooperazione tra le stesse sia nelle fasi di acquisto/approvvigionamento sia di mutuo scambio nel caso di carenze o esuberi di dosi vaccinali determinando in tal modo prevedibili risparmi economici e limitando lo spreco di dosi vaccinali. In passate stagioni si è registrata in alcune realtà insufficienza di dosi rispetto alle richieste dei MMG mentre in altre rimaneva inutilizzato un elevato numero di dosi consegnate tardivamente.
Le caratteristiche generali dell’organizzazione dell’offerta vaccinale delle singole Regioni variano:
per la presenza e la composizione o l’assenza della Commissione Regionale Vaccini;
per l’adozione di un modello a conduzione centralizzata o di modelli parcellizzati aziendali o distrettuali;
per l’utilizzo di sistemi informatici digitali centralizzati tipo anagrafe vaccinale:
aperti a tutti gli operatori ove confluiscono quindi i dati di tutte le vaccinazioni somministrate dai diversi soggetti;
aperti solo ai Dipartimenti di Prevenzione, nei quali quindi è documentata solo l’attività da questi svolta;
per l’assenza di sistemi di informatizzazione e l’impiego di sistemi chiusi ancora relegati alla registrazione cartacea;
per la presenza o assenza di cooperazione applicativa della piattaforma/anagrafe regionale vaccini con i sistemi informatizzati e le piattaforme dei MMG.
In ogni Regione dovrebbe essere insediata una Commissione Regionale Vaccini, a funzione consultiva, la cui composizione però non prevede costantemente la presenza degli attori coinvolti, come il medico di famiglia. Inoltre, in alcune Regioni, la Commissione regionale vaccini non è ancora operativa.
La rilevazione dei bisogni viene effettuata nella maggior parte dei casi considerando il dato storico e mantenendone il tetto invariato nel tempo.
In alcune Regioni il medico di famiglia può indicare all’inizio della campagna vaccinale la quantità di vaccini necessari alla propria popolazione di pazienti; in altre, invece, può riceverne un numero massimo fissato dalle Aziende e spesso per anni invariato, non tenendo conto quindi che l’insorgenza di malattie croniche e l’invecchiamento della popolazione determina una costante variazione del numero di dosi necessarie.
In alcune Regioni, il Medico di famiglia, alcuni mesi prima o all’inizio della campagna, può indicare oltre alla quantità anche la tipologia dei vaccini necessari alla propria popolazione di assistiti, per classi di età, condizioni o patologie, in accordo con le Linee Guida indicate dal Ministero della Salute, in un’ottica di appropriatezza vaccinale.
In molti altri casi invece non è consentito al medico di scegliere quale vaccino somministrare ai propri pazienti o perché la Regione decide di acquistarne una sola tipologia o perché effettua a monte tale scelta, indicando in modo stringente l’impiego dei diversi tipi di vaccino, talora riservando l’uso di una tipologia di vaccino, non sulla base di condizioni cliniche o fascia di età, ma per altri fattori, ad esempio legandolo solo alla residenza in casa di riposo e non nel proprio domicilio, nonostante la presenza di caratteristiche cliniche assimilabili. Tali scelte potrebbero aprire la necessità di valutare l’equità o la disparità di accesso dei cittadini a un LEA e la variazione dell’incidenza della sindrome influenzale al variare delle indicazioni prescrittive delle diverse Regioni/AASSLL.
Le modalità e i tempi di consegna delle dosi vaccinali condizionano pesantemente la gestione della programmazione delle sedute vaccinali, l’aderenza dei pazienti (in modo particolare dei pazienti più giovani in attività lavorativa o dei caregiver), la possibilità di vaccinare in modo estemporaneo pazienti afferenti allo studio del medico di famiglia anche per motivi diversi dalla vaccinazione.
All’interno delle AASSLL due diversi Dipartimenti sono in genere coinvolti nella organizzazione della campagna, il Dipartimento di Prevenzione e il Dipartimento delle Cure Primarie, non vincolati però a obiettivi di risultato correlati alle coperture. Inoltre, la carenza di personale amministrativo e/o sanitario deputato a organizzare la distribuzione dei vaccini, spesso ha determinato nelle passate stagioni ritardi nelle consegne dei vaccini ai MMG, rispetto a quanto invece annunciato alla popolazione a mezzo stampa.
Questo determina per il MMG la difficoltà di programmare tempestivamente gli appuntamenti per la vaccinazione e, in molti casi, la necessità di annullare e spostare sedute vaccinali già programmate con rilevanti disagi dei pazienti o dei loro caregiver e determinando in tal modo un ulteriore ostacolo all’adesione alla vaccinazione.
Una soluzione alternativa adottata da alcune Regioni era l’affidamento della distribuzione dei vaccini alle Farmacie territoriali, determinando in tal modo ulteriore incremento dei costi della campagna vaccinale. Le nuove norme di Legge che affidano alle Farmacie anche la somministrazione dei vaccini antinfluenzali rendono questa strada più difficilmente percorribile per l’evidente conflitto di interessi che si realizzerebbe rispetto ai farmacisti che al contempo dovrebbero vaccinare e garantire la consegna dei vaccini ai MMG.
La necessità di superare questa criticità sta permettendo di individuare nuove modalità di distribuzione e consegna presso gli studi dei MMG dei vaccini antinfluenzali, portando alla scelta di nuovi sistemi di distribuzione quali gestori di delivery, Poste Italiane, (che appaiono vantaggiosi non solo rispetto alle tempistiche ma anche al contenimento dei costi legati alla logistica) o di strumenti innovativi come i droni sempre più frequentemente impiegati per consegnare, anche in situazioni di emergenza, apparecchiature, dispositivi e presidi sanitari e farmaci termosensibili.
La Regione Lazio ha in atto un protocollo con Enac per consentire ai droni la consegna di farmaci, plasma, organi e dispositivi medici e campioni biomedicali in caso di necessità. La Regione Piemonte affiderà nella prossima campagna vaccinale la distribuzione delle dosi vaccinali a una società partecipata da Poste Italiane anche al fine di evitare un conflitto di interessi rispetto ai farmacisti che al contempo dovrebbero vaccinare e garantire la consegna dei vaccini ai MMG.
La condivisione dei dati relativi allo stato vaccinale dei cittadini rappresenta un elemento chiave nel garantire l’efficienza delle campagne vaccinali.
Al momento attuale, lo scopo delle anagrafi regionali e nazionale appare finalizzato principalmente al monitoraggio delle campagne realizzate, ad aspetti amministrativi e di rendicontazione più che alla valutazione in tempo reale, ossia durante lo svolgimento della campagna vaccinale, dei bisogni di prevenzione del singolo cittadino e alla conoscenza da parte degli operatori dello stato vaccinale dei cittadini che afferiscono alla seduta vaccinale. La molteplicità dei setting vaccinali richiede che ogni attore sia messo nelle condizioni di poter visionare lo stato vaccinale degli utenti e al contempo di mettere a disposizione degli altri setting l’avvenuta vaccinazione, la tipologia di vaccino, eventuali note informative.
I MMG sono già dotati di strumenti informatici che, se collegati funzionalmente attraverso la cooperazione applicativa [7] alle piattaforme/Anagrafi Vaccinali, consentirebbero, oltre alla conoscenza e condivisione del dato sul singolo paziente, una programmazione delle campagne vaccinali in base ai bisogni specifici della popolazione di riferimento e agli obiettivi concordati fra Medicina Generale e Dipartimenti di Prevenzione.
Le indagini svolte dalle associazioni scientifiche di area sui bisogni formativi dei MMG sul tema della vaccinazione antinfluenzale e sugli strumenti utili a stimolare il miglioramento della performance e a incoraggiare l’attività preventiva svolta dal MMG, testimoniano la carenza di offerta formativa da parte delle Aziende e la costante assenza di un feedback degli obiettivi raggiunti dalla campagna vaccinale [1, 9].
È necessario il coinvolgimento dei MMG in fase sia di programmazione che di analisi delle campagne vaccinali e della prevenzione vaccinale in generale, in modo da realizzare la condivisione e il raggiungimento degli obiettivi stabiliti e la realizzazione di percorsi, se non formativi almeno in una prima fase informativi, che prevedano la condivisione delle informazioni sulla campagna vaccinale tra Medici di famiglia e specialisti delle discipline finalizzate alla presa in carico di patologie per cui è indicata la vaccinazione antinfluenzale anche prima dei 60 anni.
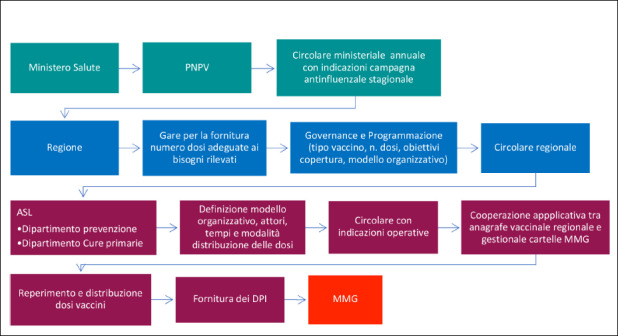
Livelli decisionali/organizzativi e percorso della campagna della vaccinazione antinfluenzale.
Tempistiche di emanazione della Circolare del Ministero della Salute sulle raccomandazioni per le stagioni influenzali dal 2016-2017 al 2022-2023.
| Stagione Campagna antinfluenzale | Data pubblicazione Circolare Ministeriale |
|---|---|
| 2016-2017 | 2 agosto 2016 |
| 2017-2018 | 31 luglio 2017 |
| 2018-2019 | 30 maggio 2018 |
| 2019-2020 | 1 agosto 2019 |
| 2020-2021 | 4 giugno 2020 |
| 2021-2022 | 8 aprile 2021 |
| 2022-2023 | 6 luglio 2022 |
L’influenza è un’infezione respiratoria acuta virale che si trasmette in modo efficiente per via aerea e colpisce le alte e basse vie respiratorie [1]. Solitamente è una malattia autolimitante a esito benigno, talvolta può rendersi responsabile di una serie di complicanze, in particolare nei soggetti in età avanzata e in quelli affetti da patologie croniche come il diabete, le malattie cardiovascolari e respiratorie croniche e le malattie immunitarie [2]. In tali soggetti la malattia influenzale determina un onere aggiuntivo dovuto a conseguenze più ampie che includono eventi cardiovascolari, esacerbazioni di condizioni croniche sottostanti, maggiore suscettibilità alle infezioni batteriche secondarie, tutti fattori che possono portare a un aumentato rischio di ospedalizzazione e morte [3]. Tra le principali complicanze correlate all’influenza, le infezioni batteriche secondarie, in particolare da Streptococcus pneumoniae, sono particolarmente legate a forme severe che possono richiedere il ricovero in terapia intensiva o esitare in decesso [4]. Si stima che nell’anziano e nel soggetto con condizioni a rischio la probabilità di sviluppare complicanze possa raggiungere valori del 60% [5].
Il Centro Europeo per il controllo delle Malattie (ECDC) riporta che, in media, circa 40.000 persone muoiano ogni anno in Europa per cause correlate all’influenza e il 90% dei decessi si verifichi in soggetti di età uguale o superiore ai 65 anni, specialmente quelli affetti da due o più malattie croniche [6]. In ragione dell’elevato numero di individui colpiti e del potenziale rischio di complicanze legate all’infezione l’epidemia di influenza stagionale rappresenta ogni anno una sfida per la Sanità Pubblica.
È noto come la popolazione anziana sia quella sulla quale si riflette il maggior burden di malattia legato all’infezione. Infatti, la metà circa delle forme gravi che necessita di ricovero in terapia intensiva riguarda i soggetti over 65enni. Va, inoltre, osservato che una percentuale variabile dal 77,7% al 96,1% dei decessi legati all’influenza riguardi proprio i soggetti over 65enni [7]. Il mezzo più efficace per combattere l’influenza ed evitare complicanze potenzialmente gravi è la prevenzione che prevede l’utilizzo di vaccini sicuri ed efficaci con un rapporto costo/beneficio e costo/efficacia comprovatamene favorevole [8].
In Italia dal 1999 è attiva la sorveglianza epidemiologica e virologica dell’influenza e delle sindromi simil-influenzali InfluNet in grado di monitorarne l’andamento durante l’epidemia stagionale. Inoltre, dalla stagione pandemica 2009/2010 è attivo anche il monitoraggio dell’andamento delle forme gravi e complicate di influenza stagionale, mirata a meglio comprenderne l’epidemiologia, anche in termini di possibili fattori di rischio e cambiamenti nel corso dell’epidemia [9].
La regione Liguria partecipa sia alla rete InfluNet, avvalendosi del contributo dei Medici di Medicina Generale (MMG) e Pediatri di Libera Scelta (PLS) (15 professionisti in totale), e dei laboratori di riferimento regionale per l’influenza sia alla sorveglianza delle forme severe di malattia, segnalando al Ministero della Salute e all’Istituto Superiore di Sanità i casi gravi e complicati di influenza confermata in laboratorio, ovvero tutte le forme gravi di infezione respiratoria acuta (SARI) e sindrome da distress respiratorio acuto (ARDS) ricoverate in Unità di Terapia Intensiva e/o che necessitano di Ossigenazione Extracorporea a Membrana (ECMO), in cui sia stata confermata in laboratorio la presenza di un tipo/sottotipo di virus influenzale.
La regione Liguria implementa la sorveglianza sindromica delle ILI e malattie respiratorie dell’area metropolitana genovese in grado di rilevare tempestivamente, attraverso l’analisi dei dati di accettazione dei Pronto Soccorso (PS), la presenza di cluster di sindromi simil-influenzali (ILI) e di infezioni delle basse vie respiratorie (LRTI) attraverso l’individuazione delle definizioni operative delle sindromi e delle parole chiave da ricercare nei campi “anamnesi”, “quadro clinico” e “diagnosi di dimissione/ricovero” del software per la gestione del paziente afferente al PS del Dipartimento Emergenza Accettazione-DEA con predisposizione e adeguamento degli strumenti informatici delle strutture di emergenza partecipanti al fine di rilevare le sindromi influenzali. Il sistema definisce indicatori di attività (media mobile dell’incidenza nei 5 giorni precedenti, corretta per giorno della settimana) per garantire elevate sensibilità e specificità e il sistema di feed-back informativo comprende sia report periodici sia segnalazione di “early warning”.
A livello regionale, secondo i dati della rete InfluNet nella stagione influenzale 2021/2022 l’andamento epidemiologico dalla 42 alla 17 settimana ha visto un’incidenza di ILI <3,16 per 1.000 assistiti, nelle settimane 47, 48, 51-4, 10-15 e 17 i valori osservati sono stati <9.37 per 1.000 assistiti. La stagione è stata caratterizzata da una bassa circolazione virale (tipo A/H3N2) e da un avvio ritardato, fine di febbraio (9 settimana) [9]. Occorre evidenziare che a livello globale, in Italia e in Liguria, durante le ultime due stagioni influenzali, 2020/2021 e 2021/2022, a causa della pandemia da COVID-19, è stata registrata una drastica riduzione dei casi di sindromi simil-influenzali (influenza-like-illness, ILI). Diversi i fattori che potrebbero aver determinato tale andamento epidemiologico come gli interventi non farmacologici (uso di mascherine, distanziamento sociale, incremento del lavaggio sociale delle mani, etc.), la riduzione degli spostamenti della popolazione (sia a livello locale/nazionale sia a lunga distanza) e possibili interazioni tra i due virus (interferenza virale) [10,11]. Tale fenomeno può verificarsi quando la circolazione di più patogeni, in questo caso SARS-CoV-2 e il virus dell’influenza, determina interazioni collaborative/competitive durante una stessa stagione, conferendo un’immunità aspecifica e ad ampio spettro nell’ospite (inclusa una risposta immunitaria primaria) per una precedente infezione o competizione per gli stessi tipi di cellule e altri fattori [11].
La rapida e rigorosa attuazione degli interventi non farmacologici in tutto il mondo per combattere la diffusione di SARS-CoV-2 è verosimilmente il fattore principale che ha contribuito alla riduzione dell’influenza. Tuttavia, malgrado il mutato quadro epidemiologico dell’influenza negli ultimi anni, la comunità scientifica è concorde nel non abbassare la guardia e rafforzare tutte le misure di prevenzione, inclusa la vaccinazione.
La pandemia da SARS-CoV-2 è tuttora in corso, e anche la prossima stagione influenzale rappresenta motivo di preoccupazione. Infatti, poiché nelle ultime due stagioni meno soggetti sono stati esposti a virus respiratori stagionali come l’influenza, l’immunità della popolazione potrebbe essere diminuita.
Inoltre, anche se l’attività dell’influenza stagionale è risultata bassa, la prosecuzione della vaccinazione annuale contro l’influenza è ancora fondamentale per assicurare una certa immunità nella popolazione. Pertanto, monitorare e prepararsi alla prossima epidemia di influenza stagionale attraverso l’implementazione della sorveglianza epidemiologica e virologica, di indagini rapide sui focolai, di sequenziamento tempestivo e condivisione dei dati, sono di fondamentale rilevanza.
L’attuazione di un programma di vaccinazione contro l’influenza stagionale previene la morbilità e la mortalità nei soggetti di qualsiasi età e nei gruppi a rischio [12]. I vaccini antinfluenzali stagionali offrono, infatti, protezione in tutti i soggetti che sono a rischio di contrarre l’influenza o che possono incorrere in gravi malattie (es. complicanze legate all’influenza o ricovero ospedaliero), che rientrano in categorie di gruppi e lavoratori a rischio. Inoltre, robusti programmi di vaccinazione contro l’influenza stagionale rafforzano la capacità di vaccinazione locale e la capacità di produzione globale dei preparati contro l’influenza.
Le campagne di vaccinazione stagionali per l’influenza realizzate ogni anno prevedono attività strutturate in grado di offrire la vaccinazione ai target previsti dalla circolare annuale ministeriale e disporre di sistemi per monitorare la copertura vaccinale.
Specificatamente, in Liguria la programmazione della campagna vaccinale antinfluenzale stagionale è svolta da A.Li.Sa. in collaborazione con la Commissione Vaccini Regionale e le Aziende Sanitarie operanti sul territorio.
A livello regionale secondo quanto espresso dalle AASSLL, gli obiettivi di copertura da raggiungere e i quantitativi messi a disposizione in sede di gara regionale - Centro Regionale di Acquisto (C.R.A.), ora S.U.A.R. stazione unica appaltante regionale – il fabbisogno stimato è di circa 440.000 dosi, incrementabile nella misura del 20% in caso di forte richiesta da parte dell’utenza.
Nei primi mesi dell’anno la Commissione Vaccini Regionale, organo tecnico-scientifico la cui composizione è stata recentemente aggiornata con DGR 451/2021, partecipa alle attività programmatorie della campagna di immunizzazione, come ad esempio la migliore allocazione delle 440.000 dosi di vaccino in termini di stratificazione per ASL e tipologia di preparato. Per la campagna vaccinale 2022/2023 sono messe a disposizione della Sanità Pubblica, diverse tipologie di preparato: vaccino tetravalente inattivato adiuvato per soggetti ≥ 65 anni, vaccino tetravalente inattivato con antigeni di superficie frammentati/split a partire dai 6 mesi di età, vaccino tetravalente a sub-unità inattivato coltivato su substrato cellullare a partire dai 2 anni, vaccino tetravalente (virione split inattivato) 60 μgr HA/ceppo per adulti di età superiore ai 60 anni e vaccino tetravalente vivo attenuato spray nei bambini e adolescenti di età compresa tra 24 mesi e 18 anni.
La scelta di disporre di più tipologie di vaccini sta nel perseguire l’appropriatezza d’uso dei vaccini anti-influenzali, tematica di rilevanza per la scelta dei prodotti più adatti per ogni categoria di soggetti che possono essere colpiti da tale malattia [12]. Da evidenziare che un intervento risulta appropriato nel momento in cui risponde il più possibile, relativamente al contesto in cui si colloca, ai criteri di efficacia, sicurezza ed efficienza. Alcuni recenti esempi internazionali supportano l’importanza dell’applicazione del concetto di “appropriatezza della vaccinazione antinfluenzale”. Inoltre, l’appropriatezza dell’offerta dei vaccini antinfluenzali rappresenta anche un importante passaggio intermedio verso la “precision vaccinology” [13]. Qualsiasi vaccino può essere determinante per evitare complicanze, ospedalizzazioni e morte, e l’uso del vaccino più appropriato, specialmente nei soggetti anziani, è in grado di ottimizzare il risultato, con un favorevole rapporto costi/benefici.
La campagna influenzale prevede l’attivo coinvolgimento dei MMG e PLS grazie ad accordi specifici, siglati annualmente. L’obiettivo degli accordi è facilitare l’accesso ai beneficiari della vaccinazione assistita dai MMG in virtù della loro capillare distribuzione sul territorio, permettendo così il raggiungimento di coperture ottimali volte a diminuire l’incidenza e le complicanze della malattia, ed è coerente con le caratteristiche di universalità ed equità di accesso alle cure nonché di appropriatezza dell’uso delle risorse. Inoltre, tiene conto della sostenibilità economica e del gradimento dei cittadini riguardo all’assistenza fornita dal proprio MMG.
Gli accordi prevedono incentivi da erogare per la partecipazione attiva del MMG alla somministrazione della vaccinazione per influenza e anche per Herpes zoster e Pneumococco ai soggetti aventi diritto secondo LEA e PNPV 2017/2019 e si basano sul calcolo di indicatori in relazione agli assistiti in carico over 65 anni.
Inoltre, al fine di agevolare le diverse fasi preparatorie, utili agli operatori sanitari, è stato affinato il portale regionale PoLiSS tramite il quale il MMG/PLS visualizza i propri assistiti eleggibili per la vaccinazione, ad esempio i soggetti con età >65 anni e gli altri target della vaccinazione come i soggetti a rischio; tale sistema permette fin dalla prossima campagna di implementare un’offerta con chiamata attiva dei soggetti a rischio.
In Liguria la vaccinazione antinfluenzale sul territorio ligure è offerta anche alle fasce d’età: 6 mesi - 6 anni e alle fasce d’età 60-64 anni secondo le indicazioni ministeriali e la DGR n.628/2021.
La prenotazione della vaccinazione da parte degli utenti avviene tramite CUP (numero verde CUP 800 098543, presso punti di prenotazione CUP distrettuali, presso le farmacie e i medici aderenti al servizio CUP) e tramite il portale regionale “Prenoto Vaccino” che consente (i) di centralizzare l’accesso ai servizi online resi disponibili al cittadino in ottica di promozione della salute, prevenzione e gestione delle campagne vaccinali, (ii) la multicanalità nell’accesso alle prenotazioni, (iii) la pianificazione e ottimizzazione delle disponibilità e dell’offerta sanitaria e (iv) l’istituzione di una Anagrafe Vaccinale Regionale.
Solo coloro che rientrano nelle fasce di età e nelle categorie a rischio di complicanze identificate dal Ministero della Salute per cui è prevista la vaccinazione gratuita e che non abbiano effettuato la prenotazione presso il proprio medico, possono prenotare la vaccinazione.
L’ampio ventaglio di possibilità di accesso è disegnato in modo tale da agevolare l’utenza e quindi permettere la più ampia adesione alla vaccinazione. Le sedi dove è possibile vaccinarsi sono lo studio del proprio medico o pediatra di famiglia, gli ambulatori dedicati delle AASSLL, le farmacie e le associazioni di appartenenza o centri trasfusionali per i donatori di sangue. Con DGR n.996/2021 è stato recepito protocollo d’intesa tra il governo, le Regioni e le Province Autonome, Federfarma e Assofarm per la somministrazione da parte dei farmacisti dei vaccini antinfluenzali.
Alcune AASSLL offrono anche la possibilità di vaccinarsi in modalità “accesso libero”, con la possibilità di ricevere il vaccino anti SARS-CoV-2 congiuntamente a quello antinfluenzale, e un circuito itinerante di sedi come supermercati e punti di aggregazione.
Poiché gli obiettivi di copertura vaccinale per tutti i gruppi target sono il 75% come obiettivo minimo perseguibile e 95% ottimale [14], risulta necessario individuare tutte le modalità utili al raggiungimento di tali obiettivi soprattutto quelle orientate al raggiungimento dei gruppi a rischio e promuovere fortemente la vaccinazione di tutti gli operatori sanitari in ogni occasione possibile.
Relativamente alla registrazione delle coperture vaccinale dalla stagione 2021/2022, tutte le AASSLL hanno effettuato il consolidamento sulle proprie istanze dell’anagrafe vaccinale nazionale (VCN) dei dati delle somministrazioni di vaccinazioni anti-influenzali inserite sul portale PoLiSS per la Campagna Vaccinale Anti-influenzale 2021-2022.
In figura 1 sono riportate le coperture negli anziani e negli adulti 45-64 in Italia e in Liguria relative al periodo 2000-2022. È possibile notare che nella stagione 2020/21 si è registrato un picco di copertura, probabilmente legato al fatto che la vaccinazione anti SARS-CoV2 non era ancora disponibile e l’aver ricevuto la vaccinazione antinfluenzale determinava un peso diagnostico discriminante rilevante, mentre nella stagione successiva la concomitanza delle due campagne vaccinali antinfluenzale e anti SARS- CoV2 potrebbe aver influenzato la scelta di vaccinarsi a favore di quest’ultima.
Presso le farmacie territoriali liguri è stata condotta un’indagine conoscitiva sull’attitudine della popolazione over 60 anni alla vaccinazione nel periodo della campagna 2021/2022.
In totale hanno partecipato alla compilazione del questionario anonimo 30.566 soggetti; nelle figure 2 e 3 sono riportati alcuni risultati della survey. Da evidenziare che il 76,2% (23.310/30.566) dei partecipanti si era vaccinato nella stagione precedente e che il 68,5% (20952/30.566) aveva in programma di farlo per la stagione presente; “il proteggere sé stesso dal rischio di influenza” era la motivazione più frequentemente riportata. Gli utenti hanno ricercato informazioni della vaccinazione soprattutto dal proprio medico (43,1%) e dai farmacisti di fiducia (36,9%).
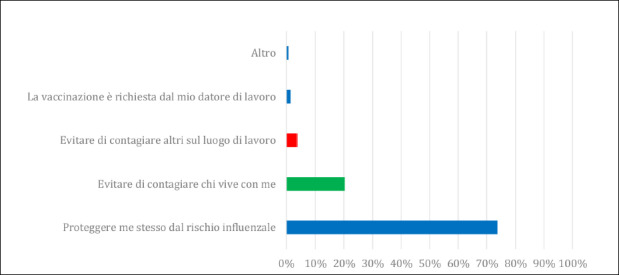
Risultati dell’indagine conoscitiva sull’attitudine alla vaccinazione antinfluenzale: “perché si è vaccinato”.
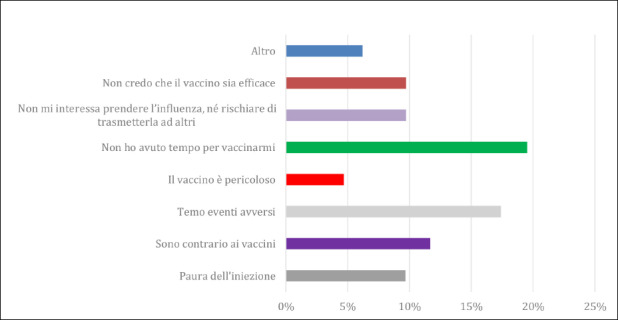
Risultati dell’indagine conoscitiva sull’attitudine alla vaccinazione antinfluenzale: “perché non si è vaccinato”
Come emerge in altri studi l’accettabilità del vaccino influenzale varia a seconda del tempo, luogo, tipo di vaccino e informazioni disponibili [15]. La conoscenza, gli atteggiamenti e le pratiche nei confronti del vaccino tra la popolazione a rischio di sviluppare la malattia possono contribuire a personalizzare le strategie al fine di migliorare l’aderenza alle raccomandazioni [15].
A livello regionale ogni anno è svolta un’attiva campagna di promozione della vaccinazione antinfluenzale.
La campagna è multimediale, veicolata attraverso spot trasmessi dalle principali emittenti locali, messaggi pubblicati sulle pagine locali dei principali quotidiani, sponsorizzazione attraverso canali social di Regione Liguria (Instagram e Facebook), banner sulle testate locali on-line, e locandine affisse presso farmacie liguri, studi di MMG e PLS e ambulatori delle AASSLL. La caratterizzazione della comunicazione è orientata all’uso di linguaggi e stili chiari e facilmente comprensibili da parte della popolazione, con particolare attenzione alle fasce di popolazione di età avanzata e di minore scolarizzazione, anche attraverso partner e testimonial che possono diffondere in modo efficace messaggi comunicativi efficaci e coerenti [16,17].
In conclusione, occorre evidenziare che la prevenzione dell’influenza stagionale continua a essere una priorità di Sanità Pubblica e che gli obiettivi della vaccinazione sono sia individuali (prevenire la malattia e le sue complicanze) sia collettivi (ridurre la diffusione dell’infezione e i costi sociali). Inoltre, la vaccinazione può esercitare effetti sia diretti che indiretti rivolti al contenimento del fenomeno dell’antibiotico-resistenza [18].
Una metanalisi su studi clinici controllati e osservazionali (vaccinati vs non vaccinati/placebo) indica una significativa riduzione di circa il 25% sulla prescrizione di antibiotici nei soggetti immunizzati [18].
L’hesitancy vaccinale è una delle sfide principali per il controllo delle malattie infettive; la riluttanza a ricevere i vaccini nasce spesso da un sensibile desiderio di meglio comprenderne il profilo di sicurezza e gli effetti dei preparati vaccinali; a tal riguardo gli utenti andrebbero incoraggiati, a porre domande ed esprimere eventuali preoccupazioni ai professionisti di salute circa la vaccinazione.
Il proseguimento di indicazioni chiare, nonché il coordinamento continuo tra le autorità sanitarie e gli operatori sanitari, è fondamentale per ridurre il carico dell’influenza e prevenire i casi gravi che possono sovraccaricare il sistema sanitario regionale. Il mancato raggiungimento dei tassi di copertura comporta inevitabilmente una riduzione dei benefici della vaccinazione.
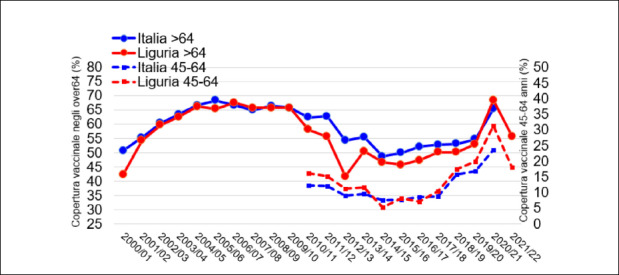
Coperture vaccinali in Italia e in Liguria - periodo 2000-2022 negli over 64 anni e adulti 45-64 [Min Sal. e VCN].
Le epidemie di influenza stagionale, secondo il WHO, causano da 3 milioni a 5 milioni di casi gravi e da 300.000 a 500.000 morti a livello globale ogni anno; solo negli Stati Uniti si registrano da 140.000 a 710.000 ricoveri correlati all’influenza e da 12.000 a 56.000 decessi ogni anno, con il più alto carico di malattie che colpisce i giovanissimi, i molto anziani e le persone con condizioni mediche coesistenti.
L’impatto economico dell’influenza stagionale è determinato da costi diretti derivanti dall’utilizzo di risorse sanitarie (farmaci, costi sanitari, ospedalizzazioni), in particolar modo da parte di anziani e gruppi di popolazione ad alto rischio, e costi indiretti derivanti dalla perdita di giornate lavorative.
I virus influenzali causano malattia in persone di tutte le età, sono soggetti a deriva e spostamento antigenico e le variazioni stagionali nella circolazione del ceppo influenzale insieme ai fattori dell’ospite, possono influenzare significativamente, nel mondo reale, l’efficacia del vaccino antinfluenzale in particolare nei gruppi ad alto rischio.
I tassi di infezione influenzale sono più alti tra i bambini; le complicanze, i ricoveri e i decessi sono più elevati nei soggetti ≥65, nei bambini <5 anni e in soggetti di qualsiasi età a rischio.
La contagiosità dei virus influenzali dipende dalla virulenza del ceppo in circolazione, dall’esistenza di un’immunità pregressa nella popolazione e dalla somiglianza o “corrispondenza” tra i virus utilizzati per produrre il vaccino e quelli in circolazione.
L’entità della morbilità e della mortalità per influenza, in un dato anno, riflette il grado di deriva o spostamento genetico nel ceppo dominante del virus influenzale, l’efficacia e la copertura della vaccinazione.
Negli anni, in cui i vaccini antinfluenzali sono ben abbinati ai virus circolanti, le stime dell’efficacia del vaccino variano dal 40 al 60%, un valore inferiore a quello della maggior parte dei vaccini non influenzali autorizzati.
L’efficacia non ottimale del vaccino è probabilmente multifattoriale; inoltre, i fattori dell’ospite come l’età e le condizioni coesistenti, influenzano l’efficacia del vaccino, alcuni di questi effetti possono essere mitigati utilizzando adiuvanti o vaccini ad alte dosi per generare risposte immunitarie più solide negli anziani [1]; ed ancora la reale efficacia protettiva dei vaccini antinfluenzali, dipende non solo dalla risposta immunitaria ma anche dalla percentuale di vaccinati tra i soggetti a rischio e nella popolazione generale.
Un altro fattore che può alterare l’efficacia dei vaccini antinfluenzali è il substrato utilizzato per produrli; la maggior parte dei virus dei vaccini antinfluenzali si propaga nelle uova e solo una piccola parte viene prodotta in colture cellulari o esprimendo proteine virali specifiche con l’utilizzo di tecnologie del DNA ricombinante.
Durante il processo di produzione a base di uova, il virus del vaccino acquisisce cambiamenti nella proteina emoagglutinina (HA) che media il legame del recettore; poiché l’HA è l’obiettivo principale degli anticorpi neutralizzanti, piccole modifiche in questa proteina possono causare cambiamenti antigenici nel virus e ridurre l’efficacia del vaccino, in particolare contro il sottotipo A (H3N2).
Per quanto imperfetti gli attuali vaccini antinfluenzali rimangono un fondamentale strumento di salute pubblica, riducono la gravità dell’influenza prevengono i ricoveri, diminuiscono l’accesso al sistema sanitario.
La ricerca, mirata per migliorare gli attuali antigeni, e le piattaforme e strategie di produzione dei vaccini, porterà a breve termine a una maggiore efficacia dei vaccini contro l’influenza stagionale.
Da tempo, ormai sono stati sviluppati vaccini antinfluenzali potenziati per rafforzare la risposta immunitaria [1], compresi i vaccini antinfluenzali inattivati (adiuvati, a base cellulare, ad alto dosaggio), i vaccini antinfluenzali ricombinanti e i vaccini antinfluenzali vivi attenuati.
In Europa, LAIV4 è approvato per bambini e adolescenti; gli altri vaccini potenziati approvati per l’utilizzo sono:
il vaccino influenzale quadrivalente adiuvato (aIIV4), indicato per adulti di età ≥65 anni, contenente antigene NA, una dose standard di antigene HA (15 μg) e MF59 come adiuvante; è progettato per migliorare l’entità, la persistenza e l’ampiezza della risposta immunitaria nei soggetti di età ≥65 anni, rispetto ai vaccini non adiuvati ed è stato utilizzato nella pratica clinica dal 1997, nella sua formulazione trivalente e recentemente quadrivalente [2, 3];
il vaccino antinfluenzale quadrivalente a base cellulare (ccIIV4), indicato per persone di età ≥2 anni, (negli Stati Uniti approvato da FDA a partire dai 6 mesi), contenente l’antigene della neuraminidasi (NA) e una dose standard di antigene dell’emoagglutinina (HA) (15 μg); l’utilizzo di vaccini antinfluenzali a coltura cellulare, rispetto ai vaccini da uovo, rappresenta un potenziale vantaggio, a causa del possibile impatto dell’egg-adaptation sull’efficacia dei vaccini antinfluenzali, in particolare contro i ceppi A(H3N2) [4];
il vaccino antinfluenzale ricombinante quadrivalente (RIV4), indicato per adulti di età ≥18 anni, contenente tre volte il livello dell’antigene HA (45 μg) [5];
il vaccino antinfluenzale quadrivalente ad alte dosi (HD-IIV4), indicato per adulti di età ≥60 anni, contenente antigene NA e un livello quattro volte superiore all’antigene HA (60 μg); il contenuto aggiuntivo di antigene è inteso a migliorare la risposta immunitaria [6].
Per la stagione influenzale 2021/22, [7] alcuni paesi dell’Unione Europea hanno incluso aIIV4, e HD-IIV4 nei loro programmi di vaccinazione per gli anziani. In Italia, Spagna e Stati Uniti, aIIV4 e HD-IIV4 sono disponibili per gli anziani insieme ad altri vaccini quadrivalenti, inclusi IIV4s, ccIIV4 e RIV4 a seconda del Paese, senza una raccomandazione specifica; nel Regno Unito sia aIIV4 che HD-IIV4 sono raccomandati di preferenza e in Francia, solo HD-IIV4 è disponibile insieme a IIV4s. Recentemente negli Stati Uniti sono state emesse, per la stagione influenzale 2022/2023, le raccomandazioni per l’uso preferenziale nella popolazione ≥65 anni, dei vaccini potenziati (vaccino quadrivalente adiuvato, vaccino ad alto dosaggio e vaccino ricombinante) senza alcuna preferenza di uno dei tre vaccini rispetto agli altri due [8].
L’immunità indebolita nelle persone anziane, li rende più suscettibili alle infezioni influenzali naturali, e impedisce loro di sviluppare un’immunità protettiva ai vaccini antinfluenzali standard; questa vulnerabilità nei confronti dell’influenza, degli adulti ≥ 65 anni, rende ragione degli sforzi in corso per migliorare i vaccini antinfluenzali per questa fascia di età.
Vi è un fiorire di studi per vaccini antinfluenzali che conferiscano una protezione ampia e duratura contro diversi ceppi virali con un effetto importante sulla salute globale e per ridurre la necessità di riformulazione e immunizzazione annuale del vaccino.
Interessanti sono gli immunogeni di nanoparticelle adiuvate che inducono risposte anticorpali neutralizzanti e ampiamente protettive contro un’ampia varietà di virus dell’influenza [9].
Si sente la necessità di adoperarsi, per un vaccino antinfluenzale “universale” che protegga dalle varianti della deriva dell’influenza stagionale e da potenziali ceppi pandemici, con una durata migliore rispetto agli attuali vaccini annuali [10]; esistono diversi approcci promettenti per lo sviluppo di un vaccino antinfluenzale universale, è probabile che, nei prossimi anni, almeno uno di essi entri in uso e diventi una pratica diffusa.
I vaccini antinfluenzali, a base di acido ribonucleico messaggero (mRNA) sono attualmente in fase di sviluppo e si prevede che saranno più efficaci dei vaccini convenzionali [11].
Ed ancora, il futuro dei vaccini antinfluenzali sarà cambiato anche dai risultati sui vaccini COVID-19 [11]; i vaccini influenzali inattivati, moderatamente efficaci, potrebbero essere meno accettabili per un pubblico che si è abituato a vaccini COVID-19 altamente efficaci; le nuove tecnologie per i vaccini, come l’mRNA, e la più ampia disponibilità di vaccini antinfluenzali adiuvati, HD, e non a base di uova, possono migliorare considerevolmente l’efficacia media annuale dei vaccini antinfluenzali.
Per l’influenza stagionale, le regole sono conosciute: i virus influenzali cambiano continuamente e il WHO monitora l’epidemiologia dei virus influenzali in tutto il mondo, formulando raccomandazioni sui ceppi da includere nei vaccini, con raccomandazioni confermate per la stagione 2022/2023 [12]. Questo processo è stato molto più difficile e potenzialmente meno preciso dall’inizio del 2020, a causa del numero molto inferiore di virus influenzali isolati e analizzati in tutto il mondo.
L’aggiornamento dei vaccini contro SARS-CoV-2 presenta delle sfide [13]; la prossima generazione di vaccini COVID-19 dovrà fornire immunità crociata contro le varianti SARS-CoV-2, conferire una maggiore durata della protezione ed essere facile da aggiornare; aggiornare i vaccini COVID-19 è più facile a dirsi che a farsi; la sfida è che non si conoscono le regole di come si comporta il virus SARS-CoV-2.
Mentre la maggior parte dei vaccini antinfluenzali ha piattaforme simili, con tempi simili necessari per aggiornarli, non è il caso dei vaccini COVID-19; non solo, le piattaforme dei vaccini COVID-19 differiscono l’una dall’altra, ma non c’è stato alcun coordinamento tra i produttori, che si trovano in varie fasi degli studi clinici con vaccini aggiornati di varia composizione; un vaccino multivalente contro il COVID-19, contenente antigeni di molteplici varianti preoccupanti di SARS-CoV-2, sarà il passo successivo dopo un vaccino monovalente, ma, come con i vaccini contro l’influenza stagionale quadrivalenti, i produttori devono dimostrare che gli antigeni di più varianti combinati sono altrettanto immunogenici come ciascuno da solo.
Durante l’inverno del 2021, l’attività influenzale è quasi scomparsa, mostrando una diminuzione drammatica degli isolati virali e lo stesso è accaduto con il virus respiratorio sinciziale (i bambini sono i principali driver di entrambi i virus).
Gli interventi non farmacologici (NPI), per prevenire il COVID-19, hanno ridotto l’incidenza dell’influenza durante le stagioni 2020/2021 e 2021/2022; una volta allentate le misure NPI, la prossima influenza stagionale può verificarsi prima e raggiungere un’incidenza più elevata.
Occorre interpretare e monitorare i dati sentinella, relativi alla fase iniziale della stagione influenzale nell’emisfero sud, anche ma non solo, alla luce dell’impatto del decadimento delle misure di distanziamento fisico e del cambiamento delle abitudini e comportamenti sanitari legati alla pandemia da COVID-19 [14]; sono uno dei pochi indicatori e riferimenti a nostra disposizione, in grado di aiutarci nella preparazione a un possibile andamento della malattia nell’emisfero nord e a un’eventuale epidemia influenzale.
È probabile che nell’autunno-inverno 2022-2023, si registrerà una ripresa dell’attività influenzale a livelli simili o superiori a quelli precedenti la pandemia; il potenziale di co-circolazione di influenza, COVID-19 e altri virus respiratori potrebbe aumentare sostanzialmente le pressioni sul nostro Servizio Sanitario Nazionale (SSN), aggiungendo o prolungando il periodo complessivo per il quale i virus respiratori circolano in sequenza.
Una delle misure più importanti è sviluppare una “strategia di vaccinazione potenziata dall’influenza” durante le prossime campagne vaccinali per ridurre la popolazione suscettibile, raggiungendo coperture vaccinali più elevate negli over 60 e nei soggetti a rischio e aumentando il livello di vaccinazione nelle fasce pediatriche.
Sono pertanto, necessari programmi più’ estesi di vaccinazione e anche campagne di sensibilizzazione per le popolazioni attraverso una comunicazione mirata, appropriata e coerente con le evidenze scientifiche; occorre ricalibrare i sistemi sanitari e dotare i sistemi di sorveglianza di una maggiore capacità di prevedere situazioni emergenziali.
La vaccinazione antinfluenzale è raccomandata [15] negli over 60, in tutti i soggetti con malattie croniche e nelle gravide in qualsiasi momento durante la gravidanza [16].
I vaccini antinfluenzali, come tutti i vaccini inattivati, possono essere somministrati a tutti i pazienti immunocompromessi; sono sicuri ma l’immunogenicità può essere ridotta [17].
I tassi di vaccinazione nei pazienti immunosoppressi sono sub-ottimali per assenza di raccomandazioni; i vaccini antiinfluenzali e anti-pneumococcici, nei soggetti con malattie reumatiche sono sicuri e sufficientemente protettivi [18].
La vaccinazione COVID-19 è efficace nella maggior parte dei pazienti oncologici, nonostante molti siano immunocompromessi a causa del cancro e delle cure; i booster di vaccinazione COVID-19 sono incredibilmente importanti per i malati di cancro [19].
Infine, si ribadiscono, i vantaggi nella co-somministrazione [20] di possibili dosi di richiamo del vaccino COVID-19 con il vaccino contro l’influenza stagionale. Secondo il CDC [21] e altri organismi scientifici internazionali, i vaccini COVID-19 (inattivati) possono essere somministrati, indipendentemente dai tempi di altri vaccini compresi gli antinfluenzali e l’immunogenicità e i profili degli eventi avversi sono generalmente simili quando somministrati contemporaneamente o da soli.
Le campagne di vaccinazione della Regione Lazio, ormai da anni, sono improntate su due elementi chiave:
appropriatezza del vaccino antinfluenzale: a ognuno il suo vaccino in rapporto all’età e allo stato di salute; a titolo esemplificativo si indicano la tipologia e la quantità di vaccini aggiudicati in gara per la campagna 2021/2022: aIIV4: 840.000; ccIIV4: 720.000; LAIV4: 110.000; IIV4s: 80.000 totale 1.750.000 dosi; per la campagna 2022/2023: aIIV4: 840.000; ccIIV4: 470.000; LAIV4: 60.000; HD-IIV4: 30.000; IIV4s: 65.000 totale 1.465.000 dosi;
fortissimo coinvolgimento dei MMG e PLS, presenti sul territorio, con obiettivi di fiduciarietà, prossimità e domiciliarità e un’offerta vaccinale equa e facilmente accessibile, valorizzata da un approccio «personalizzato e una “prevenzione di precisione” adeguata ai bisogni del singolo paziente.
La necessità di raggiungere almeno, l’obiettivo minimo di copertura vaccinale per influenza negli adulti anziani e nei fragili, rappresenta un importante passo per centrare il duplice obiettivo della salvaguardia della longevità e della sostenibilità del sistema sanitario.
Nell’ultimo decennio, vi è stata buona corrispondenza tra i ceppi di influenza nel vaccino e quelli circolanti, spesso un’efficacia più scarsa verso il sottotipo A(H3N2) nei soggetti ≥ 65, il quale muta più frequentemente e colpisce maggiormente gli anziani; la presenza di comorbidità rappresenta un fattore di rischio ulteriore nello sviluppo di complicanze legate all’influenza e conseguente necessità di ospedalizzazione; pertanto, nella esperienza regionale, sù tale target, si è inteso prioritizzare un utilizzo estensivo di vaccini potenziati in grado di conferire una maggiore protezione.
Punti forti dell’esperienza della Regione Lazio nelle campagne vaccinali antinfluenzali sono:
il provvedimento istitutivo annuale P.O.;
il protocollo tecnico-operativo [22];
la gara vaccini centralizzata regionale per l’acquisizione dei vaccini sul fabbisogno ASL e Ospedali, con grandi vantaggi e importanti economie di scala;
il flusso informativo dedicato;
la valutazione economica-statistica-epidemiologica.
Gli attori principali sono i MMG, i PLS, gli operatori sanitari dei centri vaccinali (ampliamento delle fasce orarie di accesso di tali presidi e programmazione di sessioni di vaccinazione per le persone a rischio), i coordinatori aziendali, gli ospedali pubblici e privati AO, PU, IRCCS, OC che sono enti di autonoma erogazione delle vaccinazioni con i loro centri vaccinali ospedalieri (CVO), le farmacie dei servizi a partite dalla campagna vaccinale 2021/2022.
Si è strutturalmente organizzata, una rete di 105 medici sentinella (86 MMG e 19 PLS) distribuiti tra le Aziende sanitarie territoriali e coordinati a livello regionale.
Si è implementata, nel corso degli anni, l’offerta attiva alla vaccinazione antiinfluenzale attraverso i MMG e PLS, la fidelizzazione della classe d’ingresso dell’età anziana i 65enni; si sono attuate misure per aumentare la copertura negli operatori sanitari con un coinvolgimento dei medici competenti nell’ambito della sorveglianza sanitaria; si è potenziata la logistica organizzativa, rendendo più snelli ed efficienti l’approvvigionamento, la distribuzione e l’erogazione del vaccino.
I vaccini antiinfluenzali vengono somministrati in tempo sufficiente per garantire la protezione dei pazienti prima che l’influenza inizi a circolare, tenendo conto del fatto che la risposta immunitaria alla vaccinazione impiega circa due settimane per svilupparsi completamente.
La vaccinazione antinfluenzale, in definitiva, è stata resa accessibile il più facilmente possibile, con azioni di offerta attiva di provata efficacia e una comunicazione sui benefici di una copertura vaccinale ottimale.
La Regione Lazio ha introdotto una fortissima raccomandazione alla vaccinazione per gli operatori sanitari, per i soggetti over 60, per tutti i soggetti con malattia cronica e per tutti i bambini > 6mesi < 6 anni.
Si ricorda che i bambini da 0 a 4 anni si ammalano d’influenza, dieci volte più di frequente dell’anziano e l’ospedalizzazione dei bambini sotto i 2 anni per influenza è simile proporzionalmente a quella dell’anziano.
Nel piano operativo regionale [22] sono definiti gli obiettivi di copertura e gli obiettivi di performance; i risultati sono continuamente monitorati; ogni vaccinazione, effettuata dai MMG/PLS, dai centri vaccinali e dalle altre strutture dotate di autonoma capacità di erogazione, ai soggetti appartenenti alle categorie della popolazione bersaglio, è documentata mediante la registrazione dei dati relativi alla identità del vaccinato e alla vaccinazione.
Ci si propone di raggiungere, nelle prossime campagne di vaccinazione antinfluenzale, un migliore assorbimento della vaccinazione negli operatori sanitari, negli over 60 con precedenza per le persone ricoverate in strutture assistenziali a lungo termine o assistite a domicilio, nei gruppi a rischio clinico, nei bambini di età compresa tra 6 mesi e 6 anni e nelle donne in gravidanza, per fornire una protezione diretta a coloro che sono maggiormente a rischio di influenza.
I MMG, i PLS, i presidi vaccinali del territorio e in ospedale, i servizi di farmacia comunitaria offrono, in modo proattivo, la vaccinazione antinfluenzale e garantiscono a tutti i pazienti idonei l’opportunità di essere vaccinati mediante meccanismi di chiamata e richiamo attivi.
Occorre incoraggiare gli operatori sanitari, i datori di lavoro e i leader della comunità a promuovere la vaccinazione con un uso diffuso a ed estensivo dei vaccini antinfluenzali.
Gli operatori vaccinali sono i veri influencers delle decisioni di vaccinazione in quanto somministrano il vaccino, informano la popolazione, affrontano le preoccupazioni e le ansie degli utenti, circa la sicurezza e l’efficacia del vaccino; vi sono responsabilità etiche degli operatori sociosanitari, la loro esitazione nei confronti delle vaccinazioni è fonte di preoccupazione significativa.
Un consenso condiviso è la variabile prioritaria per un’elevata adesione vaccinale, così come una opinione pubblica informata e consapevole dei vantaggi di un uso diffuso ed estensivo della vaccinazione antinfluenzale.
L’influenza rappresenta un serio problema di sanità pubblica e una rilevante fonte di costi diretti e indiretti per la gestione dei casi e delle complicanze della malattia e l’attuazione delle misure di controllo. Lo strumento più efficace e sicuro per prevenirla e ridurne le complicanze è la vaccinazione, unitamente alle misure di protezione personale, quali l’igiene respiratoria e il lavaggio delle mani. Ogni anno il Ministero della Salute delinea le strategie e gli obiettivi della campagna di vaccinazione antinfluenzale, anche alla luce delle più recenti raccomandazioni dell’Organizzazione Mondiale della Sanità (OMS), attraverso l’emanazione di una circolare. Per la scorsa campagna vaccinale, detta Circolare Ministeriale avente a oggetto «Prevenzione e controllo dell’influenza: raccomandazioni per la stagione 2021-2022», entrata in vigore in data 08.04.2021 [1]. La Regione Puglia vanta di una Commissione Tecnico-Scientifica Vaccini costituita da referenti/rappresentanti dell’Università (Pediatria e Igiene e Medicina Preventiva), dei Dipartimenti di Prevenzione, delle Società Scientifiche e Federazioni (SITI, FIMMG, SIP, FIMP), il tutto coordinato dall’Assessorato Regionale. Relativamente alla campagna vaccinale antinfluenzale, detta Commissione ha l’onere di recepire la Circolare Ministeriale e stilare un proprio protocollo di intervento portando alla pubblicazione, a ottobre, prima dell’inizio della campagna vaccinale, di una propria Circolare Regionale avente come oggetto: “Circolare del Ministero della Salute prot. 0014614 del 08.04.2021 in materia di prevenzione e controllo dell’influenza-Campagna di vaccinazione antinfluenzale nella Regione Puglia per la stagione 2021-2022” [2] in cui sono contenute le indicazioni operative da attuare al fine del raggiungimento degli obiettivi previsti. Si ritiene opportuno rimarcare degli aspetti fondamentali delle indicazioni ministeriali per la stagione influenzale 2021-2022 alla luce dell’emergenza sanitaria da COVID-19 che la Regione Puglia ha recepito, al fine di migliorare la capacità di risposta del sistema sanitario:
facilitare la diagnosi differenziale nelle fasce d’età di maggiore rischio di malattia grave, la vaccinazione antinfluenzale che può essere offerta gratuitamente nella fascia d’età 60-64 anni;
raccomandare fortemente la vaccinazione per le professioni sanitarie e socio-sanitarie che operano a contatto con i pazienti, e per gli anziani istituzionalizzati in strutture residenziali o di lungo degenza;
rafforzare la partecipazione alla sorveglianza virologica da parte dei MMG e PLS partecipanti alla sorveglianza epidemiologica per stimare l’impatto dell’influenza confermata e l’efficacia vaccinale sul campo dei vaccini antinfluenzali, nei soggetti di tutte le età non ospedalizzati.
Inoltre, il vaccino antinfluenzale è raccomandato per tutti i soggetti a partire dai 6 mesi di età che non hanno controindicazioni al vaccino per cui, sulla base delle indicazioni dell’OMS nel contesto della pandemia CoVID-19, sono state riconsiderate le priorità dei gruppi a rischio per la vaccinazione antinfluenzale:
offerta attiva con la massima priorità agli adulti con età superiore ai 50 anni a più alto rischio e ai soggetti ricoverati in strutture assistenziali a lungo termine o assistiti a domicilio;
offerta attiva con priorità:
alle donne in gravidanza;
alle persone con patologie di base che aumentano il rischio di complicanze da influenza;
ai bambini tra 6 mesi e 6 anni.
Con circolare prot. 0044591 del 02.10.2021 il Ministero della Salute ha divulgato, altresì, la nota congiunta Consiglio Superiore di Sanità, AIFA e ISS recante “Intervallo temporale tra la somministrazione dei vaccini anti-SARS-CoV-2/COVID-19 e altri vaccini” al fine di rendere possibile la co-somministrazione di vaccini antinfluenzali con vaccini anti SARS-CoV-2/COVID-19 per la popolazione target che rientra nelle stesse categorie di rischio e per cui è prevista la somministrazione della “dose addizionale” o della “dose booster”.
Vista la situazione epidemiologica relativa alla circolazione del virus SARS-CoV-2, il Ministero, ha anche raccomandato di anticipare la conduzione della campagna di vaccinazione antinfluenzale a partire dall’inizio di ottobre 2021 e di offrire la vaccinazione ai soggetti eleggibili in qualsiasi momento della stagione influenzale. Pertanto, la Regione Puglia ha dato indicazione che l’offerta vaccinale venisse garantita in corrispondenza con l’effettiva disponibilità delle dosi di vaccino ordinate da ciascuna Azienda Sanitaria dando priorità alla vaccinazione degli operatori sanitari, dei soggetti appartenenti alle categorie di rischio per motivi sanitari, dei pazienti in carico ai Centri specialistici delle Reti di Patologia, dei pazienti ricoverati o ospitati presso le strutture sanitarie, socio-sanitarie e socio-assistenziali. Si è sempre rammentata l’idea che la campagna di vaccinazione antinfluenzale rappresentasse occasione privilegiata anche per l’offerta delle vaccinazioni antipneumococcica e anti herpes zoster con le modalità già previste dalle precedenti note regionali emanate in materia nonché in base a quanto previsto dal nuovo Calendario Vaccinale per la Vita della Regione Puglia - ed. 2021, approvato con deliberazione della Giunta Regionale a ottobre 2021.
La Regione Puglia ha aggiudicato, mediante il Soggetto Aggregatore Regionale, la gara per l’acquisizione delle varie tipologie di vaccino antinfluenzale che per la stagione 2021-2022 sono:
quadrivalente split (VIQ) per i soggetti dai 6 mesi di età;
quadrivalente adiuvato (VIQa) per i soggetti > 65 anni;
quadrivalente su colture cellulari (VIQcc) prioritariamente per operatori sanitari;
quadrivalente vivo attenuato (LAIV) per i soggetti tra 2 e l7 anni;
quadrivalente ad alto dosaggio (VIQhd) indicato nella popolazione > 65 anni (specificamente per anziani ricoverati in strutture residenziali a lungo termine).
Il coordinamento dell’andamento della campagna di vaccinazione a livello regionale è assicurato dalla Commissione Regionale Vaccini con il supporto della competente Sezione Promozione della Salute e del Benessere. Per tali attività la Commissione è allargata anche alla partecipazione di altre figure, esperti e rappresentanti di categoria. Il coordinamento delle attività a livello territoriale è affidato ai Servizi Igiene e Sanità Pubblica (SISP) dei Dipartimenti di Prevenzione delle Aziende Sanitarie Locali territorialmente competenti. I Dipartimenti del Farmaco (ove costituiti), le Aree Gestione Servizio Farmaceutico e le Farmacie ospedaliere assicurano la partecipazione attiva e la collaborazione a tutte le attività della campagna di vaccinazione antinfluenzale 2021-2022 a supporto delle necessità organizzative e logistiche dei Dipartimenti di Prevenzione territorialmente competenti. Dopo l’acquisizione dei vaccini, i piani di consegne devono essere definiti dalle ASL, AOU, IRCCS pubblici considerando la calendarizzazione delle attività, l’organizzazione della distribuzione e la capacità di stoccaggio mediante frigoriferi idonei per la conservazione dei vaccini. Le farmacie territoriali e ospedaliere afferenti alle rispettive Aziende Sanitarie, Enti e Istituti del Servizio Sanitario Regionale assicurano la ricezione, la conservazione, la custodia e la movimentazione, nel rispetto delle norme e delle linee guida vigenti, dei vaccini assicurando il tracciamento informatico di tutte le movimentazioni effettuate. Ciascuna Azienda Sanitaria Locale, Azienda Ospedaliero-Universitaria e IRCCS pubblico cura direttamente la distribuzione dei vaccini in favore dei vari attori coinvolti nella somministrazione degli stessi. Ciascuna Azienda Sanitaria Pugliese è organizzata diversamente nella distribuzione dei vaccini ai MMG e PLS, per esempio, per cui nel capoluogo sono le Farmacie Territoriali a fornirli direttamente mentre in altre ASL ciò avviene attraverso gli Uffici di Igiene Territoriali oppure dalla Farmacia Ospedaliera per mezzo dei Distretti Socio Sanitari. Importante è sicuramente consentire l’avvio prioritario della vaccinazione in favore degli “operatori sanitari” e dei soggetti in carico ai Centri specialistici delle Reti di Patologia e alle strutture private e delle strutture sanitarie, socio sanitarie e socio assistenziali del Servizio Sanitario Regionale. In questo contesto si rammenta che in Puglia, la Legge Regionale 19 giugno 2018, n. 27 recante «Disposizioni per l’esecuzione degli obblighi di vaccinazione degli operatori sanitari» ha introdotto l’obbligo di vaccinazione per tutti gli operatori sanitari impegnati nei servizi erogati nell’ambito del Servizio Sanitario Regionale, al fine di «prevenire e controllare la trasmissione delle infezioni occupazionali e degli agenti infettivi ai pazienti, ai loro familiari, agli altri operatori e alla collettività». Inoltre, con regolamento regionale 25 giugno 2020, n. 10 sono state definite le modalità operative per l’esecuzione delle vaccinazioni indicate dal Piano Nazionale Prevenzione Vaccinale [3] negli operatori sanitari e la conseguente idoneità allo svolgimento della mansione e della specifica attività.
Il regolamento regionale si applica agli “operatori sanitari” del Servizio Sanitario Regionale e agli studenti dei corsi di laurea dell’area sanitaria e prevede che la vaccinazione antinfluenzale debba essere effettuata annualmente da tutti gli operatori sanitari. La vaccinazione in favore di questa categoria di lavoratrici e di lavoratori è eseguita dai Medici competenti e/o dalle Direzioni Mediche o Sanitarie di ciascun Ente o Struttura.
Relativamente alle altre categorie di vaccinare, la Regione Puglia è così organizzata:
vaccinazione donne in gravidanza: è garantita a tutte le donne che all’inizio della stagione epidemica si trovino in gravidanza e nel periodo “postpartum”. I medici di medicina generale che hanno in cura le donne in stato di gravidanza o nel periodo “postpartum” devono assicurare la somministrazione tempestiva del vaccino antinfluenzale provvedendo alla contestuale registrazione dei dati. I medici specialisti, invece, assicurano l’informazione e sensibilizzazione delle donne in stato di gravidanza circa l’importanza della vaccinazione antinfluenzale;
vaccinazione pazienti ricoverati: è garantita a tutti i pazienti di età superiore a 6 mesi, che all’inizio della stagione epidemica si trovino in dimissione dalle strutture di ricovero pubbliche e private accreditate della Regione Puglia e che appartengono alle categorie a rischio della Circolare ministeriale. A tal fine, le Direzioni Sanitarie prendono accordi con il SISP territorialmente competente per l’organizzazione delle attività finalizzate a garantire quanto indicato;
vaccinazione categorie a rischio: fatto salvo quanto indicato ai paragrafi precedenti, la vaccinazione dei soggetti appartenenti alle categorie a rischio della Circolare ministeriale nonché i soggetti con età pari o superiore ai 60 anni dovrà essere assicurata prioritariamente dai Medici di Medicina Generale e dai Pediatri di Libera Scelta;
vaccinazione in ambito lavorativo non sanitario (es. forze dell’ordine, servizi pubblici, associazioni di volontariato, etc): la vaccinazione a queste categorie di lavoratori dovrà essere eseguita dai medici competenti o dal personale sanitario in servizio presso ciascun ente o soggetto pubblico o privato previo approvvigionamento dei vaccini presso il Dipartimento di Prevenzione territorialmente competente;
vaccinazione donatori di sangue: la vaccinazione a questa categoria dovrà essere eseguita dai centri immunotrasfusionali pubblici laddove il soggetto non abbia già effettuato la vaccinazione antinfluenzale per altro motivo. A tal fine, le direzioni sanitarie e le direzioni delle strutture immunotrasfusionali prendono accordi con il SISP per l’organizzazione delle attività finalizzate a garantire quanto indicato;
vaccinazione bambini: la vaccinazione dei bambini in età compresa tra i 6 mesi e i 6 anni dovrà essere garantita da parte dei Pediatri di Libera Scelta e da parte dei Centri Vaccinali ASL;
vaccinazione soggetti di età > 60 anni: la vaccinazione dei soggetti di età pari o superiore ai 60 anni è effettuata dai Medici di Medicina Generale, con particolare riferimento ai soggetti affetti da patologie che aumentano il rischio di complicanze da influenza.
Si conferma, dunque, la centralità del ruolo dei Medici di Medicina Generale e dei Pediatri di Libera scelta nell’offerta attiva della vaccinazione antinfluenzale e si ribadisce, pertanto, l’impegno fondamentale dei MMG/PLS per il raggiungimento degli obiettivi di copertura individuali, distrettuali, aziendali e regionali garantendo la chiamata attiva dei soggetti di propria competenza, la partecipazione alla campagna di comunicazione e partecipando attivamente alle azioni finalizzate al potenziamento e alla diversificazione delle modalità di offerta della vaccinazione. La Regione Puglia è una delle regioni che per prime si è dotata di una anagrafe regionale vaccinale (il sistema GIAVA) che per la prima volta, con il coinvolgimento delle softwarehouse dei Medici di medicina generale e dei Pediatri di libera scelta, ha reso possibile una rilevazione estremamente puntuale delle coperture in una sorta di Cooperazione Operativa. Il neo di detto sistema è l’assenza, però, della gestione del “magazzino vaccini” dei MMG e PLS: ciò sarebbe di fondamentale utilità perché l’acquisizione e la gestione informatica di questo dato consentirebbe in tutta la Regione, di evidenziare, per esempio le coperture per singolo medico di famiglia e non più solo per Asl. In Puglia ci sono medici con oltre il 95% di vaccinati tra i loro assistiti ultra 65enni e medici che non arrivano al 15%. Ne conseguono le grandi potenzialità, anche comunicative, che un’analisi così puntuale del dato potrebbe offrire ai decisori che in tal modo orienterebbero le loro azioni in maniera estremamente mirata.
In Puglia, durante l’ultima campagna vaccinale, sono state somministrate in totale 534.060 dosi di vaccino a soggetti con età ≥ 65 anni. La copertura vaccinale nei soggetti con età ≥ 65 anni è risultata pari al 58,7% [5] e la Tabella I descrive le coperture vaccinali delle singole ASL della Regione Puglia.
La Figura 1 descrive, invece, il trend delle coperture vaccinali nei soggetti ultrasessantacinquenni dalla stagione 2008/09 alla stagione 2021/22. Nella stagione 2021/2022 abbiamo assistito a una diminuzione della copertura vaccinale di tre punti percentuali rispetto alla precedente stagione, probabilmente dovuto alla concomitante campagna vaccinale anti SARS-CoV-2 che con Circolare Ministeriale del 08.10.2021, ha raccomandato la somministrazione della dose addizionale o booster ai soggetti ultraottantenni, agli operatori sanitari e ai soggetti fragili. Allo stesso tempo, con circolare del 02.10.2021 il Ministero della Salute ha divulgato, altresì, la nota congiunta Consiglio Superiore di Sanità, AIFA e ISS recante “Intervallo temporale tra la somministrazione dei vaccini anti-SARS-CoV-2/COVID-19 e altri vaccini” al fine di rendere possibile la co-somministrazione di vaccini antinfluenzali con vaccini anti SARS-CoV-2/COVID-19 per la popolazione target che rientra nelle stesse categorie di rischio e per cui è prevista la somministrazione della “dose addizionale” o della “dose booster”. L’inizio della campagna vaccinale antinfluenzale ha visto una buona adesione della popolazione adulta/anziana e dei bambini, sicuramente incentivata dai propri MMG o PLS. Ai primi di novembre 2021, nel pieno della campagna antinfluenzale, è stato siglato l’accordo tra la Regione Puglia e le organizzazioni sindacali dei MMG per la somministrazione delle terze dosi anti covid ai soggetti anziani e fragili. Purtroppo la raccomandazione del Ministero sulla possibilità della co-somministrabilità non è stata recepita dalla grande totalità dei MMG con il risultato che è stata data precedenza alla somministrazione delle terze dosi con conseguente calo delle vaccinazioni antinfluenzali. I Dipartimenti di Prevenzione hanno cercato di rimediare negli Hub di popolazione attraverso l’offerta attiva della vaccinazione antinfluenzale in concomitanza delle terze dosi anti covid, ma i risultati non sono stati sufficienti a recuperare percentuali di copertura vaccinale adeguati. Il risultato è stato purtroppo una copertura vaccinale in questa fascia di età più bassa rispetto all’anno precedente.
La Tabella II riporta le dosi somministrate nei soggetti a rischio, per categoria: il totale delle dosi somministrate è stata di 974.898 [4].
Nel corso della stagione influenzale 2020/2021 erano state somministrate 1.004.653 dosi di vaccino anti-influenzale, di cui 28.872 a personale sanitario.
Al fine di aumentare l’offerta vaccinale, la Commissione Regionale Vaccini e i SISP dei Dipartimenti di Prevenzione delle ASL hanno condiviso la necessità di individuare nuove modalità organizzative utili per ampliare e potenziare l’offerta vaccinale nel territorio pugliese. Pertanto, sono state condivise ipotesi organizzative come quella della realizzazione di un gruppo di coordinamento distrettuale: con lo scopo di garantire un monitoraggio costante dell’andamento della campagna di vaccinazione antinfluenzale in ciascun territorio, si ritiene di dover attivare gruppi di coordinamento in tutti i Distretti Socio Sanitari delle ASL, costituiti dal Direttore del Distretto o suo delegato e dal Responsabile dell’UDMG del Distretto Socio Sanitario. Ciascun gruppo deve assicurare:
la rilevazione della popolazione > 60 anni di ciascun medico al 1° settembre e la definizione dell’obiettivo “aggiuntivo” di copertura, rispetto a quello raggiunto nella stagione precedente, per ciascun medico;
la verifica settimanale dell’andamento della campagna vaccinale, sulla scorta della reportistica generata dal sistema informativo “GIAVA”, valutando, in particolare, il rapporto dosi ricevute/dosi somministrate e la progressione del dato di copertura;
l’attivazione del Servizio Igiene e Sanità Pubblica aziendale per concordare e avviare tutte le azioni ritenute necessarie al superamento di eventuali criticità di percorso;
il recupero delle informazioni necessarie alla verifica del raggiungimento degli obiettivi individuali dei medici insistenti nel Distretto Socio Sanitario e degli obiettivi distrettuali anche ai fini del riconoscimento di quanto stabilito dalla contrattazione regionale.
È necessario altresì riorganizzare i Punti Vaccinali: al fine della realizzazione di una efficace campagna vaccinale, è necessario che le ASL prevedano l’utilizzo della rete dei Punti Vaccinali di Popolazione (Hub vaccinali) organizzata per la campagna di vaccinazione anti-SARS-CoV-2/COVID-19, nonché la rete dei Punti Vaccinali locali afferenti ai SISP/Dipartimenti di Prevenzione ASL.
L’esperienza della campagna vaccinale anti-COVID ha permesso che venisse finalmente accettata l’ipotesi di vaccinare al di fuori dell’ambulatorio vaccinale. Sono stati infatti attivati i Centri Specialistici per la vaccinazione di particolari categorie a rischio come per esempio i dializzati o gli oncologici; abbiamo vaccinato negli Ospedali sia gli Operatori Sanitari sia particolari gruppi a rischio che necessitavano della vaccinazione in ambiente protetto; hanno vaccinato i MMG nei propri ambulatori ma anche in sedute domiciliari per i pazienti allettati o particolarmente fragili; abbiamo vaccinato nelle RSA e RSSA, negli “Hub” (Palazzetti dello Sport, palestre delle scuole, centri polivalenti, ecc.); abbiamo vaccinato in modalità drive in ampi parcheggi. Tutto ciò ha maggiormente istituzionalizzato i rapporti di collaborazione tra la medicina generale, gli specialisti e i Dipartimenti di Prevenzione in un quadro di potenziamento della Sanità Pubblica Territoriale che deve essere sicuramente applicato per la campagna vaccinale antinfluenzale.
Importante è la comunicazione, così come suggerito anche dalla circolare ministeriale che raccomanda un rafforzamento delle attività di comunicazione e di educazione, suggerendo di porre una specifica attenzione al superamento delle disuguaglianze di accesso legate a fattori culturali, linguistici, socio-economici e logistici. A tal fine, il Ministero suggerisce di adottare modalità di condivisione e partnership con organizzazioni/associazioni di utenti e stakeholder, coinvolgendo testimonial e opinion makers noti ai diversi gruppi target, come per esempio è stata la campagna vaccinale del 2019-2020 che ha visto protagonista, per la Regione Puglia, Lino Banfi.
In questo contesto comunicativo va rivalutato il ruolo della percezione del rischio che le persone hanno nei confronti di queste malattie. Il Covid ha avuto un forte impatto emotivo sulla popolazione a tal punto che l’alta percezione del rischio della malattia da covid ha portato la popolazione ad accettare la vaccinazione in maniera consapevole e incondizionata. Per malattie come l’influenza, l’herpes zoster, la pertosse o le infezioni da pneumococco, il rischio viene ampiamente sottovalutato. La seconda ricerca realizzata dal Censis sulle opinioni sull’influenza e i comportamenti degli italiani over 50 e sulla propensione alla vaccinazione antinfluenzale indica, infatti, che “l’influenza tutti la conoscono, ma pochi la temono”.
Dobbiamo insistere e continuare a sottolineare l’importanza della “chiamata attiva” alla vaccinazione e il “sollecito” di questa, non dimenticandoci che “l’invito alle persone obiettivo dei programmi vaccinali” fa parte dei nuovi Livelli Essenziali di Assistenza. Si comprende, dunque, che la mancata chiamata attiva alla vaccinazione per un avente diritto, come lo è appunto l’anziano, costituisce un diritto negato al cittadino di cui tutta la “filiera” del SSN e del SSR ne sono i responsabili. La chiamata attiva, infatti, è tra gli interventi di promozione delle vaccinazioni risultati più efficaci. La Circolare ministeriale raccomanda un aumento del coinvolgimento dei Medici di Medicina Generale e dei Pediatri di Libera Scelta e la sensibilizzazione dei Medici specialisti ospedalieri, delle Associazioni dei malati, delle Associazioni dei cittadini e delle Associazioni per gli anziani sull’importanza di incrementare la compliance alla vaccinazione antinfluenzale nei pazienti fragili, visto anche il raggiungimento, lo scorso anno, di basse coperture vaccinali in questi pazienti [7].
Continua a esserci la necessità di avere anagrafi vaccinali informatizzate, quanto più complete e interoperabili possibili per consentire l’aggiornamento in tempo reale del dato, facilitando le analisi sulle coperture e, quindi, eventuali interventi correttivi mirati in collaborazione con tutti gli attori coinvolti. L’informatizzazione inoltre potrebbe anche migliorare la gestione clinica del paziente, rendendo disponibili le informazioni sul suo stato immunitario, oltre a velocizzare le pratiche amministrative e facilitare gli interventi di recall al paziente, con programmi automatici per l’invio di email o sms.
È necessario continuare a sostenere il concetto dell’innovazione. Sicuramente nell’ultimo periodo sono stati fatti passi da gigante in questo settore perché oltre a una innovazione organizzativa raggiunta, grazie anche all’esperienza Covid, ci sono state importanti novità da un punto di vista tecnologico con l’introduzione in primis di vaccini nuovi, come quello anti-covid, poi con l’introduzione di nuovi vaccini più efficaci. Adesso è fondamentale fare un ulteriore sforzo da parte delle comunità scientifiche affinché venga studiata l’eventuale co-somministrabilità dei vari vaccini con la vaccinazione antinfluenzale ma soprattutto uno sforzo da parte degli attori affinchè dette co-somministrabilità vengono eseguite. Ciò comporterebbe una maggiore adesione della popolazione anziana e fragile alle vaccinazioni raccomandate [7], in considerazione del ridotto numero di accessi richiesti, e una maggiore rapidità nel raggiungimento della protezione contro le malattie prevenibili da vaccinazione.
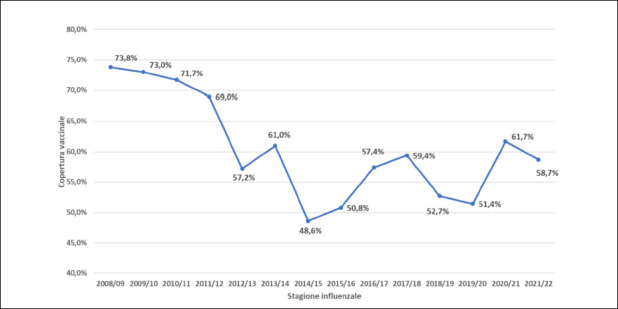
Trend delle coperture vaccinali nei soggetti ≥ 65 anni. Regione Puglia, anni 2008-2022.
Coperture vaccinali nei soggetti con età ≥ 65 anni, per ASL di residenza. Regione Puglia, stagione influenzale 2021/2022.
| ASL | Popolazione over65 (ISTAT 2021) [6] | N. Vaccinati over 65 | CV (%) |
|---|---|---|---|
| BA | 276.781 | 170.365 | 61,6 |
| BR | 91.506 | 51.684 | 56,5 |
| BT | 77.568 | 45.961 | 59,3 |
| FG | 134.001 | 70.703 | 52,8 |
| LE | 195.166 | 112.905 | 57,9 |
| TA | 134.374 | 82.442 | 61,4 |
| PUGLIA | 909.396 | 534.060 | 58,7 |
Dosi di vaccino anti-influenzale somministrate per categoria target. Regione Puglia, stagione influenzale 2021/2022.
| Categoria | 2021/2022 |
|---|---|
| Soggetti di età pari o superiore ai 65 anni | 534.060 |
| Soggetti di età compresa tra 60 e 64 anni | 87.143 |
| Soggetti di età compresa tra 6 mesi e 60 anni con condizioni di rischio | 25.077 |
| Donne in gravidanza | 701 |
| Individui di qualunque età ricoverati presso strutture lungo degenti | 1.933 |
| Medici e personale sanitario di assistenza | 33.193 |
| Familiari e contatti di soggetti ad alto rischio | 18.404 |
| Soggetti addetti a servizi pubblici di primario interesse collettivo | 30.725 |
| Personale che per motivi di lavoro è a contatto con animali che potrebbero costituire fonte di infezione | 779 |
| Donatori di sangue | 653 |
| Popolazione generale (escluse le categorie di cui sopra) | 242.230 |
| Totale | 974.898 |
Il grande dibattito sulle vaccinazioni che ha caratterizzato l’ultimo decennio, nel nostro come in altri paesi occidentali, è stato attraversato negli anni più recenti da alcune importanti trasformazioni. La prima può collocarsi nel momento dell’approvazione della Legge 31 luglio 2017, n. 119 [1], con cui si è stabilita non solo l’obbligatorietà della vaccinazione ai fini della iscrizione scolastica, ma anche un calendario vaccinale più ricco e ampliato a tutte le età della vita. Il secondo momento è certamente rappresentato dall’irrompere della pandemia da COVID-19 e dal ruolo strategico assunto dai nuovi vaccini, sperimentati in tempi brevissimi, e dalla massiccia campagna vaccinale nell’arginare le conseguenze più problematiche di questo momento di vera e propria cesura, sperimentato a livello planetario.
Certo, l’esperienza della grande adesione alla campagna vaccinale anti-COVID, pur non esente dall’opposizione di una frangia di no vax, può aver contribuito a modificare l’atteggiamento complessivo della popolazione nei confronti di quello che si è rivelato ai più come uno strumento strategico di prevenzione [2, 3].
E la vaccinazione antinfluenzale, la più diffusa e comune delle vaccinazioni per gli adulti, ha mostrato un andamento in cui è presente un innalzamento significativo delle coperture nell’anno che coincide con quello della piena pandemia: si registra infatti il passaggio dal 16,8% del 2019-2020 al 23,7% del 2020-21 per quel che riguarda la popolazione generale e dal 54,6% del 2019-2020 al 65,3% del 2020-21 per gli over 64enni. È probabile che tale recupero sia, almeno in parte, dovuto alla co-somministrazione o alla volontà di essere protetti almeno dall’influenza stagionale per facilitare la diagnosi differenziale rispetto al COVID.
Proprio per il suo essere una sorta di archetipo delle vaccinazioni per adulti, e la più ampiamente diffusa tra esse, l’atteggiamento degli italiani nei confronti di questa misura strategica e familiare di prevenzione è da anni oggetto di studi e di approfondimenti [4].
Considerare il punto di vista dei cittadini sulla vaccinazione antinfluenzale è dunque importante, così come valutare le conoscenze e l’atteggiamento che stanno alla base dei comportanti preventivi della popolazione e soprattutto degli anziani, che ne sono i principali fruitori, anche per comprendere se, e in che misura, l’esperienza relativa alla vaccinazione durante la pandemia potrà nel tempo modificarli.
Molti sono gli spunti offerti in tal senso da una ricerca del Censis della fine del 2019 su un campione di 1.000 individui, rappresentativo della popolazione italiana di 50 anni e più, sulle opinioni e le esperienze della popolazione adulta e anziana rispetto alla influenza e alla vaccinazione antinfluenzale.
In particolare, l’atteggiamento verso quest’ultima appare fortemente condizionato dalla percezione della gravità dell’influenza: si tratta di una tra le patologie più conosciute ma è incerta la consapevolezza delle sue possibili conseguenze e delle specifiche condizioni di rischio (come età e patologie croniche). È vero che è maggioritaria (53,1%) la quota di chi è consapevole del fatto che può essere una malattia anche molto grave in base alle condizioni di chi si ammala (persone anziane, malati cronici) ed è pari al 34,5% quella di chi ritiene che la gravità dell’influenza dipenda dal tipo di virus in circolazione. Tuttavia, anche se minoritaria (12,3%), la percentuale di chi minimizza la gravità dell’influenza tende a crescere tra i meno istruiti (17,2%) e proprio tra i più anziani (14,8%) che rappresentano invece la popolazione potenzialmente più a rischio. Si tratta forse di una gravità attribuita piuttosto generica, perché la consapevolezza degli intervistati in merito alle specifiche complicanze dell’influenza appare articolata: mentre ci sono pochi dubbi sul rapporto tra influenza e complicanze che hanno a che vedere con il sistema respiratorio, qualche incertezza emerge quando si parla di altre malattie, per esempio, in merito alle possibili complicanze cardiocircolatorie. Più che altro è considerata rischiosa sulla carta, ma alla maggioranza non fa paura (57,9%) (e ancor meno ai soggetti più a rischio over 75 e con licenza media) e non è un caso che sia affrontata soprattutto con strategie di autocura (1 su 4 consulta il medico e il 45% solo se i sintomi peggiorano).
Come ci si difende dunque da una malattia di cui si tende a riconoscere la potenziale gravità legata alle diverse complicanze, ma che, nei fatti, non si teme particolarmente?
È importante notare che la strategia ritenuta più efficace è proprio la vaccinazione antinfluenzale, che, peraltro, praticamente tutti affermano di conoscere (99,2%); lo dice il 61,1% del campione e, in misura ancora maggiore, gli intervistati con il livello di istruzione più elevato (Tab. I). La vaccinazione è inoltre richiamata principalmente dagli uomini (66,9% contro 56,5% delle donne) e da coloro che hanno dai 65 ai 75 anni (68,2%).
Comportamenti sono più efficaci per difendersi dal rischio di contrarre l’influenza, per titolo di studio (val. %).
| Fino alla licenza media | Diploma | Laurea e oltre | Totale | |
|---|---|---|---|---|
| Vaccinarsi contro l’influenza stagionale | 54,0 | 62,6 | 66,1 | 61,1 |
| Lavarsi spesso le mani | 34,1 | 39,1 | 44,4 | 39,0 |
| Evitare di prendere freddo | 24,6 | 16,7 | 11,7 | 17,6 |
| Non stare a contatto con persone che hanno l’influenza | 42,4 | 46,4 | 46,4 | 45,4 |
| Assumere regolarmente vitamine | 10,1 | 12,8 | 10,5 | 11,6 |
| Non fumare | 11,2 | 7,2 | 3,8 | 7,5 |
| Altro | 2,2 | 0,9 | 2,1 | 1,5 |
N.B. Il totale è diverso da 100 perché erano possibili più risposte. Fonte: Indagine Censis, 2019
Nella gerarchia di efficacia rispetto alle misure per prevenire l’influenza, è dunque riconosciuto il valore della vaccinazione, ma di nuovo, tra i soggetti per cui si ritiene indicata, sono citati soprattutto coloro che soffrono di malattie respiratorie (il 94,6% degli intervistati ritiene che si tratta dei soggetti per i quali è consigliabile vaccinarsi contro l’influenza) e poi i cronici (80%) e gli anziani (87%).
L’informazione sulla vaccinazione antinfluenzale rappresenta dunque un patrimonio condiviso, anche se i destinatari prevalenti sono, secondo gli italiani, quelli per i quali è prevista la vaccinazione gratuita e soprattutto coloro che sono affetti da patologie legate all’apparto respiratorio. Scarsa la consapevolezza sul rischio di alcune condizioni, come la gravidanza ma anche il diabete.
È interessante notare che la fonte informativa di gran lunga prevalente sulla vaccinazione antinfluenzale risulta essere il Medico di Medicina Generale (MMG), citato dal 69,8% degli intervistati, più frequentemente dai rispondenti anziani e anche dai meno istruiti (rispettivamente 73,6 e 76,8%). Marginale il richiamo ad altri professionisti della sanità, e anche il servizio vaccinale delle Asl è indicato come fonte informativa sulla vaccinazione antinfluenzale da una quota molto ridotta (6,9%). La seconda fonte è invece rappresentata dai media tradizionali, televisione e radio (33,8%), in questo caso citati in misura maggiore dai meno anziani. Il 9,5% ha ricevuto le informazioni di cui dispone da amici, familiari, conoscenti, in particolare i più istruiti. Solo il 2,1% è stato informato della vaccinazione attraverso i nuovi media (siti web, social network, blog), dato in parte ascrivibile alle caratteristiche del campione sotto il profilo dell’età (dai 50 anni in su), ma con ogni probabilità legato principalmente al ruolo centrale che il MMG esercita rispetto alla vaccinazione antinfluenzale anche sotto il profilo della somministrazione (nel campione interpellato l’80,4%, che sale all’86,9% tra gli over 74enni, ha effettuato la vaccinazione antinfluenzale presso lo studio del proprio medico di medicina generale).
La centralità di questo professionista emerge anche dal richiamo al peso delle sue indicazioni e dei sui consigli nell’indirizzare i pazienti verso la decisione di vaccinarsi.
Un primo aspetto dell’atteggiamento verso la vaccinazione antinfluenzale è dunque legato al rischio attribuito alla patologia che essa previene.
Insieme alla questione strategica della conoscenza e dell’informazione, è emerso che, in tale atteggiamento, appare rilevante anche il tema chiave della percezione del proprio personale rischio, legata a una concezione soggettiva della età e della propria vulnerabilità alla malattia.
Solo il 22,8% afferma di vaccinarsi contro l’influenza a causa della propria condizione di cronicità, mentre la motivazione più citata è semplicemente quella di evitare di ammalarsi (46,6%). E, d’altra parte, la quota maggiore (45,1%) tra chi ha deciso di non vaccinarsi contro l’influenza motiva la sua scelta con il fatto di non sentirsi un soggetto a rischio (Fig. 1).
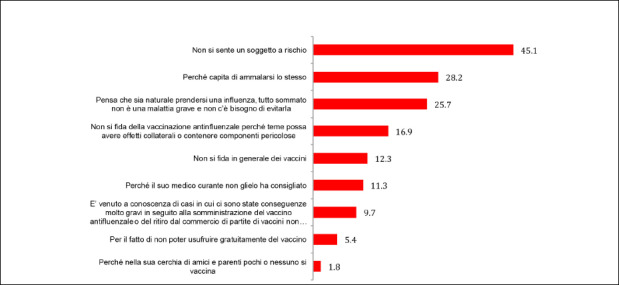
Gli elementi che contribuiscono alla scelta di non vaccinarsi contro l’influenza (N = 48,5%) (val. %). Fonte: Indagine Censis, 2019.
È evidente che le opinioni e i comportamenti relativi alla vaccinazione antinfluenzale espressi dagli italiani si inscrivono in un contesto più generale, che ha a che vedere con l’atteggiamento complessivo nei confronti della vaccinazione come pratica preventiva.
Va intanto segnalato che, seppure a fronte della tendenza prevalente ad affermare l’efficacia delle strategie di prevenzione basate sugli stili di vita, seguita dal richiamo alla prevenzione secondaria basata su controlli in assenza di sintomi (screening, check- up, esami del sangue, esami diagnostici strumentali, ecc.), non è irrilevante l’opinione di chi sottolinea l’importanza della vaccinazione, che un italiano su 4 ritiene efficace come strumento per garantire un buono stato di salute a se stessi e alla propria famiglia. Peraltro, si tratta di una quota che cresce al crescere del livello di istruzione (32,2%) (Tab. II).
Le strategie di prevenzione ritenute efficaci per assicurare un buono stato di salute a se stessi e alla propria famiglia, per titolo di studio (val.%).
| Fino alla licenza media | Diploma | Laurea e oltre | Totale | |
|---|---|---|---|---|
| Preferisco prevenire l’insorgenza delle malattie ricorrendo alla vaccinazione | 22,8 | 25,5 | 32,2 | 26,3 |
| Preferisco prevenire l’insorgenza delle malattie facendo controlli preventivi (screening, check- up, esami del sangue, esami diagnostici strumentali, ecc.) | 27,5 | 37,6 | 41,8 | 35,9 |
| Preferisco prevenire l’insorgenza di malanni/virus mantenendo un’alimentazione sana | 52,2 | 40,9 | 37,7 | 43,1 |
| Preferisco prevenire l’insorgenza di malanni/virus assumendo vitamine ed integratori alimentari | 10,9 | 17,8 | 13,4 | 15,0 |
| Preferisco prevenire l’insorgenza di malanni/virus facendo attività fisica | 15,9 | 18,3 | 15,5 | 17,1 |
| Preferisco prevenire l’insorgenza di malanni/virus evitando comportamenti a rischio quali fumo e alcool | 21,7 | 21,1 | 30,1 | 23,3 |
| Non ho interesse per la prevenzione, preferisco risolvere il problema nel momento in cui si presenta | 10,9 | 6,2 | 5,9 | 7,4 |
N.B. Il totale è diverso da 100 perché erano possibili più risposte. Fonte: Indagine Censis, 2019
Le opinioni degli intervistati sulla vaccinazione antinfluenzale riflettono poi la tendenza culturale diffusa, che vede il prevalere di coloro che si fidano abbastanza delle vaccinazioni in generale (53,2%), a fronte di quote meno rilevanti che si esprimono totalmente a favore o contro le vaccinazioni.
Infatti, circa un terzo dei rispondenti (32,7%) afferma di fidarsi molto delle vaccinazioni e il livello di massima fiducia cresce all’aumentare del titolo di studio e tra i più anziani, con un picco tra i 65-74enni (40,8%).
La parte restante indica di fidarsi poco e per nulla (14,1%), e si tratta più spesso dei rispondenti del Centro (16,8%), dei meno istruiti (17,3%), dei 60-64enni (21,0%) e delle donne (16,7%).
E rispetto al valore e al peso attributo alla vaccinazione antinfluenzale, vanno considerati poi i comportamenti nei confronti delle vaccinazioni tout court, che appaiono abbastanza articolati a fronte, ancora una volta, di un atteggiamento comunque in larga parte positivo. Infatti:
il 39,5% afferma di fidarsi sempre e comunque delle vaccinazioni (più alta la quota dei rispondenti che hanno dai 65 ai 74 anni (41,9%) e dei laureati (41,8%);
il 30,0% è favorevole solo alle vaccinazioni gratuite coperte dal SSN;
il 25,7% decide di volta in volta (in particolare i rispondenti dai 60-64 anni (30,4%), le donne (28,6%) e coloro che hanno un tiolo di studio più basso (28,6%);
solo il 4,8% ammette di essere contrario alle vaccinazioni perché rischiose, percentuale che sale al 9,4% tra i meno istruiti.
I tratti di questa cultura della vaccinazione, in cui è presente ma minoritaria la componete della cultura no vax, ed è certamente rilevabile un bisogno non sempre soddisfatto di informazione, ma anche di validazione delle informazioni, per poter meglio decidere a livello personale l’adesione alla prevenzione vaccinale, si sono manifestati anche durante la campagna vaccinale contro il SARS-CoV-2.
Il tratto che rimane sullo sfondo, trasversale sia nei confronti della vaccinazione in generale e di quella antinfluenzale in particolare, è quello di un atteggiamento in cui è rilevante la concezione soggettiva della propria vulnerabilità alla malattia e un approccio personale verso la vaccinazione e sulla scelta di vaccinarsi. La dimensione culturale e quella dell’informazione assumono dunque un valore strategico, in grado di guidare le scelte e motivare i comportamenti.
Tuttavia, il dato sull’ampia copertura vaccinale raggiunta durante la pandemia mette in rilievo una importante e diffusa assunzione di fiducia collettiva nei confronti delle vaccinazioni da parte degli italiani. Fiducia che probabilmente avrà un peso nell’indirizzare l’atteggiamento e il valore attribuito anche alla vaccinazione antinfluenzale e alla prevenzione più in generale, anche alla luce della percezione di una maggiore fragilità rispetto alle malattie da tutti sperimentata durante la fase pandemica.
L’esitazione vaccinale rappresenta un fenomeno molto complesso, che coinvolge la società tutta e che raramente ha visto soluzione di continuità dalla scoperta dei vaccini [1]. Il fenomeno, definito in inglese come Vaccine Hesitancy e in italiano come “esitazione vaccinale” (termine che comprende i concetti di indecisione, incertezza, ritardo, riluttanza), è strettamente legato ai differenti contesti, con diversi determinanti: periodo storico, aree geografiche, situazione politica.
L’opposizione ai vaccini non nasce, infatti, con lo studio del 1998 (ritirato) del medico (radiato) Andrew Wakefield, che ha contribuito in modo rilevante a una drammatica diminuzione delle pratiche vaccinali e conseguenti epidemie dagli anni ’90 di patologie eliminabili quali il morbillo, la varicella, la rosolia congenita e molte altre: si tratta di una storia che perdura da almeno due secoli in cui si riconoscono fenomeni ricorrenti.
Kant e Rousseu criticarono la pratica vaccinale in quanto ‘innaturale’, nel corso dell’ottocento nel Regno Unito si ebbero violente rivolte di piazza per richiedere l’abolizione dell’obbligatorietà della vaccinazione antivaiolosa [2]: in sintesi, da quando sono stati sviluppati, i vaccini, sono stati dibattuti da minoranze delle popolazioni che ne hanno, di volta in volta, sminuito l’importanza o messo in dubbio il valore scientifico o espresso sfiducia nei confronti dei loro sostenitori.
L’esitazione vaccinale è un’ampia questione sociale in cui il comportamento individuale ha conseguenze dirette sulla morbosità e mortalità a livello di comunità: vaccini funzionano solo quando sono accettati, pertanto l’esitazione sul vaccino non è una scelta né una questione personale di un individuo, ma richiede sforzi e scelte collettive.
L’accettazione della vaccinazione è un comportamento risultante da un processo decisionale complesso che può essere influenzato e condizionato da una vasta gamma di fattori. Nello sviluppo della definizione di ‘esitazione vaccinale’, un gruppo di lavoro dell’OMS ha esaminato una serie di modelli concettuali [3] concludendo come il modello delle ‘3c’ (complacency, convenience e confidence) sia quello maggiormente sintetico e comprensibile.
La confidence viene definita non solo come la fiducia nell’efficacia e sicurezza dei vaccini ma anche nel sistema decisionale, dalle autorità sanitarie ai professionisti della salute che li propongono; la complacency è la capacità di percepire i rischi legati alle patologie prevenibili con vaccinazione; la convenience si riferisce invece all’accessibilità alla vaccinazione che tiene in considerazione, tra altri fattori, la fruibilità e la qualità dei servizi sanitari, la disponibilità a una eventuale partecipazione alla spesa e la health literacy della popolazione.
Inoltre è necessario ricordare come l’esitazione non sia mai uniforme in una popolazione [4] e come un’analisi accurata dei dati possa rilevare sottogruppi di popolazione con tassi di copertura inferiori al previsto, spesso non definiti dai loro determinanti sociali ma da fattori comportamentali classificati proprio dal livello di fiducia e convenienza.
L’esitazione vaccinale è un problema scottante per i decisori e gli operatori sanitari che affrontano sfide sempre più ardue nella costruzione di relazioni di fiducia con i loro pazienti riflettendo un fenomeno sociale più ampio [5]: lo stato fluido e mutevole delle competenze nella contemporaneità che vede porre sullo stesso livello di credibilità gli studi scientifici, che sono alla base della Evidence Based Prevention, con il numero di like ottenuti su un social network.
In questo contesto, l’educazione e la comunicazione sanitaria rappresentano uno strumento efficace se attentamente pianificate e integrate con un’offerta vaccinale solida e servizi efficienti. Seppur la comunicazione sanitaria sia, oggi, una scienza in rapido mutamento al fine di stare al passo con nuovi modelli di relazione tra professionisti della salute e cittadini, l’esperienza ha dimostrato che alcuni elementi chiave devono essere tenuti in considerazione [6]: la necessità di essere proattivi e la consapevolezza che - soprattutto oggi - la comunicazione è un processo bidirezionale e la mera conoscenza non è sufficiente a modificare i comportamenti.
L’esperienza pandemica ci ha messo negli ultimi anni di fronte ai temi cruciali della comunicazione sia da un punto di vista di politiche sanitarie che di singola relazione: come gli operatori sanitari possano modificare i comportamenti degli individui per soddisfare le esigenze collettive di limitare le malattie, cosa possano fare le autorità sanitarie per aiutare gli operatori sanitari ad affrontare l’esitazione all’interno dei diversi contesti sanitari.
Una strategia di comunicazione, che includa un’adeguata selezione degli strumenti di comunicazione disponibili, dovrebbe essere parte integrante di ogni programma di immunizzazione, affrontando i fattori specifici che influenzano l’esitazione nelle popolazioni target.
Nel marzo 2022 la Società di Igiene, Medicina Preventiva e Sanità Pubblica ha divulgato un position paper sulle azioni da intraprendere per affrontare l’esitazione vaccinale in Italia [7]: tra queste si evidenziano una formazione diffusa interdisciplinare e intersettoriale per facilitare la comprensione di fenomeni complessi e la formazione su Risk communication, Community engagement e Infodemiologia. Proprio in tema di infodemiologia è necessario non dimenticare, trattando di comunicazione sanitaria, l’importante ruolo giocato dai mass media dal momento che se da un lato possono essere veicolo straordinario, a basso costo, di messaggi virtuosi che possono condurre direttamente o indirettamente a modifiche di comportamenti individuali, dall’altro possono avere un impatto drammaticamente negativo sull’esitazione vaccinale laddove rappresentino cassa di risonanza di fake news o ciarlatani.
Questo capitolo si propone di trattare il tema dell’esitazione nel contesto italiano, sottolineandone le caratteristiche più significative, discutendo le posizioni a favore e contrarie agli interventi vaccinali, individuando gli strumenti maggiormente efficaci con particolare attenzione agli aspetti comunicativi.
Negli ultimi anni, numerosi studi hanno esplorato il fenomeno dell’esitazione vaccinale in Italia nella popolazione generale e nei professionisti sanitari. A titolo esemplificativo si possono menzionare alcune tra le survey che hanno maggiormente contribuito all’analisi della situazione italiana.
Una survey nazionale condotta tra dicembre 2016 e aprile 2017 su 3.865 genitori di bambini di età compresa tra 3 mesi e 7 anni ha portato alla luce elevati livelli di esitazione vaccinale con percentuali di genitori esitanti e genitori anti-vaccinisti pari rispettivamente al 32,4 e al 3,6% [8]. Una survey condotta tra settembre e novembre 2017 dall’Istituto Nazionale per l’Analisi delle Politiche Pubbliche ha individuato, invece, su 2.626 partecipanti una quota pari al 19% di soggetti dichiaranti che i vaccini sono dannosi per la salute dell’uomo e del 10% affermanti di non avere fiducia nella comunità scientifica in ambito vaccinale [9]. Lo Moro et al. [10] hanno recentemente indagato l’esitazione vaccinale in circa 1000 studenti in medicina relativamente alla vaccinazione contro il SARS-CoV-2: circa il 7% è risultato esitante. La fiducia posta nell’attività vaccinale nel nostro Paese è passibile di ampi margini di miglioramento. Come sottolineato dal “The State of Vaccine Confidence Project” nel 2016, infatti, l’Italia ha primeggiato in passato in quanto a percentuale di individui in disaccordo sull’importanza dei vaccini per la popolazione pediatrica (15,4% rispetto a una media globale del 5,8%) e di coloro che mettono in dubbio la sicurezza dei vaccini stessi (18,7% rispetto a una media globale del 9,1%) [11, 12]. Negli anni successivi alla suddetta survey, in un’analisi retrospettiva che riporta dati fino al 2019, la fiducia nei vaccini sembrava essere aumentata in Italia [13], ma dati più recenti relativi alle vaccinazioni anti-SARS-CoV-2 introdotte nel 2021 riportano una quota di esitanti vicina al 20% [14].
In misura analoga, numerosi studi hanno approfondito il contributo all’esitazione vaccinale fornito dalla categoria di soggetti che maggiormente dovrebbe rendersi promotrice della bontà e dell’utilità di questo efficace intervento di prevenzione primaria. Una survey condotta da Filia et al. nel 2016 su 903 pediatri ha riportato come la stragrande maggioranza (95,3%) di essi fosse completamente a favore dei vaccini, il 66% di questi abbia dichiarato di avere conoscenze adeguate su vaccinazioni e malattie prevenibili grazie a esse, ma anche come solo l’8,9% abbia poi risposto correttamente ad alcune affermazioni relative a sicurezza ed efficacia dei vaccini stessi e solo il 5,4% abbia identificato in modo appropriato tutte le vere e le false controindicazioni alla vaccinazione. Inoltre, uno su tre ha affermato di non verificare in maniera sistematica l’aggiornamento dello stato vaccinale dei propri assistiti [15]. Mazzilli et al. hanno invece indagato nel 2018 le attitudini di 451 ginecologi in merito alle vaccinazioni per donne in stato di gravidanza, evidenziando come il 61% dei partecipanti non proceda a raccomandare di routine il vaccino antipertussico, per lo più per scarsa conoscenza del vaccino, dei protocolli e delle linee guida [16].
A limitate conoscenze, inevitabilmente, conseguono dati poco incoraggianti sull’adesione ai programmi di vaccinazione dedicati a questa categoria a rischio. Nonostante le raccomandazioni vaccinali per i professionisti sanitari fornite dal Piano Nazionale di Prevenzione Vaccinale (PNPV), infatti, i risultati di una revisione della letteratura hanno confermato come i livelli di copertura vaccinale in questa categoria di soggetti in diverse regioni e città italiane siano bassi e del tutto lontani dagli obiettivi previsti dal PNPV [17], così come confermato da uno studio condotto nel 2018 da Genovese et al. [18]. Nel 2020, Barbadoro et al. hanno analizzato dati ISTAT confermando una bassa adesione dei professionisti sanitari italiani alle raccomandazioni nazionali e internazionali in tema di vaccinazione antinfluenzale, riportando una copertura media del 18,08% (IC 95% 17,09-19,07) [19].
Un contributo a questo risultato sconfortante è probabilmente da ricondurre dalla scarsa percezione del rischio di essere contagiati da una patologia prevenibile mediante vaccino all’interno del setting ospedaliero [20], ancora più evidente in alcuni reparti quali le terapie intensive, il pronto soccorso e l’onco-ematologia e tra il personale del comparto [21]. Al fine di comprendere il fenomeno pare pertanto essenziale esaminare le ragioni sottostanti all’esitazione vaccinale.
La letteratura scientifica internazionale che si pone l’obiettivo di esaminare le ragioni sottostanti l’opposizione ai vaccini da parte di alcune frange della popolazione è ricca e sottolinea come l’esitazione sia influenzata da numerosi fattori quali età, genere, livello di istruzione, percezione della gravità della patologia, cultura e contesto locale, dalle preoccupazioni in merito alla sicurezza e ai possibili eventi avversi e, per quanto riguarda le vaccinazioni contro SARS-CoV-2, dalla rapidità di sviluppo e introduzione sul mercato dei vaccini stessi [11, 14, 22-27].
Dubbi sull’efficacia e sulla sicurezza dei vaccini e l’errata convinzione che alcuni di questi non siano necessari sono motivazioni sufficienti a contrastare l’attività preventiva vaccinale anche per alcuni professionisti sanitari [14], con conseguente minore propensione alla raccomandazione e somministrazione di vaccini e possibilità di influenzare le percezioni del rischio dei loro assistiti [28]. Tra i medici stessi si può evidenziare una differente sensibilità in merito all’utilità delle vaccinazioni, in particolare ne riconoscono maggiormente i meriti i pediatri rispetto ad altri professionisti coinvolti nella prevenzione primaria [28].
Sicurezza ed efficacia sono elementi-chiave dell’esitazione vaccinale anche in altri sottogruppi di popolazione, quali gli adolescenti e i genitori. I primi, evidenziano Cadeddu et al., lamentano quali cause anche carenze informative limitanti le loro possibilità di compiere scelte consapevoli e la paura degli aghi e del dolore associato all’iniezione [29]: su di essi un effetto positivo pare essere esercitato dal contesto famigliare e scolastico qualora questo li indirizzi verso la scelta vaccinale.
Tra i genitori, invece, le cause di esitazione vaccinale sono molteplici e si possono ricondurre in gran parte ai possibili danni che il vaccino può indurre nei loro figli. Vanno ricordate, tra le principali, le seguenti credenze: - i vaccini contengono ingredienti tossici e nocivi per i bambini; - gli effetti collaterali dei vaccini comprendono frequentemente disabilità, sordità, danni mentali, autismo, tumori, coma e morte; - i vaccini compromettono il sistema immunitario o sono in grado di alterare il DNA; - gli stili e l’ambiente di vita sono in grado, senza necessità di ulteriori interventi, di ridurre i rischi legati alle malattie prevenibili mediante vaccino; - alcune malattie non sono particolarmente pericolose da meritare la vaccinazione e/o l’esposizione naturale e la conseguente immunità naturale è preferibile; - non ci si deve fidare di governi e istituzioni in quanto hanno interessi commerciali, economici e con l’industria farmaceutica; - la ricerca scientifica non è moralmente integra quando si parla di vaccini e di eventi avversi ed è talvolta totalmente carente in merito alle conseguenze a lungo termine; - i medici sono guidati da interessi economici e sono poco trasparenti nel discutere gli effetti collaterali, i quali spesso vengono minimizzati o manipolati; - il calendario vaccinale è sovraccarico [11, 27, 30, 31].
La valutazione delle cause di esitazione vaccinale evidenzia, di fatto, come i vaccini per molti individui rimangano un mistero e sia inadeguata la conoscenza di come essi funzionino e vengano prodotti [32]. Queste lacune informative creano un ambiente, favorevole alla nascita di fake news, soprattutto in un contesto mediatico che tende spesso a esagerare i rischi legati all’attività vaccinale [33].
L’analisi delle cause induce inevitabilmente i professionisti di sanità pubblica a ragionare su possibili interventi utili a ridurre il numero di individui esitanti. La letteratura ha evidenziato in più occasioni in passato la carenza di strumenti efficaci nel contrasto della vaccine hesitancy [34]. Una revisione sistematica di Sadaf et al. ha studiato gli effetti degli interventi mirati a ridurre il rifiuto vaccinale da parte dei genitori e ne ha sottolineato la mancanza di evidenze qualitativamente apprezzabili [35], e in misura analoga Jarrett ha riportato come siano poche le strategie esplicitamente disegnate per combattere l’esitazione vaccinale e ancor meno gli studi che ne abbiano quantificato l’impatto [36]. Laddove presenti, le evidenze di elevata qualità sono per lo più pertinenti al contesto statunitense, mentre di minor rilievo paiono essere i dati Europei [11].
La conoscenza delle caratteristiche degli esitanti è il punto di partenza fondamentale per agire con efficacia [37], al punto che tali informazioni insieme alle cause sottostanti all’esitazione vanno inglobate in un approccio al fenomeno metaforicamente di tipo quasi diagnostico per poter poi associare a esso il più appropriato intervento “terapeutico” [32].
Tra gli interventi maggiormente efficaci, in base a un’approfondita revisione della letteratura condotta da Jarrett et al. [36], rientrerebbero gli interventi: - disegnati su e indirizzati a persone non vaccinate e/o esitanti; - volti ad aumentare conoscenze e consapevolezza; - in grado di migliorare la convenience e l’accesso alle vaccinazioni; - indirizzati a sottogruppi di popolazione specifici come i professionisti sanitari; - aventi come core l’obbligo alla vaccinazione o una sanzione in caso di mancato adempimento; - coinvolgenti leader religiosi o di altra natura. Interventi meno efficaci parrebbero essere quelli maggiormente passivi (es. affissione di poster o creazione di siti web) e quelli che prevedono incentivi economici [36], sebbene non vi sia pieno accordo sulla loro inefficacia [38].
La difficoltà nell’individuare azioni fortemente impattanti sul fenomeno dell’esitazione vaccinale non esime dalla possibilità di fornire alcune chiare raccomandazioni:
non è sufficiente la semplice erogazione di informazioni ma è opportuno un approccio integrato [32, 34, 39] che agisca su più fronti e sia improntato sul dialogo con l’assistito [Jarrett, 2015] meglio se con un approccio presuntivo [32], come da indicazioni successive;
evitare gli interventi che alimentano lo scontro tra le fazioni pro e anti-vaccinazione [40];
è fondamentale intervenire sulla Health Literacy. Quando l’alfabetizzazione sanitaria è scarsa ne può risentire non solo la comunicazione tra professionista sanitario e assistito [41, 42], ma anche la fiducia nei vaccini [43], le coperture vaccinali e la suscettibilità nei confronti dei movimenti anti-vaccinali [44, 45]. La leggibilità e la comprensibilità delle informazioni scritte su tematiche vaccinali possono essere oggetto di interventi volti al loro miglioramento in quanto a informazioni più semplici da comprendere corrisponde una maggiore propensione dei lettori a far loro affidamento [44]. A sottolineare l’importanza di tale linea d’azione contribuiscono alcuni studi che mostrano come molte informazioni sui vaccini utilizzino terminologia medica senza alcuna definizione, siano carenti di grafici esplicativi o di raccomandazioni sintetiche [46, 47];
si deve agire sulla formazione dei professionisti sanitari e sulla loro conoscenza delle linee guida. Numerosi studi rivelano una inadeguata conoscenza in ambito vaccinale dei professionisti sanitari [48-50], dato ancor più sconfortante se si considera che un’appropriata conoscenza delle linee guida può aumentare la fiducia nei vaccini [28]. A maggiore conoscenza, inoltre, corrisponde maggiore adesione alle vaccinazioni da parte dei professionisti stessi e maggiore propensione a raccomandare i vaccini ai loro assistiti [28];
l’interazione medico-paziente è cruciale per il cambiamento del pensiero di chi si oppone al vaccino [39, 51, 52] ma va approfondita con cautela ed esperienza. Gli approcci di shared-decision making e in particolare la ricerca di dialogo e condivisione in merito alla scelta tra più alternative in ambito sanitario sono efficaci nell’assistere i pazienti sottoposti a trattamenti ma sono meno noti in merito al contributo che riescono a offrire in ambito vaccinale. Una recente meta-analisi ha indagato come fornire informazioni sulle diverse alternative e aiutare il paziente a chiarirsi e a comunicare i propri valori personali, nel processo che lo porta a prendere una decisione, possano incrementare l’intenzione teorica alla vaccinazione, ridurre le errate percezioni sugli eventi avversi, minimizzare i conflitti decisionali ma non cambiare l’adesione reale alla vaccinazione [31, 53];
gli interventi attraverso i social media hanno buone potenzialità ma rischiano di essere controproducenti [11, 36, 37]. L’approccio all’esitante attraverso i social media può funzionare soprattutto per il coinvolgimento di coloro che hanno già aderito parzialmente al calendario vaccinale. I social media, tuttavia, sono uno dei principali territori di lotta tra le fazioni pro-vaccino e anti-vacciniste e rischiano di essere un territorio scivoloso in cui addentrarsi. La comunicazione nel terzo millennio non può tuttavia esimersi dal passare anche attraverso questi canali pertanto essi devono essere presi in opportuna considerazione da parte dei professionisti sanitari ad esempio per comprendere quali siano le principali preoccupazioni nella popolazione e arrivare pronti a fornire risposte ai dubbi di coloro che esitano di fronte alla vaccinazione [31];
i miglioramenti operativi sono sempre consigliati. Non vi è dubbio che alcune indicazioni operative possano avere benefici importanti nel raggiungimento degli obiettivi vaccinali. Tra queste vanno annoverate il miglioramento dell’attività di reminder [54, 55], la diffusione del calendario vaccinale tra i medici, la riduzione delle problematiche logistiche, l’utilizzo di protocolli standard, l’incremento della partecipazione dei medici di medicina generale e dei pediatri nei sistemi informativi vaccinali [56];
i sistemi informativi vaccinali possono dare un prezioso contributo nella lotta all’esitazione vaccinale. Possono, infatti, svolgere un ruolo importante su diversi fronti: facilitare l’attività di reminder/recall, valutare le coperture vaccinali per area geografica, monitorare gli eventi avversi, gestire le scorte vaccinali, agire in interoperabilità con l’anagrafe e i registri di patologia, studiare le cause di rifiuto/esitazione e le caratteristiche degli esitanti [57];
i fondi pubblici destinati alla ricerca devono essere aumentati. Di fronte alla percezione di un pesante conflitto di interessi tra istituzioni governative, professionisti sanitari e aziende farmaceutiche, il ruolo svolto da queste ultime dovrebbe essere ridimensionato e la ricerca dovrebbe poter procedere speditamente anche e soprattutto su finanziamenti di natura pubblica [32];
l’obbligo vaccinale aumenta le coperture vaccinali ma rischia di allontanare ancor di più gli esitanti. L’introduzione dell’obbligo è in grado di incrementare le coperture vaccinali [58, 59] e può essere considerato eticamente giustificabile [60]. Talvolta, tuttavia, rischia di essere controproducente soprattutto quando colpisce i soggetti categorizzati come esitanti, come è stato osservato in Germania [61], e se viene imposto in un contesto sociale di scarsa fiducia verso il governo e le istituzioni. In tal caso, l’obbligo può avere l’effetto opposto e aumentare la resistenza e l’opposizione all’attività vaccinale [62]. La letteratura qualitativa, infatti, fa emergere come tale imposizione sia percepita da alcuni genitori come una violazione dei loro diritti [63].
L’importanza di una buona comunicazione nel contrasto all’esitazione vaccinale è riconosciuta e condivisa. A puro titolo esemplificativo si può ricordare come, già nel 2012, Leask et al. evidenziassero la necessità di una buona comunicazione con i genitori per l’accrescimento della loro fiducia nei vaccini e il mantenimento di elevate coperture vaccinali in età pediatrica [51]. Le buone norme in ambito comunicativo quando si parla di esitazione vaccinale presentano elementi comuni con quanto già osservato per le altre tipologie di interventi: non è sufficiente e anzi può essere controproducente la semplice proposizione di informazioni [31, 64] e sono relativamente scarse le evidenze di efficacia degli interventi basati sulla comunicazione rivolti agli esitanti [35, 65]. Il contesto in cui tali interventi vengono condotti e la comunicazione del professionista sanitario si trova a operare è, inoltre, gravato da un bilanciamento delle fonti informative non congeniale al buon esito dei programmi di vaccinazione. Frequentemente la popolazione, infatti, mette a confronto le informazioni ufficiali di fonti istituzionali o di professionisti sanitari con quanto reperito sul Web o su riviste non specialistiche senza bilanciare correttamente peso e qualità delle informazioni reperite [30].
Nonostante le premesse possano risultare poco confortanti, alcune utili raccomandazioni nella lotta alla vaccine hesitancy possono essere proposte anche sul fronte della comunicazione:
è fondamentale personalizzare la comunicazione sui destinatari e quindi sugli esitanti. Tra gli approcci da evitare va ricordato: - evitare l’esposizione ripetuta alle fake news perché accresce la loro familiarità e la possibilità che vengano prese per notizie veritiere, - evitare eccessive controargomentazioni a tali falsi miti perché inducono il soggetto a schierarsi sulle posizioni della disinformazione se questa è più semplice, - evitare di evidenziare eccessivamente l’ampia frequenza di comportamenti non desiderabili perché si corre il rischio di farli passare per socialmente accettabili, - evitare i messaggi che criticano pesantemente uno specifico gruppo perché ne rafforzano l’identità e il rifiuto delle argomentazioni contrarie a esso, - evitare di indurre paura perché si possono scatenare risposte difensive e atteggiamenti di chiusura in chi ascolta [11, 66];
il contrasto alla disinformazione è importante ma non sufficiente se ci si limita al singolo tema messo in dubbio. Una comunicazione efficace che si avvale di informazioni evidence-based per contrastare i messaggi che possono disinformare la popolazione generale è imprescindibile per il contenimento delle fake news [22]. Tuttavia, questa attività di debunking non è sufficiente se non si interviene anche e soprattutto sull’ambiente che favorisce la diffusione di tali fake news e sulle predisposizioni emotive che conducono alla loro creazione [32];
il contrasto alla disinformazione può essere un’arma a doppio taglio. È noto da tempo come trascorrere troppo tempo a esaminare e approfondire le fake news sui vaccini rischia di rafforzare queste convinzioni in chi le ascolta [67]. La disinformazione andrebbe identificata, ne andrebbe dichiarata la falsità e poi ci si dovrebbe rapidamente focalizzare sui fatti reali presentandoli in modo che appaiano semplici e comprensibili, rimpiazzando le informazioni errate nelle fake news circolanti [68];
bisogna agire sulla trasparenza delle informazioni. Per aumentare la fiducia nei vaccini le strategie comunicative e l’offerta vaccinale dovrebbero fondarsi su informazioni trasparenti, oneste, accurate, veritiere, multimodali e frequenti attraverso una partnership relazionale tra comunità e professionisti sanitari che faccia dell’inclusività il suo elemento-chiave [22, 37];
non sempre il linguaggio e lo stile comunicativo professionale è il più efficace. Talvolta può essere utile un’informazione presentata con un linguaggio non professionale e uno stile di maggiore immediatezza e di più facile comprensione per la popolazione generale [22];
il fine ultimo dovrebbe essere il potenziamento del pensiero critico. Arede et al., per superare l’esitazione vaccinale, suggeriscono approcci comunicativi a lungo termine che prevedano plurimi canali di comunicazione e siano finalizzati a facilitare lo sviluppo di un pensiero critico e l’accesso all’educazione e alle informazioni in ambito vaccinale, in linea con quanto già approfondito in tema di health literacy [69];
prediligere l’approccio presuntivo o il colloquio motivazionale alla decisione partecipata. L’approccio presuntivo prevede che il professionista sanitario, dialogando, si ponga partendo dal presupposto che la scelta di vaccinarsi sia quella scontata facendo così passare l’atto vaccinale come banale norma sociale. Tale approccio consente di raggiungere il risultato in breve tempo ma rischia di non essere strutturato e di portare l’esitante a sentirsi escluso dal processo decisionale. Un approccio alternativo e in alcuni casi preferibile può essere rappresentato dal colloquio motivazionale che prevede una discussione aperta per far emergere le eventuali preoccupazioni sulla pratica vaccinale e, dopo aver chiesto il permesso di condividere informazioni, affrontarle con un tono improntato al dialogo e alla comprensione [31];
spostare il focus dal vaccino alle malattie che vengono da esso prevenute [31];
incrementare le abilità del professionista sanitario nello story-telling. Tale approccio viene frequentemente utilizzato da chi si oppone alle vaccinazioni con la consapevolezza della sua efficacia nell’influenzare l’opinione dell’ascoltatore. Senza discostarsi dall’evidenza scientifica può quindi essere utile ragionare su un appropriato ricorso a elementi di pathos e ad aneddoti personali per far presa sull’attenzione dell’individuo esitante [31, 32], ricordando sempre di non utilizzare la paura come arma per convincere [70];
prestare cura ai valori personali dell’individuo esitante. Allinearsi con i valori personali dell’individuo esitante di fronte alla vaccinazione può facilitare la comunicazione di idee scientifiche e facilitare i cambiamenti comportamentali [71]. Uno sforzo comunicativo volto a dimostrare come la vaccinazione sia parte integrante della narrativa famigliare creando ponti di somiglianza e condivisione di valori e conducendo i professionisti sanitari a sembrare simili e vicini a chi li ascolta può essere utile ad accrescerne la fiducia [32];
dare voce a chi ha scelto la vaccinazione. Per contrastare i messaggi iper-pubblicizzati ed estremamente diffusi di coloro che si oppongono ai vaccini può essere utile formare chi supporta la vaccinazione al fine di far diventare anche loro comunicatori efficaci e utili a fare advocacy per i vaccini all’interno delle comunità locali [31, 72];
curare la comunicazione istituzionale e governativa. Una comunicazione chiara, coerente ed efficace da parte del governo e delle istituzioni è centrale per costruire fiducia da parte della popolazione nei programmi di vaccinazione. Tale comunicazione deve includere spiegazioni in merito a come funzionano i vaccini, a come vengono sviluppati, al percorso che porta alla loro approvazione sulla base dei dati di efficacia e sicurezza, al tempo necessario ai vaccini per indurre l’immunità e al significato di un’ampia copertura vaccinale nella popolazione ai fini dell’immunità collettiva [14];
è fondamentale costruire fiducia nelle agenzie regolatorie nazionali e internazionali in merito alle loro valutazioni sull’efficacia e sulla sicurezza dei vaccini [14].
Nell’ambito della prevenzione vaccinale, particolare attenzione deve essere rivolta alla vaccinazione antinfluenzale, poiché l’influenza rappresenta un problema di sanità pubblica con un considerevole impatto dal punto di vista epidemiologico, clinico, economico e sociale. Le malattie infettive, e in particolare quelle prevenibili da vaccino come l’influenza, richiedono un approccio globale per la loro prevenzione e il loro controllo. Tali strategie richiedono necessariamente l’abbattimento di barriere ideologiche e politiche, ma anche di ostacoli economici e culturali, a favore di un approccio collettivo e globale a difesa della salute delle popolazioni.
Le evidenze scientifiche raccolte nel presente documento sottolineano l’esigenza di prendere in esame una strategia value-based di immunizzazione contro l’influenza, con l’obiettivo di mettere concretamente il cittadino/paziente al “centro”. Per fare ciò è necessario conoscere e divulgare le evidenze scientifiche sul valore complessivo della vaccinazione antinfluenzale, nonché promuovere e implementare strategie di immunizzazione che tengano conto del valore più ampio di questa vaccinazione.
Questo approccio basato sul valore si sposa perfettamente con l’agenda promossa nel settembre del 2019 dalla Commissione Europea e dall’Organizzazione Mondiale della Sanità che hanno pubblicato il documento “Dieci azioni verso la vaccinazione per tutti” definendo un vero e proprio decalogo per garantire la vaccinazione per tutti e contrastare, e laddove possibile eliminare, le malattie prevenibili con vaccino. Le dieci azioni prevedono:
promuovere a livello globale la leadership politica e l’impegno nei confronti della vaccinazione e costruire una collaborazione e una partnership efficace a livello nazionale, regionale e locale con autorità sanitarie, operatori sanitari, società civile, comunità, scienziati e industria per proteggere tutti e ovunque, sostenendo tassi elevati di copertura vaccinale;
garantire l’introduzione e l’attuazione di strategie di vaccinazione a livello nazionale in tutti i paesi e il rafforzamento della stabilità finanziaria, in linea con i progressi verso una copertura sanitaria universale, senza lasciare indietro nessuno;
creare sistemi di sorveglianza efficaci delle malattie prevenibili da vaccino, in particolar modo di quelle sottoposte a eliminazione globale ed eradicazione;
affrontare le cause all’origine della riluttanza nei confronti dei vaccini, aumentando la fiducia nella vaccinazione nonché progettando e attuando interventi basati sulle evidenze e su elementi concreti;
sfruttare il potere delle tecnologie digitali al fine di rafforzare il monitoraggio dell’efficacia dei programmi di vaccinazione;
sostenere gli sforzi della ricerca per creare costantemente dati sull’efficacia e la sicurezza dei vaccini e sull’impatto dei programmi di vaccinazione;
proseguire gli sforzi e gli investimenti – compresi nuovi modelli di finanziamento e di incentivi – nel campo della ricerca, dello sviluppo e dell’innovazione dei vaccini;
ridurre i rischi della scarsa disponibilità di vaccini migliorando i sistemi di monitoraggio, proiezione, acquisto, consegna e stoccaggio, e la collaborazione con i produttori e con tutti coloro che prendono parte alla catena di distribuzione, per utilizzare al meglio la capacità di produzione e/o per aumentare quella esistente;
incoraggiare media e professionisti sanitari a fornire al pubblico informazioni efficaci, trasparenti e obiettive, per contrastare le informazioni false e fuorvianti, coinvolgendo anche le piattaforme social e le aziende tecnologiche;
allineare e integrare la vaccinazione nelle agende globali in materia di sanità e sviluppo, mediante una nuova agenda 2030 in materia di vaccinazione.
Oltre alla raccomandazione di offrire un supporto politico all’uso della vaccinazione come strumento di salute globale, appaiono rilevanti i temi quali la sostenibilità economica, il monitoraggio delle strategie intraprese, l’uso delle nuove tecnologie digitali, come i sistemi informativi dedicati e le anagrafi vaccinali, di cui i programmi vaccinali possono avvantaggiarsi.
Il successo della vaccinazione antinfluenzale, e delle vaccinazioni in generale, dipende non solo dalle scelte del paese, ma anche dall’impegno di tutti gli stakeholder per le rispettive competenze. Per promuovere il benessere dei cittadini e migliorare la buona salute è necessario utilizzare un approccio olistico e definire una visione strategica intersettoriale e multisettoriale. In questa ottica occorre armonizzare il sistema della prevenzione in ogni paese e in tutte le agende politiche, al fine di ridurre le disuguaglianze e i costi sanitari e sociali, e per garantire uno sviluppo sostenibile, in quanto investire in prevenzione vuol dire investire in salute. È necessario, pertanto, che tutti i professionisti sanitari, i decisori politici, le Istituzioni, l’Industria, i cittadini, si impegnino per favorire il corretto utilizzo dei vaccini e per divulgare l’indiscusso valore delle vaccinazioni.