Cost-effectiveness analysis of caplacizumab in the new standard of care for immune Thrombotic Thrombocytopenic Purpura in Italy
Objectives:
To evaluate the cost-effectiveness analysis (CEA) of caplacizumab in combination with plasmapheresis (PEX) and immunosuppression compared to PEX and immunosuppression in the treatment of acute episodes of iTTP.
Methods:
A Markov model was used to conduct the CEA from the perspective of the hospital, over a lifetime horizon. Clinical data derived from HERCULES trial and a systematic literature review. Economic input included direct costs only. Utility and disutility values were obtained from literature. Data on healthcare resources and costs were retrieved from HERCULES trial, literature, TTP guidelines and Italian tariffs. A sensitivity analysis was conducted. The cost-effectiveness probability was tested for several options of discount levels considering a suggested willingness to pay (WTP) threshold of € 60,000 in Italy.
Results:
The use of caplacizumab in combination with PEX and immunosuppression is associated with a positive difference in survival of 3.27 life years (24.53 vs 21.26) and in quality of life of 3.06 QALY (22.01 vs 18.96) when compared to PEX and immunosuppression. Caplacizumab leads to an ICER per life years of € 41,653 and an ICER per QALY of € 44,572. For the suggested WTP threshold, the probability of caplacizumab being cost-effective is 82.4% (no discount), 92.8% (15% discount), 95.3% (20% discount), 96.9% (25% discount) and 98.2% (30% discount).
Conclusions:
Caplacizumab in addition to PEX and immunosuppression is cost-effective, allowing the hospital to achieve greater efficiency in managing the burden of a life-threatening disease such as iTTP.
Keywords: Caplacizumab, Cost-effectiveness, Hospital, Immune Thrombotic Thrombocytopenic Purpura, Orphan drug, Rare blood disorders
Introduzione
La porpora trombotica trombocitopenica immune (iTTP), parimenti detta autoimmune, è una microangiopatia trombotica caratterizzata da una bassa incidenza (2-6/1.000.000 abitanti) e da un’età media di circa 40 anni a maggior prevalenza femminile (oltre il 70%) (1,2). La diagnosi di iTTP è fondamentale, in quanto, se non trattata, determina una mortalità del 90%; per questo motivo, la diagnosi di iTTP dovrebbe essere sempre trattata come un’emergenza medica.
L’iTTP è la forma più comune di porpora trombotica trombocitopenica (95% dei casi) (3) ed è caratterizzata da anticorpi, tipicamente IgG, diretti contro l’enzima ADAMTS13 (the 13th member of a disintegrin and metalloproteinase with thrombospondin motifs 13), responsabile del processo di degradazione del fattore di von Willebrand (vWF) nella sua forma “ultralarge” (ULVWF) (4,5). Il deficit di enzima che ne deriva determina la formazione di grossi trombi, potenzialmente occlusivi, a livello delle arteriole terminali e dei capillari di diversi organi (cuore, pancreas, reni, surreni, cervello, milza e fegato) (6). Tutto ciò può provocare anemia, trombocitopenia, ischemia tissutale (reni, fegato, cuore e altri), disfunzione d’organo ed eventi ischemici acuti che possono portare a eventi tromboembolici maggiori e/o a morte prematura(7-13).
Uno studio italiano ha dimostrato come, nei pazienti con iTTP, anche anni dopo la fase acuta, persista la presenza di disturbi neurologici (14). Durante la fase di remissione, lo studio ha evidenziato un danno significativo nei domini di memoria rispetto alla popolazione generale (14). Oltre ai problemi neurologici e cognitivi, lo studio ha rilevato anche ansia e depressione (14). Un ulteriore studio ha evidenziato l’effetto negativo dell’iTTP sulla qualità della vita, correlata allo stato di salute (Health Related Quality of Life, HR-QoL) (15).
Sebbene plasmaferesi (PEX) e immunosoppressione abbiano migliorato gli esiti clinici dei pazienti con iTTP, rimane significativa la probabilità di un danno d’organo irreversibile e di mortalità (20%, con un tempo mediano al decesso di 9 giorni [range 4-14 giorni]) (13). Secondo i dati del registro inglese, circa la metà dei decessi avviene nelle prime 24 ore (soprattutto nelle donne) (16). In aggiunta, i soggetti possono manifestare, nel 30%-50% dei casi, un’esacerbazione della malattia (conta piastrinica <150.000/mm3 per 3 giorni consecutivi, se si presenta un nuovo episodio trombotico acuto nei primi 30 giorni dalla fine della PEX) (13).
Caplacizumab è un Nanobody bivalente umanizzato di 28 kD, composto da due elementi strutturali umanizzati identici (PMP12A2hum1), legati fra loro da un linker costituito da una tripletta di alanina. Caplacizumab agisce contro il dominio A1 del fattore di von Willebrand, inibendo l’interazione tra quest’ultimo e le piastrine (13).
L’efficacia e la sicurezza di caplacizumab sono state indagate grazie a un programma di sperimentazione clinica che ha incluso lo studio registrativo HERCULES di fase III, randomizzato, in doppio cieco, controllato con placebo, multicentrico (17). Rispetto a quelli trattati con PEX e immunosoppressione, i pazienti che hanno ricevuto caplacizumab in associazione con PEX e immunosoppressione hanno raggiunto una più rapida risoluzione dell’episodio acuto di iTTP (17). Nello specifico, il 95% dei pazienti nel gruppo trattato con caplacizumab ha fatto registrare una normalizzazione della conta piastrinica (≥150.000/mm3) al quinto giorno di trattamento (endpoint primario dello studio), rispetto al 77% dei pazienti trattati con PEX e immunosoppressione (17). Oltre al minor tempo necessario per la normalizzazione della conta piastrinica, si è ridotta sensibilmente la probabilità di morte a seguito di un episodio acuto di iTTP e sono diminuite le esacerbazioni e la possibilità di incorrere in un evento tromboembolico grave(17-19). Caplacizumab previene la refrattarietà al trattamento proteggendo gli organi vitali dai danni vascolari, come dimostrato da una più rapida normalizzazione degli indicatori di tale danno(17-19). Caplacizumab permette di ridurre il volume (21,3±1,6 vs 35,9±4,2, pari a una riduzione del 41%) e la durata (5,8±0,5 vs 9,4±0,8, pari a una riduzione del 38%) della plasmaferesi e il numero di giornate trascorse in terapia intensiva (3,4±0,4 vs 9,7±2,1, pari a una riduzione del 65%) o in ricovero ordinario (9,9±0,7 vs 14,4±1,2, pari a una riduzione del 31%) rispetto alla sola terapia con PEX e immunosoppressione, con un evidente risparmio di risorse sanitarie e una riduzione del rischio di sovraesposizione di infezioni(17-19).
Caplacizumab, in virtù dei dati di efficacia e di un favorevole profilo di sicurezza (che ne consente l’utilizzo durante tutta la fase di attività della malattia e ne suggerisce l’utilizzo quanto più precoce possibile durante gli episodi della malattia)(17-19), è stato inserito da AIFA nell’elenco dei farmaci innovativi che devono essere resi immediatamente disponibili agli assistiti, anche senza il formale inserimento nei prontuari terapeutici ospedalieri regionali (non sono stati, inoltre, previsti né registro né piano terapeutico web based) (20).
Alla luce della maggiore efficacia evidenziata dai risultati dello studio HERCULES (17) e del costante bisogno dei decision-maker di stimare il valore delle nuove terapie, la presente analisi è stata condotta con l’obiettivo di determinare, secondo la prospettiva dell’ospedale, il rapporto costo-efficacia incrementale (Incremental Cost-Effectiveness Ratio, ICER) di caplacizumab in associazione con PEX e immunosoppressione, rispetto a PEX e immunosoppressione nel trattamento di episodi acuti di iTTP.
Metodi
Premessa
Per condurre l’analisi costo-efficacia (Cost-Effectiveness Analysis, CEA) è stato sviluppato un modello di Markov ad hoc, in grado di simulare il decorso clinico di un paziente con un episodio acuto di iTTP. Questo tipo di modello viene adottato se, ai fini dell’analisi, è necessario rappresentare una successione di stati di salute e se ciascuno di essi può manifestarsi nuovamente nel tempo (21). Come ogni modello decisionale, il modello di Markov, oltre a integrare i dati dello studio clinico di riferimento con quelli provenienti da altre fonti (per esempio, analisi epidemiologiche e/o analisi economiche), permette di estendere il periodo di osservazione oltre quello (solitamente breve) coperto dallo studio clinico (21). Esso, quindi, ha la funzione di replicare i possibili percorsi che si possono susseguire dopo un determinato evento indice, lungo un arco temporale (p. es., 1 anno, 5 anni o lifetime), frazionato in unità di tempo dette “cicli”, della durata, per esempio, di un trimestre oppure di 1 anno (21). Con l’inizio di ogni ciclo, può avvenire il passaggio (transizione) del paziente a un diverso stato di salute oppure la sua permanenza nello stesso stato di salute (21).
La CEA ha permesso di confrontare le conseguenze cliniche (sopravvivenza semplice, Life Years, LY, o pesata per la qualità della vita, Quality-Adjusted Life Years, QALY) ed economiche (costi diretti sanitari) di caplacizumab in associazione con PEX e immunosoppressione rispetto a PEX e immunosoppressione nel trattamento di episodi acuti di iTTP. L’adozione della CEA è da considerarsi adeguata quando si presume che una nuova tecnologia sanitaria possa avere un impatto positivo sulla sopravvivenza e/o sulla qualità della vita dei pazienti rispetto alla/alle alternative disponibili. La CEA è stata condotta secondo la prospettiva dell’ospedale. Sono stati considerati i soli costi diretti sanitari, quali acquisizione delle terapie a confronto, gestione dell’episodio acuto di iTTP, gestione degli eventi avversi associati all’episodio acuto di iTTP e remissione. I risultati della CEA vengono presentati in termini di costo incrementale per anno di vita (LY) guadagnato e di costo incrementale per anno di vita corretto per la qualità (QALY) guadagnato. Infine, in accordo con quanto raccomandato dall’Associazione Italiana di Economia Sanitaria (AIES), costi e benefici che si manifestano oltre l’anno sono stati scontati applicando uno sconto del 3,0% (22). I costi sono stati valorizzati facendo riferimento all’anno 2020.
La struttura del modello di Markov
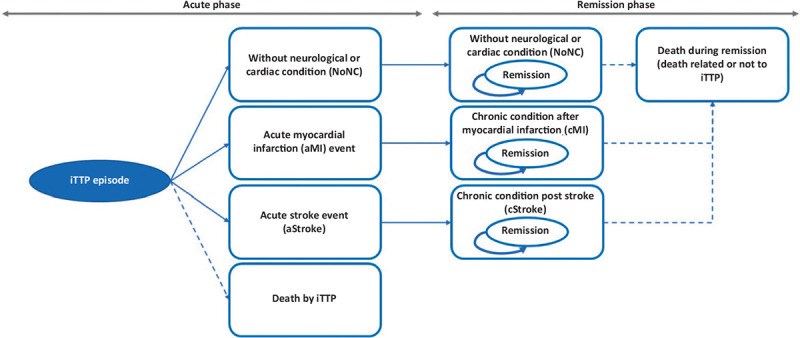
Il paziente entra nel modello a seguito della diagnosi di iTTP confermata sulla base di livelli di ADAMTS13 <10%, con la presenza di anticorpi contro ADAMSTS13. Si precisa che, sebbene il trattamento di un episodio di iTTP non debba essere ritardato, i risultati dei test ADAMTS13 sono importanti per proseguire il trattamento iniziato. La struttura logico-formale del modello di Markov prevede una prima fase acuta e una successiva di remissione, caratterizzate ciascuna da quattro stati di salute mutuamente esclusivi che permettono di descrivere il decorso naturale della malattia e le sue principali implicazioni (Fig. 1). Gli 8 stati di salute presenti nel modello sono:
Fig. 1 -.
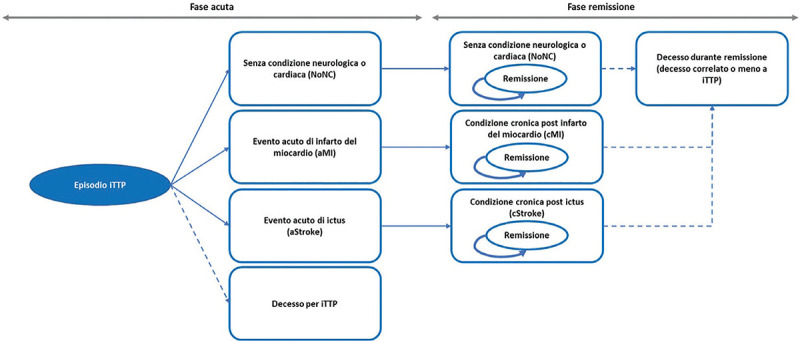
Struttura del modello decisionale.
(fase acuta) senza condizione neurologica o cardiaca (NoNC);
(fase acuta) con evento acuto di infarto del miocardio (aMI);
(fase acuta) con evento acuto di ictus (aStroke);
(fase acuta) decesso per iTTP;
(fase remissione) senza condizione neurologica o cardiaca (NoNC);
(fase remissione) condizione cronica post infarto del miocardio (cMI);
(fase remissione) condizione cronica post ictus (cStroke);
(fase remissione) decesso correlato o meno a iTTP.
Il modello segue nel tempo il paziente trattato con caplacizumab associato a PEX e immunosoppressione o con PEX e immunosoppressione. È stata considerata un’età media di insorgenza dell’episodio acuto di iTTP di 37 anni (23) e una prevalenza femminile del 69% (17). Il paziente, libero da precedenti condizioni croniche, entra nel modello (fase acuta) a seguito del ricovero ospedaliero per un episodio acuto di iTTP (evento indice). In questa fase acuta (primo ciclo), il paziente, a causa dell’episodio, può sperimentare l’assenza (NoNC) o la presenza di un evento cardiaco (infarto, aMI) o neurologico (ictus, aStroke) oppure il decesso (Fig. 1). Nella successiva fase di remissione, il paziente transita nei corrispondenti 4 stati di salute di remissione a seguito dell’assenza (NoNC) o della presenza di un evento cardiaco (cMI) o neurologico (cStroke) (Fig. 1). Nella fase di remissione, il paziente può andare incontro a decesso per cause correlate o meno all’episodio acuto di iTTP (Fig. 1).
Con l’obiettivo di individuare per le due opzioni terapeutiche le differenze più importanti espresse in termini sia di outcome clinico che di costi di trattamento, è stato considerato un orizzonte temporale lifetime (24), caratterizzato da cicli di 90 giorni (3 mesi), sufficiente a catturare l’episodio acuto di iTTP e il suo naturale decorso (17).
La differenziazione in stati acuti (aMI, aStroke) e cronici (cMI, cStroke) permette di includere nel modello le conseguenze a lungo termine degli episodi acuti di iTTP, ovvero che la presenza di un evento acuto quale aMI o aStroke possa influenzare la mortalità nella fase di remissione. Nel modello sono stati, infine, inclusi altri eventi acuti che possono verificarsi durante il trattamento dell’episodio acuto di iTTP, come complicazioni durante la plasmaferesi, sanguinamenti gravi dovuti al trattamento, embolia polmonare e trombosi venosa profonda.
È stato, infine, assunto che non c’è differenza nei risultati per un paziente, se caratterizzato da un precedente episodio di iTTP.
Dati clinici
Il modello decisionale è stato popolato utilizzando i dati di efficacia, di mortalità, di morbilità (infarto del miocardio, ictus ed esacerbazione), delle complicazioni (embolia polmonare e trombosi venosa profonda), degli eventi avversi (infezioni durante plasmaferesi e sanguinamento grave correlato al trattamento) e dei consumi sanitari associati alle due opzioni di trattamento raccolti dallo studio HERCULES (17) e da una revisione sistematica della letteratura (25).
Nello studio HERCULES sono stati arruolati 145 pazienti con diagnosi di iTTP, di cui 72 trattati con caplacizumab in associazione con PEX e immunosoppressione e 73 con placebo in associazione con PEX e immunosoppressione. Le caratteristiche cliniche dei due gruppi sono risultate ben bilanciate all’arruolamento. L’endpoint primario dello studio è stato il tempo alla normalizzazione della conta piastrinica, definito come l’arco temporale che intercorre dalla prima somministrazione endovenosa di caplacizumab o placebo alla normalizzazione della conta piastrinica (ovvero una conta piastrinica almeno ≥150.000 mm3), seguita da interruzione della plasmaferesi entro i 5 giorni successivi. Il 95% dei pazienti nel gruppo trattato con caplacizumab ha fatto registrare una normalizzazione della conta piastrinica (≥150.000/mm3) al quinto giorno di trattamento rispetto al 77% dei pazienti trattanti con placebo in associazione con PEX e immunosoppressione (hazard ratio 1,55, IC 95%: 1,09-2,19; P = 0,01). Il tempo alla normalizzazione della conta piastrinica è stato analizzato tramite un modello parametrico di regressione di Weibull (26), i cui principali parametri sono riportati nella Tabella I. La revisione sistematica della letteratura (25) ha incluso 141 studi per un totale di 20.131 pazienti con almeno un episodio di iTTP. I dati principali mostrano come la manifestazione più importante di un episodio acuto di iTTP sia di tipo cardiaco o neurologico che, con alta probabilità, può portare a morte o generare un impatto negativo sulla qualità della vita dei pazienti. Nella Tabella II sono riportati i principali dati di efficacia considerati nel modello.
TABELLA I -.
Parametri del modello parametrico di regressione di Weibull applicato al tempo alla normalizzazione della conta piastrinica
| Tempo alla normalizzazione della conta piastrinica | Responder al trattamento | |
|---|---|---|
| PEX e immunosoppressione | Caplacizumab + PEX e immunosoppressione | |
| Parametrizzazione Weibull | ||
| Forma | 1,56 | 1,56-0,27 |
| Scala | 0,68 | 0,68 |
TABELLA II -.
Sintesi dei dati di efficacia, di mortalità e di manifestazione di altri eventi durante un episodio acuto di iTTP
| Parametro di efficacia | PEX e immunosoppressione | Fonte | Rischio Relativo (RR) | Caplacizumab + PEX e immunosoppressione | Fonte |
|---|---|---|---|---|---|
| Criterio di risposta clinica | |||||
| % di pazienti con esacerbazione* dopo episodio acuto di iTTP | 36,30% | (25) | 0,12 | 4,23% | (17) |
| Probabilità di ictus non fatale durante un episodio acuto di iTTP | 4,44% | (25) | 0,69 | 3,06%** | (17) |
| Probabilità di infarto del miocardio non fatale durante un episodio acuto di iTTP | 4,39% | (25) | 1,03 | 4,52%** | (17) |
| Mortalità | |||||
| Probabilità di morte durante un episodio acuto di iTTP | 13,20% | (25) | 0,00 | 0,0%** | (17) |
| Altri eventi durante un episodio acuto di iTTP | |||||
| Probabilità di embolia polmonare | 0,00% | (17) | NA | 1,41% | (17) |
| Probabilità di trombosi venosa profonda | 4,11% | (17) | 1,03 | 4,23% | (17) |
| Tasso di infezioni per paziente durante la plasmaferesi | 1,31 | (17) | 0,44 | 0,57 | (17) |
| Tasso di eventi di sanguinamento gravi correlati al trattamento per paziente | 0,00 | (17) | NA | 0,13 | (17) |
*L’esacerbazione viene definita come una riduzione della conta piastrinica (<150.000/mm3) per 3 giorni consecutivi, se si presenta un nuovo episodio trombotico acuto nei primi 30 giorni dalla fine della plasmaferesi.
**Il dato corrispondente a caplacizumab in associazione con PEX e immunosoppressione è stato calcolato applicando il RR stimato nello studio HERCULES (16) al dato riportato nella Tabella per PEX e immunosoppressione.
Mortalità
Nel modello sono state considerate differenti probabilità di mortalità. La prima serie, sulla base dello studio HERCULES e della revisione della letteratura (17,25), riflette la probabilità che, durante la fase acuta, a seconda della terapia somministrata, il paziente possa morire a causa dell’episodio di iTTP (Tab. II). Nel modello è stato ipotizzato che, in riferimento a entrambe le coorti, nella fase acuta la manifestazione di un evento quale infarto o ictus non determini il decesso intraospedaliero del paziente. La seconda serie riflette, invece, la probabilità che un paziente, durante la fase di remissione, possa andare incontro a decesso per cause non correlate all’episodio acuto di iTTP. In quest’ultimo caso, la mortalità annua per cause non correlate all’episodio acuto di iTTP è stata ricavata dalle tavole di mortalità della popolazione generale italiana (ISTAT 2017) (27). Rispetto al paziente senza condizione cronica neurologica o cardiaca, per quello con condizione cronica post infarto o post ictus (fase remissione) è stato considerato un rischio di mortalità aggiuntivo (Tab. III) (28,29).
TABELLA III -.
Mortalità annua standardizzata per i pazienti con ictus o infarto del miocardio
| Popolazione | Mortalità annua | Fonte |
|---|---|---|
| Pazienti in condizione cronica post infarto del miocardio cronico* | 2,02% | (28) |
| Pazienti con infarto del miocardio acuto* | 2,02% | (28) |
| Pazienti in condizione cronica post ictus | 3,90% | (29) |
| Pazienti con ictus acuto | 3,90% | (29) |
*In assenza di uno specifico dato per l’infarto del miocardio, è stato considerato come proxy quello riferito allo scompenso cardiaco cronico (28).
Probabilità di transizione
La Tabella IV riporta il dettaglio delle probabilità di transizione associate agli stati di salute relativi all’episodio acuto di iTTP per i due gruppi di trattamento. Tali probabilità sono state determinate sulla base dei dati di efficacia relativi allo studio HERCULES (17) e alla revisione della letteratura (25). Ai fini dell’analisi probabilistica per gli stati di salute NoNC e Morte, è stata considerata la distribuzione Beta, mentre, per aStroke e aMI, è stata considerata la distribuzione Lognormale.
TABELLA IV -.
Probabilità di transizione associate agli stati di salute nella fase acuta
| Trattamento | NoNC | aStroke | aMI | Morte |
|---|---|---|---|---|
| PEX e immunosoppressione | 79,10% | 3,90% | 3,80% | 13,20% |
| Caplacizumab + PEX e immunosoppressione | 93,40% | 2,70% | 3,90% | 0,00% |
Utilità
La qualità della vita (Quality of Life, QoL) dei pazienti è stata valutata attribuendo specifici valori di utilità o disutilità, per ogni stato di salute (Tab. V).
Ad ogni paziente che entra nel modello, applicando i valori stimati per la popolazione generale italiana (calcolati con il questionario EQ-5D) (30), è stata associata un’utilità di 0,939 prima dell’insorgenza dell’episodio acuto di iTTP. Dal momento che lo studio HERCULES (17) non ha raccolto dati sulla QoL dei pazienti trattati e che, in letteratura, non sono presenti studi che abbiano stimato valori di utilità per i pazienti con un episodio acuto di iTTP, nel modello è stato assunto che l’anemia falciforme rappresenti una patologia assimilabile all’iTTP in termini di impatto sulla QoL, in quanto anch’essa è caratterizzata da frequenti ospedalizzazioni nella fase acuta. Secondo quanto riportato da uno studio internazionale, il valore di utilità, misurato attraverso il questionario EQ-5D, per un paziente ospedalizzato con un episodio acuto di anemia falciforme, è di 0,520 (31). Lo studio ha, inoltre, riportato il valore medio di utilità di 0,750 per il paziente nella settimana successiva alla dimissione ospedaliera (31). Sulla base di questi dati, nel presente modello è stato assunto che la differenza dei due valori riportati sopra, pari a 0,230 (0,750 – 0,520), corrisponda al valore di disutilità associato a un episodio acuto di iTTP o a una successiva esacerbazione (Tab. V).
TABELLA V -.
Valori di utilità
| Evento | Valore di utilità/disutilità | Fonte |
|---|---|---|
| Basale – prima dell’insorgenza dell’episodio acuto di iTTP | 0,939 | (30) |
| Episodio acuto di iTTP | -0,230 | (31) |
| Esacerbazione | -0,230 | Assunzione |
| Infarto non fatale – fase acuta | 0,786 | (32) |
| Ictus – fase acuta | 0,628 | (32) |
| Infarto non fatale – fase remissione | 0,880 | (32) |
| Ictus – fase remissione | 0,628 | (32) |
| Complicazioni | ||
| Embolia polmonare | -0,250 | (33) |
| Trombosi venosa profonda | -0,250 | (33) |
| Eventi avversi | ||
| Infezioni durante plasmaferesi | -0,050 | (25) |
| Sanguinamento grave correlato al trattamento | -0,100 | (25,33,34) |
Infine, nella Tabella V sono riportati i valori di disutilità associati ad altri eventi, quali complicazioni (embolia polmonare e trombosi venosa profonda) o eventi avversi (infezioni durante plasmaferesi e sanguinamento grave correlato al trattamento), che potrebbero verificarsi durante un episodio acuto di iTTP, e quelli di utilità, associati a infarto non fatale e ictus nella fase acuta e cronica (25,32-34).
Consumo di risorse e costi unitari
Nel caso base è stato considerato un costo di € 3.867,86 per un flaconcino da 10 mg di caplacizumab. Tale costo riflette il prezzo ex factory al netto delle riduzioni di legge obbligatorie e al lordo di ulteriori sconti concordati. Sulla base dello schema posologico (10 mg/die) e della durata del trattamento adottata nel modello (35 giorni) (17), è stato, poi, calcolato il costo medio di caplacizumab per un episodio acuto di iTTP.
A esclusione del costo di caplacizumab, nella Tabella VI sono riportati i costi totali di gestione dell’episodio acuto di iTTP per i due gruppi di trattamento. Tali costi sono stati calcolati moltiplicando il consumo medio di ogni risorsa sanitaria per il relativo costo unitario. I consumi medi delle risorse sanitarie sono stati calcolati in base a quanto indicato dallo studio HERCULES (17,35) e, quando necessario, integrando con le Linee Guida per la porpora trombotica trombocitopenica (16), mentre i costi unitari sono stati ricavati dalla letteratura disponibile e, in mancanza di quest’ultima, dalle tariffe di rimborso attualmente in vigore in Italia, quali proxy dei costi ospedalieri. Nello specifico, le giornate trascorse dal paziente in terapia intensiva sono state valorizzate sulla base dei risultati di uno studio nazionale che ha stimato i costi di degenza in terapia intensiva (36), mentre le giornate trascorse dal paziente in regime ordinario sono state valorizzate sulla base di quanto indicato dal Rapporto sull’attività di ricovero ospedaliero SDO 2018 (37) (Tab. VI). In questo secondo caso, il costo unitario è stato stimato dividendo la spesa complessiva (€ 20.452.619) associata ai ricoveri associati al DRG 397 (disturbi della coagulazione) per le relative giornate di degenza (53.247), considerando il DRG 397 quali proxy del ricovero per un episodio acuto di iTTP.
TABELLA VI -.
Costo di gestione dell’episodio acuto di iTTP
| Risorsa utilizzata | Costo unitario | PEX e immunosoppressione | Caplacizumab + PEX e immunosoppressione | ||
|---|---|---|---|---|---|
| Frequenza | Costo totale | Frequenza | Costo totale | ||
| Terapia intensiva (giorni) | € 1.108,00 (36) | 2,7 (16,33) | € 2.991,60 | 1,34 (16,33) | € 1.484,72 |
| Ospedalizzazione (giorni) | € 384,11 (37) | 8,1 (16,33) | € 3.111,29 | 8,2 (16,33) | € 3.149,70 |
| Plasmaferesi giornaliera (giorni) | € 438,99 (38) | 6,5 (16,33) | € 2.853,44 | 5,5 (16,33) | € 2.414,45 |
| Plasmaferesi aggiuntiva (giorni) | € 438,99 (38) | 0,1 (16,33) | € 43,90 | 0,1 (16,33) | € 43,90 |
| Test ADAMTS13 | € 78,9 (39) | 4,0* | € 315,60 | 4,0* | € 315,60 |
| Visita specialistica ematologica | € 20,66 (38) | 2,0* | € 41,32 | 2,0* | € 41,32 |
| Terapia con acido folico 5mg al giorno durante la plasmaferesi | € 0,09 (40) | 0,3 (34) | € 0,03 | 0,3 (34) | € 0,02 |
| Terapia immunosoppressiva | € 35,54 (41) | 3,0 (34) | € 106,62 | 3,0 (34) | € 106,62 |
| Costo totale | € 9.463,79 | € 7.556,33 | |||
*Il test viene eseguito per 4 volte durante l’episodio acuto di iTTP. Due dei quattro test vengono eseguiti solitamente quando il paziente è stato già dimesso dall’ospedale, quindi vengono eseguiti durante una visita specialistica dall’ematologo.
Non disponendo di specifici costi standard ospedalieri, la plasmaferesi è stata, invece, valorizzata utilizzando la tariffa prevista per l’erogazione della prestazione ambulatoriale identificata dal codice 99.71 (plasmaferesi terapeutica) (38). La diagnosi molecolare e biochimica della porpora trombocitopenica acquisita viene effettuata attraverso l’esecuzione del test ADAMTS13 valorizzato, in mancanza di un costo standard, con la tariffa di € 78,90 (codice 90.72.F attività proteasica ADAMTS13) (39). La visita ematologica è stata valorizzata utilizzando come proxy la tariffa prevista per la visita generale (codice 89.7) (38). Le terapie con acido folico (a supporto della plasmaferesi) e immunosoppressiva con corticosteroidi (metilprednisolone) sono state valorizzate utilizzando il relativo prezzo al pubblico (40,41).
Poiché gli eventi avversi associati all’episodio acuto di iTTP, così come l’ictus e l’infarto del miocardio in fase acuta, si manifestano durante il ricovero ospedaliero, nel modello non è stato considerato alcun costo, in quanto, di fatto, già valorizzato all’interno delle giornate trascorse in regime ordinario e/o in terapia intensiva.
Il costo di gestione della fase di remissione (€ 49,77) è uguale per entrambi i gruppi di trattamento ed è stato considerato costante nel tempo. Tale costo, indipendentemente dallo stato di salute associato al paziente nella fase di remissione, prevede l’esecuzione del test ADAMTS13 e della visita ematologica ogni 6 mesi. Considerando la lunghezza del ciclo del modello di tre mesi, è stata considerata una frequenza di 0,5 per entrambe le prestazioni.
Analisi di sensibilità
Per valutare la solidità del modello decisionale in risposta a scostamenti che nella realtà potrebbero verificarsi rispetto ai valori di base dei parametri utilizzati (in quanto stime campionarie), sono state condotte un’analisi deterministica (Deterministic Sensitivity Analysis, DSA), un’analisi probabilistica (Probabilistic Sensitivity Analysis, PSA) e un’analisi di scenario. Nello specifico, per quanto riguarda la DSA (analisi di sensibilità a una via), sono stati fatti variare in sequenza i seguenti parametri, utilizzando, quando possibile, il rispettivo intervallo di confidenza o, in alternativa, assumendo una variazione del ±20%:
pazienti con esacerbazione – PEX e immunosoppressione (IC 95%: 26,0%-47,3%; distribuzione Beta);
pazienti con esacerbazione – caplacizumab + PEX e immunosoppressione (IC 95%: 0,9%-9,9%; distribuzione Beta);
probabilità di decesso per episodio iTTP – PEX e immunosoppressione (IC 95%: 9,6%-17,3%; distribuzione Beta);
costo di un episodio acuto iTTP – PEX e immunosoppressione (variazione ±20%: € 9.463,79 – € 11.356,55; distribuzione Gamma);
costo di un episodio acuto iTTP – caplacizumab + PEX e immunosoppressione (variazione ±20%: € 6.045,06 – € 9.067,60; distribuzione Gamma);
costo dell’esacerbazione senza nuovo ricovero – PEX e immunosoppressione (variazione ±20%: € 5.212,01 – € 7.818,02; distribuzione Gamma);
costo dell’esacerbazione senza nuovo ricovero – caplacizumab + PEX e immunosoppressione (variazione ±20%: € 3.832,59-€ 5.748,89; distribuzione Gamma);
costo dell’esacerbazione con nuovo ricovero – PEX e immunosoppressione (variazione ±20%: € 5.212,01 – € 7.818,02; distribuzione Gamma);
costo remissione (3 mesi) – PEX e immunosoppressione (variazione ±20%: € 36,23 - € 65,45; distribuzione Gamma);
costo remissione (3 mesi) – caplacizumab + PEX e immunosoppressione (variazione ±20%: € 36,23 – € 65,45; distribuzione Gamma);
probabilità ictus durante un episodio acuto iTTP (escluso decesso) – RR HERCULES (IC 95%: 0,50-0,91; distribuzione Gamma);
probabilità infarto durante un episodio acuto iTTP (escluso decesso) – RR HERCULES (IC 95%: 0,75-1,35; distribuzione Gamma).
Oltre a questi parametri è stato valutato anche l’impatto della variazione dello sconto applicato a benefici e costi; nello specifico sono stati valutati 2 scenari alternativi al caso base: nel primo caso non è stato applicato nessuno sconto (0%), mentre, nel secondo caso, benefici e costi sono stati scontati applicando uno sconto del 5%.
Per quanto riguarda, invece, la PSA, sono state effettuate 2.000 iterazioni del modello, facendo, ogni volta, variare simultaneamente e casualmente i valori dei parametri secondo le distribuzioni probabilistiche loro assegnate e ricalcolando i risultati. Il prodotto della PSA è stato, quindi, presentato nelle forme della superficie di accettabilità del rapporto costo-efficacia incrementale (Cost-Effectiveness Plane) e della curva di accettabilità del rapporto costo-efficacia incrementale (Cost-Effectiveness Acceptability Curve). La superficie di accettabilità del rapporto costo-efficacia incrementale mostra la dispersione dei 2.000 risultati delle iterazioni, ciascuno in funzione delle rispettive variazioni incrementali di beneficio (QALY) e di costo di caplacizumab in associazione con PEX e immunosoppressione rispetto a PEX e immunosoppressione. La curva di accettabilità del rapporto costo-efficacia incrementale, sempre sulla base delle 2.000 iterazioni, indica (percentualmente) le frequenze con cui l’ICER (rapporto tra la variazione incrementale del costo e la variazione incrementale del beneficio caplacizumab in associazione con PEX e immunosoppressione rispetto a PEX e immunosoppressione) risulta inferiore a un determinato valore soglia, ovvero fornisce la probabilità che, per un determinato valore soglia, il trattamento sia costo-efficace.
Infine, dal momento che quello considerato nel caso base potrebbe non riflettere l’attuale prezzo di cessione di caplacizumab, in quanto potrebbero essere praticati degli sconti aggiuntivi a favore delle strutture sanitarie, è stata condotta un’analisi di scenario per valutare l’impatto che diverse percentuali di sconto sul prezzo di caplacizumab potrebbero determinare sul calcolo dell’ICER per QALY. Non disponendo di specifiche informazioni, sono stati proposti quattro scenari alternativi di sconto addizionale (15%, 20%, 25% o 30%) del prezzo base di caplacizumab, ipotizzando che l’effettivo prezzo di cessione di quest’ultimo potesse ricadere all’interno di tale variazione.
Risultati
Analisi costo-efficacia incrementale
Complessivamente, rispetto a PEX e immunosoppressione, il trattamento con caplacizumab in associazione con PEX e immunosoppressione determinerebbe un aumento della sopravvivenza di 3,27 anni e un aumento della sopravvivenza aggiustata per la qualità della vita di 3,06 QALY. L’aggiunta di caplacizumab a PEX e immunosoppressione determinerebbe un incremento dei costi del trattamento farmacologico (€ 136.169), che, in parte, verrebbe compensato dalla riduzione dei costi di gestione della patologia (-€ 3.372) e dal miglioramento dell’aspettativa di vita e/o della qualità della vita. Tali valori determinerebbero un costo incrementale per anno di vita guadagnato di € 41.653 e un costo incrementale per QALY guadagnato di € 44.572 (Tab. VII).
TABELLA VII -.
Risultati dell’analisi costo-efficacia incrementale
| Parametri | Caplacizumab + PEX e immunosoppressione | PEX e immunosoppressione | Variazione incrementale |
|---|---|---|---|
| Outcome | |||
| Anni di vita (LY) | 24,53 | 21,26 | 3,27 |
| Anni di vita aggiustati per la qualità (QALY) | 22,01 | 18,96 | 3,06 |
| Costi diretti (€) | |||
| Caplacizumab | € 139.540 | € 0 | € 139.540 |
| Gestione iTTP | € 12.553 | € 15.924 | -€ 3.372 |
| TOTALE costi diretti | € 152.093 | € 15.924 | € 136.169 |
| Rapporto costo-efficacia incrementale (ICER) | |||
| ICER (Caplacizumab + PEX e immunosoppressione vs PEX e immunosoppressione) (Δcosti/ΔLY) | € 41.653 | ||
| ICER (Caplacizumab + PEX e immunosoppressione vs PEX e immunosoppressione) (Δcosti/ΔQALY) | € 44.572 | ||
In Italia, non esistono soglie definite di accettabilità per i farmaci orfani a cui poter rapportare gli ICER qui stimati. Tuttavia, diverse pubblicazioni italiane riportano come plausibile soglia di accettabilità un valore di € 60.000 per QALY guadagnato(42-44). Se si confronta, quindi, tale valore soglia con l’ICER per QALY qui stimato, si può ritenere che caplacizumab, in aggiunta a PEX e immunosoppressione, sia un’opzione terapeutica costo-efficace.
Analisi di sensibilità
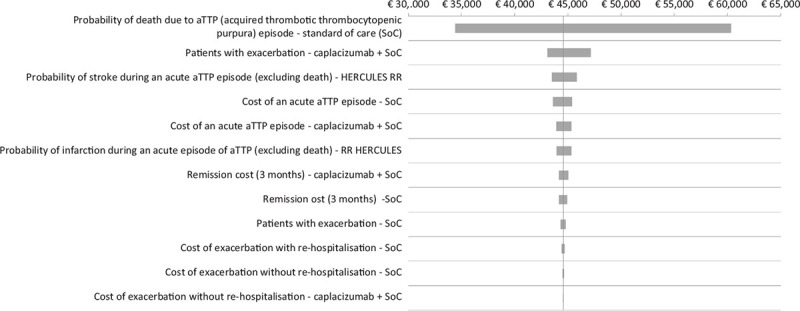
I risultati dell’analisi di sensibilità deterministica mostrano come la probabilità di decesso per un episodio acuto di iTTP (PEX e immunosoppressione), la probabilità di esacerbazione (caplacizumab + PEX e immunosoppressione), la probabilità di ictus durante un episodio acuto di iTTP e il costo di un episodio acuto di iTTP (PEX e immunosoppressione) costituiscano i principali driver dell’analisi costo-efficacia incrementale (Fig. 2). Il diagramma a tornado mostra il range di impatto determinato dalle principali variabili sul rapporto costo-efficacia incrementale di caplacizumab in associazione con PEX e immunosoppressione rispetto a PEX e immunosoppressione (Fig. 2).
Fig. 2 -.
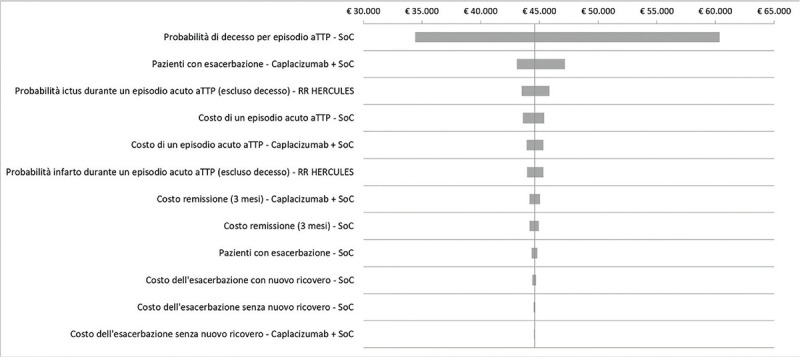
Diagramma a tornado: analisi di sensibilità deterministica.
Applicando uno sconto dello 0% a benefici e costi, il modello stima un ICER per LY e uno per QALY di € 21.962 e di € 23.924, rispettivamente. Applicando, invece, uno sconto del 5%, l’ICER per LY risulterebbe pari a € 57.709, mentre quello per QALY sarebbe di € 61.194.
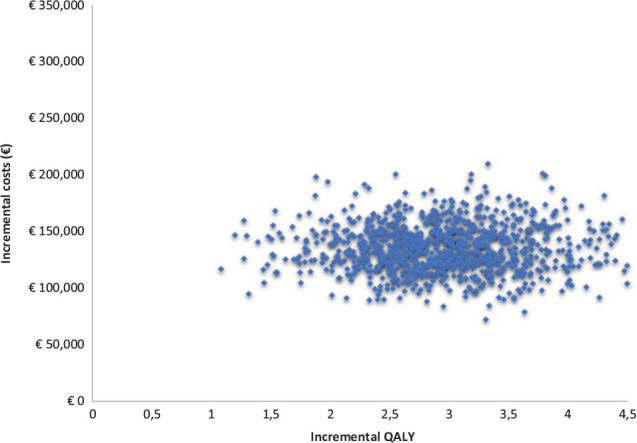
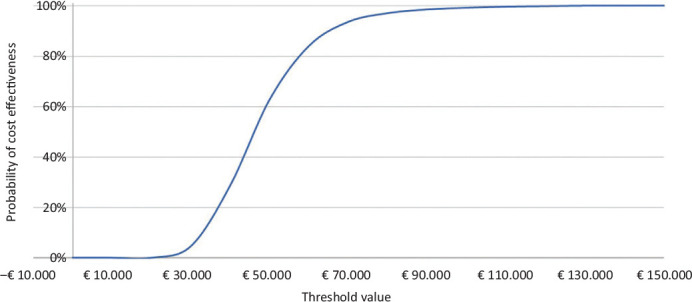
Per quanto riguarda, invece, la PSA, la superficie di accettabilità del rapporto costo-efficacia incrementale mostra come tutta la dispersione delle 2.000 iterazioni sia racchiusa nel primo quadrante (Fig. 3). Sempre sulla base delle 2.000 iterazioni, la Figura 4 (curva di accettabilità del rapporto costo-efficacia incrementale di caplacizumab in associazione con PEX e immunosoppressione rispetto a PEX e immunosoppressione) indica che la probabilità che l’ICER di caplacizumab in associazione con PEX e immunosoppressione rispetto a PEX e immunosoppressione sia inferiore a un valore soglia di € 60.000 sarebbe pari all’84,2%.
Fig. 3 -.
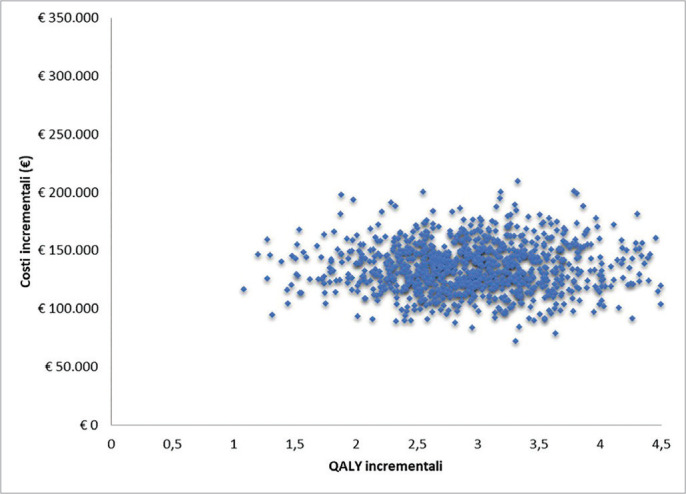
Superficie di accettabilità del rapporto costo-efficacia incrementale di caplacizumab in associazione con PEX e immunosoppressione rispetto a PEX e immunosoppressione.
Fig. 4 -.
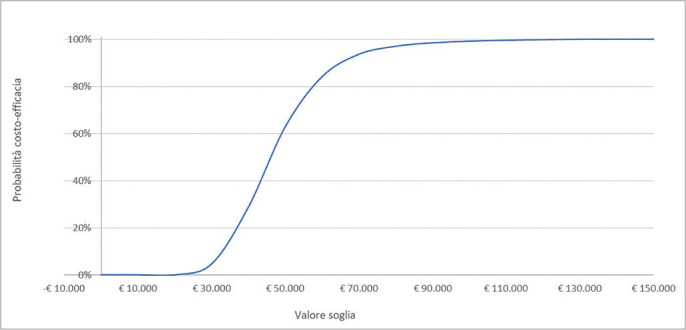
Curva di accettabilità del rapporto costo-efficacia incrementale di caplacizumab in associazione con PEX e immunosoppressione rispetto a PEX e immunosoppressione.
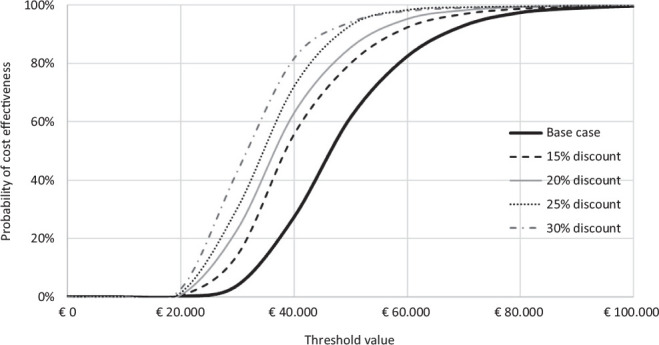
La Figura 5 e la Tabella VII riportano i risultati dell’analisi di scenario. A fronte di un ulteriore sconto del 15% del prezzo di caplacizumab, la probabilità che l’ICER per QALY di caplacizumab in associazione con PEX e immunosoppressione rispetto a PEX e immunosoppressione sia inferiore a un valore soglia di € 60.000 sarebbe pari al 92,8%. Tale probabilità salirebbe al 95,3%, al 96,9% e al 98,2% a fronte di un corrispettivo sconto del 20%, del 25% o del 30% (Fig. 5). In virtù dei differenti livelli di sconto ipotizzati, l’ICER per QALY di caplacizumab in associazione con PEX e immunosoppressione rispetto a PEX e immunosoppressione diminuirebbe fino a € 30.869 (Tab. VIII).
Fig. 5 -.
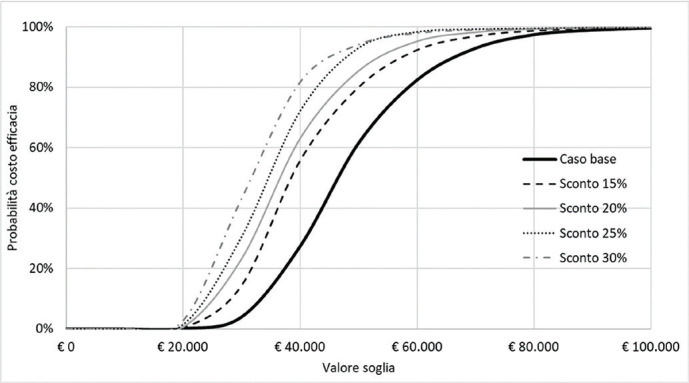
Analisi di scenario: curva di accettabilità del rapporto costo-efficacia incrementale di caplacizumab in associazione con PEX e immunosoppressione rispetto a PEX e immunosoppressione.
TABELLA VIII -.
Risultati dell’analisi di scenario
| Parametri | ICER per QALY | Δ vs caso base |
|---|---|---|
| Caso base | € 44.572 | |
| Scenario sconto 15% | € 37.721 | -€ 6.851 |
| Scenario sconto 20% | € 35.437 | -€ 9.135 |
| Scenario sconto 25% | € 33.153 | -€ 11.419 |
| Scenario sconto 30% | € 30.869 | -€ 14.419 |
Discussione e conclusioni
La disponibilità di caplacizumab in aggiunta a PEX e immunosoppressione permette ai pazienti trattati di raggiungere una più rapida risoluzione dell’episodio acuto di iTTP rispetto a quelli trattati con PEX e immunosoppressione(17-19). A fronte di tale vantaggio clinico, l’aggiunta di caplacizumab a PEX e immunosoppressione solleva, però, l’aspetto della sostenibilità del relativo costo di trattamento a carico del SSN, da cui deriva la necessità di valutarne l’accettabilità tramite l’analisi costo-efficacia. La necessità, quindi, di valutare un nuovo trattamento lungo un orizzonte temporale idoneo a raccoglierne i principali benefici e costi determina l’opportunità di perfezionare l’analisi economica estendendola lungo un periodo lifetime, che, a sua volta, si scontra, però, con la breve durata degli studi clinici. Ciò ha giustificato, in questa sede, il ricorso a un modello di Markov che, grazie a una semplice rappresentazione del percorso clinico del paziente con un episodio acuto di iTTP, ha permesso di valutare, lungo un periodo lifetime, l’ICER di caplacizumab in aggiunta a PEX e immunosoppressione rispetto a PEX e immunosoppressione.
Come accade ogni volta che viene fatto ricorso a un modello decisionale, i risultati dell’analisi rimangono legati ad alcune zone di incertezza. Nel presente studio, tale incertezza ha diversi motivi, in primis il fatto che non tutti i confronti di efficacia tra i due regimi di trattamento siano riferiti a un unico studio. I dati di efficacia di caplacizumab in associazione con PEX e immunosoppressione rispetto a PEX e immunosoppressione sono, infatti, estrapolati dallo studio HERCULES (17) e da una revisione sistematica della letteratura (25). A parziale giustificazione di ciò, si ricorda che il ricorso a differenti fonti bibliografiche rappresenta un “male” necessario per il popolamento di un modello decisionale, soprattutto lungo un orizzonte temporale lifetime. Un secondo aspetto riguarda i coefficienti di utilità considerati. Nel modello, non disponendo di alcun dato, per stimare i valori di disutilità associati alla manifestazione dell’episodio acuto di iTTP, si è fatto ricorso a quanto presente in letteratura per l’anemia falciforme, ritenendo l’impatto sulla qualità della vita di quest’ultima assimilabile a quello dell’iTTP per via delle frequenti ospedalizzazioni nella fase acuta. Un terzo aspetto riguarda l’assunzione che un precedente episodio acuto di iTTP non determini differenze in termini di efficacia e costi rispetto a un primo episodio. Un quarto aspetto è, invece, riferito all’assunzione che, per entrambe le coorti, nella fase acuta, la manifestazione di un evento quale infarto o ictus non determini il decesso intraospedaliero del paziente, non riflettendo pienamente quanto, invece, potrebbe accadere nella pratica clinica. Dal momento che le probabilità di ictus o infarto sono lievemente inferiori per il gruppo di pazienti in trattamento con caplacizumab, si ritiene che tale eventuale bias non possa influenzare significativamente il risultato del caso base. Infine, l’ultimo aspetto è il ricorso, in alcuni casi, a proxy per la valorizzazione dei consumi sanitari, come avvenuto, per esempio, per la visita ematologica o per le giornate di ospedalizzazione.
Per eliminare qualsiasi incertezza legata ai parametri adottati e alle assunzioni fatte, è stata condotta un’analisi di sensibilità deterministica e probabilistica che, nel complesso, ha confermato la solidità dei risultati del caso base. In particolare, la DSA ha mostrato come la probabilità di decesso per un episodio acuto di iTTP associata al gruppo trattato con PEX e immunosoppressione costituisca il principale driver dell’analisi costo-efficacia incrementale, mentre la curva di accettabilità dell’ICER per QALY, derivata dalla PSA, ha evidenziato una probabilità dell’84,2% che caplacizumab in aggiunta a PEX e immunosoppressione sia costo-efficace rispetto a PEX e immunosoppressione, a fronte di una soglia di accettabilità posta pari a € 60.000(42-44).
Sarebbe, inoltre, buona consuetudine discutere i risultati di uno studio confrontandoli con quelli già pubblicati. Purtroppo, al momento della redazione del presente manoscritto, non sono, tuttavia, presenti in letteratura valutazioni farmacoeconomiche di caplacizumab nel trattamento di un episodio acuto di iTTP da utilizzare per questo proposito.
Alla luce di quanto qui riportato, riteniamo sia possibile affermare che l’aggiunta di caplacizumab a PEX e immunosoppressione costituisca una valida alternativa alle opzioni di trattamento attualmente disponibili per la gestione di un episodio acuto di iTTP, aggiunta che consentirebbe all’ospedale di raggiungere un maggiore efficientamento dell’onere della malattia.
Disclosures
Conflict of interest: The authors declare no conflict of interest.
Financial support: This research was made possible thanks to Sanofi Genzyme.
Bibliografia
- 1.Osservatorio Malattie Rare (OMAR). [accessed december; 2019 ]. Online
- 2.Taruscio D. 17/8 – Il Registro Nazionale Malattie Rare nel contesto nazionale e internazionale. 3° Rapporto (dati al 31 dicembre 2014). [accessed december; 2019 ];2017 Online [Google Scholar]
- 3.Scully M, Yarranton H, Liesner R et al. Regional UK TTP registry: correlation with laboratory ADAMTS 13 analysis and clinical features. Br J Haematol. 2008;142(5):819–826. doi: 10.1111/j.1365-2141.2008.07276.x. PubMed [DOI] [PubMed] [Google Scholar]
- 4.Joly BS, Coppo P, Veyradier A. Thrombotic thrombocytopenic purpura. Blood. 2017;129(21):2836–2846. doi: 10.1182/blood-2016-10-709857. PubMed [DOI] [PubMed] [Google Scholar]
- 5.Sadler JE. What’s new in the diagnosis and pathophysiology of thrombotic thrombocytopenic purpura. Hematology (Am Soc Hematol Educ Program). 2015;2015(1):631–636. doi: 10.1182/asheducation-2015.1.631. PubMed [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Callewaert F, Roodt J, Ulrichts H et al. Evaluation of efficacy and safety of the anti-VWF Nanobody ALX-0681 in a preclinical baboon model of acquired thrombotic thrombocytopenic purpura. Blood. 2012;120(17):3603–3610. doi: 10.1182/blood-2012-04-420943. PubMed [DOI] [PubMed] [Google Scholar]
- 7.Terrell DR, Williams LA, Vesely SK, Lämmle B, Hovinga JA, George JN. The incidence of thrombotic thrombocytopenic purpura-hemolytic uremic syndrome: all patients, idiopathic patients, and patients with severe ADAMTS-13 deficiency. J Thromb Haemost. 2005;3(7):1432–1436. doi: 10.1111/j.1538-7836.2005.01436.x. PubMed [DOI] [PubMed] [Google Scholar]
- 8.Kremer Hovinga JA, Coppo P, Lämmle B, Moake JL, Miyata T, Vanhoorelbeke K. Thrombotic thrombocytopenic purpura. Nat Rev Dis Primers. 2017;3(1):17020. doi: 10.1038/nrdp.2017.20. PubMed [DOI] [PubMed] [Google Scholar]
- 9.Bennett CL, Djulbegovic B. Thrombotic thrombocytopenic purpura: gaining knowledge. Lancet Haematol. 2016;3(5):e210–e211. doi: 10.1016/S2352-3026(16)30028-X. PubMed [DOI] [PubMed] [Google Scholar]
- 10.Falter T, Alber KJ, Scharrer I. Long term outcome and sequelae in patients after acute thrombotic thrombocytopenic purpura episodes. Hamostaseologie. 2013;33(2):113–120. doi: 10.5482/HAMO-12-11-0019. PubMed [DOI] [PubMed] [Google Scholar]
- 11.Reese JA, Muthurajah DS, Kremer Hovinga JA, Vesely SK, Terrell DR, George JN. Children and adults with thrombotic thrombocytopenic purpura associated with severe, acquired Adamts13 deficiency: comparison of incidence, demographic and clinical features. Pediatr Blood Cancer. 2013;60(10):1676–1682. doi: 10.1002/pbc.24612. PubMed [DOI] [PubMed] [Google Scholar]
- 12.Miller DP, Kaye JA, Shea K et al. Incidence of thrombotic thrombocytopenic purpura/hemolytic uremic syndrome. Epidemiology. 2004;15(2):208–215. doi: 10.1097/01.ede.0000113273.14807.53. PubMed [DOI] [PubMed] [Google Scholar]
- 13.Knoebl P, Cataland S, Peyvandi F et al. Efficacy and safety of open-label caplacizumab in patients with exacerbations of acquired thrombotic thrombocytopenic purpura in the HERCULES study. J Thromb Haemost. 2020;18(2):479–484. doi: 10.1111/jth.14679. PubMed [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Riva S et al. Long-term neuropsychological sequelae, emotional wellbeing and quality of life in patients with acquired thrombotic thrombocytopenic purpura. Haematologica. 2020;105(7):1957–1962. doi: 10.3324/haematol.2019.226423. PubMed [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Kennedy AS, Lewis QF, Scott JG et al. Cognitive deficits after recovery from thrombotic thrombocytopenic purpura. Transfusion. 2009;49(6):1092–1101. doi: 10.1111/j.1537-2995.2009.02101.x. PubMed [DOI] [PubMed] [Google Scholar]
- 16.Scully M, Hunt BJ, Benjamin S et al. British Committee for Standards in Haematology. Guidelines on the diagnosis and management of thrombotic thrombocytopenic purpura and other thrombotic microangiopathies. Br J Haematol. 2012;158(3):323–335. doi: 10.1111/j.1365-2141.2012.09167.x. PubMed [DOI] [PubMed] [Google Scholar]
- 17.Scully M, Cataland SR, Peyvandi F et al. HERCULES Investigators. Caplacizumab Treatment for Acquired Thrombotic Thrombocytopenic Purpura. N Engl J Med. 2019;380(4):335–346. doi: 10.1056/NEJMoa1806311. PubMed [DOI] [PubMed] [Google Scholar]
- 18.Peyvandi F, Scully M, Kremer Hovinga JA et al. TITAN Investigators. Caplacizumab for acquired thrombotic thrombocytopenic purpura. N Engl J Med. 2016;374(6):511–522. doi: 10.1056/NEJMoa1505533. PubMed [DOI] [PubMed] [Google Scholar]
- 19.Peyvandi F. Integrated Efficacy Results from the Phase II and Phase III Studies with Caplacizumab in Patients with Acquired Thrombotic Thrombocytopenic Purpura. Blood. 2018;132(Suppl. 1) doi: 10.1182/blood-2018-99-112125. [DOI] [Google Scholar]
- 20.Area Strategia ed Economia del Farmaco. Settore HTA ed Economia del Farmaco. Elenco dei farmaci innovativi ai sensi dell’articolo 10, comma 2, legge 8 novembre 2012, n. 189, come definito dall’art. 1 comma 1 e 2 dell’accordo Stato-Regioni del 18 novembre 2010 (Rep. Atti n. 197/CSR). [accessed august; 2020 ]. Online Disponibile su:
- 21.Sonnenberg FA, Beck JR. Markov models in medical decision making: a practical guide. Med Decis Making. 1993;13(4):322–338. doi: 10.1177/0272989X9301300409. PubMed [DOI] [PubMed] [Google Scholar]
- 22.Fattore G. Proposta di Linee Guida per la valutazione economica degli interventi sanitari in Italia. PharmacoEconomics – Ital-Res-Articles. 2009;11(2):83–93. doi: 10.1007/BF03320660. [DOI] [Google Scholar]
- 23.Lotta LA, Mariani M, Consonni D et al. Different clinical severity of first episodes and recurrences of thrombotic thrombocytopenic purpura. Br J Haematol. 2010;151(5):488–494. doi: 10.1111/j.1365-2141.2010.08385.x. PubMed [DOI] [PubMed] [Google Scholar]
- 24.Caro JJ, Briggs AH, Siebert U, Kuntz KM. ISPOR-SMDM Modeling Good Research Practices Task Force. Modeling good research practices—overview: a report of the ISPOR-SMDM Modeling Good Research Practices Task Force—1. Value Health. 2012;15(6):796–803. doi: 10.1016/j.jval.2012.06.012. PubMed [DOI] [PubMed] [Google Scholar]
- 25.Ablynx Data on file. Systematic review on the clinical burden of disease in thrombotic thrombocytopenic purpura. 2017.
- 26.Team RC. A language and environment for statistical computing. 2018 Online R Foundation for Statistical Computing; [Google Scholar]
- 27.ISTAT. Istituto nazionale di statistica. Tavole di mortalità della popolazione residente: Italia, anno 2017. Online
- 28.Yusuf S, Pitt B, Davis CE, Hood WB Jr, Cohn JN. SOLVD Investigators. Effect of enalapril on mortality and the development of heart failure in asymptomatic patients with reduced left ventricular ejection fractions. N Engl J Med. 1992;327(10):685–691. doi: 10.1056/NEJM199209033271003. PubMed [DOI] [PubMed] [Google Scholar]
- 29.Rutten-Jacobs LCA, Arntz RM, Maaijwee NA et al. Long-term mortality after stroke among adults aged 18 to 50 years. JAMA. 2013;309(11):1136–1144. doi: 10.1001/jama.2013.842. PubMed [DOI] [PubMed] [Google Scholar]
- 30.Scalone L, Cortesi PA, Ciampichini R, Cesana G, Mantovani LG. Health Related Quality of Life norm data of the general population in Italy: results using the EQ-5D-3L and EQ-5D-5L instruments. Online [Google Scholar]
- 31.Anie KA, Grocott H, White L, Dzingina M, Rogers G, Cho G. Patient self-assessment of hospital pain, mood and health related quality of life in adults with sickle cell disease. BMJ Open. 2012;2(4):e001274. doi: 10.1136/bmjopen-2012-001274. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.NICE Clinical Guideline Centre. Lipid modification: Cardiovascular risk assessment and the modification of blood lipids for the primary and secondary prevention of cardiovascular disease. Jul, 2014. Online Clinical Guideline CD181 Appendices. [PubMed]
- 33.NICE. NICE TA327. Dabigatran etexilate for the treatment and secondary prevention of deep vein thrombosis and/or pulmonary embolism. Online
- 34.NICE. NICE TA420. Ticagrelor for preventing atherothrombotic events after myocardial infarction. Online
- 35.Sanofi Data on file. Clinical Study Report HERCULES Study.
- 36.Pradelli L, Klek S, Mayer K et al. Omega-3 fatty acid-containing parenteral nutrition in ICU patients: systematic review with meta-analysis and cost-effectiveness analysis. Crit Care. 2020;24(1):634. doi: 10.1186/s13054-020-03356-w. PubMed [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Rapporto sull’attività di ricovero ospedaliero SDO 2018. [accessed january; 2018 ]. Online
- 38.Prestazioni di assistenza specialistica ambulatoriale. Online
- 39.Tariffario Regione Veneto 2017. Online
- 40.Farmadati 2019. Acido Folico (DOC Generici), 5 mg, 120 CPR. Prezzo ex factory al lordo delle riduzioni di legge € 11,25.
- 41.Lista farmaci classe A 15-11-19 (ITALIA)SOLUMEDROL, 1 flacone IM EV 1 g + 1 flacone solv 16 ml. Online
- 42.Martone N, Lucioni C, Mazzi S. V. Fadda – Valutazione di costo-efficacia dei nuovi farmaci oncologici immessi sul mercato italiano – Global & Regional Health Technol Assess. 2014;1(2):31–43. doi: 10.33393/grhta.2014.315. [DOI] [Google Scholar]
- 43.Messori A, Santarlasci B, Trippoli S, Vaiani M. Controvalore economico del farmaco e beneficio clinico: stato dell’arte della metodologia e applicazione di un algoritmo farmacoeconomico. PharmacoEconomics – Ital-Res-Articles. 2003;5(2):53–67. doi: 10.1007/BF03320605. [DOI] [Google Scholar]
- 44.Messori A, Maratea D, Nozzoli C, Bosi A. The role of bortezomib, thalidomide and lenalidomide in the management of multiple myeloma: an overview of clinical and economic information. Pharmacoeconomics. 2011;29(4):269–285. doi: 10.2165/11585930-000000000-00000. PubMed [DOI] [PubMed] [Google Scholar]