Cost per responder for upadacitinib vs abatacept in patients with moderate-to-severe Rheumatoid Arthritis in Italy
Purpose:
The objective of this economic evaluation was to compare the cost per responder between upadacitinib and abatacept (intravenous [iv] or subcutaneous [sc]) in patients with moderate-to-severe Rheumatoid Arthritis (RA) in Italy.
Methods:
The clinical efficacy was assessed based on SELECT-CHOICE study results. The clinical efficacy of upadacitinib and abatacept (iv or sc) was measured by Clinical Remission (CR), Low Disease Activity (LDA) and American College of Rheumatology response (ACR20, 50 and 70). The treatment cost was based on the number of administrations dispensed at 12 or 24 weeks. The cost per responder was adopted as a cost-effectiveness indicator.
Results:
Independent of the clinical efficacy measure used and the duration of treatment considered, the cost per responder was consistently lower for upadacitinib compared to abatacept (iv or sc) across all clinical measures. For example, considering the CR at 24 weeks, the cost per responder for upadacitinib was € 9,417 compared to € 17,817 for abatacept sc or to € 23,110 for abatacept iv. The differences in the cost per responder between upadacitinib and abatacept (iv or sc) increased when higher ACR response levels were considered.
Conclusions:
These results suggested that upadacitinib is a cost-effectiveness option compared to abatacept (iv or sc) from the perspective of the Italian National Health Service in patients with moderate-to-severe Rheumatoid Arthritis in Italy.
Keywords: Abatacept, Cost per responder, Italian NHS, Rheumatoid Arthritis, Upadacitinib
Introduzione
L’artrite reumatoide (AR) è una malattia autoimmune infiammatoria cronica, caratterizzata da una sinovite persistente, che provoca la progressiva distruzione della cartilagine e l’erosione ossea, con conseguenti deformazione articolare e disabilità (1,2). L’AR è una delle malattie reumatiche più comuni al mondo, con una prevalenza che varia dallo 0,3% all’1% e un’incidenza di circa 3 casi ogni 10.000 abitanti (3). Essa tende a manifestarsi tra i 35 e i 50 anni, con una maggiore incidenza nelle donne (rapporto di 3:1), anche se tale differenza tende a ridursi in età più avanzata (3). Secondo una stima fornita da indagini regionali, la prevalenza dell’AR in Italia sarebbe dello 0,46% (95% CI 0,33-0,59) (4). Tale dato è in linea con quello di un successivo studio epidemiologico che, condotto su quasi 5 milioni di soggetti adulti (età ≥18 anni) rappresentativi della popolazione italiana, ha stimato una prevalenza dello 0,48% e un’incidenza di 3,5 casi ogni 10.000 abitanti (5).
Secondo le raccomandazioni dell’European League Against Rheumatism (EULAR), la gestione dell’AR include terapie sia non farmacologiche che farmacologiche (6). Tra queste ultime, le prime che vengono prescritte sono costituite dai farmaci convenzionali sintetici antireumatici modificanti la malattia (csDMARD), come il metotrexato (MXT). Con l’obiettivo, però, di ottimizzare la risposta clinica e di ridurre la disabilità soprattutto nel lungo termine, l’approccio terapeutico si è orientato verso i farmaci biologici antireumatici modificanti la malattia (bDMARD), come gli inibitori del fattore di necrosi tumorale (TNF)-alfa (7,8,9,10,11) o i farmaci sintetici mirati antireumatici modificanti la malattia (tsDMARD), come gli inibitori JAKm (12,13,14,15). bDMARD e tsDMARD rappresentano una valida alternativa, particolarmente raccomandata nei pazienti con risposta inadeguata o intolleranti a csDMARD o per i quali risulta inefficace continuare il trattamento con csDMARD (16,17).
Per la valutazione dell’attività dell’AR e della risposta al trattamento somministrato, vengono utilizzati nella pratica clinica differenti endpoint, tra cui i criteri dell’American College of Rheumatology (ACR) 20, 50 e 70, la remissione clinica (Clinical Remission, CR) e la bassa attività di malattia (Low Disease Activity, LDA) (18,19,20,21).
L’ACR è costituito da punteggi dicotomici che misurano l’efficacia di un trattamento valutando un numero definito di variabili di attività della malattia (definito core set), quali il numero delle articolazioni dolenti e tumefatte, la capacità funzionale, le proteine di fase acuta (velocità di eritrosedimentazione [VES] e proteina C reattiva [PCR]), il giudizio circa la gravità della malattia espresso sia dal medico sia dal paziente e il giudizio sull’intensità del dolore percepito dal paziente (22,23). Così strutturato, l’indice ACR si basa sull’analisi delle variazioni delle variabili del core set tra valore iniziale e finale, classificando la risposta al trattamento come un miglioramento del 20% (ACR20), del 50% (ACR50) o del 70% (ACR70) (22).
La CR e la LDA sono, invece, calcolate sulla base dell’indice composito DAS28 (Disease Activity Score 28); quest’ultimo monitora l’attività e il contestuale controllo dell’AR grazie a una scala di valori da 0 a 9,4, dove un punteggio > 5,1 indica un’elevata attività di malattia (High Disease Activity, HDA), un punteggio ≤ 3,2 indica una bassa attività di malattia (Low Disease Activity, LDA) e un punteggio ≤ 2,6 indica che la malattia è in remissione (Clinical Remission, CR).
Upadacitinib (tsDMARD) è un inibitore selettivo e reversibile delle JAK, somministrato per via orale. Nei test cellulari umani, upadacitinib agisce inibendo la via di segnalazione da parte di JAK1 o JAK1/3, con una selettività funzionale rispetto a quella dei recettori delle citochine, che avviene tramite coppie di JAK2. Upadacitinib ha recentemente ottenuto dall’Agenzia Europea per i Medicinali (European Medicines Agency, EMA) l’approvazione in Europa per diverse indicazioni, tra cui il trattamento dell’AR da moderata a grave in pazienti adulti che hanno avuto una risposta inadeguata o che sono intolleranti a uno o più farmaci antireumatici modificanti la malattia (24). L’efficacia e la sicurezza di upadacitinib sono state valutate in un ampio programma di studi clinici randomizzati (25,26,27,28,29), tra cui lo studio di fase III SELECT-CHOICE (30,31). In riferimento a quest’ultimo studio, l’efficacia e la sicurezza di upadacitinib sono state confrontate rispetto a quelle di abatacept (30,31). Abatacept è una proteina di fusione costituita dal dominio extracellulare dell’antigene 4 associato al linfocita T citotossico umano (CTLA-4) legato alla porzione Fc modificata dell’immunoglobulina G1 umana (IgG1). Abatacept è indicato per il trattamento dell’AR attiva da moderata a severa in pazienti adulti che hanno avuto una risposta insufficiente alla precedente terapia con uno o più DMARDs, incluso metotrexato (MTX) o anti TNF-alfa. Il farmaco può essere somministrato come infusione endovenosa (ev) oppure nella formulazione sottocutanea (sc); studi di confronto tra le due formulazioni hanno dimostrato efficacia e sicurezza paragonabili (32,33).
Obiettivo
La presente valutazione economica è stata condotta con l’obiettivo di stimare, sulla base dei risultati clinici dello studio di confronto diretto SELECT-CHOICE (30,31), il costo per responder di upadacitinib e di abatacept nel trattamento dell’AR in fase attiva da moderata a severa nei pazienti adulti che hanno avuto una risposta inadeguata o che sono risultati intolleranti a uno o più farmaci antireumatici modificanti la malattia.
Metodi
Premessa
L’analisi è stata sviluppata in ambiente Microsoft Excel®. In linea con i risultati clinici dello studio SELECT-CHOICE, il costo di trattamento associato alle opzioni terapeutiche è stato calcolato considerando una duplice durata di 12 e 24 settimane. I relativi costi per responder sono stati calcolati dividendo il costo totale di trattamento a 12 o a 24 settimane per gli endpoint di efficacia (CR, LDA, ACR20, ACR50 e ACR70) raccolti dallo studio SELECT-CHOICE (30,31).
Popolazione
L’analisi, in linea con le caratteristiche della popolazione arruolata nello studio SELECT-CHOICE (30,31), ha considerato i pazienti adulti con diagnosi di AR in fase attiva da moderata a severa che hanno avuto una risposta inadeguata o che sono intolleranti a uno o più farmaci antireumatici modificanti la malattia.
Dati clinici
Gli endpoint di efficacia considerati nella presente analisi riflettono i risultati dello studio SELECT-CHOICE, multicentrico, di fase III, in doppio cieco, controllato, di 24 settimane in cui pazienti adulti (età media: 55 anni, femmine: 82%) con AR da moderata a grave sono stati randomizzati (rapporto 1:1) a ricevere upadacitinib orale (os) (n = 303) o abatacept ev (n = 309) (30,31). Entrambi i trattamenti sono stati somministrati in combinazione con csDMARD (30,31). La Tabella I riporta il dettaglio degli endpoint dello studio clinico SELECT-CHOICE a 12 e a 24 settimane di trattamento qui considerati: i) la percentuale di pazienti con CR (punteggio DAS 28-CRP ≤2,6), ii) la percentuale di pazienti che ha raggiunto la LDA (punteggio DAS 28-CRP ≤ 3,2) e iii) la percentuale di pazienti con risposta ACR20, ACR50 e ACR70 (30,31).
TABELLA I -.
Endpoint dello studio SELECT-CHOICE valutati nella presente analisi economica
| Endpoint | Upadacitinib (n = 303) | Abatacept (n = 309) | p |
|---|---|---|---|
| 12 settimane | |||
| – CR (DAS 28-CRP ≤ 2,6) | 30% | 13% | p ≤ 0,001 |
| – LDA (DAS 28-CRP ≤ 3,2) | 50% | 29% | p ≤ 0,001 |
| – ACR20 | 76% | 66% | p ≤ 0,05 |
| – ACR50 | 46% | 34% | p ≤ 0,01 |
| – ACR70 | 22% | 14% | p ≤ 0,01 |
| 24 settimane | |||
| – CR (DAS 28-CRP ≤ 2,6) | 46% | 31% | p ≤ 0,001 |
| – LDA (DAS 28-CRP ≤ 3,2) | 63% | 48% | p ≤ 0,001 |
| – ACR20 | 79% | 74% | n.s. |
| – ACR50 | 59% | 50% | p < 0,05 |
| – ACR70 | 37% | 27% | p < 0,01 |
n.s. = non significativo.
Trattamenti considerati
Dal momento che, in riferimento al setting di pazienti qui considerato, abatacept è disponibile e rimborsato dal Servizio Sanitario Nazionale (SSN) anche nella formulazione sc, si è ritenuto opportuno estendere il confronto di upadacitinib rispetto anche a questa ulteriore opzione di trattamento. Dato che i risultati dello studio clinico SELECT-CHOICE sono riferiti alla sola formulazione ev, si è arrivati a considerare, sulla base degli esiti di due studi di confronto (32,33), un’efficacia e una sicurezza uguali tra le due formulazioni, così da applicare ad abatacept sc gli stessi valori degli endpoint associati alla formulazione ev.
Orizzonte temporale
Il calcolo del costo per responder è stato effettuato lungo un duplice orizzonte temporale di 12 e 24 settimane, in linea con i timepoint considerati nello studio SELECT-CHOICE (30,31). Si ritiene che tali orizzonti temporali, soprattutto quello a 24 settimane, siano idonei a rilevare, tra le opzioni considerate, eventuali differenze in termini sia di efficacia (CR, LDA, e ACR) che di costo di trattamento.
Prospettiva di analisi
L’analisi economica è stata condotta nella prospettiva del SSN considerando i soli costi (diretti sanitari) determinati dalla terapia farmacologica d’elezione (upadacitinib o abatacept). Il costo per i csDMARD non è stato incluso poiché, costituendo questi ultimi la “background therapy” somministrata a tutti i pazienti dello studio SELECT-CHOICE, di fatto non determinano una differenza incrementale in termini di consumi e di costi per upadacitinib e abatacept (30,31). Non è stato incluso nella valutazione alcun costo per la gestione di eventuali eventi avversi gravi, poiché, alla luce dei profili di sicurezza riportati nello studio SELECT-CHOICE (upadacitinib: 3,3%; abatacept: 1,6%), non sono emerse differenze significative tali da influenzare sensibilmente l’analisi del costo per responder (30,31). Sebbene i farmaci siano caratterizzati da differenti vie di somministrazione (os, ev e sc), in via conservativa, non è stato considerato alcun costo a carico del SSN per l’erogazione di tale attività. Infine, si è ritenuto opportuno non valorizzare l’attività di monitoraggio del farmaco somministrato in quanto in letteratura non sono presenti analisi economiche che, nel trattamento dell’AR, abbiano stimato i consumi e i costi ad essa associati, distinguendo tra farmaci biologici caratterizzati da differenti vie di somministrazione. Così facendo, si è stabilito che la gestione dell’attività di monitoraggio non determina differenziali di costo di trattamento tra le alternative qui considerate.
Schema di somministrazione
La Tabella II riporta lo schema posologico e il numero di somministrazioni di upadacitinib e abatacept (ev o sc) a 12 e a 24 settimane di trattamento. Dal momento che il dosaggio della formulazione ev di abatacept è peso-dipendente, per stimarne il relativo costo di trattamento è stato considerato un paziente standard con peso medio corporeo di 70 kg.
TABELLA II -.
Schema e numero di somministrazioni a 12 e a 24 settimane
| Farmaco | Posologia | Numero somministrazioni |
|---|---|---|
| 12 settimane | ||
| Upadacitinib | Una compressa da 15 mg una volta al giorno | 84 |
| Abatacept ev* | Prima infusione della durata di 30 minuti alla dose di 500 mg (peso corporeo <60 kg), 750 mg (da ≥60 kg a ≤100 kg) e 1.000 mg (≥100 kg). Somministrazione 2 e 4 settimane dopo la prima infusione e, successivamente, ogni 4 settimane | 4 |
| Abatacept sc | 125 mg una volta a settimana | 12 |
| 24 settimane | ||
| Upadacitinib | Una compressa da 15 mg una volta al giorno | 168 |
| Abatacept ev* | Prima infusione della durata di 30 minuti alla dose di 500 mg (peso corporeo <60 kg), 750 mg (da ≥60 kg a ≤100 kg) e 1.000 mg (≥100 kg). Somministrazione 2 e 4 settimane dopo la prima infusione e, successivamente, ogni 4 settimane | 7 |
| Abatacept sc | 125 mg una volta a settimana | 24 |
*Nella presenta analisi, è stato considerato un paziente con peso medio di 70 kg.
Costo di acquisizione dei medicinali considerati
Sia per upadacitinib che per abatacept ev o sc è stato considerato il prezzo ex-factory al netto degli sconti temporanei di legge (Determinazione AIFA del 3 luglio 2006, GU n° 156 del 7 luglio 2006 e successiva Determinazione AIFA del 9 febbraio 2007, GU n° 57 del 9 marzo 2007 e proroghe). Per upadacitinib è stato considerato un prezzo di € 722,00 per la confezione da 28 compresse da 15 mg, mentre, per abatacept, è stato considerato un prezzo di € 1.023,44 e di € 920,55 per la confezione da 3 flaconcini da 250 mg e per la confezione da 4 siringhe da 125 mg, rispettivamente. A differenza di upadacitinib, che aderisce a entrambi gli sconti temporanei di legge (-5% e -5%), abatacept aderisce a un solo sconto di legge (-5%) e alla procedura di pay-back. Con l’obiettivo di rendere omogeneo il confronto in termini di costo, si è deciso di uniformare le scontistiche considerando per abatacept (ev o sc) uno sconto del 5% come proxy della procedura di pay-back.
Analisi di sensibilità
Dal momento che quello considerato nel caso base potrebbe non riflettere il reale prezzo di cessione dei farmaci praticato alle strutture sanitarie, è stata condotta un’analisi di sensibilità finalizzata a stimare l’impatto sul costo per responder di alcune ipotesi di sconto sul prezzo di upadacitinib e abatacept (ev o sc). È stato, quindi, ipotizzato che ai farmaci possano essere praticati degli ulteriori sconti compresi tra lo 0% e il 25% (0%, 5%, 10%, 15%, 20% e 25%). L’analisi di sensibilità, tramite tabelle a matrice, mostra tutti i possibili confronti dei valori di costo per responder a 12 e a 24 settimane, calcolati per ogni endpoint considerato.
Sulla base delle evidenze dello studio SELECT-CHOICE si è assunto che non vi siano significative differenze in termini di eventi avversi gravi tra le opzioni considerate, così da escluderne il costo di gestione dal calcolo del costo per responder. Dato che lo studio SELECT-CHOICE riporta, però, a 24 settimane, una maggiore incidenza di eventi avversi gravi di upadacitinib rispetto ad abatacept (3,3% vs 1,6%), è sembrato opportuno ricalcolare il costo per responder del caso base a 24 settimane, includendo anche questa voce di costo. Sulla base dei dati raccolti dallo studio SELECT-CHOICE, sono state individuate le tipologie di eventi avversi gravi, considerando che la manifestazione di ognuno di essi determinasse il ricovero ospedaliero; questi ultimi sono stati valorizzati tramite le relative tariffe DRG. Così facendo, è stato determinato un costo medio per paziente per la gestione degli eventi avversi trattato con abatacept (ev o sc) di € 44,43 o con upadacitinib di € 111,07 (Tab. III).
TABELLA III -.
Costo medio grave evento avverso per paziente
| Evento avverso | DRG | Tariffa | % EA abatacept | % EA upadacitinib |
|---|---|---|---|---|
| Malattia cardiaca | DRG122 | € 3.443,34 | 0,0% | 0,3% |
| Malattia gastrointestinale | DRG183 | € 1.170,28 | 0,0% | 0,3% |
| Artrite settica | DRG242 | € 3.571,35 | 0,0% | 0,3% |
| Polmonite | DRG090 | € 2.206,71 | 0,3% | 0,3% |
| Pielonefrite | DRG321 | € 1.832,75 | 0,0% | 0,3% |
| Sepsi | DRG576 | € 4.236,45 | 0,3% | 0,0% |
| Frattura della pelvi | DRG236 | € 3.477,45 | 0,0% | 0,3% |
| Compressione frattura spinale | DRG009 | € 4.681,95 | 0,3% | 0,0% |
| Disidratazione | DRG297 | € 2.265,08 | 0,0% | 0,3% |
| Osteoartrite | DRG245 | € 1.230,22 | 0,0% | 0,3% |
| Malattia motoneurone | DRG012 | € 3.570,45 | 0,0% | 0,3% |
| Sincope | DRG142 | € 1.108,56 | 0,3% | 0,0% |
| Aborto spontaneo | DRG381 | € 1.206,00 | 0,0% | 0,3% |
| Epistassi | DRG066 | € 1.424,24 | 0,0% | 0,3% |
| Versamento pleurico | DRG086 | € 3.402,18 | 0,0% | 0,3% |
| Embolia polmonare | DRG078 | € 3.804,09 | 0,0% | 0,3% |
| Sindrome tosse vie resp. sup. | DRG069 | € 1.495,82 | 0,3% | 0,0% |
| Ipertensione | DRG134 | € 1.049,74 | 0,0% | 0,3% |
| Costo medio per paziente | € 44,43 | € 111,07 |
Risultati
Costo per responder a 12 e a 24 settimane
La Figura 1 riporta il costo per responder a 12 e a 24 settimane di upadacitinib e abatacept (ev o sc) calcolato rispetto alla CR. Upadacitinib determina il minor costo per responder, con una differenza compresa nel range di € 13.544-€ 23.560 a 12 settimane e di € 8.400-€ 13.693 a 24 settimane.
Fig. 1 -.
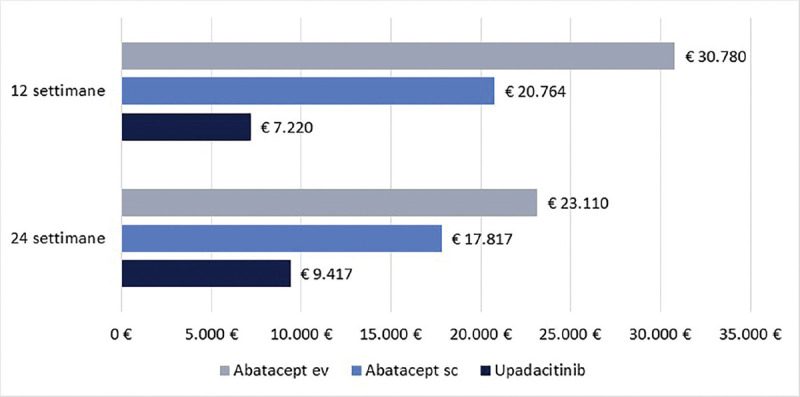
Clinical Remission: costo per responder a 12 e a 24 settimane.
La Figura 2 illustra, invece, il costo per responder calcolato rispetto alla LDA. A 12 settimane, il costo per responder è risultato di € 4.332 per upadacitinib e di € 9.523 e di € 14.116 per abatacept sc ed ev, rispettivamente (range differenza: € 5.191-€ 9.784). A 24 settimane, il costo per responder è risultato di € 6.876 per upadacitinib, di € 11.507 per abatacept sc e di € 14.925 per abatacept ev (range differenza: € 4.631-€ 8.049).
Fig. 2 -.
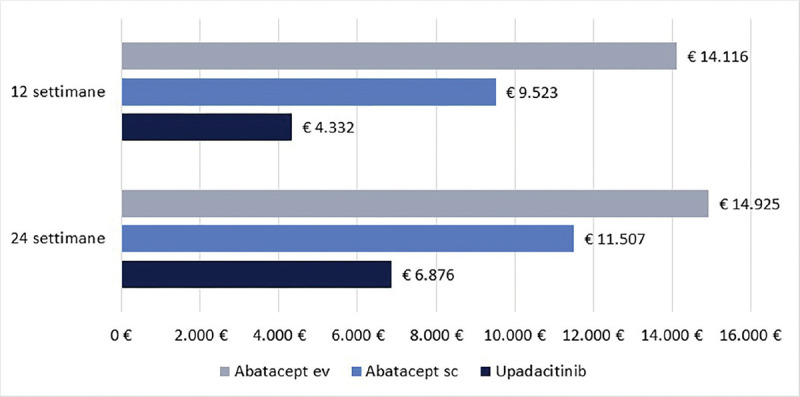
Low Disease Activity: costo per responder a 12 e a 24 settimane.
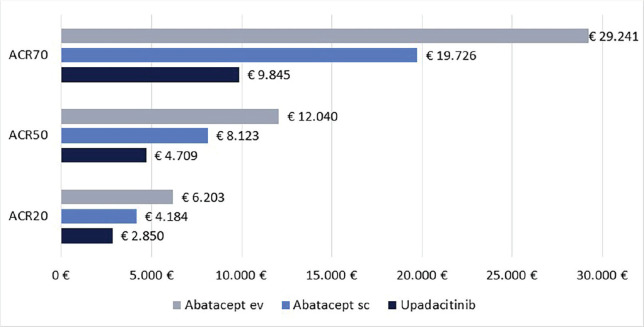
Infine, le Figure 3 e 4 riportano il costo per responder calcolato rispetto ai criteri di risposta ACR20, ACR50 e ACR70 alla settimana 12 e alla settimana 24, rispettivamente. Anche in questa ulteriore serie di confronti upadacitinib determina sempre il minor costo per responder. In particolare, questi risultati suggeriscono come, all’aumentare della valutazione del miglioramento della risposta clinica (da ACR20 ad ACR70), cresca anche la differenza del costo per responder a favore di upadacitinib. Per esempio, a 12 settimane, si va da un range di differenza del costo per responder a vantaggio di upadacitinib di € 1.334-€ 3.353 per ACR20 a uno di € 9.881-€ 19.396 per ACR70. A 24 settimane, il range di riduzione del costo per responder a vantaggio di upadacitinib passa da € 1.980-€ 4.198 per ACR20 a € 8.749-€ 14.826 per ACR70.
Fig. 3 -.
ACR20, ACR50 e ACR70: costo per responder a 12 settimane.
Fig. 4 -.
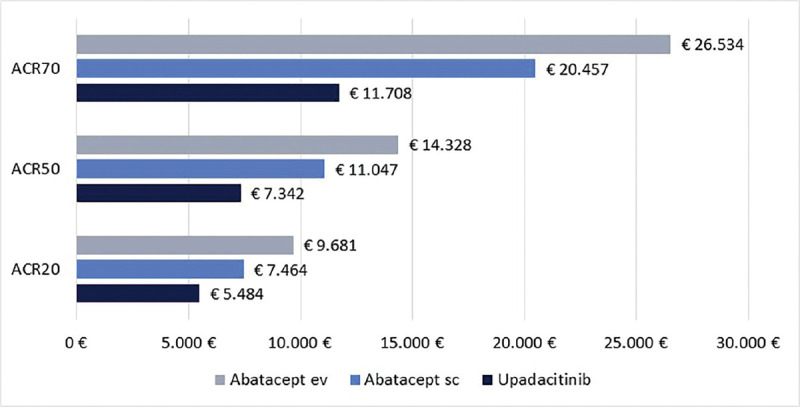
ACR20, ACR50 e ACR70: costo per responder a 24 settimane.
Analisi di sensibilità
I risultati dell’analisi di sensibilità, finalizzata a stimare l’impatto di alcune ipotesi di sconto adottate per il calcolo del costo per responder di upadacitinib e di abatacept (ev o sc), sono riportati nelle Figure 5-9. Indipendentemente dall’endpoint e dal timepoint considerato, upadacitinib evidenzia sempre il minor costo per responder rispetto a tutte le possibili combinazioni di sconto applicate ad abatacept ev o sc.
Fig. 5 -.
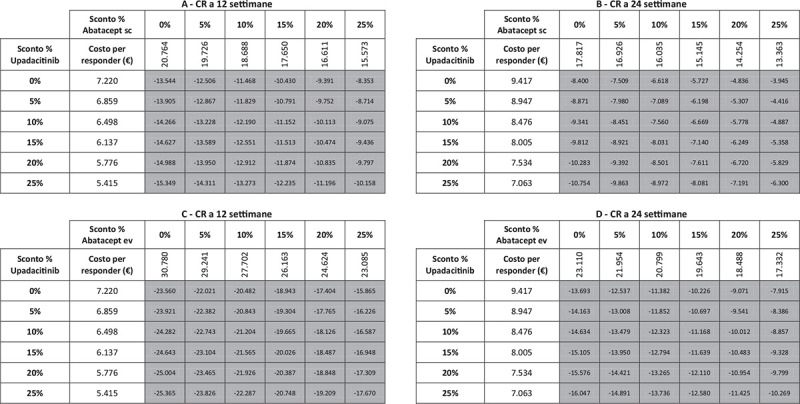
Analisi di sensibilità sconto costo per responder a 12 e a 24 settimane: Clinical Remission.
Note: A = CR a 12 settimane upadacitinib vs abatacept sc; B = CR a 24 settimane upadacitinib vs abatacept sc; C = CR a 12 settimane upadacitinib vs abatacept ev; D = CR a 24 settimane upadacitinib vs abatacept ev.
Legenda: grigio = costo per responder di upadacitinib < costo per responder di abatacept ev o sc; nero = costo per responder di upadacitinib > costo per responder di abatacept ev o sc.
Fig. 9 -.
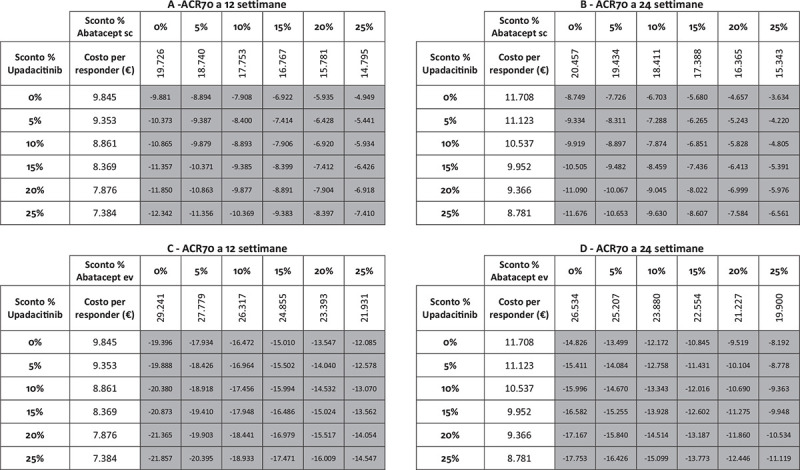
Analisi di sensibilità sconto costo per responder a 12 e a 24 settimane: ACR70.
Note: A = ACR70 a 12 settimane upadacitinib vs abatacept sc; B = ACR70 a 24 settimane upadacitinib vs abatacept sc; C = ACR70 a 12 settimane upadacitinib vs abatacept ev; D = ACR70 a 24 settimane upadacitinib vs abatacept ev.
Legenda: grigio = costo per responder di upadacitinib < costo per responder di abatacept ev o sc; nero = costo per responder di upadacitinib > costo per responder di abatacept ev o sc.
Fig. 6 -.
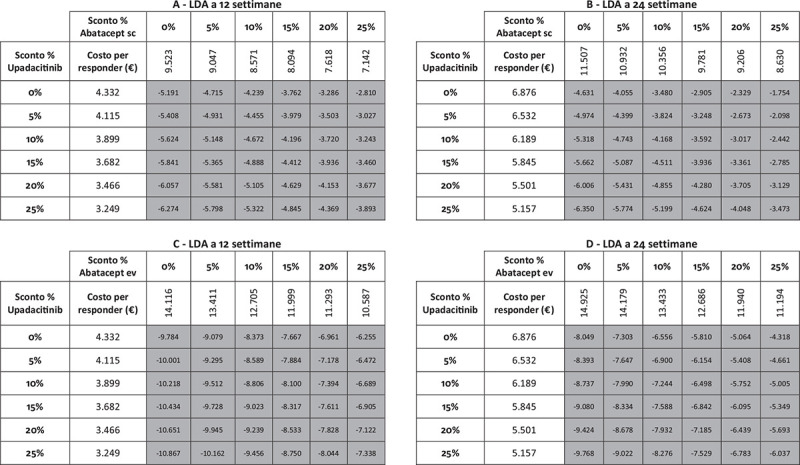
Analisi di sensibilità sconto costo per responder a 12 e a 24 settimane: Low Disease Activity.
Note: A = LDA a 12 settimane upadacitinib vs abatacept sc; B = LDA a 24 settimane upadacitinib vs abatacept sc; C = LDA a 12 settimane upadacitinib vs abatacept ev; D = LDA a 24 settimane upadacitinib vs abatacept ev.
Legenda: grigio = costo per responder di upadacitinib < costo per responder di abatacept ev o sc; nero = costo per responder di upadacitinib > costo per responder di abatacept ev o sc.
Fig. 7 -.
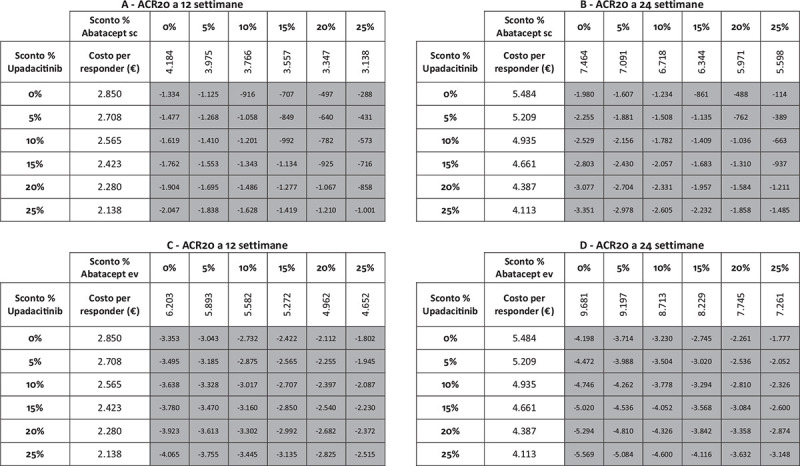
Analisi di sensibilità sconto costo per responder a 12 e a 24 settimane: ACR20.
Note: A = ACR20 a 12 settimane upadacitinib vs abatacept sc; B = ACR20 a 24 settimane upadacitinib vs abatacept sc; C = ACR20 a 12 settimane upadacitinib vs abatacept ev; D = ACR20 a 24 settimane upadacitinib vs abatacept ev.
Legenda: grigio = costo per responder di upadacitinib < costo per responder di abatacept ev o sc; nero = costo per responder di upadacitinib > costo per responder di abatacept ev o sc.
Fig. 8 -.
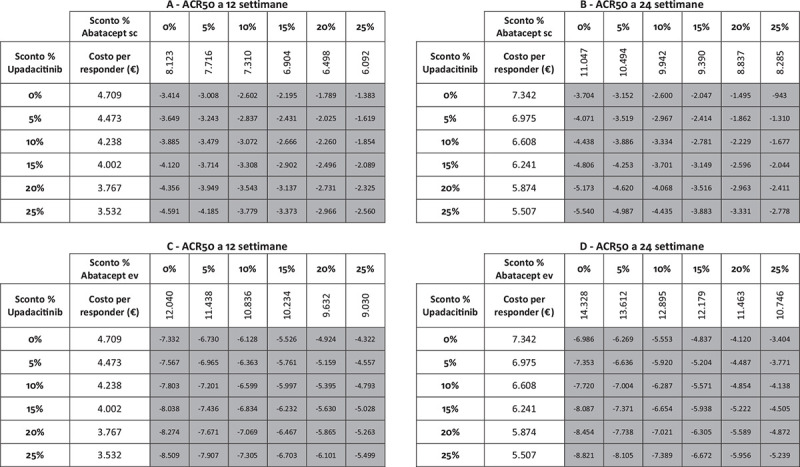
Analisi di sensibilità sconto costo per responder a 12 e a 24 settimane: ACR50.
Note: A = ACR50 a 12 settimane upadacitinib vs abatacept sc; B = ACR50 a 24 settimane upadacitinib vs abatacept sc; C = ACR50 a 12 settimane upadacitinib vs abatacept ev; D = ACR50 a 24 settimane upadacitinib vs abatacept ev.
Legenda: grigio = costo per responder di upadacitinib < costo per responder di abatacept ev o sc; nero = costo per responder di upadacitinib > costo per responder di abatacept ev o sc.
Nella Tabella IV sono, infine, riportati i risultati dell’analisi di sensibilità, nella quale, rispetto al caso base, è stato aggiunto al costo per il farmaco quello per la gestione degli eventi avversi gravi. In tutti i confronti a 24 settimane, upadacitinib risulta essere costo-efficace rispetto ad abatacept ev o sc.
TABELLA IV -.
Analisi di sensibilità: costo per responder a 24 settimane, inclusi i costi per la gestione degli eventi avversi gravi
| Endpoint | Upadacitinib | Abatacept ev | Abatacept sc |
|---|---|---|---|
| Costo per responder a 24 settimane | |||
| – CR (DAS 28-CRP ≤ 2,6) | € 9.417 | € 23.110 | € 17.817 |
| – LDA (DAS 28-CRP ≤ 3,2) | € 6.876 | € 14.925 | € 11.507 |
| – ACR20 | € 5.484 | € 9.681 | € 7.464 |
| – ACR50 | € 7.342 | € 14.328 | € 11.047 |
| – ACR70 | € 11.708 | € 26.534 | € 20.457 |
Discussione
Nella presente analisi, il costo per responder è stato utilizzato quale indicatore per pesare i benefici clinici e i costi di trattamento associati all’utilizzo di upadacitinib o di abatacept (ev o sc) nel trattamento di pazienti adulti con diagnosi di AR in fase attiva da moderata a severa, che hanno avuto una risposta inadeguata o che sono risultati intolleranti a uno o più farmaci antireumatici modificanti la malattia.
Grazie a una maggiore efficacia, valutata tramite differenti endpoint (CR, LDA, ACR20, ACR50 e ACR70) e timepoint (12 e 24 settimane), upadacitinib determina in ogni confronto il minor costo per responder rispetto ad abatacept ev o sc. L’analisi economica poggia le proprie basi cliniche sui risultati dello studio SELECT-CHOICE, che ha valutato l’efficacia delle due molecole nel trattamento dell’AR da moderata a severa (30,31). Nello studio SELECT-CHOICE, upadacitinib è stato confrontato con la sola formulazione ev di abatacept; però, dato che, nell’attuale pratica clinica, anche la formulazione sc di abatacept viene prescritta per questo setting di pazienti, ci è sembrato opportuno inserire nel confronto anche quest’ultima. Ciò è stato possibile assumendo, alla luce dei risultati di due studi di confronto, un’efficacia e una sicurezza paragonabili tra le due formulazioni (32,33). I valori degli endpoint associati ad abatacept ev sono stati, quindi, applicati anche alla formulazione sc.
Dal momento che, nella conduzione di analisi economiche, si devono spesso utilizzare dati clinici forniti da analisi aggregate o da confronti indiretti con tutti i limiti del caso (popolazioni non sovrapponibili, indicatori clinici non omogenei, ecc.), la disponibilità di uno studio che abbia, invece, confrontato direttamente i due trattamenti qui considerati costituisce un punto di forza della presente analisi. La scelta degli endpoint, in linea con la metodologia adottata dallo studio SELECT-CHOICE (30,31), è ricaduta sulla CR, sulla LDA e sull’indice ACR. Purtroppo, non è stato possibile validare la dimensione clinica del confronto, in quanto in letteratura sembrerebbero non essere presenti altri confronti diretti condotti tra i due farmaci nel trattamento dell’AR.
L’analisi di sensibilità ha permesso, invece, di validare la dimensione economica del confronto, valutando l’impatto di eventuali scontistiche applicate ai prezzi dei farmaci considerati, in quanto il prezzo ex-factory al netto delle riduzioni temporanee di legge potrebbe non riflettere l’attuale prezzo di cessione praticato alle strutture sanitarie. Ipotizzando, quindi, una scontistica compresa tra l’1% e il 25% per i farmaci considerati, sono state valutate tutte le possibili combinazioni di costo per responder in termini di endpoint e timepoint. Anche a fronte di significative riduzioni del prezzo di abatacept (sc o ev), upadacitinib rimarrebbe l’alternativa costo-efficace.
Nella valutazione economica delle tecnologie sanitarie, le Linee Guida nazionali (34) e internazionali (35,36) raccomandano l’uso di un orizzonte temporale idoneo a catturare le differenze più importanti in termini sia di efficacia che di costo di trattamento. Nella presente analisi, la scelta di un orizzonte temporale a 12 e a 24 settimane è stata dettata dai timepoint adottati dallo studio SELECT-CHOICE (30,31). Malgrado ciò, si sottolinea come soprattutto le 24 settimane rappresentino in letteratura (37) l’orizzonte temporale più frequentemente utilizzato per valutare l’efficacia di un farmaco nel trattamento dell’AR. Si considera, inoltre, che un periodo di sei mesi sia sufficiente anche a catturare le differenze più importanti in termini di costo di trattamento. Ci si aspetta che, in futuro, vengano condotte analisi real life per corroborare sul lungo periodo i risultati qui trovati. Queste analisi potrebbero, inoltre, essere condotte con l’obiettivo di raccogliere dati su aspetti non trattati in questa sede, quali compliance al trattamento e persistenza.
Dalla presente analisi sono stati esclusi i costi correlati alla gestione di eventuali eventi avversi gravi associati al trattamento somministrato, poiché lo studio di riferimento non ha evidenziato significative differenze tra le alternative terapeutiche (30,31). Tale voce di costo è stata, però, considerata nell’analisi di sensibilità, con l’obiettivo di verificarne il peso sul risultato del caso base. In tutti i confronti, upadacitinib determina il minor costo per responder, confermando di fatto l’ininfluente peso economico dei costi associati alla gestione degli eventi avversi gravi sul costo per responder.
Nonostante upadacitinib e abatacept siano caratterizzati da differenti vie di somministrazione, in via conservativa, i costi sanitari associati a tale attività non sono stati considerati. L’inclusione di tale voce di costo determinerebbe un minino incremento per il solo costo di trattamento di abatacept ev, nell’ipotesi di valorizzare tale attività con la tariffa rimborsata a livello nazionale pari a € 11,62 (cod. 99.14.1), considerando, invece, per upadacitinib e abatacept sc l’autosomministrazione da parte del paziente. Rimane, però, da sottolineare come la formulazione orale possa avere un maggiore effetto, rispetto alle altre, sul miglioramento della qualità di vita dei pazienti.
Infine, in assenza di analisi economiche in grado di supportare una qualche differenza tra i consumi sanitari per l’attività di monitoraggio associata a farmaci biologici con differenti vie di somministrazione nel trattamento dell’AR, si è preferito non associare alcun costo a tale attività, ipotizzando che un’eventuale valorizzazione non determini differenze incrementali di costo tra le alternative considerate.
Conclusioni
I risultati di questa analisi, basata sul calcolo del costo per responder, identificano in upadacitinib un’opzione terapeutica costo-efficace, se confrontato, nella prospettiva del SSN, a 12 o a 24 settimane ad abatacept ev o sc nel trattamento di pazienti adulti con diagnosi di AR in fase attiva da moderata a severa, che hanno avuto una risposta inadeguata o che sono intolleranti a uno o più farmaci antireumatici modificanti la malattia.
Acknowledgment
This is the final version of record of this article as stated in DOI 10.33393/grhta.2022.2383
Disclosures
Conflict of interest: The authors declare no conflict of interest.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Bibliografia
- 1.Gibofsky A. Epidemiology, pathophysiology, and diagnosis of rheumatoid arthritis: A Synopsis. Am J Manag Care. 2014;20((7)(suppl)):S128–S135. PubMed [PubMed] [Google Scholar]
- 2.Gibofsky A. Overview of epidemiology, pathophysiology, and diagnosis of rheumatoid arthritis. Am J Manag Care. 2012;18((13)(suppl)):S295–S302. PubMed [PubMed] [Google Scholar]
- 3.World Health Organization. Chronic diseases and health promotion. Chronic rheumatic conditions. [Accessed March; 2021 ]. Online
- 4.Salaffi F, De Angelis R, Grassi W. MArche Pain Prevalence; INvestigation Group (MAPPING) study. Prevalence of musculoskeletal conditions in an Italian population sample: results of a regional community-based study. I. The MAPPING study. Clin Exp Rheumatol. 2005;23(6):819–828. PubMed [PubMed] [Google Scholar]
- 5.Rossini M, Rossi E, Bernardi D et al. Prevalence and incidence of rheumatoid arthritis in Italy. Rheumatol Int. 2014;34(5):659–664. doi: 10.1007/s00296-014-2974-6. PubMed [DOI] [PubMed] [Google Scholar]
- 6.Smolen JS, Landewé RBM, Bijlsma JWJ et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2019 update. Ann Rheum Dis. 2020;79(6):685–699. doi: 10.1136/annrheumdis-2019-216655. PubMed [DOI] [PubMed] [Google Scholar]
- 7.Nell VP, Machold KP, Eberl G, Stamm TA, Uffmann M, Smolen JS. Benefit of very early referral and very early therapy with disease-modifying anti-rheumatic drugs in patients with early rheumatoid arthritis. Rheumatology (Oxford). 2004;43(7):906–914. doi: 10.1093/rheumatology/keh199. PubMed [DOI] [PubMed] [Google Scholar]
- 8.Emery P, Breedveld FC, Dougados M, Kalden JR, Schiff MH, Smolen JS. Early referral recommendation for newly diagnosed rheumatoid arthritis: evidence based development of a clinical guide. Ann Rheum Dis. 2002;61(4):290–297. doi: 10.1136/ard.61.4.290. PubMed [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Kuek A, Hazleman BL, Ostör AJK. Immune-mediated inflammatory diseases (IMIDs) and biologic therapy: a medical revolution. Postgrad Med J. 2007;83(978):251–260. doi: 10.1136/pgmj.2006.052688. PubMed [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Lee DM, Weinblatt ME. Rheumatoid arthritis. Lancet. 2001;358:903–911. doi: 10.1016/S0140-6736(01)06075-5. PubMed [DOI] [PubMed] [Google Scholar]
- 11.Caporali R, Conti F, Alivernini S et al. Italian Society for Rheumatology. Recommendations for the use of biologic therapy in rheumatoid arthritis: update from the Italian Society for Rheumatology I. Efficacy. Clin Exp Rheumatol. 2011;29((3)(suppl 66)):S7–S14. PubMed [PubMed] [Google Scholar]
- 12.Strand V, Kremer JM, Gruben D, Krishnaswami S, Zwillich SH, Wallenstein GV. Tofacitinib in Combination With Conventional Disease-Modifying Antirheumatic Drugs in Patients With Active Rheumatoid Arthritis: Patient-Reported Outcomes From a Phase III Randomized Controlled Trial. Arthritis Care Res (Hoboken). 2017;69(4):592–598. doi: 10.1002/acr.23004. PubMed [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.van Vollenhoven RF, Fleischmann R, Cohen S et al. ORAL Standard Investigators. Tofacitinib or adalimumab versus placebo in rheumatoid arthritis. N Engl J Med. 2012;367(6):508–519. doi: 10.1056/NEJMoa1112072. PubMed [DOI] [PubMed] [Google Scholar]
- 14.Fleischmann R, Schiff M, van der Heijde D et al. Baricitinib, Methotrexate, or Combination in Patients With Rheumatoid Arthritis and No or Limited Prior Disease-Modifying Antirheumatic Drug Treatment. Arthritis Rheumatol. 2017;69(3):506–517. doi: 10.1002/art.39953. PubMed [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Taylor PC, Keystone EC, van der Heijde D et al. Baricitinib versus Placebo or Adalimumab in Rheumatoid Arthritis. N Engl J Med. 2017;376(7):652–662. doi: 10.1056/NEJMoa1608345. PubMed [DOI] [PubMed] [Google Scholar]
- 16.Thwaites C, Finney A. Rheumatoid arthritis. 2: exploring treatment options to achieve early control and remission. Nurs Times. 2010;106(10):18–20. PubMed [PubMed] [Google Scholar]
- 17.National Institute for Health and Clinical Excellence. London, UK: NICE; 2009. Rheumatoid arthritis (CG79): full guideline.Online [Google Scholar]
- 18.van der Heijde DMFM, van ’t Hof M, van Riel PLCM, van de Putte LBA. Development of a disease activity score based on judgment in clinical practice by rheumatologists. J Rheumatol. 1993;20(3):579–581. PubMed [PubMed] [Google Scholar]
- 19.van Gestel AM, Prevoo ML, van ’t Hof MA, van Rijswijk MH, van de Putte LB, van Riel PL. Development and validation of the European League Against Rheumatism response criteria for rheumatoid arthritis. Comparison with the preliminary American College of Rheumatology and the World Health Organization/International League Against Rheumatism Criteria. Arthritis Rheum. 1996;39(1):34–40. doi: 10.1002/art.1780390105. PubMed [DOI] [PubMed] [Google Scholar]
- 20.Prevoo ML, van ’t Hof MA, Kuper HH, van Leeuwen MA, van de Putte LB, van Riel PL. Modified disease activity scores that include twenty-eight-joint counts. Development and validation in a prospective longitudinal study of patients with rheumatoid arthritis. Arthritis Rheum. 1995;38(1):44–48. doi: 10.1002/art.1780380107. PubMed [DOI] [PubMed] [Google Scholar]
- 21.van Gestel AM, Haagsma CJ, van Riel PL. Validation of rheumatoid arthritis improvement criteria that include simplified joint counts. Arthritis Rheum. 1998 Oct;41(10):1845–50. doi: 10.1002/1529-0131(199810)41:10<1845::AID-ART17>3.0.CO;2-K. PubMed [DOI] [PubMed] [Google Scholar]
- 22.Salaffi F, Cimmino MA, Leardini G, Gasparini S, Grassi W. Disease activity assessment of rheumatoid arthritis in daily practice: validity, internal consistency, reliability and congruency of the Disease Activity Score including 28 joints (DAS28) compared with the Clinical Disease Activity Index (CDAI). Clin Exp Rheumatol. 2009;27(4):552–559. PubMed [PubMed] [Google Scholar]
- 23.Aletaha D, Smolen J. The Simplified Disease Activity Index (SDAI) and the Clinical Disease Activity Index (CDAI): a review of their usefulness and validity in rheumatoid arthritis. Clin Exp Rheumatol. 2005;23((5)(suppl 39)):S100–S108. PubMed [PubMed] [Google Scholar]
- 24.Upadacitinib RCP. [Accessed November; 2020 ]. Online
- 25.Burmester GR, Kremer JM, Van den Bosch F et al. Safety and efficacy of upadacitinib in patients with rheumatoid arthritis and inadequate response to conventional synthetic disease-modifying anti-rheumatic drugs (SELECT-NEXT): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. 2018;391(10139):2503–2512. doi: 10.1016/S0140-6736(18)31115-2. PubMed [DOI] [PubMed] [Google Scholar]
- 26.Fleischmann R, Pangan AL, Song IH et al. Upadacitinib versus placebo or adalimumab in patients with rheumatoid arthritis and an inadequate response to methotrexate: results of a phase III, double-blind, randomized controlled trial. Arthritis Rheumatol. 2019;71(11):1788–1800. doi: 10.1002/art.41032. PubMed [DOI] [PubMed] [Google Scholar]
- 27.Genovese MC, Fleischmann R, Combe B et al. Safety and efficacy of upadacitinib in patients with active rheumatoid arthritis refractory to biologic disease-modifying anti-rheumatic drugs (SELECT-BEYOND): a double-blind, randomised controlled phase 3 trial. Lancet. 2018;391(10139):2513–2524. doi: 10.1016/S0140-6736(18)31116-4. PubMed [DOI] [PubMed] [Google Scholar]
- 28.Smolen JS, Pangan AL, Emery P et al. Upadacitinib as monotherapy in patients with active rheumatoid arthritis and inadequate response to methotrexate (SELECT-MONOTHERAPY): a randomised, placebo-controlled, double-blind phase 3 study. Lancet. 2019;393(10188):2303–2311. doi: 10.1016/S0140-6736(19)30419-2. PubMed [DOI] [PubMed] [Google Scholar]
- 29.van Vollenhoven R, Takeuchi T, Pangan AL et al. Efficacy and safety of upadacitinib monotherapy in methotrexatenaïve patients with moderately to severely active rheumatoid arthritis (SELECT-EARLY): a randomized, double-blind, active-comparator, multi-center, multi-country trial. Arthritis Rheumatol. 2020 doi: 10.1002/art.41384. Epub ahead of print. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Rubbert-Roth A, Enejosa J, Pangan AL et al. Trial of Upadacitinib or Abatacept in Rheumatoid Arthritis. N Engl J Med. 2020;383(16):1511–1521. doi: 10.1056/NEJMoa2008250. PubMed [DOI] [PubMed] [Google Scholar]
- 31.Rubbert-Roth A, Enejosa J, Pangan AL et al. Efficacy and safety of upadacitinib vs abatacept in patients with active rheumatoid arthritis and prior inadequate response or intolerance to biologic disease-modifying anti-rheumaticdDrugs (SELECT-CHOICE): A double-blind, randomized controlled phase 3 trial. Presented at the European Congress of Rheumatology, 2020 June 3–6; Online [Google Scholar]
- 32.Abatacept RCP. [Accessed November; 2020 ]. Online
- 33.Genovese MC, Covarrubias A, Leon G et al. Subcutaneous abatacept versus intravenous abatacept: a phase IIIb noninferiority study in patients with an inadequate response to methotrexate. Arthritis Rheum. 2011;(10):2854–64. doi: 10.1002/art.30463. PubMed [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Fattore G. Gruppo di lavoro AIES (coordinato da G. Fattore). Proposta di linee guida per la valutazione economica degli interventi sanitari in Italia. PharmacoEcon Ital Res Artic. 2009;11(2):83–93. doi: 10.1007/BF03320660. [DOI] [Google Scholar]
- 35.National Institute for Health and Care Excellence. Guide to the methods of technology appraisal. 2013. [Accessed March; 2021 ]. Online [PubMed]
- 36.Canadian Agency for Drugs and Technologies in Health. Guidelines for the Economic Evaluation of Health Technologies: Canada, 3rd Edition. 2006. [Accessed March; 2021 ]. Online
- 37.NICE Guidance. Adalimumab, etanercept, infliximab, certolizumab pegol, golimumab, tocilizumab and abatacept for rheumatoid arthritis not previously treated with DMARDs or after conventional DMARDs only have failed. Technology appraisal guidance Published: 26 January 2016. [Accessed March; 2021 ]. Online