Abstract
目的
通过分析MC1R在食管鳞癌细胞和组织中的表达水平及其与相关临床病理参数的相关性, 探讨MC1R在食管鳞癌中的临床意义。
方法
通过生物信息学分析MC1R在食管癌中的表达情况; 以RT-PCR和Western blotting方法比较分析人食管上皮细胞BAr-T、人食管鳞癌细胞ECA109、KYSE30、KYSE150、KYSE510、TE-1、TE-13、EC9706、人胃癌细胞SGC7901及19对食管鳞癌组织和对应癌旁组织中MC1R的表达水平; 以IHC方法比较分析32对食管鳞癌组织切片和对应癌旁组织切片中MC1R的表达水平; 使用t检验进行组间MC1R表达量的差异比较, 使用Fisher's精确检验分析MC1R表达水平与临床病理特征之间的关系。
结果
生物信息学分析显示MC1R在食管癌组织中显著高表达(P < 0.05);食管鳞癌细胞ECA109、KYSE30、KYSE510、TE-13、EC9706和胃癌细胞系SGC7901中MC1R表达量高于食管上皮细胞(P < 0.05);食管鳞癌组织切片中MC1R相对表达量显著高于癌旁组织(P < 0.05)。MC1R高表达现象主要存在于老年、胸中段和中分化食管鳞癌患者中, 其与肿瘤T分期有关(P < 0.05), 与年龄、细胞分化程度、肿瘤原发部位、TNM分期等临床病理参数无关(P>0.05)。
结论
MC1R在食管鳞癌细胞系和组织中表达量显著升高, 可能作为食管鳞癌诊断的辅助分子标志物。
Keywords: MC1R, 食管鳞癌, 临床病理参数, 分子标志物
Abstract
Objective
To investigate the expression of MC1R in esophageal squamous cell carcinoma and its correlation with the clinicopathological parameters.
Methods
We analyzed the expression of MC1R in esophageal cancer based on data from TCGA databse and examined its expression levels using RT-PCR and Western blotting in a human esophageal epithelial cell line BAr-T, human esophageal squamous cell carcinoma cell lines ECA109, KYSE30, KYSE150, KYSE510, TE-1, TE-13, and EC9706, a human gastric cancer cell line SGC7901 and 19 pairs of esophageal squamous cell carcinoma tissues and adjacent tissues.Immunohistochemistry was used to detect MC1R expression levels in 32 pairs of paraffin-embedded sections of esophageal squamous cell carcinoma and adjacent tissues, and the correlation of MC1R expression and the patients'clinicopathological characteristics was analyzed.
Results
Bioinformatics analysis showed that MC1R was significantly overexpressed in esophageal cancer tissues (P < 0.05).MC1R expression was also increased in 5 esophageal squamous cell carcinoma cell lines ECA109, KYSE30, KYSE510, TE-13, EC9706 and the gastric cancer cell line SGC7901 as compared with that in esophageal epithelial cells (P < 0.05).Immunohistochemistry revealed significantly increased MC1R expression in esophageal squamous cell carcinoma tissue sections in comparison with the adjacent tissue sections (P < 0.05).In patients with esophageal squamous cell carcinoma, a high MC1R expression was detected mainly in those with an old age, positive for middle-thoracic involvement, and with moderately differentiated tumor cells, and showed a correlation with T stage of tumor (P < 0.05), but not with the other clinicopathological parameters such as gender, age, degree of cell differentiation, primary tumor site, or TNM stage (P>0.05).
Conclusion
MC1R is highly expressed in esophageal squamous cell carcinoma and may serve as a molecular biomarker to assist in the diagnosis of esophageal squamous cell carcinoma.
Keywords: MC1R, esophageal squamous cell carcinoma, clinicopathological parameters, molecular biomarker
食管癌(EC)是常见的消化道恶性肿瘤之一,其发病率和死亡率在我国分别位居第6位和第4位[1]。流行病学数据表明,食管癌的发病率具有男性高于女性的特点,男女比例约为3∶1[2]。食管癌的组织学类型主要为鳞状细胞癌和腺癌[3],其中食管鳞癌(ESCC)是我国食管癌患者的常见类型[4]。由于食管鳞癌缺乏早期临床症状及特异性诊断方法,故临床确诊时多已为中晚期,错过患者最佳的治疗时期,致使治愈率和五年生存率较低[5]。因此,探索可用于食管鳞癌诊断的分子标志物具有重要意义。
黑色素皮质I型受体(MC1R)基因是人类黑色素合成过程中的关键基因[6]。近些年来,越来越多的研究表明MC1R与黑色素瘤、结直肠癌等肿瘤的发生相关[7-9],其主要通过调控肿瘤细胞增殖进而参与肿瘤的发生发展[9-11]。迄今为止,暂无MC1R在食管鳞癌细胞或组织中表达量变化的相关文献报道,但柳溪林等[12]在对靶向MC1R重组毒素进行不同细胞系的杀伤作用分析时发现,该毒素对人食管中段鳞癌细胞ECA109细胞的杀伤能力很强,且MC1R在该细胞中的表达量显著上调,但没有进行临床病例分析。MC1R在肿瘤细胞与正常细胞中表达量的差异,表明其具有作为诊断或靶向治疗标志物的潜力[13]。
因此,为了进一步探究MC1R在食管鳞癌临床中的意义,我们使用RT-PCR、Western blotting和IHC等方法探究MC1R在食管鳞癌中的表达情况,并分析MC1R表达量与临床病理参数如年龄、分化程度、分期等的关系,以初步探讨MC1R在食管鳞癌诊断或预后中的价值。
1. 资料和方法
1.1. 基于UALCAN平台进行生物信息学分析
使用基于TCGA数据库的UALCAN平台(http://ualcan.path.uab.edu/analysis.html)验证MC1R在食管癌和正常食管组织中的表达情况[14]。在UALCAN平台中设置限定条件如下:gene symbol: MC1R; TCGA dataset: Esophageal carcinoma。
1.2. 组织样本与细胞
选取2019年~2021年吉林大学中日联谊医院收治的接受食管癌根治手术治疗且病理和临床资料完整的食管鳞癌患者51例,其中男性47例,女性4例。所选取术后组织标本均由临床和病理确诊为食管鳞癌,包括19例食管鳞癌组织和配对的食管癌旁组织(距癌灶3~5 cm)以及32例食管鳞癌组织切片和配对的癌旁组织切片。纳入标准:(1)原发性食管癌,且经病理确诊为食管鳞状细胞癌;(2)患者接受食管癌根治手术,男女均可;(3)患者依从性好,临床资料完整;(4)患者同意本研究并签署知情同意书。排除标准:(1)合并患有其他部位恶性肿瘤的患者;(2)合并患有其他可能影响肿瘤标志物表达的疾病;(3)存在精神类疾病、自身免疫系统疾病、妊娠、哺乳等可能影响本研究结果的患者;(4)术前曾进行放化疗及其他针对食管癌的治疗[15, 16]。受地域因素影响,所获取的样本男女比例差异较大,但鉴于食管癌男女性皆可发病及其流行病学特征,故未将性别作为排除标准。参照AJCC制订的恶性肿瘤临床分期(第八版)中食管癌分期标准对标本进行临床分期,并分别从年龄、肿瘤位置、分化程度及TNM分期等7个临床特征进行分析。本研究获得吉林大学中日联谊医院伦理委员会的许可(伦理号:20220118012)。
人食管鳞癌细胞系TE-1、ECA109、KYSE150购自湖南丰晖生物科技有限公司,人食管鳞癌细胞系KYSE30、KYSE510购自上海誉弛生物科技有限公司,人食管鳞癌细胞系TE-13、EC9706购自宁波明舟生物科技有限公司,以RPMI 1640培养基培养;人食管上皮细胞BAr-T、人胃癌细胞系SGC7901购自宁波明舟生物科技有限公司,以DMEM培养基培养。上述培养基中均含有10%胎牛血清(FBS)和1%青霉素-链霉素混合液,细胞置于37 ℃,5% CO2的培养箱中培养。
1.3. 试剂及材料
TRIzol试剂(Invitrogen);PrimerScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)(TaKaRa);2×M5 HiPer Plus Taq HiFi PCR mix(with blue dye)、M5 Prestained Protein Ladder(10 000-180 000)with 45 000、M5 DL2000 DNA Marker(北京聚合美生物科技);RIPA裂解液(碧云天生物技术);PMSF、BCA蛋白定量试剂盒(北京索莱宝科技);兔源MC1R多克隆抗体、鼠源β-actin单克隆抗体、HRP标记的山羊抗兔和山羊抗小鼠抗体(Immunoway);即用型免疫组化UltraSensitive TM SP试剂盒(福州迈新生物技术);DAB显色试剂盒(武汉博士德生物工程)。PCR引物由上海生工生物工程股份有限公司合成(表 1)。
表 1.
RT-PCR引物序列
Sequence of RT-PCR primers
| Gene | Sequence (5'-3') | Length of product (bp) |
| MC1R | F: CATCGCCAAGAACCGGAAC | 271 |
| R: GTAGCGCAGTGCGTAGAAGA | ||
| β-actin | F: CATGTACGTTGCTATCCAGGC | 250 |
| R: CTCCTTAATGTCACGCACGAT |
1.4. 食管鳞癌细胞及组织总RNA提取和cDNA的合成
采用TRIzol法提取细胞和食管癌临床组织样品中的总RNA[17]。按照PrimerScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)操作说明书进行RNA的反转录,合成cDNA。
1.5. 食管鳞癌细胞及组织总蛋白提取
将食管癌临床组织样品进行充分研磨,使用含有1%PMSF的RIPA裂解液提取细胞和食管癌临床组织样品中的总蛋白,用BCA蛋白定量试剂盒测量其浓度[18]。
1.6. 食管鳞癌细胞及组织基因水平MC1R表达情况的RT-PCR分析
以1.3所述的cDNA为模板,以β-actin为内参基因[19],进行RT-PCR验证。反应体系为20 μL,包括:2×M5 HiPer Plus Taq HiFi PCR mix(with blue dye)10 μL、cDNA 2 μL、正向引物和反向引物各1 μL、DEPC水6 μL。反应条件为:94 ℃预变性2 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环。用双蒸馏水(ddH2O)作为空白对照,以排除体系污染。PCR产物经质量浓度为10 g/L琼脂糖凝胶电泳检测,使用Image J软件对核酸表达进行半定量分析[20]。
1.7. 食管鳞癌细胞及组织蛋白水平MC1R表达情况的Western blotting分析
将提取的细胞或组织总蛋白经10% SDS-PAGE凝胶电泳分离,通过PVDF膜以200 mA湿转2 h,兔源MC1R多克隆抗体稀释倍数为1∶300,鼠源β-actin单克隆抗体稀释倍数为1∶500。二抗为HRP标记的山羊抗兔和山羊抗小鼠抗体,以1∶3000的稀释倍数进行孵育。经TBST洗膜后于化学发光成像系统Microchemi 4.0显影,使用Image J软件测定显影密度并对蛋白表达进行半定量分析[21]。选择食管鳞癌患者癌组织MC1R表达量的中位数0.773为阈值,小于等于此值计入低表达组,高于此值计入高表达组[9]。
1.8. 食管鳞癌组织切片中MC1R的表达情况分析
采用免疫组织化学(IHC)方法分析MC1R在食管鳞癌组织切片中的表达情况。将石蜡切片在二甲苯中脱蜡,经由不同浓度的乙醇水化后,使用EDTA缓冲液进行抗原修复。后续操作按照即用型免疫组化UltraSensitiveTM SP试剂盒的说明书进行,其中切片在4 ℃与MC1R抗体(Immunoway, 1∶50)孵育过夜。并按照DAB显色试剂盒的说明书进行显色,自来水冲洗后用苏木精复染。最后,在光学显微镜下观察切片并记录。
依据细胞的染色强度和组织中阳性细胞百分比综合判断染色情况。染色强度评分为0(阴性);1(弱);2(中等);3(强)。染色程度取决于阳性细胞的百分比,评分为0(0%~5%);1 (6%~25%);2(26%~50%);3(51%~ 75%);4(76%~100%)。将染色强度得分和染色程度得分相乘计算最终得分,0~4分为低表达;4分以上为高表达[22]。
1.9. 统计学分析
采用GraphPad Prism 8.0和SPSS 22.0进行数据分析。使用t检验比较组间MC1R表达量的差异[23],以确定MC1R的差异表达是否具有统计学意义。采用Fisher's精确检验分析MC1R表达与临床病理特征之间的关系[24],以确定MC1R在食管鳞癌中的临床意义。P < 0.05为差异具有统计学意义。
2. 结果
2.1. 食管癌与MC1R表达的生物信息学分析
使用UALCAN平台验证TCGA数据库中MC1R在正常食管组织和食管癌组织中的差异表达情况,结果表明,MC1R在食管癌组织中显著高表达(P < 0.05,图 1)。
图 1.
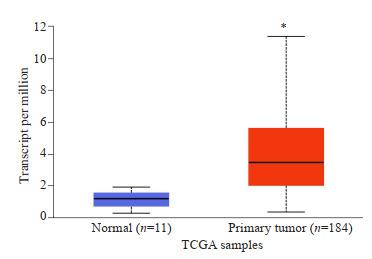
TCGA数据库中MC1R在正常食管组织和食管癌组织中的表达
Expression of MC1R in normal esophageal and esophageal carcinoma tissues in TCGA(*P < 0.05).
2.2. 细胞MC1R表达情况
MC1R在食管鳞癌细胞系KYSE150中的表达量与BAr-T相当,在TE-1中的表达量略高于BAr-T,食管鳞癌细胞系ECA109、KYSE30、KYSE510、TE-13、EC9706和胃癌细胞系SGC7901中MC1R表达量显著高于人食管上皮细胞BAr-T(P < 0.01,图 2)。
图 2.
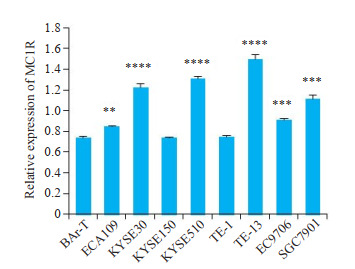
MC1R细胞水平相对表达分析
Analysis of relative MC1R expression in 7 esophageal squamous cell carcinoma (ESCC) cell lines, gastric cancer cell line SGC7901 and esophageal epithelial cell BAr-T. **P < 0.01, ***P < 0.001, ****P < 0.0001 vs BAr-T cells.
2.3. 组织MC1R表达情况
分别使用RT-PCR和Western blotting检测MC1R在19例食管鳞癌及对应癌旁组织的mRNA表达水平和蛋白表达水平,图 3A、B分别为8组病例的RT-PCR和Western blotting检测结果,其中超过50%(10/19对)的病例癌组织MC1R表达量高于癌旁组织。但t检验结果(图 3C、D)显示,RT-PCR和Western blotting检测的MC1R表达量在癌组织与癌旁组织中差异不显著(P>0.05)。
图 3.
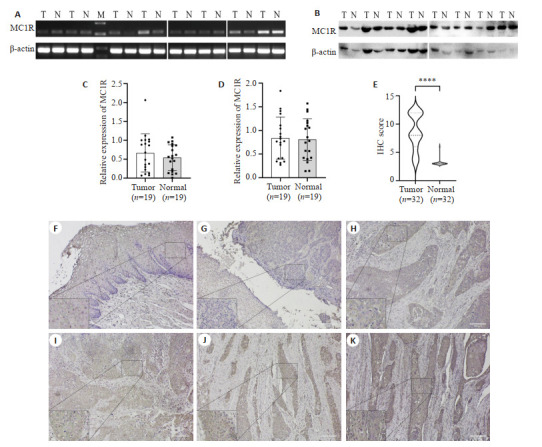
MC1R在食管鳞癌临床组织中的表达情况
MC1R expression in clinical samples of ESCC. A: MC1R mRNA expression in 8 pairs of representative cases detected by RT-PCR (T: ESCC tissue. N: Paracancerous tissue). B: MC1R expression in 8 pairs of representative cases detected by Western blotting. C: Analysis of MC1R mRNA expression in 19 pairs of ESCC and adjacent tissues detected by RT-PCR. D: Analysis of MC1R expression in 19 pairs of ESCC and adjacent tissues detected by Western blotting. E: Analysis of differential expression of MC1R in 32 pairs of ESCC and adjacent tissue sections detected by IHC. F-K: MC1R expression in 6 representative cases detected by IHC (Original magnification: ×100). ****P < 0.0001.
使用IHC的方法检测32对食管鳞癌及对应癌旁组织切片中MC1R的表达量,其中有93.75%(30/32对)的癌组织切片MC1R表达量高于相应的癌旁组织切片。使用t检验比较两组组织之间MC1R的表达量差异,结果如图 3E所示,食管鳞癌切片样本中癌组织MC1R表达量显著高于对应的癌旁组织,差异具有统计学意义(P < 0.0001)。6例代表性病例的IHC检测结果中,F为食管癌旁组织,镜下可见鳞状上皮增生,上皮脚下延,细胞排列整齐,层次清晰,无异型性,整体呈颜色较浅的背景色;G为MC1R低表达(IHC Score=3)的病例,镜下可见癌组织不规则片状排列,间质少许纤维组织内慢性炎性细胞浸润,肿瘤细胞染色强度相较于癌旁食管组织略深,胞浆呈浅黄色,镜下阳性细胞数60%+;H、I为MC1R较高表达(IHC Score=8)的病例,镜下可见癌细胞多角形,不规则巢片状排列,癌巢与间质边界清楚,核分裂象易见,间质纤维组织中有炎性细胞浸润,肿瘤细胞胞浆呈棕黄色,镜下阳性细胞数约76%+;J、K为MC1R高表达(IHC Score=12)病例,可见癌细胞多角形,呈大小不一的巢片状排列,浸润性生长,间质纤维组织增生,炎性细胞浸润,肿瘤细胞胞浆呈棕褐色,镜下阳性细胞数约90%+(图 3F~K)。
2.4. 患者临床信息统计
食管鳞癌组织与切片样品取自51名食管癌患者。所有患者均接受了手术切除,且临床病历与样品相匹配。患者的中位年龄为63(45~81)岁。根据第八版食管癌TNM分期标准,共有26名患者诊断为Ⅰ/Ⅱ期,25名患者为Ⅲ/Ⅳ期。患者的具体临床信息见表 2。
表 2.
51例食管鳞癌患者的临床病理参数
Clinicopathological parameters of 51 patients with ESCC
| Characteristics | Number of cases | Percentage (%) |
| All cases | 51 | |
| Gender | ||
| Male | 47 | 92.2 |
| Female | 4 | 7.8 |
| Median age, year (range) | 63 (45-81) | |
| Primary site | ||
| Upper thoracic | 2 | 3.9 |
| Middle thoracic | 35 | 68.6 |
| Lower thoracic | 14 | 27.5 |
| Differentiation | ||
| Well | 3 | 5.9 |
| Moderate | 36 | 70.6 |
| Poor | 12 | 23.5 |
| TNM Stage | ||
| Ⅰ | 5 | 9.8 |
| Ⅱ, Ⅱa, Ⅱb | 21 | 41.2 |
| Ⅲ, Ⅲa, Ⅲb | 20 | 39.2 |
| Ⅳ, Ⅳa, Ⅳb | 5 | 9.8 |
| T Stage | ||
| T1 | 5 | 9.8 |
| T2 | 10 | 19.6 |
| T3 | 32 | 62.8 |
| T4 | 4 | 7.8 |
| N Stage | ||
| N0 | 26 | 51.0 |
| N1 | 21 | 41.2 |
| N2 | 4 | 7.8 |
| M Stage | ||
| M0 | 48 | 94.1 |
| M1 | 3 | 5.9 |
2.5. MC1R表达与临床病理特征的关系
将Western blotting和IHC方法检测的组织样品分别按1.7和1.8中所述的判定标准分为高表达组与低表达组。MC1R在不同的年龄、肿瘤原发部位、细胞分化程度和TNM分期中的表达状态如表 3所示。
表 3.
食管鳞癌中MC1R表达与临床病理特征的关系
Relationship between expression of MC1R and clinicopathological features in ESCC
| Clinicopathological parameters | MC1R (Detected by WB) | P | MC1R (Detected by IHC) | P | ||
| MC1R low expression group | MC1R high expression group | MC1R low expression group | MC1R high expression group | |||
| Number of case | 9 | 10 | 6 | 26 | ||
| Age (year) | 0.170 | 0.648 | ||||
| ≥60 | 2 | 6 | 5 | 18 | ||
| < 60 | 7 | 4 | 1 | 8 | ||
| Primary site | 0.245 | 0.310 | ||||
| Upper thoracic | 0 | 1 | 1 | 0 | ||
| Middle thoracic | 5 | 2 | 3 | 17 | ||
| Lower thoracic | 4 | 7 | 2 | 9 | ||
| Differentiation | 0.305 | 0.205 | ||||
| Well | 1 | 0 | 1 | 1 | ||
| Moderate | 4 | 9 | 5 | 18 | ||
| Poor | 4 | 1 | 0 | 7 | ||
| T Stage | 0.019 | 0.439 | ||||
| T1 | 2 | 0 | 1 | 2 | ||
| T2 | 3 | 0 | 0 | 7 | ||
| T3 | 4 | 9 | 5 | 14 | ||
| T4 | 0 | 1 | 0 | 3 | ||
| N Stage | 0.103 | 0.604 | ||||
| N0 | 3 | 6 | 3 | 14 | ||
| N1 | 6 | 2 | 3 | 10 | ||
| N2 | 0 | 2 | 0 | 2 | ||
| M Stage | 1.000 | 1.000 | ||||
| M0 | 8 | 9 | 6 | 25 | ||
| M1 | 1 | 1 | 0 | 1 | ||
| TNM stage | 0.550 | 0.653 | ||||
| Ⅰ | 2 | 1 | 1 | 1 | ||
| Ⅱ | 2 | 5 | 2 | 12 | ||
| Ⅲ | 4 | 2 | 3 | 11 | ||
| Ⅳ | 1 | 2 | 0 | 2 | ||
在随机抽取的食管鳞癌患者中,MC1R高表达更易发生于60岁以上的老年患者以及胸中段食管鳞癌和中分化食管鳞癌患者。将MC1R表达与TNM分期结合分析,发现MC1R高表达主要存在于T3期病例。
为了进一步确定MC1R表达在食管鳞癌临床中的意义,采用Fisher's精确检验分析MC1R表达水平与年龄、肿瘤原发部位、细胞分化程度和TNM分期等临床病理参数之间的关系。数据分析显示Western blotting方法检测的冷冻组织样品中MC1R表达水平与T分期相关(P < 0.05),与其他已获得的临床病理参数无关(P>0.05);IHC方法检测的切片组织样品中MC1R表达水平与已获得的临床病理参数无关(P>0.05)。
3. 讨论
食管鳞癌是食管癌中最常见的类型,约占所有食管癌病例的90%[25],因其现有标志物的临床诊断效果存在局限性[26],故仍以CT、胃镜和活检等作为主要诊断方式。近年来,有关肿瘤分子标志物的研究逐渐增多,其中MC1R已被认为是黑色素瘤的重要标志物,在黑色素瘤中高表达且可作为黑色素瘤靶向治疗的靶点[27, 28]。迄今为止,有关MC1R与食管鳞癌的研究还未见报道,但实验室前期研究发现食管鳞癌细胞系ECA109中存在MC1R高表达的现象[12]。使用UALCAN平台进行生物信息学分析同样显示MC1R在食管癌组织中显著高表达(P < 0.05)。在此基础上,本研究首次探讨了MC1R在食管鳞癌中的表达及其在食管鳞癌临床上的意义。
首先,为了确定MC1R在食管鳞癌细胞系的普遍表达水平,我们购买了大部分可购得的食管鳞癌细胞系,并分别利用RT-PCR方法与Western blotting方法检测MC1R在mRNA水平和蛋白水平的表达情况。结果显示,除KYSE150之外的其他食管鳞癌细胞MC1R表达量均高于人食管上皮细胞BAr-T,且在所检测的7株食管鳞癌细胞系中,5株食管鳞癌细胞MC1R表达量显著高于食管上皮细胞BAr-T。因此,我们初步认为MC1R的表达可能与食管鳞癌的发生有关。
为了进一步探究临床食管鳞癌患者组织中MC1R的表达情况,对已获得的19对冷冻保存的食管鳞癌组织及癌旁组织分别提取RNA和蛋白质,并利用RT-PCR和Western blotting检测食管鳞癌组织中MC1R在mRNA水平和蛋白水平的表达情况。结果显示,超过半数(10/19对)的样品检测结果为癌组织MC1R表达量高于癌旁组织,但采用t检验进行统计学分析时发现,癌组织与癌旁组织间MC1R表达量差异不显著(P>0.05)。
为了提高样本量,我们还抽取了32对食管鳞癌及癌旁组织的病理石蜡切片,通过IHC方法检测组织切片中的MC1R表达情况。结果显示大部分(30/32对)癌组织MC1R表达量高于对应的癌旁组织。使用t检验进行两种组织之间MC1R表达量的差异分析,结果显示,与对应癌旁组织相比,食管鳞癌组织样本中MC1R表达量显著升高(P < 0.05)。镜下观察免疫组化染色后的组织,可见癌旁食管组织鳞状上皮增生,细胞排列整齐,层次清晰,无异型性,整体呈较浅的背景色;食管鳞癌组织不规则巢片状排列,癌灶内肿瘤细胞胞浆呈棕黄色至棕褐色,细胞核未着色,说明MC1R在食管鳞癌细胞中呈浆阳性表达。这可能是因为MC1R具有7个跨膜结构域[29],抗体的免疫原即抗体针对的肽段也是多次跨膜的区域,导致抗体结合位点可能在细胞膜内从而出现浆阳性的情况;此外,由于组织中细胞密度较高,在普通光学显微镜下难以明确辨别具体的细胞结构,后续可使用膜蛋白特异性的Marker共染,来确认是否为细胞膜表达。但整体而言,MC1R在食管鳞癌中表达呈阳性,且与对应的食管癌旁组织相比表达量显著升高。
食管鳞癌组织病理切片的IHC检测结果显示,癌组织与癌旁组织MC1R表达量具有极显著差异(P < 0.01),而WB检测结果未见显著差异。造成这种现象的可能原因如下:一是IHC病理切片要求组织离体后置于福尔马林溶液中固定,以保持细胞原有的成分,防止细胞溶解、抗原丢失[30];而冷冻的组织受运输、保存等环节的影响,存在抗原丢失的可能,进而导致表达量检测不够精确。二是Western blotting通常检测游离蛋白,而IHC可原位检测组织切片的某个蛋白,在病理诊断中的准确率、灵敏度、特异性更高,漏诊率低[31]。尽管如此,仍有78.4%(40/51)的病例食管鳞癌组织MC1R表达量高于癌旁组织,因此,我们认为MC1R在食管鳞癌中普遍存在高表达现象。这表明MC1R在食管鳞癌的发生中处于活跃状态,预示着MC1R与食管鳞癌的发生可能有潜在相关性,即对食管鳞癌的发生可能有促进或抑制作用,MC1R有可能作为食管鳞癌潜在的分子标志物。
食管鳞癌不同临床治疗措施的选择很大程度上依赖于临床病理参数[32],如年龄、肿瘤细胞分化程度、TNM分期等。因此,本研究分析了MC1R表达量与临床病理参数的关系,发现MC1R高表达更易发生在老年患者中,且以胸中段和中分化食管鳞癌较为普遍。此外,MC1R高表达主要存在于T3期,此时肿瘤已侵犯食管纤维膜,浸润程度较深,不利于食管组织的彻底恢复[33],这暗示了MC1R对于食管鳞癌的预后可能具有指示意义,MC1R高表达的食管鳞癌患者预后情况可能较差。
为了进一步确定MC1R表达在食管鳞癌临床中的意义,运用Fisher 's精确检验分析MC1R表达水平与年龄、肿瘤原发部位、细胞分化程度和TNM分期等之间的关系,数据分析显示Western blotting方法检测的冷冻组织样品中MC1R表达水平与T分期相关(P < 0.05),与其他已获得的临床病理参数无关(P>0.05);IHC方法检测的切片组织样品中MC1R表达水平与已获得的临床病理参数无关(P>0.05)。这可能是由于获取的样品中低表达MC1R的数量较少、男性所占比例较大等原因,导致研究对象选择性偏倚,因此在分析MC1R与临床病理参数的关系时结果有所偏差。出现这种性别偏倚的现象主要是因为食管癌在发病率和死亡率上都具有男性高于女性[34]的特点,导致难以获取足够的女性样本,整体样本量受到局限(包括样本数量和样本类型),未来需要大量女性患者的临床病例研究以深入探讨MC1R与临床病理参数的关系。此外,癌组织存在较正常组织更为复杂的生物学性状,仅上述病理参数并不能充分反映食管鳞癌病灶内复杂的生物学特征。目前可用于食管鳞癌临床诊断的肿瘤标志物有限,缺乏特异的诊断标志物,很多病例缺乏相关肿瘤标志物的检测,因此无法与其他肿瘤标志物相结合以进行更深入的分子生物学分析。但上述研究结果表明,MC1R在食管鳞癌发生中的异常表现值得关注,其表达量升高可能与T分期有关。在未来的研究中,我们将通过大规模的临床研究,来进一步评估食管鳞癌中MC1R表达与临床病理参数的关系。
本研究分析了食管鳞癌中MC1R的表达情况,发现其在食管鳞癌细胞系和食管鳞癌组织中的表达量较正常细胞和组织明显升高,且MC1R高表达现象主要存在于老年、胸中段、中分化、T3期食管鳞癌患者中。综上所述,MC1R与食管鳞癌的发生具有一定的关系,MC1R有可能作为食管鳞癌诊断的辅助分子标志物,但其机制和具体临床意义目前尚不明确,仍需进一步探索。
Biography
周笑世,在读硕士研究生,E-mail: zhouxs1996@163.com
Funding Statement
山东省自然科学基金(ZR2019MH103);吉林省科技发展计划重点研发项目(20200404123YY);盘锦市自然科学基金计划(202101005)
Contributor Information
周 笑世 (Xiaoshi ZHOU), Email: zhouxs1996@163.com.
柳 增善 (Zengshan LIU), Email: zsliu1959@163.com.
张 国军 (Guojun ZHANG), Email: zguojun1962@163.com.
References
- 1.Cao W, Chen HD, Yu YW, et al. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020. Chin Med J (Engl) 2021;134(7):783–91. doi: 10.1097/CM9.0000000000001474. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CACancer J Clin. 2021;71(3):209–49. doi: 10.3322/caac.21660. [DOI] [PubMed] [Google Scholar]
- 3.Liu KC, Zhao TT, Wang JK, et al. Etiology, cancer stem cells and potential diagnostic biomarkers for esophageal cancer. Cancer Lett. 2019;458:21–8. doi: 10.1016/j.canlet.2019.05.018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.周 家琛, 陈 茹, 庄 贵华, et al. 食管鳞状细胞癌危险因素与潜在分子标志物研究进展. 中华肿瘤杂志. 2021;43(12):1223–7. doi: 10.3760/cma.j.cn112152-20190812-00514. [DOI] [PubMed] [Google Scholar]
- 5.张 丽亚, 贾 培君, 尚 晋文, et al. 食管癌肿瘤标志物的研究进展. 肿瘤基础与临床. 2020;33(3):272–6. [Google Scholar]
- 6.Herraiz C, Garcia-Borron JC, Jiménez-Cervantes C, et al. MC1R signaling. Intracellular partners and pathophysiological implications. Biochim Biophys Acta Mol Basis Dis. 2017;1863(10 Pt A):2448–61. doi: 10.1016/j.bbadis.2017.02.027. [DOI] [PubMed] [Google Scholar]
- 7.Manganelli M, Guida S, Ferretta A, et al. Behind the scene: exploiting MC1R in skin cancer risk and prevention. Genes. 2021;12(7):1093. doi: 10.3390/genes12071093. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Miao Y, Quinn TP. Advances in receptor-targeted radiolabeled peptides for melanoma imaging and therapy. J Nucl Med. 2021;62(3):313–8. doi: 10.2967/jnumed.120.243840. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Peng LX, Chang J, Liu XL, et al. MC1R is a prognostic marker and its expression is correlated with MSI in colorectal cancer. Curr Issues Mol Biol. 2021;43(3):1529–47. doi: 10.3390/cimb43030108. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Kansal RG, McCravy MS, Basham JH, et al. Inhibition of melanocortin 1 receptor slows melanoma growth, reduces tumor heterogeneity and increases survival. Oncotarget. 2016;7(18):26331–45. doi: 10.18632/oncotarget.8372. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Herraiz C, Jiménez-Cervantes C, Sánchez-Laorden B, et al. Functional interplay between secreted ligands and receptors in melanoma. Semin Cell Dev Biol. 2018;78:73–84. doi: 10.1016/j.semcdb.2017.06.021. [DOI] [PubMed] [Google Scholar]
- 12.柳溪林. 靶向MC1R重组毒素高效表达纯化、抗黑色素瘤活性及相关靶向信号分析[D]. 长春: 吉林大学, 2018.
- 13.郭 文静, 谢 而付, 张 巧娣. 不同早期消化道恶性肿瘤的血清肿瘤标志物表达差异. 实用临床医药杂志. 2021;25(5):7–9. [Google Scholar]
- 14.Wu GT, Zhao ZJ, Yan YL, et al. CPS1 expression and its prognostic significance in lung adenocarcinoma. Ann Transl Med. 2020;8(6):341. doi: 10.21037/atm.2020.02.146. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.胡 曙民, 史 良会. PFN2在胃癌组织中高表达并促进胃癌细胞的增殖和迁移. 南方医科大学学报. 2022;42(2):215–22. [Google Scholar]
- 16.Han N, Zhang YY, Zhang ZM, et al. High expression of PDGFA predicts poor prognosis of esophageal squamous cell carcinoma. Medicine. 2021;100(20):e25932. doi: 10.1097/MD.0000000000025932. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.梁 云微, 连 相尧, 党 春艳, et al. lncRNA01296在食管癌组织中的表达及其对食管癌TE-2细胞增殖和迁移的影响. 中国肿瘤生物治疗杂志. 2019;26(12):1377–82. [Google Scholar]
- 18.孟 雪梅, 刘 思桦, 常 胜, et al. miR-1299在食管癌中的表达及其对食管癌细胞迁移和侵袭的影响. 肿瘤. 2019;39(8):623–31. [Google Scholar]
- 19.Chang J, Liu ZS, Song DF, et al. Cholecystokinin type 2 receptor in colorectal cancer: diagnostic and therapeutic target. J Cancer Res Clin Oncol. 2020;146(9):2205–17. doi: 10.1007/s00432-020-03273-z. [DOI] [PubMed] [Google Scholar]
- 20.李 菁, 金 玉, 李 启阳, et al. 蛋白激酶WEE1在胃癌组织中的表达及其临床意义. 中国临床解剖学杂志. 2020;38(6):680-4, 690. [Google Scholar]
- 21.Wang C, Fan HQ, Zhang YW. miR-511-5p functions as a tumor suppressor and a predictive of prognosis in colorectal cancer by directly targeting GPR116. Eur Rev Med Pharmacol Sci. 2019;23(14):6119–30. doi: 10.26355/eurrev_201907_18425. [DOI] [PubMed] [Google Scholar]
- 22.Jing JS, Li HB, Wang SC, et al. NDRG3 overexpression is associated with a poor prognosis in patients with hepatocellular carcinoma. Biosci Rep. 2018;38(6):BSR20180907. doi: 10.1042/BSR20180907. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.朱 应超, 李 翠翠, 邹 峰, et al. 环状RNA 0004390对食管鳞状细胞癌增殖、凋亡、迁移及侵袭的影响. 中华实验外科杂志. 2022;39(3):468–71. doi: 10.3760/cma.j.cn421213-20210814-01237. [DOI] [Google Scholar]
- 24.Yang R, Zheng G, Ren DF, et al. The clinical significance and biological function of tropomyosin 4 in colon cancer. Biomed Pharmacother. 2018;101:1–7. doi: 10.1016/j.biopha.2018.01.166. [DOI] [PubMed] [Google Scholar]
- 25.Abnet CC, Arnold M, Wei WQ. Epidemiology of esophageal squamous cell carcinoma. Gastroenterology. 2018;154(2):360–73. doi: 10.1053/j.gastro.2017.08.023. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.孟 茜茜, 张 子凡, 程 志远, et al. 食管癌肿瘤标志物研究及临床应用进展. 中国实用内科杂志. 2019;39(7):634–9. [Google Scholar]
- 27.Tafreshi NK, Tichacek CJ, Pandya DN, et al. Melanocortin 1 receptor-targeted α-particle therapy for metastatic uveal melanoma. J Nucl Med. 2019;60(8):1124–33. doi: 10.2967/jnumed.118.217240. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Li MS, Liu DJ, Lee D, et al. Enhancing the efficacy of melanocortin 1 receptor-targeted radiotherapy by pharmacologically upregulating the receptor in metastatic melanoma. Mol Pharm. 2019;16(9):3904–15. doi: 10.1021/acs.molpharmaceut.9b00512. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Wolf Horrell EM, Boulanger MC, D'Orazio JA. Melanocortin 1 receptor: structure, function, and regulation. Front Genet. 2016;7:95. doi: 10.3389/fgene.2016.00095. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.茅 育蕾, 陈 柏庆. 病理组织免疫组化技术常见问题与质量控制. 中国医药导报. 2018;15(8):163-5, 178, 182. [Google Scholar]
- 31.张 晓云. 免疫组化技术用于病理诊断的效果分析. 甘肃科技. 2021;37(17):151–3. doi: 10.3969/j.issn.1000-0952.2021.17.051. [DOI] [Google Scholar]
- 32.李 俊毅, 温 越, 李 渊, et al. 早期食管癌术后肿瘤复发的多因素分析. 中国微创外科杂志. 2021;21(8):695–9. doi: 10.3969/j.issn.1009-6604.2021.08.005. [DOI] [Google Scholar]
- 33.雷 海科, 廖 忠莉, 李 小升, et al. 重庆市食管癌患者生存随访调查及预后影响因素研究. 中国癌症杂志. 2020;30(2):98–105. [Google Scholar]
- 34.杨 欢, 孙 宛怡, 王 建炳, et al. 中国食管癌病因学、筛查及早期诊断研究进展. 肿瘤防治研究. 2022;49(3):169–75. doi: 10.3971/j.issn.1000-8578.2022.21.1033. [DOI] [Google Scholar]


