Placebo- sowie Noceboeffekte sind nach wie vor unterschätzte Phänomene in der Interaktion von Ärzt*innen und Patient*innen. Der Erfolg oder Misserfolg einer Therapie kann durch Wissen darüber maßgeblich beeinflusst werden. In aktuellen Guidelines in der Schmerztherapie wird sogar explizit auf die Nutzung des Placeboeffekts sowie auf die Vermeidung des Noceboeffekts hingewiesen.
Als beeindruckendes Beispiel aus dem klinischen Alltag möchte ich einen Fall erwähnen, in welchem bei einem seit 15 Jahren an chronischen Schmerzen leidenden Patienten eine Wurzelblockade einseitig lumbal durchgeführt wurde. Unmittelbar nach der Intervention gab der Patient an, endlich schmerzfrei zu sein – es wurde jedoch die falsche Seite punktiert.
Placeboeffekt
Ein Placebo (lat. „ich werde gefallen“) ist eine Scheinsubstanz oder -behandlung, die die positiven Wirkungen eines Arzneimittels oder einer Intervention nachzuahmen vermag, ohne aber dabei das spezifische Arzneimittel oder die spezifische Behandlungsmethode zu beinhalten.
Unter Placeboeffekt subsummiert man alle positiven neurobiologischen und psychophysiologischen Reaktionen, die nicht auf die spezifische Wirksamkeit einer Behandlung zurückzuführen sind, sondern auf den psychosozialen Kontext der Therapie.
Das Auftreten von Placeboantworten ist nicht nur auf Placebobehandlungen beschränkt, diese können auch im Rahmen jeder anderen Therapie erscheinen und das Ergebnis dieser entscheidend beeinflussen.
Schon im Alten Orient wurden Kranke durch Besprechen geheilt. Der griechische Philosoph Plato war davon überzeugt, dass Worte die Kraft haben, Kranke zu heilen. Lange Zeit jedoch wurde der Begriff Placebo abschätzig verwendet, im Sinne von „aus Gründen der Gefälligkeit“ [9].
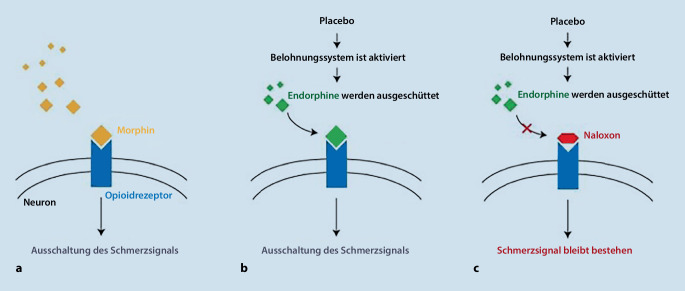
Bedeutung für die Neuzeit erlangte Placeboanalgesie erstmals im 2. Weltkrieg, als dem amerikanischen Anästhesiepionier Henry Beecher in der Schmerztherapie verwundeter Soldaten das Morphin ausging und er aus Verzweiflung Kochsalzlösung i.v. verabreichte – und damit einen analgetischen Effekt erzielte [6]. Dazu konnte Levine et al. 1978 eine Studie präsentieren, die erstmals den Placeboeffekt physisch nachweisen konnte [7]. Nach Verabreichung des Opioidantagonisten Naloxon wurde nicht nur die Morphin-, sondern auch die Placebowirkung aufgehoben, worauf die Hypothese bestätigt wurde, dass Placebowirkung auf der Ausschüttung körpereigener Opioide, wie u. a. Endorphin basiert, die an den Opioidrezeptoren andocken (Abb. 1). Mittlerweile werden sowohl Placebo- als auch Noceboeffekt als komplexe psychoneurobiologische Phänomene erkannt, welche sowohl Einfluss auf die Aktivität bestimmter Hirnregionen als auch auf periphere physiologische Prozesse nehmen.
Wie funktioniert der Placeboeffekt?
Es kommt zur Stimulation neuronaler Schaltkreise durch eine Top-down-Aktivierung endogener analgetischer Prozesse, vermittelt über das absteigende Schmerzhemmsystem. Opioid- und Placeboanalgesie verwenden hier ein gemeinsames neuronales Netzwerk, vermittelt über die Ausschüttung endogener Opioide (Endorphine), Enkephaline sowie Dopamin (Einbettung des Belohnungssystems) und anderer Botenstoffe. Eine Hemmung afferenter nozizeptiver Information findet jedoch bereits auf Höhe des spinalen Hinterhorns durch Modulation nozizeptiver Inputs statt (Abb. 2).

Die psychologischen Hauptmechanismen sind Erwartung, Konditionierung sowie die Arzt-Patient-Kommunikation. Es gibt jedoch eine Reihe weiterer Einflussfaktoren auf Placebo- sowie Noceboeffekt, wie etwa Patientenparameter (Angstniveau, Attribuierung, Wirkerwartung, Suggestibilität), Darreichungsformen von Medikamenten (Operation > Infusion > Spritze > Tablette > Tropfen, Tablettenform und -farbe [12]) sowie andere Wechselwirkungen (z. B. Ort der Anwendung, Farben in der Ordination, therapeutische Haltung, Zimmerpflanzen, Musik etc.; Abb. 3).
Die am Placeboeffekt beteiligten Hirnregionen konnten mittels fMRT und PET identifiziert werden, es handelt sich hier vor allem um den dorsolateralen präfrontalen Kortex (DLPFC), den rostralen anterioren cingulären Kortex (rACC), das periaquäduktale Grau (PAG) sowie Hypothalamus, Amygdala und Nucleus accumbens (Abb. 4). Bei der Placeboanalgesie kommt es zu verminderter Aktivität in schmerzsensiblen Hirnarealen inklusive Thalamus, Insula, rACC, PAG und ventromedialer Medulla oblongata sowie zu einer erhöhten Aktivität während der Schmerzwahrnehmung im präfrontalen Kortex (Abb. 5; [10]).

Über die Aktivierung von Hirnstrukturen während einer Noceboantwort ist bisher nur wenig bekannt. Die Placebo- und Noceboantworten scheinen einige gemeinsame Wege mit reziproken Reaktionen zu teilen, wie zum Beispiel die Aktivierung von dopaminerger und Opioid-Aktivität im Nucleus accumbens durch Placebo sowie die Deaktivierung derselben Hirnregion durch Nocebo. Die Nocebo-Reaktionen scheinen außerdem unterschiedliche Bahnen in den Hippocampus- und parahippocampalen Formationen zu nehmen [13].
Aus ethischer Sicht ist es nicht vertretbar, Patient*innen durch die Vorenthaltung der Wirksubstanz – und stattdessen durch Verabreichung eines Placebos – zu „täuschen“. Es gibt jedoch neue Studien zum Thema „offene Verabreichung von Placebo“, welche sehr wohl einen positiven Effekt belegen. Wichtig ist dabei jedoch die zusätzliche Erklärung für die Patient*innen, wie der Placeboeffekt im Gehirn zustande kommt und welche Botenstoffe daran beteiligt sind und ausgeschüttet werden [15].
Rezente Studien deuten auch darauf hin, dass ein Ansprechen auf Placebo genetisch determiniert sei, hier werden jedoch noch die Ergebnisse weiterer Studien erwartet [14].
Noceboeffekt
Der Noceboeffekt (von lat. nocere „schaden“, nocebo: „ich werde schaden“) ist eine negative gesundheitliche Wirkung nach Exposition durch ein Agens, zum Beispiel durch ein Arzneimittel oder einen anderen äußeren Einfluss, ohne dass ein direkter und unmittelbarer kausaler Zusammenhang zwischen Agens und Wirkung zu bestehen scheint [8].
Der Noceboeffekt entsteht vor allem durch die Erwartung negativer Folgen, wie sie etwa bei der Aufklärung über Nebenwirkungen von Medikamenten oder Behandlungen auftreten können; weiters auch durch negatives Denken („self-fulfilling prophecy“) oder bei schon a priori sehr ängstlichen Patient*innen. Auch negative Berichterstattung in den Massenmedien (aktuell COVID-19-Impfschäden etc.) kann einen Noceboeffekt auslösen. Die Arzt-Patient-Kommunikation ist auch hier ein wesentlicher Faktor [23].
Am deutlichsten zeigt sich der Noceboeffekt in einer krankmachenden Angst vor eingebildeten Gefahren; er tritt signifikant häufiger bei Frauen als bei Männern auf sowie vermehrt bei älteren Menschen [24].
Durch aufkeimende Angst oder psychisch bedingte Schmerzen kommt es zur Ausschüttung des in der Darmschleimhaut gebildeten Botenstoffs Cholezystokinin, der wiederum zur Angstverstärkung führt und im Gehirn eine Schmerzreaktion auslöst. Dies hat auch bei Phobien eine entscheidende Funktion [19].
Auch bei Schmerzen, die durch Worte ausgelöst werden, kommt es zu einer Überaktivität der Hypothalamus-Hypophysen-Nebennieren-Achse. Die Ankündigung, dass ein Medikament oder eine Intervention den Schmerz verstärken könnte, erhöht nicht nur den Schmerz, sondern auch die Kortisolsekretion (Abb. 6; [16]).
Welche Symptome zeigen sich beim Noceboeffekt?
Es treten meistens subjektive Symptome auf, wie zum Beispiel Übelkeit, Kopfschmerzen, Erschöpfung oder Benommenheit. Auch objektive Symptome sind möglich, vor allem Exantheme, Hypertonie und Tachykardie. Diese können leicht und von vorübergehender Natur, aber auch chronisch und im Extremfall sogar letal sein [21].
Wie kann man nun den Noceboeffekt minimieren?
Vermeiden Sie Wiederholungen der potenziellen Nebenwirkungen, räumen Sie Missverständnisse aus, erwähnen Sie diese immer im Kontext der positiven Wirkung des Medikaments oder der Therapie. Erklären Sie die Möglichkeiten zur Therapie von Nebenwirkungen [20].
Ein beeindruckender Fall trug sich 2007 in England zu. Ein Student versuchte, sich mit Tabletten zu suizidieren, die er tags zuvor von seinem Hausarzt erhalten hatte – als Teilnehmer einer Studie über Antidepressiva. Er begann zu zittern, wurde dyspnoisch und hypoton und schließlich in eine Notaufnahme gebracht, wo seine Vitalparameter initial kaum stabilisierbar waren. Erst nach Kontakt mit dem Hausarzt und der Information an den Patienten, dass er nur Placebotabletten erhalten hatte, normalisierten sich alle Werte in kürzester Zeit [22].
Zusammenfassend sind Placeboeffekte wesentliche Mechanismen, die vor allem in der Arzt-Patient-Interaktion genutzt werden können, um jeglichen Therapieerfolg positiv zu beeinflussen [17]. Im Gegensatz dazu, sollte ein Noceboeffekt vermieden werden, um das bestmögliche Outcome einer Therapie zu erzielen.
Interessenkonflikt
A. Mosser gibt an, dass kein Interessenkonflikt besteht.
Footnotes

QR-Code scannen & Beitrag online lesen
Hinweis des Verlags
Der Verlag bleibt in Hinblick auf geografische Zuordnungen und Gebietsbezeichnungen in veröffentlichten Karten und Institutsadressen neutral.
Literatur
- 1.Placebostudie Endorphine Levine, Harvard University Blog SEPTEMBER 14, 2016. More Than Just a Sugar Pill: Why the placebo effect is real by Benika Pinch, figures by Kaitlyn Choi.
- 2.Fields H, et al. State-dependent opioid control of pain. Nat Rev Neurosci. 2004;5:565–575. doi: 10.1038/nrn1431. [DOI] [PubMed] [Google Scholar]
- 3.Benedetti F, et al. The placebo response: neurobiological and clinical issues of neurological relevance. Prog Brain Res. 2009;175:283–294. doi: 10.1016/S0079-6123(09)17520-9. [DOI] [PubMed] [Google Scholar]
- 4.Schedlowski M, et al. Neuro-Bio-Behavioral Mechanisms of Placebo and Nocebo Responses: Implications for Clinical Trials and Clinical Practice. Pharmacol Rev. 2015;67:697–730. doi: 10.1124/pr.114.009423. [DOI] [PubMed] [Google Scholar]
- 5.Benedetti F, et al. Neurobiological mechanisms of the placebo effect. J Neurosci. 2005;25(45):10390–10402. doi: 10.1523/JNEUROSCI.3458-05.2005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Beecher HK. The powerful placebo. J Am Med Assoc. 1955;159:1602. doi: 10.1001/jama.1955.02960340022006. [DOI] [PubMed] [Google Scholar]
- 7.Levine JD, et al. The mechanism of placebo analgesia. Lancet. 1978;2(8091):654–657. doi: 10.1016/S0140-6736(78)92762-9. [DOI] [PubMed] [Google Scholar]
- 8.Justman S. The Nocebo Effect. Springer, 2016, ISBN 978-1-137-52329-7
- 9.Jütte R. The History of Placebo. World Med J. 2010;56:109–114. [Google Scholar]
- 10.Wager TD, et al. Placebo-induced changes in FMRI in the anticipation and experience of pain. Science. 2004;303(5661):1162–1167. doi: 10.1126/science.1093065. [DOI] [PubMed] [Google Scholar]
- 11.Brody H. Meaning and an Overview of the Placebo Effect. Perspect Biol Med. 2018;61(3):353–360. doi: 10.1353/pbm.2018.0048. [DOI] [PubMed] [Google Scholar]
- 12.Derra C, et al. Analgetika im Kontext der Arzt-Patient-Beziehung. Ärztliche Psychotherapie. 2014;3:127–131. [Google Scholar]
- 13.Enck P, et al. New insights into the placebo and nocebo responses. Neuron. 2008;59:195–206. doi: 10.1016/j.neuron.2008.06.030. [DOI] [PubMed] [Google Scholar]
- 14.Colagiuri B, et al. The placebo effect: From concepts to genes. Rev Neurosci. 2015;307:171–190. doi: 10.1016/j.neuroscience.2015.08.017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Blease C, et al. Open-label placebo clinical trials: is it the rationale, the interaction or the pill? BMJ Evid Based Med. 2020;25(5):159–165. doi: 10.1136/bmjebm-2019-111209. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Benedetti F, et al. When words are painful: unraveling the mechanisms of the nocebo effect. Neuroscience. 2007;147:260–271. doi: 10.1016/j.neuroscience.2007.02.020. [DOI] [PubMed] [Google Scholar]
- 17.Klinger R. The potential of the analgetic placebo effect - s3-guideline recommendation on the clinical use for acute and perioperative pain management. Anasthesiol Intensivmed Notfallmed Schmerzther. 2010;45(1):22–29. doi: 10.1055/s-0029-1243374. [DOI] [PubMed] [Google Scholar]
- 18.Sonthalia S, et al. Nocebo effect in Dermatology. Indian J Dermatol Venereol Leprol. 2015;81(3):242–250. doi: 10.4103/0378-6323.155573. [DOI] [PubMed] [Google Scholar]
- 19.Benedetti F, et al. Blockade of nocebo hyperalgesia by the cholecystokinin antagonist proglumide. Pain. 1997;71(2):135–140. doi: 10.1016/S0304-3959(97)03346-0. [DOI] [PubMed] [Google Scholar]
- 20.Hansen E, et al. Nocebo, informed consent and doctor-patient communication. Nervenarzt. 2020;91(8):691–699. doi: 10.1007/s00115-020-00963-4. [DOI] [PubMed] [Google Scholar]
- 21.Hahn R. The nocebo phenomenon: concept, evidence, and implications for public health. Prev Med. 1997;26:607–611. doi: 10.1006/pmed.1996.0124. [DOI] [PubMed] [Google Scholar]
- 22.Reeves RR, et al. Nocebo effects with antidepressant clinical drug trial placebos. Gen Hosp Psychiatry. 2007;29(3):275–277. doi: 10.1016/j.genhosppsych.2007.01.010. [DOI] [PubMed] [Google Scholar]
- 23.Haas J, et al. Frequency of Adverse Events in the Placebo Arms of COVID-19 Vaccine Trials. JAMA Netw Open. 2022;5(1):e2143955. doi: 10.1001/jamanetworkopen.2021.43955. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Casper RC, et al. No gender differences in placebo responses of patients with major depressive disorder. Biol Psychiatry. 2001;49:158–160. doi: 10.1016/S0006-3223(00)00966-5. [DOI] [PubMed] [Google Scholar]