Cost-effectiveness analysis of dupilumab for the treatment of severe atopic dermatitis in adults in Italy
Background:
Atopic dermatitis (AD) is a chronic, multifactorial, inflammatory skin disease with significant impact on patients’ quality of life.
Objective:
The objective of this analysis was to estimate the incremental cost-utility ratio (ICUR) of dupilumab, administered every other week, plus supportive care (SC), vs SC, in the Italian adult population with severe AD, for whom ciclosporin treatment is contraindicated, ineffective or not tolerated.
Methods:
Simulation of outcomes and costs was conducted using a 1-year decision tree, followed by a lifetime horizon Markov model. Clinical data were derived from a pooled analysis of two studies. The analysis was conducted adopting the Italian National Health Service (NHS) perspective. In the model, the following costs were considered: i) Drug acquisition costs; ii) Disease management costs; iii) Costs of adverse events. Robustness of findings was tested using both one-way deterministic and probabilistic sensitivity analyses.
Results:
In the base case, dupilumab plus SC was more effective than SC (+2.42 quality adjusted life years, QALYs). The total lifetime cost per patient treated with dupilumab was higher than SC (€ 137,267 and € 56,744, respectively). Dupilumab plus SC was cost-effective vs. SC, with an ICUR of € 33,263 per QALY gained. The ICUR fell in the informal range of ICUR acceptability proposed for Italy (range: € 25,000-€ 40,000 per QALY gained). Sensitivity analyses confirmed robustness and reliability of base case results.
Conclusions:
Dupilumab plus SC is a cost-effective option for the treatment of patients with severe AD in Italy, compared with SC, when NHS perspective is considered.
Keywords: Atopic dermatitis, Cost-utility analysis, Dupilumab, QALY
Introduzione
La dermatite atopica (DA) è una malattia cutanea comune, cronica, multifattoriale, infiammatoria di origine sconosciuta, con decorso precoce e recidivante, caratterizzata da un impatto significativo sulla qualità della vita dei pazienti e da un’infiammazione prevalente di tipo 2, causata da un’over-espressione di interleuchina (IL) 4 e IL-13 e che provoca difetti strutturali della barriera cutanea (1,2,3,4). La prevalenza negli adulti varia tra il 2% e il 5% (5,6). In Italia non esistono stime precise sulla prevalenza della DA. Un recente studio multicentrico ha concluso che circa l’8% dei pazienti italiani adulti è affetto da questa condizione (7).
Lo studio Global Burden of Disease 2010 ha classificato la DA come la condizione a più elevato impatto sulla qualità della vita, tra le malattie dermatologiche (8). I pazienti con DA soffrono di prurito, xerosi, lesioni eczematose (p. es., eritema, desquamazione e lichenificazioni) e sono a elevato rischio di infezioni della pelle con conseguenze sistemiche (8).
Inoltre, la DA è comunemente associata a livelli elevati di immunoglobuline E (IgE), il cui incremento è causato da una reazione infiammatoria di tipo 2 dovuta a una complessa interazione tra fattori genetici e ambientali, che genera un aumento di citochine infiammatorie quali IL-4 e IL-13 (2,3). Per questa ragione, i pazienti con DA sono affetti da condizioni allergiche concomitanti (tra cui allergia alimentare, asma e rinite allergica). Ciò ha dato origine alla cosiddetta teoria della “marcia atopica”, che suggerisce come la DA sia da considerare una delle fasi iniziali di un processo di progressivo accumulo di condizioni allergiche con l’avanzamento dell’età (2). Tuttavia, il decorso della DA è eterogeneo e non facilmente prevedibile, a seconda del fenotipo, dell’età di esordio, della gravità clinica, della presenza di comorbilità e della risposta alla terapia (9).
I principali obiettivi terapeutici della DA consistono nel controllo dei sintomi e nella prevenzione dell’infiammazione cutanea. Più specificamente, la scelta del trattamento appropriato dipende dalla gravità della malattia. Nella maggior parte dei pazienti con gravità moderata o severa, le terapie topiche forniscono solo un miglioramento temporaneo e devono essere integrate o sostituite da altri trattamenti che riducono l’infiammazione: fototerapia, farmaci immunomodulatori sistemici o altri trattamenti modificanti la malattia (Disease Modifying Therapy, DMT) (9).
La terapia sistemica, inclusi gli immunosoppressori non selettivi come corticosteroidi e ciclosporina, è indicata in pazienti che non sono adeguatamente controllati e/o che non tollerano il trattamento topico (6,10).
In alternativa alla ciclosporina, le attuali Linee Guida raccomandano l’uso di metotrexato, micofenolato mofetile e azatioprina, in pazienti che non rispondono alla terapia topica convenzionale o alla fototerapia (6,10). Sebbene queste terapie immunosoppressive siano risultate efficaci nel trattamento della DA, il loro uso prolungato non è raccomandato a causa di eventi avversi e di una progressiva riduzione della risposta (6,10). In Italia, l’unico trattamento indicato nel trattamento della DA (in-label) è la ciclosporina; gli altri immunosoppressori sono prescritti off-label (11).
I trattamenti biologici sviluppati per la DA hanno mostrato risultati promettenti, essendo più efficaci delle terapie convenzionali e garantendo una risposta sostenuta, con un profilo rischio-beneficio adeguato, a causa del loro effetto mirato (10). Dupilumab (nome commerciale: Dupixent) è il primo anticorpo monoclonale indicato nella DA moderata-grave (12) e ha dimostrato di essere in grado di ridurre la cascata infiammatoria di tipo 2 (13). È un anticorpo monoclonale completamente umanizzato che colpisce la subunità alfa del recettore IL-4 dell’interleuchina, per inibire la trasduzione del segnale IL-4 e IL-13, citochine di tipo 2 che giocano un ruolo importante nella produzione di chemochine, nella soppressione dei peptidi antimicrobici (AMP) e nell’infiammazione allergica (3,9,12). Nel settembre 2017, l’Agenzia Europea per i Medicinali (EMA) ha approvato l’uso di dupilumab per il trattamento della DA da moderata a grave, in pazienti adulti candidabili alla terapia sistemica (12). Mentre l’efficacia clinica di dupilumab è stata confermata da diversi studi clinici di fase 3, ossia Liberty AD SOLO 1 e 2 (SOLO) (14), Liberty AD CHRONOS (CHRONOS) (15) e Liberty AD CAFÉ (CAFÉ) (16), il profilo farmaco-economico di questa terapia non è stato formalmente valutato. La sostenibilità economica dell’uso di dupilumab dipende da due principali fattori, ossia dal costo di acquisizione della terapia e dall’effetto della terapia sui costi di gestione della malattia.
In Italia, dupilumab è rimborsato per il trattamento della DA grave in pazienti adulti (Eczema Area and Severity Index, EASI ≥ 24), per i quali il trattamento con ciclosporina è controindicato, inefficace o non tollerato (17). L’obiettivo della presente analisi è stato stimare il rapporto incrementale di costo-utilità (ICUR) e, conseguentemente, l’”accettabilità” economica di dupilumab, rispetto alla terapia convenzionale in questa popolazione.
Metodi
Struttura dei modelli
È stata sviluppata un’analisi farmaco-economica per valutare costi, esiti clinici e sopravvivenza aggiustata per la qualità di vita associati a dupilumab, somministrato ogni due settimane (Q2W), rispetto all’attuale terapia di supporto (SC). I modelli impiegati hanno una struttura molto simile a quella di altre valutazioni condotte su condizioni cliniche di pertinenza dermatologica, quali la psoriasi (18,19,20,21,22,23,24) e l’artrite psoriasica (25,26,27,28,29).
A supporto della presente analisi di costo-utilità, è stato adattato al contesto italiano un modello farmaco-economico, precedentemente sviluppato per la conduzione della medesima valutazione economica dei programmi sanitari in Inghilterra e la successiva sottomissione al National Institute for Health and Care Excellence (NICE) (30).
La simulazione dei costi e degli esiti è stata effettuata utilizzando due modelli sequenziali: i) un albero decisionale iniziale, della durata di 1 anno, con nodi probabilistici a 16 e a 52 settimane, progettato per stimare gli effetti a breve termine di dupilumab (Fig. 1a), seguito da ii) un modello Markov, su un orizzonte temporale lifetime, con probabilità di transizione dipendenti dal tempo, al fine di stimare l’efficacia a lungo termine di dupilumab e SC (Fig. 1b). I dati inclusi nell’albero decisionale sono ricavati dagli studi dupilumab (14,16). Completata la simulazione attraverso l’albero decisionale, i pazienti passano al modello di Markov.
Fig. 1 -.
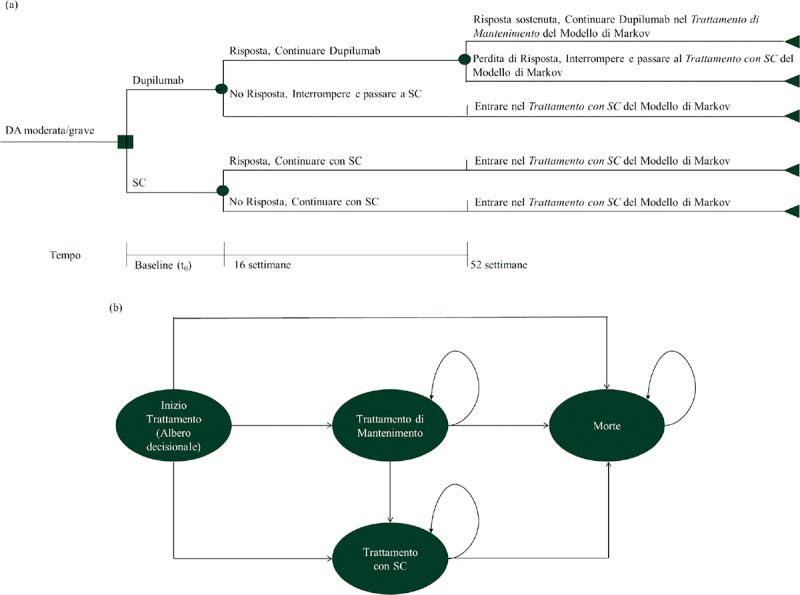
Struttura del modello: Albero decisionale (a); Modello di Markov (b). DA: dermatite atopica, SC: terapia di supporto
Come mostrato nella Figura 1a, tutti i pazienti con DA entrano nel modello al tempo t0 e ricevono dupilumab 300 mg ogni 2 settimane + terapia di supporto (per semplicità, “dupilumab”) o terapia di supporto non in associazione (per semplicità, “SC”). La risposta al trattamento è valutata per la prima volta dopo 16 settimane. I pazienti del gruppo dupilumab che rispondono alla terapia continueranno a ricevere il trattamento fino alla fine dell’anno 1, quando saranno nuovamente valutati. I pazienti non-responder interromperanno la terapia con dupilumab e passeranno al trattamento con SC, a causa dell’assenza di una risposta terapeutica adeguata o di intolleranza al trattamento. I pazienti assegnati al trattamento con SC rimarranno sempre in questo gruppo di trattamento (non essendo disponibili valide alternative terapeutiche), indipendentemente dall’efficacia del trattamento stesso.
Alla fine dell’anno 1, i pazienti responder in trattamento con dupilumab sono rivalutati. I pazienti in trattamento con dupilumab con risposta confermata alla fine dell’anno 1 continueranno il trattamento ed entreranno nel modello di Markov (Fig. 1b) nello stato di salute chiamato “Trattamento di mantenimento”. Tutti i pazienti rimanenti (pazienti trattati con dupilumab senza risposta confermata e pazienti trattati con SC) entreranno nello stato di salute chiamato “Trattamento con SC”. Successivamente all’anno 1 (modello di Markov), i pazienti trattati con dupilumab che si trovano nello stato “Trattamento di mantenimento” potranno: i) rimanere nello stesso stato di salute (se la risposta è mantenuta) o ii) passare al trattamento con SC (se la risposta non è mantenuta) o iii) morire. I pazienti nello stato “Trattamento con SC” possono: i) rimanere nello stesso stato di salute o ii) morire.
In questo modello, i pazienti sono stati osservati su un orizzonte temporale lifetime. È stato applicato un tasso di sconto del 3% a costi ed esiti (31). L’analisi è stata condotta secondo la prospettiva del Servizio Sanitario Nazionale (SSN, considera solo i costi relativi a risorse del settore sanitario).
Dati clinici impiegati nel modello
I dati clinici utilizzati nel modello sono ricavati da un’analisi aggregata di due studi di dupilumab: i) lo studio CAFÉ (16), uno studio a 16 settimane che ha arruolato pazienti con DA grave, non-responder alla ciclosporina o intolleranti o con controindicazione all’uso e ii) lo studio CHRONOS (15), uno studio clinico con valutazione primaria a 16 settimane e valutazione secondaria a 52 settimane, che ha arruolato pazienti con DA moderata o grave, con risposta inadeguata agli steroidi per uso topico. Dallo studio CHRONOS è stato identificato ed estratto un sottogruppo di pazienti le cui caratteristiche hanno rispettato i criteri di inclusione dello studio CAFÉ (da qui in avanti definito “CHRONOS-CL”) (32). Per ulteriori specifiche sui criteri di inclusione dello studio CAFÉ, si faccia riferimento alla Tabella 6, riportata nei Materiali Supplementari disponibili online. Infine, l’analisi aggregata (pooled), che ha aggregato i risultati clinici degli studi CAFÉ e CHRONOS-CL, è stata utilizzata come fonte clinica principale del modello.
Le caratteristiche al basale dei pazienti considerati nell’analisi sono state estratte dall’analisi aggregata CAFÉ + CHRONOS-CL (16,32) (Tab. I).
TABELLA 1 -.
| Caratteristica | Valore |
|---|---|
| Sesso, maschi (%) | 60,0% |
| Età, media (anni) | 38,1 |
| Utilità (N, 0-1) | 0,66 |
| Peso (kg) | 75,0 |
È stato preso in considerazione il sottogruppo di pazienti adulti con EASI > 25 come proxy del sottogruppo di pazienti che sono stati ammessi a rimborsabilità secondo i criteri dell’Agenzia italiana del farmaco (AIFA) (17). L’età media della coorte è di 38,1 anni, con il 60,0% dei pazienti di sesso maschile (Tab. I). L’età e il sesso sono stati usati per stimare la sopravvivenza dei pazienti attraverso le tavole di mortalità della popolazione italiana (33). Non sono stati considerati rischi di mortalità aggiuntivi, attribuibili alla malattia.
In questa analisi, la risposta terapeutica è stata definita come una riduzione di almeno il 50% del punteggio EASI e una riduzione di almeno 4 punti nell’indice di qualità della vita dermatologica (DLQI) dall’inizio del trattamento (EASI 50 e DLQI ≥ 4). È stato deciso di utilizzare questo approccio perché il solo indice EASI non è in grado di misurare tutti gli aspetti di gravità della DA, come la qualità della vita, che, in questa tipologia di pazienti, ha un impatto significativo. Questo approccio, inoltre, è risultato coerente con l’analisi di costo-utilità condotta in Inghilterra e presentata al NICE (30).
La Figura 2a mostra le probabilità di risposta per il sottogruppo EASI > 25 a 16 e a 52 settimane, per trattamento. Le probabilità di risposta a 16 settimane sono state ricavate dall’analisi pooled CAFÉ + CHRONOS-CL (16,32), mentre la probabilità di risposta a 52 settimane è stata ricavata dallo studio CHRONOS-CL (32). La risposta sostenuta delle alternative di trattamento è stata valutata da un gruppo di cinque esperti della DA, replicando la valutazione condotta da MC Kenna et al. 2009 (34). In questa indagine (fare riferimento al Materiale Supplementare disponibile online per ulteriori dettagli), è stato richiesto ai medici di fornire stime sulla probabilità di mantenimento della qualità di vita o di mantenimento della risposta a 1 anno e negli anni successivi, per il trattamento con dupilumab e con SC. È stato supposto che l’efficacia terapeutica di lungo periodo (dopo i 5 anni) fosse uguale all’efficacia dell’anno 5 (35). La Figura 2b mostra le stime di risposta a lungo termine. Per entrambe le opzioni è stato ipotizzato un “waning effect”, ossia una progressiva riduzione dell’efficacia del trattamento nel tempo. Tuttavia, secondo gli esperti, il waning effect era da ritenersi più marcato con SC, rispetto a dupilumab, che dovrebbe garantire un’efficacia piuttosto “sostenuta” nel tempo.
Fig. 2 -.
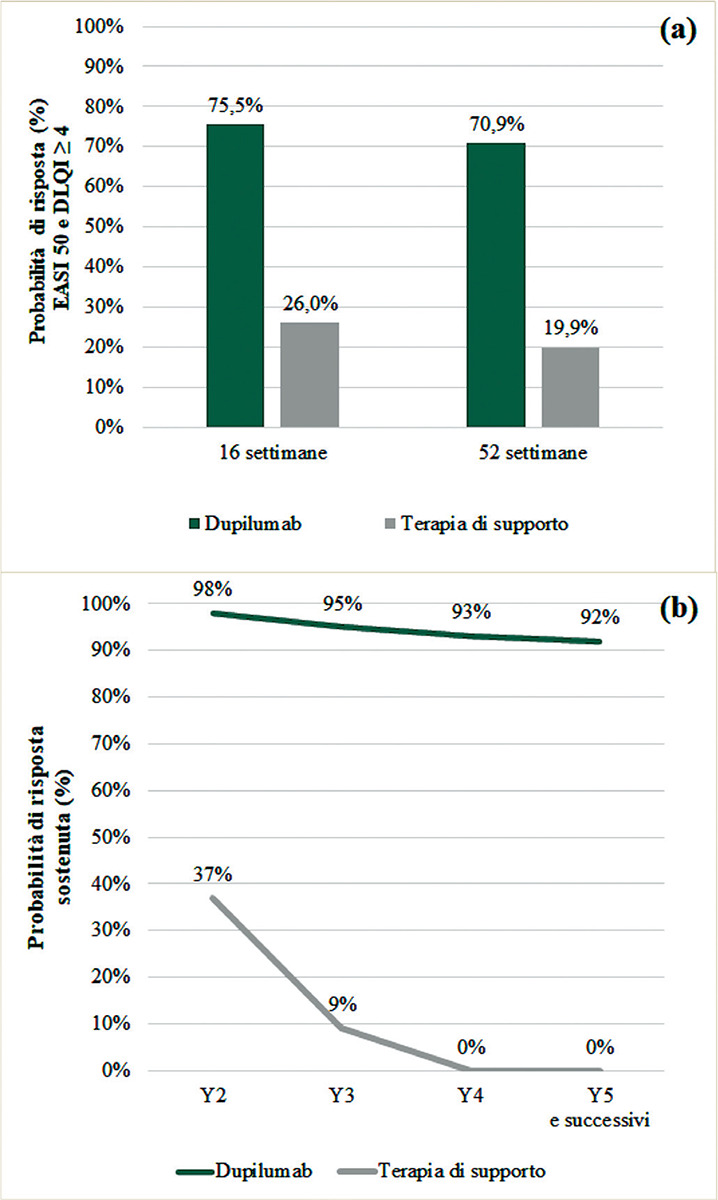
Probabilità di risposta al trattamento a 16 e 52 settimane (a) e probabilità di risposta a lungo termine (b).
DLQI: Dermatology Life Quality Index, EASI: Eczema Area and Severity Index, SC: terapia di supporto, Y: anno.
Nel gruppo dupilumab, la probabilità di rimanere in trattamento è stata aggiustata tenendo conto del rischio di interruzione. La probabilità di interruzione del trattamento è data dalla proporzione di pazienti che non hanno completato il periodo di trattamento di 52 settimane, ricavata dallo studio CHRONOS (15), secondo i criteri di risposta EASI 50 e DLQI ≥ 4, ed è stata stimata nel 3,7% dei pazienti.
Infine, è stato considerato l’effetto degli eventi avversi sui costi. L’incidenza di eventi avversi è stata ricavata dall’analisi pooled CAFÉ + CHRONOS-CL (36). Gli eventi avversi più comuni, associati al trattamento con dupilumab, sono stati: reazioni nel sito di iniezione, congiuntivite allergica, congiuntivite infettiva e herpes orale. I dati sugli eventi avversi sono riportati nella sezione successiva (“Dati di costo impiegati nel modello”).
Dati di costo impiegati nel modello
Per fornire una valorizzazione esaustiva delle risorse economiche associate alla gestione della DA, sono stati inclusi i seguenti costi: i) costi di acquisizione dei farmaci, ii) costi di gestione della malattia e iii) costi degli eventi avversi. I principali input di costo sono riportati nella Tabella II.
TABELLA II -.
Input di costo inclusi nell’analisi
| Tipo di costo | Descrizione | Valore | Note/Riferimenti bibliografici |
|---|---|---|---|
| Acquisizione farmaco | Costi di acquisizione di dupilumab (€ per fiala) | € 640,00 | Prezzo ex-factorya (37) |
| Costo di acquisizione SC (€) | € 0,00 | Assunzione | |
| Gestione della malattia (risorse sanitarie) | Costo per paziente responder (€/anno) | € 580,31 | (39,40), per i dettagli sul calcolo fare riferimento alla Tabella 7 nei Materiali Supplementari online. |
| Costo per paziente non-responder (€/anno) | € 2.313,47 | ||
| Gestione degli eventi avversi | Costo unitario della reazione nel sito di iniezione (€) | € 242,09 | Media costo accesso al Pronto Soccorso (41) |
| Costo unitario della congiuntivite allergica (€) | € 20,66 | (42) Tariffa codice 95.02 “Esame complessivo dell’occhio” | |
| Costo unitario della congiuntivite infettiva (€) | € 35,65 | (42) Tariffa codice 95.02 “Esame complessivo dell’occhio” + Costo ciprofloxacina (0,3% unguento oftalmico tubo 3,5 g) (43) | |
| Costo unitario dell’herpes orale (€) | € 41,32 | Compenso forfettario annuo per assistito del medico di medicina generale (2019) (44) | |
| Incidenza della reazione nel sito di iniezione – dupilumab (%) | 9,1% | Probabilità una tantum (36) | |
| Incidenza della congiuntivite allergica – dupilumab (%) | 40,1% | Probabilità per ciclo (36) | |
| Incidenza della congiuntivite infettiva – dupilumab (%) | 25,5% | Probabilità per ciclo (36) | |
| Incidenza dell’herpes orale – dupilumab (%) | 5,5% | Probabilità per ciclo (36) | |
| Incidenza della reazione nel sito di iniezione – SC | 0,0% | Probabilità una tantum (36) | |
| Incidenza della congiuntivite allergica – SC (%) | 18,8% | Probabilità per ciclo (36) | |
| Incidenza della congiuntivite infettiva – SC (%) | 3,3% | Probabilità per ciclo (36) | |
| Incidenza dell’herpes orale – SC (%) | 1,1% | Probabilità per ciclo (36) |
SC: terapia di supporto.
aAl lordo degli sconti obbligatori per legge, in virtù dell’ottenimento del carattere di innovatività e di eventuali ulteriori sconti applicati alle strutture pubbliche del SSN italiano.
Per calcolare il costo totale del trattamento con dupilumab, è stato moltiplicato il costo unitario di una fiala (prezzo ex-factory per fiala (37), al netto di eventuali sconti applicati alle strutture pubbliche del SSN) per il numero di fiale per trattamento (costo per ciclo) e per il numero di somministrazioni all’anno (costo per anno).
La presente analisi è stata condotta utilizzando il prezzo netto a confezione di dupilumab senza dichiararlo esplicitamente, data la confidenzialità dell’accordo negoziale con l’AIFA.
Secondo l’indicazione approvata, dupilumab è somministrato (per via sottocutanea) a una dose iniziale di 600 mg (due iniezioni da 300 mg), seguita da dosi di 300 mg Q2W. Nel modello è stata considerata una leggera riduzione della compliance di dupilumab durante la fase iniziale (settimane 0-16, compliance: 99,0%, fonte studio CAFÉ (12)) e la fase di mantenimento (compliance: 96,8%, fonte studio CHRONOS (15)). I costi di somministrazione di dupilumab sono stati ipotizzati pari a € 0. Trattandosi di una somministrazione sottocutanea, per mezzo di una siringa pre-riempita e quasi esclusivamente in un setting domiciliare, è stato assunto che il tempo necessario alla somministrazione di dupilumab sia trascurabile.
Il trattamento con SC consiste principalmente in creme idratanti ed emollienti. Di conseguenza, è stato ipotizzato che il costo di acquisizione della SC sia pari a € 0; questo costo sarebbe, comunque, attribuibile a entrambi i bracci di trattamento per lo stesso ammontare.
I costi di gestione della malattia, per i pazienti con DA, includevano altri costi medici relativi al monitoraggio e alla gestione di possibili ricoveri causati da complicanze della malattia. Nel modello è stato ipotizzato che il consumo di risorse utilizzate dai pazienti dipendesse dalla risposta al trattamento, come documentato nella letteratura pubblicata (36,38). Per quantificare tali costi, è stato recentemente condotto un expert panel in Italia (39). Agli esperti è stato chiesto di fornire una stima del consumo di risorse in base allo stato della risposta al trattamento (vale a dire farmaci concomitanti prescritti, numero annuale di visite mediche, esami di laboratorio e radiologici, accessi in Pronto Soccorso e visite mediche.
Infine, i costi per la gestione degli eventi avversi correlati al trattamento sono stati calcolati moltiplicando i costi unitari nella pratica italiana, per le rispettive probabilità.
Utilità
Le utilità, utilizzate per stimare la sopravvivenza aggiustata per la qualità della vita dei pazienti, sono state ricavate dall’analisi pooled CAFÉ + CHRONOS-CL (16,32). All’inizio della simulazione, l’utilità media al basale dei pazienti con DA (calcolata dalle risposte dei pazienti al questionario EQ-5D) era 0,660 (Tab. III, riga A (16,32)).
TABELLA III -.
| # | Utilità | Dupilumab + SC (95% IC) | SC (95% IC) |
|---|---|---|---|
| A | Settimana 0-8, al basale | 0,660 (0,594; 0,726) | 0,660 (0,594; 0,726) |
| B | Settimana 8-16a | 0,660 + 0,239 (0,186; 0,292) = 0,899b (0,78; 1,00,) | 0,660 + 0,120 (0,072; 0,168) = 0,780b (0,666; 1,000) |
| C | Dopo la settimana 16, responder | 0,660 + 0,290 (0,230; 0,350) = 0,950b (0,824; 1,00) | 0,660 + 0,120 (0,072; 0,168) = 0,780b (0,666; 1,000) |
| D | Dopo la settimana 16, non-responder | 0,780 | 0,780 |
SC: terapia di supporto.
aL’incremento di utilità rispetto ad A è attribuibile al fatto che una certa proporzione di pazienti trae beneficio dal trattamento prima della valutazione alla settimana 16.
bValore calcolato sommando le variazioni dell’utilità rispetto al valore al basale, specifiche per trattamento, ottenute dall’analisi pooled CAFÉ + CHRONOS-CL (16,32), al valore medio dell’utilità al basale (0,660).
Nel periodo compreso tra la settimana 0 e la settimana 8 (settimane 0-8) è stato assunto che l’utilità rimanesse invariata rispetto al valore iniziale, per tutti i pazienti, indipendentemente dal trattamento ricevuto.
Per le successive otto settimane di trattamento (settimane 8-16), sono stati utilizzati i valori di utilità riportati nella Tabella III riga B, supponendo che il cambiamento della qualità della vita si verificasse a metà del periodo di 16 settimane. Dopo la settimana 16, per i pazienti responder (che proseguono il trattamento iniziale), è stato ipotizzato il mantenimento di un più alto valore di utilità (riga C), mentre, per i non-responder (che passano al gruppo SC), è stata considerata la medesima utilità del trattamento con SC (Tab. III, riga D).
Sono stati considerati valori di disutilità, causati dagli eventi avversi correlati al trattamento, pari a –0,1, della durata di 20 giorni. Si tratta di un’assunzione conservativa e coerente con il valore riportato nello studio Poole et al. 2014 (45). Questo studio aveva l’obiettivo di valutare l’utilità dei pazienti affetti da rinite allergica. Il valore di utilità minimo, stimato durante il periodo del trial, è stato di –0,094 per i pazienti affetti da rinite allergica che non hanno ricevuto alcun trattamento farmacologico.
Analisi di sensibilità
Sono state condotte un’analisi di sensibilità deterministica a una via e un’analisi di sensibilità probabilistica, per identificare i valori di input con il maggiore effetto sull’ICUR e valutare la robustezza dell’analisi. L’analisi di sensibilità deterministica a una via è stata eseguita, facendo variare tutti i parametri del modello all’interno del loro intervallo di incertezza, utilizzando gli intervalli di confidenza al 95% (95% IC). Nei casi in cui il range o l’intervallo fiduciario non fossero disponibili dalle fonti originali, si è adottata una variazione pari a ± 20% del valore di base. Sono state eseguite ulteriori analisi di sensibilità univariata: i) variazione dell’orizzonte temporale, 20 anni e 10 anni, e ii) criteri di risposta (EASI 50, 75, 90). Per l’analisi probabilistica, sono state utilizzate le seguenti distribuzioni di probabilità: log-normale per il rischio relativo della risposta sostenuta a 52 settimane, per la mortalità e per il tasso di interruzione del trattamento con dupilumab, beta per le probabilità di risposta a 16 settimane, per le utilità e per le probabilità degli eventi avversi, gamma per i costi e normale per le variazioni delle utilità rispetto al basale. I parametri variati, i rispettivi range di variazione e le distribuzioni utilizzate sono riportati nella Tabella 8 dei Materiali Supplementari disponibili online.
Risultati
Risultati del Caso Base
La Tabella IV mostra i risultati dell’analisi costo-utilità nella prospettiva del SSN.
TABELLA IV -.
Risultati analisi di costo-utilità
| Item | Dupilumab + SC | SC | Differenza (dupilumab + SC – SC) |
|---|---|---|---|
| Risultati | |||
| Anni di vita | 24,70 | 24,70 | 0,00 |
| QALY | 16,96 | 14,57 | 2,42 |
| Costi relativi a risorse del settore sanitario (€) | |||
| Costi della terapia farmacologica | 95.262 | 0 | 95.262 |
| Gestione della malattia | 41.717 | 56.608 | –14.890 |
| Costi degli eventi avversi | 288 | 136 | 152 |
| Costi totali relativi a risorse del settore sanitario | 137.267 | 56.744 | 80.523 |
| ICUR (€/QALY guadagnato) | 33.263 | ||
ICUR: rapporto incrementale di costo-utilità, incremental cost-utility ratio; QALY: anni aggiustati per la qualità di vita, quality adjusted life years; SC: terapia di supporto.
Complessivamente, dupilumab è risultato più efficace rispetto a SC nel trattamento di pazienti con DA, con un aumento della sopravvivenza aggiustata per la qualità di vita (+2,42 QALY, 16,96 nel gruppo dupilumab vs 14,57 nel gruppo SC). La sopravvivenza è risultata identica nei due gruppi (24,70 anni di vita, LY). I costi relativi a risorse del settore sanitario totali sono risultati pari a € 137.267 e a € 56.744, rispettivamente per dupilumab e SC. I costi di trattamento e i costi di gestione della malattia sono stati i driver di costo in entrambi i gruppi. L’impatto economico degli eventi avversi è stato simile nei due gruppi.
Analisi di sensibilità
Entrambe le analisi di sensibilità deterministica a una via e probabilistica hanno confermato la robustezza e l’affidabilità dei risultati del Caso Base. I risultati dell’analisi deterministica a una via, nella prospettiva del SSN, sono riassunti nella Tabella V. L’ICUR è risultato relativamente stabile. La maggiore variazione è stata osservata nel caso di modifica della variazione dell’utilità rispetto al basale e nel caso di utilizzo del criterio di risposta clinica EASI 90. Questo risultato era prevedibile, poiché la risposta, valutata tramite il solo EASI score, non cattura il miglioramento nella qualità della vita dei pazienti con DA.
TABELLA V -.
Risultati dell’analisi di sensibilità deterministica a una via (Prospettiva SSN; ICUR Caso base: € 33.263)
| Parametri, variazione | ICUR risultante, (€ per QALY guadagnato) variazione relativa vs Caso Base (%) | |
|---|---|---|
| Diminuzione parametro | Aumento parametro | |
| Variazione dell’utilità rispetto al basale dupilumab (responder), estremi 95% IC | € 42.345, 27,30% | € 27.389, –17,66% |
| Compliance in mantenimento dupilumab, ± 20% | € 29.481, –11,37% | € 37.044, 11,37% |
| Probabilità di risposta sostenuta a 5+ anni dupilumab, ± 20% | € 36.496, +9,72% | € 31.409, –5,57% |
| Probabilità di risposta sostenuta a 4 anni dupilumab, ± 20% | € 30.583, –8,04% | € 34.470, +3,63% |
| Costo annuale delle risorse (non-responder), ± 20% | € 34.905, 4,94% | € 32.442, –2,47% |
| Variazione dell’utilità rispetto al basale SC (tutti i pazienti), estremi 95% IC | € 32.620, –1,93% | € 33.931, 2,01% |
| Tasso di sconto – costi ed esiti (0%; 5%) | € 32.416, –2,55% | € 33.845, +1,75% |
| Costo annuale delle risorse (responder), ± 20% | € 32.851, –1,24% | € 33.675, 1,24% |
| Età al basale, ± 20% | € 33.203, –0,18% | € 33.363, +0,30% |
| Probabilità di risposta sostenuta a 2 anni SC, ± 20% | € 33.174, –0,27% | € 33.352, +0,27% |
| Probabilità di risposta sostenuta a 3 anni dupilumab, ± 20% | € 33.289, +0,08% | € 33.256, –0,02% |
| Probabilità di risposta sostenuta a 3 anni SC, ± 20% | € 33.239, –0,07% | € 33.286, +0,07% |
| Probabilità di risposta sostenuta a 2 anni dupilumab, ± 20% | € 33.248, –0,04% | € 33.264, +0,00% |
| Orizzonte temporale – 20 anni | € 33.877, +1,85% | |
| Orizzonte temporale – 10 anni | € 35.505, +6,74% | |
| EASI 50 | € 38.147, +14,68% | |
| EASI 75 | € 40.353, +21,32% | |
| EASI 90 | € 42.044, +26,40% | |
EASI: Eczema Area and Severity Index; IC: intervallo di confidenza; ICUR: rapporto incrementale di costo-utilità, incremental cost-utility ratio; SC: terapia di supporto.
La Figura 3 mostra i risultati dell’analisi di sensibilità probabilistica, nella prospettiva del SSN.
Fig. 3 -.
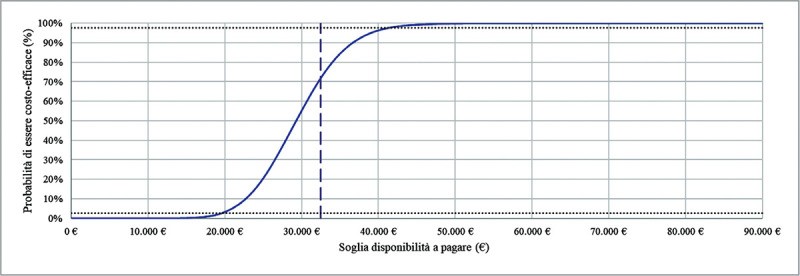
Curva di accettabilità dell’analisi costo-utilità (N = 1.000 simulazioni; ICUR Caso base: 33.263).
La curva di accettabilità dell’analisi costo-utilità (Fig. 3) mostra che, considerando il range informale di accettabilità proposto per l’Italia (€ 25.000-€ 40.000 per QALY guadagnato (31)), dupilumab ha la probabilità del 70,4% di essere economicamente accettabile rispetto alla sola SC (è stato considerato il punto medio del range di accettabilità proposto).
Discussione
L’obiettivo di questa analisi economica è stato quello di confrontare, in termini farmaco-economici, dupilumab + SC rispetto alla SC per il trattamento della DA grave con EASI ≥ 24, in pazienti adulti per i quali la terapia con ciclosporina è controindicata, inefficace o non tollerata, adottando la prospettiva del SSN.
Nell’agosto 2018, dupilumab, un nuovo anticorpo monoclonale umano, è stato rimborsato dall’AIFA per il trattamento della DA grave con EASI ≥ 24 in pazienti adulti, per i quali il trattamento con ciclosporina è controindicato, inefficace o non tollerato (17,37). Il prodotto è stato, inoltre, classificato dall’AIFA come “innovativo” (un riconoscimento particolare per terapie altamente efficaci, approvate in condizioni gravi con elevato bisogno clinico, per le quali non esistono valide opzioni terapeutiche di comprovata efficacia). Un simile riconoscimento del valore clinico è stato raggiunto da dupilumab anche in altri paesi europei, per l’indicazione DA. In Germania (giugno 2018), il Federal Joint Committee (G-BA) ha assegnato a dupilumab lo status di farmaco a “considerevole valore aggiunto” (46). In Francia (luglio 2018), la Commissione di Trasparenza ha assegnato un punteggio di ASMR III (miglioramento “moderato” del beneficio clinico) (47). Infine, il NICE (agosto 2018) ha espresso una raccomandazione positiva di dupilumab, per i pazienti con DA che non hanno risposto ad almeno un’altra terapia sistemica, come la ciclosporina, il metotrexato, il micofenolato mofetile e l’azatioprina o quando questi sono controindicati o non tollerati (30).
Coerentemente con le valutazioni formulate dalle agenzie succitate, anche la presente analisi di costo-utilità ha mostrato che, al prezzo ex-factory proposto al SSN italiano, al netto degli sconti nascosti, dupilumab è un’alternativa costo-efficace rispetto a SC, ovvero con un ICUR che ricade all’interno del range informale di accettabilità proposto per l’Italia dalla Società Italiana di Economia Sanitaria (AIES) (31), € 25.000-€ 40.000 per QALY, per il trattamento della DA grave (EASI ≥ 24).
Nel contesto di qualsiasi valutazione economica, è di fondamentale importanza valutare criticamente la metodologia dell’analisi e i limiti principali. A nostro avviso, i principali aspetti metodologici dell’analisi che richiedono un approfondimento sono: i) la differenza tra i criteri di inclusione del paziente stabiliti nell’analisi costo-utilità e i criteri di rimborso stabiliti dall’AIFA, ii) l’impiego di un expert panel per stimare l’efficacia a lungo termine di dupilumab e alcuni dati di costo della malattia e iii) l’uso del criterio di risposta combinato EASI 50 e DLQI ≥ 4. Per quanto riguarda il primo punto, in assenza di una stratificazione ad-hoc, non è stato possibile condurre un’analisi di costo-utilità che includesse esattamente i pazienti definiti nei criteri di rimborso in Italia, cioè EASI ≥ 24. Tuttavia, riteniamo che questa discrepanza abbia un effetto trascurabile sull’ICUR finale, per due ragioni: i) la differenza tra EASI ≥ 24 e EASI > 25 al basale, negli studi registrativi, era minima (pochissimi pazienti con punteggio EASI tra 24 e 25 al basale) e ii) gli attuali strumenti di classificazione e diagnosi della malattia non sono sufficientemente sensibili per distinguere 1 punto nel punteggio EASI; pertanto, EASI 24 ed EASI 25 sarebbero praticamente indistinguibili dal punto di vista della valutazione (39). Riguardo al secondo punto, bisogna riconoscere come l’utilizzo del parere di esperti per stimare i dati di input, da inserire in un modello, non sia il più robusto degli approcci, ma, date le circostanze, si trattava dell’unica soluzione possibile per condurre l’analisi. Per l’unico dato di input clinico mancante (vale a dire l’efficacia a lungo termine di dupilumab vs SC), è stata utilizzata la stessa fonte già validata in sede di valutazione da parte del NICE (30). Per quanto riguarda gli input economici, è stato adottato un approccio prevalentemente conservativo, escludendo alcuni costi (per esempio, la prescrizione di rituximab nei pazienti non-responder), che avrebbero potuto, in qualche modo, favorire dupilumab. Tuttavia, occorre menzionare che alcune delle scelte semplificatrici citate in precedenza potrebbero aver generato degli errori di accuratezza, che, comunque, sono di minima rilevanza ai fini del calcolo dell’ICUR. In ogni caso, l’incertezza è stata testata attraverso analisi di sensibilità, e queste analisi hanno confermato la robustezza dei risultati. Ovviamente, è auspicabile un aggiornamento della presente analisi, quando saranno disponibili dati più robusti, provenienti dall’uso di dupilumab in real-world.
Per ciò che riguarda il terzo punto, è stato scelto di considerare EASI 50 e DLQI ≥ 4 per misurare la risposta al trattamento, piuttosto che l’EASI 50, che era l’endpoint primario degli studi clinici di dupilumab e il criterio di risposta considerato nel registro di prescrizione stabilito dall’AIFA (14,20). Anche in questo caso, l’inclusione del parametro DLQI come criterio di risposta permette di valutare il miglioramento della qualità della vita che, in questa tipologia di pazienti, risulta essere compromessa a causa della patologia. Inoltre, tale approccio è stato utilizzato nella valutazione economica sottomessa a NICE.
Nonostante alcune limitazioni metodologiche, tipiche dei modelli economici sviluppati subito dopo la conclusione delle sperimentazioni cliniche, riteniamo che l’analisi resti informativa per i prescrittori e i policy-maker.
In conclusione, i risultati dell’analisi di costo-utilità confermano che dupilumab + SC può ritenersi un’opzione terapeutica costo-efficace rispetto alla terapia di supporto (l’unica opzione terapeutica disponibile nella fase di pre-approvazione di dupilumab), per i pazienti adulti affetti da dermatite atopica grave con EASI ≥ 24 in Italia, per i quali il trattamento con ciclosporina è controindicato, inefficace o non tollerato, quando si considera la prospettiva del SSN.
Disclosures
Conflict of interest: The authors declared the following potential conflicts of interest:
AC has received research grants, consulting, or speaker honoraria for the participation as speaker from Abbvie, Sanofi, Pfizer, Novartis, Eli Lilly, Celgene, Leo-Pharma, Almirall.
GF and RB: employees of EBMA Consulting. EBMA Consulting received consulting fees from Sanofi for conducting the analysis.
Financial support: This study was financially supported by Sanofi S.p.A. (Milan, Italy).
Materiali Supplementari
Tabella 1. Criteri di inclusione studio CAFÈ
Survey sulla risposta sostenuta in dermatite atopica.
Tabella 2. Costo di gestione della malattia per paziente responder e non-responder.
Tabella 3. Costo farmaci concomitanti per paziente responder e non-responder.
Tabella 4. Parametri variati nell'analisi di sensibilità.
Tabella 5.
Criteri di inclusione studio CAFÈ.
| Criteri di inclusione |
|---|
|
BSA: -body surface area- area di superficie corporea, EASI: Eczema Area and Severity Index, IGA: Investigator Global Assessment.
Survey sulla risposta sostenuta in dermatite atopica.
L’obiettivo della survey è stato di valutare l’efficacia sostenuta di dupilumab e della SC nel trattamento della DA. Sono stati intervistati 5 dermatologi al fine di determinare i valori di risposta sostenuta nel tempo. Ciascun esperto ha completato l’indagine in maniera autonoma. All’inizio dell’esercizio è stata posta, a tutti i partecipanti la seguente domanda (in riferimento sia a dupilumab che a SC):
Per i pazienti trattati con dupilumab durante lo studio, i benefici sulla qualità della vita ottenuti entro la fine dello studio sarebbero mantenuti, in maniera continuativa, se questi continuassero ad assumere dupilumab?
Per i pazienti trattati con SC durante lo studio, i benefici della qualità della vita ottenuti entro la fine dello studio sarebbero mantenuti, in maniera continuativa, nella normale pratica clinica se questi continuassero ad essere trattati con gli SC?
Per queste domande è stata prevista una risposta di tipo Sì/No. Se la risposta è Sì, l’esercizio termina.
Nelle successive domande è stato chiesto quale percentuale del beneficio acquisito (qualità della vita), acquisita entro la fine dello studio, andrebbe persa dopo che i pazienti trattati con dupilumab o SC, che hanno completato lo studio, sono rimasti in trattamento con la medesima terapia. Se si risponde con 0%, si presuppone che tutti i pazienti continueranno al livello di qualità della vita che avevano alla fine dello studio (Qualità della vita mantenuta). Se si risponde con 100%, si presume che la qualità della vita di tutti i pazienti ritorni al livello che avevano prima di entrare nello studio.
Per elicitare la probabilità di risposta sostenuta del primo anno al secondo anno, e successivamente al terzo anno e così via ciò è stata posta, in maniera ripetitiva, la seguente domanda:
In media entro la fine dell'anno X nella pratica clinica abituale per tutti i pazienti trattati con dupilumab (o SC), quale percentuale della qualità della vita acquisita entro la fine dello studio andrebbe persa se continuassero con dupilumab (o SC)?
Èstata calcolata la media delle risposte dei clinici per anno.
Tabella 6.
Costo di gestione della malattia per paziente responder e non-responder.
| Voci di costo | Costo unitario (€) | Fonte | Paziente responder | Paziente non-responder | ||
|---|---|---|---|---|---|---|
| Utilizzo di risorse (n/anno) [2, 3] | Costo totale (€) | Utilizzo di risorse (n/anno) [2, 3] | Costo totale (€) | |||
| Cure primarie | ||||||
| Visite mediche | €41,32 | Compenso forfetario annuo per assistito del medico di medicina generale (2019) [4] | 4,7 | 76,94 | 7,8 | 127,69 |
| Test di laboratorio | 16,83 | Tariffe codici 91.49.2; 90.62.2; 90.10.4; 90.75.4; 90.27.1; 90.11.4; 90.38.5; 90.40.4; 90.37.4; 90.10.2; 90.13.3 [5] | 1,7 | 27,85 | 2,8 | 45,86 |
| Radiologia convenzionale | 15,49 | Tariffa codice 87.44.1 [5] | 0,9 | 13,94 | 2,2 | 34,08 |
| Test addizionali | 291,40 | Somma tariffe di: test diagnostici, test spirometria; TC; RM; test broncodilatazione [5] | 0,1 | 29,14 | 0,4 | 116,56 |
| Farmaci | Vedasi Tabella 7 | - | 214,93 | - | 761,90 | |
| Cure specialistiche | ||||||
| Visite mediche | 20,66 | Tariffa codice 89.7 [5] | 1,3 | 26,86 | 5,4 | 111,56 |
| Accessi in pronto soccorso | €242,09 | Media costo accesso al pronto soccorso [6] | 0,3 | 81,15 | 3,8 | 1027,95 |
| Costi totali | - | 580,31 | - | 2.313,47 | ||
RM: risonanza magnetica; TC: tomografia computerizzata.
Tabella 7.
Costo farmaci concomitanti per paziente responder e non-responder.
| Farmaci concomitanti | Frequenza prescrizione (% pazienti) [2, 3] | Posologia [3] | Confezione [3] | Costo confezione (€) [7] | Costo mensile (€)* | Durata di trattamento media (mesi / anno) [3] | Costo annuale (€)** | ||
|---|---|---|---|---|---|---|---|---|---|
| Paziente responder | Paziente non-responder | Paziente responder | Paziente non-responder | ||||||
| Antistaminici | 70,0% | 88,1% | 10 mg al giorno | 10 mg 20 compresse | 8,6 | 12,0 | 1 | 8,43 | 10,61 |
| Antagonisti dei leucotrieni | 8,5% | 20,8% | 5 mg al giorno | 5 mg 20 compresse | 7,7 | 10,8 | 1 | 0,92 | 2,25 |
| Antidepressivi | 16,2% | 43,90% | 2-6 cps al giorno | 12,5 mg 20 cps | 9,8 | 54,9 | 6 | 53,34 | 144,55 |
| Ansiolitici | 18,9% | 50,5% | 1 compressa, 3-4 volte al giorno | 0,25 mg 20 compresse | 3,5 | 19,6 | 6 | 22,23 | 59,39 |
| Farmaci antifungini | 4,6% | 10,5% | 200 mg al giorno, max 7 giorni | 100 mg 8 cps | 4,0 | 7,0 | 1 | 0,32 | 0,74 |
| Corticosteroidi topici a bassa / media potenza | 53,7% | 10,6% | Assunzione: 30 g ogni sei mesi | - | - | 40,3*** | 6 | 129,69 | 25,60 |
| Corticosteroidi topici ad alta potenza | 0,0% | 35,2% | Assunzione: 30 g ogni sei mesi | - | - | 73,8*** | 6 | 0,00 | 155,82 |
| Inibitori della calcineurina | 0,0% | 25,8% | Una volta al giorno, due volte a settimana | Unguento allo 0,1% 10 g | 8,0 | 79,6 | 6 | 0,00 | 123,22 |
| Corticosteroidi sistemici | 0,0% | 35,3% | 10-15 mg al giorno, per poche settimane | 25 mg 10 compresse | 3,6 | 5,0 | 6 | 0,00 | 10,56 |
| Ciclosporina | 0,0% | 65,2% | 2,5-5 mg/kg/giorno | 10 mg 50 cps | 6,2 | 48,3 | 6 | 0,00 | 188,93 |
| Metotrexato | 0,0% | 23,0% | 7.5 mg una volta a settimana | 10 mg / 0,40 ml soluzione iniettabile 4 siringhe preriempite | 14,8 | 14,8 | 6 | 0,00 | 20,42 |
| Azatioprina | 0,0% | 8,5% | 1-3 mg/kg/giorno | 50 mg 50 compresse | 7,9 | 7,0 | 6 | 0,00 | 3,59 |
| Micofenolato Mofetile | 0% | 15.20% | 2 g al giorno | 500 mg 50 compresse | 47,7 | 106,8 | 1 | 0,00 | 16,23 |
| Costi totali (€) | 214,93 | 761,90 | |||||||
cps: capsule.
*Calcolato a partire dal costo a confezione, tenendo conto della posologia.
**Calcolato come costo mensile moltiplicato per la frequenza annuale e per la durata del trattamento in mesi.
***Calcolato come media dei costi delle confezioni da 15 g dello stesso tipo (a bassa/media potenza e ad alta potenza), riportate nello studio Buys 2007 [8]
Tabella 8.
Parametri variati nell'analisi di sensibilità.
| Variabile | Stima puntuale | Limite inferiore | Limite superiore | Distribuzione |
|---|---|---|---|---|
| Percentuale pazienti di sesso maschile (%) | 60% | 48% | 72% | Non variato nell’analisi di sensibilità probabilistica |
| Età al basale (anni) | 38,1 | 30,5 | 45,7 | Non variato nell’analisi di sensibilità probabilistica |
| Utilità al basale (N, 0-1) | 0,660 | 0,528 | 0,792 | Beta |
| Proporzione di pazienti con risposta a 16 settimane - dupilumab (%) | 76% | 67% | 84% | Beta |
| Proporzione di pazienti con risposta parziale o completa a 16 settimane - dupilumab (%) | 87% | 70% | 100% | Beta |
| Proporzione di pazienti con risposta a 16 settimane - SC (%) | 26% | 18% | 34% | Beta |
| Proporzione di pazienti in risposta parziale a 16 settimane (EASI50) (%) | 91% | 85% | 97% | Beta |
| Rischio relativo di risposta sostenuta per 52 settimane – dupilumab (%) | 94% | 89% | 99% | Log-normale |
| Rischio relativo di risposta sostenuta per 52 settimane – SC (%) | 77% | 70% | 84% | Log-normale |
| Probabilità di risposta sostenuta a 2 anni - dupilumab(%) | 98% | 78% | 100% | Non variato nell’analisi di sensibilità probabilistica |
| Probabilità di risposta sostenuta a 3 anni - dupilumab(%) | 95% | 76% | 100% | Non variato nell’analisi di sensibilità probabilistica |
| Probabilità di risposta sostenuta a 4 anni - dupilumab(%) | 93% | 74% | 100% | Non variato nell’analisi di sensibilità probabilistica |
| Probabilità di risposta sostenuta a 5+ anni - dupilumab (%) | 92% | 74% | 100% | Non variato nell’analisi di sensibilità probabilistica |
| Probabilità di risposta sostenuta a 2 anni SC (%) | 37% | 30% | 44% | Non variato nell’analisi di sensibilità probabilistica |
| Probabilità di risposta sostenuta a 3 anni SC (%) | 9% | 7% | 11% | Non variato nell’analisi di sensibilità probabilistica |
| Tasso di interruzione annuale – dupilumab (%) | 3,7% | 2,9% | 4,4% | Log-normale |
| Costo annuale delle risorse - Pazienti responders (€) | 470,80 € | 376,64 € | 564,96 € | Gamma |
| Costo annuale delle risorse - Pazienti non-responders (€) | 2.225,60 € | 1.780,48 € | 2.448,16 € | Gamma |
| Variazione EASI rispetto al basale (tutti i pazienti) -dupilumab (N) | -29,69 | -26,70 | -32,68 | Normale |
| Variazione EASI rispetto al basale (tutti i pazienti) – SC (N) | -13,50 | -10,77 | -16,23 | Normale |
| Variazione EASI rispetto al basale (pazienti responders) -dupilumab (N) | -32,18 | -29,68 | -34,68 | Normale |
| Variazione EASI rispetto al basale (pazienti responders parziali e completi) - dupilumab (N) | -31,68 | -29,46 | -33,90 | Normale |
| Variazione del punteggio del prurito rispetto al basale (tutti i pazienti) – dupilumab (N) | -4,02 | -3,54 | -4,50 | Normale |
| Variazione del punteggio del prurito rispetto al basale (tutti i pazienti) – SC (N) | -1,95 | -1,51 | -2,39 | Normale |
| Variazione del punteggio del prurito rispetto al basale (pazienti responders) – dupilumab (N) | -4,46 | -3,89 | -5,03 | Normale |
| Variazione del punteggio del prurito rispetto al basale (pazienti responders parziali e completi) – dupilumab (N) | -4,18 | -3,67 | -4,69 | Normale |
| Variazione dell'utilità rispetto al basale (tutti i pazienti) – dupilumab (N) | 0,24 | 0,19 | 0,29 | Normale |
| Variazione dell'utilità rispetto al basale (tutti i pazienti) – SC (N) | 0,12 | 0,07 | 0,17 | Normale |
| Variazione dell'utilità rispetto al basale (pazienti responders) – dupilumab (N) | 0,29 | 0,23 | 0,35 | Normale |
| Variazione dell'utilità rispetto al basale (pazienti responders parziali e completi) – dupilumab (N) | 0,26 | 0,20 | 0,31 | Normale |
EASI: Eczema Area and Severity Index, SC: terapia di supporto.
Bibliografia
- 1.Eichenfield LF, Tom WL, Chamlin SL et al. Guidelines of care for the management of atopic dermatitis: Section 1. Diagnosis and assessment of atopic dermatitis Work Group. J Am Acad Dermatol. 2014 Feb;70(2):338–51. doi: 10.1016/j.jaad.2013.10.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Sicras-Mainar A, Navarro-Artieda R, Carrascosa Carrillo JM. Economic Impact of Atopic Dermatitis in Adults: A Population-Based Study(IDEA Study). Actas Dermosifiliogr. 2018;109:35–46. doi: 10.1016/j.ad.2017.09.003. [DOI] [PubMed] [Google Scholar]
- 3.Clinical expert opinion to determine monitoring costs associated to AD treatments. 2018. Data on file. [Google Scholar]
- 4.SISAC. Verbale preintesa - Ipotesi di Accordo Collettivo Nazionale per la Disciplina dei rapporti con i medici di medicina generale 2019. Link(Data ultimo accesso 30/06/2020) [Google Scholar]
- 5.Ministero della salute. Tariffe delle prestazioni ambulatoriali. Supplemento n.8, Gazzetta Ufficiale n. 23, 2013. Allegato 3. Link [Google Scholar]
- 6.Ministero della Salute. Progetto Mattoni SSN. Pronto Soccorso e sistema 118. Proposta metodologica per la valutazione dei costi dell’emergenza. LinkD [Google Scholar]
- 7.Codifa. L’informatore farmaceutico. Link [Google Scholar]
- 8.Buys LM. Treatment Options for Atopic Dermatitis. Am Fam Physician. 2007;75:523–8. [PubMed] [Google Scholar]
Bibliografia
- 1.Società Italiana di Allergologia e Immunologia Pediatrica. La gestione clinica della dermatite atopica in età pediatrica. http://www.riaponline.it/wp-content/uploads/2015/05/RivRiap_suppl2_2_151.pdf (Data ultimo accesso 01/12/2018). [Google Scholar]
- 2.Medscape. Atopic Dermatitis. Practise essentials. https://emedicine.medscape.com/article/1049085-overview (Data ultimo accesso 01/12/2018). [Google Scholar]
- 3.Gandhi NA, Bennett BL, Graham NMH et al. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15:35–50. doi: 10.1038/nrd4624. [DOI] [PubMed] [Google Scholar]
- 4.Kim J, Kim BE, Leung DYM. Pathophysiology of atopic dermatitis: Clinical implications. Allergy Asthma Proc. 2019;40:84–92. doi: 10.2500/aap.2019.40.4202. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Flohr C, Mann J. New insights into the epidemiology of childhood atopic dermatitis. Allergy: European Journal of Allergy and Clinical Immunology. 2014;69(1):3–16. doi: 10.1111/all.12270. [DOI] [PubMed] [Google Scholar]
- 6.Società Italiana di Dermatologia Medica, Chirurgia, Estetica e delle Malattie sessualmente trasmesse. Dermatite atopica. http://www.pacinimedicina.it/dermatite-atopica-linee-guida-sidemast-2016-2017/ (Data ultimo accesso 01/12/2018). [Google Scholar]
- 7.Barbarot S, Auziere S, Gadkari A et al. Epidemiology of atopic dermatitis in adults: Results from an international survey. Allergy. 2018;73(6):1284–93. doi: 10.1111/all.13401. [DOI] [PubMed] [Google Scholar]
- 8.Drucker AM. Atopic dermatitis: Burden of illness, quality of life, and associated complications. Allergy Asthma Proc. 2017;38(1):3–8. doi: 10.2500/aap.2017.38.4005. [DOI] [PubMed] [Google Scholar]
- 9.Hajar T, Gontijo JRV, Hanifin JM. New and developing therapies for atopic dermatitis. An Bras Dermatol. 2018;93:104–7. doi: 10.1590/abd1806-4841.20187682. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Megna M, Napolitano M, Patruno C et al. Systemic Treatment of Adult Atopic Dermatitis: A Review. Dermatol Ther (Heidelb). 2017;7:1–23. doi: 10.1007/s13555-016-0170-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Bieber T, Straeter B. Off-label prescriptions for atopic dermatitis in Europe. Allergy. 2015;70:6–11. doi: 10.1111/all.12498. [DOI] [PubMed] [Google Scholar]
- 12.Agenzia Europea per i Medicinali (EMA). Dupixent (Dupilumab). Riassunto caratteristiche prodotto. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/004390/WC500236507.pdf (Data ultimo accesso 01/12/2018). [Google Scholar]
- 13.Crepy M, Nosbaum A, Bensefa‐Colas L. Blocking type 2 inflammation by dupilumab does not control classic (type 1‐driven) allergic contact dermatitis in chronic hand eczema. Contact Dermatitis. 2019;81(2):145–7. doi: 10.1111/cod.13266. [DOI] [PubMed] [Google Scholar]
- 14.Simpson EL, Bieber T, Guttman-Yassky E et al. Two Phase 3 Trials of Dupilumab versus Placebo in Atopic Dermatitis. N Engl J Med. 2016;375(24):2335–48. doi: 10.1056/NEJMoa1610020. [DOI] [PubMed] [Google Scholar]
- 15.Blauvelt A, de Bruin-Weller M, Gooderham M et al. Long-term management of moderate-to-severe atopic dermatitis with dupilumab and concomitant topical corticosteroids (LIBERTY AD CHRONOS): a 1-year, randomised, double-blinded, placebo-controlled, phase 3 trial. Lancet. 2017;389:2287–303. doi: 10.1016/S0140-6736(17)31191-1. [DOI] [PubMed] [Google Scholar]
- 16.de Bruin-Weller M, Thaçi D, Smith CH et al. Dupilumab with concomitant topical corticosteroid treatment in adults with atopic dermatitis with an inadequate response or intolerance to ciclosporin A or when this treatment is medically inadvisable: a placebo-controlled, randomized phase III clinical t. Br J Dermatol. 2018;178:1083–101. doi: 10.1111/bjd.16156. [DOI] [PubMed] [Google Scholar]
- 17.Agenzia Italiana del farmaco (AIFA). Farmaci innovativi oncologici sottoposti a registro di monitoraggio. http://www.aifa.gov.it/sites/default/files/farmaci_innovativi_monitoraggio_01.10.2018.pdf (Data ultimo accesso 01/12/2018). [Google Scholar]
- 18.Woolacott N, Hawkins N, Mason A et al. Etanercept and efalizumab for the treatment of psoriasis: A systematic review. Health Technol Assess. 2006;10(46):1–233. i–iv. doi: 10.3310/hta10460. [DOI] [PubMed] [Google Scholar]
- 19.Pan F, Brazier NC, Shear NH et al. Cost utility analysis based on a head-to-head phase 3 trial comparing ustekinumab and etanercept in patients with moderate-to-severe plaque psoriasis: A Canadian perspective. Value Heal. 2011;14(5):652–6. doi: 10.1016/j.jval.2011.01.006. [DOI] [PubMed] [Google Scholar]
- 20.Sizto S, Bansback N, Feldman SR et al. Economic evaluation of systemic therapies for moderate to severe psoriasis. Br J Dermatol. 2009;160(6):1264–72. doi: 10.1111/j.1365-2133.2008.08962.x. [DOI] [PubMed] [Google Scholar]
- 21.Anis AH, Bansback N, Sizto S et al. Economic evaluation of biologic therapies for the treatment of moderate to severe psoriasis in the United States. J Dermatolog Treat. 2011;22(2):65–74. doi: 10.3109/09546630903551258. [DOI] [PubMed] [Google Scholar]
- 22.Colombo GL, Di Matteo S, Peris K et al. A cost-utility analysis of etanercept for the treatment of moderate-to-severe psoriasis in Italy. Clinicoecon Outcomes Res. 2009;1:53–9. doi: 10.2147/ceor.s7348. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Graham C, Mollon P, Miles L et al. A New Cost-Effectiveness Framework For Modeling Psoriasis Treatments. Value Heal. 2015;18(3):A20. [Google Scholar]
- 24.Institute for Clinical and Economic Review. Targeted immunomodulators for the treatment of moderate-to-severe plaque psoriasis: effectiveness and value. Dicembre 2016. Disponibile: https://icer-review.org/wp-content/uploads/2016/12/NE_CEPAC_Psoriasis_Evi (Data ultimo accesso 01/12/2018). [Google Scholar]
- 25.Rodgers M, Epstein D, Bojke L et al. Etanercept, infliximab and adalimumab for the treatment of psoriatic arthritis: A systematic review and economic evaluation. Health Technol Assess. 2011;15(10):i–xxi. 1–329. doi: 10.3310/hta15100. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Bojke L, Epstein D, Craig D et al. Modelling the cost-effectiveness of biologic treatments for psoriatic arthritis. Rheumatology. 2011;50(Suppl.4):iv39–iv47. doi: 10.1093/rheumatology/ker245. [DOI] [PubMed] [Google Scholar]
- 27.Cawson MR, Mitchell SA, Knight C et al. Systematic review, network meta-analysis and economic evaluation of biological therapy for the management of active psoriatic arthritis. BMC Musculoskelet Disord. 2014;15:26. doi: 10.1186/1471-2474-15-26. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Graham CN, Gunda P, Miles L et al. A new cost-effectiveness framework for modeling psoriatic arthritis treatments. Value Heal. 2016;19(3):A233–4. [Google Scholar]
- 29.Woolacott N, Vergel YB, Hawkins N et al. Etanercept and infliximab for the treatment of psoriatic arthritis: A systematic review and economic evaluation. Health Technol Assess. 2006;10(31):iii–iv. xiii–xvi, 1–239. doi: 10.3310/hta10310. [DOI] [PubMed] [Google Scholar]
- 30.National Institute for Health and Care Excellence (NICE). Dupilumab for treating moderate to severe atopic dermatitis. https://www.nice.org.uk/guidance/ta534 (Data ultimo accesso 01/12/2018). [Google Scholar]
- 31.Fattore G. Proposta di Linee Guida per la valutazione economica degli interventi sanitari in Italia. PharmacoEconomics – Italian Research Articles. 2009;11(2):83–93. [Google Scholar]
- 32.Sanofi. SAR231893. AD1224. CHRONOS – CAFÉ like population. Data on file. 2016a October 24,; [Google Scholar]
- 33.Istituto nazionale di statistica (ISTAT). Tavole di mortalità della popolazione residente: Italia. http://demo.istat.it/tvm2016/index.php?lingua=ita (Data ultimo accesso 01/12/2018). [Google Scholar]
- 34.McKenna C, McDaid C, Suekarran S et al. Enhanced external counterpulsation for the treatment of stable angina and heart failure: A systematic review and economic analysis. Health Technol Assess. 2009;13(24):iii–iv. ix–xi, 1–90. doi: 10.3310/hta13240. [DOI] [PubMed] [Google Scholar]
- 35.Sanofi. Persistence of the quality of life gain in AD. Data on file. October 19, 2017f. [Google Scholar]
- 36.Sanofi. UK model with adaptations. Data on file. November 14, 2017g. [Google Scholar]
- 37.Agenzia Italiana del Farmaco (AIFA). Regime di rimborsabilità e prezzo del medicinale per uso umano «Dupixent». GU Serie Generale n. 208 del 07-09-2018. Disponibile sul sito: https://www.gazzettaufficiale.it/eli/gu/2018/09/07/208/sg/pdf [Google Scholar]
- 38.Silverberg JI, Simpson EL. Association between severe eczema in children and multiple comorbid conditions and increased healthcare utilization. Pediatr Allergy Immunol. 2013;24(5):476–86. doi: 10.1111/pai.12095. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Clinical expert opinion to determine monitoring costs associated to AD treatments. 2018. Data on file. [Google Scholar]
- 40.Sicras-Mainar A, Navarro-Artieda R, Carrascosa Carrillo JM. Economic Impact of Atopic Dermatitis in Adults: A Population-Based Study (IDEA Study). Actas Dermosifiliogr. 2018;109:35–46. doi: 10.1016/j.ad.2017.09.003. [DOI] [PubMed] [Google Scholar]
- 41.Ministero della Salute. Progetto Mattoni SSN. Pronto Soccorso e sistema 118. Proposta metodologica per la valutazione dei costi dell’emergenza. Disponibile sul sito: http://www.mattoni.salute.gov.it/mattoni/documenti/11_Valutazione_costi_dell_emergenza.pdf (Data ultimo accesso 01/12/2018). [Google Scholar]
- 42.Ministero della salute. Tariffe delle prestazioni ambulatoriali. Supplemento n. 8, Gazzetta Ufficiale n. 23, 2013. Allegato. http://www.trovanorme.salute.gov.it/norme/renderPdf.spring?seriegu=SG&datagu=28/01/2013&redaz=13A00528&artp=3&art=1&subart=1&subart1=10&vers=1&prog=001. [Google Scholar]
- 43.Codifa. L’informatore farmaceutico. OFTACILOX. 0,3% unguento oftalmico tubo 3,5 g. Disponibile: https://www.codifa.it/cont/codica-ricerca/27/ricerca.asp?id_scheda=3810 (Data ultimo accesso 01/12/2018). [Google Scholar]
- 44.SISAC. Verbale preintesa – Ipotesi di Accordo Collettivo Nazionale per la Disciplina dei rapporti con i medici di medicina generale 2019. Disponibile: https://www.quotidianosanita.it/allegati/allegato2327959.pdf (Data ultimo accesso 30/06/2020). [Google Scholar]
- 45.Poole CD, Bannister CA, Andreasen JN et al. Estimation of health-related utility (EQ-5D index) in subjects with seasonal allergic rhinoconjunctivitis to evaluate health gain associated with sublingual grass allergen immunotherapy. Health Qual Life Outcomes. 2014;12:99. doi: 10.1186/1477-7525-12-99. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Federal Joint Commitee (G-BA). Benefit Assessment of Dupilumad. https://www.g-ba.de/downloads/39-261-3314/2018-05-17_AM-RL-XII_Dupilumab_D-328_BAnz.pdf (Data ultimo accesso 01/12/2018). [Google Scholar]
- 47.Haute Autorité de Santé. Opinion of the Transparency Committee on Dupilumab. https://www.has-sante.fr/portail/jcms/c_2865400/fr/dupixent-dupilumab-medicament-de-la-dermatite-non-corticoide (Data ultimo accesso 01/12/2018). [Google Scholar]


