Abstract
目的
研究甲巯咪唑治疗儿童甲状腺功能亢进症(简称“甲亢”)不良反应发生情况。
方法
回顾性分析中国医科大学附属盛京医院2015年1月—2021年5月住院的304例甲亢患儿的临床资料。统计甲巯咪唑治疗相关不良反应的发生情况,探讨常见不良反应的危险因素。
结果
304例患儿中,出现甲巯咪唑治疗相关不良反应87例(28.6%),其中男性20例(23%),女性67例(77%)。较常见的不良反应有粒细胞减少(12.8%)、皮疹(11.8%)、丙氨酸氨基转移酶升高(9.5%)及关节疼痛(3.0%),部分患儿可同时或间断出现多种不良反应。粒细胞减少主要出现在用药后3个月内(25/39,64%);丙氨酸氨基转移酶升高主要发生在用药后1个月内(17/29,59%);皮疹主要发生在用药后3个月内(30/36,83%)。对症治疗后上述不良反应大部分可恢复正常。多因素logistic回归分析显示,年龄小、治疗前中性粒细胞绝对计数低是甲巯咪唑治疗后粒细胞减少的危险因素(P<0.05)。
结论
甲巯咪唑治疗儿童甲亢不良反应较常见,多发生在用药后3个月内,多数经过对症治疗可缓解。年龄越小,中性粒细胞绝对计数基线值越低,越容易发生粒细胞减少。
Keywords: 甲状腺功能亢进症, 甲巯咪唑, 不良反应, 儿童
Abstract
Objective
To investigate the incidence rate of adverse reactions of methimazole in children with hyperthyroidism.
Methods
A retrospective analysis was performed on the medical data of 304 children with hyperthyroidism who were hospitalized in Shengjing Hospital of China Medical University from January 2015 to May 2021. The incidence rate of methimazole-related adverse reactions was analyzed. The risk factors for common adverse reactions were evaluated.
Results
Among the 304 children, 87 (28.6%) experienced adverse reactions, among whom there were 20 boys (23%) and 67 girls (77%). Common adverse reactions included neutropenia (12.8%), rash (11.8%), elevated alanine aminotransferase (9.5%), and joint pain (3.0%), and some children experienced multiple adverse reactions simultaneously or intermittently. Neutropenia often occurred within 3 months after administration (25/39, 64%), elevated alanine aminotransferase often occurred within 1 month after administration (17/29, 59%), and rash often occurred within 3 months after administration (30/36, 83%). Most of the above adverse reactions returned to normal after symptomatic treatment. The multivariate logistic regression analysis showed that younger age and lower absolute neutrophil count before treatment were risk factors for neutropenia after methimazole treatment (P<0.05).
Conclusions
The adverse reactions of methimazole are common in children with hyperthyroidism, and most adverse reactions occur within 3 months after administration and can be relieved after symptomatic treatment. Children with a younger age or a lower baseline absolute neutrophil count may have a higher risk of neutropenia.
Keywords: Hyperthyroidism, Methimazole, Adverse reaction, Child
甲状腺功能亢进症(简称“甲亢”)是一种常见的内分泌疾病,但儿童仅占所有年龄段确诊病例的1%~5%,发病率为0.3/10万~3/10万[1]。甲亢有3种治疗方式:抗甲状腺药物(antithyroid drug,ATD)、放射性碘和手术治疗,每种治疗方式的风险和益处各不相同。相较于手术及放射性碘治疗而言,长期ATD治疗不仅有效、便利,而且不会造成甲状腺永久性损伤[2]。国内外共识已将ATD作为甲亢治疗的首选,但其缺点是复发率高,缓解率低,相关不良反应多[3-4]。常用ATD包括甲巯咪唑(methimazole,MMI)及丙基硫氧嘧啶(propylthiouracil,PTU)。由于PTU存在严重肝毒性的风险,所以儿童甲亢首选MMI[5]。有研究表明,口服MMI后成人患者可出现皮疹、胃不耐受和关节疼痛等,极少数病例出现粒细胞缺乏和肝毒性,甚至危及生命[6]。而更罕见的有急性胰腺炎、红斑狼疮[7-8],以及胰岛素自身免疫综合征等[9]免疫系统疾病。儿童及青少年产生不良反应的概率更大[10]。ATD相关不良反应是儿童治疗中的一个难题,而国内有关儿童甲亢用药后不良反应大样本的研究较少[11],且均未深入探究不良反应潜在的危险因素及相关处理方法[12],临床尚存在着诸多困惑。因此本研究回顾性总结、分析MMI治疗儿童甲亢的不良反应发生情况及应对策略,探讨相关不良反应发生的危险因素,以提高对MMI的认识,从而提高儿童患者的用药安全性。
1. 资料与方法
1.1. 研究对象
选取2015年1月—2021年5月在中国医科大学附属盛京医院小儿内分泌遗传代谢内科住院治疗的304例甲亢患儿为研究对象。纳入标准:(1)初次诊断为甲亢;(2)年龄28 d至14岁;(3)接受MMI治疗;(4)门诊规律随访超过3个月。同时满足上述4条者即可入组。排除标准:(1)初次住院,但外院确诊后已经用药治疗的住院患儿;(2)亚急性甲状腺炎、急性化脓性甲状腺炎和医源性甲亢等有明确病因的甲亢及有自身免疫性肝炎、病毒性肝炎、酒精性肝炎、骨髓或肝移植病史等基础疾病;(3)合并感染;(4)临床资料不全及研究期结束前失访。符合上述任一条者即排除。
本研究已通过中国医科大学附属盛京医院科研项目伦理审查(2002PS484K)。
1.2. 诊断标准
甲亢诊断标准:(1)甲状腺毒症所致高代谢的症状和体征;(2)甲状腺肿大;(3)血清游离三碘甲状腺原氨酸(free triiodothyronine,FT3)和游离甲状腺素(free thyroxine,FT4)增高,促甲状腺激素(thyroid-stimulating hormone,TSH)降低。同时具备以上3个条件,甲亢的诊断即可成立[13]。
粒细胞减少:指外周血中性粒细胞绝对计数(absolute neutrophil count,ANC)低于正常,即新生儿生后2周至1岁时ANC<1.0×109/L,>1岁及成人<1.5×109/L[14]。粒细胞缺乏:ANC<0.5×109/L[14]。
药物性肝病:指使用1种或多种药物后,由药物或其代谢产物引起的肝脏损伤,主要根据用药史、停用药物后的恢复情况、再用药时的反应、实验室检查有肝细胞损伤及胆汁淤积的证据,可采用国际上常用的RUCAM评分系统[阳性:再用药后丙氨酸氨基转移酶(alanine aminotransferase,ALT)升高>2倍正常值上限][15-16]。
胆汁淤积:(1)血清总胆红素<5.0 mg/dL,直接胆红素>1.0 mg/dL(17 μmol/L);(2)血清总胆红素>5.0 mg/dL,直接胆红素占血清总胆红素比例≥20%。符合其中1条即可诊断[17]。
1.3. 基本信息收集
(1)在我院系统的电子病历记录中获得患儿的基本信息,包括患儿的年龄、性别、家族史等;(2)收集MMI治疗前患儿全血细胞计数、甲状腺激素(FT4和FT3)、TSH、ALT、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)等实验室检查结果及MMI初始剂量;(3)收集MMI治疗相关的不良反应类型、出现不良反应的时间及治疗后是否好转等相关临床数据。
1.4. 随访记录
查看患儿在门诊规律复查的病历记录、医嘱、用药记录(剂量、频率和持续时间)、相关实验室检查报告,详细记录患儿可疑的不良反应及与不良反应相关的可能因素,直到数据收集结束或患儿未继续门诊就诊时随访结束(随访时间均大于3个月)。
1.5. 统计学分析
采用SPSS 26.0软件进行数据分析。计量资料采用中位数(四分位数间距)[M(P 25,P 75)]表示,组间比较采用Mann-Whitney U检验或Kruskal-Wallis检验;计数资料以例数和百分率(%)表示,组间比较采用 检验。将单因素分析中具有统计学意义的变量纳入多因素logistic回归模型,分析影响阳性事件结局的因素。P<0.05为差异有统计学意义。
2. 结果
2.1. MMI相关不良反应的总体概况
2015年1月—2021年5月期间我院甲亢住院患儿共331例,因未规律门诊复查、院外用药等原因排除27例,最终纳入304例。其中男性69例(22.7%),女性235例(77.3%);平均年龄为9.9岁(范围1.7~13.9岁)。随访时间均大于3个月,最长达81个月。304例患儿中,出现不良反应87例(28.6%),其中男性20例(23%),女性67例(77%)。部分患儿可同时或间断出现多种不良反应,相对常见的有粒细胞减少(39例,12.8%)、皮疹(36例,11.8%)、ALT升高(29例,9.5%)及关节疼痛(9例,3.0%),相对少见的有胆汁淤积(3例,1.0%)、肌肉疼痛(2例,0.7%)、血小板减少(1例,0.3%)、粒细胞缺乏(1例,0.3%)(图1)。
图1. 304例患儿甲巯咪唑相关不良反应发生率及出现时间.
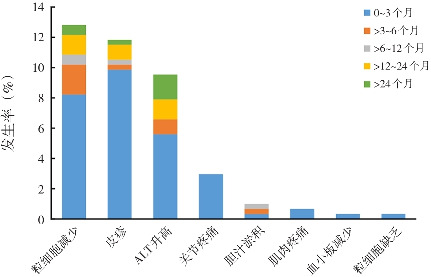
粒细胞减少主要出现在用药后3个月内(25/39,64%),其中14例出现在用药后1周,最晚可在用药后36个月出现,经过口服升ANC的药物治疗后,ANC在3个月内大部分患儿可恢复到正常(35/39,90%)。ALT升高主要发生在用药后1个月内(17/29,59%),最晚可在用药后60个月出现,ALT升高≥2倍的患儿予保肝药后大部分得到有效缓解(7/8,88%)。皮疹主要发生在3个月内(30/36,83%)。27例轻度皮疹,予以密切观察;9例中重度皮疹,予抗组胺类药物口服。大部分患儿皮疹减轻至消退;2例皮疹仍未缓解者,停用MMI,改为PTU治疗后皮疹消退。
有不良反应组和无不良反应组MMI治疗前临床资料的比较显示,年龄、性别、家族史阳性、病程、甲状腺激素指标、甲状腺抗体指标及MMI初始剂量的比较差异均无统计学意义(P>0.05),见表1。
表1.
有无不良反应患儿MMI治疗前临床资料的比较
| 项目 | 无不良反应组 (n=217) | 有不良反应组 (n=87) | Z/ 值 | P值 |
|---|---|---|---|---|
| 年龄 [M(P 25, P 75), 岁] | 10.0(7.0, 11.8) | 9.4(6.0, 11.5) | 1.051 | 0.293 |
| 女性 [n(%)] | 168(77.4) | 67(77.0) | 0.006 | 0.939 |
| 家族史阳性# [n(%)] | 98(45.2) | 36(41.4) | 0.360 | 0.548 |
| 病程 [M(P 25, P 75), 月] | 3.0(1.0, 6.0) | 3.0(1.0, 6.0) | 0.611 | 0.541 |
| FT3 [M(P 25, P 75), pmol/L] | 31.0(19.4, 47.0) | 31.0(19.2, 47.0) | 0.038 | 0.970 |
| FT4 [M(P 25, P 75), pmol/L] | 43.1(34.3, 52.3) | 42.4(34.6, 52.0) | 0.014 | 0.988 |
| TSH (×10-4) [M(P 25, P 75), μIU/mL] | 2.0(1.0, 8.5) | 4.5(1.0, 10.5) | 1.226 | 0.220 |
| TRAb [M(P 25, P 75), IU/L] | 22.3(20.6, 24.1) | 22.1(19.7, 24.6) | 0.168 | 0.867 |
| TPOAb阳性 [n(%)] | 188(86.6) | 76(87.4) | 0.033 | 0.856 |
| TGAb阳性 [n(%)] | 173(79.7) | 69(79.3) | 0.189 | 0.664 |
| MMI初始剂量 [M(P 25, P 75), mg/kg] | 0.63(0.55, 0.68) | 0.63(0.57, 0.67) | 0.502 | 0.616 |
注:[FT3]游离三碘甲状腺原氨酸;[FT4]血清游离甲状腺素;[TSH]促甲状腺激素;[TRAb]促甲状腺激素受体抗体;[TPOAb]甲状腺过氧化物酶抗体;[TGAb]抗甲状腺球蛋白抗体;[MMI]甲巯咪唑。#家族史所涉及的疾病包括甲状腺功能亢进症、甲状腺功能减低症、甲状腺癌。
2.2. 甲亢患儿MMI治疗前后血ANC的变化
2.2.1. MMI治疗前血ANC情况
20例患儿在口服MMI前即出现粒细胞减少,其中男性5例(25%),女性15例(75%)。对于粒细胞缺乏者,先予升ANC的药物治疗,待ANC正常后再予MMI治疗。粒细胞减少者,可同时给予MMI和升ANC的药物治疗。此类患儿MMI一般选择偏小剂量[0.5 mg/(kg·d)]。有18例患儿ANC在3个月内恢复正常,而2例患儿分别在复查的12个月及20个月内反复出现粒细胞减少。
2.2.2. MMI治疗后ANC的变化
284例患儿治疗前ANC正常,MMI治疗后39例粒细胞减少(粒细胞减少组),245例ANC正常(粒细胞正常组)。粒细胞减少组中有4例患儿在复查期间ANC无明显改善,但均无发热、咽痛等明显感染症状。
粒细胞减少组和粒细胞正常组治疗前临床资料的比较显示:粒细胞减少组患儿年龄小于粒细胞正常组,病程长于粒细胞正常组,ANC低于粒细胞正常组,差异均有统计学意义(P<0.05);而2组性别、家族史阳性、MMI初始剂量及FT3、FT4、TSH、甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)、抗甲状腺球蛋白抗体(thyroid globulin antibody,TGAb)、TRAb水平等指标的比较差异均无统计学意义(P>0.05)。见表2。
表2.
MMI治疗后粒细胞减少组和粒细胞正常组治疗前临床资料的比较
| 项目 | 粒细胞正常组 (n=245) | 粒细胞减少组 (n=39) | Z/ 值 | P值 |
|---|---|---|---|---|
| 年龄 [M(P 25, P 75), 岁] | 10.0(7.0, 11.7) | 7.6(4.5, 11.4) | 2.571 | 0.010 |
| 女性 [n(%)] | 191(78.0) | 29(74.4) | 1.898 | 0.168 |
| 家族史阳性# [n(%)] | 134(54.7) | 23(59.0) | 0.224 | 0.636 |
| 病程 [M(P 25, P 75), 月] | 3.0(1.0, 6.0) | 6.0(1.0, 7.0) | 2.035 | 0.042 |
| ANC [M(P 25, P 75), ×109/L] | 3.2(2.3, 4.6) | 2.5(2.0, 3.5) | 2.735 | 0.006 |
| FT3 [M(P 25, P 75), pmol/L] | 29.6(18.9, 47.0) | 31.0(22.9, 44.3) | 0.640 | 0.522 |
| FT4 [M(P 25, P 75), pmol/L] | 42.1(33.9, 52.1) | 42.4(36.4, 51.2) | 0.400 | 0.689 |
| TSH (×10-4) [M(P 25, P 75), μIU/mL] | 3.0(1.0, 9.3) | 2.0(1.0, 9.5) | 0.481 | 0.631 |
| TRAb [M(P 25, P 75), IU/L] | 22.1(20.5, 23.8) | 23.9(20.5, 27.3) | 0.764 | 0.445 |
| TPOAb 阳性 [n(%)] | 210(85.7) | 35(89.7) | 0.043 | 0.835 |
| TGAb 阳性 [n(%)] | 194(79.2) | 31(79.5) | 0.166 | 0.684 |
| MMI初始剂量 [M(P 25, P 75), mg/kg] | 0.63(0.55, 0.68) | 0.63(0.59, 0.68) | 1.019 | 0.308 |
注:[ANC]中性粒细胞绝对计数;[FT3]游离三碘甲状腺原氨酸;[FT4]血清游离甲状腺素;[TSH]促甲状腺激素;[TRAb]促甲状腺激素受体抗体;[TPOAb]甲状腺过氧化物酶抗体;[TGAb]抗甲状腺球蛋白抗体;[MMI]甲巯咪唑。#家族史所涉及的疾病包括甲状腺功能亢进症、甲状腺功能减低症、甲状腺癌。
将表2中2组比较差异具有统计学意义的指标,即年龄、病程、治疗前ANC作为自变量,以是否发生粒细胞减少为因变量构建多因素logistic回归方程。结果显示:年龄越大,发生粒细胞减少的风险越低(P<0.05);治疗前ANC越高,发生粒细胞减少的风险越低(P<0.05)。见表3。
表3.
粒细胞减少的多因素分析结果
| 变量 | B | SE | Wald | P | OR | 95%CI | |
|---|---|---|---|---|---|---|---|
| 下限 | 上限 | ||||||
| 年龄 | -0.170 | 0.055 | 9.650 | 0.002 | 0.843 | 0.757 | 0.939 |
| 病程 | 0.039 | 0.024 | 2.723 | 0.099 | 1.040 | 0.993 | 1.090 |
| 治疗前ANC | -0.355 | 0.134 | 6.982 | 0.008 | 0.701 | 0.539 | 0.912 |
| 常数项 | 0.600 | 0.659 | 0.830 | 0.362 | 1.823 | - | - |
注:[ANC]中性粒细胞绝对计数。各变量均为连续型变量。
粒细胞缺乏仅发生1例,出现在口服MMI后1周,予暂停MMI、注射粒细胞集落刺激因子治疗,待ANC恢复正常后再次试用小剂量MMI,在1.5个月复查时ANC升至4.2×109/L,此后未再出现粒细胞减少或缺乏。
2.3. 甲亢患儿MMI治疗前后肝功能的变化
304例患儿中,口服MMI后出现肝损伤52例(17.1%),包括ALT升高及胆红素升高,其中有2例患儿间断兼有出现ALT升高及胆红素升高,但均未达到胆汁淤积性肝炎程度。
2.3.1. 甲亢患儿MMI治疗前后ALT的变化
14例患儿在口服MMI前即出现ALT升高(ALT参考区间0~40 U/L),290例正常。根据MMI治疗后ALT水平,将290例患儿分为ALT正常组(261例)、ALT升高<2倍组(21例)、ALT升高≥2倍组(8例)。3组间治疗前临床资料比较,显示3组年龄、性别、家族史阳性、病程、MMI初始剂量、ALT、FT3、FT4、TSH、TRAb、TPOAb阳性、TGAb阳性等指标的比较差异均无统计学意义(P>0.05),见表4。
表4.
MMI治疗后ALT升高组和正常组治疗前临床资料的比较
| 项目 | ALT正常组 (n=261) | ALT升高<2倍组 (n=21) | ALT升高≥2倍组 (n=8) | H/ 值 | P值 |
|---|---|---|---|---|---|
| 年龄 [M(P 25, P 75), 岁] | 9.8(7.0, 11.6) | 8.5(4.4, 11.8) | 10.0(8.5, 11.6) | 1.292 | 0.524 |
| 女性 [n(%)] | 204(78.2) | 15(71.4) | 6(75.0) | 0.850 | 0.696 |
| 家族史阳性# [n(%)] | 115(44.1) | 11(52.4) | 4(50.0) | 0.732 | 0.701 |
| 病程 [M(P 25, P 75), 月] | 3.0(1.0, 6.0) | 3.0(0.5, 6.0) | 3.3(0.3, 6.0) | 0.099 | 0.952 |
| ALT [M(P 25, P 75), U/L] | 27.0(19.3, 37.0) | 30.5(17.7, 43.3) | 30.5(25.5, 39.5) | 0.615 | 0.735 |
| FT3 [M(P 25, P 75), pmol/L] | 30.6(18.9, 47.0) | 27.6(21.9, 44.6) | 47.0(31.5, 47.0) | 3.943 | 0.139 |
| FT4 [M(P 25, P 75), pmol/L] | 42.3(34.3, 52.1) | 40.1(31.5, 50.7) | 42.6(37.6, 52.2) | 0.368 | 0.832 |
| TSH (×10-4) [M(P 25, P 75), μIU/mL] | 2.0(1.0, 10.0) | 3.0(2.0, 14.0) | 5.0(2.0, 7.0) | 1.292 | 0.524 |
| TRAb [M(P 25, P 75), IU/L] | 21.7(20.2, 23.3) | 22.9(18.2, 27.5) | 22.9(12.1, 33.6) | 0.205 | 0.903 |
| TPOAb 阳性 [n(%)] | 225(86.2) | 20(95.2) | 6(75.0) | 0.043 | 0.835 |
| TGAb 阳性 [n(%)] | 210(80.5) | 17(81.0) | 5(62.5) | 0.166 | 0.684 |
| MMI初始剂量 [M(P 25, P 75), mg/kg] | 0.63(0.56, 0.68) | 0.63(0.52, 0.69) | 0.64(0.49, 0.68) | 0.097 | 0.953 |
注:[ALT]丙氨酸氨基转移酶;[FT3]游离三碘甲状腺原氨酸;[FT4]血清游离甲状腺素;[TSH]促甲状腺激素;[TRAb]促甲状腺激素受体抗体;[TPOAb]甲状腺过氧化物酶抗体;[TGAb]抗甲状腺球蛋白抗体;[MMI]甲巯咪唑。#家族史所涉及的疾病包括甲状腺功能亢进症、甲状腺功能减低症、甲状腺癌。
2.3.2. 甲亢患儿MMI治疗前后胆红素的变化
MMI治疗前4例总胆红素、直接胆红素轻度升高(指标升高但未达到胆汁淤积标准),300例胆红素水平正常。300例胆红素水平正常的患儿中,MMI治疗后出现胆汁淤积3例。这3例均为女孩,年龄均大于10岁,出现时间分别为用药后1个月、4个月、7个月;另外,出现胆红素轻度升高22例。这25例患儿出现胆红素升高的时间多集中在MMI治疗3个月后(19/25,76%),最晚在治疗后66个月,予保肝药及利胆药后大部分患儿胆红素下降至正常水平(23例)。
3. 讨论
本研究观察了304例新诊断甲亢患儿应用MMI治疗相关不良反应发生情况,发现较常见的不良反应有粒细胞减少、皮疹、ALT升高、关节疼痛等,少见的有胆汁淤积、肌肉疼痛、粒细胞缺乏和血小板减少。一项754例的成年人大样本研究发现,84.5%的患者在开始ATD治疗后90 d内出现粒细胞减少症[18]。本研究中,大部分患儿粒细胞减少发生在3个月内(25/39,64%),其中14例(14/39,36%)出现在7 d内,但最晚可出现在用药后36个月,且可多次出现粒细胞减少情况,予升ANC的药物治疗后大部分患儿ANC可恢复到正常。粒细胞减少或缺乏是MMI的严重不良反应,如不早期发现及时处理,患者可能出现严重感染及甲状腺风暴,甚至死亡,必要时需进行血浆置换[19]。
值得注意的是,少数甲亢患儿(20/304,6.6%)在应用ATD前即出现粒细胞减少,可能与过量甲状腺激素的直接毒性作用及免疫调节有关[20]。本研究中,对于ANC明显降低者,先予升ANC的药物治疗,待ANC正常后再予MMI治疗,若单用升ANC的药物ANC难以恢复正常者,可加用MMI联合治疗;ANC轻度降低者,可同时给予偏小剂量的MMI和升ANC的药物治疗。因此,新诊断的甲亢患者在开始ATD治疗之前检查ANC水平是很必要的,否则ANC降低可能被错误地归因于ATD而影响治疗方案的选择。
MMI相关粒细胞缺乏的机制目前未完全明确,有研究提出了2种可能的机制[21]:免疫介导的过程和直接中毒。一般来说,由免疫介导的过程引起的粒细胞缺乏进展迅速,而直接中毒引起的粒细胞破坏通常是剂量和浓度依赖的,且在持续接触毒物(药物)几周后发生[22]。有研究显示在停药3周后出现了粒细胞缺乏症状,认为可能是由于早期的免疫相互作用导致的晚期破坏[23]。也有研究表明,NOX3基因变异可能与抗甲状腺药物诱导的粒细胞凋亡有关[24]。因此,无论治疗时间或剂量如何,甚至是停药与否,都需要对MMI相关粒细胞缺乏保持警惕。文献检索尚未发现MMI相关粒细胞减少与年龄、ANC的联系。本研究显示口服MMI后粒细胞减少的发生风险与ANC基线水平及年龄呈负性关联,因此,对年龄较小,治疗前ANC水平较低的患儿应更加注意复查ANC水平,以便及时干预。
其次,肝损伤也是MMI的严重不良反应。本研究中304例甲亢患儿口服MMI后有52例出现肝损伤,包括ALT升高29例及胆红素升高25例。幸运的是这些患儿多数仅为轻度ALT升高或胆红素升高,予保肝药及利胆药后大部分患儿ALT和胆红素可恢复正常。如遇药物治疗无法缓解的肝损伤,必要时可行血液滤过甚至是肝移植治疗[25]。
甲亢引起肝损伤的可能机制包括:肝脏耗氧量增加,引起肝细胞供氧相对不足,导致损伤或凋亡;胆汁淤积导致肝损伤;高浓度甲状腺素的直接毒性;胆固醇结石的形成造成机械性损伤[26]。有研究显示,单胺氧化酶抑制、活性氧产生、线粒体功能障碍和DNA破坏可能导致MMI诱导的肝毒性[27],或是呈剂量依赖关系[25]。另有研究表示携带HLA-C*03:02等位基因的个体发生MMI诱导的重型药物性肝损伤的风险增加[28]。
此外,本研究显示,皮疹也是MMI较常见的不良反应,常表现为风团样皮疹,伴瘙痒、皮肤划痕症阳性,轻者可自行消退,中重度皮疹予抗组胺类药物口服,绝大部分皮疹减轻至消退。2例皮疹仍未缓解者,停用MMI,改为PTU治疗,皮疹消退。国外有文献报道,1例儿童患者在口服MMI后出现类似婴儿炎症性皮肤病的侧化皮疹,停用MMI,并使用抗组胺药和皮质类固醇治疗后症状消失,改为PTU治疗没有任何不良反应[29]。
本研究有几个局限性需要强调。首先,本研究为回顾性病例对照研究,复查的患儿均为门诊系统随诊,真实用药剂量的使用及收集存在困难,未能研究产生不良反应时的药物的累积剂量,得出的MMI不良反应与剂量不相关的结果可能存在偏倚。其次,虽然近年来药物性肝损伤标准[5]已被广泛用于评估药物性肝损伤,但由于碱性磷酸酶不敏感,以及尚且存在的诸多争议,为了减少此类错误,本研究仍沿用国际上常用的RUCAM评分系统[15-16],将肝毒性结果限制在住院及门诊事件中,定义以ALT升高≥2倍为ALT升高有意义,需重视处理,而ALT升高<2倍可根据临床酌情决定下一步治疗措施。再者,本中心尚未开展MMI不良反应易感基因检测,未能探讨不良反应与基因型的相关关系。
综上所述,本研究显示,甲亢患儿用药后出现不良反应的概率不低,但经过对症处理后大部分均能恢复,且无重症出现,安全性较为可靠;而且年龄越小、用药前ANC越低,越有可能发生粒细胞减少,这对粒细胞减少的预防、诊断和治疗有一定指导作用。
利益冲突声明
所有作者均声明不存在利益冲突。
参 考 文 献
- 1. Caputo M, Pecere A, Sarro A, et al. Incidence and prevalence of hyperthyroidism: a population-based study in the Piedmont Region, Italy[J]. Endocrine, 2020, 69(1): 107-112. DOI: 10.1007/s12020-020-02222-7. [DOI] [PubMed] [Google Scholar]
- 2. Chiang YT, Ting WH, Huang CY, et al. Long-term outcomes of Graves disease in children treated with anti-thyroid drugs[J]. Pediatr Neonatol, 2020, 61(3): 311-317. DOI: 10.1016/j.pedneo.2019.12.009. [DOI] [PubMed] [Google Scholar]
- 3. 王婕, 苏颖, 顾艳红, 等. 儿童Graves病的治疗进展及抗甲状腺药物治疗的停药时机[J]. 中国妇幼保健, 2019, 34(19): 4588-4591. DOI: 10.7620/zgfybj.j.issn.1001-4411.2019.19.75. [DOI] [Google Scholar]
- 4. Lane LC, Wood CL, Cheetham T. Graves' disease: moving forwards[J]. Arch Dis Child, 2022. Epub ahead of print. DOI: 10.1136/archdischild-2022-323905. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Chalasani NP, Maddur H, Russo MW, et al. ACG clinical guideline: diagnosis and management of idiosyncratic drug-induced liver injury[J]. Am J Gastroenterol, 2021, 116(5): 878-898. DOI: 10.14309/ajg.0000000000001259. [DOI] [PubMed] [Google Scholar]
- 6. Watanabe N, Narimatsu H, Noh JY, et al. Antithyroid drug-induced hematopoietic damage: a retrospective cohort study of agranulocytosis and pancytopenia involving 50, 385 patients with Graves' disease[J]. J Clin Endocrinol Metab, 2012, 97(1): E49-E53. DOI: 10.1210/jc.2011-2221. [DOI] [PubMed] [Google Scholar]
- 7. Pecere A, Caputo M, Sarro A, et al. Methimazole treatment and risk of acute pancreatitis: a population-based cohort study[J]. J Clin Endocrinol Metab, 2020, 105(12): dgaa544. DOI: 10.1210/clinem/dgaa544. [DOI] [PubMed] [Google Scholar]
- 8. Beernaert L, Vanderhulst J. Antithyroid drug-induced lupus erythematosus and immunoglobulin a deficiency[J]. Am J Case Rep, 2020, 21: e927929. DOI: 10.12659/AJCR.927929. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. Sun L, Fang W, Yi D, et al. Analysis of the clinical characteristics of insulin autoimmune syndrome induced by methimazole[J]. J Clin Pharm Ther, 2021, 46(2): 470-475. DOI: 10.1111/jcpt.13307. [DOI] [PubMed] [Google Scholar]
- 10. Lane LC, Cheetham T. Graves' disease: developments in first-line antithyroid drugs in the young[J]. Expert Rev Endocrinol Metab, 2020, 15(2): 59-69. DOI: 10.1080/17446651.2020.1735359. [DOI] [PubMed] [Google Scholar]
- 11. 毛晓健, 马晓丹, 刘丽, 等. 甲巯咪唑治疗379例甲状腺功能亢进儿童的单中心临床研究[J]. 中华内分泌代谢杂志, 2016, 32(1): 6-10. DOI: 10.3760/cma.j.issn.1000-6699.2016.01.003. [DOI] [Google Scholar]
- 12. 黄占克, 李维丽. 甲巯咪唑联合左甲状腺素治疗小儿甲状腺功能亢进症的效果和安全性[J]. 中国实用医刊, 2021, 48(19): 91-94. DOI: 10.3760/cma.j.cn115689-20210530-01889. [DOI] [Google Scholar]
- 13. Mooij CF, Cheetham TD, Verburg FA, et al. 2022 European Thyroid Association guideline for the management of pediatric Graves' disease[J]. Eur Thyroid J, 2022, 11(1): e210073. DOI: 10.1530/ETJ-21-0073. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. 戴云鹏. 实用儿童血液病学[M]. 长春: 吉林科学技术出版社, 2019: 133-134. [Google Scholar]
- 15. 中华医学会消化病学分会肝胆疾病协作组 . 急性药物性肝损伤诊治建议(草案)[J]. 中华消化杂志, 2007, 27(11): 765-767. DOI: 10.3760/j.issn:0254-1432.2007.11.016. [DOI] [Google Scholar]
- 16. 葛均波, 徐永健, 王辰, 等. 内科学[M]. 9版. 北京: 人民卫生出版社, 2018: 401-404. [Google Scholar]
- 17. Fawaz R, Baumann U, Ekong U, et al. Guideline for the evaluation of cholestatic jaundice in infants: joint recommendations of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition and the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition[J]. J Pediatr Gastroenterol Nutr, 2017, 64(1): 154-168. DOI: 10.1097/MPG.0000000000001334. [DOI] [PubMed] [Google Scholar]
- 18. Kim H, Lee J, Ha J. A case of antithyroid drug-induced agranulocytosis from a second antithyroid drugs (ATD) administration in a relapsed Graves' disease patient who was tolerant to the first ATD treatment[J]. Clin Case Rep, 2018, 6(9): 1701-1703. DOI: 10.1002/ccr3.1644. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Nagarajan VD, Morales A, Pleasant L, et al. Sepsis and thyroid storm in a patient with methimazole-induced agranulocytosis[J]. BMJ Case Rep, 2020, 13(7): e235536. DOI: 10.1136/bcr-2020-235536. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. Scappaticcio L, Bellastella G, Maiorino MI, et al. Graves' hyperthyroidism-related pancytopenia: a case report with literature review[J]. Hormones (Athens), 2021, 20(1): 93-100. DOI: 10.1007/s42000-020-00227-5. [DOI] [PubMed] [Google Scholar]
- 21. Nakamura H, Miyauchi A, Miyawaki N, et al. Analysis of 754 cases of antithyroid drug-induced agranulocytosis over 30 years in Japan[J]. J Clin Endocrinol Metab, 2013, 98(12): 4776-4783. DOI: 10.1210/jc.2013-2569. [DOI] [PubMed] [Google Scholar]
- 22. Pisciotta AV. Immune and toxic mechanisms in drug-induced agranulocytosis[J]. Semin Hematol, 1973, 10(4): 279-310. [PubMed] [Google Scholar]
- 23. Üçler R, Atmaca M, Candar Ö, et al. Development of agranulocytosis after discontinuation of methimazole: an unusual case[J]. Case Rep Endocrinol, 2015, 2015: 974524. DOI: 10.1155/2015/974524. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24. Plantinga TS, Arts P, Knarren GH, et al. Rare NOX3 variants confer susceptibility to agranulocytosis during thyrostatic treatment of Graves' disease[J]. Clin Pharmacol Ther, 2017, 102(6): 1017-1024. DOI: 10.1002/cpt.733. [DOI] [PubMed] [Google Scholar]
- 25. Suzuki N, Noh JY, Hiruma M, et al. Analysis of antithyroid drug-induced severe liver injury in 18, 558 newly diagnosed patients with Graves' disease in Japan[J]. Thyroid, 2019, 29(10): 1390-1398. DOI: 10.1089/thy.2019.0045. [DOI] [PubMed] [Google Scholar]
- 26. 徐如意, 唐红, 白浪. 新发或未控制甲状腺功能亢进症导致肝损伤的诊断与治疗[J]. 中华肝脏病杂志, 2021, 29(10): 926-931. DOI: 10.3760/cma.j.cn501113-20210830-00439. [DOI] [PubMed] [Google Scholar]
- 27. Li X, Yang J, Jin S, et al. Mechanistic examination of methimazole-induced hepatotoxicity in patients with Grave's disease: a metabolomic approach[J]. Arch Toxicol, 2020, 94(1): 231-244. DOI: 10.1007/s00204-019-02618-z. [DOI] [PubMed] [Google Scholar]
- 28. Li X, Jin S, Fan Y, et al. Association of HLA-C*03: 02 with methimazole-induced liver injury in Graves' disease patients[J]. Biomed Pharmacother, 2019, 117: 109095. DOI: 10.1016/j.biopha.2019.109095. [DOI] [PubMed] [Google Scholar]
- 29. Arrigo T, Cutroneo PM, Vaccaro M, et al. Lateralized exanthem mimicking figurate inflammatory dermatosis of infancy after methimazole therapy[J]. Int J Immunopathol Pharmacol, 2016, 29(4): 707-711. DOI: 10.1177/0394632016652412. [DOI] [PMC free article] [PubMed] [Google Scholar]


