Abstract
En este artículo se examina la última evidencia disponible sobre las actividades preventivas en la persona mayor, incluyendo los trastornos de sueño, el ejercicio físico, la deprescripción, los trastornos cognitivos y las demencias, la nutrición, el aislamiento social y la fragilidad.
Palabras clave: Mayor, Prevención, Atención primaria
Abstract
This article examines the latest available evidence on preventive activities in the elderly, including sleep disorders, physical exercise, deprescription, cognitive disorders and dementias, nutrition, social isolation and frailty.
Keywords: Elderly, Prevention, Primary care
Introducción
En la presente actualización se ha revisado como tema nuevo los trastornos del sueño en el adulto mayor, y se ha vuelto a investigar sobre las recomendaciones en ejercicio físico, deprescripción, malnutrición, asilamiento social y fragilidad, además de deterioro cognitivo leve y demencia.
Prevención de los trastornos del sueño en el mayor
Las características del sueño se modifican en la persona mayor con respecto al adulto joven. Se reduce el tiempo total de sueño, la calidad del sueño REM y la eficiencia del sueño, y se incrementa levemente la latencia del sueño y más marcadamente el número de despertares. Se adelanta la hora del sueño y se producen más siestas diurnas. Sin embargo, la presencia de hipersomnia diurna no puede ser considerada como normal1.
Los cambios en el estilo de vida asociados al retiro laboral y al envejecimiento pueden colaborar a la aparición de insomnio y otros trastornos del sueño, así como la presencia y el deficiente control de enfermedades cardiovasculares o pulmonares, entre otras, y algunas medicaciones como los betabloqueantes2.
El control de estímulos que permite asociar el uso de la cama y del dormitorio solo con la actividad de dormir facilitan un mejor descanso, con consejos como emplear la cama y el dormitorio solo para dormir, levantarse de la cama si pasan más de 20 min sin dormir y regresar cuando tenga sueño y, sobre todo, mantener una hora constante para levantarse por las mañanas. Es interesante emplear terapia cognitiva como prevención del insomnio, evitando la aparición de pensamientos erróneos en espiral sobre ideas falsas y expectativas no realistas, tales como las consecuencias de dormir menos, o el deber de mantener horarios similares a personas en épocas más tempranas de la vida3.
Se debe indagar sobre las características del sueño de la persona mayor (horas de sueño, despertares, hora de ir a la cama y de despertar, somnolencia diurna…). Es relevante preguntar sobre la presencia de pausas de apnea, ronquidos, movimientos corporales y/o vocalizaciones durante el sueño, pues permitirán averiguar la posible presencia de causas de trastorno del sueño como la apnea obstructiva o parasomnias. Destaca el desorden de comportamiento relacionado con la fase REM, posible indicador precoz de enfermedades neurodegenerativas como Parkinson o demencia de cuerpos de Lewy. El uso de fármacos sedantes en el anciano tiene una efectividad limitada y discutida3.
Recomendaciones
-
•
Se debe indagar sobre los trastornos de sueño en la persona mayor, pero no intervenir en las variaciones normales asociadas a la edad
-
•
El uso de control de estímulos y la terapia cognitiva pueden prevenir la aparición de trastornos del sueño
-
•
El uso de fármacos sedantes tiene una eficacia limitada y controvertida
Ejercicio físico en relación con la prevención
El ejercicio físico es una medida preventiva, sobre todo asociada a otros factores de vida como la alimentación. En el mayor, previene la aparición de diversas enfermedades como la afección cardiovascular, diabetes u obesidad, reduciendo todas las causas de mortalidad y retrasando la aparición de fragilidad y dependencia funcional. Se asocia a un incremento en la calidad de vida. Todos estos beneficios se producen independientemente del estado funcional y del nivel de fragilidad del paciente. La OMS recomienda en los mayores de 65 años realizar al menos 150 min semanales de actividad aeróbica moderada o 75 min si es vigorosa, acompañado de al menos 2 días de actividad de fortalecimiento muscular (en movimientos explosivos/potencia o contra resistencia/fuerza) y de equilibrio. Todos estos ejercicios se pueden compaginar en la realización de ejercicio multicomponente (combina ejercicio aeróbico, anaeróbico, flexibilidad y equilibrio de forma estructurada). Las recomendaciones del último consenso internacional sobre ejercicio físico en mayores se muestran en la tabla 1 4.
Tabla 1.
Recomendaciones de los diferentes tipos de ejercicio físico en el mayor
| Tipo de ejercicio | Aeróbico | Equilibrio | Resistencia/fuerza | Resistencia/potencia |
|---|---|---|---|---|
| Frecuencia (por semana) | 3-7 días | 1-7 días | 2-3 días, con al menos un día de descanso | El mismo día que el ejercicio de fuerza |
| Volumen de ejercicio | 20-60 min por sesión | Combinación de 4 a 10 ejercicios, 1 o 2 series por sesión | 1-3 series de 8-12 repeticiones, sobretodo de grupos musculares mayores | Pocas repeticiones con sobrecarga en muy cortos periodos de tiempo |
| Ejemplos | Caminar, bailar, ciclismo, nadar… | Taichí, yoga, caminar en tándem o de puntillas… | Peso libre, extensiones de rodilla y codos, de forma progresiva | Peso libre (con elementos externos) |
La actividad física previene la aparición de dependencia funcional, y es tratamiento de la misma. Debe ser personalizada en función del estado funcional, nivel de dependencia y preferencias del individuo, incluyendo todos los componentes mostrados en la tabla 1. La actividad física se puede centrar en el perfeccionamiento de actividades diarias como levantarse de la silla. El ejercicio físico puede ser una herramienta para mitigar el aislamiento social5. Es preferible realizarla en grupo y con un profesional entrenado, pero la realización de ejercicio en el domicilio en casos de necesidad también ha demostrado mejorar la salud de las personas mayores6.
El ejercicio físico multicomponente es la principal intervención en la prevención y manejo del síndrome de fragilidad, como se comentará en el apartado correspondiente de este artículo.
Recomendaciones
-
•
Se debe indicar siempre la actividad física y el ejercicio en todas las personas mayores independientemente de su estado funcional, adaptado a las características funcionales y físicas y capacidad de cada persona
-
•
Se recomienda la combinación de ejercicio aeróbico, de equilibrio y de resistencia (fuerza y potencia), bien en diferentes etapas en la semana o como ejercicio multicomponente
-
•
El ejercicio multicomponente es la intervención principal para la prevención y tratamiento de la fragilidad
Prevención de la malnutrición en la persona mayor
Cada vez se hace más evidente la importancia de una buena alimentación en el envejecimiento saludable. La nutrición inadecuada favorece la progresión de muchas enfermedades, contribuye a la etiología compleja de la fragilidad y se asocia a aumento de mortalidad7.
La malnutrición por defecto o desnutrición es el resultado de la ingesta insuficiente de nutrientes para cubrir las necesidades fisiológicas. Se han descrito diversos factores de riesgo, como la edad avanzada, la pérdida del gusto y olfato, la polimedicación, los problemas económicos, el aislamiento social, el estreñimiento, los problemas dentales, las enfermedades neurodegenerativas, la depresión, la disfagia, las enfermedades crónicas y la sarcopenia, que convierten a la población anciana en un colectivo especialmente vulnerable para sufrir déficits nutricionales8, 9. La prevalencia de desnutrición aumenta con la edad, y varía según el ámbito de referencia, siendo más baja en los pacientes ambulatorios (6,9-7,8%), aumentando progresivamente en residencias geriátricas (20,8-28,4%), y en ancianos hospitalizados (24,6-40%)8, 10, 11. La desnutrición se asocia a mayores tasas de infección, aumento de caídas, aparición de úlceras, estancias hospitalarias más largas, fragilidad y aumento de la mortalidad7, 8, 10.
Por otro lado, la malnutrición por exceso (obesidad) y sus consecuencias sobre la salud, son un problema creciente que afecta al 18-30% de la población mayor de 65 años7. Diversos estudios han demostrado que un Índice de masa corporal (IMC) entre 25 y 29,9 kg/m2 se asocia a un mejor estado de salud7, 10. Sin embargo, la obesidad (IMC > 30 kg/m2), y especialmente la obesidad mórbida (IMC > 35 kg/m2), aumenta el riesgo cardiovascular, limita la movilidad, y se asocia a pérdida de masa muscular y fragilidad7, 9.
Diagnóstico de desnutrición
En la actualidad no existe una definición universal que sirva como referencia para diagnosticar la desnutrición. Con el fin de desarrollar un consenso mundial, representantes de diversas sociedades científicas formaron la Global Leadership Initiative on Malnutrition (GLIM), proponiendo los criterios que se describen en la tabla 2 9, 11, 12, 13. Constituyen una iniciativa de enorme valor para establecer una terminología común en todo el mundo para diagnosticar la desnutrición en diferentes entornos clínicos, pero deben validarse, y es preciso comprobar que permiten comparar resultados12.
Tabla 2.
Criterios GLIM para el diagnóstico de desnutrición
| Fase 1 Cribado del riesgo nutricional con una herramienta validada | |||
|---|---|---|---|
| Fase 2 Diagnóstico de malnutrición (al menos un criterio etiológico y uno fenotípico) | |||
| C. etiológicos | Ingesta alimentaria o absorción intestinal reducidas | Ingesta ≤ 50% del requerimiento energético Cualquier reducción de la ingesta durante más de 2 semanas Cualquier condición digestiva que afecte la asimilación de alimentos |
|
| Inflamación subyacente | Enfermedad aguda Enfermedad crónica |
||
| C. fenotípicos | Desnutrición moderada | Desnutrición severa | |
| Pérdida de peso no voluntaria | 5-10% en 6 meses 10-20% en más de 6 meses |
> 10% en 6 meses > 20% en más de 6 meses |
|
| IMC bajo | < 20 kg/m2 en < 70 años < 22 kg/m2 en ≥ 70 años |
< 18,5 kg/m2 en < 70 años < 20 kg/m2 en ≥ 70 años |
|
| Masa muscular reducidaa | Déficit leve/moderado | Déficit severo | |
GLIM: Global Leadership Initiative on Malnutrition; IMC: índice de masa corporal.
Según técnicas validadas de composición corporal (bioimpedancia, ecografía, tomografía computerizada o resonancia magnética) o mediciones antropométricas (circunferencia muscular del brazo, perímetro pantorrilla) o dinamometría.
Fuente: Ritchie y Yukawa9, López Mongil et al.11, León Sanz12 y Jensen et al.13.
Los criterios GLIM plantean realizar el diagnóstico de malnutrición en 2 pasos. El primero es identificar el estado de riesgo mediante el uso de cualquier herramienta de cribado validada. La herramienta de cribado más utilizada en nuestro entorno es el Mini-Nutritional Assessment Short Form (MNA-SF), que ha sido ampliamente validado y puede aplicarse en pacientes ambulatorios, hospitalizados o institucionalizados8, 9, 10, 11, 14.
Aunque diversas sociedades científicas aconsejan realizar el cribado de forma anual en población ambulatoria7, 10, otros autores aconsejan priorizar a los pacientes con sospecha clínica de desnutrición (pérdida de peso involuntaria, pérdida de músculos y grasa subcutánea, falta de apetito persistente, problemas con la ingesta, deglución, digestión o absorción de nutrientes), así como en presencia de enfermedad intercurrente prolongada15.
A los pacientes con cribado positivo se les deberá realizar una evaluación nutricional completa (historia clínica y dietética, examen físico, antropometría, valoración funcional, analítica) para poder establecer el diagnóstico y la clasificación de la gravedad de la desnutrición, y definir un plan de cuidados y tratamiento adecuado9, 10, 11, 15.
Diagnóstico de deshidratación
Todas las personas mayores deberían ser preguntadas por la ingesta de líquidos, especialmente si su situación clínica cambia inesperadamente o en caso de desnutrición. Los signos clínicos habituales (signo del pliegue, sequedad mucosas, color de la orina,…) no sirven para valorar la hidratación en ancianos. El diagnóstico de deshidratación se establece cuando la osmolalidad plasmática > 300 mOsm/kg. Ya que en Atención Primaria (AP) no disponemos de este dato, el cálculo de la osmolaridad plasmática > 295 mmol/l nos puede ser útil7.
Osmolaridad = 1,86 × (Na + K) + 1,15 × glucosa + urea + 14 (todo medido en mmol/l).
Intervención nutricional (tabla 3)
Tabla 3.
Resultados adversos asociados con la soledad y el aislamiento social
| Salud física | Salud mental | Uso de servicios de salud |
|---|---|---|
| Aumento de: • Mortalidad • Caídas • Enfermedades cardiovasculares • Enfermedades graves • Desnutrición • Deterioro funcional |
Aumento de depresión y demencia Disminución de la satisfacción con la vida Mayor abuso de ancianos |
Aumento de: • Visitas a servicios de urgencias • Visitas médicas • Reingresos hospitalarios • Ingresos en residencias y centros de larga estancia |
Fuente: Adaptado de Freedman y Nicolle20.
El objetivo de la intervención nutricional será mantener y/o mejorar el estado nutricional, la capacidad funcional y la calidad de vida. Las causas potenciales de malnutrición y deshidratación deben ser corregidas lo antes posible 7, 9.
La asistencia a la hora de comer, hacerlo en un entorno agradable, ofrecer «aperitivos» y respetar las preferencias del paciente pueden mejorar la ingesta. Las dietas restrictivas deben evitarse en lo posible7, 9.
La ingesta de líquidos será de 1,6-2 l/día. Habrá que aumentar la ingesta en verano, al realizar ejercicio físico, con fiebre, diarrea o vómitos. Debemos animarles a consumir cantidades adecuadas de líquidos (agua, leche, zumos, infusiones, café, sopa, batidos, etc.) respetando sus preferencias. En caso de insuficiencia cardiaca o renal, puede ser necesaria la restricción de líquidos7.
Con la edad, el gasto metabólico basal disminuye. En mayores sanos se aconseja la ingesta de 30 kcal/kg/día, aunque este valor debe ajustarse según sexo, estado nutricional, actividad física o presencia de enfermedad7. Para evitar la pérdida de masa magra, la ingesta de proteínas debe ser de 1-1,2 g/kg/día, e incluso cifras mayores en caso de enfermedad grave, úlceras o desnutrición7, 14. La ingesta insuficiente de energía aumenta los requerimientos de proteínas, así que es importante asegurar niveles adecuados de ambas7. En personas obesas, la dieta debe ser equilibrada y moderadamente hipocalórica, limitando la ingesta de grasas y azúcares añadidos, y asegurando la ingesta adecuada de proteínas7, 14, 16.
La mayoría de los nutrientes, si no todos, deben obtenerse de la alimentación oral. Las comidas enriquecidas (con huevo, aceite, nata, leche en polvo) pueden aumentar la energía y densidad proteica con pequeñas cantidades de alimento7, 9, 15. En pacientes con disnea, disfagia, o problemas de masticación, se ofrecerán alimentos enriquecidos con textura adaptada7, 9.
Si los cambios en la dieta no son suficientes para mejorar el estado de desnutrición, los suplementos nutricionales pueden obtener pequeños aumentos de peso y descenso de la mortalidad9. En pacientes hospitalizados, y especialmente tras una fractura de cadera, los suplementos han demostrado disminuir las complicaciones y los reingresos7. La indicación de suplementos debe mantenerse, al menos, durante un mes, y posteriormente debe evaluarse mensualmente para monitorizar beneficios y la duración del tratamiento7, 11.
No se aconseja el uso de fármacos estimulantes del apetito (megestrol, dronabinol, mirtazapina, análogos de la grelina) por su limitada eficacia y potenciales efectos secundarios9. Tampoco está indicado el uso de polivitamínicos de forma indiscriminada.
Las intervenciones nutricionales son más efectivas combinadas con ejercicio físico, consiguiendo mejorar la masa muscular y la capacidad funcional, especialmente en pacientes obesos7, 9, 14, 16.
Recomendaciones
-
•
La pérdida de peso involuntaria debe generar preocupación clínica, independientemente del IMC al inicio del estudio
-
•
En pacientes con sospecha clínica de desnutrición se recomienda revisar el estado nutricional mediante la escala MNA u otra herramienta de cribado
-
•
No es preciso hacer intervención nutricional si no hay malnutrición o riesgo
-
•
Se debe asegurar una ingesta proteica adecuada en población mayor
-
•
Se recomienda que las intervenciones nutricionales vayan acompañadas de ejercicio físico, especialmente en personas obesas
-
•
No se aconseja el uso de fármacos estimulantes del apetito ni de complejos vitamínicos de forma rutinaria
Prevención aislamiento social
El aislamiento social es uno de los problemas sociales más graves y comunes en las sociedades que envejecen. Según la definición de la Organización Mundial de la Salud, el aislamiento social se relaciona con «la falta de contacto con familiares, amigos u otras personas»17.
La soledad se define como «n sentimiento emocional, que puede ir acompañado o no de aislamiento social y solo puede evaluarse preguntando a las personas si se sienten solas». Si bien estos estados históricamente no se han distinguido bien, más recientemente se han identificado como distintos17, 18.
Se ha encontrado que la soledad tiene una débil correlación con el aislamiento social y que uno de ellos puede ocurrir sin el otro. Las personas pueden tener sentimientos de soledad a pesar de tener una participación social frecuente, mientras que otras personas sin interacciones sociales frecuentes pueden no sentirse solas. El aislamiento social y la soledad son conceptos separados con diferentes predictores y resultados17, 18.
El aislamiento social en poblaciones de mayor edad es un factor de riesgo de enfermedad cardiovascular, accidente cerebrovascular, demencia, depresión, trastornos del sueño, necesidad de atención a largo plazo y mortalidad17, 19. Algunas de sus consecuencias se aprecian en la tabla 3.
La edad aumenta la probabilidad de vivir en soledad. En España, se ha producido un aumento hogares unipersonales en personas de 65 y más años, siendo mayor la proporción entre las mujeres que entre los varones (2018: 31,0 frente al 17,8%). La forma de convivencia mayoritaria entre los varones de 65 y más años es la pareja sola (sin hijos ni otros convivientes). Entre las mujeres predominan las viudas a partir de los 75 años sobre el resto de estados civiles21.
Los estudios sobre los predictores y factores de riesgo del aislamiento social son muy limitados porque solo unos pocos estudios han tratado el aislamiento social como un resultado17.
El brote de COVID-19 y sus medidas de control de salud pública han aumentado la prevalencia del aislamiento social y la soledad entre las poblaciones de adultos mayores desde el comienzo de la pandemia, relacionada con la duración de esta, las medidas de control de salud pública y la gravedad de la pandemia19, 22.
Identificación de las personas en riesgo de aislamiento social
El aislamiento social habitualmente no es detectado en las consultas de AP, por lo que es de vital importancia aumentar la conciencia y el papel de los profesionales que están en primera línea, para fomentar la evaluación y la posterior implementación de intervenciones23.
Existen diferentes instrumentos para medir el aislamiento social. Destaca la escala de red social de Lubben (Lubben Social Network Scale). Dispone de una versión extensa de 18 preguntas y de una abreviada de 6 que puede ser muy útil para el ámbito clínico. Mide los 3 aspectos esenciales de la red social: el emocional, la tangibilidad y el tamaño. Es un cuestionario que ha demostrado su validez y cuenta con una versión en español que los autores han publicado en su web http://www.bc.edu/schools/gssw/lubben/translations.html
La escala de soledad de UCLA (UCLA loneliness scale) y la de Jong Gierveld (Jong Gierveld loneliness scale) son las más utilizadas en Europa, miden la soledad subjetiva emocional y relacional24, 25.
La escala de soledad de la Universidad de California y Los Ángeles (UCLA-LS) es la escala más utilizada para evaluar la soledad en la población general. Desarrollada por Russell et al. en 1978 con el objetivo de evaluar las dimensiones sociales y emocionales de la soledad. Se ha convertido en un cuestionario clínico y de investigación clave. La escala original constaba de 20 preguntas auto-informadas. Está validada en España24, 25. Varias versiones cortas del UCLA-LS, denominadas según el número de preguntas incluidas, que se desarrollaron para reducir la longitud del cuestionario y aumentar la tasa de respuesta en la práctica clínica y los estudios longitudinales. Una revisión sistemática ha evaluado la validez y confiabilidad concluyendo que hay evidencia alta de que las versiones cortas UCLA: 10, 7, 6 y 4, serían más útiles en investigación práctica clínica relacionadas con la soledad26.
Intervenciones
Se han estudiado diversas intervenciones dirigidas a reducir la soledad y el aislamiento social. Múltiples revisiones sistemáticas que evalúan estas intervenciones han llegado a conclusiones diferentes y a menudo contradictorias. Algunas revisiones sistemáticas han encontrado mejores resultados con intervenciones grupales que son educativas o sociales, o que combinan el ejercicio con una intervención de ocio o psicosocial. Otras demuestran una mayor evidencia para las intervenciones uno a uno (como videoconferencias, uso de Internet y terapia con animales). Hay que tener en cuenta la calidad metodológica deficiente de los estudios primarios20 (tabla 4).
Tabla 4.
Comparación de intervenciones para abordar el aislamiento social y la soledad
| Intervención | Ejemplos | Resultados relevantes |
|---|---|---|
| Facililitación social | Grupal: clubes sociales, programas diurnos. Individual: videoconferencia con la familia, videojuegos interactivos, salas de chat | Las intervenciones grupales más exitosas incluyen un enfoque educativo o psicosocial Tecnología estudiada principalmente a nivel individual tanto en la comunidad como en las instituciones |
| Terapias psicológicas | Terapia del humor, reducción del estrés basada en la atención plena, programas de mejora cognitiva, terapia grupal de reminiscencia | Dirigido por profesionales de la salud Difícil determinar el efecto del propio grupo vs. terapia |
| Basado en animales | Visitas de animales vivos, perros robóticos | Ambos probablemente efectivos La terapia asistida por animales es más efectiva en mayores que viven en su domicilio |
| Actividad física | Ejercicio, ejercicio más ocio, nutrición | Las intervenciones más exitosas son las que se administran más de una vez por semana y están supervisadas por un profesional sanitario |
| Seguro de salud y social | Identificación mayores en riesgo, seguimiento y rehabilitación geriátrica | Participación de los profesionales de la salud |
| Ocio y desarrollo de habilidades | Jardinería, artes, cocina, deportes, informática, música | La formación en Internet y el préstamo de material informático fueron efectivos para reducir la soledad Las actividades de ocio son más eficaces con ejercicio o apoyo social |
Fuente: Adaptado de Freedman y Nicolle20.
Las revisiones de la literatura coinciden en que las relaciones sociales, tanto en cantidad como en calidad, son un factor importante que contribuyen a reducir la morbilidad y la mortalidad. Las consecuencias de la soledad y el aislamiento varían con la posición social, dado que los mayores que tienen recursos económicos suficientes para vivir acompañados, sea con la familia o en una comunidad de jubilados, viajar, salir, realizar actividades y relacionarse, las consecuencias adversas de la soledad son menores23.
La soledad es menos común entre las personas que viven en vecindarios con mejores recursos, más seguros y físicamente accesibles. Un mayor compromiso social se ha asociado con una disminución de la discapacidad y una menor mortalidad. Las conexiones sociales mejoran la adherencia a los regímenes m,dicos y reducen el tiempo de hospitalización17, 20.
El enfoque centrado en el paciente es fundamental, al igual que el trabajo multidisciplinar y la coordinación entre los diferentes agentes que trabajan en el cuidado de la salud del mayor. El aislamiento social y la soledad podrían ser los nuevos «gigantes geriátricos»20.
Los profesionales de AP debemos detectar y captar al mayor que está en situación de aislamiento social, registrarlo como diagnóstico en su historia clínica. Esto nos permitirá proponer intervenciones que disminuyan el riesgo de que el hecho de «vivir solo» y «sentirse solo» representan para la calidad de vida.
Los objetivos serian: conservar autonomía, adecuación de la vivienda, fomentar las redes de apoyo sanitario y social, realizar programas de enriquecimiento y participación social y actividades que aumenten la amistad, la autoestima y el bienestar20, 26.
Aislamiento social en el contexto pandemia por COVID-19
Respecto al aislamiento social derivado de la pandemia por COVID-19 se esperaría que los adultos mayores con acceso a más recursos manejen mejor las restricciones y sean menos propensos a una mayor soledad. La soledad durante la pandemia está asociada con recursos materiales como ingresos bajos y mala salud física y mental19.
Existe evidencia que las nuevas tecnologías y las redes sociales reducen la soledad en mayores si se usan como un medio para mejorar las relaciones existentes y formar nuevas en lugar de reemplazar las previas. Sin embargo, las relaciones a distancia no brindan el mismo significado y valor que los contactos cara a cara o táctiles en todas las situaciones, por ejemplo, cuando una persona está emocionalmente angustiada19.
Respecto a las intervenciones de videollamadas para reducir el aislamiento social en los adultos mayores no hay evidencia de su efectividad. La evidencia con respecto a la efectividad para los resultados de los síntomas de depresión es incierta27.
Por otro lado, existe la brecha digital. A partir de los 55 años hay un descenso en los porcentajes de personas que utilizan Internet. Entre las personas de 65-74 años, los varones emplean el ordenador y acceden a Internet en mayor medida que las mujeres. En 2008, 7 mayores de cada 100 utilizaban Internet; en 2019, esta cifra alcanza los 64, aumentando el porcentaje de mujeres21.
Muchas intervenciones para reducir la soledad se basan en actividades grupales, que en el contexto de pandemia no se han podido organizar fácilmente o se han tenido que cancelar. Si bien mantener la distancia física no significa que sea imposible tener contactos sociales, existen barreras para crear condiciones seguras para las interacciones sociales inclusivas para todos. Por ejemplo, las personas físicamente frágiles pueden necesitar apoyo para reunirse al aire libre, y el uso de equipos de protección personal puede ser complicado para las personas con deficiencias cognitivas19.
Recomendaciones
-
•
Se recomienda realizar detección del aislamiento social en las consultas de AP y proponer intervenciones para disminuir los riesgos derivados
-
•
Aunque no hay suficiente evidencia sobre la efectividad de las intervenciones para mejorar el aislamiento social, las que parecen ser más efectivas son aquellas que ofrecen una actividad social y/o apoyo dentro de un formato grupal y en las que los individuos participan de manera activa
-
•
Se recomienda mantener relaciones sociales de calidad durante toda la vida para prevenir el aislamiento social
-
•
Se recomienda que las autoridades a nivel nacional, regional y local trabajen junto con las comunidades para evaluar el contexto social e implementar las intervenciones de acuerdo con las necesidades de los ciudadanos
Deprescripción en los mayores
Introducción
El progresivo aumento de la esperanza de vida ha originado un aumento de las comorbilidades y la polifarmacia. Esta suele definirse como el consumo de 5 o más medicamentos, de manera que uno de cada 3 mayores cumple este criterio en España1. La polifarmacia también puede definirse como el uso de más fármacos que los que están correctamente indicados, introduciendo el concepto de polifarmacia evitable, puesto que habrá fármacos difíciles de evitar acorde a las evidencias científicas28.
El tratamiento farmacológico en las personas mayores no está libre de efectos indeseables. La medicación debe aportar beneficios en relación a la morbimortalidad, calidad de vida y, sobre todo, funcionalidad, que es lo que más pierden los mayores. La polifarmacia supone un aumento de las interacciones farmacológicas, empeora la adherencia terapéutica, incrementa las reacciones adversas a medicamentos (RAM) y el uso de fármacos inapropiado28, aumentando el riesgo de ingreso hospitalario, caídas y mortalidad prematura28.
Según Le Coteur et al.29, la deprescripción es el cese de un tratamiento de larga duración bajo supervisión médica. Por extensión incluye otros términos, como la revisión sistemática de la medicación, que puede concluir con la disminución, cambio o retirada de dosis de un medicamento, así como lograr la mejor relación entre riesgo y beneficio de los fármacos en base a la mejor evidencia disponible.
Pocos son los ensayos clínicos que se realizan en los mayores, que además son más sensibles a los efectos adversos de los fármacos28. Hasta hace poco tiempo era difícil hallar evidencias científicas que avalaran la deprescripción. No obstante, la deprescripción es obligatoria al margen de la edad, la polifarmacia o las comorbilidades28, 30, cuando hay RAM moderadas o severas, interacciones relevantes, duplicidades de fármacos, indicación dudosa, falta de eficacia, en enfermedades terminales o en el final de la vida y si existe sobretratamiento farmacológico, frecuente en la hipertensión y la diabetes mellitus28.
Síntesis de la evidencia
Recientemente han empezado a aparecer estudios que avalan la deprescripción, en general bajo la perspectiva de la no inferioridad de resultados. A nivel general una revisión sistemática31 demostró que la deprescripción no modificaba significativamente la mortalidad en estudios randomizados (OR: 0,82; IC 95%: 0,61-1,11), aunque la disminuyó en estudios no randomizados (OR: 0,32; IC 95%: 0,17-0,60). La deprescripción no disminuyó el riesgo de una primera caída, pero sí de las siguientes, aunque otra revisión sistemática mostró que la revisión de la medicación redujo un 24% las caídas en mayores institucionalizados32. La mayor parte de revisiones sistemáticas no mostraron modificaciones en la calidad de vida, aunque una mostró mejoría medida mediante el Euro-Quol-5D32. A nivel específico, una revisión sistemática33 identificó 2 ensayos clínicos en los que la deprescripción de antihipertensivos no era inferior a la continuación del tratamiento en las cifras de presión arterial. Otra revisión sistemática mostró que la disminución del tratamiento hipoglucemiante no modificó los niveles de hemoglobina glicosilada significativamente, sin aumentar además caídas, hipoglucemias y hospitalizaciones34. La deprescripción de estatinas en pacientes frágiles de edades avanzadas (>74 años) tampoco modificó la mortalidad y aumentó la calidad de vida35. Otros estudios28 avalan la deprescripción de benzodiacepinas, hipnóticos–Z o antidepresivos tras 6 meses sin sintomatología depresiva, inhibidores de la bomba de protones si no están bien indicados, inhibidores de la acetilcolinesterasa y la memantina si no hay eficacia o en demencia avanzada, neurolépticos si no hay respuesta clínicamente significativa y/o efectos secundarios, y bifosfonatos tras 5 años de tratamiento, RAM graves y situaciones de corta esperanza de vida.
Proceso de la deprescripción
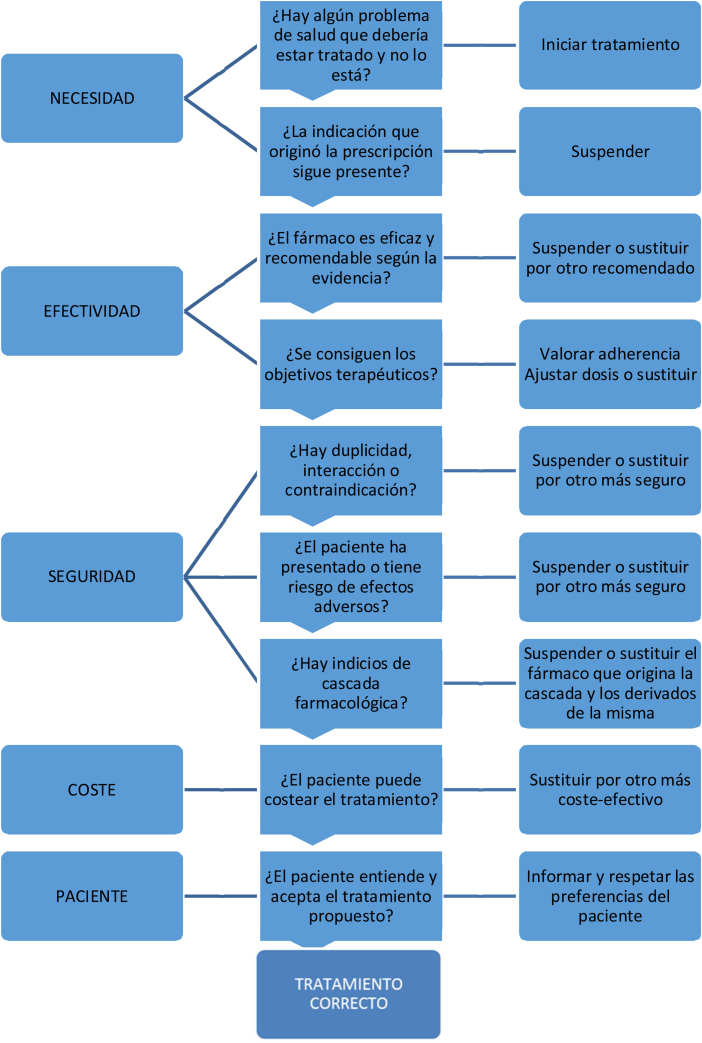
La deprescripción es una tarea compleja y debería realizarse sobre todo desde la AP, dado que el médico de familia, junto con enfermería, son los profesionales que mejor conocen a los pacientes28, 30. Se inicia revisando la lista de medicación con el paciente y/o cuidador, valorando las indicaciones, objetivos del tratamiento, riesgo de efectos secundarios, interacciones y los beneficios/perjuicios percibidos por el paciente28, 30. El algoritmo de la figura 1 puede ser de ayuda.
Figura 1.
Algoritmo de revisión de la medicación23.
Existen muchas herramientas para facilitar la deprescripción. Estas herramientas (tabla 5) siguen métodos implícitos (centrados en el paciente) o explícitos (centrados en la medicación) y sirven de guía, pero no sustituyen el criterio médico, las preferencias y las necesidades de cada paciente individual1. Los más utilizados son los criterios de Beers y los criterios de STOPP/START. Listados más específicos son los STOPP-Pal, orientados a pacientes con poca esperanza de vida, y LESS-CHRON, orientados a pacientes pluripatológicos28.
Tabla 5.
Herramientas de detección de la prescripción inadecuada
| Herramienta | Características |
|---|---|
| Criterios Beers | Creados en 1991, actualizados periódicamente (American Geriatric Society, 2019) y validados para > 65 años ambulatorios o institucionalizados (excepto en situación paliativa). Tiene 3 listados de fármacos: 30 a evitar siempre, 40 a evitar en determinadas situaciones y 6 a usar con precaución en > 75 años. Tiene un 20% de fármacos no comercializados en Europa y son los criterios más usados en España |
| Criterios STOPP/START (Screening Tool of Older Person's Prescriptions/Screening Tool to Alert doctors to Right Treatment) | Publicados en 2008, actualizados en 2015 por la European Union Geriatric Medicine Society y validado para atención primaria y hospitalaria. Los criterios STOPP contienen 87 prescripciones potencialmente inapropiadas en pacientes mayores. Los criterios START son 34 prescripciones que podrían beneficiar al paciente mayor en determinadas situaciones clínicas. Se estructuran por sistemas fisiológicos y serían la alternativa europea a los criterios de Beers |
| Criterios STOPP-Frail ó STOPP-Pal | Publicados en 2017 y desarrollados específicamente para pacientes frágiles con limitada esperanza de vida. Tiene 27 criterios ordenados por sistemas fisiológicos |
| Criterios List of Evidence baSed depreScribing from CHRONic patients (LESS-CHRON) | Elaborados en España en 2017 para pacientes con multimorbilidad. Consta de 27 criterios o situaciones clínicas susceptibles de deprescripción, indicando cuáles precisan monitorización y seguimiento una vez retirada la medicación |
| Criterios Improved Prescribing in the Elderly Tool (IPET) | Elaborados en el año 2000, es un listado de los 14 errores de prescripción más frecuentes en mayores de 70 años. Fácil de aplicar, su aceptación es limitada fuera de Canadá |
| Proyecto MARC | Promovido por el Ministerio de Sanidad, Servicios Sociales e Igualdad en 2014, es un listado de 14 grupos de medicamentos y 4 medicamentos específicos considerados como de alto riesgo |
| Listado Anticholinergic Risk Scale (ARS) | Elaborado en 2008, incluye 33 fármacos con efecto anticolinérgico, que se puntúan entre 1 (riesgo bajo) y 3 (riesgo alto) |
| Proyecto Assessing care of Vulnerable Elders (ACOVE) | Elaborado en 2001 en EE. UU. Consta de 217 indicadores de calidad basados en la mejor evidencia científica, destinados a pacientes geriátricos vulnerables. Solo el 29% se refieren a fármacos |
| Australian Prescribing Indicators Tool | Publicada en 2008, recoge 48 indicadores de determinadas condiciones médicas y escenarios clínicos. No está validada |
| Listado PRISCUS | Publicados en Alemania en 2010, consta de 83 medicamentos inapropiados en > 65 años |
| Recomendaciones Polypharmacy | Publicados en Escocia en 2012, actualizados en 2018. Tiene 49 recomendaciones y clasifica los fármacos en apropiados o no según la indicación para la que fueron prescritos, su eficacia o su seguridad |
| Anticholinergic Burden Calculator (ABC Calculator) | Desarrollada en 2017 en España, es una web gratuita que calcula la carga anticolinérgica en 9 escalas diferentes. Los resultados se muestran de forma cuantitativa, cualitativa, y mediante un código de colores en función del riesgo anticolinérgico |
| MedStopper | Página web para tomar decisiones en deprescripción. Se introducen los medicamentos que recibe el paciente y la herramienta secuencia las posibilidades de interrupción representado con caras. Incluye enlaces con calculadoras on-line de riesgo/beneficio y NNT |
| Deprescribing | Página que aborda la deprescripción según los riesgos asociados a diversos medicamentos en pacientes geriátricos (anticolinesterásicos y memantina, benzodiacepinas e hipnóticos-Z, antipsicóticos, hipoglucemiantes e inhibidores de la bomba de protones) |
| NICE Multimorbidity Guidance | Guía que aborda la optimización de la atención para adultos pluripatológicos al reducir la carga de tratamiento. Prioriza la toma de decisiones compartidas, valorando las prioridades de salud del paciente, estilo de vida y objetivos personales |
| NHS Polypharmacy Guidance | Publicada en Escocia en 2018, esta guía ofrece una estructura centrada en el paciente tanto para iniciar un tratamiento, como para revisar el existente. Incluye indicadores de polifarmacia, toxicidad acumulativa por anticolinérgicos y NNT |
| Método Medication Appropriateness Index (MAI) | Desarrollado en 1992 y validado para atención primaria y hospitalaria. Consta de 10 ítems, que puntúan de 1 a 3 según la adecuación terapéutica. Precisa bastante tiempo |
Fuente: Gorroñogoitia Iturbe et al.23.
El primer paso en la deprescripción es comprobar qué fármacos toma el paciente, si tiene problemas con alguna medicación, si es efectiva, si le cuesta tomarla, si la puede costear, o si le produce efectos secundarios. La toma de decisiones debe ser compartida, valorando los objetivos del tratamiento según la situación clínica, funcional y social del paciente, su expectativa de vida, y sus preferencias personales28.
El siguiente paso es identificar qué fármacos se pueden deprescribir. El objetivo de la deprescripción será revisar y suspender exclusivamente los fármacos inadecuados o innecesarios28, 30, ya que la retirada de medicamentos esenciales podría ser nociva para el paciente. Es importante establecer con el paciente una relación de confianza y utilizar un lenguaje apropiado, para que comprenda la información28. En pacientes con déficit cognitivo será necesaria una mayor participación de los cuidadores.
El tercer paso, es planear el orden en que se van a retirar los fármacos. Se recomienda hacerlo de uno en uno, aunque podrían ser dos o más simultáneamente en caso de reacciones adversas o prescripción en cascada. La deprescripción no es un proceso irreversible, hecho que tranquiliza a los pacientes y cuidadores. Algunos casos requerirán bajar la dosis progresivamente para evitar síntomas de retirada e identificar la dosis más baja eficaz, que minimizaría el riesgo de efectos adversos si no se puede retirar totalmente. Los pacientes y cuidadores serán advertidos de las posibles consecuencias de la retirada del fármaco, siendo preciso por ello un seguimiento estrecho, con un plan de visitas para monitorizar los cambios realizados, modificar el tratamiento y/o valorar nuevas prescripciones si fuese preciso28.
Recomendaciones
-
•
Se recomienda la revisión sistemática de la medicación en los mayores, puesto que ha demostrado disminuir los eventos adversos en salud
-
•
Se recomienda el uso de herramientas de ayuda a la deprescripción, como los criterios Beers 2019 o los STOPP-START, así como otras herramientas adaptadas al entorno español (LESS-CHRON) y a situaciones de terminalidad (STOPP-Pal)
-
•
La deprescripción debe de priorizarse en mayores polimedicados, con tratamientos excesivos para su situación clínica, frágiles, con enfermedades terminales y en el final de la vida
-
•
Es imprescindible contar con el paciente y los cuidadores, discutiendo riesgos y beneficios, y tomando las decisiones de forma conjunta
-
•
El seguimiento es fundamental para establecer si se puede interrumpir un fármaco totalmente, reducir la dosis, o si hay que restaurarlo
Prevención de fragilidad en la persona mayor
La fragilidad se define como el deterioro progresivo relacionado con la edad de los sistemas fisiológicos que provoca una disminución de las reservas de la capacidad intrínseca, lo que confiere una mayor vulnerabilidad a los factores de estrés y aumenta el riesgo de una serie de resultados sanitarios adversos36.
Está íntimamente relacionada con la pérdida de funcionalidad de las personas mayores a nivel individual y poblacional y es uno de los mejores predictores de eventos como hospitalización, caídas, discapacidad y muerte. Su prevalencia aumenta con la edad, aunque no es una consecuencia inevitable del proceso de envejecimiento, se trata de una entidad potencialmente reversible, especialmente en fases tempranas, de ahí la relevancia de su detección precoz e intervención, con el propósito de retrasar o evitar el deterioro funcional. La detección precoz e intervención sobre fragilidad se alinea con las principales estrategias y en el objetivo global de promover el envejecimiento activo sin discapacidad o dependencia37, siendo la AP el medio asistencial primordial en esta estrategia36, 37.
Referencias clave en nuestro medio para su desarrollo e implantación
-
•
Documento de consenso sobre prevención de la fragilidad en la persona mayor del Ministerio de Sanidad37
Inicialmente publicado y aprobado por el Consejo Interterritorial del Sistema Nacional de Salud (SNS) en 2014, implicaba el compromiso de todas las comunidades autónomas (CC. AA.) en su ejecución. Ha sido actualizado en mayo de 2022 y aprobado por la Comisión de Salud Pública. Selecciona a personas de 70 o más años sin alteración importante en actividades básicas de la vida diaria (ABVD, índice de Barthel ≥ 90 puntos, propone las pruebas de ejecución (preferiblemente la Short Physical Performance Battery [SPPB] o el test de velocidad de la marcha [VM]) como principales herramientas para la detección de fragilidad, seguido de una valoración posterior amplia a través de una valoración geriátrica integral (VGI) y aplicación de las intervenciones consecuentes.
La revisión incluye la novedad de recomendar la escala FRAIL cuando los pacientes no puedan acudir al centro de salud, no se puedan realizar las pruebas de ejecución o bien, en el caso de una estrategia de detección en otros espacios del ámbito comunitario. Durante la etapa de la pandemia por COVID-19 se elaboró un documento complementario a la estrategia, que hacía precisamente énfasis en esta detección comunitaria y empleo de medios telemáticos38.
-
•
Acción conjunta ADVANTAGE36
Marco común europeo en la gestión de la fragilidad, basado en el «Estado del Arte» y con un enfoque de carácter preventivo que promueva un envejecimiento saludable. Cada estado miembro elaboró su propia hoja de ruta de acciones para ello; la de España está disponible en https://advantageja.eu/images/FPA-Core-ADVANTAGE-doc.pdf
Principales herramientas para la detección precoz y diagnóstico de fragilidad36, 39, 40, 41, 42
Diagnóstico
Existen 2 modelos conceptuales de fragilidad en los cuales se basa, principalmente, el diagnóstico de este síndrome geriátrico:
-
–
El modelo físico o fenotipo de Fried, cuyo exponente es la escala de Fried que basa el diagnóstico en cinco criterios: pérdida de peso, debilidad muscular, baja energía, lentitud en la marcha y bajo nivel de actividad física. Su aplicación lleva unos 10 min, y tiene la limitación de requerir un dinamómetro.
-
–
El modelo acumulativo de déficits o multidimensional, que considera la alteración en diferentes dominios o áreas (física, enfermedades, signos o síntomas, hallazgos de laboratorio, funcional, mental y social), cuyo prototipo es el índice de fragilidad (FI) o su versión electrónica (eFI); basado en los ítems de la valoración geriátrica integral (VGI), es más complejo de obtener por lo que apenas se emplea en nuestro medio, bien por el tiempo que requiere, la calidad de registros en la historia electrónica o la falta de desarrollo de su versión electrónica.
La escala de rasgos de fragilidad —forma corta— 5 items (Frailty Trait Scale-Short Form [FTS]-5), desarrollada y validada en población española, se ha propuesto también como herramienta para el diagnóstico de fragilidad. Identifica siete dimensiones de la fragilidad: equilibrio energético-nutricional, actividad física, sistema nervioso, sistema vascular, resistencia y VM36, 37.
-
•
Detección precoz o cribado
La escala FRAIL43 comparte características de ambos modelos, el físico (pérdida de peso, cansancio, deambulación, marcha) y el multidimensional (tener más de 5 enfermedades). Numerosos estudios han validado su capacidad predictiva. La sencillez de su aplicación y el no requerir material complementario ni apenas instrucción, permitiría seleccionar posibles pacientes frágiles.
Las pruebas de ejecución son las más recomendadas y usadas para el cribado de fragilidad en nuestro ámbito. Valoran la capacidad y tiempo de realización por la persona de determinadas acciones de marcha, movilidad o equilibrio. Por lo tanto, se relacionan, fundamentalmente con el dominio físico de la fragilidad. La más completa y propuesta en primera estancia en el documento de consenso del Sistema Nacional de Salud (SNS) español es la SPPB (valora equilibrio en posición de pies juntos, en semitándem y en tándem, VM en 4 m, y levantarse y sentarse de una silla con los brazos cruzados) (fig. 2). Como alternativa propone la VM (tiempo que tarda en caminar 3, 4 o 6 m, o también, el test cronometrado de «levántese y ande» (Up and Go-U&G, tiempo que tarda en levantarse de la silla, caminar 3 m, y volver a sentarse de nuevo en la silla). Son rápidas y factibles de realizarse en la mayoría de las consultas de AP.
Figura 2.
Short Physical Performance Battery (SPPB) o test de Guralnik.
Otras escalas utilizadas en la detección de fragilidad son la escala clínica de fragilidad (Clinical Frailty Scale [CFS]), que describe gráficamente diferentes grados de fragilidad y discapacidad, de acuerdo a su nivel de vulnerabilidad, la escala PRISMA-7, y el instrumento Integrated Care for Older People (ICOPE) de la OMS que se desarrolló para cribar la pérdida de capacidad intrínseca a través de seis áreas: estado cognitivo, movilidad, malnutrición, alteración visual o auditiva, o depresión; se dispone de una versión electrónica de este último que facilita su aplicación43.
Los instrumentos de cribado identifican a aquellos en riesgo de fragilidad o que ya la han desarrollado; en su mayoría son herramientas sensibles, pero a menudo muestran una baja especificidad39.
No siempre existe un límite claro entre las pruebas de detección y las de diagnóstico, en la medida de lo posible se confirmará el diagnóstico de fragilidad en los casos detectados con las pruebas de cribado.
Intervenciones en fragilidad
El manejo tras el diagnóstico de fragilidad debiera hacerse, idealmente, en forma de una VGI, que se caracteriza por un enfoque multidimensional y centrado en la función. Permite establecer e individualizar intervenciones específicas en el marco de una valoración global.
La VGI no está extendida en la AP, además de su complejidad, la evidencia de su efectividad en este medio es menos clara. Una revisión sistemática que evalúa la efectividad de diferentes intervenciones en fragilidad en el ámbito comunitario encuentra que la VGI redujo la fragilidad en comparación al grupo control, en base principalmente a los resultados de un ensayo clínico en ≥ 75 años con multimorbilidad y 3 o más ingresos en el último año44. Una reciente revisión sistemática (RS) Cochrane concluye que la VGI en el anciano frágil o de riesgo en la comunidad, no tiene impacto en la mortalidad o institucionalización y, con una evidencia de calidad baja, que puede disminuir el riesgo de hospitalización no planificada45.
Por otro lado, se ha desarrollado alguna experiencia de VGI adaptada o rápida como, por ejemplo, la dirigida al manejo (identificación de posibles causas subyacentes y su tratamiento) de los cinco componentes de la escala FRAIL43, 46.
En esta línea, la herramienta VALINTAN www.valintan.com es una informatización de la VGI dirigida a la AP, orientada a la funcionalidad y fragilidad, que facilita su realización y se focaliza en intervenciones en base a diagnósticos geriátricos que a su vez se relacionan con la pérdida de función47. Experiencias, cuya efectividad ha de ser explorada
Tras la valoración, los aspectos clave de la intervención en fragilidad son: el ejercicio físico (programas de ejercicio multicomponente), evaluación y recomendaciones nutricionales y revisión de la medicación.
Varias RS de ensayos clínicos aleatorizados exploran el efecto del ejercicio y/o la nutrición en ancianos frágiles en la comunidad, una de ellas, citada anteriormente9, concluye que el ejercicio físico (predominantemente ejercicios de resistencia) solo o con educación nutricional puede reducir la fragilidad física. En otra48, con una calidad de evidencia moderada, las intervenciones en nutrición (incluida la suplementación proteica) o combinada con actividad física producen un pequeño pero significativo efecto en medidas de función física y movilidad. En la de Khor49, las intervenciones multifactoriales fueron más eficaces que la nutricional aislada, en mejorar el estatus de fragilidad y rendimiento físico.
El programa VIVIFRAIL (https://vivifrail.com/es/inicio/) es un ejemplo de programa de promoción de ejercicio físico multicomponente que se ha implantado en algunas CC. AA.
Otras intervenciones, aunque no específicas de fragilidad, incluyen: las dirigidas a la valoración y prevención del riesgo de caídas, manejo de la multimorbilidad y otros síndromes geriátricos.
Además, el abordaje de la fragilidad debe ser interdisciplinar, requiere la coordinación de los diferentes agentes implicados, sociales, comunitarios y niveles asistenciales sanitarios.
Recomendaciones
-
•
Se recomienda una detección activa oportunista de fragilidad en AP, en personas ≥ 70 años
-
•
En AP se recomiendan herramientas sencillas, validadas y aplicables en este medio asistencial
-
•
La detección se inicia con una preselección en base a la edad (≥ 70 años), sin alteración en las actividades básicas de la vida diaria (ABVD, índice de Barthel ≥ 90 puntos), seguido de pruebas de ejecución (Short Physical Performance Battery [SPPB] o la velocidad de la marcha [VM]) y valoración del riesgo de caídas
-
•
El manejo posterior de las personas frágiles se realiza a través de una valoración geriátrica integral (VGI), de la que se derivan las intervenciones específicas individualizadas a llevar a cabo. Herramientas como VALINTAN www.valintan.com facilitan la aplicación de la VGI en AP
-
•
Se recomienda la prescripción actividad o ejercicio físico, preferiblemente multicomponente, adaptado en intensidad y estructurado como intervención principal para prevenir y/o retrasar la pérdida funcional en la fragilidad
-
•
Ejemplo: programa VIVIFRAIL https://vivifrail.com/es/inicio/
-
•
Otras intervenciones recomendadas son: la intervención nutricional, revisión y adecuación de la medicación y el correcto manejo de situaciones clínicas coincidentes (multimorbilidad y otros síndromes geriátricos)
Prevención en deterioro cognitivo y demencia
Introducción
La demencia o trastorno neurocognitivo mayor (DSM 5) se define por una disminución significativa en uno o más dominios cognitivos (atención compleja, función ejecutiva, aprendizaje y memoria, lenguaje, función motora perceptiva y cognición social) que interfiere con la independencia de una persona en las actividades diarias50. En personas con deterioro cognitivo leve (DCL) el deterioro no es lo suficientemente grave como para interferir con el funcionamiento diario independiente, pero la tercera parte pueden progresar a demencia al cabo de 5 años50.
La prevalencia de demencia aumenta con la edad, del 3,2% en personas de 65 a 74 años al 29,3% de las de 85 años o más50. Con el aumento de la esperanza de vida, la prevalencia de demencia está aumentando en el mundo suponiendo una importante carga familiar y social51. Sin embargo, en países de ingresos altos, desde hace años la incidencia de demencia no está creciendo a la velocidad prevista, hecho que se ha atribuido a mejoras en educación, nutrición, estilos de vida, atención de salud y control de enfermedades crónicas52, 53.
Cribado de deterioro cognitivo y demencia
Dado que las terapias médicas actuales para la demencia no parecen afectar su curso a largo plazo, el beneficio potencial de la detección temprana puede estar en el diseño de intervenciones efectivas que puedan ayudar a los pacientes y cuidadores a prepararse para manejar los síntomas y las consecuencias de la demencia, así como facilitar la discusión sobre temas legales, financieros y de salud mientras el paciente aún conserva la capacidad de tomar decisiones50, 54.
El elevado porcentaje de demencias diagnosticadas tardíamente en el ámbito de la AP50, obliga a considerar diferentes situaciones en las que sería conveniente estar alerta:
Cribado en población general mayores de 65 años asintomática
Los beneficios potenciales de la detección temprana del DC no se han llegado a demostrar todavía en los ensayos clínicos54. Teniendo en cuenta lo anterior y la falta de tratamientos eficaces, en la actualidad no está indicado realizar cribados de DC con pruebas cognitivas en mayores de 65 años asintomáticos que viven en la comunidad y que no tengan síntomas ni signos de DC50, 54, 55 (fig. 1). Tampoco se recomienda realizar cribado en asintomáticos con antecedentes familiares de demencia o factores de riesgo cardiovascular (FRCV)55.
Cribado en situaciones especiales
En personas con alto riesgo de deterioro cognitivo (DC) (fig. 1) es razonable preguntar al paciente y/o familiares por la presencia de quejas de memoria y/u otro defecto cognitivo. En caso de resultar positivo, hay que proceder como cuando hay síntomas de alarma55.
Conducta ante sospecha de deterioro cognitivo55
La presencia de síntomas de alarma (fig. 1) obliga a realizar una evaluación amplia del paciente50, 55. Esta evaluación incluiría entrevista al paciente y a un familiar o cuidador preguntando de forma sistemática por la presencia de síntomas cognitivos o neuropsiquiátricos y comprobar si hay cambios en la capacidad funcional para actividades de la vida diaria.
Es conveniente objetivar el déficit mediante test o escalas cognitivas y funcionales validadas para la población de referencia55. El Mini-Mental State Examination (MMSE) y su versión normalizada de Lobo (Mini Examen Cognoscitivo [MEC]) es el test más conocido y usado, con alta sensibilidad y especificidad para diferenciar demencia de cognición normal, sobre todo en poblaciones de alta prevalencia de demencia (edad > 85 años)50, 56. Sin embargo, es menos adecuado para detectar DCL50, 54, 55, 56. Otros test validados en España y de uso libre como el Fototest o el test de alteración de la memoria (T@M) han demostrado tener gran capacidad discriminativa en la detección del DC en personas con sospecha de deterioro57.
La precisión diagnóstica mejora si junto con los test cognitivos al paciente se realizan cuestionarios a los cuidadores como el Informant Questionnaire on Cognitive Decline in the Elderly (IQCODE o test del informador), que ayuden a detectar alteraciones cognitivas y/o cambios funcionales del paciente55 o escalas que analicen alteraciones de comportamiento del paciente como el Inventario Neuropsiquiátrico (NPI-Q)55.
Los resultados de la entrevista y de las escalas ayudan a detectar/diferenciar entre quejas cognitivas, alteración conductual leve, DCL y/o demencia. Los síntomas neuropsiquiátricos refuerzan el diagnóstico de demencia o DCL. Si se presentan de forma aislada, sin DC o funcional, se puede hablar de alteración conductual (fig. 3).
Figura 3.
Esquema de actuación en la detección de deterioro cognitivo según escenario clínico.
Es importante resaltar que el diagnóstico de demencia no puede hacerse exclusivamente con el resultado de los test cognitivos o funcionales55.
Papel de las escalas en el seguimiento
Si tras la valoración se detecta DCL o alteración conductual leve, es recomendable un seguimiento clínico periódico (al menos anual)55 por el mayor riesgo de evolución a demencia respecto a población general. El resultado aislado de un test cognitivo como el MMSE, no permite predecir qué persona con DCL desarrollará demencia en un futuro55, 58. Es más útil realizar test cognitivos y funcionales de forma periódica y ver si cambian a lo largo del tiempo55, 58.
En caso de demencia, se recomienda un seguimiento periódico de paciente y cuidador en el que la utilización de escalas tiene el valor de permitir ver a lo largo del tiempo la respuesta cognitiva, funcional o de comportamiento del paciente, relacionadas con la propia evolución de la demencia y/o con el tratamiento. Los cuestionarios que detectan la sobrecarga del cuidador, como el test de Zarit ayudaran a ver el riesgo de institucionalización55.
Prevención
La prevención de la demencia es el objetivo a conseguir, al menos mientras no haya alternativas terapéuticas para el tratamiento. Es además una de las áreas de acción estratégicas del plan de acción mundial de la Organización Mundial de la Salud (OMS) para la demencia. Conseguir retrasar unos años el inicio de DC y demencia puede reducir la prevalencia y la carga humana y socioeconómica asociada a la enfermedad53.
Factores de riesgo y protección de deterioro cognitivo y demencia
La edad, el sexo y algunas alteraciones genéticas son factores de riesgo para la demencia no modificables50. Sin embargo, hay evidencia de que alrededor del 40% de las demencias puede atribuirse a una combinación de 12 factores de riesgo que pueden darse en diferentes etapas de la vida y que son potencialmente modificables: menor educación, contaminación del aire, tabaquismo, consumo excesivo de alcohol, obesidad, sedentarismo, hipertensión, diabetes mellitus, lesión cerebral traumática, discapacidad auditiva, depresión y aislamiento social52. El control de estos factores de riesgo podría tener un efecto protector50, en unos casos protegiendo contra el riesgo vascular, en otros aumentando la reserva cognitiva, entendiendo por tal la capacidad de preservar la cognición y funcionalidad durante más tiempo, a pesar de patología cerebral.
Dentro de los factores de riesgo de demencia no hay que olvidar el uso de fármacos con propiedades anticolinérgicas, incluso en adultos sanos cognitivamente, ya que tiene un efecto acumulativo en el tiempo («carga anticolinérgica») que puede provocar DC en el futuro59.
Intervenciones en prevención
Se estima que una intervención sobre los factores de riesgo modificables podría reducir o retrasar el desarrollo de demencia, sobre todo en los países de ingresos bajos y medios52. Para ello son necesarias intervenciones estatales y recomendaciones de salud pública que promuevan conductas saludables, referidas a educación, salud ambiental, hábitos de vida, prevención de accidentes, etc. Estas intervenciones son especialmente importantes en las poblaciones más vulnerables, donde son más frecuentes la agrupación de varios de estos factores de riesgo.
Muchos de los factores de riesgo de demencia se superponen con los factores de riesgo de accidente cerebrovascular y enfermedad cardiovascular60. Esto coloca a la AP, en un lugar privilegiado para realizar prevención de DC mediante el control adecuado de las enfermedades crónicas como la hipertensión52, la prevención de ictus y el consejo sanitario sobre hábitos saludables en nutrición, ejercicio, hábitos tóxicos, higiene del sueño o uso de audífonos, o la revisión de la medicación crónica (Tabla 6, Tabla 7).
Tabla 6.
Intervenciones farmacológicas que influyen en la progresión del deterioro cognitivo
| Anticolinesterásicos y/o memantina50, 54, 55 | Pueden mejorar levemente la cognición y/o la función en los pacientes con demencia leve-moderada y están indicados si son bien tolerados50 Cuando se plantee la deprescripción, tener en cuenta que no deben suspenderse en personas con síntomas psicóticos clínicamente significativos55 Se recomienda suspender los anticolinesterásicos en los casos no indicados (p. ej., demencia frontotemporal) y/o cuando ya no se espera ningún beneficio de ellos (p. ej., demencia terminal en ausencia de síntomas neuropsiquiátricos)55 En personas con DCL no se ha demostrado que mejoren la función cognitiva ni retrasen la progresión a demencia54, 55 |
| Antipsicóticos51 | Pueden empeorar el DC al tener un efecto sedante Indicados en pacientes con demencia con agitación o síntomas psicóticos graves. Usar solo en caso con riesgo para el paciente o la familia y/o en ausencia de respuesta a medidas no farmacológicas. Si fuesen necesarios, realizar una retirada planificada51 |
| Benzodiacepinas e hipnóticos | Evitar por su asociación con DC |
| Antidepresivos53 | La evidencia es actualmente insuficiente para recomendar el uso de medicamentos antidepresivos para reducir el riesgo de deterioro cognitivo o de demencia |
| Fármacos anticolinérgicos55, 59 | La «carga anticolinérgica» puede provocar deterioro cognitivo en el futuro59. Este efecto es mayor con dosis más altas, a mayor duración del tratamiento y según tipo de fármaco59 Evitar en adultos mayores y utilizar alternativas si estos fuesen necesarios (p. ej., depresión, incontinencia urinaria de urgencia, dolor neuropático)55 |
| Opioides51 | Pueden empeorar el DC. Valorar riesgo/beneficio e interrumpir en personas con DCL y demencia si no hay indicación clara, o se presentan efectos secundarios como estreñimiento, náuseas, caídas, sedación, o empeoramiento del DC51 |
| Anticoagulantes51 | En pacientes con fibrilación auricular, para prevención de ictus (1.° episodio o recurrencias), con o sin demencia asociada51 |
| AAS55, 60, 63 | No usar en mayores de 60 años para prevención primaria de ictus y/o demencia60, 63 No usar en caso de lesiones de sustancia blanca sin antecedente clínico de ictus o AIT55, 60 Indicación dudosa (pero razonable) en pacientes con DC vascular e imágenes de infartos cerebrales sin evidencia clínica previa de ictus55, 60 Indicados en antecedentes de ictus isquémico o infarto de miocardio previo60 |
| AINE54, 63 | No mejoran la cognición en personas con DCL y demencia54 |
| Estatinas54 | No mejoran la cognición en personas con DCL y demencia54 |
| Hormonas gonadales54 | Los estrógenos, progesterona o testosterona no mejoran la cognición en personas con DCL y demencia54 |
| Complementos nutricionales52, 54 | No se deben recomendar las vitaminas B y E, los ácidos grasos polinsaturados/omega ni los suplementos multicomplejos para mejorar el DC en personas con DCL o demencia sin carencias nutricionales |
AAS: ácido acetilsalicílico; AINE: antiinflamatorios no esteroideos; AIT: accidente isquémico transitorio; DC: deterioro cognitivo; DCL: deterioro cognitivo leve.
Tabla 7.
Intervenciones en Atención Primaria que pueden ayudar a prevenir y/o reducir la progresión del deterioro cognitivo
| Tensión arterial52, 55, 60 | Control de la TA desde la edad media, si es necesario con tratamiento antihipertensivo52 Vigilar la TA en personas con DC de posible etiología vascular55, 60 En adultos mayores, vigilar que no aparezcan signos de hipoperfusión cerebral (síncopes o caídas) con el tratamiento60 |
| Tabaco52 | Evitar el hábito de fumar y apoyar el abandono de tabaco en cualquier edad52 |
| Alcohol52 | Evitar el consumo excesivo de alcohol52 |
| Contaminación ambiental52 | Reducir la exposición a la contaminación del aire y del humo de tabaco ajeno52 |
| Estilo de vida52 | Intervenciones sobre el estilo de vida para reducir el sedentarismo, la obesidad, la diabetes o el insomnio52 |
| Ejercicio físico (para mejorar la cognición)52, 53, 55 | Mantener actividad física moderada-vigorosa en edad media52, 53 En adultos mayores, realizar actividad física de al menos intensidad moderada con ejercicio aeróbico y/o entrenamiento de resistencia55 y, probablemente, ejercicios de baile o taichí En personas con DCL, ejercicio aeróbico y probablemente, ejercicios de resistencia y taichí55 En personas con demencia, ejercicio individual o grupal, sin recomendaciones específicas sobre el tipo de ejercicio55 |
| Sueño55 | Utilizar CPAP en caso de apnea del sueño (SAHS)55 Intentar dormir más de 5 h55 Evitar el uso de hipnóticos o benzodiacepinas |
| Pérdida auditiva y visual52, 53, 55 | Protegerse de la exposición excesiva al ruido52 y evitar fármacos ototóxicos53, 55 Preguntar si hay «dificultad para oír en la vida cotidiana»55 Confirmar la pérdida auditiva con audiometría55 y valorar si es conveniente el uso de audífonos52, 55 Aunque no hay pruebas que respalden la asociación de discapacidad visual y DC, la correcci>n de la visión podría mejorar el funcionamiento cognitivo55 |
| Entrenamiento cognitivo52, 55 | Recomendar actividades en mediana edad (tocar música, viajes, salidas sociales, leer, hablar un 2.° idioma, trabajo exigente cognitivamente) ya que se asocian a mejor cognición en la vejez52 Participar en actividades cognitivamente estimulantes, voluntariado y aprendizaje permanente55 |
| Lesiones cerebrales52 | Intentar prevenir accidentes con lesiones craneales (transporte, entorno laboral, deportes de riesgo)52 |
| Educación y compromiso social52, 55 | Proporcionar educación primaria y secundaria a todos los niños52, 55 Estrategias de reducción de la pobreza y de aumento de participación social55 Apoyar la inclusión social durante todo el ciclo de la vida |
| Nutrición55 | Recomendar la dieta mediterránea, con alto contenido en fruta y verduras, ácidos grasos mono y poliinsaturados y bajo consumo de ácidos grasos saturados55 |
Intervenciones en pacientes con deterioro cognitivo leve y demencia
El objetivo de las intervenciones sobre DCL y demencia debe ser el bienestar de los pacientes y sus familias52.
Las personas con DCL o demencia pueden tener más dificultad para expresar sus dolencias lo que puede provocar menos acceso a la atención médica. Sin embargo, es importante intentar realizar seguimiento médico sistemático de las comorbilidades asociadas y de los problemas derivados de la demencia, ya que puede disminuir carga de enfermedad y deterioro funcional y reducir los ingresos hospitalarios que favorecen el delirio, empeoran el DC y aumentan el gasto sanitario51, 52.
En pacientes con demencia leve-moderada el control de los factores de riesgo cardiovascular (tratamiento HTA, hipercolesterolemia, diabetes mellitus) y de la fibrilación auricular, puede evitar patología cerebrovascular que empeore el curso de la demencia51 (tabla 6). En pacientes con demencia avanzada y expectativa de vida corta, o en caso de caídas frecuentes o mala adherencia al tratamiento, será preciso individualizar ya que en estos casos no está claro si los beneficios superan los riesgos (hemorragia cerebral con anticoagulantes, mareos o caídas con antihipertensivos)51.
La polifarmacia con sus posibles interacciones puede contribuir al DC. Es preciso racionalizar el uso de fármacos55 y valorar periódicamente riesgo/beneficio de cada intervención51 con especial cuidado en los fármacos que más afectan a la cognición (opioides, neurolépticos, fármacos con actividad anticolinérgica)54.
Las intervenciones multicomponente específicas para intentar prevenir y manejar los síntomas neuropsiquiátricos pueden evitar un uso abusivo de fármacos psicotrópicos, con poca eficacia y efectos adversos a veces graves52.
Los trabajos publicados sobre intervenciones para reducir el riesgo de DC y demencia no tienen resultados alentadores61, 62. No suele haber ensayos a largo plazo, las intervenciones son muy heterogéneas y el desarrollo de la enfermedad es lento, lo que dificulta obtener resultados y/o interpretarlos. Sin embargo, los numerosos estudios observacionales a largo plazo sobre factores de riesgo y demencia apoyan la intervención sobre los mismos, empezando de forma temprana y continuando toda la vida.
Recomendaciones
Se recomienda
-
•
Realizar estudio ante síntomas de alarma, como fallos cognitivos o pérdida de autonomía funcional, referidos por el paciente, la familia o los profesionales sanitarios
-
•
Vigilar a pacientes con mayor riesgo de DC o demencia (pacientes frágiles o de edad muy avanzada, enfermedad de Parkinson, antecedentes de ictus, síntomas depresivos, sobre todo si aparecen en edades tardías)
-
•
Seguir de forma periódica las personas con DCL o con síntomas neuropsiquiátricos por su elevado riesgo de desarrollo de demencia
-
•
Realizar un diagnóstico temprano de la demencia para poder planificar los cuidados, evitar riesgos y permitir al paciente y a la familia tomar decisiones sobre su futuro
-
•
Fomentar (a nivel personal y como estrategia de prevención en salud pública) la actividad física y la alimentación saludable, la prevención de factores de riesgo cardiovascular, en especial dejar de fumar, reducir el consumo de alcohol, mantener peso adecuado, controlar la hipertensión arterial en edades medias, realizar un control adecuado de enfermedades crónicas; así como aconsejar sobre prevención de exposición a ruido y uso de audífonos y potenciar actividades sociales que eviten el aislamiento social
-
•
Evitar en lo posible medicación anticolinérgica por su efecto acumulativo a largo plazo
-
•
En personas con demencia leve y moderada, mantener las medidas de control de FRCV y de prevención del ictus, y cuidado especial con la medicación que pueda empeorar el DC
No se recomienda
-
•
La realización de pruebas cognitivas en mayores de 65 años asintomáticos que viven en la comunidad
-
•
Utilizar fármacos (inhibidores de la acetilcolinesterasa, estatinas, antiinflamatorios no esteroideos [AINE], Ginkgo biloba, ácidos grasos) ni suplementos vitamínicos (B o C), para prevenir el DC y/o su progresión a demencia
-
•
El uso de neurolépticos para tratar los síntomas neuropsiquiátricos de las personas con demencia, salvo en situaciones de riesgo para el paciente o la familia
Financiación
Los autores declaran no haber recibido ningún tipo de financiación. Este estudio no implica investigación con personas o animales.
Conflicto de intereses
Los autores declaran no presentar ningún conflicto de intereses relevantes en relación al manuscrito.
Bibliografía
- 1.Feinsilver S.H. Normal and Abnormal Sleep in the Elderly. Clin Geriatr Med. 2021;37:377–386. doi: 10.1016/j.cger.2021.04.001. [DOI] [PubMed] [Google Scholar]
- 2.Tatineny P., Shafi F., Gohar A., Bhat A. Sleep in the Elderly. Mo Med. 2020;117:490–495. [PMC free article] [PubMed] [Google Scholar]
- 3.Ebben M.R., Kapella M.C. Insomnia. Am J Respir Crit Care Med. 2014;190 doi: 10.1164/rccm.19012P9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Izquierdo M., Merchant R.A., Morley J.E., Anker S.D., Aprahamian I., Arai H., et al. International Exercise Recommendations in Older Adults (ICFSR): Expert Consensus Guidelines. J Nutr Health Aging. 2021;25:824–853. doi: 10.1007/s12603-021-1665-8. [DOI] [PubMed] [Google Scholar]
- 5.Levinger P., Hill K.D. Are the Recommended Physical Activity Guidelines Practical and Realistic for Older People With Complex Medical Issues? J Geriatr Phys Ther. 2021;44:2–8. doi: 10.1519/JPT.0000000000000291. [DOI] [PubMed] [Google Scholar]
- 6.Chaabene H., Prieske O., Herz M., Moran J., Höhne J., Kliegl R., et al. Home-based exercise programmes improve physical fitness of healthy older adults: A PRISMA-compliant systematic review and meta-analysis with relevance for COVID-19. Ageing Res Rev. 2021;67:101265. doi: 10.1016/j.arr.2021.101265. [DOI] [PubMed] [Google Scholar]
- 7.Volkert D., Beck A.M., Cederholm T., Cruz-Jentoft A., Hooper L., Kiesswetter E., et al. ESPEN practical guideline: Clinical nutrition and hydration in geriatrics. Clin Nutr. 2022;41:958–989. doi: 10.1016/j.clnu.2022.01.024. [DOI] [PubMed] [Google Scholar]
- 8.Milá Villaroel R., Formiga F., Duran alert P., Abellana Sangrà R. Prevalencia de malnutrición en la población anciana española: una revisión sistemática. Med Clin (Barc) 2012;139:502–508. doi: 10.1016/j.medcli.2012.04.008. [DOI] [PubMed] [Google Scholar]
- 9.Ritchie C, Yukawa M. Geriatric nutrition: nutritional issues in older adults. En: Schmader KE, Seres D (Ed). UpToDate, 2021. Disponible en: https://www.uptodate.com/contents/geriatric-nutrition-nutritional-issues-in-older-adults
- 10.Camina-Martín M.A., de Mateo-Silleras B., Malafarina V., Lopez-Mongil R., Niño-Martín V., López-Trigo J.A., et al. Valoración del estado nutricional en Geriatría: declaración de consenso del grupo de nutrición de la Sociedad Española de Geriatría y Gerontología. Rev Esp Geriatr Gerontol. 2016;51:52–57. doi: 10.1016/j.regg.2015.07.007. [DOI] [PubMed] [Google Scholar]
- 11.López Mongil R., López Trigo J., Hernández Ruiz A., Niño Martín V. Hacia la desnutrición cero en residencias de ancianos y centros de día. Alianza masnutridos. 2018 Disponible en: https://www.alianzamasnutridos.es/cuadernos/ [Google Scholar]
- 12.León Sanz M. Revisión crítica de los criterios GLIM. Nutr Hosp. 2021;(Extra 1):29–33. doi: 10.20960/nh.03558. 38. [DOI] [PubMed] [Google Scholar]
- 13.Jensen G.L., Cederholm T., Correia M.I.T.D., Gonzalez M.C., Fukushima R., Higashiguchi T., et al. GLIM Criteria for the Diagnosis of Malnutrition: A consensus report from the Global Clinical Nutrition Community. JPEN J Parenter Enteral Nutr. 2019;43:32–40. doi: 10.1002/jpen.1440. [DOI] [PubMed] [Google Scholar]
- 14.Gabrovec B., Veninšek G., Samaniego L.L., Carriazo A.M., Antoniadou E., Jelenc M., et al. The role of nutrition in ageing: A narrative review fron the perspective of the European Joint Action on Frailty-ADVANTAGE JA. Eur J Intern Med. 2018;56:26–32. doi: 10.1016/j.ejim.2018.07.021. [DOI] [PubMed] [Google Scholar]
- 15.Torres M.L., López M., Megía C., Álvarez J., de la Cuerda C., León M., Burgos R. Hacia la desnutrición cero en la comunidad. Alianza masnutridos. 2018 [consultado May 2022]. Disponible en: https://www.alianzamasnutridos.es/cuadernos/ [Google Scholar]
- 16.Curilem Gatica C., Bahamondes Ávila C., Bruneau-Chávez J., Berral de la Rosa F.J. Effect of Nutritional Intervention and Exercise Patterns on the Funcionality of Obese Elderly People: A review. Univ Med. 2021;62:1–11. [Google Scholar]
- 17.Ejiri M., Kawai H., Ishii K., Oka K., Obuchi S. Predictors of older adults’ objectively measured social isolation: A systematic review of observational studies. Arch Gerontol Geriatr. 2021;94 doi: 10.1016/j.archger.2021.104357. [DOI] [PubMed] [Google Scholar]
- 18.Su Y., Rao W., Li M., Caron G., D’Arcy C., Meng X. Prevalence of loneliness and social isolation among older adults during the COVID-19 pandemic: A systematic review and meta-analysis. Int Psychogeriatr. 2022:1–13. doi: 10.1017/S104161022200019. [DOI] [PubMed] [Google Scholar]
- 19.Hwang T.J., Rabheru K., Peisah C., Reichman W., Ikeda M. Soledad y aislamiento social durante la pandemia de COVID-19. Psicogeriatr Int. 2020;32:1217–1220. doi: 10.1017/S1041610220000988. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Freedman A., Nicolle J. Social isolation and loneliness: The new geriatric giants: Approach for primary care. Can Fam Physician. 2020;66:176–182. [PMC free article] [PubMed] [Google Scholar]
- 21.Pérez Díaz J, Abellán García A, Aceituno Nieto P, Ramiro Fariñas D. (2020). Un perfil de las personas mayores en España, 2020. Indicadores estadísticos básicos. Madrid, Informes Envejecimiento en red n.° 25, 39p [consultado 12 Mar 2020] Disponible en: http://envejecimiento.csic.es/documentos/documentos/enred-indicadoresbasicos2020.pdf
- 22.Dahlberg L. Loneliness during the COVID-19 pandemic. Aging Ment Health. 2021;25:1161–1164. doi: 10.1080/13607863.2021.1875195. [DOI] [PubMed] [Google Scholar]
- 23.Gorroñogoitia Iturbe A., López-Torres Hidalgo J., Martin Lesende I., Herreros Herreros Y., Acosta Benito M.A., de Hoyos Alonso M., et al. PAPPS GdT Major 2020 Update [Article in Spanish] Aten Primaria. 2020;52(Suppl 2):114–124. doi: 10.1016/j.aprim.2020.09.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Alsubheen S.A., Oliveira A., Habash R., Goldstein R., Brooks D. Systematic review of psychometric properties and cross-cultural adaptation of the University of California and Los Angeles loneliness scale in adults. Curr Psychol. 2021 doi: 10.1007/s12144-021-02494-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Velarde-Mayol C., Fragua-Gil S., Garc-a-de-Cecilia J.M. Validation of the UCLA loneliness scale in an elderly population that live alone [Article in Spanish] Semergen. 2016;42:177–183. doi: 10.1016/j.semerg.2015.05.017. [DOI] [PubMed] [Google Scholar]
- 26.Das A., Padala K.P., Crawford C.G., Teo A., Mendez D.M., Phillips O.A., et al. A systematic review of loneliness and social isolation scales used in epidemics and pandemics. Psychiatry Res. 2021;306 doi: 10.1016/j.psychres.2021.114217. 114217. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Noone C., McSharry J., Smalle M., Burns A., Dwan K., Devane D., et al. Video calls for reducing social isolation and loneliness in older people: A rapid review. Cochrane Database Syst Rev. 2020 doi: 10.1002/14651858.CD013632. CD013632. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.García Pliego R.A., Baena Diez J.M., Herreros Herreros Y., Acosta Benito M.A. Deprescripción en las personas mayores: es el momento de pasar a la acción. Aten Primaria. 2022;54:102367. doi: 10.1016/j.aprim.2022.102367. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Le Coteur D., Banks E., Gnjidic D., McCachlan A. Deprescribing. Aust Prescr. 2011;34:182–185. doi: 10.18773/austprescr.2011.095. [DOI] [Google Scholar]
- 30.Esteban Jiménez O., Arroyo Aniés M.P., Vicens Caldentey C., González Rubio F., Hernández Rodríguez M.A., Sempere Manuel M. Deprescribiendo para mejorar la salud de las personas o cuando deprescribir puede ser la mejor medicina. Aten Primaria. 2018;(Suppl 2):S70–S79. doi: 10.1016/j.aprim.2018.09.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Page A.T., Clifford R.M., Potter K., Schwartz D., Etherton-Beer C.D. The feasibility and effect of deprescribing in older adults on mortality and health: Asystematic review and meta-analysis. Br J Clin Pharmacol. 2016;82:583–623. doi: 10.1111/bcp.12975. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Liacos M., Page A.M., Etherton-Beer T. Deprescribing in older people. Aust Prescr. 2020;43:114–120. doi: 10.18773/austprescr.2020.033. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Crisafulli S., Luxi N., Coppini R., Capuano A., Scavone C., Zinzi A., et al. Anti-hypertensive drugs deprescribing: An updated systematic review of clinical trials. BMC Fam Pract. 2021;22:208. doi: 10.1186/s12875-021-01557-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Seidu S., Kunutsor S.K., Topsever P., Hambling C.E., Cos F.X., Khunti K. Deintensification in older patients with type 2 diabetes: A systematic review of approaches, rates and outcomes. Diabetes Obes Metab. 2019;21:1668–1679. doi: 10.1111/dom.13724. [DOI] [PubMed] [Google Scholar]
- 35.Kutner J.S., Blatchford P.J., Taylor D.H., Jr., Ritchie C.S., Bull J.H., Fairclough D.L., et al. Safety and benefit of discontinuing statin therapy in the setting of advanced, life-limiting illness: A randomized clinical trial. JAMA Intern Med. 2015;175:691–700. doi: 10.1001/jamainternmed.2015.0289. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.ADVANTAGE Joint Action (JA). Promoting Healthy Ageing through a frailty prevention approach. 2019 [consultado 7 Jun 2022] Disponible en: http://www.advantageja.eu/index.php/es/index.php?option = com_content&view = article&layout = edit&id = 343%22
- 37.Ministerio de Sanidad. Actualización del documento de consenso sobre prevención de la fragilidad en la persona mayor 2022. Madrid; 2022 [consultado 7 Jun 2022] Disponible en: https://www.sanidad.gob.es/profesionales/saludPublica/prevPromocion/Estrategia/EnvejecimientoSaludable_Fragilidad/Fragilidadycaidas.htm
- 38.Ministerio de Sanidad. Recomendaciones para abordaje de la fragilidad en situación de crisis sanitaria generada por la COVID-19. 2021 [consultado 7 Jun 2022] Disponible en: https://www.sanidad.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov/documentos/COVID19_Fragilidad.pdf
- 39.Martín-Lesende I, Gorroñogoitia A, Abizanda P, Justo S. Persona mayor frágil: detección y manejo en atención primaria - Guía Fisterra. 2020 [consultado 7 Jun 2022] Disponible en: https://www.fisterra.com/guias-clinicas/persona-mayor-fragil-deteccion-manejo-atencion-primaria/
- 40.Oviedo-Briones M., Laso ÁR, Carnicero J.A., Cesari M., Grodzicki T., Gryglewska B., et al. A Comparison of Frailty Assessment Instruments in Different Clinical and Social Care Settings: The Frail tools Project. J Am Med Dir Assoc. 2021;22:607. doi: 10.1016/j.jamda.2020.09.024. e7-607.e12. [DOI] [PubMed] [Google Scholar]
- 41.Op Het Veld L.P.M., Beurskens A.J.H.M., de Vet H.C.W., van Kuijk S.M.J., Hajema K., Kempen G.I.J.M., et al. The ability of four frailty screening instruments to predict mortality, hospitalization and dependency in (instrumental) activities of daily living. Eur J Ageing. 2019;16:384–387. doi: 10.1007/s10433-019-00502-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Sukkriang N., Punsawad C. Comparison of geriatric assessment tools for frailty among community elderly. Heliyon. 2020;6:e04797. doi: 10.1016/j.heliyon.2020.e04797. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Ruiz J.G., Dent E., Morley J.E., Merchant R.A., Beilby J., Beard J., et al. Screening for and Managing the Person with Frailty in Primary Care: ICFSR Consensus Guidelines. J Nutr Health Aging. 2020;24:920–927. doi: 10.1007/s12603-020-1492-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Macdonald S.H., Travers J., Shé ÉN, Bailey J., Romero-Ortuno R., Keyes M., et al. Primary care interventions to address physical frailty among community-dwelling adults aged 60 years or older: A meta-analysis. PLoS One. 2020;15:e0228821. doi: 10.1371/journal.pone.0228821. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Briggs R., McDonough A., Ellis G., Bennett K., O’Neill D., Robinson D. Comprehensive Geriatric Assessment for community-dwelling, high-risk, frail, older people. Cochrane Database Syst Rev. 2022;5 doi: 10.1002/14651858.CD012705.pub2. CD012705. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Dent E., Morley J.E., Cruz-Jentoft A.J., Woodhouse L., Rodríguez-Mañas L., Fried L.P., et al. Physical Frailty: ICFSR International Clinical Practice Guidelines for Identification and Management. J Nutr Health Aging. 2019;23:771–787. doi: 10.1007/s12603-019-1273-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Martin-Lesende I., Mendibil L.I., Berrizbeitia A., Aguirre N., Llamosas I., Merino I. Comparación/coincidencia en diagnósticos e intervenciones entre la valoración geriátrica integral VALINTAN y la estándar realizada por geriatras. Estudio piloto. Gac Med Bilbao. 2021;118:99–107. [consultado 7 Jun 2022] Disponible en: http://gacetamedicabilbao.eus/index.php/gacetamedicabilbao/article/view/843/0. [Google Scholar]
- 48.Racey M., Ali M.U., Sherifali D., Fitzpatrick-Lewis D., Lewis R., Milos J., et al. Effectiveness of physical activity interventions in older adults with frailty or prefrailty: A systematic review and meta-analysis. CMAJ Open. 2021;9:E728–E743. doi: 10.9778/cmajo.20200222. [DOI] [Google Scholar]
- 49.Khor P.Y., Vearing R.M., Charlton K.E. The effectiveness of nutrition interventions in improving frailty and its associated constructs related to malnutrition and functional decline among community-dwelling older adults: A systematic review. J Hum Nutr Diet. 2022;35:566–582. doi: 10.1111/jhn.12943. [DOI] [PubMed] [Google Scholar]
- 50.Owens D.K., Davidson K.W., Krist A.H., Barry M.J., Cabana M., Caughey A.B., et al. US Preventive Services Task Force Screening for Cognitive Impairment in Older Adults: US Preventive Services Task Force Recommendation Statement. JAMA. 2020;323:757–763. doi: 10.1001/jama.2020.0435. [consultado 7 May 2022] Disponible en: https://jamanetwork.com/journals/jama/fullarticle/2761651. [DOI] [PubMed] [Google Scholar]
- 51.Frederiksen K.S., Cooper C., Frisoni G.B., Frölich L., Georges J., Kramberger M.G., et al. A European Academy of Neurology guideline on medical management issues in dementia. Eur J Neurol. 2020;27:1805–1820. doi: 10.1111/ene.14412. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Livingston G., Huntley J., Sommerlad A., Ames D., Ballard C., Banerjee S., et al. Dementia prevention, intervention, and care: 2020 report of the Lancet Commission. Lancet. 2020;396:413–446. doi: 10.1016/S0140-6736(20)30367-6. [consultado 7 Nov 2022] Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S0140673620303676. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.World Health Organization. Reducción de los riesgos de deterioro cognitivo y demencia. Directrices de la OMS 2020 [consultado May 2022]. Disponible en: https://iris.paho.org/bitstream/handle/10665.2/52426/9789275322574_spa.pdf
- 54.Patnode C.D., Perdue L.A., Rossom R.C., Rushkin M.C., Redmond N., Thomas R.G., et al. Screening for Cognitive Impairment in Older Adults: Updated Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA. 2020;323:764. doi: 10.1001/jama.2019.22258. [consultado May 2022] Disponible en: https://jamanetwork.com/journals/jama/fullarticle/2761650. [DOI] [PubMed] [Google Scholar]
- 55.Ismail Z., Black S.E., Camicioli R., Chertkow H., Herrmann N., Laforce R., et al. Recommendations of the 5 th Canadian Consensus Conference on the diagnosis and treatment of dementia. Alzheimers Dement. 2020;16:1182–1195. doi: 10.1002/alz.12105. [consultado 8 Nov 2020] Disponible en: https://onlinelibrary.wiley.com/doi/10.1002/alz.12105. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Hemmy L.S., Linskens E.J., Silverman P.C., Miller M.A., Talley K.M.C., Taylor B.C., et al. Brief Cognitive Tests for Distinguishing Clinical Alzheimer-Type Dementia From Mild Cognitive Impairment or Normal Cognition in Older Adults With Suspected Cognitive Impairment: A Systematic Review. Ann Intern Med. 2020;172:678–687. doi: 10.7326/M19-3889. [consultado 9 May 2022] Disponible en: https://www.acpjournals.org/doi/10.7326/M19-3889. [DOI] [PubMed] [Google Scholar]
- 57.Carnero-Pardo C., Rego-García I., Mené Llorente M., Alonso Ródenas M., Vílchez Carrillo R. Utilidad diagnóstica de test cognitivos breves en el cribado de deterioro cognitivo. Neurología. 2019 doi: 10.1016/j.nrl.2019.05.007. [consultado May 2022] Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S0213485319300866. [DOI] [PubMed] [Google Scholar]
- 58.Arevalo-Rodriguez I., Smailagic N., Roqué-Figuls M., Ciapponi A., Sanchez-Perez E., Giannakou A., et al. Mini-Mental State Examination (MMSE) for the early detection of dementia in people with mild cognitive impairment (MCI). Cochrane Dementia and Cognitive Improvement Group, editor. Cochrane Database Syst Rev. 2021:7. doi: 10.1002/14651858.CD010783.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Taylor-Rowan M., Edwards S., Noel-Storr A.H., McCleery J., Myint P.K., Soiza R., et al. Anticholinergic burden (prognostic factor) for prediction of dementia or cognitive decline in older adults with no known cognitive syndrome. Cochrane Database Syst Rev. 2021 doi: 10.1002/14651858.CD013540.pub2. [consultado 13 May 2022] Disponible en: http://doi.wiley.com/10.1002/14651858.CD013540.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Smith E.E., Barber P., Field T.S., Ganesh A., Hachinski V., Hogan D.B., et al. Canadian Consensus Conference on Diagnosis and Treatment of Dementia (CCCDTD)5: Guidelines for management of vascular cognitive impairment. Alzheimers Dement (N Y) 2020;6:e12056. doi: 10.1002/trc2.12056. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Hafdi M., Hoevenaar-Blom M.P., Richard E. Multi-domain interventions for the prevention of dementia and cognitive decline. Cochrane Database Syst Rev. 2021;11 doi: 10.1002/14651858.CD013572.pub2. [consultado 14 May 2022] Disponible en: http://doi.wiley.com/10.1002/14651858.CD013572.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Cunningham E.L., Todd S.A., Passmore P., Bullock R., McGuinness B. Pharmacological treatment of hypertension in people without prior cerebrovascular disease for the prevention of cognitive impairment and dementia. Cochrane Database Syst Rev. 2021 doi: 10.1002/14651858.CD004034.pub4. [consultado 14 May 2022] Disponible en: http://doi.wiley.com/10.1002/14651858.CD004034.pub4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Jordan F., Quinn T.J., McGuinness B., Passmore P., Kelly J.P., Tudur Smith C., et al. Aspirin and other non-steroidal anti-inflammatory drugs for the prevention of dementia. Cochrane Database Syst Rev. 2020;4 doi: 10.1002/14651858.CD011459.pub2. [consultado 28 May 2022] Disponible en: http://doi.wiley.com/10.1002/14651858.CD011459.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]