Resumo
A Ranolazina (RANO), conhecida na clínica como Ranexa, é um fármaco que previne a arritmia cardíaca através da inibição da corrente de sódio tardia (INaT). Um gradiente de voltagem transmural do canal Nav1.5 encontra-se na parede ventricular esquerda do coração. Assim, investigamos os efeitos da RANO em cardiomiócitos saudáveis e em modelo celular da Síndrome do QT longo tipo 3 (SQTL tipo 3). Usamos células isoladas do endocárdio (ENDO) e do epicárdio (EPI) e um software de medição com detecção de bordas por vídeo e microscopia de fluorescência para monitorar os transientes de cálcio. A RANO (0,1, 1, 10 e 30 uM, a 25OC) em uma série de frequências de estimulação teve impacto pouco significativo sobre ambos os tipos de células, mas a RANO (30uM) a 35OC minimizou o encurtamento dos sarcômeros em ~21% para células do endocárdio. Em seguida, para simular a SQTL tipo 3, as células do ENDO e EPI foram expostas à toxina ATX-II da anêmona do mar, que aumenta a INaT. As arritmias celulares induzidas por ATX-II foram suprimidas com o uso da RANO (30 µM) a 35OC. Com base nesses resultados, podemos concluir que a RANO tem um impacto pouco significativo sobre o encurtamento dos sarcômeros de células saudáveis do ENDO e EPI. Além disso, ela suprime as arritmias induzidas por INaT para níveis semelhantes nas células do ENDO e EPI.
Keywords: Arritmias, Síndrome do QT Longo do Tipo 3, ATX-II, Ranolazina, Corrente Tardia de Sódio, Contração
Introdução
A arritmia nas doenças cardiovasculares é uma das principais causas de morte no mundo todo.1 A ação antiarrítmica da ranolazina é atribuída à diminuição do componente de inativação lenta da corrente cardíaca interna através do Nav1.5, conhecida como corrente de sódio tardia (INaT).2 Apesar dos avanços importantes na compreensão dos mecanismos celulares subjacentes à ação da RANO, a sua ação transmural nas células musculares do coração permanece incerta. Consequentemente, neste estudo, nossa hipótese é que a RANO desempenha uma ação transmural nas células saudáveis do endocárdio (ENDO) e epicárdio (EPI) estimuladas por região, bem como nas arritmias e perturbação do cálcio induzidas pela toxina de anêmona (ATX-II),3 que aumenta a INaT e simula vários aspectos da Síndrome do QT longo tipo 3 (SQTL tipo 3), uma doença relacionada ao aumento da INaT nas células do coração.2
Métodos
Animais
Foram usados ratos Wistar machos (160-250 g; com 5 a 7 semanas de vida) nos experimentos. Todos os procedimentos experimentais foram realizados conforme as diretrizes institucionais, e o estudo foi aprovado pelo Comitê de revisão ética local. Os cardiomiócitos foram isolados conforme descrito anteriormente.4
O encurtamento do sarcômero e o transiente de cálcio
Os experimentos foram conduzidos como descrito anteriormente pelo nosso grupo.5 As células foram perfundidas com RANO (Alomone, Israel) a 0,1, 1, 10, ou 30 µM a partir de uma solução stock de 10 mM. Os dados foram normalizados como a função de contração do sarcômero antes da exposição à RANO. Para acessar o efeito antiarrítmico da RANO após exposição ao ATX-II (6 nM) (Alomone, Israel), os tempos para 90% de relaxamento do sarcômero (T90R) e recaptação de cálcio (T90Ca2) foram registrados como índices arrítmicos. Adicionalmente, 10 mM de Tetrodotoxina (TTX) (Alomone, Israel) foi utilizado para confirmar que o fenótipo observado era de fato decorrente da INaT.
Análise estatística
Todos os resultados foram expressos como média ± erro padrão da média. Diferenças significativas foram determinadas usando o teste de T não pareado de duas amostras ou ANOVA de uma via para medidas repetidas, seguidos de análises post-hoc (Teste de Tukey). Valores de p < 0,05 foram considerados significativos. Os cardiomiócitos de pelo menos dois corações diferentes foram usados em cada experimento.
Resultados e Discussão
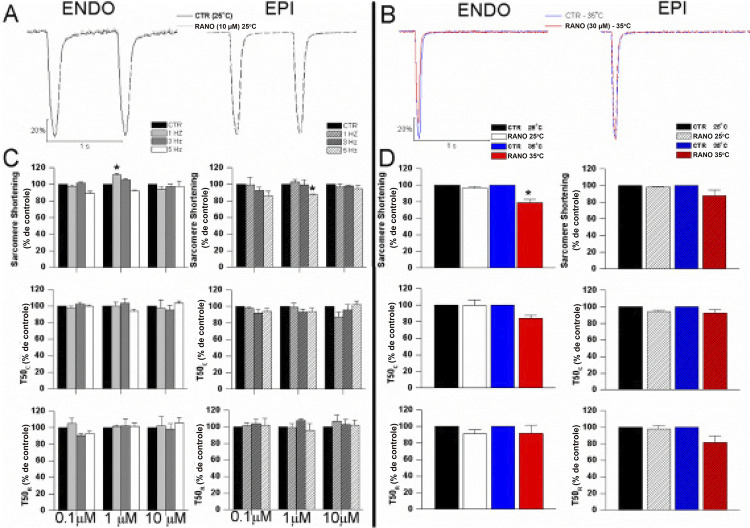
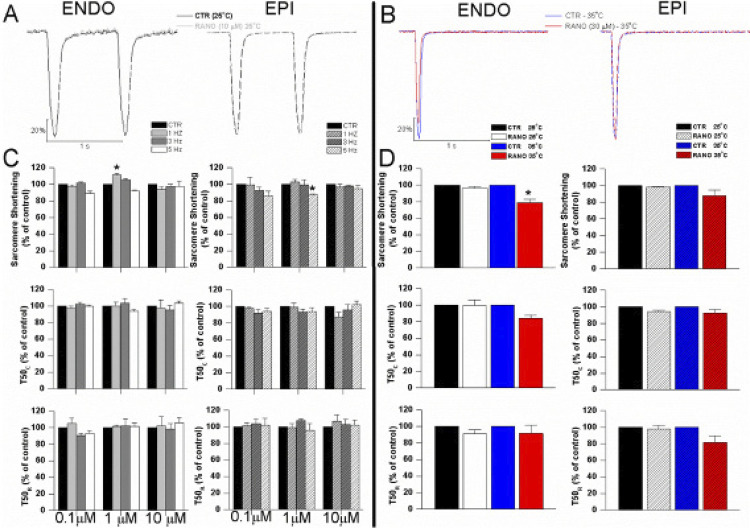
Estudos anteriores demonstraram que os cardiomiócitos saudáveis apresentam INaT.6 Além disso, um gradiente de corrente de sódio foi registrado na parede ventricular esquerda que, conforme vem sendo relatado, é maior nas células do ENDO no que nas células do EPI.7 Desse modo, levantamos a hipótese de que as células do ENDO apresentam maior INaT quando comparadas com as células do EPI. Uma vez que a INaT modula o [Ca2]i nos cardiomiócitos,8 a RANO seria capaz de minimizar a contração em ambos os grupos celulares, porém com maior potência nas células do ENDO e EPI. Para testar essas hipóteses, as células foram perfundidas a 25oC com RANO; Entretanto, a RANO não foi capaz de minimizar o encurtamento do sarcômero nos cardiomiócitos do ENDO e do EPI ( Figuras 1A e C ). Uma tendência semelhante foi observada quando os cardiomiócitos foram expostos à RANO (30 µM) e estimulados a 0,2 Hz. Quando as células do ENDO e EPI foram expostas à RANO (30 µM) e estimuladas a 0,2 Hz, usando uma solução de perfusão a 35oC, o encurtamento do sarcômero foi reduzido nas células do ENDO em ~21% (p < 0.05), mas não nas células do EPI ( Figuras 1B e D ). Desse modo, corroborando os achados anteriores, nossos resultados sugerem que as células saudáveis do ENDO de fato apresentam maior INaT do que as células do EPI. Entretanto, também é importante observar que a RANO (30 µM) também poderia bloquear a corrente de cálcio tipo L nos cardiomiócitos.9
Figura 1. – Efeito Inotrópico da ranolazina (RANO) sobre o encurtamento do sarcômero dos cardiomiócitos do ENDO e EPI. Registros característicos de encurtamennto do sarcômero antes (preto (25ºC) e azul (35ºC)) e após (cinza claro (25ºC) e vermelho (35ºC)) exposição do cardiomiócito do ENDO (esquerda) e EPI (direita) à RANO ((A) 10 and (B) 30 µM). Efeito inotrópico da RANO (0,1, 1, e 10 µM) (C) e 30 µM (D) sobre o encurtamento do sarcômero (barras superiores); tempo normalizado de contração do sarcômero para 50% (T50C) (barras do meio) e; tempo normalizado de relaxamento do sarcômero para 50% (T50R) (barras inferiores). As barras tracejadas representam as células do EPI (n = 3–6 células/concentração). *p < 0,05, na comparação antes e depois de exposição à RANO.
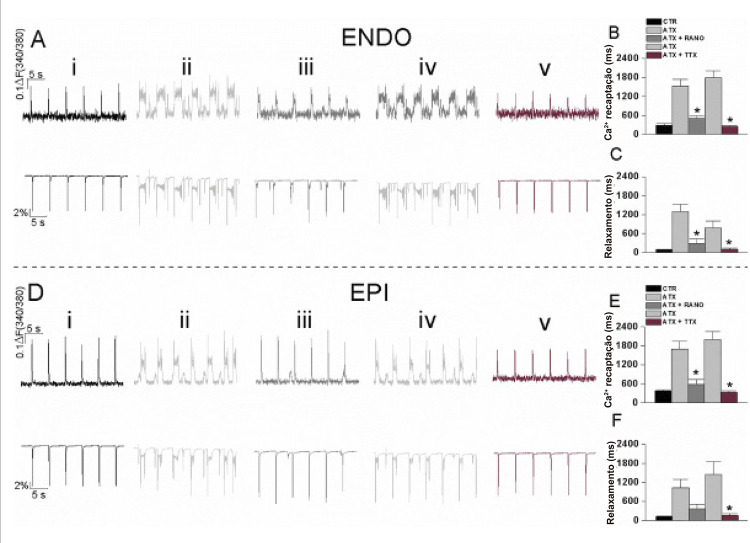
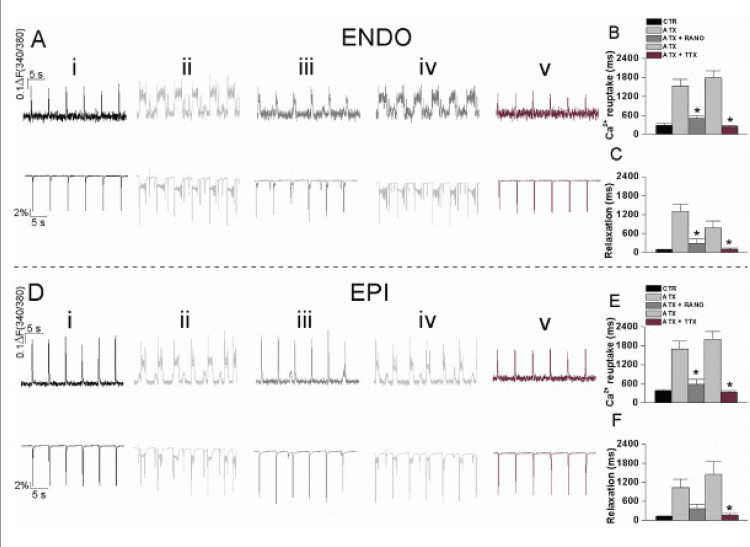
Para melhor compreensão do mecanismo subjacente ao encurtamento do sarcômero induzido por RANO, experimentos posteriores foram realizados a 35OC. Os cardiomiócitos foram carregados com Fura-2/AM para monitorar a oscilação de cálcio durante a contração celular, e as células foram expostas à ATX-II para aumentar a INaT e induzir um fenótipo de SQTL tipo 33 ( Figura 2 ). As células do ENDO ( Figuras 2A, B e C ) e do EPI ( Figuras 2D, E e F ) expostas ao ATX-II mostraram evidentes perturbações do cálcio e arritmias mecânicas simultâneas. A RANO (30 µM) minimizou expressivamente o fenótipo arrítmico induzido por ATX-II em ambos os grupos celulares para extensões similares. Para confirmar que o fenótipo arrítmico observado nos nossos experimentos foram realmente atribuídos à INaT, as células foram expostas ao ATX-II (6 nM) [ Figura 2A (iv) e Figura 2D (iv) ], após exposição a 10 µM de TTX e ATX-II (6 nM) [ Figura 2A (v) e Figura 2D (v) ]. Os resultados confirmaram que o fenótipo arrítmico observado foi decorrente do incremento da INaT. Apesar de as células do ENDO dos ratos ter apresentado maiores correntes de sódio em relação às células do EPI,7 , 10 o fenótipo arrítmico induzido por ATX-II e a extensão dos efeitos antiarrítmicos da Raneza foram semelhantes em ambos os grupos celulares.
Figura 2. – Ação da ranolazina (RANO) nos cardiomiócitos do ENDO e EPI expostos ao ATX-II e estimulados a 0,2 Hz. Traços característicos de transientes de cálcio (traços superiores) e encurtamento dos sarcômeros dos cardiomiócitos (traços inferiores) após contato com solução de Tyrode (i), ATX-II (6 nM) (ii), ATX-II (6 nM) + RANO (30 µM) (iii), ATX-II (6 nM) (iv), e ATX-II (6 nM) + TTX (10 µM) (iv) nas células do ENDO (A) e EPI (D). Tempo para 90% de receptação de Ca2+ nas células do ENDO (n = 8 células) (B) e EPI (n = 6 células) (E). Tempo para 90% de relaxamento do sarcômero nas células do ENDO (C) e EPI (F). * p < 0,05, quando comparado com o grupo ATX-II.
Curiosamente, o intervalo de concentração terapêutica da RANO é de 1–10 µM.11 A aparente discrepância no potencial da RANO pode ser explicada pelo fato de que o ATX-II nas doses de 1–10 nM induz maior INaT nos cardiomiócitos do que aquele observado nas doenças cardiovasculares.3 , 6
Conclusão
A RANO exerceu pouca influência sobre o encurtamento do sarcômero de cardiomiócitos saudáveis e suprimiu as arritmias induzidas por INaT a extensões semelhantes nas células do ENDO e EPI.
Funding Statement
Fontes de financiamento
Vinculação acadêmica
Este artigo é parte de dissertação de Mestrado de Victor Martins de Miranda pela Universidade Federal de São Paulo.
Aprovação ética e consentimento informado
Este estudo foi aprovado pelo Comitê de Ética do CEUA UNIFESP sob o número de protocolo 2435/70816. Todos os procedimentos envolvidos nesse estudo estão de acordo com a Declaração de Helsinki de 1975, atualizada em 2013.
Fontes de financiamento
O presente estudo foi financiado pela FAPESP nº 2014/09861-1.
Referências
- 1.Deo R, Albert CM. Epidemiology and genetics of sudden cardiac death. Circulation. 2012;125(4):620–637. doi: 10.1161/CIRCULATIONAHA.111.023838. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Bohnen MS, Peng G, Robey SH, Terrenoire C, Iyer V, Sampson KJ, et al. Molecular pathophysiology of congenital long QT syndrome. Physiol Rev. 2017;97(1):89–134. doi: 10.1152/physrev.00008.2016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Clark RB, Giles WR. Current-voltage relationship for late Na(+) current in adult rat ventricular myocytes. Curr Top Membr. 2016;78:451–478. doi: 10.1016/bs.ctm.2016.04.002. [DOI] [PubMed] [Google Scholar]
- 4.Santos-Miranda A, Cruz JS, Roman-Campos D. Electrical properties of isolated cardiomyocytes in a rat model of thiamine deficiency. Arq Bras Cardiol. 2015;104(3):242–245. doi: 10.5935/abc.20150010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Santos MS, Oliveira ED, Santos-Miranda A, Cruz JS, Gondim ANS, Menezes JER, Filho, et al. Dissection of the effects of quercetin on mouse myocardium. Basic Clin Pharmacol Toxicol. 2017;120(6):550–559. doi: 10.1111/bcpt.12743. [DOI] [PubMed] [Google Scholar]
- 6.Iyer V, Roman-Campos D, Sampson KJ, Kang G, Fishman GI, Kass RS. Purkinje cells as sources of arrhythmias in long QT syndrome type 3. 13287Sci Rep. 2015 Aug 20;5 doi: 10.1038/srep13287. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Rosati B, Grau F, McKinnon D. Regional variation in mRNA transcript abundance within the ventricular wall. J Mol Cell Cardiol. 2006;40(2):295–302. doi: 10.1016/j.yjmcc.2005.11.002. [DOI] [PubMed] [Google Scholar]
- 8.Fraser H, Belardinelli L, Wang L, Light PE, McVeigh JJ, Clanachan AS. Ranolazine decreases diastolic calcium accumulation caused by ATX-II or ischemia in rat hearts. J Mol Cell Cardiol. 2006;41(6):1031–1038. doi: 10.1016/j.yjmcc.2006.08.012. [DOI] [PubMed] [Google Scholar]
- 9.Allen TJ, Chapman RA. Effects of ranolazine on L-type calcium channel currents in guinea-pig single ventricular myocytes. Br J Pharmacol. 1996;118(2):249–254. doi: 10.1111/j.1476-5381.1996.tb15395.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Honen BN, Saint DA. Heterogeneity of the properties of INa in epicardial and endocardial cells of rat ventricle. Clin Exp Pharmacol Physiol. 2002;29(3):161–166. doi: 10.1046/j.1440-1681.2002.03620.x. [DOI] [PubMed] [Google Scholar]
- 11.Chaitman BR, Skettino SL, Parker JO, Hanley P, Meluzin J, Kuch J, et al. Anti-ischemic effects and long-term survival during ranolazine monotherapy in patients with chronic severe angina. J Am Coll Cardiol. 2004;43(8):1375–1382. doi: 10.1016/j.jacc.2003.11.045. [DOI] [PubMed] [Google Scholar]