Abstract
Hintergrund
Seit 1997 steht mit den antiretroviralen, kombinierbaren Wirkstoffen eine effektive Prävention und Behandlung einer Infektion mit dem „human immunodeficiency virus“ (HIV) zur Verfügung.
Fragestellung
Was wurde in dieser Zeit durch die Transmissionsprophylaxe und Behandlung der HIV-Infektion bei Kindern in Deutschland erreicht?
Material und Methoden
Darstellung der Entwicklung der Transmissionsprophylaxe und der epidemiologischen Erhebungen des Robert Koch-Instituts, Darstellung der Arzneimittelentwicklung und der Leitlinien zur antiretroviralen Therapie (ART) bei Kindern und Jugendlichen, Vorstellung von Erhebungen der deutschen Kinder-HIV-Kohorte („German pediatric and adolescent HIV cohort“, GEPIC).
Ergebnisse
Die Einführung der HIV-Testung Schwangerer hat die regelmäßige ART HIV-positiver Schwangerer und die Einführung von transmissionsmindernden Maßnahmen möglich gemacht. Damit konnte das Risiko der vertikalen Transmission von ca. 30 % auf < 1 % gesenkt werden. Gegenwärtig wird untersucht, ob HIV-exponierte Kinder ohne Risiko gestillt werden können. Die ART bei Kindern hat die Überlebensraten sowie die körperliche und die kognitive Entwicklung HIV-positiver Kinder entscheidend verbessert. Neue Wirkstoffe haben ein günstigeres Nebenwirkungsprofil. In Deutschland konnten die WHO-Ziele, bei 90 % der Kinder eine vollständige Suppression der Viruslast zu erzielen, erreicht werden. Späte Diagnosen sind bei Kindern und Jugendlichen weiterhin mit schweren Infektionen verbunden. Die HIV-Infektion ist weiterhin eine Erkrankung mit Stigma geblieben und wird deswegen meist gegenüber den Kindern und ihrer Umwelt geheim gehalten.
Schlussfolgerung
Mit der jetzt möglichen Transmissionsprophylaxe und Therapie gelingt es, Transmissionen weitgehend zu verhindern und HIV-positiven Kindern bei frühzeitiger Diagnose ein weitgehend gesundes Leben zu ermöglichen. Das Ziel, dass Kinder ihre Krankheit ohne Angst kennen und nennen können, ist nach wie vor nicht erreicht.
Schlüsselwörter: Schwangere Frauen; HIV-Testung; Infektionskrankheit, vertikale Transmission; Antiretrovirale Therapie; GEPIC-Kohorte
Abstract
Background
Since 1997 an effective prevention and treatment of infections with human immunodeficiency virus (HIV) have been available in the form of antiretroviral combination therapy.
Objective
What has been achieved during this time by transmission prophylaxis and treatment of HIV infections in children in Germany?
Material and methods
Presentation of the development of transmission prophylaxis and the epidemiological surveys of the Robert Koch Institute, presentation of drug development and guidelines for antiretroviral therapy in children and adolescents and presentation of surveys of the German pediatric and adolescent HIV cohort (GEPIC).
Results
The introduction of HIV testing of pregnant women has made regular antiretroviral treatment of HIV positive pregnant women and the introduction of transmission-reducing measures possible. This has reduced the risk of vertical transmission from about 30% to < 1%. Currently, it is being investigated whether children exposed to HIV can be breastfed without risk. Antiretroviral therapy in children has decisively improved the survival rates and the physical and cognitive development of HIV positive children. New active substances have a more favorable side effect profile. In Germany, the World Health Organization (WHO) target of achieving complete suppression of the viral load in 90% of the children has been achieved. A delayed diagnosis in children and adolescents is still associated with severe infections. An HIV infection remains a disease with a stigma and is therefore usually kept secret from the children and their environment.
Conclusion
With the transmission prophylaxis and therapy that are now available, it is possible to prevent transmission to a large extent and with a timely diagnosis to enable HIV positive children to lead a largely healthy life. The goal of children being able to know and name their disease without fear has still not been achieved.
Keywords: Pregnant women; HIV testing; Infectious disease transmission, vertical; Antiretroviral therapy; GEPIC cohort
Im Rahmen der durch das „severe acute respiratory syndrome coronavirus 2“ (SARS-CoV-2) ausgelösten Pandemie ist es um das „human immunodeficiency virus“ (HIV) vergleichsweise still geworden. Dennoch hat die Zahl der Menschen, die in Deutschland mit der HIV-Infektion leben, einen Höchststand erreicht. Für viele ist es überraschend, dass auch Kinder HIV-infiziert sein können. Dies liegt nicht nur an der vergleichsweise geringen Zahl betroffener Kinder, sondern auch an der Geheimhaltung der HIV-Infektion, selbst gegenüber den betroffenen Kindern.
Fallbeispiel
Ein bisher gesunder männlicher Säugling, reif geboren nach 39 + 6 SSW, wird im Alter von 3½ Monaten in der Kinderarztpraxis vorgestellt. Er leidet seit einigen Tagen an trockenem Husten, dazu an einer neu aufgetretenen Diarrhö sowie an Fieber und einer Tachydyspnoe. Etwa eine Woche zuvor hatte das Kind die zweite Rotavirusimpfung erhalten.
Auskultatorisch findet sich ein unauffälliger Befund. Die periphere Sauerstoffsättigung beträgt aber 90 %. Das Kind wird stationär eingewiesen.
Nach der stationären Aufnahme verschlechtert sich die respiratorische Situation rasch. Unter Atemhilfe zunächst mit einer „high flow nasal cannula“ (HFNC) und dann mithilfe des „continuous positive airway pressure“ (CPAP) verschlechtert sich der Zustand weiter. Unter dem Bild eines schweren „acute respiratory distress syndrome“ (ARDS) wird das Kind intubiert und mit einer inspiratorischen Sauerstofffraktion (FIO2) von 1,0 und Beatmungsdrücken von bis zu 35 cm H2O inspiratorisch und einem endexspiratorischem Druck von 15 cm H2O beatmet. Radiologisch zeigen sich diffuse bilaterale Infiltrate. Es besteht nur eine milde Konzentrationserhöhung des C‑reaktiven Proteins (CRP). Dennoch wird eine empirische antibiotische Therapie eingeleitet. Die Blutkulturen bleiben ohne Erregernachweis; im Stuhl werden Rotaviren, im Trachealsekret Parainfluenzaviren nachgewiesen.
Aufgrund der Schwere des Krankheitsverlaufs bei dem nachgewiesenen Erregerspektrum wird eine Immundefektdiagnostik nach unauffälligem Neugeborenenscreening durchgeführt. Die initiale immunologische Diagnostik zeigt CD4+-T-Zellen im unteren altersbezogenen Normbereich. Erst im weiteren Verlauf fällt die Zahl der CD4+-T-Zellen deutlich ab. Eine ebenfalls durchgeführte „polymerase chain reaction“ (PCR) zum HIV-Nachweis zeigt eine sehr hohe Viruslast von 9.500.000 Kopien/ml. Umgehend wird eine antiretrovirale Therapie (ART) mit den nukleosidischen Reverse-Transkriptase-Inhibitoren Zidovudin und Lamivudin in Kombination mit dem Integraseinhibitor Dolutegravir aufgenommen. Für alle 3 Wirkstoffe sind orale Flüssigformulierungen verfügbar. Die neu gestellte Diagnose einer HIV-Infektion weckt den Verdacht auf eine Pneumonie durch einen opportunistischen Erreger. Wegen des negativen PCR-Befunds bezüglich des Zytomegalie-Virus (CMV) und der erhöhten Lactatdehydrogenase(LDH)-Konzentration im peripheren Blut wird der Verdacht auf eine Pneumocystis-jirovecii-Pneumonie (PJP) gestellt und eine empirische Therapie mit Cotrimoxazol und Prednisolon begonnen. Der Erreger wird später aus dem Magensaft und dem Trachealsekret isoliert.
Im weiteren Verlauf entwickelt das Kind einseitig beginnende und sekundär generalisierte Krampfanfälle. Aufgrund des Verdachts auf eine weitere opportunistische Infektion, eine Kryptokokken-Meningitis, wird das Kind empirisch zusätzlich mit Amphotericin B und Fluconazol sowie antikonvulsiv mit Levetiracetam behandelt. Das Kryptokokken-Antigen lässt sich im Serum und im Liquor jedoch nicht nachweisen.
Trotz adäquater Behandlung der PJP verschlechtert sich der respiratorische Zustand weiter und macht eine Beatmung mit inhalativem Stickstoffmonoxid (iNO) erforderlich. Erst nach mehreren Wochen setzt eine langsame, aber stetige Besserung ein, die schließlich eine Entwöhnung von der invasiven Beatmung ermöglicht. Nach CPAP-Unterstützung für weitere 2 Wochen und fortgesetzter Sauerstoffgabe über weitere 4 Wochen ist der Zustand des Kindes respiratorisch in Raumluft stabil.
Die cMRT zeigt nun eine globale Atrophie mit Marklagerverlust und bifrontal mutmaßlich postischämische Läsionen – passend zu einer HIV-Leukenzephalopathie.
Die Mutter war im 1. Trimenon HIV-negativ getestet worden. Sie hat die Infektion also mutmaßlich im weiteren Verlauf der Schwangerschaft akquiriert. Die HIV-Infektion während der Schwangerschaft birgt ein besonders hohes Risiko für eine Mutter-Kind-Übertragung. Ein 2. HIV-Antikörpertest, wie in Großbritannien üblich, hätte mit größerer Wahrscheinlichkeit (> 98 %) die kindliche Infektion verhindern können. Die unerkannte konnatale HIV-Infektion kann innerhalb weniger Monate zu lebensbedrohlichen opportunistischen Infektionen und anderen das „acquired immune deficiency syndrome“ (AIDS) definierenden Ereignissen (Infobox 1) führen.
Infobox 1 Auswahl der das „acquired immune deficiency syndrome“ (AIDS) definierenden Erkrankungen im Kindesaltera
> 1 invasive bakterielle Infektion innerhalb von 2 Jahren
„Human-immunodeficiency-virus“(HIV)-Enzephalopathie
Wasting-Syndrom, Kachexie
Pneumocystis-jirovecii-Pneumonie (PCP)
Zerebrale Toxoplasmose bei Kindern im Alter > 1 Monat
Diarrhö > 1 Monat Dauer durch Kokzidien (Cryptosporidium oder Isospora) hervorgerufen
Lymphome, einschließlich Lymphomen des Zentralnervensystems (ZNS), Kaposi-Sarkom
Progressive multifokale Leukenzephalopathie (PML)
Durch Herpes-simplex-Viren (HSV) verursachte mukokutane Ulzera (Dauer > 1 Monat)
Bronchitis, Pneumonie oder Ösophagitis durch HSV bei Kindern im Alter > 1 Monat
Lymphoide interstitielle Pneumonie (LIP) durch das Epstein-Barr-Virus (EBV) ausgelöst
Zytomegalie-Virus (CMV): u. a. Retinitis, Ösophagitis, Kolitis bei Kindern im Alter > 1 Monat
Kandidose des Ösophagus oder des Tracheobronchialsystems
Extrapulmonale Kryptokokkose
Disseminierte oder extrapulmonale Histoplasmose
Tuberkulose, atypische Mykobakteriosen
aModifiziert nach Caldwell et al. [6]
Vertikale Transmission – und wie sie verhindert werden kann
Unter den schätzungsweise 91.000 Menschen, die in Deutschland mit einer HIV-Infektion leben, befinden sich gemäß der Erhebung der pädiatrischen HIV-Ambulanzen rund 400 Kinder und Jugendliche [4]. Im Unterschied zu Erwachsenen werden Kinder nahezu ausschließlich während der Schwangerschaft, Geburt oder Stillzeit infiziert (vertikale Transmission). Zur Prävention der kindlichen HIV-Infektion zählten ursprünglich die Sectio-Entbindung, ein Stillverzicht und eine 6‑wöchige Zidovudinprophylaxe beim Säugling, wodurch die Transmissionsrate von etwa 30 % auf weniger als 2 % gesenkt werden konnte. Voraussetzung für diese Maßnahmen war, dass die HIV-Infektion bei der Mutter auch bekannt war. Wegen geringen HIV-Testraten bei Schwangeren wurde 2007 eine verpflichtende Beratung über den HIV-Test in die Mutterschaftsrichtlinien aufgenommen. Im Jahr 2016 war die Testrate Schwangerer auf 92 % gestiegen [21]. Ein deutlicher Rückgang der HIV-Neuinfektionen in Deutschland geborener Kinder war die Folge.
Therapie der Mutter
Heute beschränken sich perinatale HIV-Transmissionen in Mitteleuropa trotz einer auf 800 angestiegenen jährlichen Zahl der Schwangerschaften HIV-positiver Mütter auf Einzelfälle [20]. Die Transmissionsrate beträgt unter 1 %. Mit den heutigen Wirkstoffen können HIV-positiv getestete Schwangere noch vor der Entbindung eine nichtnachweisbare Viruslast erreichen, was gleichbedeutend mit einem sehr geringen Transmissionsrisiko ist. Je stabiler die Virusreplikation bei der Mutter unterdrückt ist, desto sicherer erscheint eine Prävention der vertikalen Transmission.
In einer großen Kohorte von Müttern, die bereits vor der Konzeption eine dauerhaft nichtnachweisbare Virusreplikation aufwiesen, kam es zu keiner einzigen Transmission [19]. Entsprechend wurde in den letzten Jahren der Katalog der übrigen Präventionsmaßnahmen schrittweise verkleinert: vaginale statt Sectio-Entbindung (sofern die HIV-Viruslast < 50 Kopien/ml beträgt) sowie eine auf 2 Wochen verkürzte und unter bestimmten Voraussetzungen sogar ausgesetzte antiretrovirale Postexpositionsprophylaxe beim Säugling.
Ist Stillen noch gefährlich?
Inzwischen steht auch der Stillverzicht zur Disposition. In ressourcenarmen Ländern wurde das Stillen durch HIV-positive Mütter von der WHO von Anfang an empfohlen, weil die diarrhöbedingte Sterblichkeit bei nichtgestillten Säuglingen höher war als die vertikalen HIV-Transmissionsraten. Entsprechend stammen die meisten Daten zur Transmission gestillter Säuglinge aus den Hochprävalenzländern [12]. Obwohl das HIV-Genom in der Muttermilch auch dann noch nachweisbar ist, wenn die Viruslast im peripheren Blut unter der Nachweisgrenze liegt, sind die Infektionsraten bei gestillten Kindern in Europa so niedrig, dass sich Transmissionsraten kaum berechnen lassen. Die verfügbaren Daten reichen zwar nicht aus, um Stillen als „sicher“ zu betrachten, aber sie stellen kein eindeutiges Gefahrensignal mehr dar, um deshalb vom Stillen abzuraten [9, 15, 27]. Gegenwärtig finden in Deutschland und der Schweiz prospektive Erhebungen statt, um die vergleichsweise wenigen Fälle gestillter Säuglinge mit einer HIV-Infektion in Deutschland auswerten zu können [15, 27].
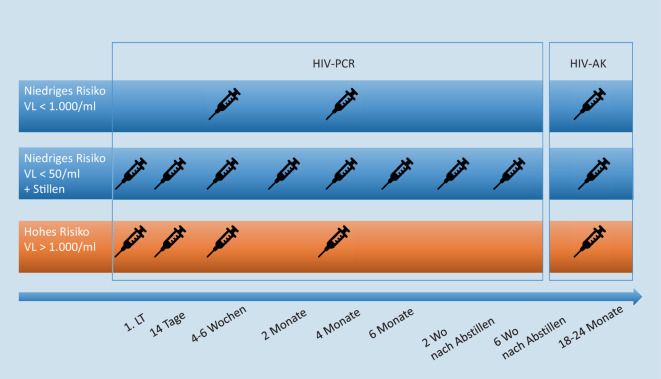
Entsprechend empfehlen die aktuellen Leitlinien, die Entscheidung für oder gegen das Stillen gemeinsam mit der werdenden Mutter bzw. den werdenden Eltern nach eingehender Aufklärung über Vorbedingungen und Vorteile des Stillens sowie dessen mögliche Risken zu treffen [9]. Gestillte Säuglinge sollen in der pädiatrischen HIV-Nachsorge allerdings häufiger als Ungestillte virologisch untersucht werden (Abb. 1).
Nach Erfahrung der Autoren ist die Enttabuisierung des Stillens HIV-positiver Mütter noch nicht in allen Arbeitsbereichen der Behandlung Schwangerer und Wöchnerinnen angekommen. Damit ist es auch Aufgabe der pädiatrischen HIV-Behandler*innen, die geburtshilflichen und neonatologischen Teams mit dieser Neuerung vertraut zu machen.
Nachsorge exponierter Kinder
Auch für Kinderärzt*innen ist die Betreuung HIV-exponierter Kinder einfacher geworden. Die früher aufwendige Einschätzung des Transmissionsrisikos und die daraus folgende Wahl der prophylaktischen ART des Neugeborenen hat sich auf wenige Kriterien reduziert: die Bestimmung der Viruslast bei der Mutter und das Reifealter des Kindes (Abb. 2).
Um eine etwaige Transmission frühzeitig zu entdecken, werden HIV-exponierte Neugeborene nach einem risikoadaptierten Schema auf eine mögliche HIV-Infektion untersucht (Abb. 1). Bis zum Alter von 18 Monaten kann wegen der langen Persistenz maternaler Antikörper im kindlichen Blut allerdings der Antikörpertest nicht angewendet werden. Um eine HIV-Infektion dennoch frühzeitig detektieren zu können, werden bei den exponierten Kindern serielle HIV-PCR-Untersuchungen durchgeführt. Nabelschnurblut sollte nicht untersucht werden, weil das HIV-Genom darin häufig nachgewiesen werden kann, ohne dass die Kinder später HIV-positiv sind.
Erstversorgende Kinderärzt*innen stehen vor der Frage, ob die HIV-Exposition ins Vorsorgeheft einzutragen ist. Ein solcher Eintrag birgt die Gefahr, dass die HIV-Infektion der Mutter gegenüber Dritten unbeabsichtigt offenbart wird. Der Hinweis auf eine mütterliche Infektion in der Schwangerschaft in dem dafür vorgesehenen Feld ist ausreichend. Die Qualität der Exponiertennachsorge hängt auch nicht von einem Eintrag in dem Vorsorgeheft ab, sondern von der Planung bei der U1 und U2: Die medikamentöse Prophylaxe ist einzuleiten, und die Nachsorgeuntersuchungen müssen terminiert werden. Um den Müttern eine angemessene Entscheidung für oder gegen das Stillen zu ermöglichen, eine sachgerechte risikoadaptierte Wahl von Geburtsmodus und postnataler Prophylaxe zu sichern und die Umsetzung veralteter Leitlinien zu verhindern, sollten HIV-positive Mütter ihre Kinder in HIV-Schwerpunkt-Kliniken zur Welt bringen.
Die früher realistische Erwartung werdender HIV-positiver Mütter, ihr Kind zu infizieren und selbst zu sterben, bevor sie dieses großziehen können, ist Geschichte – oder könnte es zumindest sein. In der Betreuung exponierter Kinder zeigt sich, dass Ängste und Missverständnisse langlebiger sein können als die Viren. Immer wieder scheuen sich HIV-positive Mütter ihre Kinder zu küssen, um sie nicht dabei zu infizieren. Küssen ist aber selbst bei hoher Viruslast nicht infektiös.
Infektion verhindert – Probleme gelöst?
Trotz der Erfolge der perinatalen Transmissionsprophylaxe sind nicht alle Fragen gelöst. In mehreren Studien wiesen Kinder von HIV-positiven Müttern, die während der Schwangerschaft eine ART einnahmen, im Vergleich zu Kindern HIV-negativer Mütter ein geringeres Geburtsgewicht, schwächere Impfantworten und höhere Raten an Infektionen und Hospitalisierungen auf und ihre motorische und sprachliche Entwicklung war verzögert [11, 18, 29]. Ursächlich sind wahrscheinlich nicht oder nicht nur die während der Schwangerschaft eingenommenen Wirkstoffe. Kinder von Müttern, die bereits vor der Schwangerschaft eine ART erhielten, entwickelten sich besser als Kinder von Müttern, deren ART erst während der Schwangerschaft begonnen wurde [14]. Vor allem im ersten Lebensjahr waren die Morbidität und infektionsbedingte Mortalität HIV-exponierter Kinder im Vergleich zu nichtexponierten Kindern höher. Möglicherweise führt eine Virusreplikation in der Frühphase der Schwangerschaft bereits zu Schäden beim Ungeborenen, unabhängig von dessen tatsächlicher Infektion. Eine Diagnosestellung und Behandlung der HIV-Infektion bei Frauen vor der Schwangerschaft würde demnach nicht nur die Gesundheit der Betroffenen, sondern auch die ihrer zukünftigen Kinder verbessern.
Klinischer Verlauf der kindlichen Infektion
Der Verlauf der HIV-Infektion bei Kindern, die peri- oder postnatal mit dem HIV infiziert wurden, unterscheidet sich, wie das obige Fallbeispiel illustriert, erheblich von dem Verlauf bei Erwachsenen. Bei Erwachsenen kontrolliert das Immunsystem nach der Infektion innerhalb weniger Wochen die Virusreplikation auf ein relativ geringes Niveau. Anschließend fällt in einem mehrjährigen Zeitraum die Zahl der CD4+-T-Helferzellen nur langsam ab. Meist fühlen sich die Betroffenen in diesem Stadium gesund. Erst wenn die Zahl der T‑Helferzellen deutlich abgefallen ist – als Richtwert gelten 250 CD4+-T-Zellen/µl –, steigt das Risiko für die das „acquired immunodeficiency syndrome“ (AIDS) definierenden Erkrankungen, z. B. Pneumonie durch Pneumocystis jirovecii, Soorösophagitis oder progressive multifokale Leukenzephalopathie (PML). Bei einem weiteren Abfall der T‑Helferzellen auf < 50/µl bestehen hohe Risiken für eine CMV-Retinitis und Kryptokokkose.
Dem Immunsystem perinatal infizierter Kinder gelingt es während der Säuglingszeit dagegen kaum, die Virusreplikation zu begrenzen. Ein Fünftel der perinatal infizierten Kinder erleidet bereits im Säuglingsalter HIV-Enzephalitiden [7]. Wegen der geringer kontrollierten Virusreplikation ist bei Kindern die Progression zum Stadium AIDS schneller. Bis zum Alter von 4 Jahren sind bereits bei der Hälfte der perinatal HIV-infizierten Kinder AIDS-definierende Erkrankungen eingetreten [10], bei den anderen kann diese Phase bis in das Jugendalter reichen. Bis dahin kann auch ohne schwere Erkrankungen eine beeinträchtigte Entwicklung auf eine HIV-Infektion hinweisen, z. B. in Form von Gedeihstörung [4], Kleinwuchs [24], verminderter Knochendichte [23] oder verschlechterten Lungenfunktionsparametern [13]. Auch die neurokognitive Entwicklung kann beeinträchtigt sein [17]. Gemäß den Beobachtungen der Autoren stellen dazu die ersten 3 Lebensjahre eine vulnerable Phase dar. Die Höhe der Viruslast in dieser Altersspanne korrelierte negativ mit der neurokognitiven Entwicklung, nicht jedoch die Viruslast in höheren Altersgruppen [28].
Bei Kindern verläuft die Progression zum Stadium AIDS schneller als bei Erwachsenen
Unentdeckte HIV-Infektionen bei in Deutschland geborenen Kindern sind wegen des flächendeckenden HIV-Screenings Schwangerer und der wirksamen Postexpositionsprophylaxe eine Seltenheit. Bei Kindern, die in Hochprävalenzregionen geboren wurden und später nach Europa migrieren, können vergleichbare Programme nicht vorausgesetzt werden. Deshalb werden in Deutschland die meisten HIV-Neudiagnosen bei Kindern gestellt, die nicht in Deutschland geboren wurden. Unabhängig vom Geburtsort muss die Diagnose frühzeitig gestellt werden, um schwerste Verläufe mit Todesfolge oder dauerhaften Schäden zu verhindern. Diese treten meist in der frühen Kindheit auf, können sich aber auch erst im Jugendalter manifestieren. Die Infobox 2 fasst klinische Warnzeichen für eine HIV-Infektion zusammen.
Infobox 2 Wann an HIV-Infektion denken?
Herkunft aus Hochprävalenzregion (Subsahara-Afrika, Osteuropa, Südostasien)
Gedeihstörung
Kleinwuchs
Lymphadenopathie
Schwerer Herpes zoster
Chronisches Ekzem
Ungewöhnlich hohe Immunglobulinspiegel
Lymphozytopenie
Opportunistische Infektionen und andere AIDS-definierende Erkrankungen
Antiretrovirale Therapie
Durchführung
Mit der ART sollen eine dauerhafte Suppression der Virusreplikation, der Erhalt oder die Wiederherstellung der Immunkompetenz, die Senkung der Morbidität und Mortalität sowie eine möglichst gesunde körperliche und kognitive Entwicklung der Kinder erreicht werden [8]. Wegen der besonderen Vulnerabilität von Säuglingen und Kleinkindern wurde in den von der Pädiatrischen Arbeitsgemeinschaft AIDS (PAAD) formulierten Leitlinien für diese Altersgruppe bereits eine generelle Therapieempfehlung gegeben, als international noch der Beginn der Therapie von der Zahl der CD4+-T-Helferzellen abhängig gemacht wurde [22]. Heute wird international angesichts der wesentlich besseren Verträglichkeit der Wirkstoffe ein umgehender Beginn der ART für alle Altersgruppen empfohlen.
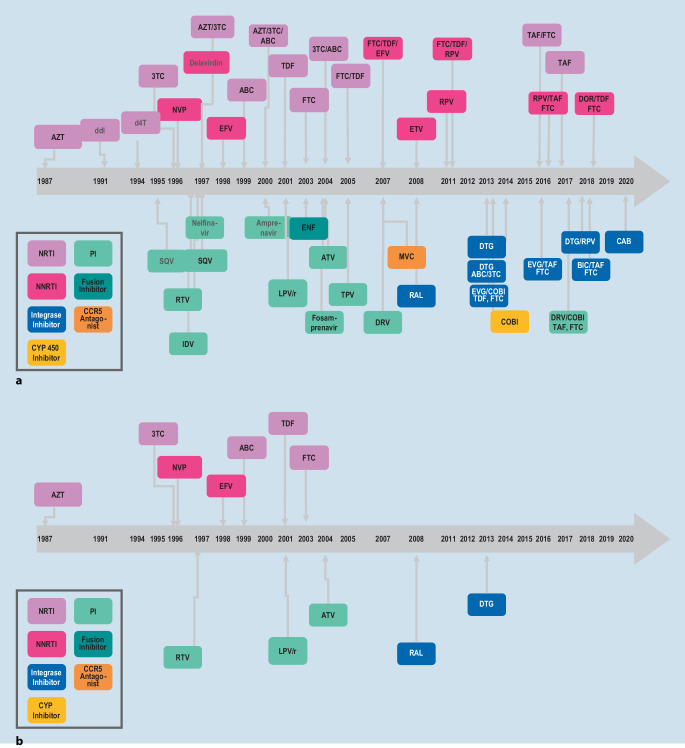
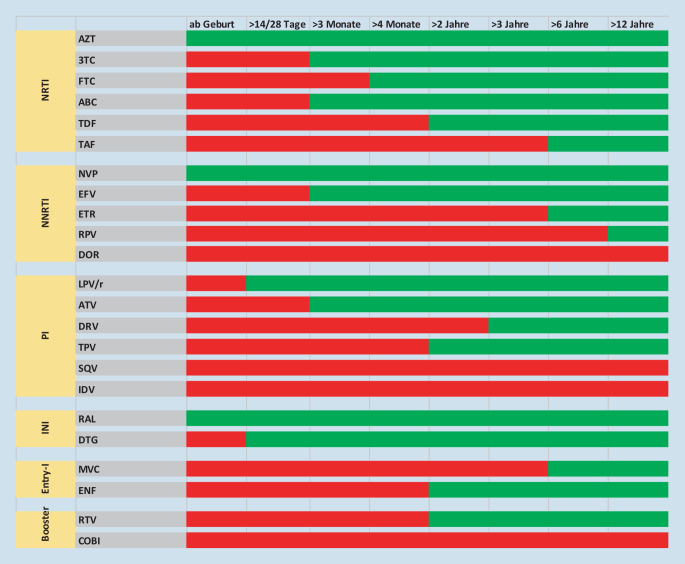
Die 3 antiretroviral wirksamen Substanzen aus mindestens 2 verschiedenen Substanzklassen zusammen. Nach aktuellen Empfehlungen wird entweder ein „integrase strand transfer inhibitor“ (INSTI), ein nichtnukleosidischer Reverse-Transkriptase-Inhibitor (NNRTI) oder ein Proteinaseinhibitor (PI) mit 2 nukleosidischen Reverse-Transkriptase-Inhibitoren (NRTI) kombiniert. Der Zulassung des ersten NRTI Zidovudin 1987 folgten inzwischen mehr als 40 weitere Wirkstoffe aus 7 Substanzgruppen für Erwachsene (Abb. 3a). Die Auswahl der für Kinder zugelassenen und in geeigneter Formulierung erhältlichen Wirkstoffe ist dagegen eingeschränkt. Zur Behandlung Neugeborener stehen lediglich 3 Wirkstoffe zur Verfügung, im Alter von 2 Jahren sind es 12 (Abb. 3b und 4). Die Therapie von Kleinkindern gestaltet sich regelmäßig schwierig, weil die verfügbaren Substanzen meist eine niedrige Resistenzschwelle oder einen so schlechten Geschmack haben, dass deren dauerhafte Gabe problematisch sein kann. Für die Behandlung von Jugendlichen sind ab dem Alter von 12 Jahren mehrere Kombinationspräparate zugelassen (Abb. 5), die die einmal tägliche Einnahme von einer Tablette ermöglichen. Diese Konfektionen können die bei Adoleszenten möglicherweise eingeschränkte Adhärenz verbessern.
Effektivität
Die ART bei Kindern hat seit den späten 90er-Jahren des letzten Jahrhunderts zu erheblich gebesserten Überlebensraten geführt. In einer großen US-amerikanischen Kohorte sank die Mortalität nach Einführung der ART um fast 90 % von 7,2/100 Patientenjahre auf 0,8/100 Patientenjahre [3]. Ein früher Beginn der ART bei noch erhaltener Immunkompetenz senkt die Sterblichkeit besonders effektiv. Europäische und thailändische Daten zeigen, dass die Mortalität um das 1,8- bis 3,5Fache höher ist, wenn mit der Therapie bei Jugendlichen begonnen wird [16].
Die in Deutschland erreichten Behandlungserfolge sind im internationalen Vergleich beachtlich
Im Jahr 2014 rief die WHO das globale Ziel aus, die HIV-Infektion bei mindestens 90 % der Betroffenen zu diagnostizieren, davon mindestens 90 % zu therapieren und bei diesen bei mindestens 90 % eine Viruslast unter der Nachweisgrenze zu erreichen [26]. Naturgemäß waren diese Ziele im Hinblick auf Erwachsene konzipiert, die in Deutschland über 99 % der mit einer HIV-Infektion lebenden Menschen ausmachen. Im Jahr 2020 stellte die WHO für Deutschland das Erreichen dieser 90-90-90-Ziele fest.
Diese Ziele sind auch für die pädiatrische HIV-Kohorte erreicht. Die GEPIC-Studie (German Pediatric and Adolescent HIV Cohort) der PAAD zeigte eine nahezu vollständige Behandlungsrate (99,5 %) und ein gutes Therapieansprechen unter den in Deutschland behandelten Kindern und Jugendlichen: Es hatten 91 % eine Viruslast < 50 Kopien/ml [5]. Der Therapieerfolg war altersabhängig: Bei Kleinkindern betrug der Anteil 85,7 %, bei Jugendlichen bei 92,1 %.
Die in Deutschland erhobenen Zahlen sind im internationalen Vergleich beachtlich. In einer britischen Erhebung betrug der Anteil der Kinder und Jugendlichen mit einer Viruslast < 400 Kopien/ml 66 % [1]. Der erreichte Therapieerfolg kann allerdings rasch verloren gehen (Infobox 3).
Infobox 3 Exkurs: HIV-Infektion während der SARS-CoV-2-Pandemie
Der mit hohem Aufwand von Behandler*innen und Familien erreichte Therapieerfolg kann rasch verloren gehen. Eine aktuelle Auswertung von Daten der GEPIC-Erhebung zeigt, dass die Zahl der Behandlungen in den pädiatrischen HIV-Ambulanzen während der durch das „severe acute respiratory syndrome coronavirus 2“ (SARS-CoV-2) ausgelösten Pandemie (01.03.2020–31.05.2021) im Vergleich zum unmittelbar vorausgegangenen Zeitraum (01.12.2018–28.02.2020) um 15 % (p = 0,016) zurückging. Während der Pandemie stieg der Anteil von Patient*innen mit grenzwertigem oder positiven Virusnachweis von 30 % auf 47 % (p = 0,011) an, während die Werte der CD4+-T-Helferzellen um rund 2 % (p = 0,015) abfielen. Der Anstieg der mit einer HIV-Infektion verbundenen Viruslast korrelierte mit den einzelnen Coronawellen und den dabei wirksamen Beschränkungen (u. a. virtueller Schulunterricht). Bemerkenswert war, dass diese pandemiebedingten Entwicklungen ausschließlich bei männlichen Jugendlichen nachweisbar waren (Königs C et al. Auswertung der GEPIC-Dokumentation vor und während der SARS-CoV-2-Pandemie; mündl. Mitteilung, 22.07.2022).
Die Suppression der Virusreplikation geht mit einer Besserung HIV-bedingter Störungen der Entwicklung einher. Unter ART kommt es u. a. zum Aufholwachstum [24], zu einer verbesserten Lungenfunktion [13] und zu einer verbesserten neurologischen Entwicklung [25]. In Deutschland lebende HIV-positive Kinder hatten unter ART einen zu gesunden Gleichaltrigen vergleichbaren neurokognitiven Entwicklungsstand und Intelligenzquotienten [28].
Unerwünschte Arzneimittelwirkungen
Im Vergleich zu den frühen Jahren der ART sind kurz- und langfristige Nebenwirkungen deutlich weniger geworden. Vor 15 Jahren wurden bei 65 % der Jugendlichen Veränderungen des Unterhautfettgewebes (Lipodystrophie) ab dem Tanner-Stadium IV beschrieben [2]. Mithilfe neuer Wirkstoffe kann eine Lipodystrophie weitgehend vermieden werden. Doch es gibt bei den neuen, als besonders gut verträglich geltenden Wirkstoffen neue Profile von unerwünschten Arzneimittelwirkungen, deren Relevanz noch nicht abschließend einzuschätzen ist. Bei Erwachsenen, die mit Tenofoviralafenamid, Dolutegravir oder Bictegravir behandelt wurden, fiel eine signifikante Gewichtszunahme auf [3]. Dieser Effekt konnte inzwischen auch bei Kindern und Jugendlichen in der deutschen GEPIC-Kohorte gezeigt werden [4]. In der Auswertung wurden nur Kinder und Jugendliche mit einem normalen Immunstatus berücksichtigt, um ein Aufholwachstum nicht als pathologisch zu werten. Es wird jetzt darauf zu achten sein, ob die ungewollte Gewichtszunahme die Therapieadhärenz bei Jugendlichen gefährdet.
Umgang mit der Diagnose
Muss die Diagnose verschwiegen werden?
Die HIV-Infektion ist die einzige Erkrankung im Kindesalter, die den betroffenen Kindern regelmäßig verschwiegen wird. Während die Behandlung der HIV-Infektion große Fortschritte gemacht hat und sie nicht mehr den Charakter einer tödlichen Infektion besitzt, ist die Überwindung ihrer Stigmatisierung langsamer. Die Angst vor Ansteckung durch HIV-positive Kinder ist an Kindergärten, Schulen und in Vereinen sowohl bei Eltern anderer Kinder als auch bei Mitarbeiter*innen verbreitet. Ein Bekanntwerden der Diagnose beinhaltet das Risiko der Ausgrenzung bis hin zu Ausschluss und Verweis.
Das Bekanntwerden der Diagnose beinhaltet noch immer das Risiko der Ausgrenzung
Damit Kinder ihre HIV-Diagnose nicht unbedacht zum Ausdruck bringen und eine unkontrollierte Angstreaktion in der Umgebung auslösen, ist es in 2022 immer noch angemessen, den Familien das Verschweigen der Diagnose zu raten. Die Autoren empfehlen, den Kindern durch einen Ersatzbegriff zu erläutern, warum sie behandelt werden, um ihnen eine Einordnung des Grundes ihrer Behandlung zu ermöglichen, und gleichzeitig zu vermeiden, dass in der Umgebung der Verdacht auf ein delikates Geheimnis entsteht. Hier hat die Metapher einer Krankheit der „Körperpolizei“ weite Verbreitung gefunden und in mehr als 20 Jahren zu keinen „Unfällen“ geführt. Einige Eltern gehen allerdings mit der HIV-Diagnose offen nach außen um, ohne dadurch eine Ausgrenzung zu erfahren. Wahrscheinlich ist diese Strategie erfolgreicher, weil das offene und sachliche Ansprechen eine Einordnung der HIV-Infektion als „ungefährlich“ ermöglicht, bevor Ängste aufgrund mangelnden Wissens entstehen.
Diagnoseaufklärung und sexuelle Aktivität
Die HIV-Diagnose kann und soll den Kindern nicht dauerhaft verschwiegen werden. Im Alter zwischen 10 und 12 Jahren sind Kinder in der Lage, das Wissen um ihre eigene HIV-Infektion zu verstehen und es für sich zu behalten. Im Aufklärungsgespräch sollte dem Kind einleitend und unter Wertschätzung mitgeteilt werden, warum es zu diesem Gespräch kommt („Du bist jetzt alt genug, dass wir Dir ein Geheimnis anvertrauen können“), bevor erläutert wird, worin dieses Geheimnis besteht. Aufklärungen sollten vor Beginn der Pubertät geschehen, damit die Diagnosemitteilung nicht zu einem Störfaktor in der turbulenten Phase der sexuellen Entwicklung wird. Die Bedeutung der HIV-Infektion als Gefahrenmoment bei sexueller Aktivität ist nicht mehr gegeben – unter der Voraussetzung einer wirksamen ART. Die Autoren empfehlen weiter nachdrücklich, Präservative zu benutzen, aber nur noch, um Schwangerschaften und eine Ansteckung mit anderen sexuell übertragbaren Krankheiten zu vermeiden.
Versorgungsstruktur in Deutschland
Wegen der Seltenheit der kindlichen HIV-Infektion und der Besonderheiten ihrer Therapie (die Leitlinien umfassen 127 Seiten [8, 9]) findet die Behandlung der rund 400 positiven Kinder und Jugendlichen sowie der exponierten Säuglinge nahezu ausschließlich an Schwerpunktambulanzen von Universitäten und anderen Maximalversorgern statt. Diese Ambulanzen teilen mit den anderen Ambulanzen der spezialärztlichen Versorgung die nichtkostendeckende Finanzierung. Da die HIV-Behandlung von Kindern weitgehend ambulant erfolgt, gibt es auch keine Querfinanzierung aus dem stationären Sektor. Wie bei anderen seltenen Erkrankungen ist der Aufwand zur Fortbildung, bezogen auf die Patientenzahl, erheblich. Wahrscheinlich höher als bei den meisten seltenen Erkrankungen sind die Anteile von Kindern mit nichteuropäischer Herkunft (80 %) und von alleinerziehenden (50 %) oder nicht mehr vorhandenen Eltern (35 %, Zahlen der HIV-Ambulanz an der Medizinischen Hochschule Hannover). Psychosoziale Mitarbeiter*innen sind im ambulanten Sektor nicht finanziert und stehen in Deutschland nur in wenigen Ambulanzen drittmittelfinanziert zur Verfügung. Patientenselbsthilfen, die bei der Vernetzung der betroffenen Familien helfen und öffentlich Spenden einwerben, gibt es aus verständlichen Gründen nicht.
Ausblick und Forschungsbedarf
Kombinationspräparate für eine einmal tägliche Einnahme haben bei Erwachsenen und mittlerweile auch bei Jugendlichen die medikamentöse Therapie sehr vereinfacht. Kinder unter 12 Jahren können von dieser Entwicklung bisher kaum profitieren (Abb. 3). Besonders aufwendig ist die Entwicklung von Arzneimitteln, die von Kindern unter 6 Jahren eingenommen werden können, weil keine geringer dosierten Festkonfektionen verwendet werden können. Gegenwärtig prüft die Europäische Arzneimittelagentur die Zulassung des ersten antiretroviralen Arzneimittels als Kombinationspräparat für Kinder unter 6 Jahren. Es besteht aus einer 3 Wirkstoffe enthaltenden suspendierbaren Tablette. Entwicklungen dieser Art könnten dazu beitragen, dass die 90-90-90-Ziele der WHO auch bei Vorschulkindern erreicht werden.
Mit HIV infizierte Kinder und Jugendliche sehen unverändert einer lebenslangen ART entgegen
Während Behandler und Eltern dankbar auf die Erfolge der ART sehen, wünschen sich HIV-positive Jugendliche v. a., von der Krankheit in Ruhe gelassen zu werden. Kürzlich (für Erwachsene) zugelassene Depotwirkstoffe ermöglichen es, die Behandlung auf Injektionen in 2‑monatigen Abständen zu reduzieren. Wirkstoffe für eine einmal jährliche Injektion sind in der Entwicklung. Realistische Konzepte für eine Heilung sind dagegen weiterhin nicht erkennbar. Die provirale DNA müsste gentechnisch aus jeder infizierten Körperzelle entfernt werden.
Damit sehen HIV-infizierte Kinder und Jugendliche unverändert einer lebenslangen ART entgegen. Eine Forschungsaufgabe wird die Erfassung und ggf. Behandlung möglicher Langzeiteffekte der ART sein. Gegenwärtig wird auch diskutiert, ob die verbleibende Virusreplikation unterhalb der heutigen Nachweisgrenze zu einer Langzeitaktivierung des Immunsystems und einer Störung der Integrität von Endothel- und Epithelverbänden führt [30].
Weiterführende Informationen
Kontakt mit HIV-Behandler*innen: www.kinder-aids.de
Fazit für die Praxis
Die Prävention einer Infektion mit dem „human immunodeficiency virus“ (HIV) bei Kindern setzt die HIV-Testung und die Behandlung Schwangerer voraus.
Werdende Mütter, die HIV-positiv sind, sollten in Kliniken, die im Umgang mit HIV-exponierten Säuglingen erfahren sind, entbunden werden.
Unter der Voraussetzung einer dauerhaft nichtnachweisbaren Virusreplikation ist Stillen durch HIV-positive Mütter möglich.
Die HIV-Infektion der Mutter ist nicht in das Vorsorgeheft des Kindes einzutragen.
Bei Kindern HIV-positiver Mütter ist der HIV-Antikörpertest im ersten Lebensjahr immer positiv und nicht aussagekräftig.
Die HIV-Infektion bei Kindern sollte so früh wie möglich behandelt werden.
Bei Kindern unter 6 Jahren kann die Einnahme von Flüssigarzneimitteln wegen deren schlechten Geschmacks schwierig sein.
Kinder sollten vor der Pubertät über ihre Diagnose aufgeklärt werden.
Von Kindern, die HIV-positiv sind, geht keine Ansteckungsgefahr aus. Sie können uneingeschränkt alle Gemeinschaftseinrichtungen besuchen.
Einhaltung ethischer Richtlinien
Interessenkonflikt
C. Königs gibt an, ein Vortragshonorar von MSD erhalten zu haben. U. Baumann und U. Schulze Sturm geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autor/-innen keine Studien an Menschen oder Tieren durchgeführt. Bei den hier aufgeführten GEPIC-Daten handelt es sich um Originaldaten, erhoben aus pseudonymisierten Registerdaten. Damit wurden in diesem Beitrag Daten verarbeitet, welche im Zusammenhang mit der Behandlung von Menschen erhoben wurden. Für die erhobenen Daten gelten die Genehmigungen der jeweiligen Ethikkommissionen.
Footnotes

QR-Code scannen & Beitrag online lesen
Literatur
- 1.Asad H, Collins IJ, Goodall RL, Crichton S, Hill T, Doerholt K, et al. Mortality and AIDS-defining events among young people following transition from paediatric to adult HIV care in the UK. HIV Med. 2021;22(8):631–642. doi: 10.1111/hiv.13096. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Aurpibul L, Puthanakit T, Lee B, Mangklabruks A, Sirisanthana T, Sirisanthana V. Lipodystrophy and metabolic changes in HIV-infected children on non-nucleoside reverse transcriptase inhibitor-based antiretroviral therapy. Antivir Ther. 2007;12(8):1247–1254. doi: 10.1177/135965350701200811. [DOI] [PubMed] [Google Scholar]
- 3.Bourgi K, Jenkins CA, Rebeiro PF, Palella F, Moore RD, Altoff KN, et al. Weight gain among treatment-naïve persons with HIV starting integrase inhibitors compared to non-nucleoside reverse transcriptase inhibitors or protease inhibitors in a large observational cohort in the United States and Canada. J Int AIDS Soc. 2020;23(4):e25484. doi: 10.1002/jia2.25484. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.GEPIC (2021). Entwicklung von Gewicht und BMI HIV-positiver Kinder und Jugendlicher nach Therapiewechsel. Deutsch-österreichischer AIDS-Konferenz, 26. März 2021
- 5.Braun M. Situation HIV-infizierter Kinder und junger Erwachsener in Deutschland. Frankfurt: Universitätsklinikum der Goethe-Universität; 2022. [Google Scholar]
- 6.Caldwell M, Oxtoby MJ, Simonds RJ. 1994 revised classification system for human immunodeficiency virus infection in children less than 13 years of age; official authorized addenda: human immunodeficiency virus infection codes and official guidelines for coding and reporting ICD-9-CM. MMWR Morb Mortal Wkly Rep. 1994;43(12):1–19. [Google Scholar]
- 7.Cooper ER, Hanson C, Diaz C, Mendez H, Abboud R, Nugent R, et al. Encephalopathy and progression of human immunodeficiency virus disease in a cohort of children with perinatally acquired human immunodeficiency virus infection. Women and Infants Transmission Study Group. J Pediatr. 1998;132(5):808–812. doi: 10.1016/S0022-3476(98)70308-7. [DOI] [PubMed] [Google Scholar]
- 8.Deutsche AIDS-Gesellschaft. Deutsch-Österreichische Leitlinien Zur Antiretroviralen Therapie der HIV-Infektion bei Kindern und Jugendlichen. AWMF Leitlinie 2019, Registernummer 048-011.
- 9.Deutsche AIDS-Gesellschaft e. V. Deutsch-Österreichische Leitlinien Zur HIV-Therapie in der Schwangerschaft und bei HIV-exponierten Neugeborenen. AWMF Leitlinie 2020, Registernummer 055-002.
- 10.Diaz C, Hanson C, Cooper ER, Read JS, Watson J, Mendez HA, et al. Disease progression in a cohort of infants with vertically acquired HIV infection observed from birth: the women and Infants transmission study (WITS) J Acquir Immune Defic Syndr Hum Retrovirol. 1998;18(3):221–228. doi: 10.1097/00042560-199807010-00004. [DOI] [PubMed] [Google Scholar]
- 11.Evans C, Humphrey JH, Ntozini R, Prendergast AJ. HIV-exposed uninfected infants in Zimbabwe: insights into health outcomes in the pre-antiretroviral therapy era. Front Immunol. 2016;7:190. doi: 10.3389/fimmu.2016.00190. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Flynn PM, Taha TE, Cababasay M, Fowler MG, Mofenson LM, Owor M, et al. Prevention of HIV-1 transmission through breastfeeding: efficacy and safety of maternal antiretroviral therapy versus infant nevirapine prophylaxis for duration of breastfeeding in HIV-1-infected women with high CD4 cell count (IMPAACT PROMISE): a randomized, open-label, clinical trial. J Acquir Immune Defic Syndr. 2018;77(4):383–392. doi: 10.1097/QAI.0000000000001612. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Githinji LN, Gray DM, Zar HJ. Lung function in HIV-infected children and adolescents. Pneumonia. 2018;10:6. doi: 10.1186/s41479-018-0050-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Goetghebuer T, Smolen KK, Adler C, Das J, McBride T, Smits G, et al. Initiation of antiretroviral therapy before pregnancy reduces the risk of infection-related hospitalization in human immunodeficiency virus-exposed uninfected infants born in a high-income country. Clin Infect Dis. 2019;68(7):1193–1203. doi: 10.1093/cid/ciy673. [DOI] [PubMed] [Google Scholar]
- 15.Haberl L, Audebert F, Feiterna-Sperling C, Gillor D, Jakubowski P, Jonsson-Oldenbüttel C, et al. Not recommended, but done: breastfeeding with HIV in Germany. AIDS Patient Care STDS. 2021;35(2):33–38. doi: 10.1089/apc.2020.0223. [DOI] [PubMed] [Google Scholar]
- 16.Judd A, Chappell E, Turkova A, Le Coeur S, Noguera-Julian A, Goetghebuer T, et al. Long-term trends in mortality and AIDS-defining events after combination ART initiation among children and adolescents with perinatal HIV infection in 17 middle- and high-income countries in Europe and Thailand: A cohort study. PLoS Med. 2018;15(1):e1002491. doi: 10.1371/journal.pmed.1002491. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Judd A, Le Prevost M, Melvin D, Arenas-Pinto A, Parrott F, Winston A, et al. Cognitive function in young persons with and without perinatal HIV in the AALPHI cohort in england: role of non-HIV-related factors. Clin Infect Dis. 2016;63(10):1380–1387. doi: 10.1093/cid/ciw568. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Labuda SM, Huo Y, Kacanek D, Patel K, Huybrechts K, Jao J, et al. Rates of hospitalization and infection-related hospitalization among human Immunodeficiency virus (HIV)-exposed uninfected children compared to HIV-unexposed uninfected children in the United States, 2007–2016. Clin Infect Dis. 2020;71(2):332–339. doi: 10.1093/cid/ciz820. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Mandelbrot L, Tubiana R, Le Chenadec J, Dollfus C, Faye A, Pannier E, et al. No perinatal HIV-1 transmission from women with effective antiretroviral therapy starting before conception. Clin Infect Dis. 2015;61(11):1715–1725. doi: 10.1093/cid/civ578. [DOI] [PubMed] [Google Scholar]
- 20.Marcus U, Beck N. Infektionen mit dem humanen Immundefizienzvirus bei Kindern in Deutschland, 1999–2016. Monatsschr Kinderheilkd. 2022;170(5):403–411. doi: 10.1007/s00112-020-00865-4. [DOI] [Google Scholar]
- 21.Marcus U. HIV infections and HIV testing during pregnancy, Germany, 1993 to 2016. Eur Surv Bull. 2019;24(48):1–10. doi: 10.2807/1560-7917.ES.2019.24.48.1900078. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Niehues T, Baumann U, Buchholz B, Dünsch D, Edelhäuser M, Funk M, et al. Empfehlungen zur antiretroviralen Therapie bei HIV-infizierten Kindern 2006 – Vollständig überarbeitetes und aktualisiertes Konsensus-Statement der Pädiatrischen Arbeitsgemeinschaft AIDS (PAAD) und der Deutschen Gesellschaft für Pädiatrische Infektiologie (DGPI) Monatsschr Kinderheilkunde. 2022;154(6):563–573. [Google Scholar]
- 23.Rosso R, Vignolo M, Parodi A, Di Biagio A, Sormani MP, Bassetti M, et al. Bone quality in perinatally HIV-infected children: role of age, sex, growth, HIV infection, and antiretroviral therapy. Aids Res Hum Retroviruses. 2005;21(11):927–932. doi: 10.1089/aid.2005.21.927. [DOI] [PubMed] [Google Scholar]
- 24.Traisathit P, Urien S, Le Coeur S, Srirojana S, Akarathum N, Kanjanavanit S, et al. Impact of antiretroviral treatment on height evolution of HIV infected children. BMC Pediatr. 2019;19(1):287. doi: 10.1186/s12887-019-1663-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.van Wyhe KS, Laughton B, Cotton MF, Meintjes EM, van der Kouwe A, Boivin MJ, et al. Cognitive outcomes at ages seven and nine years in South African children from the children with HIV early antiretroviral (CHER) trial: a longitudinal investigation. J Int AIDS Soc. 2021;24(7):e25734. doi: 10.1002/jia2.25734. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26. HIV/Aids: Erste Ziele in Deutschland erreicht. https://unric.org/de/hiv03122021/. Zugegriffen: 22. Juli 2022
- 27.Wagner N, Crisinel P, Kahlert C, Martinez De Tejada B. Breastfeeding for HIV-positive mothers in Switzerland: are we ready to discuss? Rev Med Suisse. 2020;16(712):2050–2054. [PubMed] [Google Scholar]
- 28.Weber V, Radeloff D, Reimers B, Salzmann-Manrique E, Bader P, Schwabe D, et al. Neurocognitive development in HIV-positive children is correlated with plasma viral loads in early childhood. Medicine. 2017;96(23):e6867. doi: 10.1097/MD.0000000000006867. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Wedderburn CJ, Weldon E, Bertran-Cobo C, Rehman AM, Stein DJ, Gibb DM, et al. Early neurodevelopment of HIV-exposed uninfected children in the era of antiretroviral therapy: a systematic review and meta-analysis. Lancet Child Adolesc Health. 2022;6(6):393–408. doi: 10.1016/S2352-4642(22)00071-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Zicari S, Sessa L, Cotugno N, Ruggiero A, Morrocchi E, Concato C, et al. Immune activation, inflammation, and non-AIDS co-morbidities in HIV-infected patients under long-term ART. Viruses. 2019;11(3):1–19. doi: 10.3390/v11030200. [DOI] [PMC free article] [PubMed] [Google Scholar]