Abstract
Objective This study aimed to evaluate the influence of sterilization on the compressive and flexural mechanical strength of hydroxyapatite-based biocomponents obtained through freeze-dried bovine bone, and its association with chitosan.
Methods Freeze-dried bovine bone was processed into 100 μm particles and mixed with 50% of its weight in chitosan. The mixture was packed in metallic molds for preparing the specimens, and sterilized at 127°C using an autoclave for subsequent experimentation. The specimens were subjected to compression and flexion tests following norm 5833 of the International Organization for Standardization (ISO), with 6 × 12 mm cylindrical blocks (for compression tests) and 75 × 10 × 3.3 mm plates (for flexion tests) as samples. The samples were divided into four groups of 20 specimens each, with 10 for compression and 10 for flexion tests. Three groups were sterilized (autoclave, gamma rays, and ethylene oxide), whereas the fourth group (control) was not. The mechanical tests obtained from the different sterilization processes were compared using analysis of variance (ANOVA, p < 0.05), followed by the Tukey multiple comparison test of means, with a 95% confidence interval.
Results The specimens presented mean compressive strengths of 10.25 MPa for the control group and 3.67 MPa, 9.65 MPa, and 9.16 MPa after ethylene oxide, gamma ray, and autoclave sterilization, respectively. Flexion test results showed an average resistance of 0.40 MPa in the control group, and 0.15 MPa, 0.17 MPa, and 0.30 MPa after ethylene oxide, gamma ray, and autoclave sterilization, respectively. There were statistically significant differences observed in the maximum compression of the ethylene oxide-sterilized group compared with that of the control group ( p = 0 . 0002), gamma ray-sterilized ( p = 0.0003), and the autoclaved ( p = 0.0006) groups. There was a statistically significant difference in maximum flexion of the specimens sterilized by gamma rays when compared with the control group ( p = 0.0245). However, low flexural strengths were observed in all specimens.
Conclusion The autoclave sterilization group did not result in statistically significant differences in either compression or flexion strength tests. Thus, the autoclave proved to be the best sterilization option for the hydroxyapatite-based biocomponents in this study.
Keywords: biocompatible materials, chitosan, bone transplantation, hydroxyapatite, mechanical tests
Introduction
Advances in the health area, combined with engineering and other branches of science, mainly motivated by the increase in life expectancy and quality of life, have enabled the development of techniques that seek to reestablish the total or partial functions of the organ or tissue of people who suffered some kind of mutilation or were affected by some disease. 1
As the body ages, joints and bones become fragile, causing pain and restricting certain movements. Thus, orthopedic, dental and veterinary implants have been applied with greater frequency, and many studies are performed to obtain equipment and, in this case, implant materials such as bone that meet these new medical needs. 2
Biomaterials are more relevant in devices that are temporarily or permanently implanted into the human body. These improve the bone repair process in the dental, orthopedic and veterinary areas, mainly in bone fractures and affections, such as: small bone defect in elongation or shortening of extremities, corrective addition or subtraction osteotomies, dental and orthopedic prostheses, tumoral bone defects, and pseudoarthrosis.
These materials differ from others because they contain a combination of mechanical, chemical, physical, and biological properties that make them viable to be used inside the human body. 2 Among the several materials that are constantly being tested and evaluated in the laboratory are hydroxyapatite—with proven osteoconductive function—and chitosan—a biopolymer capable of stimulating the release of cellular cytokine inducers. The combination of these biomaterials consolidates their advantages into a single compound that accelerates the bone regeneration process, especially in cases of fractures with delayed or poor bone union. 3
Hydroxyapatite is one of the most biocompatible ceramics due to its similarity with the minerals that constitute human bones and teeth. 4 It has various advantages such as uniform composition, high biocompatibility, safety—it is not toxic, allergenic, or carcinogenic—and completely controllable microstructure (pore size). 5 Therefore, it has been studied as a potential substitute material for bone and dental implants. 6 Some studies used hydroxyapatite with different proportions of calcium and phosphorus to verify its function in bone regeneration based on its osteoconductive property. 7 8
Kong et al. 9 conducted an in vitro study to investigate the bioactivity of chitosan/hydroxyapatite and observed that the composite presented better bioactivity than chitosan alone. Chitosan is obtained from chitin, a polysaccharide found abundantly in nature, primarily in crustaceans, insects, and fungi. Chitosan is obtained from chitin by a process of chemical or enzymatic deacetylation. 10 The antimicrobial and antioxidant properties of chitosan led to its numerous applications in different fields, including the food industry, cosmetic and personal care products, wastewater management, pharmacological products, and implantable materials. 11 12
In this study, it was determined that we cannot use these biomaterials, hydroxyapatite and chitosan, in the human body without going through the sterilization process, which weakens the mechanical structure of these components, changing their resistance. Based on that, this referent study aims to research the best sterilization method that allows its use without changing the characterization of the material and losing its resistance. Therefore, hypotheses are made regarding the best sterilization method. The chosen methods can be divided into physical (heat, filtration, and radiation) and chemical (phenolic compounds, chlorhexidine, halogens, alcohols, peroxides, ethylene oxide, formaldehyde, glutaraldehyde, and peracetic acid).
Therefore, this study aims to analyze the effect of sterilization on the mechanical strength of lyophilized bovine bone (hydroxyapatite) that was processed and mixed with chitosan at 50% by weight. The specimens from the different groups were submitted to compression and flexion tests according to norm 5833 of the International Organization for Standardization (ISO).
Materials and Methods
For this study, 10 bovine femurs were obtained from animals between 2 and 3 years of age from slaughterhouses in the Southern Region of Brazil. A flowchart of this study's chemical and mechanical processes was prepared to facilitate the execution ( Fig. 1 ).
Fig. 1.
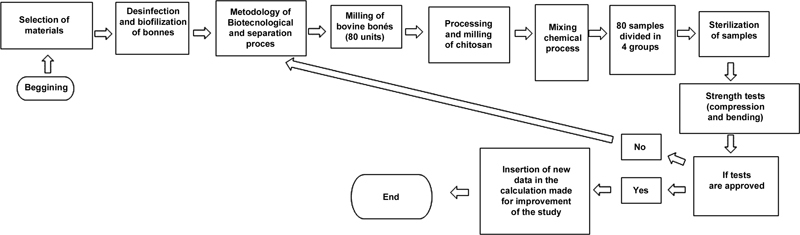
Flowchart of the chemical and mechanical processes in the experimental study.
Initially, the muscular portion of the bones was removed, then cleaned and degreased with hydrogen peroxide and saline solution. Bone fillets were prepared using a band saw, frozen in an ultrafreezer (−70°C), and lyophilized using a LS3000 Terroni (Terroni Elec., São Carlos, SP, Brazil) freeze-drier ( Fig. 2 ). Freeze-drying was performed over a period of 5 days to remove all bone moisture by sublimation. After lyophilization, the bones were cut into blocks, triturated, and ground using a SPLabor Parakeet Mill (SPLabor. Presidente Prudente, SP, Brazil) model 16 at an average rotation of 50 RPM, using 30 Ø8 mm and 80 Ø15 mm spheres ( Fig. 3 ). The grinding was performed for 6 to 12 hours, until it reached a maximum granulometry of 100 µm, as verified using the Mastersizer 3000 (Malvern Panalytical. Malvern, United Kingdom) equipment ( Fig. 4 ).
Fig. 2.

Freeze-dryer Terroni LS 3000 model.
Fig. 3.

Parakeet Mill SPLabor model 16.
Fig. 4.

Mastersizer 3000.
For mixing the inputs, first the materials were weighed in a Shimadzu analytical balance, model AY220. Chitosan was added, with a proportion of 50% in weight, to lyophilized bovine bone in a Marconi industrial mixer (Marconi Ltda. Piracicaba, SP, Brazil) for a period of 3 minutes. To make an alloy, 3.5 mL of distilled water was added for every 10 g of powder. After homogenization, the composite was inserted into metal molds to make the specimens. These were made in standardized templates, manufactured according to ISO 5833. The molds were filled with the bone mixture after applying the release agent WD-40 (Theron Marketing Ltda. Curitiba, PA, Brazil) in the holes to facilitate the subsequent removal of the components. Metallic molds with dimensions of 6 ×12 mm (compression test) and 75 ×10 ×3.3 mm (flexion test) were used ( Fig. 5A and 5B ). Steel 316L plates were used for the lower and upper ends of the molds to facilitate sample extraction. A pachymeter was used to verify the specimens' standardization.
Fig. 5.

( A ) Compression matrix. ( B ) Bending matrix.
The molds were immobile for 7 days and the removal was aided by an extruder tool formed by a handle of clinical grade dental mirror (size no. 5). Thereafter, the samples were stored away from humidity and light, at an average temperature of 23°C, to prevent interference until the application of mechanical loads.
After the calibration process, they were sterilized in four groups of 20 units each using autoclave for the first, gamma rays for the second, and ethylene oxide for the third group.
The results of the mechanical tests obtained from the different sterilization processes performed were compared using analysis of variance (ANOVA), followed by the Tukey multiple comparison test of means, with a 95% confidence interval. Statistical analysis was performed using the Statistica (Statsoft Inc., Tulsa, OK, USA) software, version 7.0. The values considered as statistically significant were p < 0.05.
Autoclave
Autoclaving sterilization was performed in the Sterilization Center of the Hospital São Vicente de Paulo in Passo Fundo, RS, Brazil. The material was sterilized at a water boiling temperature of 121°C for 15 minutes.
We used the 300-L STERIS Industrial Autoclave (Future Health Concepts Inc. Sanford, FL, USA) model SV 3043, following all the protocols required by the Brazilian Health Surveillance Standards.
Gamma Rays
The specimens were sent to Companhia Brasileira de Esterilização (EMBRARAD. Cotia, SP, Brazil) for application of gamma rays using a Linear Cobalt 60 Accelerator (Nordion Inc. Ottawa, ON, Canada) models JS 7500 and JS 9600.
All the controls and documentation of the process were followed, as foreseen by the ISO 9001 standard. They were made with 3 cycle times of 2'18” for the JS 9600 model and 2 cycle times of 7'45” for the JS 7500 model.
Ethylene Oxide
The sterilization method using ethylene oxide gas was performed in a Baumer autoclave (Baumer, São Paulo, SP, Brazil) with a 700 L capacity for 3 to 4 hours of exposure.
The ethylene oxide gas is injected into the chamber once it reaches the pressure and temperature levels adjusted to the exposure time. After exposure to ethylene oxide, the material goes through a vacuum processing phase with nitrogen injection sequence, to completely remove the gas and reduce the risk of poisoning.
Mechanical Tests
The tests were performed using the SCHENK machine (Hangzhou Jizhi Mechatronic Ltd. Hangzhou, China) from the Mechanical Engineering Laboratory of the Universidade de Passo Fundo, in the Southern Region of Brazil.
Of the 80 samples, 40 units were assayed for flexion and 40 for compression. The samples were divided into 60 units that went through a sterilization process, 20 each for autoclave, gamma rays, and ethylene oxide, while the other 20 control samples did not undergo sterilization. The tests were performed according to ISO 5833 ( Fig. 6A ).
Fig. 6.

( A ) Compression test. ( B ) Bending test.
Compression Test
According to ISO 5833, samples for compression testing should be made in cylindrical matrices with dimensions of 6 mm in diameter and 12 mm in length. In our study, the speed of application of compressive force was constant with values between 19.8 and 25.6 mm/min.
Bending Test
The flexural test follows the ISO 5833 standard, which proposes a minimum flexural strength of 1800 MPa and an upper flexural modulus starting at 50 MPa. The standard also suggests recording the flexural values found when the loading was equal to 15N (initial) and 50N ( Fig. 6B ), in addition to the rupture force of the specimen.
Results
In all compression and flexural tests, supraphysiological loads were used to break the specimens.
In the compression tests, there was no statistically significant difference observed between the control and gamma ray-sterilized groups ( p = 0.9634), control and autoclave-sterilized ( p = 0.8170), and gamma rays and autoclave sterilized groups ( p = 0 . 9784). However, there were statistically significant differences observed in the maximum compression of the ethylene oxide-sterilized group compared with the control ( p = 0.0002), gamma ray-sterilized ( p = 0.0003), and the autoclaved ( p = 0.0006) groups. These results indicate that there is a loss of resistance to compression when the biomaterial specimens are sterilized by ethylene oxide. Thus, ethylene oxide is not a good alternative for the sterilization of the composite studied.
Considering the flexural strength, there was no statistically significant difference between specimens from the control and ethylene oxide sterilized groups ( p = 0 . 0764), control and autoclave-sterilized ( p = 0.5816), ethylene oxide-sterilized and autoclaved ( p = 0.4182), ethylene oxide and gamma ray-sterilized ( p = 0.9954), and gamma ray-sterilized and autoclaved groups ( p = 0.3230). However, there was a statistically significant difference in maximum flexion of the specimens sterilized by gamma rays when compared with the control group ( p = 0.0245). Therefore, there was a significant loss of flexural strength when comparing the specimens sterilized by gamma rays with the control group.
Although there were no statistically significant differences observed in the control group to flexural strength, ethylene oxide caused an important loss of strength of the material. However, low flexural strengths were observed in all specimens. Moreover, the autoclave sterilization group did not present statistically significant differences in either compression or flexion strength tests ( Table 1 , Figs. 7 and 8 ).
Table 1. Average values of resistance of specimens sterilized using different processes.
| Sterilization process | Maximum compression (MPa) – Average value (±SD) | Maximum bending (MPa) – Mean value (±SD) |
|---|---|---|
| Control | 10.25 (±3.14) a | 0.40 (±0.24) a |
| Ethylene oxide | 3.67 (±0.88) b | 0.15 (±0.06) a, b |
| Gamma rays | 9.65 (±3.58) a | 0.17 (±0.07) b |
| Autoclave | 9.16 (±2.67) a | 0.30 (±0.17) a, b |
Abbreviation: SD, standard deviation. Notes: a, b Equal letters in the same column indicate values belonging to the same homogeneous group, in which there was no statistically significant difference between its components, according to the Tukey test, at a 95% confidence interval.
Fig. 7.
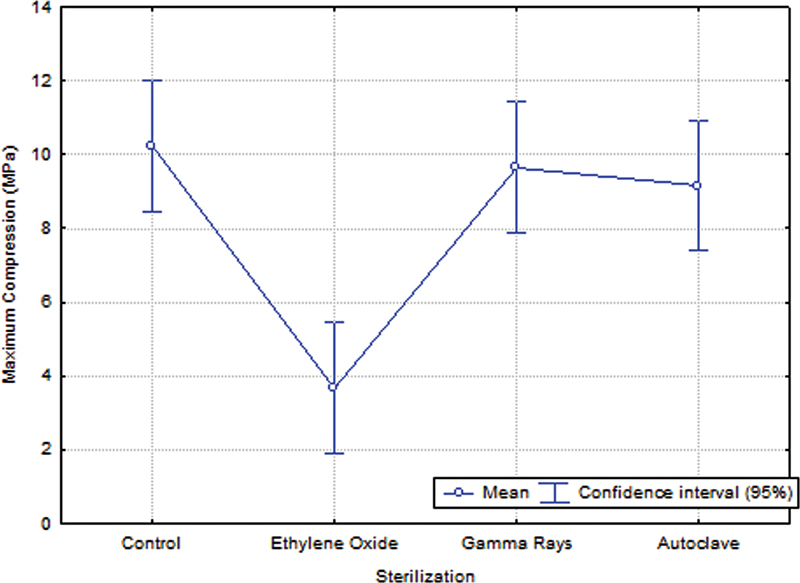
Values of average compressive stress found in the different groups.
Fig. 8.
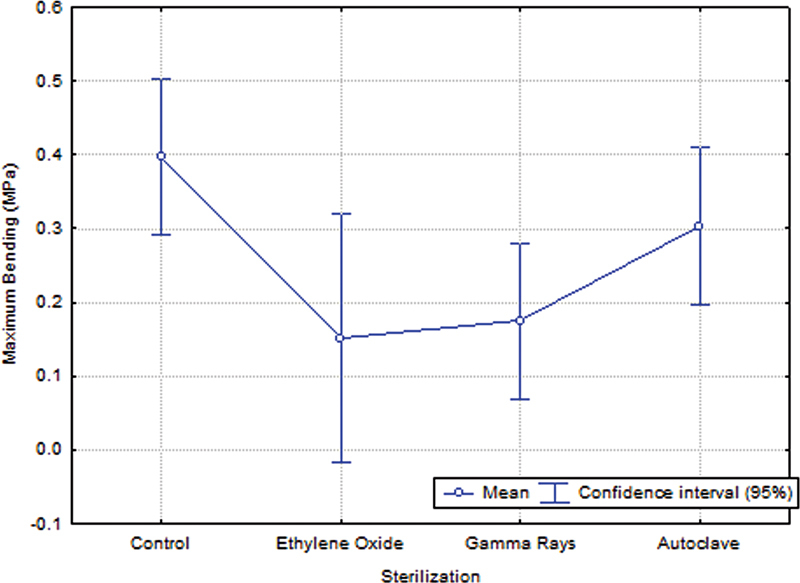
Values of average stress to bending found in the different groups.
Discussion
According to the studies by Somfai et al. 13 (2010) they mention that it is interesting to use a compound of hydroxyapatite and chitosan, combining the osteoconductive characteristic of the first with the biodegradability and mechanical resistance of the second. They reported that after 60 days, complete degradation of the biomaterials was not observed in implants for dogs. However, for Danilchenko et al. 14 (2009), who evaluated that the same composite, implanted in the tibia of rats, had good osteoconductive properties and biodegradation was practically complete, suggesting that the total replacement of the hydroxyapatite/chitosan implant by the neoformed bone tissue inside of bone failure occurs up to the 24th day after implantation. This difference was probably due to the difference between species (the metabolism rate of rats is higher than that of dogs). Fontes 15 (2009), in a study with hydroxyapatite to assess alveolar bone regeneration in dogs, found that at 60 days there was still the presence of the biomaterial. It was concluded that more studies are necessary to evaluate the biodegradation time of this compound.
According to the study by Rolim et al. 16 (2018) there was a more favorable biological response when chitosan was associated with other biomaterials. Therefore, it is important to continue scientific investigations with the use of these natural biopolymers, to better understand their role in cell behavior, as well as to improve manufacturing methodologies that can expand their clinical use in bone regeneration. With ongoing scientific investigations in all relevant areas of knowledge and in biomaterials, it is expected that many bone diseases—such as bone loss due to trauma, bone resection due to tumors, bone aging, as well as skeletal, metabolic, or genetic alterations—will be successfully treated with new bone regeneration protocols.
As reported by Rosito 17 (2006), the freeze-drying process may cause damage to the properties of the bone, especially to resistance. However, other studies using freeze-dried and frozen human and bovine bone grafts in acetabular reconstruction of patients found that the resistance property of these grafts was similar. With the application of compression tests, one can evaluate the resistance of freeze-dried bone and observe whether the mechanical properties are not altered. 17 Another study on freeze-dried bone showed a weakening of the grafts after the tests. 18 Resistance to torque was also applied to freeze-dried bones, showing an alarming loss of 88% of the original resistance. 19 In contrast, there were studies reporting that lower humidity increased the bone's mechanical resistance. 20 Furthermore, it has been demonstrated that freeze-dried human bone presents greater mechanical resistance to compression than fresh bone.
Although the biological aspect is not the focus of this study, it should be noted that Galia's 21 (2004) and Kakiuchi et al.'s 22 (1996) biopsy studies, performed in hip and knee prosthesis reviews, observed signs of integration of hydroxyapatite graft, characterized by the presence of necrotic bone trabeculae, involved by newly formed bone tissue, marrow hematopoietic, and adipose cells.
In his study, Mendes 23 (2006) used metal molds containing 48 cylindrical-shaped holes with dimensions of 6 ×12 mm to prepare bone cement specimens. The author used a universal mechanical test press to which a load cell of 49050 N (5000 kgf) had been attached at the speed of 20 mm/min. In this research, the author used 5 samples of 5 brands of bone cement found in the market. The tests were performed as described in ISO 5833. The tests ended when the cylinder broke or when it exceeded the yield limit. Mendes 23 (2006) demonstrated that all the brands considered in the study were in accordance with the standard, as they presented a compressive strength higher than 80 MPa while the standard requires a minimum value of 70 MPa.
The specimens analyzed in freeze-drying studies are varied, without standardization. In cubic samples, the length varies between 88 and 100 mm, width between 8 and 30 mm, and thicknesses between 2 and 15 mm. 2 5 21 24 Cylindrical samples vary less and are between 8 and 10 mm. 25 26 Based on these studies, we chose different sample sizes to guide the real significance, since this characteristic may influence the outcome of the procedure. Finally, these samples were discarded, since no significant difference was observed in the compression and flexion tests.
To generate a completely dry sample without wasting time, we studied the change in mass every 24 hours of the process and concluded that 120 hours are a satisfactory time. As a final step before the use of the grafts, sterilization is necessary to inhibit any type of antigenicity that may cause damage to patients. 27 One of the first sterilization techniques used ethylene oxide as a substrate. However, over time, its use was substituted due to its toxic effects. 28 Gamma radiation doses equal to 25 kGy have shown to be promising for sterilization of bone bacteria, with no resistance loss; 2 18 27 29 however, there are cases in which the permanence of prions (infectious protein particles) and of the HIV virus could only be eliminated with higher doses of radiation. 27 Loss of mechanical resistance is observed when higher doses of gamma radiation are used. 30 31 The autoclave process, which stipulates the use of temperatures higher than 120°C to exterminate infection risks to the recipient, can be used as an option for sterilization. 2 14 21 26 27 In contrast, this process significantly reduces the mechanical resistance of the bone graft. 14 There is still no consensus on the best method to sterilize lyophilized bones. 25
Additionally, the ethylene oxide sterilization process is normally performed with temperatures in the range of 40°C to 60°C, relative humidity with an optimum point between 40% and 80%, and a gas concentration usually above 400mg/L (optimal point of efficiency) with an average cycle duration from 3 to more than 10 hours. 30 This method was used due to the low temperature in the sterilization process, in which the deformation of the used inputs does not occur.
Comparing previous studies with ours, it was possible to verify that there was no statistically significant difference in flexural strength between specimens from the control and ethylene oxide-sterilized groups ( p = 0.0764), control and autoclave-sterilized ( p = 0 . 5816), ethylene oxide and autoclave sterilized ( p = 0 . 4182), ethylene oxide and gamma ray sterilized ( p = 0 . 9954), and gamma ray and autoclave sterilized groups ( p = 0.3230). However, there was a statistically significant difference in maximum flexion of the specimens sterilized via gamma rays when compared with the control group ( p = 0.0245). Although there was no significant difference in the control group, ethylene oxide caused loss of resistance of the material. Therefore, autoclaving seems to be a better option for sterilization of the studied biomaterial, as it did not result in significant losses of resistance either to compression or flexion.
Conclusion
The present study evaluated the influence of the sterilization processes (autoclave, ethylene oxide, and gamma rays) on biocomponents containing hydroxyapatite and chitosan in the proportion of 50% weight. The different processes of sterilization evaluated can cause different losses of resistance compared with the non-sterilized biomaterial. The autoclave sterilization process did not result in significant loss of resistance to compression and flexion, proving to be a good option for the sterilization of the hydroxyapatite-based biocomponents studied here.
Funding Statement
Suporte Financeiro Não houve suporte financeiro de fontes públicas, comerciais ou sem fins lucrativos.
Financial Support There was no financial support from public, commercial, or non-profit sources.
Conflito de Interesses Os autores declaram não haver conflito de interesses.
Trabalho desenvolvido no Hospital São Vicente de Paulo (HSVP) e Universidade de Passo Fundo (UPF), RS, Brasil.
Trabalho desenvolvido no Hospital São Vicente de Paulo (HSVP) e Universidade de Passo Fundo (UPF), RS, Brasil.
Referências
- 1.Galia C R, Macedo C A, Rosito R, Mello T M, Camargo L M, Moreira L F. In vitro and in vivo evaluation of lyophilized bovine bone biocompatibility. Clinics (São Paulo) 2008;63(06):801–806. doi: 10.1590/S1807-59322008000600016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Owusu-Dompreh F.Aplicação de tecnologias de manufatura rápida ao desenvolvimento integrado de produtos em clínicas e indústrias de manufatura médica [dissertação] Ohio: Youngstown State University; 2013. Disponível em:http://rave.ohiolink.edu/etdc/view?acc_num=ysu1389697786 [Google Scholar]
- 3.Teixeira E R. São Paulo: Artes Médicas; 2001. Superfícies dos implantes: o estágio atual; pp. 63–80. [Google Scholar]
- 4.Fook A CB, Aparecida A H, Fook M VL. Desenvolvimento de biocerâmicas porosas de hidroxiapatita para utilização comoscaffolds para regeneração óssea. Rev Matéria. 2010;15(03):392–399. [Google Scholar]
- 5.Ono I, Tateshita T, Nakajima T. Evaluation of a high density polyethylene fixing system for hydroxyapatite ceramic implants. Biomaterials. 2000;21(02):143–151. doi: 10.1016/s0142-9612(99)00141-6. [DOI] [PubMed] [Google Scholar]
- 6.Pretorius J A, Melsen B, Nel J C, Germishuys P J. A histomorphometric evaluation of factors influencing the healing of bony defects surrounding implants. Int J Oral Maxillofac Implants. 2005;20(03):387–398. [PubMed] [Google Scholar]
- 7.Vital C C, Borges A PB, Fonseca C C et al. Biocompatibilidade e comportamento de compósitos de hidroxiapatita em falha óssea na ulna de coelhos. Arq Bras Med Vet Zootec. 2006;58(02):175–183. [Google Scholar]
- 8.Rezende C MF, Borges A PB, Bernis W O, Melo E G, Nobrega Neto P I. Aspectos clínicos cirúrgicos e radiográficos da hidroxiapatita sintética na diáfise proximal da tíbia de cães. Arq Bras Med Vet Zootec. 1998;50(05):537–545. [Google Scholar]
- 9.Kong L, Yuan G, Lu G, Gong Y, Zhao N, Zhang X. A study on the bioactivity of chitosan/nano-hydroxyapatite composite scaffolds for bone tissue engineering. Eur Polym J. 2006;42(12):3171–3179. [Google Scholar]
- 10.Costa Silva H SR, Santos K SCR, Ferreira E I. Quitosana: derivados hidrossolúveis, aplicações farmacêuticas e avanços. Quim Nova. 2006;29(04):776–785. [Google Scholar]
- 11.Enescu D, Olteanu C E. Chitosan funcionalizado e a sua utilização na investigação farmacêutica, biomédica e biotecnológica. Chem Eng Commun. 2008;195(10):1269–1291. [Google Scholar]
- 12.Cheung C. The future of bone healing. Clin Podiatr Med Surg. 2005;22(04):631–641. doi: 10.1016/j.cpm.2005.07.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Somfai T, Noguchi J, Kaneko H et al. Production of good-quality porcine blastocysts by in vitro fertilization of follicular oocytes vitrified at the germinal vesicle stage. Theriogenology. 2010;73(02):147–156. doi: 10.1016/j.theriogenology.2009.08.008. [DOI] [PubMed] [Google Scholar]
- 14.Danilchenko S N, Maksym P V, Kalinkevich O V, Kalinkevich A N. Chitosan–hydroxyapatite composite biomaterials made by a one step co-precipitation method: preparation, characterization and in vivo tests. J Biol Phys Chem. 2009;9(03):119–126. [Google Scholar]
- 15.Fontes E B. Santa Maria, RS: Medicina Veterinária, Universidade Federal de Santa Maria; 2009. Hidroxiapatita sintética associada ou não à fração total de células mononucleares na regeneração de osso alveolar de cães [dissertação] [Google Scholar]
- 16.Rolim A E, Carvalho F, Costa R, Rosa F P. Chitosan Scaffolds - Physico -Chemical and Biological Properties for Bone Repair. Rev Virtual Quim. 2018;10(02):211–228. [Google Scholar]
- 17.Rosito R. Porto Alegre: Universidade Federal do Rio Grande do Sul, Faculdade de Medicina; 2006. Reconstrução acebular com enxerto ósseo liofilizado humano ou bovino associado a dispositivo de reforço [dissertação] [Google Scholar]
- 18.Fosse L, Rønningen H, Benum P, Lydersen S, Sandven R B. Factors affecting stiffness properties in impacted morsellized bone used in revision hip surgery: an experimental in vitro study. J Biomed Mater Res A. 2006;78(02):423–431. doi: 10.1002/jbm.a.30854. [DOI] [PubMed] [Google Scholar]
- 19.Iturria M, Rodriguez-Emmenegger C, Viegas R et al. Basic design of lyophilization protocols for human bone tissues. Lat Am Appl Res. 2010;40(02):147–151. [Google Scholar]
- 20.Orsi V V, Collares M VM, Nardi N B et al. Osso liofilizado bovino não-desmineralizado com células-tronco mesenquimais para engenharia tecidual: estudo experimental em sítio heterotópico. Rev Soc Bras Cir Craniomaxilofac. 2007;10(04):133–139. [Google Scholar]
- 21.Galia C R. Porto Alegre: Universidade Federal do Rio Grande do Sul; 2004. Enxertos ósseos liofilizados impactados humano e bovino em revisão de artroplastia total de quadril [dissertação] [Google Scholar]
- 22.Kakiuchi M, Ono K, Nishimura A, Shiokawa H. Preparation of bank bone using defatting, freeze-drying and sterilisation with ethylene oxide gas. Part 1. Experimental evaluation of its efficacy and safety. Int Orthop. 1996;20(03):142–146. doi: 10.1007/s002640050051. [DOI] [PubMed] [Google Scholar]
- 23.Mendes R. Rio de Janeiro: Pontifícia Universidade Católica do Rio de Janeiro; 2006. Estudo experimental comparativo dos cimentos ósseos nacionais [dissertação] [Google Scholar]
- 24.Oliveira A CP. Porto Alegre: Universidade Federal do Rio Grande do Sul, Faculdade de Medicina; 2007. Comparação entre enxertos ósseos autólogo, homólogo congelado e homólogo liofilizado em cranioplastia de ratos [dissertação] [Google Scholar]
- 25.Nather A, Thambyah A, Goh J C. Biomechanical strength of deep-frozen versus lyophilized large cortical allografts. Clin Biomech (Bristol, Avon) 2004;19(05):526–533. doi: 10.1016/j.clinbiomech.2004.01.010. [DOI] [PubMed] [Google Scholar]
- 26.Fideler B M, Vangsness C T, Jr, Lu B, Orlando C, Moore T. Gamma irradiation: effects on biomechanical properties of human bone-patellar tendon-bone allografts. Am J Sports Med. 1995;23(05):643–646. doi: 10.1177/036354659502300521. [DOI] [PubMed] [Google Scholar]
- 27.Nguyen H, Morgan D A, Forwood M R. Sterilization of allograft bone: effects of gamma irradiation on allograft biology and biomechanics. Cell Tissue Bank. 2007;8(02):93–105. doi: 10.1007/s10561-006-9020-1. [DOI] [PubMed] [Google Scholar]
- 28.Mikhael M M, Huddleston P M, Zobitz M E, Chen Q, Zhao K D, An K N. Mechanical strength of bone allografts subjected to chemical sterilization and other terminal processing methods. J Biomech. 2008;41(13):2816–2820. doi: 10.1016/j.jbiomech.2008.07.012. [DOI] [PubMed] [Google Scholar]
- 29.Viceconti M, Toni A, Brizio L, Rubbini L, Borrelli A. The effect of autoclaving on the mechanical properties of bank bovine bone. Chir Organi Mov. 1996;81(01):63–68. [PubMed] [Google Scholar]
- 30.Taylor D. Inactivation of the BSE agent. C R Biol. 2002;325(01):75–76. doi: 10.1016/s1631-0691(02)01386-0. [DOI] [PubMed] [Google Scholar]
- 31.Agência Nacional de Vigilância Sanitária (ANVISA) Resolução RDC n. 156, de 11 de agosto de 2016Dispõe sobre o registro, rotulagem e reprocessamento de produtos médicos, e dá outras providências. Disponível em:https://www.saude.mg.gov.br/index.php?option=com_gmg&controller=document&id=896










