Abstract
To investigate the clinical and immunological features of dermatomyositis (DM) complicated with macrophage activation syndrome (MAS). The demographic and clinical characteristics of five patients diagnosed with DM complicated with MAS hospitalized in the Department of Rheumatology and Immunology, Peking University People ' s Hospital from 2011 to 2021 were collected. The results of clinical manifestations, laboratory tests, immunological features, treatments and prognosis were analyzed and summarized. In this study, five female patients in Peking University People's Hospital with an average age of 63.8 (44.0-83.0) years and an average disease duration of 16.1 (1.5-48.0) months. All the patients had typical DM rash (such as heliotrope sign, V/shawl sign or Gottron's sign/papules). They all had muscle involvement (including myalgia or muscle weakness). Two patients had positive myositis-specific antibodies (MSAs), in which case 1 had anti-TIF1-γ antibody and case 5 had anti-NXP-2 antibody. Four patients had interstitial lung disease except case 3. All of the cases developed MAS in the active stage of DM. Common manifestations of MAS in these five patients included high-grade fever, cytopenia, decreased fibrinogen, elevated ferritin and increased soluble CD25. Case 1 presented with neutropenia (0.6×109 /L), thrombocytopenia (26.0×109 /L), hypofibrinogenemia (0.9 g/L), markedly elevated ferritin (26 331.0 μg/L), decreased NK cell activity. Case 2 had anaemia (hemoglobin 81.0 g/L), thrombocytopenia (55.0×109 /L), hypertriglyceridemia (4.7 mmol/L), hypofibrinogenemia (1.2 g/L), elevated ferritin (>100 000.0 μg/L), hemophagocytosis in bone marrow. Case 3 had anaemia (hemoglobin 88 g/L), decreased fibrinogen (1.9 g/L), increased ferritin (>27 759.0 μg/L), splenomegaly, hemophagocytosis in bone marrow. Case 4 suffered from neutropenia(0.3×109 /L), anaemia(hemoglobin 78 g/L), hypertriglyceridemia (4.2 mmol/L), hypofibrinogenemia (0.9 g/L), increased ferritin (>100 000.0 μg/L), and decreased NK cell activity. Case 5 presented anaemia (hemoglobin 60.0 g/L), thrombocytopenia (67.0×109 /L), hypertriglyceridemia (12.7 mmol/L), decreased fibrinogen (1.1 g/L), and elevated ferritin (>923.0 μg/L). All the patients were treated with methylprednisone pulse therapy (200-500 mg) combined with cyclosporine while case 5 received rituximab after methylprednisone pulses. In addition, case 3 also received the combination of mycophenolate mofetil. Case 1 was given etoposide while case 4 was treated with cyclophosphamide and repeated plasmapheresis at the same time. Moreover, intravenous immunoglobulin was added meantime apart from case 3. The condition of four patients improved significantly, nevertheless case 4 experienced recurred pulmonary symptoms and died of respiratory failure. As for complications about infection, case 2 had bacterial infection with high level procalcitonin (PCT) before MAS treatment and condition was improved after empiric antibacterial therapy. Case 3 had cytomegalovirus DNAemia before diagnosis of MAS and viral titer turned negative after ganciclovir therapy. After treatment of MAS, four patients developed cytomegalovirus DNAemia except case 3, in which case 5 was co-infected with bacteria. To sum, DM complicated with MAS is relatively rare, and its patients are of ten in life-threatening condition. Early detection, treatment and prevention of infection during treatment are critical to improve the prognosis.
Keywords: Dermatomyositis, Macrophage activation syndrome, Myositis specific autoantibodies, Infection, Prognosis
皮肌炎(dermatomyositis,DM)是特发性炎性肌病(idiopathic inflammatory myopathy,IIM)的一种亚型,其特征是骨骼肌和皮肤炎性细胞浸润致肌痛、肌无力,典型皮肤表现包括Gottron疹/征、向阳疹、V领征、披肩征等,皮肌炎还常并发间质性肺炎(interstitial lung disease, ILD)、关节炎、心脏疾病和恶性肿瘤等。继发于自身免疫病的噬血细胞性淋巴细胞增多症(hemophagocytic lymphohistiocytosis,HLH)也称为巨噬细胞活化综合征(macrophage activation syndrome,MAS),是一种少见的危及生命的疾病,是由淋巴细胞、巨噬细胞和促炎因子过度激活引起的严重炎症反应,常见的表现包括高热、全血细胞减少、肝脾肿大和凝血功能障碍。在MAS合并的自身免疫病类型中,幼年特发性关节炎(juvenile idiopathic arthritis,JIA)、系统性红斑狼疮(systemic lupus erythematosus,SLE)及成人斯蒂尔病(adult-onset Still’s disease, AOSD)较多见,皮肌炎则鲜有报道。本研究选择北京大学人民医院2011年7月至2021年7月诊断皮肌炎合并MAS的患者共5例进行分析,回顾总结所有患者的临床特点、治疗方案及预后,旨在提高临床医生对这类患者的早期识别能力,以期早期积极强化治疗,改善预后。
1. 病例资料
1.1. 病例选择
选择北京大学人民医院风湿免疫科2011年7月至2021年7月住院治疗的5例诊断明确的皮肌炎并发MAS患者。
皮肌炎诊断标准: 皮肌炎诊断参照1975年Bohan/Peter标准[1]和2017年EULAR/ACR炎性肌病分类标准[2],5例患者均为确诊的皮肌炎。
MAS诊断标准: 参照HLH-2004噬血细胞性淋巴组织细胞增多症的诊断标准[3],需要满足以下8条标准中的5条或以上者: (1)发热;(2)脾大;(3)血细胞减少(2系或2系以上受累): 血红蛋白(hemoglobin, HGB)<90 g/L(<4周的婴儿: HGB<100 g/L),血小板(platelet,PLT)<100×109 /L,中性粒细胞(neutrophil, NEU)<1.0×109 /L;(4)高甘油三酯(triglycerides,TG)血症(空腹TG>3.0 mmol/L),或低纤维蛋白原(fibrinogen,Fbg)血症(Fbg<1.5 g/L);(5)骨髓、脾、淋巴结或肝中发现噬血现象,且无恶变证据;(6)NK细胞活性减低或缺乏;(7)铁蛋白>500.0 μg/L(>3 000.0 μg/L敏感度更高);(8)可溶性CD25(sCD25)>2 400.0 U/mL(依据不同实验室诊断标准的差异调整)。
排除标准: 其他自身免疫性疾病继发MAS患者。
1.2. 临床资料
病例1,女,75岁,2019年4月因“间断发热、皮疹1.5月”入院,伴肌痛,查体可见皮肤破溃、Gottron疹,辅助检查示抗TIF1-γ抗体阳性,胸部CT平扫提示肺间质病变,结合肌活检结果考虑皮肌炎诊断明确,2019年5月患者出现高热,辅助检查示全血细胞减少(NEU 0.6×109 /L,HGB 95 g/L,PLT 26×109 /L)、血脂升高(空腹TG 2.1 mmol/L)、低纤维蛋白原血症(Fbg 0.9 g/L)、铁蛋白明显升高(26 331.0 μg/L)、sCD25升高、NK细胞活性下降,诊断为皮肌炎继发MAS,予甲泼尼龙(500 mg×3 d)冲击,序贯地塞米松(12.5 mg/d),静脉用免疫球蛋白(20 g×5 d)、环孢素(50 mg,2次/d)治疗,同时加用两次依托泊苷(100 mg,1次/周),患者未再出现发热,血常规、纤维蛋白原等指标改善。
病例2,女,83岁,2018年12月因“皮疹4年,加重伴发热3周”入院,伴肌无力,查体可见V领征、Gottron征、向阳疹、躯干广泛红色充血性皮疹,辅助检查示全血细胞减少(NEU 1.5×109/L,HGB 81 g/L,PLT 55×109/L)、高甘油三酯血症(空腹TG 4.7 mmol/L)、低纤维蛋白原血症(Fbg 1.2 g/L)、铁蛋白明显升高(>100 000.0 μg/L)、sCD25升高、NK细胞活性下降、肌酸激酶升高(265 U/L),胸部CT平扫可见肺间质病变,骨髓穿制可见噬血现象,诊断为皮肌炎继发MAS,予甲泼尼龙(200 mg×3 d)冲击,序贯泼尼松(50 mg/d),静脉用免疫球蛋白(20 g×7 d)、环孢素(75 mg,2次/d)治疗,患者症状、临床指标逐渐改善。
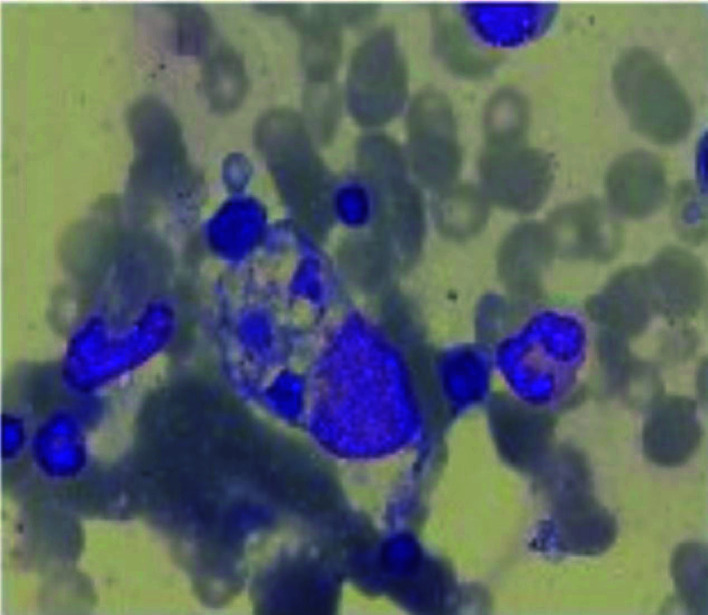
病例3,女,58岁,2021年4月因“发热、皮疹1月”入院,伴肌痛、四肢近端肌无力,查体可见向阳疹、V领征、技工手,辅助检查示血红蛋白下降(HGB 88 g/L)、血脂升高(空腹TG 2.5 mmol/L)、纤维蛋白原降低(Fbg 1.9 g/L)、铁蛋白明显升高(27 759.0 μg/L)、脾大、sCD25升高、NK细胞活性下降,骨髓穿刺可见噬血现象(图 1),诊断为皮肌炎继发MAS,予甲泼尼龙(500、200、500 mg)冲击3 d,序贯地塞米松(15 mg/d)、环孢素(50 mg,2次/d)、吗替麦考酚酯(500 mg,2次/d)治疗,患者症状、临床指标逐渐改善。
图 1.
病例3骨髓涂片可见噬血现象
Hemophagocytosis in bone marrow of case 3
病例4,女,59岁,2016年3月因“皮疹、肌痛1年,发热10天”入院,患者表现为上肢近端肌肉疼痛,查体可见向阳疹、V领征、Gottron征、技工手,辅助检查示全血细胞中两系减低(NEU 0.3×109/L,HGB 78 g/L)、高甘油三酯血症(空腹TG 4.2 mmol/L)、低纤维蛋白原血症(Fbg 0.9 g/L)、铁蛋白明显升高(>100 000.0 μg/L)、sCD25升高、NK细胞活性下降,胸部CT平扫示肺间质病变,诊断为皮肌炎继发MAS,予甲泼尼龙(500 mg×3 d)冲击,序贯泼尼松(50 mg/d),静脉用免疫球蛋白(20 g×5 d)、环孢素(75 mg,2次/d)、环磷酰胺(600 mg,1次/2周)治疗,辅助血浆置换3次,患者复查胸部CT提示肺部病变再次加重,后因呼吸衰竭死亡。
病例5,女,44岁,2021年7月因“皮疹伴肌无力18月,间断腹痛10月,加重2月”入院,患者表现为发热、肌痛、四肢近端肌无力,伴吞咽困难、饮水呛咳及构音障碍,查体可见向阳疹、V领征、披肩征、Gottron征、技工手、甲周红斑、皮下钙化,辅助检查发现全血细胞中两系减低(HGB 60 g/L,PLT 67×109/L)、高甘油三酯血症(空腹TG 12.7 mmol/L)、低纤维蛋白原血症(Fbg 1.1 g/L)、铁蛋白升高(923.0 μg/L)、sCD25升高、肌酸激酶升高(1 198 U/L)、抗NXP-2抗体阳性,胸部CT平扫可见肺间质病变,诊断为皮肌炎继发MAS,予甲泼尼龙(500 mg×3 d)冲击,序贯甲泼尼龙(60 mg,1次/d),静脉用免疫球蛋白(20 g×5 d)、利妥昔单抗(100、200、500、500 mg, 共4次)治疗,患者症状及实验室检查指标较前改善。
1.3. 并发症及预后
5例患者中,病例2在确诊MAS前合并细菌感染和降钙素原(procalcitonin,PCT)明显升高,经验性抗细菌治疗后PCT降至正常,病例3在确诊MAS前血清巨细胞病毒(cytomegalovirus,CMV)脱氧核糖核酸(deoxyribonucleic acid,DNA)阳性,经更昔洛韦抗病毒治疗后转阴。5例患者均经甲泼尼龙冲击治疗,除病例5外均联合环孢素免疫抑制治疗,病例3同时联合吗替麦考酚酯治疗,病例4同时联合环磷酰胺治疗,病例5同时联合利妥昔单抗治疗;除病例3外,其余4例患者均联合静脉用免疫球蛋白治疗;此外,病例1联合依托泊苷进行治疗,病例4进行了3次血浆置换。
5例均在皮肌炎病情活动期出现MAS,治疗过程中,病例1、病例2、病例4、病例5出现不同程度CMV DNA阳性,病例5治疗后同时合并细菌感染。除病例4经治疗后肺部病变仍有进展、最终因呼吸衰竭死亡,余4例患者症状及化验结果均有所改善。
2. 讨论
MAS的发病源于巨噬细胞和T细胞过度激活及细胞因子释放诱发的过度炎症反应综合征,这些细胞因子包括γ-干扰素(interferon γ, IFN-γ)、肿瘤坏死因子(tumor necrosis factor, TNF)-α、白细胞介素(interleukin, IL)-2、IL-1、IL-6、IL-18,以及巨噬细胞集落刺激因子(macrophage colony-stimulation factor, M-CSF)等[4]。成人合并MAS的基础疾病常见SLE (52.3%)、AOSD (26.7%),皮肌炎较少见(仅占6.9%)[5]。皮肌炎继发MAS的危险因素包括感染、皮肌炎本身的高活动度及间质性肺疾病急性加重,Liang等[6]进行的一项单中心研究中,皮肌炎继发MAS和无MAS患者的病死率分别为77.8%和6.5%。
临床医生应警惕皮肌炎患者出现MAS的表现,尤其是难以解释的持续发热,不明原因的血细胞减少(尤其是血小板的减少)、肝脾肿大、持续高铁蛋白血症、高甘油三酯血症等,应考虑为MAS典型体征及进行化验检查,需及时完善骨髓穿刺、sCD25水平及NK细胞活性检测。但这些临床及化验检查异常通常出现在MAS中后期,且易与免疫病自身特点混淆,由此可能导致MAS诊断及治疗延迟。据报道,自身免疫病病程中血小板计数、天冬氨酸氨基转移酶、丙氨酸氨基转移酶、铁蛋白、乳酸脱氢酶、甘油三酯和D-二聚体水平变化>50%可能提示MAS诊断[7],此外结合MAS发病机制,IL-6、IL-18等细胞因子的明显升高,亦有助于MAS的诊断[8]。另外Kostik等[9]在总结JIA合并MAS的早期诊断方案时指出,MAS临床症状常常易受免疫病相关症状干扰,而以下实验室化验≥3项异常是早期诊断MAS的依据,即血小板和白细胞计数降低,天冬氨酸氨基转移酶升高,乳酸脱氢酶升高,低白蛋白,铁蛋白升高,蛋白尿和低纤维蛋白原。Fardet等[10]开发并验证了HScore获得性HLH评分系统,纳入免疫抑制病史及多项实验室指标辅助MAS早期诊断,其诊断特异性可达86%,敏感性93%。如果骨髓未发现噬血现象,并不能排除MAS的诊断,可能需多次行骨髓穿刺检查[4]。MAS诊断方法多针对结缔组织病合并MAS,有学者总结皮肌炎合并MAS一些特殊表现(如非典型临床特征,包括肝功能障碍、中枢神经系统受累等)值得进一步关注;治疗方面,皮肌炎合并MAS经糖皮质激素治疗后初始病情可改善,随后可能出现迅速恶化[11]。此外,抗MDA5抗体阳性相关皮肌炎继发MAS患者可能预后更差,更加需要早期识别MAS迹象,但抗MDA5抗体阳性皮肌炎患者本身更易出现血清铁蛋白水平升高,且升高水平与疾病活动度相关,故抗MDA5抗体阳性皮肌炎患者出现铁蛋白持续升高时需注意皮肌炎病情活动及合并MAS的鉴别[12]。MAS治疗成功的关键在于早期识别,多学科协作,着重治疗原发病及控制炎症。由于发病机制的差异,MAS治疗不同于HLH。2019年成人噬血细胞性淋巴组织细胞增多症的管理专家共识提出,MAS需进行个体化分级治疗,大剂量甲泼尼龙冲击(1 g/d,连续3~5 d)是常用的初始治疗方案,治疗反应欠佳者考虑加用环孢素[2~7 mg/(kg·d)]以及阿那白滞素(2~6 mg/kg)治疗,阿那白滞素是一种重组IL-1受体拮抗剂,已证明在MAS治疗中有效,2019年HLH管理共识中已经被公认为MAS患者的一线治疗用药,共识亦推荐CD20单抗(利妥昔单抗)用于治疗EB病毒(Epstein-Barr virus,EBV)诱发的MAS[13]。此外,其他生物制剂治疗MAS的经验也正在逐步积累,针对IL-18的结合蛋白[14],针对IFN-γ的依玛鲁单抗[15]、鲁索替尼[16]和托法替布[17]等JAK抑制剂及针对IL-6受体的托珠单抗[18]在一些病例报道中成功改善了MAS患者的症状及异常的实验室检查结果。对于病情危重或出现中枢神经系统受累的患者,小剂量应用依托泊苷(50~100 mg/m2)可能有效;同时可考虑应用免疫球蛋白抑制炎症反应,治疗过程中需持续监测患者症状及实验室指标,及时调整治疗方案[13]。Fujita等[19]报道的病例在大剂量激素冲击,加免疫抑制剂基础上行血浆置换治疗,成功治疗了一例抗MDA5抗体阳性皮肌炎并发MAS的患者。Kaieda等[20]报道的病例加用血浆置换清除炎症因子治疗,病情改善。Komiya等[21]报道的病例经糖皮质激素、钙调磷酸酶抑制剂、静脉注射免疫球蛋白和依托泊苷、血浆置换等治疗后仍有发热和高铁蛋白血症,因加用了英夫利昔单抗,发热和高铁蛋白血症逐渐改善。但也有研究报告肌炎患者使用TNF-α抑制剂依那西普和英夫利昔单抗后出现肌酸激酶升高和肌无力加重,因而目前暂不被推荐在肌炎患者中使用[22]。
感染是HLH常见的诱发因素,尤其是CMV及EBV感染[23]。本研究提示MAS治疗过程中感染风险相对较高,特别是CMV等机会感染,这可能同MAS治疗过程中激素冲击、免疫抑制剂引发的免疫功能低下有关,这些机会感染患者经积极有效治疗后感染可以得到有效控制,因此监测细菌、病毒、真菌等感染指标,并进行及时有效的治疗对于改善MAS患者预后至关重要。
综上所述,根据本中心5例病例及相关文献复习,皮肌炎继发MAS患者临床少见,但病情较重,皮肌炎临床工作中应警惕继发MAS,关注实验室指标的动态变化,及时识别继发MAS者,尽早应用糖皮质激素联合免疫抑制剂,辅助血浆置换、生物制剂等治疗,并在治疗过程中严密监测感染相关指标,改善患者预后。
Funding Statement
北京大学人民医院研究与发展基金(RDX2020-03)
Supported by the Research and Development Fund of Peking University People's Hospital (RDX2020-03)
References
- 1.Bohan A, Peter JB. Polymyositis and dermatomyositis (first of two parts) N Engl J Med. 1975;292(7):344–347. doi: 10.1056/NEJM197502132920706. [DOI] [PubMed] [Google Scholar]
- 2.Lundberg IE, Tjarnlund A, Bottai M, et al. 2017 European League Against Rheumatism/American College of Rheumatology classification criteria for adult and juvenile idiopathic inflammatory myopathies and their major subgroups. Ann Rheum Dis. 2017;76(12):1955–1964. doi: 10.1136/annrheumdis-2017-211468. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Henter JI, Horne A, Arico M, et al. HLH-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis. Pediatr Blood Cancer. 2007;48(2):124–131. doi: 10.1002/pbc.21039. [DOI] [PubMed] [Google Scholar]
- 4.Lerkvaleekul B, Vilaiyuk S. Macrophage activation syndrome: Early diagnosis is key. Open Access Rheumatol. 2018;10:117–128. doi: 10.2147/OARRR.S151013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Kumakura S, Murakawa Y. Clinical characteristics and treatment outcomes of autoimmune-associated hemophagocytic syndrome in adults. Arthritis Rheumatol. 2014;66(8):2297–2307. doi: 10.1002/art.38672. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Liang J, Xu D, Sun C, et al. Hemophagocytic lymphohistiocytosis: Prevalence, risk factors, outcome, and outcome-related factors in adult idiopathic inflammatory myopathies. J Rheumatol. 2020;47(10):1532–1540. doi: 10.3899/jrheum.190542. [DOI] [PubMed] [Google Scholar]
- 7.Minoia F, Davi S, Horne A, et al. Clinical features, treatment, and outcome of macrophage activation syndrome complicating systemic juvenile idiopathic arthritis: A multinational, multicenter study of 362 patients. Arthritis Rheumatol. 2014;66(11):3160–3169. doi: 10.1002/art.38802. [DOI] [PubMed] [Google Scholar]
- 8.Tang S, Li S, Zheng S, et al. Understanding of cytokines and targeted therapy in macrophage activation syndrome. Semin Arthritis Rheum. 2021;51(1):198–210. doi: 10.1016/j.semarthrit.2020.12.007. [DOI] [PubMed] [Google Scholar]
- 9.Kostik MM, Dubko MF, Masalova VV, et al. Identification of the best cutoff points and clinical signs specific for early recognition of macrophage activation syndrome in active systemic juvenile idiopathic arthritis. Semin Arthritis Rheum. 2015;44(4):417–422. doi: 10.1016/j.semarthrit.2014.09.004. [DOI] [PubMed] [Google Scholar]
- 10.Fardet L, Galicier L, Lambotte O, et al. Development and validation of the HScore, a score for the diagnosis of reactive hemophagocytic syndrome. Arthritis Rheumatol. 2014;66(9):2613–2620. doi: 10.1002/art.38690. [DOI] [PubMed] [Google Scholar]
- 11.Schulert GS. The storm beneath the storm: MAS-HLH in inflammatory myopathies. J Rheumatol. 2020;47(10):1461–1463. doi: 10.3899/jrheum.191274. [DOI] [PubMed] [Google Scholar]
- 12.Gono T, Kawaguchi Y, Ozeki E, et al. Serum ferritin correlates with activity of anti-MDA5 antibody-associated acute interstitial lung disease as a complication of dermatomyositis. Mod Rheumatol. 2011;21(2):223–227. doi: 10.3109/s10165-010-0371-x. [DOI] [PubMed] [Google Scholar]
- 13.La Rosee P, Horne A, Hines M, et al. Recommendations for the management of hemophagocytic lymphohistiocytosis in adults. Blood. 2019;133(23):2465–2477. doi: 10.1182/blood.2018894618. [DOI] [PubMed] [Google Scholar]
- 14.Canna SW, Girard C, Malle L, et al. Life-threatening NLRC4-associated hyperinflammation successfully treated with IL-18 inhibition. J Allergy Clin Immunol. 2017;139(5):1698–1701. doi: 10.1016/j.jaci.2016.10.022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Gabr JB, Liu E, Mian S, et al. Successful treatment of secondary macrophage activation syndrome with emapalumab in a patient with newly diagnosed adult-onset Still's disease: Case report and review of the literature. Ann Transl Med. 2020;8(14):887. doi: 10.21037/atm-20-3127. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Ahmed A, Merrill SA, Alsawah F, et al. Ruxolitinib in adult patients with secondary haemophagocytic lymphohistiocytosis: An open-label, single-centre, pilot trial. Lancet Haematol. 2019;6(12):e630–e637. doi: 10.1016/S2352-3026(19)30156-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Verweyen E, Holzinger D, Weinhage T, et al. Synergistic signaling of TLR and IFNalpha/beta facilitates escape of IL-18 expression from endotoxin tolerance. Am J Respir Crit Care Med. 2020;201(5):526–539. doi: 10.1164/rccm.201903-0659OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Wu J, Sun L, Tang X, et al. Effective therapy of tocilizumab on systemic juvenile idiopathic arthritis associated refractory macrophage activation syndrome[J]. Mod Rheumatol, 2021[2022-08-01]. https://doi.org/10.1093/mr/roab119.
- 19.Fujita Y, Fukui S, Suzuki T, et al. Anti-MDA5 antibody-positive dermatomyositis complicated by autoimmune-associated hemophagocytic syndrome that was successfully treated with immunosuppressive therapy and plasmapheresis. Intern Med. 2018;57(23):3473–3478. doi: 10.2169/internalmedicine.1121-18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Kaieda S, Yoshida N, Yamashita F, et al. Successful treatment of macrophage activation syndrome in a patient with dermatomyositis by combination with immunosuppressive therapy and plasmapheresis. Mod Rheumatol. 2015;25(6):962–966. doi: 10.3109/14397595.2013.844402. [DOI] [PubMed] [Google Scholar]
- 21.Komiya Y, Saito T, Mizoguchi F, et al. Hemophagocytic syndrome complicated with dermatomyositis controlled successfully with infliximab and conventional therapies. Intern Med. 2017;56(23):3237–3241. doi: 10.2169/internalmedicine.7966-16. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Sasaki H, Kohsaka H. Current diagnosis and treatment of polymyositis and dermatomyositis. Mod Rheumatol. 2018;28(6):913–921. doi: 10.1080/14397595.2018.1467257. [DOI] [PubMed] [Google Scholar]
- 23.Gavand PE, Serio I, Arnaud L, et al. Clinical spectrum and therapeutic management of systemic lupus erythematosus-associated macrophage activation syndrome: A study of 103 episodes in 89 adult patients. Autoimmun Rev. 2017;16(7):743–749. doi: 10.1016/j.autrev.2017.05.010. [DOI] [PubMed] [Google Scholar]