Abstract
目的
比较大剂量环磷酰胺及短间期小剂量环磷酰胺两种方案治疗系统性红斑狼疮(systemic lupus erythematosus,SLE)患者的耐受性。
方法
收集2017年3月至2018年7月期间在全国17个省份24家医院就诊的1 022例SLE患者的基本信息、临床表现、实验室检查结果、不良反应及伴随疾病等。根据静脉输注环磷酰胺的治疗方案分为短间期小剂量环磷酰胺组(short-interval low-dose intravenous cyclophosphamide therapy,SILD IV-CYC,每次400 mg,每2周1次)和大剂量环磷酰胺组(high-dose intravenous cyclophosphamide therapy,HD IV-CYC,每次500 mg/m2体表面积,每月1次),有256例接受大剂量环磷酰胺治疗,506例接受短间期小剂量环磷酰胺治疗,比较两组患者停药原因及治疗过程中的不良反应发生率,另有260例患者因没有规律应用环磷酰胺未纳入两组治疗方案不良反应的比较。此外,377例接受短间期小剂量环磷酰胺治疗和214例接受大剂量环磷酰胺治疗的SLE患者随访到停用环磷酰胺,对其停药原因进行分析。
结果
在所有591例停环磷酰胺的患者中,有199例(33.67%)SLE患者因发生药物相关不良反应停药,238例(40.27%)SLE患者因为病情改善而停用环磷酰胺。大剂量环磷酰胺治疗组的SLE患者中因不良反应停用环磷酰胺的比例为38.79%(83/214),明显高于短间期小剂量环磷酰胺治疗组的30.77%(116/377,P=0.048)。进一步比较506例接受短间期小剂量环磷酰胺治疗和256例接受大剂量环磷酰胺治疗患者的不良反应提示,短间期小剂量环磷酰胺治疗组感染(13.04% vs. 22.27%,P=0.001)、胃肠道反应(17.39% vs. 31.25%,P < 0.001)、骨髓抑制(9.68% vs. 19.92%,P < 0.001)、月经异常(25.18% vs. 39.72%,P=0.001)、脱发(13.44% vs. 19.14%,P=0.039)等不良反应发生率明显低于大剂量环磷酰胺治疗组。
结论
短间期小剂量环磷酰胺方案(SILD方案)治疗SLE的耐受性明显优于大剂量环磷酰胺治疗,患者不良反应的发生率较低。
Keywords: 系统性红斑狼疮, 环磷酰胺, 不良反应
Abstract
Objective
To compare the safety of low-dose cyclophosphamide and high-dose cyclophosphamide in the treatment of systemic lupus erythematosus (SLE).
Methods
A total of 1 022 patients with systemic lupus erythematosus from 24 hospitals in China between March 2017 to July 2018 were enrolled. Their clinical manifestations, laboratory tests, adverse events, reasons for stopping receiving intravenous cyclophosphamide and comorbidities were collected. Among them, 506 SLE patients received short-interval low-dose intravenous cyclophosphamide therapy (SILD IV-CYC, 400 mg every two weeks), and 256 patients underwent high-dose cyclophosphamide therapy (HD IV-CYC, 500 mg/m2 of body surface area every month), the side effects between the two groups were compared, the remaining 260 SLE patients were treated with IV-CYC irregularly. Moreover, a total of 377 patients in SILD IV-CYC group and 214 patients in HD IV-CYC group had medical records of the reasons for stopping recei-ving IV-CYC. The reasons for stopping receiving IV-CYC in these two groups were analyzed.
Results
In this study, only 40.27%(238/591)of the SLE patients stopped receiving intravenous cyclophosphamide for the causes of disease improvement, however, up to 33.67% (199/591) of the patients for the reason of drug-related side effects. There were 83 patients out of 214 (38.79%) with high-dose intravenous cyclophosphamide treatment who stopped receiving IV-CYC for the drug-related side effects, which was significantly higher than that in the low-dose cyclophosphamide group (30.77%, 116/337, P=0.048). Of theses 506 patients in SILD IV-CYC group, 88 (17.39%) patients experienced gastrointestinal reactions, 66 (13.04%) suffered from infections, 49 (9.68%) had myelosuppression and 68 (13.44%) had alopecia, respectively. Among the 256 patients in the HD IV-CYC group, 80 (31.25%) experienced gastrointestinal reactions, 57 (22.27%) suffered from infections, 51 (19.92%) had myelosuppression and 49 (19.14%) had alopecia. Moreover, 71 (25.18%) of 282 female patients with age between 16 to 45 years in SILD IV-CYC group had abnormal menstruation, while menstrual disorder occurred in 39.72% (56/141) patients of HD IV-CYC group. There was no difference of drug-induced hepatic injury, hemorrhagic cystitis and fatigue between the two groups.
Conclusion
Low-dose cyclophosphamide showed a lower prevalence of adverse events than high-dose cyclophosphamide in systemic lupus erythematosus patients.
Keywords: Systemic lupus erythematosus, Cyclophosphamide, Adverse events
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种多系统受累的慢性自身免疫性疾病,严重者可引起肾、神经系统、胃肠道、心、肺等重要脏器损伤,甚至危及生命。环磷酰胺是目前治疗SLE被广泛认可的免疫抑制剂之一[1]。自20世纪70年代以来,美国国立卫生研究院(National Institutes of Health,NIH)进行了一系列糖皮质激素联合环磷酰胺治疗SLE的临床研究,结果表明糖皮质激素联合环磷酰胺治疗优于单用糖皮质激素治疗[2-3],此后,NIH逐步提出了标准化大剂量环磷酰胺冲击治疗(high-dose intravenous cyclophosphamide therapy,HD IV-CYC,每次500 mg/m2体表面积,每月1次)[4]。近些年,欧洲狼疮性肾炎临床研究(The Euro-Lupus Nephritis Trial,ELNT)结果显示, 短间期小剂量(short-interval low-dose intravenous cyclophosphamide therapy,SILD IV-CYC,每次500 mg,每2周1次)环磷酰胺治疗狼疮性肾炎与NIH标准化大剂量环磷酰胺治疗SLE效果相当[5],小剂量环磷酰胺治疗方案逐渐被接受并在临床应用。环磷酰胺改善了SLE患者的预后并有效地减少了疾病的复发[6],被推荐用于治疗重症SLE[7]。同时,环磷酰胺的感染、性腺抑制等副作用也逐渐被关注。本研究回顾性比较大剂量环磷酰胺治疗及短间期小剂量环磷酰胺治疗的不良反应发生情况,为SLE患者选择治疗方案提供重要证据。
1. 资料与方法
1.1. 研究对象
连续纳入2017年3月至2018年7月期间在全国17个省份的24家医院就诊并规律随访的1 137例系统性红斑狼疮患者,所有患者均符合《美国风湿病学会1997年推荐的系统性红斑狼疮分类标准》,并接受过静脉输注环磷酰胺治疗,回顾性分析患者的既往住院及门诊病历资料。115例患者因病例资料不完整被剔除,其余1 022例SLE患者(SILD队列)中,有256例接受大剂量环磷酰胺治疗(每次500 mg/m2体表面积,每月1次),506例接受短间期小剂量环磷酰胺治疗(每次400 mg,每2周1次),另有260例患者因没有规律应用环磷酰胺未纳入两组治疗方案不良反应的比较。此外,有591例患者随访到停用环磷酰胺并对停药原因进行分析,其中377例接受短间期小剂量环磷酰胺治疗,214例接受大剂量环磷酰胺治疗。所有患者环磷酰胺应用的中位时间为6.0(3.0,10.0)个月,其中大剂量环磷酰胺组环磷酰胺应用中位时间为6.0(4.0,8.75)个月,短间期小剂量环磷酰胺组环磷酰胺应用中位时间为6.0(3.0,10.63)个月。本研究获得北京大学人民医院伦理审查委员会批准(批准号:2015PHB004-01),研究对象均签署知情同意书。
1.2. 研究方法
收集患者的基本资料(包括性别、应用环磷酰胺年龄、发病年龄、环磷酰胺应用时程、环磷酰胺累积量)、临床表现(包括狼疮性肾炎、神经精神性狼疮、肺部病变、血液系统受累等)、实验室检查结果(包括白细胞、血红蛋白、血小板、尿白细胞、尿红细胞、尿蛋白、24小时尿蛋白、补体3、补体4、抗双链DNA抗体等)、不良反应(包括感染、胃肠道反应、骨髓抑制、月经改变、肝损伤、乏力、脱发、皮疹、出血性膀胱炎)、用药情况(羟氯喹、感染发生时激素用量、曾使用的免疫抑制剂等)、停药原因及伴随疾病(如糖尿病、高血压、冠心病、高脂血症等)。
1.3. 统计学分析
应用SPSS 20.0软件进行统计分析。连续变量采用M(P25,P75)表示,两组间的差异使用Mann-Whitney U检验进行评估,分类变量采用百分数表示,两组间的差异应用χ2检验或Fisher’s精确检验,P < 0.05为差异有统计学意义。
2. 结果
2.1. SLE患者停用环磷酰胺的原因
40.27%(238/591)的SLE患者因病情改善而停用环磷酰胺,33.67%(199/591)患者因发生药物相关的不良反应而停药。此外,8.29%(49/591)患者因疗效不佳停药,58例(9.82%)患者因依从性差停药,47例(7.95%)患者因其他原因停药。
2.2. 不同剂量环磷酰胺治疗方案的停药原因和停药率比较
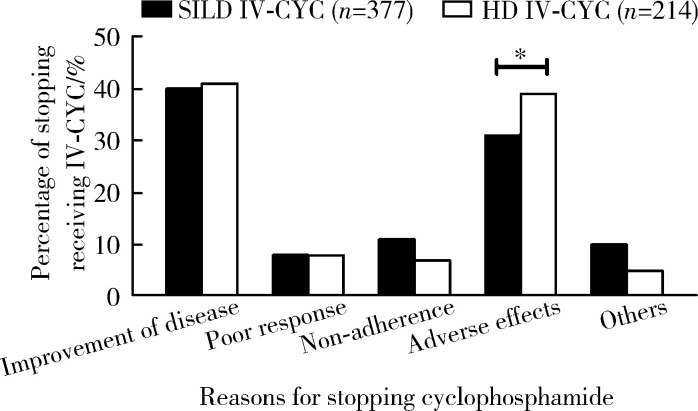
短间期小剂量环磷酰胺治疗组(151/377)因病情改善停用环磷酰胺的发生率与大剂量环磷酰胺组(87/214)相当,分别为40.05%和40.64%。大剂量环磷酰胺组有38.79%(83/214)的患者因发生不良反应停药,而短间期小剂量环磷酰胺组不良反应停药率为30.77%(116/377),大剂量环磷酰胺组发生率明显高于小剂量环磷酰胺组(P=0.048,图 1)。
图 1.
两组应用不同剂量环磷酰胺的SLE患者停药原因比较
Comparison of reasons for stopping intravenous cyclophosphamide in SLE patients with SILD IV-CYC and HD-IV-CYC management
SILD IV-CYC, short-interval low-dose intravenous cyclophosphamide; HD IV-CYC, high-dose intravenous cyclophosphamide; SLE, systemic lupus erythematosus. * P < 0.05.
2.3. 不同剂量环磷酰胺治疗方案的不良反应发生率比较
对506例应用短间期小剂量环磷酰胺治疗及256例应用大剂量环磷酰胺治疗的SLE患者不良反应进行比较,两组SLE患者的临床特点见表 1。
表 1.
两组应用不同剂量环磷酰胺的SLE患者临床特征比较
Characteristics of SLE patients in the study
| Items | SILD IV-CYC(n=506) | HD IV-CYC(n=256) | P value |
| Data were presented as median (interquartile range) or count (percentage). SLE, systemic lupus erythematosus; CYC, cyclophosphamide; NPSLE, neuropsychiatric SLE; SILD IV-CYC, short-interval low-dose intravenous cyclophosphamide; HD IV-CYC, high-dose intravenous cyclophosphamide; HCQ, hydroxychloroquine; SLEDAI, systemic erythematosus disease activity index. | |||
| Female/male, n | 463/43 | 234/22 | 1.000 |
| Age/years, M(P25,P75) | 40 (31, 51) | 39 (30, 50) | 0.699 |
| Age/years, M(P25,P75) | 32 (24, 43) | 31.5 (23.0, 42.0) | 0.421 |
| CYC course/months, M(P25,P75) | 6.0 (3.0, 10.63) | 6.0 (4.0, 8.75) | 0.471 |
| Accumulated dose of CYC/g, M(P25,P75) | 4.8 (2.4, 8.4) | 5.6 (3.2, 8.0) | 0.139 |
| Lupus nephritis, M(P25,P75) | 269 (53.16) | 149 (58.20) | 0.187 |
| NPSLE, M(P25,P75) | 70 (13.83) | 30 (11.72) | 0.414 |
| Respiratory system, M(P25,P75) | 65 (12.85) | 23 (8.98) | 0.115 |
| Hematologic system, M(P25,P75) | 136 (26.88) | 58 (22.66) | 0.206 |
| Diabetes mellitus, M(P25,P75) | 19 (3.75) | 10 (3.91) | 0.918 |
| Hypertension, M(P25,P75) | 92 (18.18) | 60 (23.43) | 0.086 |
| Coronary heart disease, M(P25,P75) | 12 (2.37) | 4 (1.56) | 0.462 |
| Hyperlipemia, M(P25,P75) | 24 (4.74) | 17 (6.64) | 0.273 |
| Glucocorticoid dose/ (mg/d),M(P25,P75) | 20.0 (10.0, 45.0) | 18.75 (10.0, 35.0) | 0.089 |
| HCQ, n (%) | 450 (88.93) | 221 (86.33) | 0.295 |
| SLEDAI, M(P25,P75) | 6.0 (2.0, 9.0) | 6.0 (2.0, 9.0) | 0.316 |
短间期小剂量环磷酰胺治疗组的SLE患者感染、胃肠道反应、骨髓抑制、月经异常、脱发等不良反应发生率(分别为13.04%、17.39%、9.68%、25.18%、13.44%)明显低于大剂量环磷酰胺治疗组的患者(分别为22.27%、31.25%、19.92%、39.72%、19.14%),差异有统计学意义(P < 0.05,表 2)。
表 2.
不同剂量环磷酰胺不良反应发生率的比较
Adverse effects of SILD IV-CYC and HD IV-CYC treatment in SLE patients
| Adverse events | Patients(n=762) | SILD IV-CYC (n=506) | HD IV-CYC (n=256) | P values | |||||
| n | % | n | % | n | % | ||||
| Data were presented as count (percentage). * P < 0.05. a, a total of 423 female patients aged between 16 and 45 were included in 762 patients with SLE; b, a total of 282 female patients with age between 16 and 45 were included in SILD IV-CYC group; c, a total of 141 female patients with age between 16 and 45 were included in HD IV-CYC group. SILD IV-CYC, short-interval low-dose intravenous cyclophosphamide; HD IV-CYC, high-dose intravenous cyclophosphamide; SLE, systemic lupus erythematosus. | |||||||||
| Infection | 123 | 16.14 | 66 | 13.04 | 57 | 22.27 | 0.001* | ||
| Gastrointestinal reaction | 168 | 22.05 | 88 | 17.39 | 80 | 31.25 | < 0.001* | ||
| Myelosuppression | 100 | 13.12 | 49 | 9.68 | 51 | 19.92 | < 0.001* | ||
| Abnormal menstruation | 127a | 30.02 | 71b | 25.18 | 56c | 39.72 | 0.001* | ||
| Drug-induced hepatic injury | 46 | 6.04 | 27 | 5.34 | 19 | 7.42 | 0.253 | ||
| Hemorrhagic cystitis | 4 | 0.52 | 3 | 0.59 | 1 | 0.39 | 1.000 | ||
| Fatigue | 46 | 6.04 | 33 | 6.52 | 13 | 5.08 | 0.429 | ||
| Alopecia | 117 | 15.35 | 68 | 13.44 | 49 | 19.14 | 0.039* | ||
| Rash | 12 | 1.57 | 10 | 1.98 | 2 | 0.78 | 0.355 | ||
3. 讨论
环磷酰胺是一种烷化剂,目前已被广泛应用于SLE的治疗。NIH的标准化大剂量环磷酰胺治疗显著改善了SLE患者的预后,提高了患者生存率。近二十年来逐渐有学者提出短间期小剂量的环磷酰胺冲击治疗SLE的方案,其中ELNT研究结果提示了短间期小剂量的环磷酰胺治疗狼疮性肾炎的疗效与大剂量环磷酰胺疗效相当,并且通过10年的随访发现,短间期小剂量环磷酰胺治疗在死亡率、终末期肾病发生率与大剂量组比较差异无统计学意义[5]。此外,本课题组既往研究结果同样提示,改良的短间期小剂量环磷酰胺治疗在诱导狼疮性肾炎缓解方面的疗效与大剂量环磷酰胺相当[8]。本研究比较了两种环磷酰胺治疗方案下SLE患者的停药原因,发现两组患者因病情改善及疗效不佳而停药的比例相当。
随着越来越多的研究提示两种环磷酰胺治疗方案疗效一致,人们开始更加关注环磷酰胺的不良反应。环磷酰胺常见的不良反应有胃肠道症状、脱发、乏力、肝损伤、感染、性腺抑制、出血性膀胱炎、肿瘤等。既往研究结果表明,短间期小剂量的环磷酰胺治疗不良反应发生率少于大剂量环磷酰胺[5, 8]。环磷酰胺常见的胃肠道症状为恶心、呕吐、纳差等,文献报道SLE患者应用大剂量环磷酰胺胃肠道反应发生率在9.00%~31.82%之间,明显高于小剂量、短间歇环磷酰胺治疗组的0.00%~11.11%[8-9],本研究结果与既往文献报道一致。
本课题组既往随机对照研究结果显示[8],大剂量环磷酰胺治疗组白细胞减少的发生率(19.80%)高于小剂量环磷酰胺组(9.73%)。本研究也提示大剂量环磷酰胺组发生骨髓抑制的风险明显高于小剂量环磷酰胺组(9.68%),进一步证实了小剂量环磷酰胺治疗方案在减少骨髓抑制风险方面的优势。
国内外一系列研究均表明,感染是引起SLE患者死亡位列前三的重要原因之一[10-12]。SLE患者因固有免疫及适应性免疫系统的异常,易于发生感染,激素及免疫抑制剂的应用可进一步增加感染风险[13-14]。环磷酰胺作为SLE危重症患者的重要治疗药物,其感染风险一直备受瞩目。本课题组既往随机对照研究结果提示,小剂量环磷酰胺治疗组感染发生人数少于大剂量环磷酰胺治疗组[8]。ELNT研究结果显示,接受NIH大剂量环磷酰胺治疗的SLE患者感染风险是短间期小剂量治疗组的2倍[5]。此外,一项meta分析也提示,小剂量环磷酰胺治疗组发生严重感染人数低于大剂量环磷酰胺治疗的患者[15]。本研究结果与上述报道一致,并通过多中心大样本研究表明,小剂量环磷酰胺治疗与大剂量治疗方案相比,可以降低患者感染风险。
SLE好发于育龄期女性,而性腺抑制是环磷酰胺另一个重要的不良反应,可引起SLE患者月经量减少、月经周期不规则甚至闭经等,影响患者生育功能,环磷酰胺相关的卵巢早衰风险阻碍了其在SLE患者中的应用[16]。文献报道,环磷酰胺引起卵巢早衰的发生率在11.00%~54.00%之间[17]。本研究结果显示,小剂量环磷酰胺引起月经改变的发生率在25.18%,显著低于大剂量环磷酰胺相关的月经改变,提示小剂量环磷酰胺可以减少治疗相关的性腺抑制。
此外,本研究结果还显示,小剂量环磷酰胺引起脱发的发生率也明显低于接受大剂量环磷酰胺治疗的患者,在引起肝损伤、乏力、皮疹等方面两组患者差异并无统计学意义。环磷酰胺的主要代谢产物丙烯醛对膀胱移行上皮细胞有直接毒性,可引起出血性膀胱炎等不良反应[18],但在本研究中未见发生出血性膀胱炎的患者。
静脉用环磷酰胺目前仍然是SLE患者诱导缓解治疗的重要方案,尤其是危重症SLE患者。本研究通过全国多中心研究进一步证实,短间期小剂量的环磷酰胺治疗在感染、性腺抑制、胃肠道反应、骨髓抑制等方面的不良反应发生率比大剂量环磷酰胺低,因此,对于一些发生相关不良反应风险较大的SLE患者而言,小剂量短间隔的环磷酰胺治疗方案(SILD方案)可作为优先选择的治疗方案。
本研究也存在一定的局限性: (1)激素的应用可能会增加患者感染风险,本研究为回顾性研究,对于激素的累积量、平均剂量等均无法进行准确的分析;(2)既往研究结果表明两种不同剂量的环磷酰胺治疗SLE疗效相当[5, 8],因此,本研究并未对两种不同剂量的疗效数据进行收集及分析;(3)回顾性研究中患者的病例资料可能存在对不良事件的漏记,造成信息偏倚,环磷酰胺的实际不良反应发生率有可能更高。
SILD队列研究组其他参加作者及其工作单位:北京大学人民医院风湿免疫科苗苗、张霞、安媛、何菁、张学武、贾园;贵州中医药大学第二附属医院风湿免疫科姚血明;河南科技大学第一附属医院风湿免疫科王飞、史晓飞;山西省人民医院风湿免疫科崔潞萍;郑州大学第一附属医院风湿免疫科张磊、刘升云;包头医学院第一附属医院风湿免疫科鲁芙爱、骆康凯、赵思萌、王永福;北京大学深圳医院风湿免疫科吴晓、王庆文;宜昌市第一人民医院风湿免疫科刘洪江、宋书林;遵义医学院附属医院风湿免疫科周小园;中国人民解放军联勤保障部队第九六零医院肾内风湿科张晓苹、石书梅;宁夏医科大学总医院风湿免疫科竺红;吴忠市人民医院风湿血液科陈瑶;中国人民解放军联勤保障部队第九四二医院肾内科禹红莲;新乡市中心医院风湿免疫科吴洁、余瑞云、范文强;昆明医科大学第一附属医院风湿免疫科刘爽、徐健;温州医科大学附属乐清医院肾内科陈志斌;北京大学国际医院风湿免疫科石连杰;山西医科大学第二医院风湿免疫科张晓英。
Funding Statement
国家自然科学基金(32000639, 82171772, 81871281)和北京大学人民医院研究与发展基金(RS2020-01)
Supported by the National Natural Science Foundation of China (32000639, 82171772, and 81871281) and Peking University People's Hospital Research and Development Funds (RS2020-01)
Contributor Information
栗 占国 (Zhan-guo LI), Email: Li99@bjmu.edu.cn.
李 茹 (Ru LI), Email: doctorliru123@163.com.
References
- 1.Fanouriakis A, Kostopoulou M, Alunno A, et al. 2019 update of the EULAR recommendations for the management of systemic lupus erythematosus. Ann Rheum Dis. 2019;78(6):736–745. doi: 10.1136/annrheumdis-2019-215089. [DOI] [PubMed] [Google Scholar]
- 2.Donadio JV, Holley KE, Ferguson RH, et al. Treatment of diffuse proliferative lupus nephritis with prednisone and combined prednisone and cyclophosphamide. N Engl J Med. 1978;299(21):1151–1155. doi: 10.1056/NEJM197811232992102. [DOI] [PubMed] [Google Scholar]
- 3.Boumpas DT, Austin HA, Vaughn EM, et al. Controlled trial of pulse methylprednisolone versus two regimens of pulse cyclophosphamide in sever lupus nephritis. Lancet. 1992;340(8822):741–745. doi: 10.1016/0140-6736(92)92292-N. [DOI] [PubMed] [Google Scholar]
- 4.Austin HA, Klippel JH, Balow JE, et al. Therapy of lupus nephritis. Controlled trial of prednisone and cytotoxic drugs. N Engl J Med. 1986;314(10):614–619. doi: 10.1056/NEJM198603063141004. [DOI] [PubMed] [Google Scholar]
- 5.Houssiau FA, Vasconcelos C, D'Cruz D, et al. Immunosuppressive therapy in lupus nephritis: The Euro-Lupus Nephritis Trial, a randomized trial of low-dose versus high-dose intravenous cyclophosphamide. Arthritis Rheum. 2002;46(8):2121–2131. doi: 10.1002/art.10461. [DOI] [PubMed] [Google Scholar]
- 6.Hussenbocus YA, Jin ZY, Pan WY, et al. Low dosage use of cyclophosphamide improves the survival of patients with systemic lupus erythematosus. Clin Rheumatol. 2022;41(7):2043–2052. doi: 10.1007/s10067-022-06117-y. [DOI] [PubMed] [Google Scholar]
- 7.Durcan L, O'Dwyer T, Petri M. Management strategies and future directions for systemic lupus erythematosus in adults. Lancet. 2019;393(10188):2332–2343. doi: 10.1016/S0140-6736(19)30237-5. [DOI] [PubMed] [Google Scholar]
- 8.Zhang XW, Li C, Ma XX, et al. Short-interval lower-dose intravenous cyclophosphamide as induction and maintenance therapy for lupus nephritis: A prospective observational study. Clinical Rheumatol. 2014;33(7):939–945. doi: 10.1007/s10067-014-2590-6. [DOI] [PubMed] [Google Scholar]
- 9.Hanaoka H, Kiyokawa T, Iida H, et al. Comparison of renal response to four different induction therapies in Japanese patients with lupus nephritis class Ⅲ or Ⅳ: A single-centre retrospective study. PLoS One. 2017;12(4):e0175152. doi: 10.1371/journal.pone.0175152. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Thomas G, Mancini J, Jourde-Chiche N, et al. Mortality associa-ted with systemic lupus erythematosus in France assessed by multiple-cause-of-death analysis. Arthritis Rheumatol. 2014;66(9):2503–2511. doi: 10.1002/art.38731. [DOI] [PubMed] [Google Scholar]
- 11.Wang Z, Wang Y, Zhu R, et al. Long-term survival and death causes of systemic lupus erythematosus in China: A systemic review of observational studies. Medicine(Baltimore) 2015;94(17):e794. doi: 10.1097/MD.0000000000000794. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Wang H, Zhou Y, Yu L, et al. Major infection in newly diagnosed systemic lupus erythematosus: An inception cohort study. Lupus Sci Med. 2022;9(1):e000725. doi: 10.1136/lupus-2022-000725. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Ghobadi MZ, Izadi S, Teymoori-RM, et al. Potential role of viral infection and B cells as a linker between innate and adaptive immune response in systemic lupus erythematosus. Immunol Res. 2021;69(2):196–204. doi: 10.1007/s12026-021-09186-4. [DOI] [PubMed] [Google Scholar]
- 14.Mok CC, Tse SM, Chan KL, et al. Effect of immunosuppressive therapies on survival of systemic lupus erythematosus: A propensity score analysis of a longitudinal cohort. Lupus. 2018;27(5):722–727. doi: 10.1177/0961203317739129. [DOI] [PubMed] [Google Scholar]
- 15.Tian M, Song XH, Dong LP, et al. Systematic evaluation of different doses of cyclophosphamide induction therapy for lupus nephritis. Medicine (Baltimore) 2017;96(51):e9408. doi: 10.1097/MD.0000000000009408. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Giambalvo S, Garaffoni C, Silvagni E, et al. Factors associated with fertility abnormalities in women with systemic lupus erythematosus: A systematic review and meta-analysis. Autoimmun Rev. 2022;21(4):103038. doi: 10.1016/j.autrev.2022.103038. [DOI] [PubMed] [Google Scholar]
- 17.Katsifis GE, Tzioufas AG. Ovarian failure in systemic lupus erythematosus patients treated with pulsed intravenous cyclophosphamide. Lupus. 2004;13(9):673–678. doi: 10.1191/0961203304lu2012oa. [DOI] [PubMed] [Google Scholar]
- 18.Ponticelli C, Escoli R, Moroni G. Does cyclophosphamide still play a role in glomerular diseases? Autoimmun Rev. 2018;17(10):1022–1027. doi: 10.1016/j.autrev.2018.04.007. [DOI] [PubMed] [Google Scholar]