Abstract
目的
研究大鼠三叉神经痛模型中三叉神经脊束核尾侧亚核(Sp5C)小胶质细胞激活情况及随时间的变化,并探究其与颌面部疼痛是否具有一致性。
方法
部分结扎大鼠三叉神经的眶下神经(IoN)分支,引起三叉神经慢性压迫性损伤(CCI),构建大鼠三叉神经痛动物模型(IoN-CCI)。手术当天(术前)、术后第1、5、10、15、30天观察大鼠行为学变化,通过电子Von Frey测痛仪测试机械痛阈变化,称重测量体重变化,免疫组织化学染色检测Sp5C中小胶质细胞标志物钙离子结合衔接分子1(Iba-1)表达量变化,并对3种不同形态的小胶质细胞占比进行分析。
结果
行为学变化及机械痛阈变化显示,IoN-CCI组手术同侧颌面部疼痛水平在术后先升高后降低。IoN-CCI组手术同侧Sp5C的Iba-1表达及变形虫样小胶质细胞占比分别在术后第10天及术后第5天达到峰值,至术后第30天基本恢复至与同组对侧一致,该趋势与颌面部疼痛水平变化基本一致。
结论
眶下神经部分结扎构建大鼠三叉神经痛模型引起Sp5C中小胶质细胞激活,激活情况与颌面部疼痛情况基本一致,在第10天达到最高峰。
Keywords: 三叉神经痛, 小胶质细胞, 神经性疼痛, 动物模型
Abstract
Objective
This study aimed to investigate whether the microglia in the spinal trigeminal nucleus caudal part (Sp5C) were activated in a rat model of trigeminal neuralgia and to explore whether the activation level of microglia is consistent with maxillofacial pain level.
Methods
Chronic constriction injury of trigeminal nerve (CCI) was induced by partial ligation of infraorbital nerve (IoN) in rats. The behavioral change of rats observed at D1, D5, D10, D15, and D30 days post-surgery and the change of pain threshold were detected with electronic Von Frey filaments served as an evaluation index of maxillofacial pain. Weight change was measured by weighing. Ionized calcium binding adaptor molecule-1 (Iba-1) expression level of Sp5C at each time point was detected, and three microglia morphological categories were analyzed by immunohistochemical staining.
Results
The changes of behavioral and pain threshold suggested the maxillofacial pain level first increased and then decreased post-surgery in the IoN-CCI group. Both the expressions of Iba-1 and proportion of ameboid morphology in ipsilateral Sp5C increased from D1 and reached their peaks in D10 and D5, respectively. Then, they recovered nearly to the same level with contralateral Sp5C on D30. This trend was consistent with the maxillofacial change.
Conclusion
The model of trigeminal neuralgia in rats constructed by partial ligation of infraorbital nerve can induce the activation of microglia in Sp5C, and the activation level is consistent with maxillofacial pain, which reached its peak at around D10 post-surgery.
Keywords: trigeminal neuralgia, microglia, neuropathic pain, animal model
三叉神经痛是在三叉神经分布区域内突然发作的、持续数秒至数分钟的剧烈疼痛,其发作具有周期性、阵发性等特点,发作间歇无症状[1]–[2]。疼痛由三叉神经末梢以神经冲动的形式传递至三叉神经节,之后进一步传递至延髓的三叉神经核复合体,通过丘脑经由众多脑区调节后传递至大脑皮层而被感知[3]。疼痛发作时,传入三叉神经核的痛觉信息主要由三叉神经脊束核尾侧亚核(spinal trigeminal nucleus caudal part,Sp5C)处理[4],该区小胶质细胞可能出现激活。小胶质细胞是神经系统内固有的重要免疫细胞,对外界刺激反应灵敏,激活后形态发生明显变化以获得更强的吞噬及运动能力,且可以进一步释放促炎因子参与疼痛的发生和维持[5]。周围神经损伤引起的炎性反应以及脊髓背角神经元的过度兴奋性,均为小胶质细胞激活的促进因素[6]。小胶质细胞的激活在神经病理性疼痛中起着关键作用,具体机制仍有待进一步研究[6]。
本研究的目的是通过经口内开口结扎大鼠三叉神经的眶下神经(infraorbital nerve,IoN)分支,引起三叉神经慢性压迫性损伤(chronic constriction injury,CCI),构建大鼠三叉神经痛动物模型(IoN-CCI)后,探索Sp5C中小胶质细胞激活情况及其随时间的变化,同时研究该变化与大鼠颌面部的疼痛是否具有一致性,以期为进一步探索三叉神经痛发病机制提供思路。
1. 材料和方法
1.1. 实验动物及分组
本实验自四川大学动物实验中心购买8~10周龄的雄性Sprague-Dawley大鼠,体重230 g±20 g,无疾患。大鼠在室内温度25 °C±2 °C的空调房内饲养,食物及水源充足。所有大鼠均符合国际动物实验要求,在正常昼夜节律下饲养3 d,待适应环境后进入实验。
本实验共使用了48只大鼠,随机抽取8只作为空白对照组,再随机将剩余40只分为IoN-CCI组及假手术组(各20只),2组中各8只用于行为学观察、机械痛阈测试及体重测量,至第30天处死取材,其余12只分别在术后第1、5、10、15天处死取材。
1.2. 眶下神经部分结扎动物模型的建立
按照体重50 mg·kg−1体重的剂量经由腹腔注射1%戊巴比妥钠溶液麻醉大鼠,将大鼠仰面固定在手术台上,使用开口器打开大鼠上下颌,碘伏消毒后,经上腭第二横皱襞与右侧颊黏膜转折处切开3~5 mm切口,用自制圆头探针经切口探入,紧贴大鼠上颌骨向眶下缘滑动,向内向上勾拉,可见眶下神经(图1A)。IoN-CCI组采用5-0丝线结扎眶下神经,松紧以使其略小于该神经的直径、稍微减缓神经表面的血流通过但不至完全阻滞为宜。两结之间间隔约2 mm。假手术组稍稍勾拉神经组织,不予结扎。随后4-0丝线缝合伤口1针。手术过程如图1所示。
图 1. 眶下神经结扎实验过程.
Fig 1 Experimental process of infraorbital nerve ligation
A:探针勾拉处为眶下神经;B:两结之间间隔2 mm;C:切口缝合1针。
1.3. 体重变化测量
在相同的环境、采用相同的饲料喂养大鼠。在手术当天(术前)及术后第1、5、10、15、30天测量大鼠体重,以空白对照组作为对比,观察口内开口对大鼠体重的影响,辅助判断手术对进食的影响。
1.4. 行为学变化观察
将大鼠放置在下方通气的透明玻璃盒(26 cm×14 cm×16 cm)中,保证大鼠可以在其内自由活动,待其适应至少5 min后,开始观察大鼠。每只大鼠观察10 min,采用计时器计算大鼠搔抓面部(face-grooming)累积时间。搔抓面部时间计入标准为:1)大鼠用前肢触碰手术侧触须垫及鼻尖部分;2)触碰头顶或身体其他部分不计入;3)仅触碰非手术侧不计入。观察人员预先不知道大鼠分组情况。
1.5. 机械痛阈测试
大鼠在进行机械痛阈测试之前5 d适应环境,并在正式测试前3 d进行适应性测验。机械痛阈通过电子Von Frey测痛仪测量。将大鼠放入塑料锥形限制器(长度25 cm)中,于前开口完整露出头部及前肢,保证其头部可以自由摆动(图2)。待大鼠平静5 min后,将纤维丝靠近大鼠眶下神经感受区(触须垫及其附近皮肤),以非常缓慢的速度加力。电脑端显示出随力值逐渐增高的坡形曲线,当大鼠出现头部回缩、偏向对侧或用前肢攻击探针时,加力被动停止,以该曲线的最大力值为痛阈。待大鼠休息3 min后,再次重复上述操作。操作中避免反复戳同一个点造成组织损伤导致测量偏差。每只大鼠进行3次,以最大值为其痛阈。在术前(0 d)和术后第1、5、10、15和30天分别测量IoN-CCI组及假手术组手术同侧及对侧的痛阈,衡量大鼠痛阈变化。
图 2. 电子Von Frey纤维丝测试痛阈.

Fig 2 Pain threshold detection using electronic Von Frey filament
1.6. 实验动物取材
将大鼠按照50 mg·kg−1体重的剂量经由腹腔注射1%戊巴比妥钠溶液麻醉,待麻醉后开胸,灌注针从心间插入左心室,用止血钳固定,再用剪刀剪开右心耳,开始灌注生理盐水,待肝脏变白后继续灌注4%多聚甲醛。灌注完成后,用剪刀剪开颅顶皮层,暴露颅骨,止血钳沿枕骨大孔处将颅骨剥开,去除大脑组织,再轻轻地将小脑剥去,暴露延髓组织,将延髓钝性分离后,切取Sp5C组织(图3)。
图 3. 三叉神经核脊束尾侧核取材位置.
Fig 3 Location of spinal trigeminal nucleus caudal part
A:取材位置对应大鼠脑组织矢状向示意图;B:横截面Sp5C脑区对应位置示意图,截面对应图A及图C所示蓝色竖线位置;C:实拍图。
1.7. 免疫组织化学染色
组织在4%多聚甲醛中固定24~48 h,脱水、透明、浸蜡、石蜡包埋。石蜡标本连续切片(厚5 µm),经脱蜡、水化、抗原修复,冷却至室温后行大鼠小胶质细胞标志物钙离子结合衔接分子1(ionized calcium binding adaptor molecule-1,Iba-1)抗体(1∶1 000,Cell Signaling Technologie公司,美国)免疫组织化学常规染色。光镜下观察Iba-1在Sp5C中的表达和分布情况并拍照。使用Image-J软件进行定量分析。
1.8. 统计分析
采用SPSS 21.0软件进行统计分析。数据符合正态分布则采用均数±标准差表示,组别与时间的影响采用重复测量的双因素方差分析。2组间同时间点比较采用独立样本t检验,3组以上则采用单因素方差分析(one-way ANOVA)对差异进行评估,并采用LSD进行事后比较。P<0.05被认为差异具有统计学意义。
2. 结果
2.1. 大鼠体重变化
空白对照组、假手术组、IoN-CCI组大鼠体重随时间变化见表1。术前及术后第1天3组间体重差异无统计学意义,术后第5天IoN-CCI组体重开始低于空白组,并持续到第30天,差异有统计学意义(均P<0.05)。IoN-CCI组术后第30天的体重为360.50 g±10.06 g,比空白对照组(381.62 g±8.66 g)低5.51%。
表 1. 各组大鼠体重变化.
Tab 1 Changes in body weight of rats of every group
| 时间 | 空白对照组 | 假手术组 | IoN-CCI组 |
| 术前 | 220.63±7.33 | 222.00±6.69 | 224.13±6.79 |
| 术后第1天 | 224.37±7.65 | 221.25±7.07 | 220.12±7.02 |
| 术后第5天 | 255.50±7.04 | 237.25±7.14* | 243.50±9.23* |
| 术后第10天 | 279.50±7.17 | 259.25±6.82* | 249.75±9.92*# |
| 术后第15天 | 328.87±6.91 | 310.37±10.59* | 295.13±10.19*# |
| 术后第30天 | 381.62±8.66 | 385.75±9.28 | 360.50±10.06*# |
注:*P<0.05,与空白对照组在同时间点相比;#P<0.05,与假手术组在同时间点相比。
g,n=8
2.2. 行为学变化
眶下神经部分结扎对大鼠搔抓面部行为的影响见图4。大鼠搔抓面部时间的变化受术后时间(P<0.01)和组别的影响(P<0.01)。对同时间点的搔抓面部时间进行t检验分析,结果显示,IoN-CCI组在术后第1天(P<0.05)、第5天(P<0.01)、第10天(P<0.01)、第15天(P<0.05)、第30天(P<0.05)的搔抓面部时间高于假手术组。
图 4. 各组大鼠搔抓面部时间的变化.

Fig 4 Changes in face-grooming time of rats of every group
*P<0.05,**P<0.01。
2.3. 机械痛阈变化
IoN-CCI组与假手术组机械痛阈的变化见图5。按照眶下神经结扎与否、手术同侧与对侧,总共分为4组,重复测量的双向方差分析表明,机械痛阈受到组别和手术后时间的影响(P<0.01)。术前及术后第5天,各组间差异均无统计学意义,而术后第1、10、15、30天,IoN-CCI组手术同侧痛阈低于假手术组同侧(均P<0.05),尤其第10天最为明显。IoN-CCI组同侧、假手术组同侧及假手术组对侧3组间术后痛阈差异均无统计学意义。
图 5. 各组大鼠颌面部机械痛阈变化.
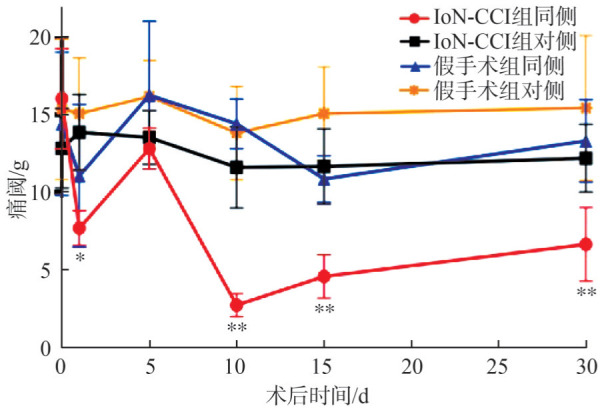
Fig 5 Changes of maxillofacial mechanical pain threshold of rats of every group
*P<0.05,**P<0.01,均与假手术组同侧在同时间点进行比较。
2.4. Sp5C中Iba-1表达变化
图6示通过免疫组织化学标记Iba-1的染色情况。图6A可见,与假手术组相比,IoN-CCI组手术侧Iba-1表达在术后第5~15天增加且集中分布在Sp5C。图6B为IoN-CCI组手术同侧及对侧Iba-1表达比较情况,可见同侧Sp5C区小胶质细胞数量增加且明显激活,对侧则呈零星分布且激活不明显。图6C为假手术组同侧、IoN-CCI组对侧、IoN-CCI组同侧的小胶质细胞激活情况定量分析。重复测量的双因素方差分析表明,Iba-1的表达受组别和时间的影响(均P<0.01)。IoN-CCI同侧的Iba-1表达水平在术后第1天至术后第15天与自身对侧相比差异均有统计学意义(P<0.01),IoN-CCI同侧Iba-1表达水平在术后第10天达到峰值,至第30天与假手术组相比差异无统计学意义。
图 6. 各组小胶质细胞激活情况随时间的变化.
Fig 6 Changes in microglia activation over time of every group
A:IoN-CCI组及假手术组小胶质细胞激活情况随时间变化。B:IoN-CCI组对侧及同侧小胶质细胞激活情况对比(术后第10天)。C:3组间Iba-1阳性面积占比分析,其中,*P<0.05,与假手术组同时间点相比;#P<0.05,与IoN-CCI组对侧同时间点相比。D:小胶质细胞形态,黑色箭头示意分支状,蓝色箭头示意中间状,红色箭头示意变形虫样 免疫组织化学 × 400。E:3组不同类型小胶质细胞构成比随时间变化。
由于小胶质细胞的变化是动态且可循环的,因此根据文献资料[7]–[8]将其大致分为3种:1)分支状:未激活状态,小胶质细胞胞体卵圆,分出细小分支;2)中间状:小胶质细胞胞体狭长,分支变少;3)变形虫样:激活状态,基本不可见细小分支,胞体形状不规则,染色更深。图6D为各组小胶质细胞形态图,黑色箭头示意分支状,蓝色箭头示意中间状,红色箭头示意变形虫状。
图6E为各组小胶质细胞构成比分析结果。IoN-CCI组同侧分支状小胶质细胞占比在术后第5天至第15天低于同时间点IoN-CCI组对侧(均P<0.01),术后第10天、第15天低于同时间点假手术组同侧(均P<0.05),与之对应的是变形虫样小胶质细胞占比增加。IoN-CCI组对侧从始至终并未观察到变形虫样细胞。IoN-CCI组同侧变形虫样细胞在术后第5天至第15天占比在30%~40%之间,术后第30天未见。
3. 讨论
三叉神经的三大分支分别为眼神经、上颌神经以及下颌神经,这三条神经的末端分支分别为眶上神经、眶下神经和下牙槽神经[9]。眶下神经是感觉神经,支配口颌面区的感觉功能,其损伤会引起颌面部的疼痛但不会造成功能障碍[10],且由于解剖学位置的关系,眶下神经结扎更为方便,因此三叉神经痛模型的建立首选对眶下神经进行慢性压迫损伤[11]。而即便是对相对容易的眶下神经进行结扎,操作仍较为复杂[12],过程中可能对眼球造成损伤,建模难度较大。近年来研究[13]–[14]报道了更为简便的建模方式,但手术切口在眶下神经分布区域,对疼痛的评估造成一定的干扰。经口内开口建立眶下神经慢性压迫性损伤的大鼠三叉神经痛动物模型在1997年由Imamura等[15]提出,由于开口在口内,对大鼠的进食造成影响。本研究通过体重辅助判断大鼠营养状况,虽然IoN-CCI组与假手术组、空白对照组有差异,但IoN-CCI组体重自手术后至第30天均在大鼠体重的正常参考值内[16],未出现营养不良。
进行眶下神经部分结扎后,本研究以搔抓面部的持续时间作为自发性疼痛的观察指标,观察到IoN-CCI组与假手术组大鼠在术后第1天搔抓面部持续时间均有升高,但假手术组在术后第5天搔抓面部时间即有下降,第10天基本回到基线,笔者猜测术后搔抓面部时间的短暂增高可能是由于手术的创伤或者术中对眶下神经轻微的勾拉导致的;而IoN-CCI组搔抓面部时间在术后持续升高,至第30天仍高于假手术组。结合大鼠颌面部痛阈变化的检测发现,进行眶下神经部分结扎后,大鼠结扎侧机械痛阈在术后第10天降至最低,后逐渐升高,且在第10天后均明显低于非手术侧以及假手术组。而在术后第1天及第5天,IoN-CCI组及假手术组的同侧痛阈变化趋势基本一致,均为术后第1天降低,术后第5天基本恢复至基线水平,而直到术后第10天组间出现明显差异。笔者推测假手术组术后第1天痛阈降低可能是由于手术创伤引起的炎性反应,而手术组同侧术后第5天出现短暂的痛阈上升可能因为手术创伤导致的局部神经水肿反应[17]。
小胶质细胞激活情况与行为学变化和机械痛阈的变化基本一致。同时,IoN-CCI组同侧小胶质细胞占比也出现了变化:分支状小胶质细胞占比先降低后回升,变形虫样小胶质细胞占比先增高后降低。当神经发生损伤后,受损的神经元及中枢神经系统的疼痛调节通路发生变化,通过大量神经递质及其他物质的作用,导致神经性疼痛的发生和维持[18]。损伤导致痛觉传入神经出现明显的自发性冲动,同时伴随电压门控钠通道mRNA水平增加[19],降低动作电位阈值,二者的共同作用下,引起异位冲动发生并沿着痛觉传递通路到达感觉皮层,引起自发性疼痛[20]–[21]。同时,受损神经支配区域附近的痛觉传入纤维中发生异位神经活动,导致脊髓背角内的兴奋性氨基酸及神经肽释放,引起第二级痛觉神经元突触后变化,诱导神经元过度兴奋,导致原本不足以引起疼痛的触觉刺激均可导致疼痛信号的传递,即痛阈降低。同时,神经损伤可导致小胶质细胞激活,激活后的小胶质细胞形态发生变化,且能分泌大量炎症因子及神经毒性分子,如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素1β(interleukin-1β,IL-1β)、一氧化氮合酶及活性氧等,通过扩大炎症反应参与神经病理性疼痛的发展与维持[22]。小胶质细胞的激活参与疼痛发生和维持的同时,小胶质细胞吞噬能力的提升对机体内环境的稳态的维持和修复也有着重要意义。
本研究通过Iba-1免疫组织化学染色观察到眶下神经结扎引起大鼠同侧Sp5C中小胶质细胞激活,同时探索到激活水平随时间的变化趋势,该趋势与眶下神经结扎引起的颌面部疼痛变化相似,说明通过眶下神经结扎建立的三叉神经痛动物模型可引起三叉神经核小胶质细胞激活,且颌面部疼痛变化趋势与小胶质细胞激活具有一致性。
本研究也有一些不足之处。本实验参考相关文献报道选择8~10周龄大鼠建立IoN-CCI模型,而临床上三叉神经痛患者年龄偏大,若采用中年大鼠(约20个月)会更加贴近临床三叉神经痛的患病人群。同时,本研究缺乏对于小胶质细胞激活机制的研究,后续将会以IoN-CCI为模型探究Sp5C中小胶质细胞的激活模式的相关信号通路,期望找到关键靶点,为安全有效地治疗三叉神经痛提供新的可能。
Funding Statement
[基金项目] 国家自然科学基金(82071147)
Supported by: The National Natural Science Foundation of China (82071147).
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.Sanchez-Larsen A, Sopelana D, Diaz-Maroto I, et al. Assessment of efficacy and safety of eslicarbazepine acetate for the treatment of trigeminal neuralgia[J] Eur J Pain. 2018;22(6):1080–1087. doi: 10.1002/ejp.1192. [DOI] [PubMed] [Google Scholar]
- 2.Zhao H, Wang XH, Zhang Y, et al. Management of primary bilateral trigeminal neuralgia with microvascular decompression: 13-case series[J] World Neurosurg. 2018;109:e724–e730. doi: 10.1016/j.wneu.2017.10.072. [DOI] [PubMed] [Google Scholar]
- 3.Tsai YH, Yuan R, Patel D, et al. Altered structure and functional connection in patients with classical trigeminal neuralgia[J] Hum Brain Mapp. 2018;39(2):609–621. doi: 10.1002/hbm.23696. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Kobayashi M, Nakaya Y. Anatomical aspects of corticotrigeminal projections to the medullary dorsal horn[J] J Oral Sci. 2020;62(2):144–146. doi: 10.2334/josnusd.19-0386. [DOI] [PubMed] [Google Scholar]
- 5.Giordano KR, Denman CR, Dubisch PS, et al. An update on the rod microglia variant in experimental and clinical brain injury and disease[J] Brain Commun. 2021;3(1):fcaa227. doi: 10.1093/braincomms/fcaa227. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Graeber MB. Changing face of microglia[J] Science. 2010;330(6005):783–788. doi: 10.1126/science.1190929. [DOI] [PubMed] [Google Scholar]
- 7.Young K, Morrison H. Quantifying microglia morphology from photomicrographs of immunohistochemistry prepared tissue using imageJ[J] J Vis Exp. 2018(136):57648. doi: 10.3791/57648. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Pomilio C, Gorojod RM, Riudavets M, et al. Microglial autophagy is impaired by prolonged exposure to β-amyloid peptides: evidence from experimental models and Alzheimer's disease patients[J] Geroscience. 2020;42(2):613–632. doi: 10.1007/s11357-020-00161-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Bathla G, Hegde AN. The trigeminal nerve: an illustrated review of its imaging anatomy and pathology[J] Clin Radiol. 2013;68(2):203–213. doi: 10.1016/j.crad.2012.05.019. [DOI] [PubMed] [Google Scholar]
- 10.Zuo X, Ling JX, Xu GY, et al. Operant behavioral responses to orofacial cold stimuli in rats with chronic constrictive trigeminal nerve injury: effects of menthol and capsazepine[J] Mol Pain. 2013;9:28. doi: 10.1186/1744-8069-9-28. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Fink BR, Aasheim G, Kish SJ, et al. Neurokinetics of lidocaine in the infraorbital nerve of the rat in vivo: relation to sensory block[J] Anesthesiology. 1975;42(6):731–736. doi: 10.1097/00000542-197506000-00017. [DOI] [PubMed] [Google Scholar]
- 12.Henry MA, Fairchild DD, Patil MJ, et al. Effect of a novel, orally active matrix metalloproteinase-2 and -9 inhibitor in spinal and trigeminal rat models of neuropathic pain[J] J Oral Facial Pain Headache. 2015;29(3):286–296. doi: 10.11607/ofph.1350. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Ding WH, You ZR, Shen SQ, et al. An improved rodent model of trigeminal neuropathic pain by unilateral chronic constriction injury of distal infraorbital nerve[J] J Pain. 2017;18(8):899–907. doi: 10.1016/j.jpain.2017.02.427. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Dingle A, Zeng WF, Ness JP, et al. Strategies for interfacing with the trigeminal nerves in rodents for bioelectric medicine[J] J Neurosci Methods. 2019;324:108321. doi: 10.1016/j.jneumeth.2019.108321. [DOI] [PubMed] [Google Scholar]
- 15.Imamura Y, Kawamoto H, Nakanishi O. Characterization of heat-hyperalgesia in an experimental trigeminal neuropathy in rats[J] Exp Brain Res. 1997;116(1):97–103. doi: 10.1007/pl00005748. [DOI] [PubMed] [Google Scholar]
- 16.樊 林花, 李 丹, 樊 平花, et al. 清洁级SD大鼠体重和主要脏器系数正常参考值研究及相关性分析[J] 中国卫生检验杂志. 2012;22(4):750–752. [Google Scholar]; Fan LH, Li D, Fan PH, et al. Study and correlation analysis of normal reference range of body weight and the main organs coefficient of clean SD rat[J] Chin J Heal Lab Tech. 2012;22(4):750–752. [Google Scholar]
- 17.Xia L, Liu MX, Zhong J, et al. Pain threshold monitoring during chronic constriction injury of the infraorbital nerve in rats[J] Br J Neurosurg. 2019;33(4):409–412. doi: 10.1080/02688697.2018.1538483. [DOI] [PubMed] [Google Scholar]
- 18.Ananthan S, Benoliel R. Chronic orofacial pain[J] J Neural Transm (Vienna) 2020;127(4):575–588. doi: 10.1007/s00702-020-02157-3. [DOI] [PubMed] [Google Scholar]
- 19.Yatziv SL, Devor M. Suppression of neuropathic pain by selective silencing of dorsal root ganglion ectopia using nonblocking concentrations of lidocaine[J] Pain. 2019;160(9):2105–2114. doi: 10.1097/j.pain.0000000000001602. [DOI] [PubMed] [Google Scholar]
- 20.Catterall WA, Lenaeus MJ, Gamal El-Din TM. Structure and pharmacology of voltage-gated sodium and calcium channels[J] Annu Rev Pharmacol Toxicol. 2020;60:133–154. doi: 10.1146/annurev-pharmtox-010818-021757. [DOI] [PubMed] [Google Scholar]
- 21.Goodwin G, McMahon SB. The physiological function of different voltage-gated sodium channels in pain[J] Nat Rev Neurosci. 2021;22(5):263–274. doi: 10.1038/s41583-021-00444-w. [DOI] [PubMed] [Google Scholar]
- 22.Inoue K, Tsuda M. Microglia in neuropathic pain: cellular and molecular mechanisms and therapeutic potential[J] Nat Rev Neurosci. 2018;19(3):138–152. doi: 10.1038/nrn.2018.2. [DOI] [PubMed] [Google Scholar]





