Abstract
Le mésusage est défini dans le Code de santé publique comme une utilisation intentionnelle et inappropriée d’un médicament ou d’un produit, non conforme à l’autorisation de mise sur le marché ou à l’enregistrement ainsi qu’aux recommandations de bonnes pratiques. On retrouve un acteur ou plus souvent l’interaction de plusieurs acteurs parmi lesquels le patient, ses aidants, le ou les prescripteurs et le ou les dispensateurs. Le mésusage est fréquent, il est source d’effets indésirables médicamenteux dont une partie importante est évitable. Des médicaments initialement prescrits ou dispensés dans le cadre de leur autorisation de mise sur le marché (AMM) peuvent également faire l’objet de dépendance primaire et de détournement. Les entreprises qui exploitent un médicament sur le territoire national déclarent auprès de l’ANSM et mettent en place des mesures pour limiter l’usage non conforme de leurs produits. Récemment, le contexte de la pandémie coronavirus-19 (COVID-19) a mis en lumière l’influence et l’impact sociétal du mésusage médicamenteux. Le constat de l’existence d’un mésusage systémique, de l’impossibilité de proposer des solutions simplistes nous amène à proposer deux principaux axes d’amélioration de l’information et de la formation des usagers et des professionnels de santé sur les médicaments dans le cadre d’interventions multi-facettes : la prévention du mésusage, d’une part, son identification et sa prise en charge, d’autre part.
Mots clés: Mésusage, Médicament, Autorisation de mise sur le marché, Formation, Information
Abréviations
- AMM
autorisation de mise sur le marché
- ANSM
Agence nationale de sécurité des médicaments et des produits de santé
- CRPV
Centre régional de pharmacovigilance
Définitions
Le mésusage (misuse en anglais) peut être globalement défini comme une utilisation intentionnelle et inappropriée, non conforme aux termes de l’autorisation de mise sur le marché (AMM, pour l’indication, la voie d’administration, la posologie ou la durée de traitement) ainsi qu’aux recommandations de bonnes pratiques. Dans leur rapport de 2013 sur la surveillance et la promotion du bon usage du médicament, Begaud et Costagliola définissent le bon usage du médicament comme l’ensemble des conditions garantissant a priori, pour un médicament ou une classe de médicaments, tant au niveau de l’individu que de la société, des rapports bénéfice/risque et coût/efficacité optimisés [1].
La notion globale de mésusage dans la littérature est extrêmement hétérogène [2]. Si l’on restreint l’analyse aux sources s’appliquant en France, il existe des différences subtiles de définition et de cadre, détaillées dans le Tableau 1 . Il convient de distinguer le mésusage d’autres notions proches qui peuvent se recouper. La notion d’erreur médicamenteuse est par essence non intentionnelle. La notion d’abus recouvre l’usage excessif mais peut parfaitement être la conséquence d’une prescription et dispensation conformes [3].
Tableau 1.
Définitions respectives du mésusage, erreur médicamenteuse, abus et surdosage selon les sources.
| Code de santé publique – Article R. 5121-152 [18] | ANSM – Bonnes pratiques de Pharmacovigilance 2018 [19] | EMA – Guideline on good pharmacovigilance practices Annex I (Rev. 4 – 2017) [20] |
|---|---|---|
| Mésusage | Mésusage (misuse) | Misuse of a medicinal product |
| Une utilisation intentionnelle et inappropriée d’un médicament ou d’un produit, non conforme à l’autorisation de mise sur le marché ou à l’enregistrement ainsi qu’aux recommandations de bonnes pratiques | Usage non conforme aux termes de l’autorisation (AMM, ATU, AIP), de l’enregistrement ou d’une recommandation temporaire d’utilisation (RTU) ainsi qu’aux recommandations de bonnes pratiques, intentionnel dans un but médical et inapproprié Usage détourné (misuse for illegal purpose) Consommation d’un médicament à des fins récréatives, ainsi que sa prescription, son commerce ou tout autre utilisation à des fins frauduleuses ou lucratives Usage hors AMM (off label use) Usage non conforme à une autorisation (AMM, ATU, AIP) ou une recommandation temporaire d’utilisation (RTU) ou un enregistrement, intentionnel et approprié au regard des données acquises de la science |
Situations where a medicinal product is intentionally and inappropriately used not in accordance with the terms of the marketing authorisation Misuse of a medicinal product for illegal purposes Misuse for illegal purposes is misuse with the additional connotation of an intention of misusing the medicinal product to cause an effect in another person. This includes, amongst others: the sale, to other people, of medicines for recreational purposes and use of a medicinal product to facilitate assault |
| Off-label use | ||
| Situations where a medicinal product is intentionally used for a medical purpose not in accordance with the terms of the marketing authorization Examples include the intentional use of a product in situations other than the ones described in the authorised product information, such as a different indication in terms of medical condition, a different group of patients (e.g. a different age group), a different route or method of administration or a different posology. The reference terms for off-label use are the terms of marketing authorisation in the country where the product is used |
||
| Erreur médicamenteuse | Erreur médicamenteuse | Medication error |
| Une erreur non intentionnelle d’un professionnel de santé, d’un patient ou d’un tiers, selon le cas, survenue au cours du processus de soin impliquant un médicament ou un produit de santé mentionné à l’article R. 5121-150, notamment lors de la prescription, de la dispensation ou de l’administration | Omission ou réalisation non intentionnelle d’un acte au cours du processus de soins impliquant un médicament, qui peut être à l’origine d’un risque ou d’un évènement indésirable pour le patient. L’erreur médicamenteuse peut être avérée ou potentielle (interceptée avant l’administration au patient) | An unintended failure in the drug treatment process that leads to, or has the potential to lead to, harm to the patient (see EMA-PRAC Good Practice Guide on Recording, Coding, Reporting and Assessment of Medication Errors, 23 October 2015) |
| Abus | Abus de médicament | Abuse of a medicinal product |
| Un usage excessif intentionnel, persistant ou sporadique, de médicaments ou de produits mentionnés à l’article R. 5121-150, accompagné de réactions physiques ou psychologiques nocives | Usage excessif, intentionnel, persistant ou sporadique de médicaments, accompagné de réactions physiques ou psychologiques nocives | Persistent or sporadic, intentional excessive use of medicinal products which is accompanied by harmful physical or psychological effects [DIR 2001/83/EC Art 1(16)] |
| Surdosage | Surdosage | Overdose |
| Administration d’une quantité de médicament ou de produit, quantité par prise ou cumulée supérieure à la dose maximale recommandée par le résumé des caractéristiques du produit mentionné à l’article R. 5121-1 | Administration d’une quantité de médicament ou de produit, quantité par prise ou cumulée, supérieure à la dose maximale recommandée par le RCP. En pratique, il s’agit d’une exposition aboutissant à des concentrations plasmatiques élevées. Il peut s’agir d’une prise excessive (intentionnelle ou accidentelle) d’un médicament | Administration of a quantity of a medicinal product given per administration or cumulatively which is above the maximum recommended dose according to the authorised product information When applying this definition, clinical judgement should always be applied |
Cadre général
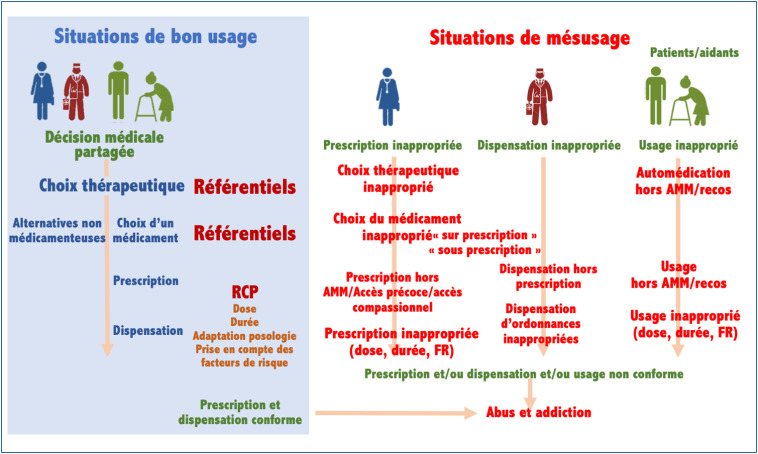
Le mésusage d’un médicament implique différents paramètres représentés schématiquement dans la Fig. 1 . On retrouve un ou plus souvent l’interaction de plusieurs acteurs parmi lesquels le patient, ses aidants, le ou les prescripteurs et le ou les dispensateurs ; une intention (l’absence d’intentionnalité étant caractéristique de l’erreur médicamenteuse), et l’objectif pour le patient (thérapeutique ou non). Ceci se situe dans un contexte dans lequel le mésusage du médicament se produit. Ce contexte va dépendre de l’existence ou non de référentiels de choix d’une thérapeutique médicamenteuse ou non médicamenteuse selon la condition clinique du patient, de la conformité au résumé des caractéristiques du produit en termes de dose, de durée, et d’adaptation posologique si la condition existe (exemple des prescriptions hors AMM en pédiatrie). Enfin, la prise en compte des facteurs de risque d’iatrogénie (insuffisance rénale, …) est un élément majeur à intégrer.
Figure 1.
Représentation graphique de la complexité des situations possibles de mésusage et des acteurs impliqués Sur la gauche est simplifié un usage « approprié » basé sur des référentiels des autorités sanitaires (HAS, ANSM) ou de sociétés savantes, et cohérent avec les résumés des caractéristiques des produits. Sur la droite sont identifiées les différentes situations de mésusage avec l’identification des acteurs. Adapté d’après [1], [2], [24]. AMM : autorisation de mise sur le marché ; FR : facteur de risque ; RCP : résumé des caractéristiques du produit.
Bilan de l’existant
La prescription hors AMM est fréquente, estimée à 20 % des prescriptions en Europe et aux USA [4]. La France est plutôt un mauvais élève dans l’Union européenne, se classant dans une étude de la Caisse nationale de l’Assurance maladie en tête pour 6 des 9 classes étudiées en comparaison avec l’Allemagne, l’Espagne, l’Italie et le Royaume-Uni [5]. Si l’on prend l’exemple des psychotropes, l’existence d’un mésusage est fréquente et facile à objectiver. La France est en Europe au 3e rang de la consommation d’hypnotiques et au 2e rang de la consommation d’anxiolytiques [6]. En 2015, la France se situe au 2e rang de la consommation de benzodiazépines, derrière l’Espagne, les états les moins consommateurs étant l’Allemagne et le Royaume-Uni. Cependant la consommation européenne a diminué de 5,1 % entre 2012 et 2015 alors qu’elle a baissé de 10 % en France sur la même période. Alors qu’en France 1/3 des personnes utilisent au moins un psychotrope au cours de leur vie, moins d’un tiers de ceux présentant un épisode dépressif majeur était traité par antidépresseur selon les recommandations [7], avec plus de 80 % des hypnotiques/anxiolytiques prescrits plus de 3 mois chez les sujets de plus de 65 ans [8]. Ainsi, bien que la prescription de psychotropes soit fréquente en France, une partie importante n’entre pas dans un bon usage.
Notion d’évitabilité
Il n’existe pas à ce jour de définition consensuelle d’un effet indésirable médicamenteux évitable ni d’outil validé pour mesurer l’évitabilité. Dans le cadre d’une enquête menée sur les effets indésirables rapportés au Centre régional de pharmacovigilance (CRPV) de Tours de novembre 2002 à novembre 2003 [9], la prescription a été considérée comme inappropriée pour 32 % des médicaments impliqués, correspondant à 45 % des patients. Ces effets indésirables médicamenteux ont été considérés comme totalement évitables chez 9 %, partiellement évitables chez 8 % des cas et inévitables chez 83 % des patients.
En utilisant la même méthodologie, le réseau français des 31 centres régionaux de pharmacovigilance a mené une étude prospective multicentrique sur un échantillon tiré au sort de 141 services de court séjour de spécialités médicales d’établissements publics hospitaliers en France métropolitaine, concernant des patients pris en charge entre janvier et mai 2018. Dans ce rapport IATROSTAT publié en novembre 2021 [10], la proportion d’hospitalisations liée à un effet indésirable médicamenteux était de 8,5 % en moyenne, avec une augmentation en fonction de l’âge pour atteindre 10,6 % des plus de 65 ans. L’extrapolation de ces résultats a permis aux auteurs d’estimer à 212 500 le nombre incident annuel d’hospitalisations liées à un effet indésirable médicamenteux dans les services court séjour de spécialités médicales du secteur public hospitalier en France métropolitaine. Le taux de mortalité après une hospitalisation pour un effet indésirable médicamenteux, après un mois de suivi, était estimé à 1,3 %, soit environ 2760 décès par an en France. L’effet indésirable médicamenteux a été jugé évitable dans 16,1 % des cas des patients hospitalisés [10]. Les principales situations de non-conformité étaient le non-respect de la dose ou de la durée d’utilisation (27,9 %), d’une mise en garde (23,2 %), ou d’une précaution d’emploi (18,6 %) du médicament impliqué dans l’effet indésirable médicamenteux. Il n’y avait aucun cas de transgression d’une contre-indication. Il convient en outre de relever que dans 11,6 % des situations de non-conformité, l’automédication inappropriée et le mésusage par le patient étaient en cause.
Notions d’abus et addiction
Le réseau français d’addictovigilance a pour objectif de surveiller toutes les substances psychoactives à potentiel d’abus, y compris les médicaments et leurs conséquences sanitaires chez l’homme. Créé en 1990 autour d’un réseau de centres régionaux d’addictovigilance couvrant l’ensemble du pays, ces pharmacologues experts en addictovigilance ont développé une interface avec différents partenaires (médecins, pharmaciens, toxicologues, structures spécialisées en addictologie…) et mis en œuvre plusieurs outils originaux complémentaires de la notification spontanée. Une telle approche multidimensionnelle incluant une surveillance proactive par ces outils et également par plusieurs sources de données hétérogènes a permis de détecter précocement des signaux et des alertes d’addictovigilance concernant des médicaments initialement prescrits ou dispensés dans le cadre de leur AMM comme le montre l’utilisation détournée de médicaments psychoactifs (analgésiques à la codéine ou antihistaminiques H1 sédatifs en vente libre) chez les adolescents et les jeunes adultes [3] ou encore la problématique des patients qui consomment un antalgique opioïde pour soulager une douleur, et qui développent une dépendance primaire à leur traitement, et parfois le détournent de son indication initiale [11].
Outils d’aide à la décision. La vision industrielle
En France, la loi du 29 décembre 2011 est venue renforcer les obligations réglementaires des entreprises qui exploitent un médicament sur le territoire national quant à la déclaration et la mise en place de mesures pour limiter l’usage non conforme de leurs produits (articles L. 5121-14-3 et R. 5121-164 du Code de la santé publique). L’Agence nationale de sécurité du médicament et des produits de santé (ANSM) a d’ailleurs dans ce cadre établit un guide de signalement à l’attention des entreprises du médicament définissant les attendus en termes de déclaration, guide qui a été actualisé le 22 décembre 2017 [12].
Les signalements ne doivent concerner que les usages médicamenteux non conformes intentionnels et dans un but médical, constatés sur le territoire national, ce système est complémentaire des risques identifiés dans le cadre des plans de gestion de risque lié à l’AMM. Le signalement est particulièrement requis lorsque l’usage non conforme dont a connaissance l’entreprise est répandu, et/ou expose les patients à un risque important, et/ou concerne une population fragile ou une maladie rare. L’analyse de risque préalable au signalement permet d’arriver à ces conclusions. Pour répondre à ces enjeux, la majorité des entreprises a mis en place un comité pluridisciplinaire afin de :
-
•
décrire l’usage non conforme et d’évaluer le risque patient (estimation du nombre de patients concernés en France, synthèse des données existantes issues de la littérature, des congrès, de la pharmacovigilance, d’expériences à l’étranger, de bases de données, etc., sur le bénéfice et le risque liés à cet usage) ;
-
•
d’élaborer un plan d’actions en cas de risque identifié pour limiter les usages non conformes (ex : sensibilisation des délégués médicaux, mises en place d’études de marché ou pharmaco-épidémiologiques, modification du RCP/notice…) ;
-
•
de suivre le cas échéant les actions implémentées.
Cette analyse approfondie permettra à l’industriel de définir s’il il y a lieu de faire ou non une déclaration à l’ANSM.
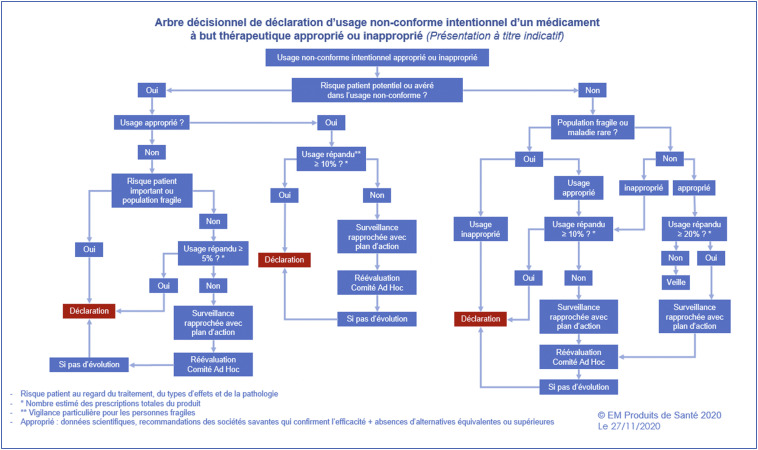
Un outil d’aide à la décision (Fig. 2 ) a été élaboré dans le cadre d’une formation destinée aux collaborateurs des entreprises pharmaceutiques travaillant dans des services en charge du suivi de l’usage non conforme intitulée « Usage non conforme des médicaments : gestion et déclaration ». Construit sous forme d’un logigramme, cet outil permet à l’issue de l’évaluation de l’ensemble des données disponibles pour l’entreprise de déterminer l’action requise pour une situation précise d’usage non conforme. Le cheminement du logigramme qui s’applique à tout usage non-conforme intentionnel, approprié ou inapproprié identifié commence tout d’abord par déterminer s’il y’a un risque patient important, potentiel ou avéré lié à ce type d’usage suggérant ainsi l’existence de pratique potentiellement à risque. Il sera ensuite déterminé si l’usage concerne une population fragile ou une maladie rare. La confrontation de cet usage avec les données de la science permettra de distinguer les usages appropriés des non appropriés. Sera également évaluée l’étendue de cet usage pour connaître si le phénomène constaté est marginal ou bien plus fréquent en appliquant des seuils d’alerte plus restrictifs en cas de caractère inapproprié ou de l’identification d’un risque patient ou population fragile. Enfin et en fonction des caractéristiques de l’usage constaté, pour chaque situation, une action sera proposée pouvant comprendre soit une surveillance rapprochée avec un plan d’actions en vue d’une réévaluation en comité ad hoc soit une déclaration à l’ANSM. La déclaration à l’ANSM comprendra une description des mesures prises, en cours ou envisagées par l’entreprise pour limiter l’usage constaté ou le rendre conforme via une modification de l’AMM ou une nouvelle autorisation.
Figure 2.
Outil d’aide à la décision élaboré dans le cadre d’une formation intitulée « Usage non conforme des médicaments : gestion et déclaration » destinée aux collaborateurs des entreprises pharmaceutiques travaillant dans des services en charge du suivi de l’usage non conforme. Cet outil permet à l’entreprise de déterminer l’action requise pour une situation précise d’usage non conforme.
Mésusage et société
Le contexte de la pandémie coronavirus-2019 (COVID-19) a mis en lumière l’influence et l’impact sociétal de la communication sur le médicament. La communication répétée par des hommes politiques de premier plan sur les bénéfices potentiels de l’hydroxychloroquine en dehors de toute indication s’est accompagnée d’une augmentation des renseignements sur internet, des achats [13], puis d’une augmentation dès avril 2020 des notifications d’effets indésirables associés à la prise d’hydroxychloroquine dans la base mondiale de l’Organisation mondiale de la santé [14], avant la conclusion définitive en avril 2021 d’une surmortalité sous hydroxychloroquine utilisée dans le cadre de la COVID-19 [15]. On retrouve donc ici un mésusage à grande échelle promu par des personnalités politiques comme le président des États-Unis d’Amérique ou du Brésil. On se heurte également à l’hétérogénéité des médias. En effet, la plupart des médias conventionnels écrits ou télévisés sont organisés avec des bureaux de fast-checking pour les informations facilement vérifiables, et les grands médias français ont produit des analyses très factuelles quant au bon usage des médicaments dans le cadre de la COVID. Le terme media regroupe donc une entité de pratiques et de courants très hétérogènes. Dans le cadre de l’hydroxychloroquine, le biais médiatique de l’information est par exemple apparu évident avec un excès de communication dans les media conservateurs américains [13], [16].
Recommandations
Le constat de l’existence d’un mésusage systémique, de l’impossibilité de proposer des solutions simplistes nous amène à proposer deux principaux axes d’amélioration de l’information et de la formation des usagers et des professionnels de santé sur les médicaments dans le cadre d’interventions multi-facettes (Tableau 2 ). Une partie de ces propositions a déjà été proposée dans le cadre du rapport sur l’amélioration de l’information des usagers et des professionnels de santé sur le médicament de 2018 [17]. Les deux grands axes de travail proposés sont, d’une part, la prévention du mésusage, avec un important volant formation. Le second axe concerne l’identification et la prise en charge du mésusage, comportant la nécessité d’identifier, de rendre transparente et de diffuser de façon compréhensible les données de mésusage à l’échelon national. À ce titre, la création d’un baromètre du mésusage à l’échelon populationnel est suggérée.
Tableau 2.
Principaux axes d’amélioration de l’information et de la formation des usagers et des professionnels de santé sur les médicaments. Recommandations de la table ronde.
| Thème | Cible | Méthode proposée | Exemples |
|---|---|---|---|
| Prévention du mésusage | |||
| Éducation/formation/acculturation générale | Collégiens/lycéens | Introduire le médicament dans l’enseignement primaire et secondaire (thématique à introduire dans le service sanitaire) | |
| Promouvoir l’éducation aux médias et à l’information | Eduscol ; https://entreleslignes.media/ | ||
| Étudiants en étude de santé | Renforcer l’enseignement sur le médicament en études de santé (médecine, pharmacie, odontologie, sage-femme, kinésithérapie, infirmière, …) | Modules médicament en PAS/LAS (parcours accès santé spécifique/licence avec option « accès santé ») ; sessions de thérapeutiques dans les examens cliniques objectifs et structurés (ECOS) en second cycle | |
| Patients et aidants | Mettre en place une formation universitaire pour patients partenaires dans les associations de patients Promouvoir l’éducation thérapeutique Travail collaboratif sur les notices patients |
Diplôme universitaire de l’Union francophone des patients partenaires https://ufpp.fr/formations-de-l-ufpp.html Travail sur les enotices https://www.ema.europa.eu/en/news/key-principles-use-electronic-product-information-eu-medicines |
|
| Population générale | Former le grand public (plateforme service public de formation/information en accès libre) | ||
| Information | |||
| Journalistes | Promouvoir le journalisme scientifique au sein des rédactions | Initiative d’Epsilon https://www.epsiloon.com/common/cms/charte | |
| Sociétés savantes | Communiquer auprès du grand public | Initiative de la Société française de pharmacologie et de thérapeutique https://sfpt-fr.org/covid19 | |
| Centres régionaux de pharmacovigilance, centres régionaux d’addictovigilance, Agence nationale de sécurité du médicament et des produits de santé | Promouvoir l’information des professionnels et des patients sur les médicaments, leurs effets indésirables et leur bon usage, permettre un accès direct des patients à l’information ; rappeler aux professionnels que l’efficacité et la sécurité d’un médicament est conditionnée, sauf exception, au respect du RCP |
https://www.rfcrpv.fr/contacter-votre-crpv ; https://addictovigilance.fr/bulletin/ https://base-donnees-publique.medicaments.gouv.fr ; https://ansm.sante.fr/dossiers-thematiques/covid-19-vaccins/covid-19-suivi-hebdomadaire-des-cas-deffets-indesirables-des-vaccins https://ansm.sante.fr/dossiers-thematiques/medicaments-et-grossesse https://ansm.sante.fr/actualites/antalgiques-opioides-lansm-publie-un-etat-des-lieux-de-la-consommation-en-france |
|
| Industriels | Communiquer auprès du grand public de façon concertée avec les agences | Antibiotiques: bon usage, charte de la visite médicale (communication sur les mesures de minimisation du risque, enquêtes sur les visites médicales), remontée des cas hors AMM. Suivi des ventes, suivi des reports | |
| Identification et prise en charge | |||
| Identification | Réseaux des centres régionaux de pharmacovigilance (CRPV) et des centres d’évaluation et d’information sur la pharmacodépendance et d’addictovigilance (CEIP-A) | Stimuler les déclarations aux CRPV ou CEIP-A des cas de mésusage, y compris sans effet indésirable afin de mieux les détecter | Notifications/demandes de renseignements reçues par les réseaux des CRPV et CEIP. Réseaux sentinelles des CEIP (dispositif OPPIDUM via les structures en addictologie ; dispositif OSIAP des ordonnances falsifiées, …) Projet Mésange: identification des cas de mésusage au moment de la délivrance pharmaceutique |
| Industriels | Remontée des signaux auprès de l’Agence nationale de sécurité du médicament et des produits de santé | Indicateurs des suivis des ventes, indicateurs des questions d’information médicale | |
| Praticiens médecins et pharmaciens | Structuration du dossier médical partagé (accès universel), et harmonisation avec le dossier pharmaceutique | ||
| Hôpitaux | Suivi de la consommation, suivi des tensions d’approvisionnement | ||
| Agence nationale de sécurité du médicament et des produits de santé | Comparaison du nombre de boites moyennes par rapport au nombre attendu, pour les abus et pour les prescriptions/dispensations hors AMM Repérage du mésusage via les bases de données d’assurance maladie [21] |
Détection du comportement de doctor-shopping[22] | |
| Patients | À titre individuel : conciliation médicamenteuse ; utilisation par le médecin d’outils de repérage des mésusages (ex opioïdes) | ||
| Prise en charge | Agence nationale de sécurité du médicament et des produits de santé | Changement des modalités de prescription (autorités de santé), mesures de réduction du risque (Agences, documents industriels ex isotretinoide) Suivi des changements des modalités de prescription |
Exemple avec suivi des reports zolpidem- > zopiclone des Z drugs [23] |
| Pharmaciens | Dispensation adaptée (01/07/2020) https://uspo.fr/dad-dispensation-adaptee-liste-des-specialites/ |
Conclusion
L’identification et la prise en charge du mésusage est complexe et ne peut pas reposer sur des mesures simplistes et sur un seul acteur. Elle nécessite en amont l’identification des situations à risque de mésusage grâce aux différents réseaux déjà disponibles (centres régionaux de pharmacovigilance, centres d’évaluation et d’information sur la pharmacodépendance et d’addictovigilance), une formation des différents professionnels de santé impliqués dans la prise en charge des patients et un relais médiatique auprès des aidants et des malades. Une coordination de tous les acteurs, incluant patients, aidants et media est ainsi requise. Elle implique enfin la mise en place de mesures d’impact de ces actions de prévention.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Footnotes
Les articles, analyses et propositions issus des Nouveaux Ateliers de Giens sont ceux des auteurs et ne préjugent pas des propositions de leur organisation.
Références
- 1.Bégaud B., Costagliola D. 2013. Rapport sur la surveillance et la promotion du bon usage du médicament en France.https://solidarites-sante.gouv.fr/IMG/pdf/Rapport_Begaud_Costagliola.pdf [Google Scholar]
- 2.Singier A., Noize P., Berdaï D., et al. Medicine misuse: a systematic review and proposed hierarchical terminology. Br J Clin Pharmacol. 2021;87(4):1695–1704. doi: 10.1111/bcp.14604. [DOI] [PubMed] [Google Scholar]
- 3.Micallef J., Jouanjus É., Mallaret M., Lapeyre-Mestre M. Détection des signaux du réseau français d’addictovigilance : méthodes innovantes d’investigation, illustrations et utilité pour la santé publique. Therapies. 2019;74:579–590. doi: 10.1016/j.therap.2019.09.005. [DOI] [PubMed] [Google Scholar]
- 4.Ministère des Solidarités et de la Santé . 2012. Rapport de synthèse des Assises du médicament. https://solidarites-sante.gouv.fr/ministere/documentation-et-publications-officielles/rapports/sante/article/rapport-de-synthese-des-assises-du-medicament [Consulté le 21 décembre 2021] [Google Scholar]
- 5.Caisse nationale de l’Assurance maladie . 2007. Consommation et dépenses de médicaments : comparaison des pratiques françaises et européennes. http://www.puppem.com/documents/cnamts_consommation_depenses_med_europe_10-2007.pdf. [Consulté le 21 décembre 2021 (14 pp.)] [Google Scholar]
- 6.ANSM . 2017. État des lieux de la consommation des benzodiazépines en France. https://archiveansm.integra.fr/var/ansm_site/storage/original/application/28274caaaf04713f0c280862555db0c8.pdf [Consulté le 21 décembre 2021 (60 pp.)] [Google Scholar]
- 7.Grolleau A., Cougnard A., Bégaud B., Verdoux H. Psychotropic drug use and correspondence with psychiatric diagnoses in the mental health in the general population survey. Encephale. 2008;34:352–359. doi: 10.1016/j.encep.2007.07.011. [DOI] [PubMed] [Google Scholar]
- 8.Institut national de veille sanitaire . 2007. Rapport d’étude épidémiologique. Psychotropes Code de l’enquête (IU2007-05) https://www.sentiweb.fr/document/955. [Consulté le 21 décembre 2021 (53 pp.)] [Google Scholar]
- 9.Jonville-Béra A.P., Saissi H., Bensouda-Grimaldi L., Beau-Salinas F., Cissoko H., Giraudeau B., et al. Avoidability of adverse drug reactions spontaneously reported to a french regional drug monitoring centre. Drug Saf. 2009;32:429–440. doi: 10.2165/00002018-200932050-00006. [DOI] [PubMed] [Google Scholar]
- 10.Laroche M.L., Polard E., Gautier S., Lebrun-Vignes B., Faillie J.L., Chouchana L., et al. Epidemiology of hospitalization due to adverse drug reactions in France: the IATROSTAT study. [Abstract CO-009] Fundam Clin Pharmacol. 2021;35(S1):14–46. https://onlinelibrary.wiley.com/doi/10.1111/fcp.12669. [Consulté le 21 décembre 2021] [Google Scholar]
- 11.ANSM . 2019. Antalgiques opioïdes : l’ANSM publie un état des lieux de la consommation en France. https://ansm.sante.fr/actualites/antalgiques-opioides-lansm-publie-un-etat-des-lieux-de-la-consommation-en-france. [Consulté le 21 décembre 2021] [Google Scholar]
- 12.ANSM . 2017. Signalement par les entreprises d’une prescription ou utilisation non conforme de médicament. https://archiveansm.integra.fr/var/ansm_site/storage/original/application/d36d6dd7055c0ac1281bd1f75a62184c.pdf. [Consulté le 21 décembre 2021 (5 pp.)] [Google Scholar]
- 13.Niburski K., Niburski O. Impact of Trump's promotion of unproven COVID-19 treatments and subsequent internet trends: observational study. J Med Internet Res. 2020;22:e20044. doi: 10.2196/20044. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Perez J., Roustit M., Lepelley M., Revol B., Cracowski J.L., Khouri C. Reported adverse drug reactions associated with the use of hydroxychloroquine and chloroquine during the COVID-19 pandemic. Ann Intern Med. 2021;174:878–880. doi: 10.7326/M20-7918. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Axfors C., Schmitt A.M., Janiaud P., Van’t Hooft J., Abd-Elsalam S., Abdo E.F., et al. Mortality outcomes with hydroxychloroquine and chloroquine in COVID-19 from an international collaborative meta-analysis of randomized trials. Nat Commun. 2021;12:2349. doi: 10.1038/s41467-021-22446-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Bordet R. Is the drug a scientific, social or political object? Therapie. 2020;75:389–391. doi: 10.1016/j.therap.2020.05.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Kierzek G., Léo M. Ministère des Solidarités et de la Santé; 2018. Rapport sur l’amélioration de l’information des usagers et des professionnels de santé sur le médicament. [ https://solidarites-sante.gouv.fr/ministere/documentation-et-publications-officielles/rapports/sante/article/rapport-sur-l-amelioration-de-l-information-des-usagers-et-des-professionnels. Consulté le 21 décembre 2021] [Google Scholar]
- 18.Légifrance . 2013. Article R. 5121-152 – Code de la santé publique. https://www.legifrance.gouv.fr/codes/article_lc/LEGIARTI000028083982/. [Consulté le 21 décembre 2021] [Google Scholar]
- 19.ANSM . 2018. Bonnes pratiques de pharmacovigilance. https://ansm.sante.fr/documents/reference/bonnes-pratiques-de-pharmacovigilance. [Consulté le 21 décembre 2021] [Google Scholar]
- 20.European Medicines Agency . 2018. Good pharmacovigilance practices. https://www.ema.europa.eu/en/human-regulatory/post-authorisation/pharmacovigilance/good-pharmacovigilance-practices. [Consulté le 21 décembre 2021] [Google Scholar]
- 21.Dupui M., Micallef J., Lapeyre-Mestre M. Interest of large electronic health care databases in addictovigilance: lessons from 15 years of pharmacoepidemiological contribution. Therapie. 2019;74:307–314. doi: 10.1016/j.therap.2018.09.078. [DOI] [PubMed] [Google Scholar]
- 22.Soeiro T., Lacroix C., Pradel V., Lapeyre-Mestre M., Micallef J. Early detection of prescription drug abuse using doctor shopping monitoring from claims databases: illustration from the experience of the French Addictovigilance Network. Front Psychiatry. 2021;12:640120. doi: 10.3389/fpsyt.2021.640120. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Gérardin M., Rousselet M., Caillet P., Grall-Bronnec M., Loué P., Jolliet P., et al. French national health insurance database analysis and field study focusing on the impact of secure prescription pads on zolpidem consumption and sedative drug misuse: ZORRO study protocol. BMJ Open. 2019;9:e027443. doi: 10.1136/bmjopen-2018-027443. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Vignot S., Daynes P., Bacon T., Vial T., Montagne O., Albin N., et al. Collaboration between health-care professionals, patients, and national competent authorities is crucial for prevention of health risks linked to the inappropriate use of drugs: a position paper of the ANSM (Agence nationale de sécurité du médicament et des produits de santé) Front Pharmacol. 2021;12:635841. doi: 10.3389/fphar.2021.635841. [DOI] [PMC free article] [PubMed] [Google Scholar]