Le déficit en α1-antitrypsine (AAT) est une maladie génétique qui contribue à l’apparition de la maladie pulmonaire obstructive chronique (MPOC), de bronchiectasies, de la cirrhose du foie et de la panniculite1; elle touche 1 personne sur 3000 à 5000 aux États-Unis2. La prévalence exacte du déficit en AAT chez les patients ayant reçu un diagnostic de MPOC est inconnue, mais de petites études l’estiment à entre 1 et 5 %3. Puisque de nombreux symptômes de déficit en AAT sont non spécifiques et pourraient recouper ceux liés à des affections plus courantes, comme l’asthme et la MPOC sans déficit en AAT, le diagnostic est souvent erroné ou substantiellement retardé. On estime que seuls 4 à 5 % des patients atteints de déficit en AAT ont été identifiés4 et en moyenne, 5,6 ans s’écoulent entre l’apparition des symptômes et le diagnostic1. Le présent rapport souligne les difficultés de même que l’importance de poser un diagnostic ponctuel en soins de première ligne dans les cas de déficit en AAT.
Cas
Un homme de 41 ans consulte son médecin de famille en raison d’une respiration laborieuse aggravée par l’activité physique modeste depuis 5 ou 6 ans. Il a récemment immigré du Portugal, mais malgré plusieurs visites chez son médecin au Portugal, son diagnostic reste nébuleux.
Jusqu’à l’an dernier, le patient fumait 1 paquet de cigarettes par jour depuis 15 ans. Il continue d’être exposé à la fumée de cigarette au travail. Il est menuisier. Il dit ne pas avoir consommé de drogues illégales ou d’alcool. Il affirme aussi ne pas avoir d’antécédents familiaux ou personnels d’asthme ou d’atopie.
L’examen physique ne révèle rien de remarquable, à l’exception d’une baisse bilatérale de l’entrée d’air dans les poumons et d’une faible saturation en oxygène (92 % au repos à l’air ambiant). Une radiographie des poumons révèle une hyperinflation des poumons de même qu’un aplatissement des hémidiaphragmes. Le diamètre antérieur-postérieur de la paroi thoracique est aussi accru.
Les tests de spirométrie effectués avant le traitement (Tableau 1) indiquent une obstruction bronchique sévère, le volume expiratoire maximal seconde (VEMS) après l’administration d’un bronchodilatateur est de 32 % de la valeur normale prédite et le rapport VEMS-capacité vitale forcée (CVF) est d’à peine 0,28. Après l’administration d’un bronchodilatateur, le VEMS et la CVF se sont renversés, les hausses observées étant de 32 et 36 %, respectivement. Ces résultats illustrent bien les difficultés liées à la distinction entre un déficit en AAT et l’asthme ou la MPOC, puisque les résultats de spirométrie répondent aux critères diagnostiques d’asthme (hausse d’au moins 12 %, ou hausse absolue d’au moins 200 mL, du VEMS) et de MPOC (baisse du rapport VEMS-CVF en deçà de 0,70 ou de la limite inférieure de la normale). Ces constatations s’appliquent aussi au syndrome de chevauchement de l’asthme et de la MPOC5. Ce patient a été traité par corticostéroïdes par voie orale et par inhalation (50 mg de prednisone par jour pendant 10 jours) de même que par une bithérapie par bronchodilatateurs à action prolongée.
Tableau 1.
Résultats de spirométrie du patient avant le traitement : Les rapportsVEMS-CVF étaient de 0,29 avant la bronchodilatation et de 0,28 après la bronchodilatation.
| MESURE DE SPIROMÉTRIE |
AVANT LE
BRONCHODILATATEUR |
APRÈS LE
BRONCHODILATATEUR |
VARIATION (%) | ||
|---|---|---|---|---|---|
|
|
|
||||
| MEILLEUR RÉSULTAT, L | % DE LA VALEUR PRÉDITE | MEILLEUR RÉSULTAT, L | % DE LA VALEUR PRÉDITE | ||
| CVF | 3,43 | 67 | 4,68 | 91 | 36 |
| VEMS | 1,01 | 24 | 1,33 | 32 | 32 |
VEMS—volume expiratoire maximal seconde, CVF—capacité vitale forcée.
Un mois plus tard, le patient ne rapporte aucune amélioration subjective et sa fonction respiratoire n’a pas changé (Tableau 2). Vu son jeune âge, ses antécédents cliniques de dyspnée remontant à plus de 5 ans, les rares facteurs de risque d’asthme et l’obstruction bronchique très avancée qui semble être réfractaire au traitement, on a procédé à un test de dépistage d’α1-antitrypsine (AAT), lequel a révélé un taux très faible d’AAT, soit de moins de 1,84 µmol/L. Le phénotypage de la protéine α1-antitrypsine (typage de l’inhibiteur de la protéase [IP]) a subséquemment montré que le type d’IP était nul-rare. Pour des raisons financières, le patient a refusé le test de génotypage.
Tableau 2.
Résultats de spirométrie du patient 1 mois après le traitement : Les rapports VEMS-CVF étaient de 0,29 avant la bronchodilatation et de 0,29 après la bronchodilatation.
| MESURE DE SPIROMÉTRIE |
AVANT LE
BRONCHODILATATEUR |
APRÈS LE
BRONCHODILATATEUR |
VARIATION (%) | ||
|---|---|---|---|---|---|
| MEILLEUR RÉSULTAT, L | % DE LA VALEUR PRÉDITE | MEILLEUR RÉSULTAT, L | % DE LA VALEUR PRÉDITE | ||
| CVF | 3,27 | 64 | 4,86 | 95 | 49 |
| VEMS | 0,94 | 23 | 1,43 | 34 | 51 |
VEMS—volume expiratoire maximal seconde, CVF—capacité vitale forcée.
Discussion
L’α1-antitrypsine est une glycoprotéine synthétisée principalement par le foie et sécrétée dans le plasma, où elle s’attache principalement à protéger les tissus contre l’élastase neutrophile. Un déficit sévère en AAT prédispose les fumeurs à un emphysème panlobulaire incapacitant à un relativement jeune âge (environ 40 ans), et très peu de ceux qui manifestent des symptômes pulmonaires vivent jusqu’à 60 ans6.
Sur le plan génétique, le déficit en α1-antitrypsine est un défaut héréditaire autosomal codominant. La maladie survient lorsqu’une personne hérite de 2 copies d’allèles déficients sur le locus Pi du bras du chromosome 14q. L’allèle sauvage est PiM et les 2 allèles déficients les plus courants sont PiZ et PiS, PiS étant plus léger que PiZ. Les hétérozygotes porteurs d’un seul allèle déficient ne sont pas considérés être exposés à un risque substantiel de MPOC grave. La présence de 2 allèles déficients, le plus souvent PiZZ, entraîne des taux sériques gravement réduits d’AAT et un risque grandement accru d’emphysème panlobulaire et de maladie hépatique. Les autres variantes alléliques d’AAT sont les allèles nuls (qui ne produisent pas de protéine AAT) et les allèles dysfonctionnels (taux normal de protéine, mais fonction protéique anormale). Pour la plupart, la maladie clinique découle des allèles déficients et nuls. Le locus Pi du patient présenté porte une copie de l’allèle nul et une autre copie d’un rare allèle morbide, ce qui cause un déficit extrêmement grave en AAT3.
Le tableau clinique classique du déficit en AAT est semblable à celui de la MPOC, quoiqu’il se présente souvent à un plus jeune âge ou après une exposition moins importante à la fumée. Les tests de fonction respiratoire montrent aussi des caractéristiques typiques de la MPOC, telles que l’obstruction bronchique et l’augmentation des volumes pulmonaires. En outre, la réversibilité n’est pas rare (> 12 % du VEMS) après l’administration de bronchodilatateurs, ce qui peut entraîner un diagnostic erroné d’asthme. La fonction respiratoire normale est aussi observée, le plus souvent chez les personnes asymptomatiques. L’exposition à la fumée est considérée comme le déterminant le plus important de la fonction respiratoire. Parmi les porteurs des allèles PiZZ, les fumeurs présentent un risque beaucoup plus élevé d’anomalies de la fonction respiratoire et un déclin plus rapide que les non-fumeurs1.
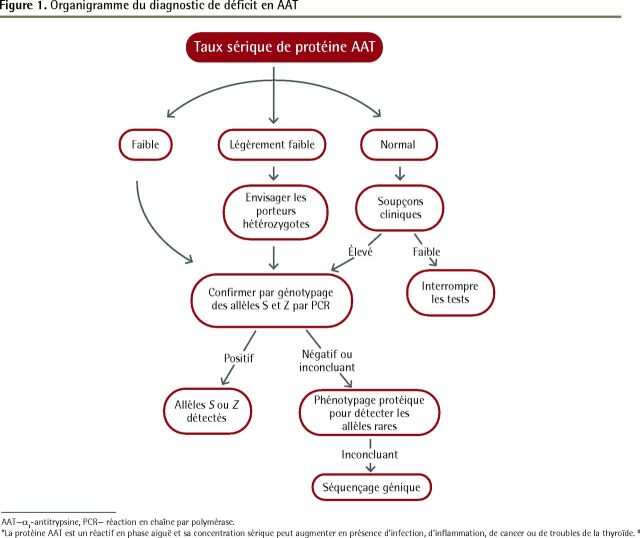
Il n’existe aucun algorithme de laboratoire accepté pour le diagnostic de déficit en AAT7. Il est raisonnable de commencer par un test visant à quantifier le taux sérique d’AAT; les taux en deçà de 11 µmol/L sont jugés importants sur le plan physiopathologique3. Le génotypage par l’entremise d’un test de réaction en chaîne par polymérase est souvent effectué sur les échantillons sanguins dans le but de détecter les allèles S et Z. La capacité de détection du génotypage est limitée dans le cas des allèles rares. Si la mesure du taux sérique d’AAT et le génotypage ne sont pas concluants, le phénotypage est la prochaine option. Le séquençage génétique est pour l’heure réservé aux cas de taux sérique faible en AAT ne pouvant être complètement expliqués par le génotypage et le phénotypage (Figure 1)8.
Figure 1.
Organigramme du diagnostic de déficit en AAT
AAT—α1-antitrypsine, PCR— réaction en chaîne par polymérase.
*La protéine AAT est un réactif en phase aiguë et sa concentration sérique peut augmenter en présence d’infection, d’inflammation, de cancer ou de troubles de la thyroïde.8
Depuis dix ans, on déploie des efforts soutenus pour sensibiliser les médecins et pour faire tomber les obstacles au test de déficit en AAT. L’American Thoracic Society et l’European Respiratory Society recommandent le dépistage génétique chez tous les patients atteints de MPOC sans égard au tabagisme, chez tous les adultes et adolescents atteints d’asthme réfractaire et chez toute personne atteinte d’une maladie hépatique inexpliquée8. Les lignes directrices de la Société canadienne de thoracologie proposent des tests plus sélectifs de dépistage du déficit en AAT, et de cibler les personnes atteintes de MPOC diagnostiquée avant 65 ans ou dont les antécédents de tabagisme sont de moins de 20 paquets-années (recommandation faible)3.
Le traitement actuel du déficit en AAT est, pour la plupart, la prise en charge des symptômes de MPOC, d’emphysème et des problèmes pulmonaires coexistants. Le but consiste à prévenir ou à ralentir la progression de l’atteinte pulmonaire. L’abandon du tabac a de loin l’effet le plus marqué sur la survie des patients emphysémateux9. Le traitement d’augmentation par AAT exogène est une autre option. La Société canadienne de thoracologie recommande le traitement d’augmentation par AAT chez les non-fumeurs et ex-fumeurs atteints de MPOC (VEMS de 25 à 80 % de la valeur prédite) dont le taux d’AAT est égal ou inférieur à 11 μmol/L3. Finalement, on conseille l’immunisation contre les virus de l’hépatite A et B afin de réduire le risque d’atteinte hépatique9. Les vaccins anti-pneumococcique et antigrippal contribuent à réduire la fréquence des exacerbations chez les patients atteints d’un déficit en AAT8.
Conclusion
Les médecins de première ligne sont souvent le premier point de contact des patients qui présentent des symptômes de maladie thoracique. Il faut effectuer un test de dépistage du déficit en AAT chez les patients qui sont atteints de MPOC d’apparition précoce et d’emphysème incapacitant dès la quarantaine ou la cinquantaine, qui présentent des antécédents familiaux de déficit en AAT, ont fumé moins de 20 paquets-années ou dont l’asthme a mal répondu au traitement lorsqu’on croyait qu’ils étaient asthmatiques.
POINTS DE REPÈRE DU RÉDACTEUR
Ce cas met en lumière les difficultés liées à la distinction entre un déficit en α1-antitrypsine (AAT) et l’asthme ou la maladie pulmonaire obstructive chronique (MPOC), puisque les résultats de spirométrie du déficit en AAT répondent aux critères de l’asthme et à ceux de la MPOC. Les observations peuvent aussi s’appliquer au syndrome de chevauchement de l’asthme et de la MPOC.
Il faut procéder au dépistage du déficit en AAT chez les patients qui sont atteints de MPOC d’apparition précoce ou d’emphysème incapacitant dès la quarantaine ou la cinquantaine; qui présentent des antécédents familiaux de déficit en AAT; qui ont fumé moins de 20 paquetsannées; ou dont l’asthme a mal répondu au traitement si l’on croyait auparavant qu’ils souffraient d’asthme.
Footnotes
Cet article donne droit à des crédits d’autoapprentissage certifiés Mainpro+. Pour obtenir des crédits, rendez-vous sur www.cfp.ca et cliquez sur le lien Mainpro+.
Cet article a fait l’objet d’une révision par des pairs.
The English version of this article is available at www.cfp.ca on the table of contents for the November 2016 issue on page 899.
Intérêts concurrents
Aucun déclaré
Références
- 1.Wood AM, Stockley RA. Alpha one antitrypsin deficiency: from gene to treatment. Respiration. 2007;74(5):481–92. doi: 10.1159/000105536. [DOI] [PubMed] [Google Scholar]
- 2.Izaguirre Anariba DE, Lessnau KD, Lanza J. Alpha1-antitrypsin deficiency. New York, NY: Medscape; 2014. Accessible à : http://emedicine.medscape.com/article/295686-overview#a6. Réf. du 19 juil. 2015. [Google Scholar]
- 3.Marciniuk DD, Hernandez P, Balter M, Bourbeau J, Chapman KR, Ford GT, et al. Alpha-1 antitrypsin deficiency targeted testing and augmentation therapy: a Canadian Thoracic Society clinical practice guideline. Can Respir J. 2012;19(2):109–16. doi: 10.1155/2012/920918. Erratum dans: Can Respir J 2012;19(4):272. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Brode SK, Ling SC, Chapman KR. Alpha-1 antitrypsin deficiency: a commonly overlooked cause of lung disease. CMAJ. 2012;184(12):1365–71. doi: 10.1503/cmaj.111749. Publ. en ligne du 3 juil. 2012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Miravitlles M, Soler-Cataluña JJ, Calle M, Molina J, Almagro P, Quintano JA, et al. Spanish guideline for COPD (GesEPOC). Update 2014. Arch Bronconeumol. 2014;50(Suppl 1):1–16. doi: 10.1016/S0300-2896(14)70070-5. [DOI] [PubMed] [Google Scholar]
- 6.O’Donnell DE, Aaron S, Bourbeau J, Hernandez P, Marciniuk D, Balter M, et al. State of the art compendium: Canadian Thoracic Society recommendations for the management of chronic obstructive pulmonary disease. Can Respir J. 2004;11(Suppl B):7B–59B. doi: 10.1155/2004/946769. [DOI] [PubMed] [Google Scholar]
- 7.Greulich T, Vogelmeier CF. Alpha-1-antitrypsin deficiency: increasing awareness and improving diagnosis. Ther Adv Respir Dis. 2016;10(1):72–84. doi: 10.1177/1753465815602162. Publ. en ligne du 4 sept. 2015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Siri D, Farah H, Hogarth DK. Distinguishing alpha1-antitrypsin deficiency from asthma. Ann Allergy Asthma Immunol. 2013;111(6):458–64. doi: 10.1016/j.anai.2013.09.019. Publ. en ligne du 23 oct. 2013. [DOI] [PubMed] [Google Scholar]
- 9.Izaguirre Anariba DE, Lessnau KD, Lanza J. Alpha1-antitrypsin deficiency treatment and management. New York, NY: Medscape; 2014. Accessible à : http://emedicine.medscape.com/article/295686-treatment. Réf. du 19 juil. 2015. [Google Scholar]