Abstract
Introduction
Le contexte sanitaire lié à la pandémie COVID-19 a entraîné le développement rapide de nombreux vaccins contre le virus SarS-Cov-2. Quatre d’entre eux sont actuellement disponibles en France et contiennent comme excipients du polyethylène glycol (PEG) ou du polysorbate 80, déjà décrits comme pourvoyeurs d’anaphylaxie. Des recommandations françaises ont été suggérées par plusieurs instances d’allergologie et proposaient une conduite à tenir face à une suspicion d’allergie à ces vaccins. Ainsi, les allergies aux excipients constituaient la seule contre-indication à la vaccination anti COVID-19. Notre objectif principal était de déterminer l’impact de ces recommandations vaccinales d’allergologie sur la prise en charge de ces patients. Notre objectif secondaire était de déterminer la prévalence des allergies vraies à ces vaccins.
Matériels et méthodes
Nous avons mené une étude rétrospective descriptive unicentrique concernant l’ensemble des patients de plus de 18 ans adressés pour un avis allergologique avant ou après une vaccination anti COVID-19. Les patients ont été classés en différents groupes d’intérêt, à partir des recommandations françaises.
Résultats
La vaste majorité des patients n’ont pas nécessité de bilan allergologique pré vaccinal. En effet, seulement 25 patients ont reçu des tests cutanés préalables à la vaccination. Le reste des patients ont pu être vaccinés sans bilan allergologique. Les patients non vaccinés pour cause d’allergie aux excipients représentent moins de 1 % de l’effectif total (n = 3/320).
Conclusion
Les recommandations françaises ont permis de vacciner la grande majorité des patients inclus dans notre étude. L’allergie au PEG, polysorbate ou leurs dérivés, seule contre-indication à la vaccination anti COVID, d’après les recommandations de février 2021, reste rare. À ce jour, plusieurs auteurs proposent des inductions de tolérance permettant la vaccination de patients allergiques aux PEG ou à leurs dérivés avec une bonne tolérance.
Mots clés: Vaccination, Vaccination anti COVID-19, SARS COV 2, Effets secondaires vaccinaux
Abstract
Introduction
The health context with COVID-19 pandemic has led to fast development of many vaccines against the SarS-Cov-2 virus. Four of them are currently available in France and contain polyethylene glycol (PEG) or polysorbate 80 as excipients, already described as causing anaphylaxis. French recommendations have been suggested by allergology authorities and proposed a course of action in the event of a suspected allergy to these vaccines. Thus, allergies to excipients were the only contraindication to COVID-19 vaccination. Our main objective was to determine the impact of these allergology vaccine recommendations on the management of these patients. Our secondary objective was to determine prevalence of true allergies to these vaccines.
Materials and methods
We conducted a unicentric descriptive retrospective study with all patients over 18 years of age referred for an allergological opinion before or after an injection of one of the anti-COVID-19 vaccines. Nineteen patients were classified into different interest groups, based on french recommendations.
Results
The vast majority of patients did not require a pre-vaccination allergological assessment. Indeed, only 25 patients received skin tests prior to vaccination. The rest of patients were able to be vaccinated without allergological assessment. Patients not vaccinated due to allergy to excipients represent less than 1% of the population (n = 3/320).
Conclusion
French recommendations made it possible to vaccinate the vast majority of patients included in our study. Allergy to PEG, polysorbate or their derivatives, the only contraindication to anti-COVID vaccination, according to the recommendations of February 2021, remains rare. Today, several authors propose tolerance inductions allowing the vaccination of patients allergic to PEGs or their derivatives with good tolerance.
Keywords: Vaccination, Vaccination anti COVID-19, SARS COV 2, Effets secondaires vaccinaux
1. Abréviations
- OMS
Organisation Mondiale de la Santé
- PEG
Polyéthylène glycol
- CDC
Centers for Disease Control
- SFA
Société Française d’Allergologie
- FFAL
Fédération Française d’Allergologie
- CNP
Conseil National Professionnel
- SAMA
Syndrome d’Activation Mastocytaire
- CNIL
Commission Nationale de l’Informatique et des Libertés
- UCS
Urticaire Chronique Spontanée
2. Introduction
Le contexte sanitaire lié à la pandémie de COVID-19 (CoronaVirusDisease 2019) a entraîné le développement rapide de nombreux vaccins contre le virus SarS-Cov-2. Le 30 décembre 2020, l’Organisation Mondiale de la Santé (OMS) a homologué le premier vaccin anti-COVID-19 à ARN messager nommé Comirnaty au titre de la procédure pour les situations d’urgence [1]. D’autres vaccins furent ensuite validés. En France, nous disposons actuellement de 2 vaccins à ARN messager tels que Comirnaty de Pfizer/BioNtech, et Spikevax du laboratoire Moderna. D’autres vaccins sont également disponibles : Janssen de Johnson et Johnson et Vaxzevria d’Astrazeneca, tous deux contenant un vecteur viral à adénovirus [2]. Le polyéthylène glycol (PEG) et le polysorbate 80 sont des excipients de ces différents vaccins. Les vaccins à ARN messager (Comirnaty et Spikevax) contiennent du PEG tandis que les vaccins à vecteur viral (Janssen et Vaxzevria) contiennent du polysorbate 80.
A ce jour, la fréquence des réactions allergiques sévères (anaphylaxie) au décours d’une vaccination anti COVID-19 varie en fonction du vaccin et des pays. Dans la littérature, l’incidence des réactions anaphylactiques au décours d’une vaccination classique est estimée de 1/500 000 à 1/1 000 000 doses administrées. En France, en mars 2021, on retrouvait une incidence de 2,53 anaphylaxies pour 100 000 doses administrés de Comirnaty de PfizerBioNtech [3]. Au Royaume uni, à la même période, l’incidence était de 1,89 anaphylaxie sévère pour 100 000 doses du vaccin Comirnaty [3]. Aux États-Unis, pour les vaccins Pfizer-BioNTech (Comirnaty®) et Moderna, l’incidence estimée par les Centers for Disease Contrôle (CDC) était finalement bien plus faible avec 1/200 000 à 1/400 000 doses [4]. Pour le vaccin Astrazeneca, on retrouvait en mars 2021 en France, une incidence faible avec 0,6 anaphylaxie pour 100 000 doses administrées [5], [6], [7].
Des cas d’anaphylaxie aux PEG ont été rapportés dans la littérature notamment lors d’injections de corticoïdes retards mais ils restent très rares [8], [9], [10], [11], [12], [13]. Cette hypersensibilité allergique au PEG semble plutôt rapportée lors d’administration du médicament par voie intra musculaire ou sous cutanée mais des cas sont aussi décrits lors de prises per os et intra articulaire. Le polysorbate 80 a également été rapporté comme responsable d’anaphylaxie [14], [15]. Par ailleurs, une sensibilisation croisée a été décrite par différents auteurs, entre les PEG, les polysorbates et les poloxamères [16]. Des recommandations françaises ont été proposées par plusieurs instances d’allergologie pour la conduite à tenir face à des patients aux nombreux antécédents allergiques, avant leur vaccination [17] (Fig. 1 ).
Fig. 1.
Recommandations vaccinales de la SFA/FFAL/CNP allergologie sur la prise en charge des patients avec une suspicion d’allergie aux vaccins anti COVID-19.
Notre objectif principal était ainsi de déterminer l’impact de ces recommandations vaccinales proposées par la Société Française d’allergologie (SFA), La Fédération Française d’Allergologie (FFAL) et le Conseil National Professionnel (CNP) d’allergologie concernant la prise en charge des patients pour lesquels un avis allergologique était demandé avant ou après la vaccination anti COVID-19. Notre objectif secondaire était de déterminer la prévalence des allergies confirmées à ces vaccins.
3. Matériels et méthodes
3.1. Design de l’étude
Il s’agissait d’une étude rétrospective descriptive monocentrique concernant l’ensemble des patients âgés de plus de 18 ans adressés dans le service d’allergologie et immunologie clinique du centre hospitalier Lyon sud pour un avis allergologique avant ou après une vaccination anti COVID-19. La période d’étude s’étendait sur 6 mois à partir du 1er janvier 2021.
3.2. Population
Les avis demandés concernaient 2 types de population : les patients ayant eu une réaction d’hypersensibilité suite à une 1re injection d’un vaccin anti COVID et les patients avec des manifestations « d’hypersensibilité » pour lesquels un avis pré-vaccinal était requis.
Les conduites à tenir, données par le service investigateur en réponse à ces avis, se résumaient par :
-
•
autorisation de la vaccination dans un centre de vaccination classique ;
-
•
autorisation de la vaccination dans un centre de vaccination classique sous anti- histaminiques ;
-
•
autorisation de la vaccination dans un milieu hospitalier sous anti-histaminiques ;
-
•
tests cutanés en service d’allergologie préalable à l’injection du vaccin sous surveillance hospitalière d’une heure avec prémédication par anti-histaminiques ;
-
•
contre-indication au vaccin.
Suite à ces avis, nous nous sommes basés sur les recommandations vaccinales de la SFA/FFAL/CNP allergologie pour classer les patients en différents groupes d’intérêt (Fig. 1) :
-
•
le groupe n°1 correspondait aux patients ayant eu une réaction immédiate (bronchospasme, urticaire généralisée ou anaphylaxie) suite à la prise d’un médicament contenant du PEG, polysorbate ou leurs dérivés (excipients des vaccins anti COVID-19). Le terme anaphylaxie correspondait à une hypersensibilité sévère avec l’atteinte d’au moins 2 organes différents.
-
•
le groupe n°2 correspondait aux patients ayant eu une réaction immédiate (bronchospasme, urticaire généralisée ou anaphylaxie) suite à la 1re injection d’un vaccin anti COVID-19. Le groupe n°2 bis correspondait aux autres réactions suite à la première injection d’un vaccin anti COVID-19. Ces réactions correspondaient à des manifestations cutanées isolées (urticaire aiguë localisée, érythème au point d’injection) ou à des réactions retardées.
-
•
le groupe n°3 comprenait les patients ayant eu une réaction immédiate suite à une injection de vaccin non COVID, ou suite à la prise d’un médicament indéterminé.
-
•
le groupe n°3 bis comprenait les patients ayant eu tout autre réaction (réactions retardées ou immédiates) suite à un vaccin non COVID ou à la prise d’un médicament identifié ne contenant pas de PEG ou polysorbate.
-
•
le groupe n°4 correspondait aux patients avec un terrain « d’hypersensibilité » ou « allergique » ;
-
•
le groupe n°4 bis comprenait les patients avec une mastocytose ou un syndrome d’activation mastocytaire (SAMA).
Les réactions médicamenteuses indéterminées correspondaient à des réactions aux médicaments non explorées ou pour lesquelles les patients avaient des souvenirs flous. Les réactions médicamenteuses identifiées correspondaient à des réactions allergiques prouvées à des médicaments, sans notion de PEG ou ses dérivés comme excipients. Les mastocytoses à risque d’anaphylaxie correspondaient à des patients ayant eu au moins une fois une réaction anaphylactique. Les mastocytoses sans risque d’anaphylaxie correspondaient à des patients ayant eu au cours de leur maladie des symptômes uniquement cutanés. Le terrain « d’hypersensibilité » ou « allergique » correspondait aux patients atopiques, atteints d’urticaire chronique, d’urticaireaux aliments ou aux médicaments.
Lorsqu’un bilan allergologique étaient indiqué, étaient réalisés des prick tests du vaccin pur prévu pour la vaccination, des prick tests polysorbate 80 pur, des prick tests Macrogol (PEG 4000) 52,5 g/L d’eau. Une seule lecture à 20 minutes était réalisée pour tous les prick tests. En cas de négativité des tests, la vaccination était réalisée sous surveillance hospitalière d’une heure sous couverture d’une prémédication par un comprimé d’antihistaminique de seconde génération 30 minutes avant l’injection.
4. Éthique
Cette étude non interventionnelle est conforme à l’article 54 de la loi informatique et liberté, loi 78-17 du 6 janvier 1978, modifiée et respecte la méthodologie référence MR-004 de la CNIL. Elle est déclarée sous le numéro 21_5486. L’étude était validée en comité d’éthique le 24/09/2021.
4.1. Résultats
Sur une période de 6 mois, à partir du 1er janvier 2021, 320 demandes d’avis allergologique avant ou après la vaccination anti COVID ont été reçus. Les demandes d’avis étaient réparties dans le temps de la façon suivante : 2,8 % des demandes en janvier (9/320), 6,9 % en février (22/320), 32,5 % en mars (104/320), 24,7 % en avril (79/320), 14,3 % en mai (46/320) et 18,8 % en juin 2021 (60/320).
Parmi ces 320 patients, 77 % étaient des femmes avec un âge moyen de 61 ans (Tableau 1 ).
Tableau 1.
Caractéristiques des patients adressés pour avis allergologique avant ou après une vaccination anti-COVID-19.
| Nombre de patients (%) | 320 (100 %) |
|---|---|
| Sexe féminin | 248 (77 %) |
| Âge (moyenne ± SD) | 61 ± 16,1 |
| Terrain atopique | 81(25,5 %) |
| Allergie alimentaire | 15 (4,7 %) |
| Urticaire chronique spontanée (UCS) | 25 (8,2 %) |
| SAMA | 4 (1,3 %) |
| Urticaire aux médicaments non allergique | 74 (23,1 %) |
| Urticaire aux aliments non allergique | 19 (5,9 %) |
| Mastocytose à risque d’anaphylaxie | 1 (0,3 %) |
| Mastocytose sans risque d’anaphylaxie | 8 (2,5 %) |
| Réactions suite à un vaccin (non COVID) | 50 (15,6 %) |
| Réactions médicamenteuses non explorées (souvenirs flous) | 85 (26,6 %) |
| Allergie médicamenteuse prouvée | 35 (10,9 %) |
Plus de 25 % d’entre eux avaient un terrain atopique, 23 % avaient une urticaire non allergique aux médicaments et 5,9 % une urticaire non allergique alimentaire. Vingt six pour cent des patients avaient présenté une réaction médicamenteuse non identifiée et 10,9 % avaient une histoire d’allergie médicamenteuse prouvée.
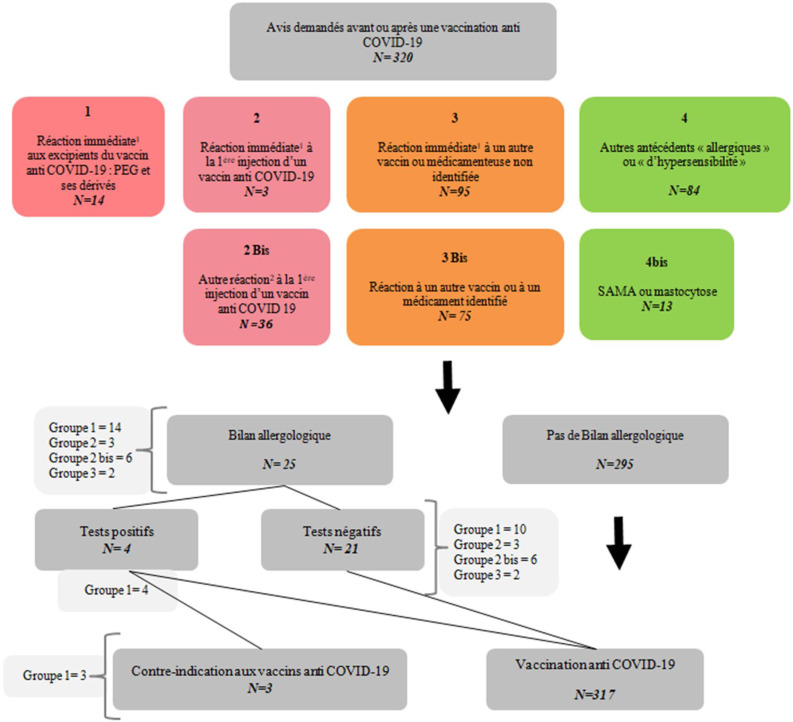
Concernant le profil des patients, le groupe 1 comprenait 14 patients avec un antécédent de réaction immédiate à un médicament contenant du PEG, polysorbate ou leurs dérivés (Fig. 2 ). Ces patients ont tous reçu un bilan allergologique pré vaccinal. Le groupe 2 comprenait 3 patients avec une réaction immédiate suite à une 1re injection de vaccin anti COVID, tous ayant également bénéficié d’un bilan allergologique pré vaccinal. Le groupe 2 bis comprenait 36 patients ayant eu un autre type de réaction suite à une 1e injection de vaccin anti COVID. Le groupe 3 comprenait 95 patients avec une réaction immédiate à un autre vaccin ou à un médicament non identifié. Le groupe 3 bis comprenait 75 patients ayant eu une autre réaction suite à une vaccination ou à un médicament identifié. Le groupe 4 comprenait 84 patients avec un terrain « d’hypersensibilité ». Le Groupe 4 bis comprenait 13 patients avec un antécédent de SAMA ou de mastocytose (Fig. 2).
Fig. 2.
Prise en charge des patients adressés pour avis concernant une « allergie » aux vaccins anti COVID-19. (1) Urticaire généralisée, bronchospasme ou anaphylaxie. (2) Ne répondant pas aux critères du groupe 2 (urticaire localisée, réaction au point d’injection, réactions retardées).
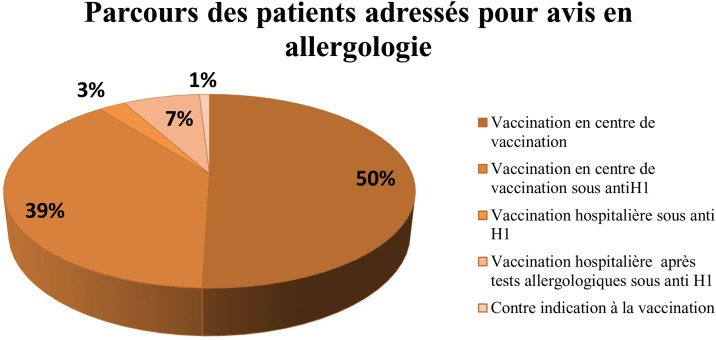
Parmi ces patients, seulement 25 ont nécessité d’un bilan allergique pré vaccinal : 14 patients dans le groupe 1, 3 patients dans le groupe 2, 6 patients dans le groupe 2 bis et 2 patients dans le groupe 3. Parmi ces patients, 50 % d’entre eux furent autorisés à être vacciné en centre de vaccination classique sans prémédication et 39 % en centre de vaccination sous prémédication par anti histaminiques. Quatre-vingt-neuf pour cent des patients ont donc pu être vaccinés dans un centre de vaccination classique. Sept pourcent des patients furent vaccinés après un bilan allergologique préalable en centre hospitalier. Seulement 3 % des patients furent autorisés à être vacciné en centre hospitalier sans bilan allergologique, sous prémédication par anti histaminiques (Fig. 3 ).
Fig. 3.
Parcours des patients adressés pour une suspicion d’allergie aux vaccins anti COVID-19.
Au total, seulement 3 patients avec un bilan allergologique positif (prick tests vaccin, PEG, polysorbate positifs) n’ont pas été vaccinés. Ces patients représentaient moins de 1 % de l’effectif total de notre étude. Un patient avec un bilan allergologique positif a bénéficié d’une adaptation du vaccin : son prick test PEG était positif mais négatif pour le polysorbate. Il a donc pu être vacciné par Janssen sans incident.
5. Discussion
5.1. Apport des résultats de notre étude sur la vaccination anti COVID
Notre étude a mis en évidence une très faible incidence d’allergie aux excipients du vaccin parmi les patients adressés dans notre service d’allergologie. En effet, ils représentent moins de 1 % des patients de notre cohorte sur la période de janvier à juin 2021 inclus. Ces données sont concordantes avec les données de la littérature : l’allergie aux excipients des vaccins anti COVID-19 (PEG et ses dérivés) est très rare [8], [15], tout comme les réactions anaphylactiques post vaccinales [3]. Les recommandations de février 2021 à destination des médecins non allergologues ont donc permis une large vaccination des patients, sans risque anaphylactique grave.
On constate que beaucoup de patients furent adressés de façon non justifiée d’après les recommandations. Par exemple, 84 patients présentaient seulement un terrain « d’hypersensibilité » sans autre antécédent notable pouvant contre indiquer la vaccination. Le nombre de patients testés avant la vaccination confirment ces données : seulement 25 parmi les 320 adressés. Ces avis demandés principalement par les médecins de ville s’expliquent peut-être par la pression exercée par les patients en raison d’un climat de méfiance et d’interrogations autour de ces vaccins anti COVID-19.
Par ailleurs, les valeurs prédictives positives et négatives des tests cutanés au PEG et polysorbate dans l’évaluation de l’allergie potentielle aux vaccins à ARN messager COVID-19 ne sont pas clairement démontrées. Leur utilité a surtout été montrée chez des patients aux antécédents d’anaphylaxie au PEG [18]. Il n’y a d’ailleurs aucune preuve concernant le lien entre les réactions médiées par les IgE aux PEG et les réactions signalées aux vaccins anti-COVID-19. Des voies alternatives non IgE pour l’activation des mastocytes sont à envisager (voies du complément par exemple) car elles pourraient conduire à une présentation clinique similaire dite « anaphylactoïde » [19], [20].
5.2. Réseau ville-hôpital : indispensable à la bonne prise en charge des patients
L’expertise des allergologues dans le diagnostic et le traitement des réactions allergiques est indispensable notamment concernant le dépistage des patients à risque, la formation du personnel soignant effectuant les vaccinations et la gestion des patients avec des réactions suite à un vaccin COVID-19.
Notre étude a mis en évidence l’importance d’une collaboration entre la médecine hospitalière et la médecine de ville pour la bonne prise en charge des patients. En effet, les médecins des centres de vaccination, les généralistes et toutes autres spécialités pouvaient demander un avis au centre investigateur via une plateforme spécialisée et sécurisée. Une réponse rapide dans les 48 heures leur était donnée et permettait d’orienter les patients rapidement soit en centre de vaccination classique soit dans le service pour un bilan allergologique spécifique pré vaccinal ou une vaccination sous surveillance hospitalière. Les réponses rapides aux différents avis ont permis une large vaccination et une levée de contre-indication non justifiée à la vaccination anti COVID-19.
5.3. Limites
Il s’agit d’une étude rétrospective avec tous les biais relatifs à ce type d’analyse. Certains avis demandés via la plateforme sécurisée ou par mail ne précisaient pas l’ensemble des antécédents allergologiques d’intérêt des patients inclus. Il existe également dans notre étude un effet centre concernant le nombre de patients avec une allergie médicamenteuse prouvée, pour lesquels leur médecin ont sollicité un avis. Ces patients représentent un nombre très important de notre population (10,9 %). En comparaison, au risque d’allergie médicamenteuse en général qui est d’environ 5 %, ce chiffre est très important [21].
6. Conclusion
Les recommandations établies à partir de plusieurs instances d’allergologie pour les médecins non allergologues ont permis de lever un grand nombre de contre-indications vaccinales non adaptées. Une vaccination élargie a été possible sans risque anaphylactique grave. L’allergie aux excipients des vaccins anti COVID-19 (PEG et ses dérivés) est très rare dans notre cohorte, comme dans la littérature, et constituait la seule contre-indication allergologique à la vaccination anti COVID-19 d’après les recommandations de février 2021. À ce jour, plusieurs auteurs proposent des inductions de tolérance permettant la vaccination de patients allergiques confirmés aux PEG ou à leurs dérivés avec une bonne tolérance [22], [23].
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Remerciements
Les auteurs tiennent à remercier toute l’équipe du service d’allergologie et immunologie clinique du centre hospitalier Lyon Sud.
Références
- 1.L’OMS valide pour la première fois un vaccin anti-COVID-19 au titre de la procédure pour les situations d’urgence et souligne que l’accès doit être équitable au niveau mondial [Internet]. [cité 14 nov 2021]. Disponible sur: https://www.who.int/fr/news/item/31-12-2020-who-issues-its-first-emergency-use-validation-for-a-covid-19-vaccine-and-emphasizes-need-for-equitable-global-access.
- 2.info coronavirus COVID 19 - Vaccins [Internet]. Gouvernement.fr. [cité 14 nov 2021]. Disponible sur: https://www.gouvernement.fr/info-coronavirus/vaccins.
- 3.Vaccin Pfizer: les chocs allergiques touchent 1 personne sur 100 000 [Internet]. [cité 18 nov 2021]. Disponible sur: https://sciencepost.fr/vaccin-pfizer-reactions-allergiques/.
- 4.Vaccin Covid Pfizer: aux États-Unis, un risque de réaction allergique sévère « excessivement rare » de l’ordre de une pour 100000 injections. Le Quotidien du Médecin [Internet]. [cité 23 nov 2021]. Disponible sur: https://www.lequotidiendumedecin.fr/specialites/infectiologie/vaccin-covid-pfizer-aux-etats-unis-un-risque-de-reaction-allergique-severe-excessivement-rare-de.
- 5.Hause AM. Safety Monitoring of an Additional Dose of COVID-19 Vaccine- United States, August 12–September 19, 2021. MMWR Morb Mortal Wkly Rep [Internet]. 2021 [cité 14 nov 2021];70. Disponible sur: https://www.cdc.gov/mmwr/volumes/70/wr/mm7039e4.htm. [DOI] [PMC free article] [PubMed]
- 6.Reports of Anaphylaxis After Receipt of mRNA COVID-19 Vaccines in the US–December 14, 2020-January 18, 2021. Allergy and Clinical Immunology. JAMA. JAMA Network [Internet]. [cité 14 nov 2021]. Disponible sur: https://jamanetwork.com/journals/jama/article-abstract/2776557. [DOI] [PMC free article] [PubMed]
- 7.PRIME PubMed. Allergic Reactions Including Anaphylaxis After Receipt of the First Dose of Pfizer-BioNTech COVID-19 Vaccine - United States, December 14-23, 2020 [Internet]. [cité 14 nov 2021]. Disponible sur: https://neuro.unboundmedicine.com/medline/citation/33444297/Allergic_Reactions_Including_Anaphylaxis_After_Receipt_of_the_First_Dose_of_Pfizer_BioNTech_COVID_19_Vaccine___United_States_December_14_23_2020_
- 8.Borderé A., Stockman A., Boone B., Franki A.S., Coppens M.J., Lapeere H., et al. A case of anaphylaxis caused by macrogol 3350 after injection of a corticosteroid. Contact Dermatitis. 2012;67:376–378. doi: 10.1111/j.1600-0536.2012.02104.x. [DOI] [PubMed] [Google Scholar]
- 9.Co-Minh H.B., Demoly P., Guillot B., Raison-Peyron N. Anaphylactic shock after oral intake and contact urticaria due to polyethylene glycols. Allergy. 2007;62:92–93. doi: 10.1111/j.1398-9995.2006.01265.x. [DOI] [PubMed] [Google Scholar]
- 10.Zhou Z.H., Stone C.A., Jakubovic B., Phillips E.J., Sussman G., Park J., et al. Anti-PEG IgE in anaphylaxis associated with polyethylene glycol. J Allergy Clin Immunol Pract. 2021;9:1731–1733.e3. doi: 10.1016/j.jaip.2020.11.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Armstrong J.K., Hempel G., Koling S., Chan L.S., Fisher T., Meiselman H.J., et al. Antibody against poly(ethylene glycol) adversely affects PEG-asparaginase therapy in acute lymphoblastic leukemia patients. Cancer. 2007;110:103–111. doi: 10.1002/cncr.22739. [DOI] [PubMed] [Google Scholar]
- 12.Bianchi A., Bottau P., Calamelli E., Caimmi S., Crisafulli G., Franceschini F., et al. Hypersensitivity to polyethylene glycol in adults and children: an emerging challenge: hypersensitivity to polyethylene glycol. Acta Biomed. 2021;92(S7) doi: 10.23750/abm.v92iS7.12384. e2021519-e2021519. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Pre-existing anti-PEG antibodies are associated with severe immediate allergic reactions to pegnivacogin, a PEGylated aptamer - Journal of Allergy and Clinical Immunology [Internet]. [cité 14 nov 2021]. Disponible sur: https://www.jacionline.org/article/S0091-6749(16)30605-4/fulltext. [DOI] [PubMed]
- 14.Schwartzberg L.S., Navari R.M. Safety of Polysorbate 80 in the oncology setting. Adv Ther. 2018;35:754–767. doi: 10.1007/s12325-018-0707-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Palacios Castaño M.I., Venturini Díaz M., Lobera Labairu T., González Mahave I., Del Pozo Gil M.D., Blasco Sarramián A. Anaphylaxis due to the excipient polysorbate 80. J Investig Allergol Clin Immunol. 2016;26:394–396. doi: 10.18176/jiaci.0109. [DOI] [PubMed] [Google Scholar]
- 16.Weiszhár Z., Czúcz J., Révész C., Rosivall L., Szebeni J., Rozsnyay Z. Complement activation by polyethoxylated pharmaceutical surfactants: Cremophor-EL Tween-80 and Tween-20. Eur J Pharm. 2012;45:492–498. doi: 10.1016/j.ejps.2011.09.016. [DOI] [PubMed] [Google Scholar]
- 17.Carole P. Vaccination contre la Covid-19 et antécédents allergiques–Société Française d’Allergologie [Internet]. [cité 12 janv 2022]. Disponible sur: https://sfa.lesallergies.fr/vaccination-contre-la-covid-19-et-antecedents-allergiques/.
- 18.Banerji A., Wickner P.G., Saff R., Stone C.A., Robinson L.B., Long A.A., et al. mRNA vaccines to prevent COVID-19 disease and reported allergic reactions: current evidence and suggested approach. J Allergy Clin Immunol Pract. 2021;9:1423–1437. doi: 10.1016/j.jaip.2020.12.047. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Szebeni J., Fontana J.L., Wassef N.M., Mongan P.D., Morse D.S., Dobbins D.E., et al. Hemodynamic changes induced by liposomes and liposome-encapsulated hemoglobin in pigs: a model for pseudoallergic cardiopulmonary reactions to liposomes. Role of complement and inhibition by soluble CR1 and anti-C5a antibody. Circulation. 1999;99:2302–2309. doi: 10.1161/01.cir.99.17.2302. [DOI] [PubMed] [Google Scholar]
- 20.Suspicions grow that nanoparticles in Pfizer's COVID-19 vaccine trigger rare allergic reactions [Internet]. [cité 9 oct 2022]. Disponible sur: https://www.science.org/content/article/suspicions-grow-nanoparticles-pfizer-s-covid-19-vaccine-trigger-rare-allergic-reactions.
- 21.Lazarou J., Pomeranz B.H., Corey P.N. Incidence of adverse drug reactions in hospitalized patients: a meta-analysis of prospective studies. JAMA. 1998;279(15):1200–1205. doi: 10.1001/jama.279.15.1200. [DOI] [PubMed] [Google Scholar]
- 22.Huynh V.A., Janssen C., Beaumier L. Induction de tolérance au vaccin à ARN COMIRNATY chez un patient avec une hypersensibilité allergique sévère au PEG. Rev Fr Allergol. 2022;62:431–434. doi: 10.1016/j.reval.2021.07.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Romantowski J., Kruszewski J., Solarski O., Bant A., Chciałowski A., Pietrzyk I., et al. Protocol of safe vaccination against COVID-19 in patients with high risk of allergic reactions. Clin Transl Allergy. 2022;12:e12152. doi: 10.1002/clt2.12152. [DOI] [PMC free article] [PubMed] [Google Scholar]