Abstract
El virus de la viruela de los monos es un virus que presenta un 90% de homología genómica con el humano (smallpox), pero se trasmite de forma natural entre diferentes reservorios animales salvajes y es considerado una zoonosis. A lo largo del siglo XX se desarrollaron diferentes vacunas basadas en el poxvirus vaccinia que fueron utilizadas para la vacunación frente a la viruela humana. Tras la erradicación de la viruela humana estas vacunas dejaron de utilizarse. Las vacunas actuales frente a la viruela de los monos se clasifican por la OMS como replicativas (ACAM2000), mínimamente replicativas (LC16m8) y no replicativas (MVA-BN), siendo esta última la utilizada en la actualidad. La epidemia extraafricana de viruela de los monos de 2022 ha puesto en evidencia la falta de vacunas de eficacia demostrada y de baja reactogenicidad. Se considera que la utilización de esta vacuna en el brote actual puede desempeñar un papel en la prevención o atenuación de la enfermedad como profilaxis preexposición en contactos estrechos de casos confirmados.
Palabras clave: Viruela del mono, Vacunas, Vacunación
Abstract
The monkeypox virus is a virus that has 90% genomic homology with the human (smallpox), but it is naturally transmitted between different wild animal reservoirs and is considered a zoonosis. Throughout the 20th century, different vaccines based on the vaccinia poxvirus were developed and used for vaccination against smallpox. After the eradication of smallpox, these vaccines were no longer used. Current vaccines against monkeypox virus are classified by the WHO as replicative (ACAM2000), minimally replicative (LC16m8) and non-replicative (MVA-BN), the latter being the one currently used. The 2022 extra-African monkeypox virus epidemic has highlighted the lack of vaccines with proven efficacy and low reactogenicity. It is considered that the use of this vaccine in the current outbreak may play a role in the prevention or attenuation of the disease as pre-exposure prophylaxis in close contacts of confirmed cases.
Keywords: Monkeypox virus, Vaccines, Vaccination
Introducción
El virus de la viruela de los monos (VM) o monkeypox fue identificado en 1958 en Dinamarca como un nuevo miembro del género Orthopoxvirus como consecuencia del empleo de tejidos y órganos de estos animales en los estudios de seguridad y aislamiento del virus de la poliomielitis para su utilización en vacunas humanas1, 2. Presenta un genoma de tipo ADN de doble hebra que contiene unas 110-260.000 pares de bases, una estructura muy compleja y un tamaño considerable (200-250 nm)1.
La infección humana por la VM fue descrita por primera vez en 1970 en la República Democrática del Congo. A partir de este año se fueron produciendo brotes en países africanos limítrofes2, 3, 4. En 2003 se produjo un brote de 47 casos en EE. UU. como consecuencia de la importación africana de roedores que posteriormente trasmitieron la infección a los perros de las praderas que como mascotas infectaron a los humanos4, 5. La distribución geográfica de esta infección no está establecida ya que apenas se han realizado estudios de portadores en personas o animales salvajes, pero muy probablemente se localice en todas aquellas áreas o países en los que se encuentren las especies animales que actúan de reservorio natural2, 6.
El virus de la viruela (smallpox) es el único miembro del género Orthopoxvirus que infecta exclusivamente al ser humano7 . 8. Por el contrario el virus de la VM (monkeypox) es un virus que presenta un 90% de homología genómica con el humano, pero se trasmite de forma natural entre diferentes reservorios animales salvajes (ardillas y roedores) y es considerado una zoonosis, pudiendo infectar al ser humano por contacto directo con estos animales9. También ha sido descrita la transmisión interhumana, especialmente en zonas rurales y entornos familiares cerrados7, 8. Se han caracterizado dos linajes filogenéticos distintos del virus de la VM que se encuentran distribuidos en el África occidental y central. Los datos epidemiológicos y virológicos parecen indicar diferencias de virulencia o gravedad de la infección en cada uno de ellos; así el linaje central parece mostrar una mayor gravedad (letalidad del 11-17%) y más complicaciones clínicas tanto en humanos como en primates2, 4, 7.
La enfermedad causada por la VM se trasmite por contacto directo y secreciones respiratorias y es muy parecida a la viruela humana, de modo que después de un período de incubación de entre 4-24 días, la mayoría de los pacientes presentan fiebre y cefalea. A los pocos días desarrollan una erupción muy característica que inicialmente es papular, para pasar a vesicular y finalmente pustular. Aunque es una enfermedad benigna en la población sana, puede llegar a presentar una letalidad del 1-5% y asociarse a complicaciones graves o secuelas en el 74% de las personas no vacunadas2, 4, 7, 10. El principal diagnóstico diferencial hay que hacerlo con la varicela, (designado como chickenpox), aunque no lo produce ningún poxvirus, sino un herpesvirus8, 10.
Desde la aparición de los diferentes brotes africanos apenas se habían descrito casos de VM fuera de estos países. Sin embargo a partir de abril de 2022 se ha producido un brote extraafricano que ha comportado la confirmación de más de 60.000 casos. Este brote actual se caracteriza por afectar preferentemente (95%) a los hombres que mantienen sexo con otros hombres, de modo que este se ha convertido en el principal grupo de riesgo y la epidemia se ha expandido en este colectivo11. El control del brote epidémico de la VM debe realizarse aplicando medidas de salud pública dirigidas a los grupos de riesgo, estableciendo sistemas de vigilancia epidemiológica como el aislamiento y el control de las personas infectadas12. Los fármacos antivirales frente a la VM son escasos y de eficacia variable13 y por ello solo las vacunas específicas frente al virus de la viruela humana, que protegen al 95% frente a la VM, podrían utilizarse en ciertas situaciones de riesgo12.
Vacunas de primera generación
A lo largo del siglo XX se desarrollaron diferentes vacunas basadas en el poxvirus vaccinia con características biológicas distintas que fueron utilizadas para la vacunación frente a la viruela humana. Estas vacunas contenían virus replicativos activos y competentes con reactogenicidad humana variable. Durante las diferentes campañas de erradicación de la viruela humana se utilizaron como vacunas diferentes cepas del virus vaccinia como la Lister/Elstree, New York City Board of Health (NYCBH, vacuna Dryvax®), EM-63 y la Tian-Tan, elegidas por su elevada seguridad en comparación con otras cepas como la Copenhagen o la Bern14, 15. Estas vacunas de primera generación se diferenciaban por su capacidad de infectar diferentes tejidos; así la vacuna Lister se hacía crecer en la membrana corioalantoidea de embriones de pollo (MCEP) y la NYCBH en células cutáneas de vaca o búfalo acuático. También se diferenciaban por su forma de presentación, congeladas o liofilizadas14, 16. La producción de estas vacunas fue disminuyendo a medida que la erradicación de la viruela fue avanzando, hasta quedar en depósito en los laboratorios de alta seguridad. En EE. UU. la vacunación general finalizó en 1972 y en 1989 para la población militar; la vacuna Dryvax® dejó de fabricarse en 1978, aunque se almacenaron 15 millones de dosis como medida preventiva14, 15, 16.
Vacunas de segunda generación
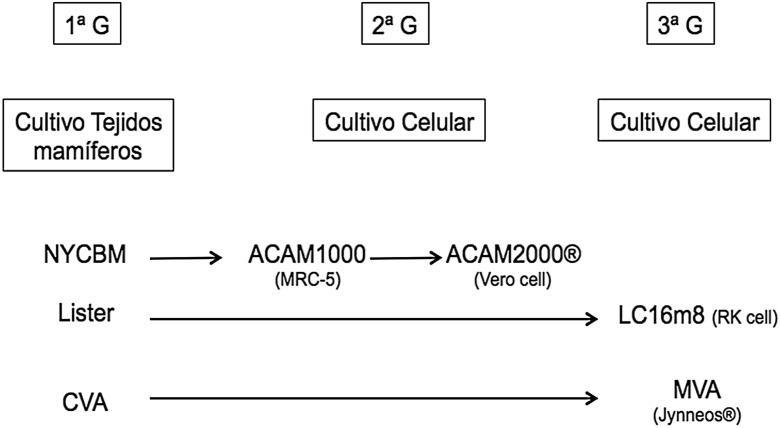
En la década de 1990 y ante la posible utilización del virus vaccinia como arma de bioterrorismo, el gobierno americano decidió reiniciar los estudios destinados a mejorar la seguridad e inmunogenicidad de la vacuna Dryvax®; esta vacuna se obtenía de las pústulas provocadas por el virus en la piel de terneros, por ello presentaba muchas impurezas y efectos no deseados. La empresa Acambis, Inc. (Cambridge, MA) fue la encargada de realizar los estudios moleculares de adaptación y mejora de la nueva vacuna frente a la viruela. Los primeros análisis mostraron que esta vacuna era heterogénea y formada por 6 clones virológicos distintos en cuanto a virulencia e inmunogenicidad. De todos ellos, el clon 2 (CL2) parecía presentar el comportamiento medio de la propia vacuna y el que presentaba una menor neurovirulencia en animales. Este clon CL2 fue pasado 7 veces en la línea de fibroblastos humanos MRC-5 y designada como ACAM1000. Para incrementar su atenuación, esta nueva cepa fue pasada 10 veces en la línea celular Vero (African Green monky kidney epitelial cells) dando lugar a la cepa y vacuna definitiva designada como ACAM2000 (Emergent BioSolutions Inc. Gaithersburg, Maryland, EE. UU.) (fig. 1 )17, 18.
Figura 1.
Evolución de las tres generaciones de vacunas frente a la viruela humana.
CVA: corioalantoidea vaccinia; MVA: Modified Vaccinia Ankara.
ACAM2000 es una vacuna viva atenuada que fue aprobada por la FDA en agosto de 2007 para reemplazar a la antigua vacuna Dryvax® basada en un vaccinia virus18, 19. Esta vacuna está indicada frente a la viruela humana en personas de riesgo mayores de 18 años inmunocompetentes, no está indicada para inmunodeprimidos, embarazadas ni lactantes. Solo se debe administrar una dosis y cada una de ellas contiene entre 2,5-12,5 x 105 unidades infectivas y se administra por la ruta percutánea (escarificación) utilizando una aguja bifurcada. Durante su administración debe tenerse mucha precaución ya que puede trasmitirse el virus a las personas que están en contacto con la persona vacunada, incluso con el personal que realiza la vacunación. Los principales efectos adversos se presentan en el sitio de la inoculación, aunque también se han descrito efectos generales (cefalea, malestar, fiebre)18, 19, 20.
En una persona vacunada por primera vez se produce una reacción cutánea tipo pustulosa en el punto de inoculación; esta lesión va evolucionando dando lugar a una pápula a los 2-5 días. La pápula evoluciona a vesícula a los 8-10 días y se seca y forma una costra a los 14-21 días, siguiendo la evolución clásica de la vacunación previa a 1.98019. La transmisión inadvertida solo se produce con esta vacuna y puede comportar la transmisión vertical determinando una viruela fetal grave. En la vacuna ACAM2000 se han descrito miopericarditis con una frecuencia de 5,7/100.000 vacunados y encefalitis posvacunal20, 21.
Vacunas de tercera generación
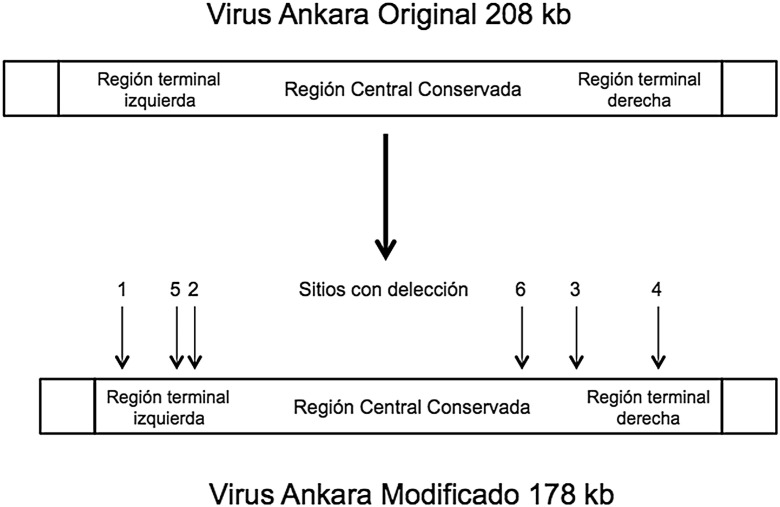
En 1.959 el microbiólogo alemán Anton Mayr empezó a infectar células derivadas de la membrana corioalantoidea de embriones de pollo (MCEP) con la cepa vacunal (vaccinia) frente a la viruela humana con el objetivo de obtener una nueva cepa atenuada22. Transcurridos varios años de pases celulares (>500), comprobó cómo este virus se había modificado y ya no era capaz de infectar a las células humanas. Sin embargo, al ser inoculado experimentalmente a animales de laboratorio, ratones y chimpancés, inducía una intensa respuesta inmune que los protegía de la viruela humana. En 1968, y tras 516 pases en MCEP, al virus se le denominó Modified Vaccinia Ankara (MVA) debido a que la cepa original procedía de un paciente de esta ciudad turca. La comparación de los mapas genómicos del virus Ankara original y el modificado (fig. 2 ) mostró importantes deleciones y mutaciones que acortaban la longitud del genoma viral pasando de 208 kb a 178 kb21. Las principales modificaciones correspondían a: a) la incapacidad de la cepa para infectar y replicarse en células de mamíferos (restricción de huésped); b) la pérdida de los genes que determinaban la formación de las inclusiones intracitoplasmáticas tipo A y c) acortamiento de la secuencia codificadora de la hemaglutinina viral que dificultaba su unión al receptor celular. Todas estas modificaciones convertían a la cepa MVA en una nueva herramienta de utilidad genómica y de producción vacunal con una elevada seguridad y respuesta inmune protectora frente la viruela humana y del mono. La cepa MVA fue utilizada por el Bavarian State Institute for Vaccines (Bavarian Nordic, Hellerup, Dinamarca) para la producción industrial de vacunas frente a la viruela humana23, 24.
Figura 2.
Modificaciones genéticas del virus Ankara original tras 572 pases en células embrionarias de pollo.
Jynneos® (también denominada Imvamune, Imvanex o MVA-BN) es una vacuna de virus atenuados no replicativos producida a partir de la modificación genética del virus vaccinia Ankara-Bavarian Nordic (cepa MVA-BN) crecida en fibroblastos de embriones de pollo. Cada dosis de 0,5 ml contiene entre 0,5 y 3,95 x 108 de unidades infectivas19. Fue aprobada por la FDA en septiembre de 2019 e indicada para la prevención de la viruela humana (smallpox) y de los monos (monkeypox) en mayores de 18 años con riesgo de adquirir estas infecciones25. Esta vacuna fue aprobada posteriormente en Europa con el nombre de Imvanex®. Se administraba en dos dosis de 0,5 ml separadas por 28 días (4 semanas) por vía subcutánea o intramuscular. En 2022 la FDA autorizó, en base a los resultados obtenidos por Frey et al.26 en 2015 con la vacuna MVA, la administración de tan solo 0,1 ml de esta vacuna pero por vía intradérmica. La elevada carga viral de la vacuna original y la demostración de una respuesta inmune semejante a la dosis recomendada previamente, fueron las principales razones para autorizar esta nueva dispensación vacunal27, 28. Las reacciones adversas se analizaron en un estudio clínico aleatorizado, doble ciego frente a placebo en un grupo de voluntarios de entre 18-40 años que recibieron dos dosis de Jynneos® frente a placebo. La mayoría de los efectos fueron a nivel del punto de inyección (dolor, enrojecimiento, edema) y locales (dolor muscular)25.
El análisis de la inmunogenicidad de la vacuna Jynneos® frente a la ACAM2000 se realizó en un estudio aleatorizado en adultos (18-42 años) que recibieron dos dosis de la primera (220 sujetos) y una de la segunda (213 sujetos). El objetivo primario de este estudio era conocer la media geométrica del título de anticuerpos neutralizantes (GMT) inducida por cada una de estas vacunas. Se comprobó cómo la vacuna Jynneos® inducía unos GMT posvacunales casi el doble (152,8 frente a 84,4) que los obtenidos con la vacuna ACAM200023, 24. Greenberg et al.24 realizaron un estudio fase II aleatorizado, doble ciego para evaluar la seguridad e inmunogenicidad de la MVA frente a placebo en personas de 56-80 años, comprobando que una o dos dosis de MVA es segura e inmunogénica en este grupo de edad.
La LC16m8 es una vacuna atenuada japonesa derivada de la cepa vacunal Lister; se desarrolló en los años 70 del siglo XX para mejorar la seguridad de las utilizadas en ese momento. La atenuación se realizó a través de múltiples pases en células primarias de riñón de conejo a temperaturas subóptimas, por ello debe considerarse como una vacuna sensible a la temperatura corporal humana14. Los datos moleculares mostraron las mutaciones inducidas por los pases en el gen B5R, dando lugar a un antígeno B8 truncado y una ineficiente producción de viriones extracelulares. Esta vacuna inducía una robusta protección frente a la viruela humana e inmunidad semejante a las vacunas convencionales pero con menos efectos adversos. Sin embargo, la capacidad replicativa del virus atenuado incluido en la vacuna y la posible reversión del gen B5R, hacía pensar en que su proceso de atenuación era menor que el obtenido en la vacuna MVA29, 30.
De las otras vacunas de tercera generación cabe mencionar la NYVAC que es atenuada y derivada de la cepa original Copenhagen. Se ha generado mediante una deleción de 18 genes no esenciales necesarios para codificar los genes de virulencia, dando lugar a una cepa atenuada de elevada seguridad. Recientes estudios parecen demostrar que esta vacuna induce bajos niveles de inmunidad humoral en los humanos en comparación con vacunas previas, motivo por el que ha dejado de utilizarse10, 14, 31. Por otro lado, la vacuna defectiva dVV-L se generó modificando la cepa Lister a través de la deleción del gen codificador del gen uracil-ADN-glucosilasa, esencial en la replicación viral. A pesar de que induce buena respuesta inmune, no se ha probado su capacidad para evitar la infección exógena por el virus de la viruela humana31.
Estrategias de vacunación
LA OMS ha publicado una guía de recomendaciones para la utilización de las vacunas frente a la VM12. En ella se establecen las siguientes conclusiones: a) de acuerdo con los riesgos, beneficios y escasez vacunal, no se recomienda la vacunación masiva de la población no expuesta ya que el riesgo de la misma es en estos momentos baja; b) la transmisión interhumana de la VM se debe controlar mediante medidas de salud pública (detección, aislamiento y seguimiento de casos); c) en los contactos estrechos de personas infectadas, se recomienda la profilaxis postexposición con una vacuna, preferentemente, de tercera generación, en los primeros 3-4 días de la exposición (hasta 14 días en ausencia de síntomas) pero si se administra entre los días 4-14 postexposición la vacuna solo reduce los síntomas pero no previene la enfermedad; y d) la profilaxis preexposición solo se recomienda para los trabajadores sanitarios de elevado riesgo de exposición, personal de laboratorio que trabaje directamente con cualquier poxvirus y las personas designadas por las autoridades sanitarias por estar implicadas directamente en el tratamiento y contacto con los posibles casos12, 19.
Las vacunas actuales frente a la VM se clasifican por la OMS como replicativas (ACAM2000), mínimamente replicativas (LC16m8) y no replicativas (MVA-BN) y las principales diferencias y recomendaciones de utilización se describen en las Tabla 1, Tabla 2 ; estas recomendaciones son muy similares a las realizadas por la ACIP en 2022, siendo favorables al empleo preferencial de la vacuna no replicativa (Jynneos®)12. La MVA-BN podría utilizarse en < 18 años con elevado riesgo de contagio, pero fuera de la ficha técnica12.
Tabla 1.
Principales diferencias entre las vacunas actuales frente a la viruela humana y del mono
| ACAM2000® | Jynneos® | |
|---|---|---|
| Virus | Atenuado | Modificado |
| Origen virus | NYCBM | MVA-BN |
| Replicación | Competente | Deficiente |
| Dosis | 1 | 2 (a los 28 días) |
| Composición | 2,5-12,5 x 105 ui | 0,5-3,95 x 108 ui |
| Inyección | Percutánea | Subcutánea |
| Reacción cutánea | Sí | No |
| Inoculación accidental | Sí | No |
| Autoinoculación | Sí | No |
| Eczema vacunal | Sí | No |
| Inmunodeprimidos | No | Sí |
| Embarazo | No | Sí |
ui: unidades infectivas.
Tabla 2.
Tipo de vacunas recomendadas según la situación de la persona expuesta
| ACAM2000 | MVA-BN | LC16m8 | |
|---|---|---|---|
| Adultos sanos | Sí | Sí | Sí |
| Inmunodeprimido | No | Sí | No |
| Embarazo | No | Sí | Sí |
| Lactancia | No | Sí | Sí |
| Niños <18 años | No | Sí* | No |
Fuera de ficha técnica.
En España las autoridades sanitarias han publicado unas recomendaciones para la detección precoz y tratamiento de los casos sospechosos de VM32. Se considera que la utilización de la vacuna Imvamex® en el brote actual puede desempeñar un papel en la prevención o atenuación de la enfermedad como profilaxis preexposición en contactos estrechos de casos confirmados. Sin embargo debido a la baja disponibilidad vacunal se debería priorizar la vacunación postexposición33. La vacuna se ha convertido en estos momentos en una medida, que junto con el control epidemiológico y clínico de los pacientes, está determinando una disminución progresiva de la actual epidemia de viruela del mono34.
Financiación
No se ha recibido ninguna financiación para la realización de este trabajo.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- 1.Jezek Z., Fenner F. Human monkeypox. Monogr Virol. 1988;17:1–40. [Google Scholar]
- 2.McCollum A.M., Damon I.K. Human monkeypox. Clin Infect Dis. 2014;58:260–267. doi: 10.1093/cid/cit703. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Rimoin A.W., Mulembakani P.M., Johnston S.C., Lloyd-Smith J.O., Kisalu N.K., Kinketa T.L., et al. Major increase in human monkeypox incidence 30 years after smallpox vaccination campaigns cease in the Democratic Republic of Congo. PNAS. 2010;107:16262–16267. doi: 10.1073/pnas.1005769107. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Reina J., Reina N. ¿Deberíamos empezar a preocuparnos por la viruela del mono? Med Clin (Barc.) 2018;151:320–322. doi: 10.1016/j.medcli.2018.03.025. [DOI] [PubMed] [Google Scholar]
- 5.Reed K.D., Melski J.W., Craham M.B., Regnery T.L., Sotir M.J., Wegner M.V., et al. The detection of monkeypox in humans in the Western Hemisphere. N Engl J Med. 2004;350:342–350. doi: 10.1056/NEJMoa032299. [DOI] [PubMed] [Google Scholar]
- 6.Parker S., Buller R.M. A review of experimental and natural infections of animals with monkeypox virus between 1958 and 2012. Future Virol. 2013;8:129–157. doi: 10.2217/fvl.12.130. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Damon I.K. Status of human monkeypox: clinical disease, epidemiology and research. Vaccine. 2011;29(S4):D54–D59. doi: 10.1016/j.vaccine.2011.04.014. [DOI] [PubMed] [Google Scholar]
- 8.Jezek Z., Szceniowski M., Paluku K.M., Mutombo M. Human monkeypox: clinical features of 282 patients. J Infect Dis. 1987;156:293–298. doi: 10.1093/infdis/156.2.293. [DOI] [PubMed] [Google Scholar]
- 9.Khodakevich L., Jezek Z., Kinzanzka K. Isolation of monkeypox virus from wild squirrel infected in nature. Lancet. 1986;1:98–99. doi: 10.1016/S0140-6736(86)90748-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Lum F.M., Torres-Ruesta A., Tay M.Z., Lin R.T., Lye D., Renia L., et al. Monkeypox: disease epidemiology, host immunity and cliniocal interventions. Nat Rev Immunol. 2022;5:1–17. doi: 10.1038/s41577-022-00775-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.World Health Organizarion (2022). Monkeypox. Disponible en: https://www.who.int/health-topics/monkeypox.
- 12.World Health Organization, Vaccines and immunization for monkeypox: Interim guidance. 24 August 2022. [consultado 13 Sep 2022]. Disponible en: https://www.who.int/publications/i/item/WHO-MPX-Immunization-2022.2-eng.
- 13.Sherwat A., Brooks J.T., Birnkrant D., Kim P. Tecovirimat and the treatment of monkeypox: past, present and future considerations. N Engl J Med. 2022;387:579–581. doi: 10.1056/NEJMp2210125. [DOI] [PubMed] [Google Scholar]
- 14.Melamed S., Israely T., Paran N. Challenges and achievements in prevention and treatment of smallpox. Vaccines. 2018;6:8. doi: 10.3390/vaccines6010008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Fenner F. A successful eradication campaign. Global eradication of smallpox. Rev Infect Dis. 1982;4:916–930. doi: 10.1093/clinids/4.5.916. [DOI] [PubMed] [Google Scholar]
- 16.Collier L.H. The development of a stable smallpox vaccine. J Hyg. 1955;53:76–101. doi: 10.1017/s002217240000053x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Nalca A., Zumbrum E.E. ACAM2000TM. The new smallpox vaccine for United States strategic national stockpile. Drug Des Devel Ther. 2010;4:71–79. doi: 10.2147/dddt.s3687. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Monath T.P., Caldwell J.R., Mundt W., Fusco J., Johnson C.S., Buller M., et al. ACAM2000 clonal Vero cell culture vaccinia virus (New York City board of health strain), a second generation smallpox vaccine for viological defense. Int J Infect Dis. 2004;S2:S31–S44. doi: 10.1016/j.ijid.2004.09.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Rizk J.G., Lippi G., Henry B.M., Forthal D.N., Rizk Y. Prevention and treatment of monkeypox. Drugs. 2022 doi: 10.1007/s40265-022-01742-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Voigt E.A., Kennedy R.B., Poland G.A. Defending against smallpox: a focus on vaccines. Expert Rev Vaccines. 2016;15:1197. doi: 10.1080/14760584.2016.1175305. 211. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.ACAM2000 Package insert. Gaitherburg, MD: emergent product development Gaithersburg Inc 2007. [consultado Sep 2022]. Disponible en: https://www.fda.gov/media/75792/dowload..
- 22.Kupferschmidt K. Monkeypox vaccination plans take shape amid questions. Science. 2022;376:1142–1143. doi: 10.1126/science.add3743. [DOI] [PubMed] [Google Scholar]
- 23.Pittman P.R., Hahn M., Lee H.S., Koca C., Samy N., Schmidt D., et al. Phase 3 efficacy trial of modified vaccinia Ankara as a vaccineagainst smallpox. N Engl J Med. 2022;381:1897–1908. doi: 10.1056/NEJMoa1817307. [DOI] [PubMed] [Google Scholar]
- 24.Greenberg R.N., Hay C.M., Stapleton J.T., Marbury T.C., Wagner E., Kreitmeir E., et al. A randomized, double-blind, placebo-controled phase II trial investigating the safety and immunogenicity of modified vaccinia Ankara smallpox vaccine (MVA-BN) in 56-80-year-old subjects. PLoS ONE. 2016 doi: 10.1371/journal.pone.0157335. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Rao A.K., Petersen B.W., Whiehill F., Razeq J.H., Isaacs S.N., Merchlinsky M.J., et al. Use of JYNNEOS (smallpox and monkeypox vaccine, live, nonreplicating) for preexposure vaccination of persons at risk for occupational exposure to orthopoxviruses: recommendations of the Advisory Committee on Immunization Practices United States, 2022. Morb Mortal Wkly Rep. 2022;71:734–742. doi: 10.15585/mmwr.mm7122e1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Frey S.E., Stapleton J.T., Ballas Z.K., Rasmussen W.L., Kaufman T.M., Blevins T.P., et al. Human antibody responses following vaccinia immunization using protein microarrays and correlation with cell-mediated immunity and antibody-depeddnt celular cytotoxicity responses. J Infect Dis. 2021;224:1372–1382. doi: 10.1093/infdis/jiab111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Larkin H.D. FDA authorizes intradermal vaccine, streamlines rules to increase monkeypox treatment Access. JAMA. 2022;328:819. doi: 10.1001/jama.2022.14692. [DOI] [PubMed] [Google Scholar]
- 28.Brooks J.T., Marks P., Goldstein R.H., Walensky R.P. Intradermal Vaccination for Monkeypox - Benefits for Individual and Public Health. N Engl J Med. 2022;387:1151–1153. doi: 10.1056/NEJMp2211311. [DOI] [PubMed] [Google Scholar]
- 29.Kennedy J.S., Gurwith M., Deckker C.L., Frey S.E., Edwards K.M., Kenner J., et al. Safety and immunigenicity of LC16m8, an attenuted smallpox vaccine in vaccinia-naive adults. J Infect Dis. 2011;204:1395–1402. doi: 10.1093/infdis/jir527. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Eto A., Saito T., Yokote H., Kurane I., Kanatani Y. Recent advances in the study of live attenuated cell-cultured smallpox vaccine LC16m8. Vaccine. 2015;33:6106–6111. doi: 10.1016/j.vaccine.2015.07.111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Midgley C.M., Putz M.M., Weber J.N., Smith G.L. Vaccinia virus strain nyvac induces substantially lower and qualitatively different human antibody responses compared with strains lister and dryvax. J Gen Virol. 2008;89:2992–2997. doi: 10.1099/vir.0.2008/004440-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Ponencia de alertas y planes de preparación y respuesta. Protocolo para la detección precoz y manejo de casos ante la alerta de viruela de los monos (monkeypox) en España. Ministerio de Sanidad. [consultado 5 Ago 2022]. Disponible en: https://www.sanidad.gob.es/profesionales/saludPublica/ccayes/alertasActual/alertaMonkeypox/home.htm.
- 33.Comisión de Salud Pública. Recomendaciones de vacunación en el brote actual de viruela del mono. Consejo interterritorial. Ministerio de Sanidad. [consultado 9 Jun 2022]. Disponible en: https://www.sanidad.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/MonkeyPox/docs/Propuesta_vacunacion_Monkeypox.pdf.
- 34.Poland G.A., Kennedy R.B., Tosh P.K. Prevention of monkeypox with vaccines: a rapid review. Lancet Infect Dis. 2022 doi: 10.1016/S1473-3099(22)00574-6. S1473-3099(22)00574-6. [DOI] [PMC free article] [PubMed] [Google Scholar]