Abstract
泡沫稳定性影响泡沫硬化疗法的疗效及副作用发生率。探究泡沫压差与泡沫稳定性的关系,能够为获得更稳定的泡沫提供思路和依据。实验选用鱼肝油酸钠泡沫,添加不同浓度的泊洛沙姆188(浓度为0%、4%、8%、12%)实现泡沫压差的改变。使用自编程序处理泡沫图片,获得泡沫压差以及泡沫的稳定性指标(析水率曲线、半衰期)与泡沫压差的关系。研究结果显示,不同时间段内的泡沫压差先随浓度增加而增加,再随浓度增加而减小,在浓度4%时达到峰值。泡沫压差随衰变时间的增加不断减小;添加剂为低浓度时,泡沫平均压差增加,添加剂浓度过高却会使泡沫平均压差减小;泡沫压差越小,泡沫稳定性越好。本文为泡沫硬化剂稳定性的研究奠定基础。
Keywords: 泡沫压差, 泡沫稳定性, 泡沫半衰期, 静脉曲张
Abstract
Foam stability affects the efficacy and incidence of side effects of foam sclerotherapy. Exploring the relationship between foam pressure difference and foam stability can provide ideas and basis for obtaining more stable foam. In the experiment, sodium cod liver oleate foam was selected, and poloxamer 188 (concentration of 0%, 4%, 8%, 12%) was added to realize the change of foam pressure. By using the self-written program to process the foam pictures, the foam pressure difference and the relationship between the foam stability indicators (water separation rate curve, half-life) and the foam pressure difference were obtained. The results showed that at first the foam pressure increased with the increase of the concentration, and then it decreased with the increase of the concentration and reached a peak at the concentration of 4%. The foam pressure difference decreases continuously with the increase of decay time. When the additive concentration is low, the foam average pressure difference increases. And if the additive concentration is too high, the foam average pressure difference decreases. The smaller the foam pressure difference is, the better the foam stability is. This paper lays a foundation for the research on the stability of foam hardener.
Keywords: Foam pressure difference, Foam stability, Foam half-life, Varicose veins
引言
下肢静脉曲张是静脉系统常见病,发病率约为40%。泡沫硬化疗法是静脉曲张的治疗手段之一。该疗法将液态硬化剂(如聚多卡醇、鱼肝油酸钠等)按一定体积比与气体(如空气、CO2、CO2/O2等)混合形成泡沫,再将泡沫注射入曲张节段,使静脉血管纤维条索化并堵塞血液,让曲张静脉闭塞[1-2]。泡沫硬化疗法以操作简单、微创、炎症反应低且疗效可观等优点逐渐被患者认可[3-4]。但泡沫硬化疗法仍面临诸多副作用[5],如肺动脉栓塞、深部静脉血栓、视觉障碍、静脉炎等[6-7];而泡沫的衰变与这些副作用直接相关[8-10]。因此,泡沫的稳定性一直是泡沫硬化疗法重点关注的问题之一[11-14]。
Tessari法是规范化制备泡沫的常用方法之一,由气体和液体按一定比例,利用注射器垂直相连来回推注混合,形成均匀稳定的泡沫[15-18]。Cameron等[19]研究发现了气体成分对泡沫结构和稳定性的影响;文献[20-23]发现了药物浓度对泡沫稳定性存在影响。诸多学者对制备方式、推注速度、药物、气体种类等进行了大量实验研究,获得了一些特定的结果[24-28],但均无法统一表征泡沫稳定性。而泡沫的衰变主要由气体扩散和排液引起,排液主要由重力及表面张力引起,气体扩散的原动力是泡沫的内外压差,而压差主要由泡沫直径和表面张力获得,因此压差是表征泡沫衰变原因的重要指标。为此,本研究拟通过实验测试,获得压差及半衰期规律,并探索两者之间的关系。
本研究能够获取泡沫内部的相关数据和规律,为临床硬化剂泡沫的稳定性改善提供基础,并为其他泡沫研究提供数据支撑和相关思路。
1. 材料和方法
1.1. 实验材料
鱼肝油酸钠注射液(H31022749,上海信谊金朱药业有限公司,中国)、泊洛沙姆188(P-188)(9003-11-6,BASF,德国)、5 mL注射器(5 mL,江西洪达医疗器械集团有限公司,中国)、三通阀(FS-3002,广东百合医疗科技有限公司,中国)、载玻片、盖玻片。
本文在研究过程中使用了如下的测量仪器和计算分析软件:
(1)千分之一天平(JA303P,常州市幸运电子设备有限公司,中国);
(2)摄像机(FDR-AX45,索尼,日本);
(3)电子显微镜(BX53,奥林巴斯,日本);
(4)表面张力仪(BZY200,上海方瑞仪器有限公司,中国);
(5)统计产品与服务解决方案软件SPSS(17.0, SPSS Inc., 美国)
1.2. 实验方法及步骤
本实验由两部分组成:
第一部分:制备不同浓度的P-188泡沫并研究其泡沫稳定性。鱼肝油酸钠和空气按照1:4比例用Tessari法制备泡沫。实验步骤:① 室温20℃,以千分之一天平称取质量为0、10、20、30 mg的P-188,分别溶解在5 mL鱼肝油酸钠注射液中,再按每支注射器1 mL的体积分装到20支5 mL注射器中,获得P-188浓度分别为0%、4%、8%、12%的鱼肝油酸钠溶液;② 用5 mL注射器抽取4 mL空气。将鱼肝油酸钠溶液和空气通过三通阀垂直连接后,由同一实验人员来回推注20次,得到均匀的鱼肝油酸钠泡沫;③ 记录制备完成的时间,然后将制备得到的泡沫迅速从注射器取下,竖直放置在桌面上静置,并用摄像机记录下泡沫衰变的全部过程;④ 重复此操作直至完成所有实验及数据记录;⑤ 整理实验场地,对所记录的实验数据进行整合分析。
采用反复回放摄像机录制的视频来读取相关数据,包括:① 析水率与对应时间,用以描述泡沫析水过程,该过程能够很好地反映泡沫衰变的整个过程。其中,析水率=析水量/药品总量。② 析水时间,即泡沫中出现可见液体时间。③ 半衰期,半衰期指泡沫析出液体达到原药剂50%所用的时间。④ 泡沫半衰期的体积量,即泡沫半衰期时剩余的泡沫量。
第二部分:获取泡沫压差的实验。在电子显微镜下观察其泡沫尺寸分布并计算各浓度下的泡沫压差。使用表面张力仪测定添加不同浓度P-188后的泡沫硬化剂表面张力,结果如表1所示。具体的实验步骤:① 制备鱼肝油酸钠泡沫样品,并用电子显微镜对泡沫样品进行预实验,确定电子显微镜采用的目镜和物镜倍数,并确定大致焦距;② 利用Tessari方法制备泡沫;③ 记录制备完成的时间,迅速取下后挤压极少量泡沫至载玻片,并迅速将盖玻片轻柔地盖至泡沫处,得到单层泡沫样本;④ 将泡沫样本置于物镜下,通过屏幕截图同时记录下此时物镜下泡沫的尺寸分布以及该尺寸分布所对应的时间;⑤ 迅速调整样本位置,使得屏幕扫描出样品另一处的泡沫图像,迅速通过屏幕截图同时记录下此时物镜下泡沫的尺寸分布以及该尺寸分布所对应的时间,重复此步骤直至记录下该泡沫样品五处不同位置的尺寸分布图像和该图像记录的相应时间;⑥ 重复此操作直至完成实验及数据记录;⑦ 整理实验场地,对所记录的实验数据进行整合分析。
表 1. Determination of basic parameters of foam hardener.
泡沫硬化剂基本参数测定
| (P-188+鱼肝油 酸钠)浓度 |
表面张力/ (mN·m−1) |
密度/ (mg·mL−1) |
| 0% | 1.50 | 50 |
| 4% | 1.54 | 52 |
| 8% | 1.58 | 54 |
| 12% | 1.56 | 58 |
泡沫制备都在相同条件下进行数据处理。首先,因为单张图片的泡沫数量多,图片总量大,因此利用泡沫识别自编程序记录的泡沫尺寸,识别超过95%以上的泡沫,认为值是可信的,如图1所示蓝色标记的泡沫,并根据比例计算得到实际的每个泡沫的尺寸。通过如式(1)所示计算出每组泡沫的压差值。
图 1.
Foam recognition processing result
泡沫识别处理结果
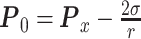 |
1 |
其中,P0为泡沫内部压强,Px为泡沫外部的液体压强(本实验中默认外部压力为0),σ为气/液界面张力(通过表面张力仪测得,每个浓度下测量三次取平均值),r为泡沫半径。最后,通过计算得到每组泡沫内外压差的均值以及泡沫压差分布。
2. 结果
如图2所示,从泡沫的析水过程总体曲线可以看出,泡沫在半衰期前的衰变较快,而在60%~70%衰变之后速度则越来越慢。在0%、4%、8%、12%四个不同表面活性剂浓度下的四个析水过程图像具有相似的变化规律,以4%为例,泡沫衰变到60%所用平均时间为373 s,衰变速度较为迅速,而在析水率到达60%后,由析水率60%到析水率80%所用平均时间为509 s,衰变速度大大减缓。析水率达到0%、20%、40%、60%、80%时,标准误差分别为6.8 s、9.2 s、13.0 s、21.6 s、28.3 s、97.2 s,随着析水率的升高,离散度也越来越大。其余各浓度下的泡沫衰变过程都与4%浓度泡沫衰变过程具有类似规律。
图 2.
The overall curves of foam drainage process
泡沫析水过程总体曲线图
如图3所示的五个时间段泡沫显微图像,随着时间的推移,泡沫的含液量逐渐减少,泡沫数量减少,直径离散度增加,大泡沫数量增多,后期可能出现肉眼可见泡沫。说明随着时间的推移泡沫直径发生较大变化,如式(1)所示,泡沫直径直接影响压差大小,泡沫在不同时期的稳定性情况可以表征压差的大小变化。
图 3.
Microscopic images of bubbles in five time periods
五个时间段的泡沫显微图像
将所有泡沫直径分类进行从小到大排序编号后,画出如图4所示泡沫分布规律。以直径40 μm作为分界线,可以获得不同时期大、小泡沫的数量分布规律。整体而言,小于40 μm的泡沫更多,最大泡沫直径差异约5倍,最小泡沫约为10 μm,最大泡沫直径不超过120 μm。四种浓度下,81~90 s时间段的小泡沫数量最少,大泡沫直径更大,总数量减少。而81~90 s之前的时间段小泡沫数量差异较小,大泡沫有一定差异。浓度为12%时,泡沫总数量减少。
图 4.
Foam diameter distribution.
泡沫直径分布
如图5所示的平均直径来看,整体增大,特别是4%浓度下,泡沫直径最小,升高趋势明显。而0%浓度下,泡沫直径变化不显著。 泡沫平均直径分布在20~24 μm之间。图5平均压差结果是通过泡沫平均直径结果和表1中的表面张力代入式(1)获得。整体而言,平均压差随着时间逐渐减小,最大幅度约为15 Pa。不同浓度下平均压差的大小有一定差异,4%浓度时,压差最大,8%浓度稍小,0%最小。表面活性剂的浓度对泡沫压差具有一定影响。
图 5.
Average foam diameter and foam pressure difference in different periods
不同时间段泡沫平均直径和平均压差变化
实验内容1获得的半衰期与实验内容2获得的压差之间的关系如图6所示。随着半衰期的增大平均压差出现先增大后减小的趋势,特别是在41~50 s的时间段内,泡沫平均压差增大,半衰期增大。
图 6.
The relationship between foam pressure difference and half-life
泡沫压差与半衰期关系
3. 讨论
根据泡沫衰变的理论,气体扩散和排液是泡沫衰变的主要过程。排液主要分为两个阶段,一是液体受到重力作用而析出,二是泡沫压差导致气泡表面的液体流动。此外,泡沫压差也是气泡间气体扩散的主要原因之一,因此泡沫压差和泡沫的衰变之间有着紧密的联系。
如图5所示,在任意浓度下的泡沫压差随时间不断减小。在泡沫衰变的过程中,不断发生气体扩散,泡沫压差的减小说明了泡沫的平均直径在不断增加。究其原因,一方面是小气泡被大气泡不断吸收,小气泡数量减小;另一方面是大气泡吸收后自身气泡体积增长。结果部分显示了添加P-188的泡沫压差比未添加组的泡沫压差高,因为添加表面活性剂会改变液体的粘度,从而影响液体的表面张力,根据式(1),气泡表面张力的提高会引起泡沫压差的增加。但是,随着添加P-188浓度的增大,泡沫压差反而降低,原因可能是粘度的增加导致了液体流动速度的减缓,使得液膜变薄速度减缓,气体扩散减少,大气泡吸收小气泡的速度变慢。如图6所示,泡沫压差先随着半衰期的增长而增长,随后减小,再增长,差异无统计学意义。可见,泡沫压差随时间的增加不断减小,且在低P-188浓度下,添加剂会使泡沫平均压差增加,但P-188浓度过高会反过来使得泡沫平均压差减小。泡沫半衰期较短时,泡沫压差随半衰期增加而增加,到达峰值后减小。
泡沫在衰变过程中的气体扩散会使得小气泡被大气泡吸收,小气泡的数量减少,大气泡的尺寸增加。泡沫析水会使得气泡间液体变薄,反过来加速气体扩散过程。气体扩散和泡沫析水在导致泡沫平均压差降低的同时,也会使泡沫压差分布越来越不均匀。因此,泡沫压差的分布也能够作为对泡沫衰变速度快慢的一个衡量指标,这一观点如图4所示。
4. 结论
泡沫稳定性方面,添加P-188能够增加泡沫稳定性,并随着P-188浓度的增加稳定性逐步增强,但增强的速度变缓。对泡沫平均压差和泡沫稳定性的关系而言,泡沫压差随时间不断减小,低浓度的P-188会使泡沫平均压差增加,但过高浓度会使得泡沫平均压差减小。泡沫压差随泡沫稳定性的增强出现先增加后减小的趋势。
重要声明
利益冲突声明:本文全体作者均声明不存在利益冲突。
作者贡献声明:白逃萍、刘继彻进行实验设想、实验操作、数据整理、论文写作,蒋文涛、李亚兰进行实验设想、论文修改等。
Funding Statement
国家自然科学基金资助项目(12102281;11972239);中国博士后面上项目资助项目(2021M702368);中央高校基本科研业务费专项资金资助项目(2021SCU12128)
Project of the National Natural Science Foundation of China; Project funded by China Postdoctoral Science Foundation; Fundamental Research Funds for the Central Universities
References
- 1.Committee G, Force T Guidelines of care for sclerotherapy treatment of varicose and telangiectatic leg veins. J Am Acad Dermatol. 1996;34(3):523–528. doi: 10.1016/S0190-9622(96)90467-3. [DOI] [PubMed] [Google Scholar]
- 2.Moneta G L Sclerotherapy: treatment of varicose and telangiectatic legveins. J Vasc Surg. 1993;15(5):941. [Google Scholar]
- 3.Hamdan A Management of varicose veins and venous insufficiency. JAMA. 2012;308(24):2612–2621. doi: 10.1001/jama.2012.111352. [DOI] [PubMed] [Google Scholar]
- 4.Evans C J, Fowkes F G, Ruckley C V, et al Prevalence of varicose veins and chronic venous insufficiency in men and women in the general population: Edinburgh vein study. J Epidemiol Community Health. 1999;53(3):149–153. doi: 10.1136/jech.53.3.149. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.祝盼盼, 白逃萍, 田琳, 等 通道长度对泡沫硬化剂稳定性影响的实验研究. 中华血管外科杂志. 2018;3(2):104–107. doi: 10.3760/cma.j.issn.2096-1863.2018.02.009. [DOI] [Google Scholar]
- 6.Jia X, Mowatt G, Burr J M, et al Systematic review of foam sclerotherapy for varicose veins. Br J Surg. 2007;94(8):925–936. doi: 10.1002/bjs.5891. [DOI] [PubMed] [Google Scholar]
- 7.Weitz-Tuoretmaa A, Rautio R, Valkila J, et al Efficacy of OK-432 sclerotherapy in treatment of lymphatic malformations: long-term follow-up results. Eur Arch Otorhinolaryngol. 2014;271(2):385–390. doi: 10.1007/s00405-013-2542-9. [DOI] [PubMed] [Google Scholar]
- 8.Spitz G A, Braxton J M, Bergan J J Outpatient varicose vein surgery with transillμminated powered phlebectomy. Vasc Surg. 2000;34:547–55. doi: 10.1177/153857440003400608. [DOI] [Google Scholar]
- 9.Min R J, Zimmet S E, Isaacs M N, et al Endovenous laser treatment of the incompetent greater saphenous vein. J Vasc Interv Radiol. 2001;12(10):1167–1171. doi: 10.1016/S1051-0443(07)61674-1. [DOI] [PubMed] [Google Scholar]
- 10.Espinola C Endovenous treatment of the greater saphenous vein with a 940-nm diode laser: thrombotic occlusion after endolμminal thermal damage by laser-generated steam foams. J Vasc Surg. 2002;35:729–736. doi: 10.1067/mva.2002.121132. [DOI] [PubMed] [Google Scholar]
- 11.Goldman M P, Mauricio M, Rao J Intravascular 1 320 nm laser closure of the great saphenous vein: a 6- to 12-month follow-up study. Dermatol Surg. 2004;30(11):1380–1385. doi: 10.1111/j.1524-4725.2004.30431.x. [DOI] [PubMed] [Google Scholar]
- 12.Kistner R L Endovascular obliteration of the great er saphenous vein: the closure procedure. Jpn J Phlebol. 2002;13:325–333. [Google Scholar]
- 13.Pavlović M D, Schuller-Petrović S Endovascular techniques for the treatment of chronic insuffificiency of the lower limb’s superfificial venous system. Rev Vasc Med. 2014;2:107–117. doi: 10.1016/j.rvm.2014.04.002. [DOI] [Google Scholar]
- 14.Bergan J, Pascarella L, Mekenas L Venous disorders: treatment with sclerosant foam. J Cardiovasc Surg (Torino) 2006;47(1):9–18. [PubMed] [Google Scholar]
- 15.Hamel-Desnos C, Desnos P, Wollmann J C, et al Evaluation of the efficacy of polidocanol in the form of foam compared with liquid form in sclerotherapy of the greater saphenous vein: initial results. Dermatol Surg. 2003;29(12):1170–1175. doi: 10.1111/j.1524-4725.2003.29398.x. [DOI] [PubMed] [Google Scholar]
- 16.Gloviczki P, Comerota A J, Dalsing M C, et al. The care of patients with varicose veins and associated chronic venous diseases: clinical practice guidelines of the society for vascular surgery and the American venous forum. J Vasc Surg, 2011, 53(5 Suppl): 2S-48S.
- 17.Tessari L, Cavezzi A, Frullini A Preliminary experience with a new sclerosing foam in the treatment of varicose veins. Dermatol Surg. 2001;27(1):58–60. [PubMed] [Google Scholar]
- 18.李龙, 张迪, 曾欣巧, 等 制作1%聚桂醇泡沫硬化剂的最佳液-气比. 介入放射学杂志. 2015;24(5):418–421. doi: 10.3969/j.issn.1008-794X.2015.05.014. [DOI] [Google Scholar]
- 19.Cameron E, Chen T, Connor D E, et al Sclerosant foam structure and stability is strongly influenced by liquid air fraction. European Journal of Vascular and Endovascular Surgery. 2013;46(4):488–494. doi: 10.1016/j.ejvs.2013.07.013. [DOI] [PubMed] [Google Scholar]
- 20.Rial R, Hervas L S, Monux G, et al Polidocanol foam stability in terms of its association with glycerin. Phlebology. 2014;29(5):304–309. doi: 10.1177/0268355513477858. [DOI] [PubMed] [Google Scholar]
- 21.Ceulen R P, Jagtman E A, Sommer A, et al Blocking the saphenofemoral junction during ultrasound-guided foam sclerotherapy-assessment of a presumed safety-measure procedure. Eur J Vasc Endovasc Surg. 2010;40(6):772–776. doi: 10.1016/j.ejvs.2010.08.010. [DOI] [PubMed] [Google Scholar]
- 22.Cabrera J, Cabera J R Nuevo métodode esclerosis en las varices tronculares. Patologia Vasc. 1995;4:55–73. [Google Scholar]
- 23.Hesse G, Breu F X, Kuschmann A, et al Sclerotherapy using air-or CO2-O2-foam. Post-approval study. Phlebologie. 2012;41(2):77–88. [Google Scholar]
- 24.白逃萍, 蒋文涛, 李亚兰 泡沫硬化剂中加入泊洛沙姆188的疗效对比比格犬实验. 医用生物力学. 2019;34(S1):138. [Google Scholar]
- 25.万浩, 白逃萍, 蒋文涛, 等 基于Tessari法泡沫硬化剂自动制备装置的研制. 生物医学工程学杂志. 2016;33(6):1191–1195. doi: 10.7507/1001-5515.20160188. [DOI] [PubMed] [Google Scholar]
- 26.白逃萍, 蒋文涛, 赵武, 等 推注速度对静脉曲张用泡沫硬化剂稳定性影响的实验研究. 生物医学工程学杂志. 2016;33(5):890–895. [PubMed] [Google Scholar]
- 27.Bai T, Liu Y, Jiang W, et al A review of sclerosing foam stability in the treatment of varicose veins. Dermatol Surg. 2020;46(2):249–257. doi: 10.1097/DSS.0000000000002039. [DOI] [PubMed] [Google Scholar]
- 28.Bai T, Liu Y, Liu J, et al A comparison of different surfactants on foam stability in foam sclerotherapy in vitro. J Vasc Surg. 2019;69(2):581–591. doi: 10.1016/j.jvs.2018.02.033. [DOI] [PubMed] [Google Scholar]








