Abstract
目前脱细胞基质是一种治疗皮肤损伤的有效修复替代材料,但是关于其性能的系统性评价研究较少。本研究实验组采用两种脱细胞方法制备基质:一种是过氧乙酸(0.2% PAA/4% 乙醇溶液)灭菌后高渗盐水脱细胞(A 组);另一种是 γ 射线灭菌后 0.05% Trypsin 酶/EDTA 脱细胞(B 组);对照组进行 PBS 浸泡(C 组),检测三组组织物理特性和化学成分。不同方法处理后,苏木精伊红(HE)染色表明 B 组脱细胞效果良好;A、B 组组织孔隙率均在 84.9% 以上;A 组压缩弹性模量(9.94 ± 3.81)MPa、B 组压缩弹性模量(12.59 ± 5.50)MPa 分别与 C 组相比差异无统计学意义;A、B 组脱细胞基质中胶原蛋白总含量均显著低于 C 组含量(1.662 ± 0.229)mg/g,但胶原Ⅰ/Ⅲ的比值 B 组与 C 组相比差异无统计学意义;扫描电镜(SEM)、原子力显微镜(AFM)观测组织微观结构无明显差异;定性检测各组纤连蛋白和弹性蛋白与 C 组材料基本一致。因此,B 组脱细胞基质作为支架材料性能更好。实验结果说明,采用 γ 射线灭菌、0.05% Trypsin 酶/EDTA 制备的脱细胞基质可用于组织工程皮肤的构建,还可为异种真皮脱细胞基质的制备及裱衬提供参考,为静电纺丝或三维打印组织工程皮肤支架提供理化参数。
Keywords: 组织工程, 人体真皮, 脱细胞基质, 快速构建, 体外培养
Abstract
At present, acellular matrix is an effective replacement material for the treatment of skin damage, but there are few systematic evaluation studies on its performance. The experimental group of this study used two decellularization methods to prepare the matrix: one was the acellular matrix which sterilized with peracetic acid first (0.2% PAA/4% ethanol solution) and then treated with hypertonic saline (group A), the other was 0.05% trypsin/EDTA decellularization after γ irradiation (group B); and the control group was soaked in PBS (Group C). Then physical properties and chemical composition of the three groups were detected. Hematoxylin eosin (HE) staining showed that the acellular effect of group B was good. The porosity of group A and B were both above 84.9%. In group A, the compressive modulus of elasticity was (9.94 ± 3.81) MPa, and the compressive modulus of elasticity was (12.59 ± 5.50) MPa in group B. There was no significant difference between group A or B and group C. The total content of collagen in acellular matrix of group A and B was significantly lower than that of group C (1. 662 ± 0.229) mg/g, but there was no significant difference in the ratio of collagen Ⅰ/Ⅲ between group B and group C. Scanning electron microscopy (SEM) and atomic force microscopy (AFM) showed that there was no significant difference in microstructure. Qualitative detection of fibronectin and elastin in each group was basically consistent with that in group C. Therefore, acellular matrix of group B had better performance as scaffold material. The experimental results show that the acellular matrix prepared by γ-ray sterilization and decellularization of 0.05% Trypsin enzyme/EDTA could be used for the construction of tissue-engineered skin. It could also provide reference for the preparation and mounting of heterogeneous dermal acellular matrix. It was also could be used for electrostatic spinning or three-dimensional printed tissue engineered skin scaffold which could provide physical and chemical parameters for it.
Keywords: tissue engineering, human dermal, acellular matrix, quickly build, in vitro culture
引言
脱细胞基质是一种治疗皮肤损伤的有效修复替代材料[1],制备与人体真皮结构相近的脱细胞基质是当前研究的难点。真皮损伤修复手段主要有自体移植、异种真皮脱细胞基质移植、同种异体真皮脱细胞基质移植,但临床效果不一。目前,国外有关真皮脱细胞基质的主要产品有 AlloDerm 和 AlloDerm RTU 等,国内有“瑞诺”和“桀亚”等,但关于理化性质方面的系统性评价研究较少。
常用的脱细胞基质制备方法包括物理处理、化学处理、生物酶处理或以上几种方法结合起来对组织进行脱细胞处理[2-3]。由于细胞密度、基质密度、组织厚度和形状等原因,不同组织和器官脱细胞的最佳方法不同[4-7],针对皮肤组织的最优、最快组织工程皮肤构建方法报道较少[8-9]。单纯的物理脱细胞方法对细胞内容物去除效果不佳[10];化学处理方法中去垢剂如十二烷基硫酸钠(sodium dodecyl sulfate,SDS)脱细胞效果较强,可以完全去核[11],但存在细胞外基质(extracellular matrix,ECM)超微结构破坏、生长因子消除和化学试剂残留等问题[12-14];生物酶处理如 Trypsin 酶可以使细胞间的蛋白质水解从而使细胞离散,可以高特异性地去除细胞残留或不良的 ECM 成分,从致密组织中完全去除细胞核[15-18]。
本研究在前期研究的基础上,简化处理步骤,防止氢氧化钠等对人体会产生危害的试剂残留,选用对人体较安全的酶或高渗盐水进行脱细胞[8, 19-22],并且增加灭菌的步骤以避免未灭菌人体真皮具有传染性疾病的危害[8]。两步法处理脱细胞基质如下:采用 γ 射线和过氧乙酸(peroxyacetic acid,PAA)两种方法分别对人体皮肤组织进行灭菌[23],采用 Trypsin 酶和高渗盐水分别进行脱细胞处理。将两组材料理化参数与正常皮肤组织对比分析,得出脱细胞基质的物理结构、生物化学成分等参数,可为异种真皮脱细胞基质的制备及裱衬提供参考,为静电纺丝或三维(three-dimensional,3D)打印组织工程皮肤支架提供理化参数。
1. 材料与方法
1.1. 主要试剂及仪器
主要试剂为 DMEM 培养液(HyClone,美国)、DMSO(生工,上海)、4% 多聚甲醛(C0402,Sigma,美国)、Trypsin 酶/EDTA 液(ScienCell,美国)、过氧乙酸 AB 型(瑞泰奇,山东)、苦味酸天狼星红染液(Sirius Red,F3D,美国)、纤连蛋白染色抗体(Anti-Fibronectin Rabbit pAb,山羊抗兔二抗,赛维尔,武汉)、羟脯氨酸试剂盒(凡科维,青岛)、CCK-8(碧云天,上海)等。主要仪器为超低温冰箱(Eppendorf,德国)、CO2 培养箱(Thermo Forma,美国)、扫描电子显微镜(JSM-7100F,Jeol,日本)、原子力显微镜(L01K180,BRUKE,德国)、荧光显微成像系统(iX70,Olympus,日本)、电热鼓风干燥箱(GZX-9240MBE,上海博迅实业有限公司医疗设备厂,中国)、万能试验机(Instron 5544,英斯特朗上海材料试验机公司,中国)、酶标检测仪(Rayto Rt2100c,Rayto,美国)、红外光谱仪(Bruker,德国)等。
1.2. 支架材料制备
经过太原理工大学伦理委员会批准,收集山西白求恩医院门诊行包皮环切术的包皮标本。取样后用生理盐水反复冲洗,碘伏消毒,使用含 1% 青-链霉素的 PBS(青霉素及链霉素浓度分别为 10 000 U/mL、10 000 µg/mL)浸润消毒 30 min,PBS 洗 3 遍。随机将 30 例包皮分为 3 组,A 组为过氧乙酸(0.2% PAA/4% 乙醇溶液)灭菌、高渗盐水脱细胞;B 组为 γ 射线灭菌、0.05%Trypsin 酶/EDTA 脱细胞;C 组为对照组,进行 PBS 浸泡处理。
取 A 组样品在摇床上用 0.2% PAA/4% 乙醇溶液灭菌 6 h,用含 1% 青-链霉素的无菌 PBS 冲洗,然后加入浓度为 58.5 g/L 的 NaCl 溶液 100 mL,置于 4℃ 冰箱中 24 h,最后使用含 1% 青-链霉素的无菌 PBS 摇床清洗 24 h。B 组样品使用剂量率为 1 000 Gy/h,总剂量 25 kGy 的 γ 射线照射,再以 0.05% Trypsin 酶/EDTA 液孵育 24 h,最后使用含 1% 青-链霉素的无菌 PBS 摇床清洗 24 h。C 组仅使用含 1% 青-链霉素的无菌 PBS 摇床清洗 24 h。以下检测全部在真皮上进行。
1.3. 检测指标
1.3.1. 支架显微结构检测
将 3 组样品切下后用 PBS 洗涤,甲醛溶液固定,常规乙醇梯度脱水,石蜡包埋,切片,苏木精伊红(hematoxylin eosin,HE)染色,光学显微镜观察脱细胞情况。将 3 组组织使用 2.5% 戊二醛磷酸缓冲液室温固定 4 h,乙醇梯度脱水后冷冻干燥样品,扫描电镜(scanning electron microscopy,SEM)观察并拍照,使用 Image J 统计纤维直径数值。原子力显微镜(atomic force microscopy,AFM)检测:将 2 种(n = 3)脱细胞基质以及对照组样品风干后贴附在直径 35 mm 的培养皿上,室温空气中使用一个探针(模型 NCHV,BRUKER,美国)和 1 Hz 扫描频率在轻敲模式下扫描组织表面,扫描面尺寸为 10 µm × 10 µm。使用 Nanoscope 软件对结果进行评估。
1.3.2. 孔隙率测量及生物力学压缩性能
每组支架(n = 3)冷冻干燥,每个支架干燥后称重记为 m1,置入 50 mL 含体积分数 75% 的乙醇离心管。抽真空至不再有气泡溢出,称含有乙醇和支架材料离心管 m2,将含有乙醇的支架材料取出,称剩余的乙醇及离心管 m3。按式(1)计算孔隙率(P):
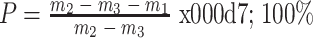 |
1 |
将各组支架(n = 3)制成适当尺寸,每个样品三次测量其厚度,取平均值计算其应变达到 80% 的位移,采用 Instron 5544 万能试验机,设置下降速率为 1 mm/min,结束条件为应变达到 80%。使用文献报道的模型对实验获得的载荷-位移曲线进行分析,按照式(2)计算获得皮肤的整体刚度,其中 F 表示载荷,E 为皮肤的整体刚度,a 为探针半径,s 表示位移, 表示泊松比,此处取值为 0.5。
表示泊松比,此处取值为 0.5。
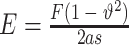 |
2 |
1.3.3. 胶原总含量和胶原成分比例测定
根据凡科维试剂盒组织样品处理方法处理组织并检测各组样品(n = 3)中羟脯氨酸含量,同时与标准液吸光度值绘制出的标准曲线相比,按羟脯氨酸含量占胶原总含量约 10% 换算出测试样品的胶原总含量。将石蜡切片脱蜡,苦味酸天狼星红染液浸染 1 h,苏木精复染。偏振光显微镜观察三组样品中Ⅰ型胶原和Ⅲ型胶原分布情况,通过 Image J 分析各组样品Ⅰ型胶原和Ⅲ型胶原的比例。
1.3.4. 纤连蛋白和弹性蛋白检测
将石蜡切片按照操作规程进行脱蜡和水化后,高温修复抗原;滴加 H2O2,室温孵育;滴加一滴非免疫动物血清,室温孵育;滴加一抗和二抗,室温孵育后 DAB 显色和苏木素复染。采用衰减全反射法(attenuated total refraction,ATR),在红外光谱仪波数 4 000~400 cm–1的测试条件下扫描每组样品(n = 3),采集样品的红外光谱。
1.3.5. 细胞活性检测
设置对照孔(仅有细胞),把人真皮成纤维细胞 4~6 代与脱细胞基质(n = 3)共培养于 24 孔板,接种密度为 1 000 个/孔,使用含 10% 胎牛血清的 DMEM 培养细胞 24 h 后,采用 CCK-8 孵育 1 h,在酶标仪 450 nm 处检测对照孔及各组基质的培养液吸光度值。
1.4. 统计学方法
采用 SPSS24.0 软件进行统计学分析。定量数据采用平均值 ± 标准差表示,测试样本为 3,组间比较采用单因素方差分析,检验水准为 0.05。
2. 结果
2.1. 真皮脱细胞效果及脱细胞基质的显微结构
HE 染色中苏木精使细胞核内的染色质与胞质内的核酸着蓝紫色,伊红使细胞质和细胞外基质中的成分着红色。各组材料 HE 染色结果见图 1a。C 组作为阴性对照组,真皮中存在大量细胞,A 组基质脱细胞效果较差,分布着较多核酸成分;B 组脱细胞效果良好,基本无核酸成分。SEM 是利用二次电子信号成像来观察样品的表面形态。使用 SEM 观察了三组材料内部结构(从表面裂缝观察),由图 1b 可见三种材料内部纵横交错的纤维,呈现孔隙较均匀的三维网状结构。
图 1.
Acellularization effect and matrix internal structure of each group ( ± SD)
± SD)
各组材料脱细胞效果及基质内部结构( ± SD)
± SD)
a. HE 染色图(Bar = 50 μm);b. SEM 观察材料内部图(Bar = 10 μm);c.各组材料纤维直径;d.各组材料纤维直径分布情况
a. HE staining diagram (Bar = 50 μm); b. SEM to observe the internal drawing of the material (Bar = 10 μm); c. fiber diameter of each group; d. fiber diameter distribution of each group
统计胶原纤维的直径,A 组为(1.2 ± 0.4)μm,B 组为(1.7 ± 0.7)μm,C 组为(1.7 ± 0.2)μm,直方图如图 1c 所示。每张图统计与随机直线相交的前 5 条纤维,每组共有 15 条纤维,分别按纤维直径小于 1、2、3、4、5 μm 统计各段的纤维直径出现的总频数,得到各组纤维分布情况如图 1d 所示。
从图 1c 和图 1d 中纤维直径分布可以看出,与 C 组纤维直径相比,A 组较大直径的胶原纤维损失严重,表现为仅存在直径 ≤ 3 μm 的纤维,统计纤维分布发现 A 组纤维直径主要集中在 1~2 μm。从不同直径的分布情况看,不同组别之间存在一定的趋势,A 组处理方法纤维直径平均值具有低于其他组的趋势。
AFM 的分辨率为纳米量级,图 2a 是使用 AFM 观察到的三组材料表面微形貌,图 2b 是各组材料微观表面高度,图 2c 是各组材料表面粗糙度结果。A、B、C 组高度分别为(1 577.3 ± 1 204.4)、(2 451.0 ± 404.4)、(1 659.3 ± 605.4)nm;粗糙度分别为 0.746 ± 0.047、0.819 ± 0.007、0.790 ± 0.035。原子力检测支架表面 100 μm2的面积内发现最高高度和粗糙度在 A、B 与 C 组之间差异无统计学意义,即 A、B 组处理方法均未改变基质的微观结构。
图 2.
Surface microstructure of each group ( ± SD)
± SD)
各组材料表面微结构( ± SD)
± SD)
a. AFM 高度模式图;b.各组材料表面微区高度平均值;c.各组材料表面粗糙度值
a. AFM height pattern diagram; b. average height of microzone on the surface of each group of materials; c. surface roughness of each group of materials
2.2. 脱细胞基质的孔隙率及生物力学压缩性能测试结果
固体材料孔隙率可反映材料的疏密程度。通过测量支架孔隙率,本文发现 A 组(84.9 ± 5.0)%、B 组(86.7 ± 2.1)% 相比 C 组的孔隙率(59.2 ± 9.9)% 均上升,差异有统计学意义,分别为 P = 0.001、P = 0.000。表明细胞脱除使得组织孔隙率增大,具体数值如图 3a 所示。A 组材料的压缩弹性模量最小,为(9.94 ± 3.81)MPa;B 组材料压缩弹性模量最大,为(12.59 ± 5.50)MPa。A 组和 B 组材料的压缩弹性模量与 C 组压缩弹性模量(6.75 ± 2.20)MPa 相比差异无统计学意义(P > 0.05),结果如图 3b 所示。
图 3.
Void fraction and modulus of elasticity in compression of each group ( ± SD)
± SD)
各组材料孔隙率及压缩弹性模量( ± SD)
± SD)
a.各组材料孔隙率;b.各组材料压缩弹性模量。**表示 P < 0.01,***表示 P < 0.001
a. void ratio of each group of materials; b. modulus of compression elasticity of each group of materials. ** P < 0.01, *** P < 0.001
2.3. 脱细胞基质的胶原总含量及胶原Ⅰ/Ⅲ的比值
检测 A、B、C 组胶原总含量分别为(1.227 ± 0.061)、(1.255 ± 0.025)、(1.662 ± 0.229)mg/g,A、B 组中胶原蛋白总含量均低于 C 组含量,且与 C 组相比差异具有统计学意义,分别为 P = 0.003、P = 0.004,结果如图 4b 所示。在偏振光显微镜下观察,Ⅰ型胶原纤维显示很强的双折光性,为红色或黄色纤维,Ⅲ型胶原显示弱的双折光性,为绿色细纤维,染色结果如图 4a 所示。统计胶原Ⅰ/Ⅲ的比值,发现 B 组(1.003 ± 0.002)与 C 组(1.006 ± 0.007)相比无显著差异,但 A 组(0.999 ± 0.003)与 C 组相比,差异具有统计学意义(P = 0.004),直方图如图 4c 所示。
图 4.
Total collagen content and collagen ratio in each group ( ± SD)
± SD)
各组材料的胶原总含量及胶原比值( ± SD)
± SD)
a.各组材料天狼星红染色图(Bar = 50 μm);b.各组材料胶原总含量;c.各组材料胶原比例。*表示 P < 0.05,**表示 P < 0.01
a. Sirius red staining of each group of materials (Bar = 50 μm); b. total collagen content in each group; c. proportion of collagen in each group. * P < 0.05, ** P < 0.01
2.4. 脱细胞基质的纤连蛋白染色及弹性蛋白定性
三组材料纤连蛋白均表现阳性结果,B 组阳性结果较弱,说明 B 组处理方法导致纤连蛋白含量下降,A 组阳性与 C 组程度一致,说明 A 组处理过程中未显著破坏组织的纤连蛋白,染色结果如图 5a 所示。红外谱图中存在弹性蛋白与胶原蛋白、糖胺聚糖、纤连蛋白等蛋白质都有的 1 650 cm–1附近酰胺Ⅰ、1 550 cm–1附近酰胺Ⅱ的特征峰外,还存在弹性蛋白在 3 309.8、1 651、1 539.1、1 238.2 cm–1处的四个特征吸收峰,分别对应于酰胺-A 带中的 N-H 伸缩振动吸收峰、酰胺-Ⅰ带中的 C=O 伸缩振动吸收峰、酰胺-Ⅱ带的 C-N 伸缩振动吸收峰和酰胺-Ⅲ带的 N-H 弯曲振动吸收峰,说明三组材料均存在弹性蛋白,结果如图 5b 所示。
图 5.
The results of fibronectin staining and elastin qualitative determination
各组材料纤连蛋白染色及弹性蛋白定性检测结果
a.纤连蛋白免疫组化染色(Bar = 50 μm);b.各组材料弹性蛋白红外检测结果
a. fibronectin immunohistochemical staining (Bar = 50 μm); b. infrared detection results of elastin in each group
2.5. 成纤维细胞在脱细胞基质中的增殖情况
接种人真皮成纤维细胞后,对照组(C 组)及 A、B 组材料周围细胞生长状况如图 6a 所示,CCK-8 检测细胞活性直方图如图 6b 所示。24 h 细胞活性检测 A、B 组与对照孔差异无统计学意义。
图 6.
Cell activity around the control hole and materials of each group
对照孔及各组材料周围细胞活性
a.对照孔及各组材料周围细胞生长状况(Bar = 100 μm);b.对照组与各组材料 CCK-8 细胞活力检测结果
a. growth of cells around the control hole and each group of materials (Bar = 100 μm); b. CCK-8 cell viability test results of control group and each group
3. 讨论
在调节生物物理刺激、生物化学和分子信号以及空间结构方面,天然 ECM 发挥着重要作用。脱细胞组织来自天然 ECM,在植入体内后,随时间延长可逐渐被患者自身的组织所取代[1]。脱细胞方案的理想目标是去除所有的细胞物质,而不影响剩余 ECM 的组成、机械完整性和生物化学活性[22],但是脱细胞过程总会造成 ECM 的改变。为了研究这种改变,本研究将脱细胞真皮基质与未脱除细胞的皮肤组织进行对比,筛选出理化性能最接近人体正常皮肤的脱细胞基质,其可用于组织工程皮肤的构建,还可为异种真皮脱细胞基质的制备及裱衬提供参考,为静电纺丝或 3D 打印组织工程皮肤支架提供理化参数。
本文使用了两种常用的组织移植物灭菌方法:γ 射线和 PAA。这两种方法灭菌操作简便、高效、安全。γ 射线照射可去除细胞中易引起免疫排斥反应的成分,被广泛应用于药物和脱细胞猪角膜等材料的灭菌[24-26]。由于 γ 射线穿透性强,灭菌同时可因电离作用使细胞死亡。已有研究表明 PAA 可以在低浓度下灭活病毒、真菌和细菌,同时可通过电子转移氧化细胞膜上的基团,从而引发细胞死亡,产生的副产物为水、氧和二氧化碳[3],对人体较安全。此外,有研究指出先灭菌有利于提高细胞的脱除效率[8],故本文使用这两种灭菌方法作为脱细胞的前处理。
脱细胞真皮基质要脱除具有免疫抗原性的细胞,本文通过 HE 染色发现 B 组无核酸成分,脱细胞效果优于 A 组,说明酶对细胞脱除具有显著的效果。使用 SEM 和 AFM 观察材料微观结构[27-31],结果显示 A、B 组材料在微观结构方面与 C 组相比差异均无统计学意义,但 A 组纤维直径相对 B 组与 C 组较小,提示 PAA 灭菌后高渗盐处理对纤维直径的破坏较大。
孔隙率反映材料内部的疏松程度,孔隙率越大,材料内部越疏松,细胞越容易长入材料内部。A、B 组孔隙率均远大于对照组 C 组,而 A 组与 B 组孔隙率相比差异无统计学意义,提示两种方法处理的基质内部孔隙基本一致。一般方法的支架孔隙率约为(74.28 ± 2.06)%[32-34],而本研究的脱细胞真皮基质孔隙率为(84.9 ± 5.0)% 和(86.7 ± 2.1)%,高于传统方法。检测发现正常组织中间也存在空隙,对比正常组织孔隙率可间接证明本文细胞脱除的有效性。较大的孔隙率初步表明本文脱细胞真皮基质的结构便于细胞长入[35-36]。支架移植后需要包扎治疗,承受压力,故本研究检测脱除细胞前、后的支架压缩弹性模量[37],结果表明 A 组高渗盐水处理、B 组酶处理后脱细胞真皮基质的压缩弹性模量接近正常皮肤,说明脱细胞处理未影响基质压缩弹性模量。
为了探索本文脱细胞基质在化学组分上是否有利于细胞长入,我们检测了样品脱细胞前、后的组分及含量变化。检测胶原总含量变化发现,与 C 组相比,A、B 组胶原总含量下降,差异具有统计学意义(均为 P < 0.01)。A 组或许是酸性环境加速了胶原蛋白的水解,B 组或许是 γ 射线使胶原缺失[3]。Ⅰ、Ⅲ型胶原是皮肤中含量最多的两种胶原成分,分别占皮肤胶原总量的 80%~85% 和 10%~15%[38],据文献报道胶原比例与人的年龄与取皮位置有关[39-41],成人Ⅰ/Ⅲ型胶原比值范围为 1~2。本研究检测这两种胶原比例比值约为 1,与邱林[42]报道的比值 1.2~1.3 相近,且经处理后胶原比例在 B 组与对照组之间差异无统计学意义。说明 B 组很好地保留了胶原比例,即 γ 射线灭菌、酶处理未显著破坏胶原Ⅰ/Ⅲ的比例。两组基质脱细胞后胶原蛋白总含量均有所下降,但是 B 组Ⅰ/Ⅲ型胶原的比例与对照组相比差异无统计学意义,说明 B 组脱细胞后细胞外基质的改变较小。
纤连蛋白可影响细胞的黏附、迁移,本文 B 组纤连蛋白明显少于 C 组,暗示 γ 射线照射和酶处理会使基质损失一部分纤连蛋白,而 PAA 灭菌、高渗盐水脱细胞的纤连蛋白保留效果较好。弹性纤维蛋白与支架弹性相关,故本文通过红外光谱图定性检测了脱细胞前、后各组弹性蛋白[43],发现 A、B 组与对照组均出现弹性蛋白特征峰,说明两组脱细胞方法对弹性蛋白无影响。脱细胞支架使用目的是要植入人体,要求脱细胞基质对细胞无毒性。A、B 组材料的生物学活性差异无统计学意义,猜测与支架的微观形貌结构差异无统计学意义有关,与材料的化学组分结构、成分相近有关。
综上所述,A 组与 B 组性能对比发现,A 组纤连蛋白保留较好,但细胞脱除效果不如 B 组;B 组对胶原比例的破坏低于 A 组,且细胞脱除效果优于 A 组;基质与细胞共培养 24 h 以上发现,A、B 组基质对细胞生长的影响差异无统计学意义,但这只是短期的培养,若要应用于人体,后期需要检测材料与细胞共培养较长时间细胞的生长状态。
4. 结论
本文认为 γ 射线灭菌后,Trypsin 酶脱细胞对脱细胞真皮基质的理化特性无显著破坏作用,其制备的脱细胞真皮基质的理化特性较 PAA 灭菌后高渗盐脱细胞更接近于对照组。故本文认为 γ 射线灭菌、0.05% Trypsin 酶/EDTA 脱细胞制备脱细胞基质性能较好。本文中 γ 射线灭菌后,Trypsin 酶脱细胞构建的脱细胞基质不仅可以直接用于组织工程皮肤的构建,还可为异种真皮脱细胞基质的制备及裱衬提供参考,为静电纺丝或 3D 打印组织工程皮肤支架提供理化参数。
利益冲突声明:本文全体作者均声明不存在利益冲突。
Funding Statement
国家自然科学基金(31870934)
The National Natural Science Foundation of China
References
- 1.范志强, 刘雯恩, 周艳芳, 等 脱细胞生物支架的研究进展. 医学综述. 2019;25(14):2788–2793. doi: 10.3969/j.issn.1006-2084.2019.14.016. [DOI] [Google Scholar]
- 2.Crapo P M, Gilbert T W, Badylak S F An overview of tissue and whole organ decellularization processes. Biomaterials. 2011;32(12):3233–3243. doi: 10.1016/j.biomaterials.2011.01.057. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Matuska A M, McFetridge P S The effect of terminal sterilization on structural and biophysical properties of a decellularized collagen-based scaffold; implications for stem cell adhesion. J Biomed Mater Res B Appl Biomater. 2015;103(2):397–406. doi: 10.1002/jbm.b.33213. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.陆莹莹, 许争, 温东朋, 等 脱细胞真皮基质修复组织缺损研究进展. 国际生物医学工程杂志. 2017;40(1):58–61. doi: 10.3760/cma.j.issn.1673-4181.2017.01.013. [DOI] [Google Scholar]
- 5.Daugs A, Hutzler B, Meinke M, et al Detergent-based decellularization of bovine carotid arteries for vascular tissue engineering. Ann Biomed Eng. 2017;45(11):2683–2692. doi: 10.1007/s10439-017-1892-7. [DOI] [PubMed] [Google Scholar]
- 6.Floy M E, Mateyka T D, Foreman K L, et al Human pluripotent stem cell-derived cardiac stromal cells and their applications in regenerative medicine. Stem Cell Res. 2020;45:101831. doi: 10.1016/j.scr.2020.101831. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.何晶, 敖强 制备细胞外基质材料组织脱细胞方法的研究与热点. 中国组织工程研究. 2020;24(927):7–14. [Google Scholar]
- 8.Wojciech L, Glik J, Agnieszka K, et al Atomic force microscopy in the production of a biovital skin graft based on human acellular dermal matrix produced in house and in vitro cultured human fibroblasts. J Biomed Mater Res B Appl Biomater. 2018;106(2):726–733. doi: 10.1002/jbm.b.33883. [DOI] [PubMed] [Google Scholar]
- 9.许洁, 金冰慧, 赵应征 大鼠子宫去细胞支架及其细胞外基质凝胶的制备. 生物医学工程学杂志. 2018;35(2):237–243. doi: 10.7507/1001-5515.201704070. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Lehr E J, Rayat G R, Chiu B, et al Decellularization reduces immunogenicity of sheep pulmonary artery vascular patches. J Thorac Cardiovasc Surg. 2011;141(4):1056–1062. doi: 10.1016/j.jtcvs.2010.02.060. [DOI] [PubMed] [Google Scholar]
- 11.Yang B, Zhang Y, Zhou L, et al Development of a porcine bladder acellular matrix with well-preserved extracellular bioactive factors for tissue engineering. Tissue Eng Part C Methods. 2010;16(5):1201–1211. doi: 10.1089/ten.tec.2009.0311. [DOI] [PubMed] [Google Scholar]
- 12.Ott H C, Clippinger B, Conrad C, et al Regeneration and orthotopic transplantation of a bioartificial lung. Nat Med. 2010;16(8):927–933. doi: 10.1038/nm.2193. [DOI] [PubMed] [Google Scholar]
- 13.Reing J E, Brown B N, Daly K A, et al The effects of processing methods upon mechanical and biologic properties of porcine dermal extracellular matrix scaffolds. Biomaterials. 2010;31(33):8626–8633. doi: 10.1016/j.biomaterials.2010.07.083. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Du L, Wu X, Pang K, et al Histological evaluation and biomechanical characterisation of an acellular porcine cornea scaffold. Br J Ophthalmol. 2010;95(3):410–414. doi: 10.1136/bjo.2008.142539. [DOI] [PubMed] [Google Scholar]
- 15.Badylak S F, Freytes D O, Gilbert T W Reprint of: Extracellular matrix as a biological scaffold material: Structure and function. Acta Biomaterialia. 2015;23(Suppl):S17–S26. doi: 10.1016/j.actbio.2015.07.016. [DOI] [PubMed] [Google Scholar]
- 16.韩巧芳 胰蛋白酶的作用机理. 生物学教学. 2007;264(12):63. doi: 10.3969/j.issn.1004-7549.2007.12.045. [DOI] [Google Scholar]
- 17.王鹏, 张刚, 李毅, 等 去细胞组织工程异种瓣膜支架制备方法的比较研究. 中国组织工程研究与临床康复. 2007;13(5):3041–3044. [Google Scholar]
- 18.Gorschewsky O, Puetz A, Riechert K, et al Quantitative analysis of biochemical characteristics of bone-patellar tendon-bone allografts. Biomed Mater Eng. 2005;15(6):403–411. [PubMed] [Google Scholar]
- 19.田广招, 杨振, 查康康, 等 脱细胞软骨基质对巨噬细胞极化的调控. 中国组织工程研究. 2021;951(22):107–112. [Google Scholar]
- 20.付勇, 廖斌, 于风旭, 等 脱细胞肠系膜制备生物膜支架的实验研究. 医用生物力学. 2020;35(1):96–100. [Google Scholar]
- 21.郑建明, 顾汉卿 三种常用脱细胞技术的比较研究. 透析与人工器官. 2006;17(2):38–41. [Google Scholar]
- 22.李宝兴, 马绍英, 李宝明. 一种同种脱细胞真皮基质制备方法: 201110134511.9. 2011-10-19.
- 23.胡欣欣. γ射线照射对蛋白质结构和功能影响的研究. 济南: 山东大学, 2015.
- 24.孙建宇 60Co-γ射线辐照灭菌在中药及制剂中的应用研究. 中国药师. 2006;9(5):464. doi: 10.3969/j.issn.1008-049X.2006.05.040. [DOI] [Google Scholar]
- 25.王思颖. 辐照消毒与纳米微囊化对骨形态发生蛋白活性的影响研究. 天津: 天津大学, 2015.
- 26.Islam M M, Sharifi R, Mamodaly S, et al Effects of gamma radiation sterilization on the structural and biological properties of decellularized corneal xenografts. Acta Biomaterialia. 2019;96:330–344. doi: 10.1016/j.actbio.2019.07.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.涂秋芬, 张怡, 李艳, 等 一种新型的脱细胞组织工程血管支架的构建和评价. 生物医学工程学杂志. 2007;24(2):379–384. doi: 10.3321/j.issn:1001-5515.2007.02.031. [DOI] [PubMed] [Google Scholar]
- 28.张华, 周团锋, 杨雪, 等 口腔内 3 种合金共存下的离子析出及表面粗糙度的改变. 上海口腔医学. 2020;29(1):46–51. [Google Scholar]
- 29.关燕清, 钟辉珍, 王笑春, 等 肿瘤坏死因子-α的光化学修饰及其固定化研究. 生物医学工程学杂志. 2006;23(2):346–349. doi: 10.3321/j.issn:1001-5515.2006.02.027. [DOI] [PubMed] [Google Scholar]
- 30.Feyza G, Bukem T, Etinkaya A, et al The effect of thickness on surface structure of rf sputtered TiO2 thin films by XPS, SEM/EDS, AFM and SAM. Vacuum. 2020;182:109766. doi: 10.1016/j.vacuum.2020.109766. [DOI] [Google Scholar]
- 31.Javid A, Hekmatshoar M, Hedayatifar L, et al Effect of surface roughness on electrical conductivity and hardness of silver plated copper. Mater Res Express. 2019;6(3):036407. [Google Scholar]
- 32.魏坤, 辛勇, 艾凡荣 海藻酸钠/纳米氧化锌/生物活性玻璃多孔支架的制备及表征. 硅酸盐通报. 2019;38(278):200–206. [Google Scholar]
- 33.Dhasmana A, Singh L, Roy P, et al Silk fibroin protein modified acellular dermal matrix for tissue repairing and regeneration. Mater Sci Eng C Mater Biol Appl. 2019;97:313–324. doi: 10.1016/j.msec.2018.12.038. [DOI] [PubMed] [Google Scholar]
- 34.姜涛, 张爱君, 李雪阳, 等 人新型脱细胞真皮制备及性状分析. 中国组织工程研究. 2016;20(7):1006–1012. doi: 10.3969/j.issn.2095-4344.2016.07.013. [DOI] [Google Scholar]
- 35.王灵平. 猪脱细胞真皮基质的制备与性能研究. 济南: 山东大学, 2011.
- 36.孙伟. 新型猪膀胱脱细胞基质的制备与理化性能表征. 济南: 山东大学, 2019.
- 37.Sneddon I N The relation between load and penetration in the axisymmetric boussinesq problem for a punch of arbitrary profile. Int J Eng Sci. 1965;3(1):47–57. doi: 10.1016/0020-7225(65)90019-4. [DOI] [Google Scholar]
- 38.王成, 荣艳华, 沈佘明, 等 正常皮肤与增生性瘢痕中Ⅰ型和Ⅲ型胶原的含量与比例. 山东大学学报: 医学版. 2016;54(11):64–67. [Google Scholar]
- 39.宋维旭, 伍津津, 鲁元刚, 等 天狼猩红-偏振光检测组织工程皮肤中胶原的观察. 重庆医学. 2007;36(5):450–453. doi: 10.3969/j.issn.1671-8348.2007.05.029. [DOI] [Google Scholar]
- 40.刘建国, 王素华, 郑姗姗, 等 稀土氧化钕粉尘染毒大鼠不同时间点Ⅰ型和Ⅲ型胶原纤维含量及 IL-12 表达的研究. 环境卫生学杂志. 2015;5(3):189–193, 201. [Google Scholar]
- 41.刘策励, 赵雄飞, 黎鳌, 等 烧伤后不同类型胶原在增生性瘢痕发生中的作用研究. 中国组织工程研究. 2001;5(10):36–37. doi: 10.3321/j.issn:1673-8225.2001.10.020. [DOI] [Google Scholar]
- 42.邱林. 不同年龄增生性瘢痕的胶原构成及影响因素的研究. 重庆: 重庆医科大学, 2002.
- 43.王晓丽. 弹性蛋白的改性研究. 天津: 天津大学, 2007.








