Abstract
脊髓损伤是一个复杂的病理过程。基于临床前实验令人鼓舞的结果,部分干细胞治疗已转化为临床实践。间充质干细胞因其来源丰富、增殖能力强、低免疫原性,现已成为干细胞移植治疗脊髓损伤策略中重要的种子细胞之一。然而,将间充质干细胞移植到脊髓损伤处后的存活率较低,阻碍了其在临床上的进一步应用。近年来,水凝胶材料因其良好的生物相容性、生物降解性被广泛应用于组织工程,水凝胶联合间充质干细胞的治疗策略在脊髓损伤修复中已取得一定进展。本综述讨论了间充质干细胞修复脊髓损伤的意义以及目前存在的问题,阐述了水凝胶联合间充质干细胞修复脊髓损伤的研究进展并对其在临床研究中的应用进行了展望,旨在为该技术今后在脊髓损伤治疗中的应用提供借鉴和新思路。
Keywords: 脊髓损伤, 间充质干细胞, 脂肪干细胞, 水凝胶
Abstract
Spinal cord injury (SCI) is a complex pathological process. Based on the encouraging results of preclinical experiments, some stem cell therapies have been translated into clinical practice. Mesenchymal stem cells (MSCs) have become one of the most important seed cells in the treatment of SCI due to their abundant sources, strong proliferation ability and low immunogenicity. However, the survival rate of MSCs transplanted to spinal cord injury is rather low, which hinders its further clinical application. In recent years, hydrogel materials have been widely used in tissue engineering because of their good biocompatibility and biodegradability. The treatment strategy of hydrogel combined with MSCs has made some progress in SCI repair. This review discusses the significance and the existing problems of MSCs in the repair of SCI. It also describes the research progress of hydrogel combined with MSCs in repairing SCI, and prospects its application in clinical research, aiming at providing reference and new ideas for future SCI treatment.
Keywords: spinal cord injury, mesenchymal stem cells, adipose derived stem cells, hydrogel
引言
脊髓损伤(spinal cord injury,SCI)是病情严重、预后较差的中枢神经系统(central nervous system,CNS)疾病。SCI 导致受损脊髓以下神经功能障碍,引起感觉或运动能力的部分或全部丧失,患者多遗留四肢瘫痪、顽固性神经痛等严重后遗症。在全球,每年 SCI 新增病例 12~65/10 万[1],损伤后续的治疗费用给患者及社会都带来沉重的经济负担。
SCI 可分为原发性损伤和继发性损伤两个阶段。原发性损伤会导致脊柱受到机械破坏和脱位,引起脊髓组织受压或横断,损伤中心区域血管系统被破坏,血-脊髓屏障损坏,进而引发持续的继发性损伤级联反应,导致脊髓进一步损伤,造成进行性神经细胞死亡和神经功能障碍。血脑屏障功能障碍和血栓形成引起水肿和局部缺血、氧自由基形成以及谷氨酸释放增加,导致大量神经元死亡;这些损伤反应又反过来引发激烈的退化级联反应,伴随白质区少突胶质细胞大量死亡,引起脱髓鞘病变、神经胶质增生和细胞外基质沉积。剧烈的免疫炎症反应是 SCI 继发性损伤的核心,也是治疗 SCI 的关键点之一。炎性微环境导致神经细胞大量死亡,形成致密瘢痕组织,而瘢痕组织是阻碍脊髓轴突再生和功能恢复的重要原因。
目前,除了手术减压和药物疗法,临床上尚无其他有效的 SCI 治疗方法。近年来,干细胞与生物材料是组织工程与再生医学领域的研究热点,对于组织再生具有重要前景。干细胞能不断自我更新,具有多向分化潜能,并且能够分泌营养因子、抗炎因子发挥保护细胞和免疫调节等作用,被广泛应用于 SCI 治疗的临床前研究。大量研究表明移植的干细胞可有效促进 SCI 后的神经再生和运动功能恢复。其中,间充质干细胞(mesenchymal stem cells,MSCs)在体外扩增迅速,可在较短时间内收获大量细胞以满足临床治疗需求,且在临床治疗中操作相对简单。生物材料是能对细胞、组织和器官进行诊断、治疗、替换修复或诱导再生的一类天然或人工合成的特殊功能材料,其制品已经被广泛地应用于临床和科研。生物材料中的一大类——水凝胶,可以模拟软组织环境,其化学组成适于整合细胞外基质(extracellular matrix,ECM)分子以及其他黏附蛋白,能够有效支持和引导轴突再生,因此是生物材料中用于 SCI 修复的极佳选择。MSCs 与水凝胶联合应用,水凝胶能够稳定病变部位炎症环境,同时负载 MSCs 将其原位递送到损伤区域进行修复,并为受伤组织的再生提供适宜环境,在 SCI 修复方面有良好的应用前景。下面针对 MSCs 在 SCI 修复中的研究意义以及目前存在的问题进行讨论,并对水凝胶联合 MSCs 在 SCI 修复中的研究进展加以阐述。
1. MSCs 在 SCI 治疗中的相关研究进展
MSCs 是成体干细胞的重要成员之一,存在于骨髓、脐血、脐带、全身结缔组织以及器官间质组织中,来源相对容易获得且在体外能够有效扩增[2],免疫原性低,是目前在临床前和临床研究中最有希望应用于 SCI 修复的干细胞。与其他几种干细胞相比,MSCs 没有伦理方面的限制,可用于自体移植,应用于中枢神经系统疾病的修复安全可靠[3-5]。近年来应用不同来源 MSCs 治疗 SCI 的研究进展如下所述。
1.1. 骨髓间充质干细胞
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)与造血干细胞(hematopoietic cells,HSCs)均来源于骨髓,区别于 HSCs,BMSCs 不表达造血干细胞表面标记物 CD14 和 CD34。在挫伤/横断的小鼠/大鼠 SCI 模型中,将 BMSCs 移植到损伤处,实验动物的运动功能均得到改善[6-8]。在大鼠脊髓缺血再灌注损伤模型中,Chen 等[9]向腹主动脉移植 BMSCs,发现睫状神经营养因子(ciliary neurotrophic factor,CNTF)以及抗炎因子白细胞介素(interleukin,IL)-10 的表达增加,促炎因子 IL-6 的表达减少,脊髓炎症环境得到改善,Basso-Beattie-Bresnahan(BBB)行为学评分及电生理结果表明大鼠后肢运动功能恢复,说明 BMSCs 起到了抗炎保护作用。BMSCs 还可通过营养支持保护受损的脊髓免受进一步的细胞损伤。苟杨等[10]在大鼠 SCI 后第 1、7 和 14 天移植 BMSCs,通过共同标记 CNPase 与 caspase3,探讨 BMSCs 移植能否抑制少突胶质细胞凋亡。实验结果表明 SCI 后,BMSCs 可能通过分泌脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)来抑制少突胶质细胞凋亡,起到保护神经髓鞘的作用。此外,由于 BMSCs 具有向受损组织迁移的能力,因此可以用作治疗的最佳载体。将 BMSCs 移植到大鼠 SCI 模型中,发现经染料标记的 BMSCs 中的线粒体可以转移到经氧-糖剥夺(oxygen-glucose deprivation,OGD)损伤的神经元上,OGD 运动神经元活性在线粒体迁移后得到改善,细胞凋亡减少,足迹分析结果表明大鼠前后肢协调性恢复良好[11]。在临床研究方面,2020 年由 Sharma 等[12]完成的一项针对 180 位 SCI 患者的开放性研究中,通过腰椎穿刺注射 1.06×108个细胞,移植后(9 ± 7)月后对患者进行随访,以功能独立性指标(functional independence measure,FIM)和 SCI 步行指数(walking index for SCI,WISCI)作为评价指标,结果发现,69.44% 的患者在 FIM 量表上得分得到改善,而 37.22% 的患者在 WISCI 上得分得到改善,但不足的是,该项临床试验缺少对照组。
1.2. 脐带间充质干细胞
脐带间充质干细胞(umbilical cord-MSCs,UMSCs)可以通过脐带或者新生儿的脐带血获得,具有低免疫原性。许多临床前研究表明,UMSCs 在小鼠或大鼠 SCI 模型中对动物运动功能的恢复均具有一定的治疗效果。Yousefifard 等[13]在大鼠 SCI 后一周移植 BMSCs 或 UMSCs,发现 BMSCs 或 UMSCs 均可减轻神经性疼痛症状,但 UMSCs 的存活率和处理后大鼠脊髓的电生理检测结果明显优于 BMSCs。目前,已有研究使用大规模中空纤维生物反应器扩增 UMSCs。研究发现经典扩增和大规模扩增 UMSCs 的方法在细胞向成脂、成骨和成软骨方面的分化能力方面没有差异[14],这种大规模扩增 UMSCs 的方式为将来在 SCI 患者中进行大规模应用奠定了一定基础。
1.3. 脂肪干细胞
与其他来源的 MSCs 相比,脂肪干细胞(adipose-derived MSCs,ADSCs)可以使用微创技术或脂肪抽吸术以微创的方式从脂肪组织中大量获取。Kim 等[15]对急性 SCI 比格犬静脉注射 ADSCs,发现小胶质细胞浸润减少,动物后肢运动功能得到改善。Khan 等[16]同样使用 ADSCs 治疗 SCI 后的比格犬,发现病变中心神经纤维丝、抗炎因子 IL-10 表达明显升高,促炎因子 IL-6、TNF-α 和 IL-1β 表达降低,星型胶质瘢痕减少,说明 ADSCs 通过改善炎症环境保护神经,使动物后肢功能得到改善。ADSCs 能够改善炎症环境可能是以旁分泌形式起作用的,其分泌物主要由生长因子、细胞外基质成分、蛋白酶、细胞因子和多种促进血管生成、伤口愈合的免疫调节分子组成。这些生物活性分子被认为有助于组织再生,并通过抑制淋巴细胞的增殖活化减轻炎症[17],以达到改善 SCI 微环境的目的。Maqueda 等[18]发现,以 H2O2 脉冲处理 ADSCs 能提高 ADSCs 在 SCI 微环境中的存活能力。大鼠 SCI 后 48 h 后移植该 ADSCs,发现细胞存活率升高,星形胶质瘢痕减少。此外,Barberini 等[19]对鞘内注射高剂量同种异体 ADSCs 的安全性做了研究。从寰枕向鞘内给实验对象马注射 GFP 标记的 1×108个 ADSCs,注射前后检测血液和脑脊液中炎症因子,均未见明显变化,动物未出现不良反应,荧光检测发现 ADSCs 迁移到腰椎区域,说明鞘内注射高剂量同种异体 ADSCs 是一种安全的方法。关于 ADSCs 的临床试验也已经开展。梅奥诊所正在进行的一项临床试验(NCT03308565)CELLTOP,旨在研究鞘内注射 ADSCs 到创伤性 SCI 患者中的安全性和有效性。患者于受伤后 11 个月通过 L3-4 腰椎穿刺接受鞘内注射 1×108个自体 ADSCs。患者对手术耐受良好,没有发生严重的不良事件,上下肢运动功能得到显著改善[20]。
多年来,MSCs 一直是临床试验的主题,但临床试验的结果未能达到多种疾病模型的临床前数据的良好结果。其中主要原因在于 MSCs 在 SCI 环境下存活率低、存活困难,难以维持自身优越的生物性能,严重限制了其临床潜力。此外,直接注射会导致损伤部位细胞丢失,以及细胞移植后到其成熟表型(包括神经元、星形胶质细胞和少突胶质细胞)的分化不受控制。
近年来,已经提出基于组织工程和再生医学的方法作为 SCI 修复/再生的替代方法。水凝胶与干细胞移植的结合也得到了广泛的探索,期望水凝胶稳定病变部位微环境,同时将干细胞递送到病变部位,并为受伤组织的再生提供适当的环境。下文将介绍使用水凝胶作为干细胞载体的重要性,以及这些有前途的神经组织再生工具的最新进展和成就。
2. 水凝胶联合 MSCs 在 SCI 修复中的应用
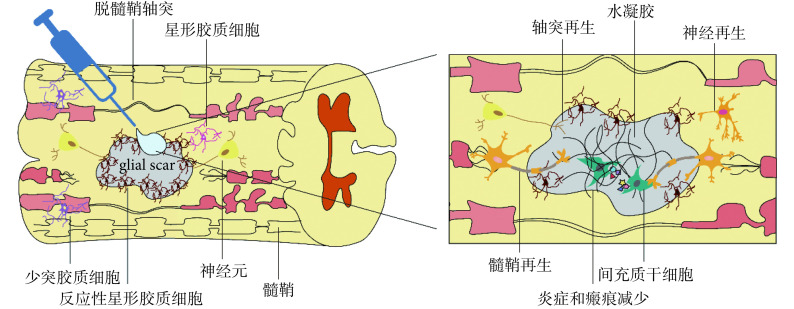
材料科学的发展为 SCI 修复提供了更多可能。水凝胶是一个能够封装 MSCs 的良好环境,具有高弹性、高透气性、无毒以及力学性能良好的特点,将其用于 SCI 的修复具有三个优点:首先,水凝胶本身能够充当载体,负载 MSCs 到达损伤部位,减少细胞向周围组织丢失而脱靶;第二,水凝胶提供三维空间支持,利于细胞迁移、增殖及分化;第三,水凝胶能够缓释生物活性因子,保护抑制性微环境中 MSCs 活性及其生物功能(见图 1)。以下将从天然高分子水凝胶、人工合成水凝胶以及天然高分子-人工合成复合水凝胶三方面对于水凝胶联合 MSCs 修复 SCI 的研究进展进行阐述。
图 1.
Schematic diagram of mesenchymal stem cells combined with hydrogels to repair spinal cord injury
间充质干细胞联合水凝胶修复脊髓损伤示意图
2.1. 天然高分子水凝胶
为了保持生物材料和生物组织的相似性,水凝胶研究首先以生物组织中天然存在的分子为主,最为合适的天然高分子有胶原、透明质酸以及多糖(包括琼脂糖、海藻酸盐、纤维素、木葡聚糖等)。天然高分子具有生物相容性强、酶促降解性、孔隙大、柔软且能使细胞黏附和迁移的特点[21]。有文献报道,天然高分子水凝胶能够通过类似外周神经神经内膜和神经束膜的作用桥接损伤区域分离的轴索束来促进轴突再生[22]。
2.1.1. 纤连蛋白水凝胶
纤连蛋白水凝胶支架由纤维蛋白网络交联构成,具有生物相容性好、无毒无过敏、生物降解、易加工等特点。除此之外,纤连蛋白水凝胶能够任意改变形状和大小,许多生物因子可以与纤连蛋白支架相结合。根据需要封装的细胞数目多少,改变合成物的浓度就能控制水凝胶的硬度。水凝胶本身的特性在损伤修复方面也起到了一定作用。Mukhamedshina 等[23]使用纤连蛋白水凝胶培养 ADSCs,移植修复 SCI,发现损伤中心空腔面积减少,GFAP、Iba1 的表达降低,说明将 ADSCs 与纤维蛋白水凝胶联合应用于 SCI 修复可刺激神经组织再生。
2.1.2. 透明质酸水凝胶
透明质酸是应用最为广泛的生物大分子之一,是细胞外基质的组成成分之一,在各类生物反应进程中起到重要作用。此外,透明质酸还能够在炎症环境中清除自由基[24]。透明质酸是一种在形态、硬度和生物活性方面都适合制作水凝胶的理想材料。使用 BDNF 转染 MSCs,并用一段黏附性肽段 PPFLMLLKGSTR 修饰透明质酸,联合植入 SCI 大鼠模型中,可有效改善脊髓组织的完整性,抑制神经胶质瘢痕形成并减轻炎症反应,而单独注射细胞组修复效果不如联合移植组[25]。Zaviskova 等[26]用 RGD 修饰透明质酸的羟苯基衍生物并酶促交联以获得柔软的可注射水凝胶。将获得的水凝胶与水凝胶+MSCs 移植治疗 SCI,发现联合使用时,轴突向损伤中心的生长能力更强。在病变微环境中活性氧的产生会严重损害 SCI 的干细胞治疗。通过将 MnO2 纳米颗粒分散在 PPFLMLLKGSTR 肽修饰的透明质酸水凝胶中来制备含有 MnO2 纳米颗粒的水凝胶,肽修饰的水凝胶使 MSCs 和神经组织桥接发生黏附性生长,MnO2 纳米颗粒通过缓解氧化程度以有效提高 MSCs 的生存活性。MSCs 联合 MnO2 纳米颗粒以及肽修饰的 HA 水凝胶移植到大鼠 SCI 全横断(4 ± 0.5)mm 模型上,肽修饰的水凝胶诱导植入的 MSCs 在体内整合并向神经分化,从而使得轴突再生,大鼠运动功能显著恢复[27]。
2.1.3. 明胶
明胶因具有较高的生物相容性、生物可降解性且体内降解后不产生其他副产物,无免疫原性,血液相容性好以及与胶原有相同的组分和生物性质,被广泛应用于组织工程和药物递送系统中,但同时,明胶也存在体内降解速度过快和机械性能差等问题。Wang 等[28]设计了一种由 H2O2 和辣根过氧化物酶(horseradish peroxidase,HRP)催化 3,4-羟基苯基丙酸(3,4-Hydroxyphenylpropionic acid,HPA)部分氧化偶联形成的由明胶-羟苯基丙酸(Gtn-HPA)共轭物组成的水凝胶。这种水凝胶可通过改变 H2O2 的浓度而无需改变聚合物前体的浓度来调节材料硬度,从而控制明胶中 MSCs 的增殖速率和分化。研究发现水凝胶硬度强烈影响着细胞的增殖速率,MSCs 增殖速率随水凝胶硬度的降低而增加,且 MSCs 的神经发生由水凝胶硬度控制,而无需使用任何其他生化信号。与在较硬(G’=841 Pa)明胶中培养的 MSCs 相比,较软水凝胶(G’=281 Pa)中 MSCs 神经元标志物表达更高。Gtn-HPA 水凝胶为 MSCs 在组织工程中的再生应用提供了一个很有前景的系统。
2.2. 人工合成水凝胶
人工合成水凝胶在组织工程领域有显著优点:支架结构允许细胞侵入,允许营养物质以及废弃物渗透以及新毛细血管网络形成。水凝胶支架孔隙应为细胞迁移和血管形成提供可用空间,因此人工合成水凝胶在调节空孔隙大小上具有优越性。与天然来源水凝胶相比,合成聚合物为设计和控制材料特性提供了更广阔的空间。另外,使用完全人工的、不含动物蛋白的生物相容性材料能明显降低过敏风险[29],且人工合成材料易于大规模生产。
2.2.1. 聚甲基丙烯酸 2-羟乙酯
合成水凝胶中适合作为三维支架培养的材料是聚甲基丙烯酸酯(poly(hydroxethyl methacrylate)),例如聚甲基丙烯酸 2-羟乙酯(Poly(2-hydroxyethylmethacrylate),PHEMA)。PHEMA 不具有细胞黏附性,因此需要对该聚合物进行其他修饰以促进材料与细胞间的相互作用。为了改善 PHEMA 支架的生物活性,需要引入带正电荷基团[30]或者使用层粘连蛋白衍生肽修饰[31]。Kubinová等[32]将甲基丙烯酸 2-[(甲氧基羰基)甲氧基]乙酯(MCMEMA)引入水凝胶提供羧基基团,以提高胆固醇修饰的 PHEMA 水凝胶的溶胀能力和柔软性。将改良 PHEMA 水凝胶移植到大鼠 SCI 模型,发现植入的修饰后 PHEMA 很好地掺入了周围组织,结缔组织逐渐浸润,神经纤维丝、施旺细胞和血管向水凝胶孔内生长。这些结果表明,高度多孔的胆固醇改良的 PHEMA 水凝胶具有生物黏附特性,能够桥接 SCI 病变区域。Hejčl 等[33]使用 SIKVAV 修饰 PHEMA,联合 MSCs 移植到大鼠 SCI 损伤区。研究发现 SIKVAV-PHEMA 支架的孔在第一周内完全充满了结缔组织成分,轴突逐步延伸到水凝胶支架中,并且在移植入水凝胶支架后的前 4 周内逐渐伸长,之后长度保持稳定,有极少部分轴突能够穿过空腔连接脊髓尾端。在之后的研究中,相关方向研究者可能需要进一步研究 PHEMA 的修饰以使得轴突更多地与损伤尾端相接,使轴突能够长时间地逐渐渗透到支架中以形成新的突触,促进整个 SCI 处连续且持久的组织再生。
2.2.2. 聚乳酸-羟基乙酸共聚物
聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA)是组织工程中最常用的生物可降解合成生物材料之一,具有制作简单、机械强度高、可降解性好等优点。Yang 等[34]在成年大鼠 SCI 3 mm 的横断间隙移植负载了活化雪旺细胞(activated Schwann cells,ASCs)和 MSCs 的 PLGA。移植后大鼠神经功能明显恢复,病变部位长出神经纤维束。除表达成熟神经元标志物外,少量 MSCs 衍生的神经元样细胞还在共移植损伤部位表达 ChAT。多通道 PLGA 支架有效弥合了全横切 SCI 大鼠的病变间隙,促进了 MSCs 的存活和分化为神经元样细胞,从而增强了轴突的再生和功能恢复。Han 等[35]则就 PLGA 支架硬度对 hMSCs 的影响做了研究,使用低/软(含 10% PLGA)或高/硬(含 40% PLGA)的 PLGA 负载 MSCs,与对照组相比,硬度高的 PLGA 激活 MSCs 机械转导和向中胚层谱系分化,而软 PLGA-MSCs 通过激活神经修复功能相关机制改善感觉运动功能,这说明 MSCs 联合 PLGA 修复 SCI 时,较低的硬度更适合神经再生。
2.3. 天然高分子-人工合成复合水凝胶
天然高分子-人工合成复合水凝胶是指使用天然高分子单体例如纤连蛋白、层粘连蛋白或者琼脂糖来包被人工合成的聚合物从而提高细胞黏附和细胞活性。天然高分子-人工合成复合水凝胶是合成物和天然高分子之间发生嵌段共聚或是通过物理相互作用的互聚物复合物。这种复合水凝胶将天然水凝胶的生物相容性与合成水凝胶的力学可调节性能结合起来。例如,添加多聚赖氨酸到 PEG,或者添加壳聚糖到甲基丙烯酰胺都能够增加材料的粘性。
2.3.1. 琼脂糖羧基乙烯共聚物
以琼脂糖羧基乙烯共聚物(copolymer of agarose and carbomer,AC)为主要成分的水凝胶模拟体内的细胞外基质,适合构建 3D 培养的 MSCs 体系。AC 水凝胶从材料缩聚开始细胞就已经潜入材料并且保持活力,材料可用表面大,使得细胞间接触更充分。高特异性的表面可以实现细胞黏附,高密度孔隙可以促进细胞生长、迁移以及有效运输液体和营养成分。共聚物形成的微孔对于毛细血管向内生长以及细胞与细胞外基质间的相互作用尤其重要,而大孔隙度则与营养供给以及细胞代谢废物相关。将 MSCs 封装在 AC 中,对细胞活力进行了测试,细胞活力保持(55 ± 5)%,这为 AC 搭载 MSCs 应用于组织工程,修复 SCI 损伤提供了良好基础[36]。
2.3.2. 甲基丙烯酸酯化明胶
甲基丙烯酸酯化明胶(methacrylated gelatin,GelMA)由甲基丙烯酸酐(MA)与明胶制备获得,是一种光敏性的生物水凝胶材料。然而,尚未有文献报道 GelMA 与 MSCs 联合修复 SCI。Fan 等[37]于 2018 年将 GelMA 水凝胶与 iPSCs 衍生的 NSCs(iNSCs)结合,研究修复 SCI 的效果,发现 GelMA / iNSCs 联合植入组炎症减轻,空腔面积明显减少,大鼠运动功能显著恢复。为进一步让再生神经能够连接损伤首尾两端,Chen 等[38]利用 GelMA 和电纺丝技术构建了一种新的用于脊髓再生的定向水凝胶超细纤维支架。与神经轴突一致的定向多孔水凝胶纤维支架对于指导细胞迁移和轴突延伸至关重要。GelMA 水凝胶杨氏模量较低,为神经元细胞提供了良好的生存和代谢环境。用 GelMA 水凝胶纤维构建的柔软的仿生支架不仅可促进神经干细胞的迁移并诱导其分化为神经元,还可抑制神经胶质瘢痕的形成,促进血管生成。基于 GelMA 的诸多优点,与 MSCs 联合使用修复 SCI 的研究效果令人期待。
3. 展望
SCI 的治疗受到了越来越多研究者的关注。本文对 MSCs 以及联合水凝胶治疗 SCI 的研究进行了概述,包括不同来源 MSCs(BMSCs、UMSCs、ADSCs)治疗 SCI 的优缺点以及相关研究,回顾了近五年利用水凝胶联合 MSCs 修复 SCI 的研究进展。由于生物材料的逐渐发展,水凝胶治疗 SCI 还有巨大的发展空间。
水凝胶具有优越的生物相容性,制备的生物支架能够较好地促进细胞分化和迁移,但在模拟细胞外基质的结构方面不如静电纺丝能够构建模拟细胞外基质的纳米纤维结构。此外,水凝胶无法控制递送,例如使用空间位阻低的药物时,药物会在水凝胶网状结构中扩散,以及负载疏水分子对水凝胶结构性能的影响。而 SCI 后面临的是一个复杂的炎症微环境,需要合理组合细胞、药物、营养因子,才能实现 SCI 的治疗效率最大化。水凝胶实现同时负载细胞、药物、营养因子并且在特定阶段释放负载物仍然是十分困难的。
针对水凝胶的这些局限性,就模拟细胞外基质而言,可以考虑将静电纺丝技术与水凝胶的特点相结合,而对于药物递送的控制,水凝胶的聚合物链可以被药物或具有不同聚合后策略的分子功能化,例如形成化学键。在这种情况下,药物的控制传递是由打破这种结合的能力控制的。对于 SCI 修复的机制方面,近几年外泌体在 SCI 修复中的效果也受到广泛关注,在之后的研究工作中,在组合策略中加入外泌体是一个研究热点。2020 年 Gao 实验室[39]将 MSCs 来源的外泌体固定在一种经肽修饰的水凝胶中进行移植,使得植入的外泌体在宿主神经组织中表现出有效的保留和持续释放,从而诱导 SCI 微环境的有效全面缓解,解决了水凝胶对于缓释的控制以及探讨外泌体在 SCI 修复中的效果。针对外泌体在 SCI 修复中发挥作用的潜在机制进行进一步研究可能会让 MSCs 移植成为更加具有针对性的疗法。要实现水凝胶更好地治疗 SCI,首先水凝胶在性能特点上需要考虑其他生物材料的优点,除了使用细胞治疗和生物材料治疗 SCI,组织工程提供了替代技术,如 3D 生物打印和微流控设备。为了使水凝胶能够进一步符合临床应用,3D 打印脊髓组织已成为再生医学研究的热点。2019 年有研究报道能够快速打印出符合临床患者 SCI 形状的组织,并在大鼠 SCI 模型中观察到轴突完全穿过病变部位[40],展现出对于 SCI 修复的良好应用前景。随着生物墨水的进一步开发以及 3D 打印设备的发展,3D 打印修复 SCI 将是未来的主要研究发展方向。
利益冲突声明:本文全体作者均声明不存在利益冲突。
Funding Statement
国家自然科学基金项目(81571105)
The National Natural Science Foundation of China
References
- 1.2016;39(4):493–494. [Google Scholar]
- 2.Lu L L, Liu Y J, Yang S G, et al Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials. Haematologica. 2006;91(8):1017–1026. [PubMed] [Google Scholar]
- 3.Zhou Y, Zhang X, Xue H, et al Autologous mesenchymal stem cell transplantation in multiple sclerosis: A meta-analysis. Stem Cells Int. 2019;2019:8536785. doi: 10.1155/2019/8536785. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Pan K, Deng L, Chen P, et al Safety and feasibility of repeated intrathecal allogeneic bone marrow-derived mesenchymal stromal cells in patients with neurological diseases. Stem Cells Int. 2019;2019:8421281. doi: 10.1155/2019/8421281. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Oliveira A G, Gonçalves M, Ferreira H, et al Growing evidence supporting the use of mesenchymal stem cell therapies in multiple sclerosis: A systematic review. Mult Scler Relat Disord. 2019;38:101860. doi: 10.1016/j.msard.2019.101860. [DOI] [PubMed] [Google Scholar]
- 6.Hedayatzadeh M, Tehranipour M, Kobravi H R Motor neuron recovery in rats after incomplete spinal cord injury using intra-spinal electrical stimulation and stem cell transfusion: A prelude to human applications. Medical Science. 2020;24(102):706–716. [Google Scholar]
- 7.Lin L, Lin H, Bai S, et al Bone marrow mesenchymal stem cells (BMSCs) improved functional recovery of spinal cord injury partly by promoting axonal regeneration. Neurochem Int. 2018;115:80–84. doi: 10.1016/j.neuint.2018.02.007. [DOI] [PubMed] [Google Scholar]
- 8.Muniswami D M, Kanthakumar P, Kanakasabapathy I, et al Motor recovery after transplantation of bone marrow mesenchymal stem cells in rat models of spinal cord injury. Ann Neurosci. 2019;25(3):126–140. doi: 10.1159/000487069. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Chen S, Yi M, Zhou G, et al Abdominal aortic transplantation of bone marrow mesenchymal stem cells regulates the expression of ciliary neurotrophic factor and inflammatory cytokines in a rat model of spinal cord ischemia-reperfusion injury. Med Sci Monit. 2019;25:1960–1969. doi: 10.12659/MSM.912697. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.苟杨, 刘丹彦, 刘金凤, 等 骨髓间充质干细胞移植对急性脊髓损伤脱髓鞘病变的保护作用. 生物工程学报. 2018;34(5):761–776. doi: 10.13345/j.cjb.170406. [DOI] [PubMed] [Google Scholar]
- 11.Li H, Wang C, He T, et al Mitochondrial transfer from bone marrow mesenchymal stem cells to motor neurons in spinal cord injury rats via gap junction. Theranostics. 2019;9(7):2017–2035. doi: 10.7150/thno.29400. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Sharma A, Sane H, Gokulchandran N, et al Intrathecal transplantation of autologous bone marrow mononuclear cells in patients with sub-acute and chronic spinal cord injury: An open-label study. Int J Health Sci (Qassim) 2020;14(2):24–32. [PMC free article] [PubMed] [Google Scholar]
- 13.Yousefifard M, Nasirinezhad F, Shardi Manaheji H, et al Human bone marrow-derived and umbilical cord-derived mesenchymal stem cells for alleviating neuropathic pain in a spinal cord injury model. Stem Cell Res Ther. 2016;7:36. doi: 10.1186/s13287-016-0295-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Vymetalova L, Kucirkova T, Knopfova L, et al Large-scale automated hollow-fiber bioreactor expansion of umbilical cord-derived human mesenchymal stromal cells for neurological disorders. Neurochem Res. 2020;45(1):204–214. doi: 10.1007/s11064-019-02925-y. [DOI] [PubMed] [Google Scholar]
- 15.Kim Y, Jo S H, Kim W H, et al Antioxidant and anti-inflammatory effects of intravenously injected adipose derived mesenchymal stem cells in dogs with acute spinal cord injury. Stem Cell Res Ther. 2015;6:229. doi: 10.1186/s13287-015-0236-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Khan I U, Yoon Y, Choi K U, et al Therapeutic effects of intravenous injection of fresh and frozen thawed HO-1-overexpressed Ad-MSCs in dogs with acute spinal cord injury. Stem Cells Int. 2019;2019:8537541. doi: 10.1155/2019/8537541. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Kokai L E, Marra K, Rubin J P Adipose stem cells: biology and clinical applications for tissue repair and regeneration. Transl Res. 2014;163(4):399–408. doi: 10.1016/j.trsl.2013.11.009. [DOI] [PubMed] [Google Scholar]
- 18.Maqueda A, Rodriguez F J Efficacy of human HC016 cell transplants on neuroprotection and functional recovery in a rat model of acute spinal cord injury. J Tissue Eng Regen Med. 2020;14(2):319–333. doi: 10.1002/term.2995. [DOI] [PubMed] [Google Scholar]
- 19.Barberini D J, Aleman M, Aristizabal F, et al Safety and tracking of intrathecal allogeneic mesenchymal stem cell transplantation in healthy and diseased horses. Stem Cell Res Ther. 2018;9(1):96. doi: 10.1186/s13287-018-0849-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Bydon M, Dietz A B, Goncalves S, et al CELLTOP clinical trial: First report from a phase 1 trial of autologous adipose tissue-derived mesenchymal stem cells in the treatment of paralysis due to traumatic spinal cord injury. Mayo Clin Proc. 2020;95(2):406–414. doi: 10.1016/j.mayocp.2019.10.008. [DOI] [PubMed] [Google Scholar]
- 21.Malafaya P B, Silva G A, Reis R L Natural-origin polymers as carriers and scaffolds for biomolecules and cell delivery in tissue engineering applications. Adv Drug Deliv Rev. 2007;59(4-5):207–233. doi: 10.1016/j.addr.2007.03.012. [DOI] [PubMed] [Google Scholar]
- 22.Hejcl A, Lesný P, Prádný M, et al Biocompatible hydrogels in spinal cord injury repair. Physiol Res. 2008;57(Suppl 3):S121–S132. doi: 10.33549/physiolres.931606. [DOI] [PubMed] [Google Scholar]
- 23.Mukhamedshina Y O, Akhmetzyanova E R, Kostennikov A A, et al Adipose-derived mesenchymal stem cell application combined with fibrin matrix promotes structural and functional recovery following spinal cord injury in rats. Front Pharmacol. 2018;9:343. doi: 10.3389/fphar.2018.00343. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Cowman M K, Lee H G, Schwertfeger K L, et al The content and size of hyaluronan in biological fluids and tissues. Front Immunol. 2015;6:261. doi: 10.3389/fimmu.2015.00261. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Li L M, Huang L L, Jiang X C, et al Transplantation of BDNF gene recombinant mesenchymal stem cells and adhesive peptide-modified hydrogel scaffold for spinal cord repair. Curr Gene Ther. 2018;18(1):29–39. doi: 10.2174/1566523218666180413150023. [DOI] [PubMed] [Google Scholar]
- 26.Zaviskova K, Tukmachev D, Dubisova J, et al Injectable hydroxyphenyl derivative of hyaluronic acid hydrogel modified with RGD as scaffold for spinal cord injury repair. J Biomed Mater Res A. 2018;106(4):1129–1140. doi: 10.1002/jbm.a.36311. [DOI] [PubMed] [Google Scholar]
- 27.Li L, Xiao B, Mu J, et al A MnO2 nanoparticle-dotted hydrogel promotes spinal cord repair via regulating reactive oxygen species microenvironment and synergizing with mesenchymal stem cells. ACS Nano. 2019;13(12):14283–14293. doi: 10.1021/acsnano.9b07598. [DOI] [PubMed] [Google Scholar]
- 28.Wang L S, Chung J E, Chan P P, et al Injectable biodegradable hydrogels with tunable mechanical properties for the stimulation of neurogenesic differentiation of human mesenchymal stem cells in 3D culture. Biomaterials. 2010;31(6):1148–1157. doi: 10.1016/j.biomaterials.2009.10.042. [DOI] [PubMed] [Google Scholar]
- 29.Horne M K, Nisbet D R, Forsythe J S, et al Three-dimensional nanofibrous scaffolds incorporating immobilized BDNF promote proliferation and differentiation of cortical neural stem cells. Stem Cells Dev. 2010;19(6):843–852. doi: 10.1089/scd.2009.0158. [DOI] [PubMed] [Google Scholar]
- 30.Hejčl A, Lesný P, Přádný M, et al Macroporous hydrogels based on 2-hydroxyethyl methacrylate. Part 6: 3D hydrogels with positive and negative surface charges and polyelectrolyte complexes in spinal cord injury repair. J Mater Sci Mater Med. 2009;20(7):1571–1577. doi: 10.1007/s10856-009-3714-4. [DOI] [PubMed] [Google Scholar]
- 31.Kubinová S, Horák D, Kozubenko N, et al The use of superporous Ac-CGGASIKVAVS-OH-modified PHEMA scaffolds to promote cell adhesion and the differentiation of human fetal neural precursors. Biomaterials. 2010;31(23):5966–5975. doi: 10.1016/j.biomaterials.2010.04.040. [DOI] [PubMed] [Google Scholar]
- 32.Kubinová S, Horák D, Hejčl A, et al Highly superporous cholesterol-modified poly(2-hydroxyethyl methacrylate) scaffolds for spinal cord injury repair. J Biomed Mater Res A. 2011;99(4):618–629. doi: 10.1002/jbm.a.33221. [DOI] [PubMed] [Google Scholar]
- 33.Hejčl A, Růžička J, ProkS V, et al Dynamics of tissue ingrowth in SIKVAV-modified highly superporous PHEMA scaffolds with oriented pores after bridging a spinal cord transection. J Mater Sci Mater Med. 2018;29(7):89. doi: 10.1007/s10856-018-6100-2. [DOI] [PubMed] [Google Scholar]
- 34.Yang E Z, Zhang G W, Xu J G, et al Multichannel polymer scaffold seeded with activated Schwann cells and bone mesenchymal stem cells improves axonal regeneration and functional recovery after rat spinal cord injury. Acta Pharmacol Sin. 2017;38(5):623–637. doi: 10.1038/aps.2017.11. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Han I B, Thakor D K, Ropper A E, et al Physical impacts of PLGA scaffolding on hMSCs: Recovery neurobiology insight for implant design to treat spinal cord injury. Exp Neurol. 2019;320:112980. doi: 10.1016/j.expneurol.2019.112980. [DOI] [PubMed] [Google Scholar]
- 36.Perale G, Giordano C, Bianco F, et al Hydrogel for cell housing in the brain and in the spinal cord. Int J Artif Organs. 2011;34(3):295–303. doi: 10.5301/IJAO.2011.6488. [DOI] [PubMed] [Google Scholar]
- 37.Fan L, Liu C, Chen X, et al Directing induced pluripotent stem cell derived neural stem cell fate with a three-dimensional biomimetic hydrogel for spinal cord injury repair. ACS Appl Mater Interfaces. 2018;10(21):17742–17755. doi: 10.1021/acsami.8b05293. [DOI] [PubMed] [Google Scholar]
- 38.Chen C M, Tang J C, Gu Y, et al Bioinspired hydrogel electrospun fibers for spinal cord regeneration. Adv Funct Mater. 2019;29(4):1806899. doi: 10.1002/adfm.201806899. [DOI] [Google Scholar]
- 39.Li L, Zhang Y, Mu J, et al Transplantation of human mesenchymal stem-cell-derived exosomes immobilized in an adhesive hydrogel for effective treatment of spinal cord injury. Nano Lett. 2020;20(6):4298–4305. doi: 10.1021/acs.nanolett.0c00929. [DOI] [PubMed] [Google Scholar]
- 40.Koffler J, Zhu W, Qu X, et al Biomimetic 3D-printed scaffolds for spinal cord injury repair. Nat Med. 2019;25(2):263–269. doi: 10.1038/s41591-018-0296-z. [DOI] [PMC free article] [PubMed] [Google Scholar]