Abstract
为了系统地评价自膨式镍钛合金血管支架的安全可靠性,本研究引用国际标准化组织推荐的支架动态安全系数定量反映支架的安全性能。利用非线性有限元软件 Abaqus 中超弹性记忆合金材料作为本构模型,结合镍钛合金管材单轴拉伸实验数据,对 Φ8×30 mm、Φ10×30 mm、Φ12×30 mm 三种L型支架先压握后自膨胀的置入过程、置入后高低血压脉动作用下的形状变化过程进行了有限元模拟。通过分析血管支架的应力变化情况,研究了血管支架使用过程中的最大应力应变、应力集中位置、疲劳强度大小以及可能的失效形式,并开展了血管支架体外加速疲劳寿命试验。有限元分析及实验结果均显示随着压握量增大,支架最大应力和最大塑性应变呈递增趋势,但支架最大应力和应变分布区域无显著变化,均集中在支撑体和连接体连接区域的圆弧内侧。三种支架动态安全系数分别为 1.31、1.23 和 1.14,数值都大于 1,表明三种支架的安全性能较好,能满足 10 年以上的疲劳寿命要求,且支架的安全性随着支架原始直径的增大有减小的趋势。
Keywords: 血管支架, 有限元分析, 疲劳强度, 疲劳寿命, 动态安全系数
Abstract
In order to evaluate the safety performance of self-expandable NiTi alloy stents systematically, the dynamic safety factor drawn up by International Organization for Standardization, was used to quantitatively reflect the safety performance of stents. Based on the constitutive model of super-elastic memory alloy material in Abaqus and uniaxial tensile test data of NiTi alloy tube, finite element method and experiments on accelerated fatigue life were carried out to simulate the self-expansion process and the shape change process under the action of high and low blood pressure for three L-type stents of Φ8×30 mm, Φ10×30 mm, Φ12×30 mm. By analyzing the changes of stress and strain of self-expanding NiTi alloy stent, the maximum stress and strain, stress concentration position, fatigue strength and possible failure modes were studied, thus the dynamic safety factor of stent was calculated. The results showed that the maximum stress and plastic strain of the stent increased with the increase of grip pressure, but the maximum stress and strain distribution area of the stent had no significant change, which were all concentrated in the inner arc between the support and the connector. The dynamic safety factors of the three stents were 1.31, 1.23 and 1.14, respectively, which indicates that the three stents have better safety and reliability, and can meet the fatigue life requirements of more than 10 years, and safety performance of the three stents decreases with the increase of stent’s original diameter.
Keywords: stents, finite element analysis, fatigue strength, fatigue life, dynamic safety factor
引言
自膨式金属血管支架的释放机制是将压握在鞘管内的支架输送到病变部位后释放,支架达到人体温度后自动膨胀恢复到预定形状,并产生足够的支撑力从而扩张血管狭窄部位。镍钛合金材料具有优良的形状记忆和超弹性、耐疲劳性、核磁共振兼容性、生物相容性、贴壁性以及抗腐蚀性等优点,优秀的材料性能及工艺特性使其被广泛应用于颅内狭窄血管治疗中。美国材料与实验学会(American Society for Testing and Materials,ASTM)F2477-07 标准[1]明确要求支架必须可以承受血管不少于 3.8 亿次的脉动收舒(10 年的疲劳寿命),因此如何优化支架结构以提高支架安全性能逐渐成为科学研究的热点。
美国的 Grujicic 等[2]将流固耦合的有限元计算方法与先进的疲劳耐久性分析技术相结合,提高了自膨式镍钛合金支架的疲劳寿命。Nes 等[3]介绍了一种鉴于血液腐蚀性的自膨式镍钛合金支架的数值疲劳寿命评估方法。Tokutake 等[4]通过有限元分析研究了股动脉多支血管狭窄对自膨式支架疲劳寿命的影响。Marrey 等[5]利用美国 Bose 公司研发的加速疲劳试验机检测了镍钛合金支架在血管内的疲劳失效形式。国内张会娟等[6]研究了支架制作材料和支架几何参数对自膨胀式血管支架成功服役的影响。赵振心等[7]按照国际标准化组织的标准,采用有限元法和 Goodman 准则分析了镍钛合金支架的疲劳强度并进行了疲劳测试。李建军等[8]使用 Ansys 模拟了支架的扩张、热处理和压握等释放过程,利用疲劳图谱分析了镍钛合金支架的疲劳特性。邢海瑞等[9]对镍钛形状记忆合金胸主动脉血管支架进行了有限元疲劳寿命分析。
上述研究中对镍钛合金支架的疲劳寿命进行了有限元模拟及实验验证,但对支架的整体安全性并没有详细探讨。本研究引用国际标准化组织规定的支架动态安全系数定量评价支架的整体安全性能,针对镍钛合金超弹性伪变形的材料特性,采用非线性有限元软件 Abaqus 中超弹性记忆合金材料作为本构模型,较真实地模拟了支架先压握后自膨胀的置入过程以及置入后高低血压脉动作用下的形状变化过程。结合美国食品药品管理局推荐的 Goodman 图表法[10],研究评估了三种不同尺寸支架的危险应力集中区域、疲劳强度和动态安全系数,并开展了血管支架体外加速疲劳试验研究。本研究旨在揭示支架直径大小对其安全性能影响的规律,以期为提升血管支架的安全可靠性提供理论依据。
1. 材料与方法
1.1. 材料特性
支架试样材料为医用激光雕刻镍钛合金管材,合金成分为 Ni(55.92%)-Ti(44.06%)[11],采用 Von Mises 屈服准则[12]和各向同性强化准则描述支架的弹塑性变形行为。结合实验室 Y8000 系列万能材料试验机的单轴拉伸实验数据[13],绘制材料的应力-应变曲线如图1 所示,其中 B:马氏体向奥氏体转变的开始应力;C:马氏体向奥氏体转变的最终应力;D:奥氏体向马氏体转变的开始应力;E:奥氏体向马氏体转变的最终应力。同时查阅相关资料[14-16],支架、血管、压握壳的材料性能参数如表1 所示。
图 1.
Stress-strain curve of NiTi alloy
镍钛合金应力-应变曲线
表 1. Material parameters of stent system.
支架系统材料性能参数
| 支架系统 | 材料 | 弹性模量 | 泊松比 | 强度极限 | 屈服极限 | 密度 |
| 支架 | 镍钛合金 | 80 GPa | 0.330 | 1 250 MPa | 820 MPa | 6.45 g/cm3 |
| 血管 | 超弹性材料 | 1.75 GPa | 0.499 | |||
| 压握壳 | 超弹性材料 | 300 GPa | 0.499 |
1.2. 几何建模与网格划分
首先在 Autocad2014 中建立血管支架的展开平面图,然后将展开图插入到三维软件 Solidwork2014 草图界面,经包覆、缝合、镜像、删除面等特征命令建立 Φ8×30 mm、Φ10×30 mm、Φ12×30 mm 三种血管支架系统的模型。支架形状基于课题组专利(Stent. J.P. Patent 3146103),外径分别为 8、10、12 mm,长度为 30 mm,其中连接体为L型,且支架支撑体、连接体周向对称分布,宽度均为 0.12 mm,壁厚为 0.2 mm。将支架、血管、压握壳的三维模型以 IGS 格式导入到 HyperMesh10.0 中进行二维与三维网格划分,采用 8 节点六面体单元(C3D8)进行网格离散,保证网格质量雅可比为 0.7,大于容限值,最后导入非线性软件 Abaqus6.14 中进行有限元分析。图2 为支架连接体部位及血管支架系统网格模型。
图 2.
Mesh model
网格模型
1.3. 边界条件
支架、压握壳、球囊和血管的约束条件都是一端约束轴向自由度,另一端周向自由度完全约束。在柱坐标环境下对整个系统施加边界约束,其中Z 方向代表模型系统的轴向,T 代表周向,R 则为径向,在压握壳与支架、球囊与支架间定义了无摩擦接触类型。具体设定如下:① 约束整个模型一端的周向位移:UT=0;② 约束整个模型中各个实体一端的轴向位移:UZ=0;③ 整个模型的径向位移 R 根据外界加载情况和各个面的接触进行定义。
1.4. 载荷定义
自膨式镍钛合金支架被压缩后输送到血管中,支架达到相变温度(36 ℃)会诱发支架形状记忆效应使其自动扩张变形达到释放尺寸。支架置入后还受到血管壁的收舒脉动作用,为了保证模拟的真实性,载荷添加分为静态压握扩张和动态交变载荷作用两个过程,而支架静态扩张过程又包括压握收缩和自膨胀扩张两个阶段。为了更好地分析最大等效应力和最大塑性应变趋势,将三种支架压握壳施加径向位移约束,使支架从起始外径逐渐压握至 4 mm,然后释放到正常尺寸;动态加载过程模拟人体血管血压变化过程,添加生理脉动载荷为高压 0.021 3 MPa、低压 0.010 7 MPa 的应力值(相当于脉压 160 mm Hg 和 80 mm Hg),加载频率为 60 Hz,如图3 所示。
图 3.
Loading process
载荷加载过程
2. 结果分析
2.1. 支架压握
血管支架的压握自膨胀过程涉及材料弹塑性、几何大变形等非线性问题,运用 Abaqus6.14 standard 求解器的 Newton-Raphson 算法进行数值求解。为了研究血管支架在压握过程中应力集中危险区域及可能出现的断裂部位,将 Φ8×30 mm、Φ10×30 mm、Φ12×30 mm 三种血管支架通过压握壳分别逐步压握至 4 mm,分析支架最大等效应力及塑性应变变化。结果显示压握过程中随着压握量的增大,三款支架最大等效应力和最大塑性应变呈递增趋势,但支架最大应力和应变分布区域无显著变化,均集中在支撑体和连接体连接区域的圆弧内侧。当支架被压握至 4 mm 时,其等效应力与塑性应变值最大。压握过程中支架最大等效应力与塑性应变如表2 所示,对应的等效应力与塑性应变如图4 所示。
表 2. Maximum stress and strain.
最大应力与应变
| 指标 | Φ8×30 mm | Φ10×30 mm | Φ12×30 mm |
| 最大等效应力/MPa | 2 214 | 1 923 | 2 730 |
| 最大塑性应变 | 0.136 | 0.098 | 0.145 |
图 4.

Equivalent stress and plastic strain of three stents
支架等效应力与塑性应变图
2.2. 疲劳强度分析
在血管壁的长期收舒脉动作用下,支架容易发生变形、坍塌甚至断裂等疲劳失效,从而降低支架的预期使用寿命。采用美国食品药品管理局、欧洲卫生部门制定的血管支架行业标准[17-18]推荐的 Goodman 图表法,对支架是否满足 10 年的疲劳寿命(3.8 亿次收舒脉动)进行评估。有限元分析得到的 80、160 mm Hg 的支架应力云图显示,支撑体与连接体过渡圆弧内侧节点处的应力较高,这与压握过程中支架承受应力的集中位置一致,说明该区域为支架使用过程中的危险部位。由式 (1)、(2) 求出三种支架的等效交替应力和等效平均应力,计算结果见表3。
表 3. Dynamic safety factors.
动态安全系数
| 指标 | Φ8×30 mm | Φ10×30 mm | Φ12×30 mm |
| 160 mm Hg 时应力/MPa | 521.6 | 537.8 | 545.5 |
| 80 mm Hg 时应力/MPa | 372.8 | 369.4 | 377.4 |
| 平均应力/MPa | 447.2 | 453.6 | 461.5 |
| 交变应力/MPa | 74.4 | 84.2 | 84.1 |
| 动态安全系数 | 1.31 | 1.23 | 1.14 |
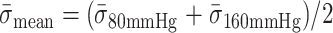 |
1 |
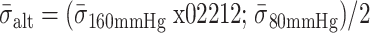 |
2 |
式中:
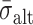 为脉动载荷交替应力,
为脉动载荷交替应力,
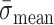 为脉动载荷平均应力。
为脉动载荷平均应力。
根据计算得到的等效交替应力和等效平均应力值绘制三种支架的疲劳强度 Goodman 图,如图5 所示。Goodman 图中的应力分布点离疲劳强度极限越近表示该位置疲劳强度越低,越容易断裂,反之则越安全;同样应力点分布区域若接近疲劳极限,说明该支架整体容易发生坍塌大变形失效。三种支架 Goodman 图中的应力分布点区域图都位于疲劳极限直线的下方,即位于安全区域内,说明均满足 10 年以上的疲劳寿命要求,能够达到预定的使用效果。
图 5.

Goodman curves of three stents
三种支架的 Goodman 曲线
2.3. 疲劳安全测试
基于 ASTM F2477-07 标准规定,利用美国 Bose 公司 SGT 9120 型支架疲劳测试仪,在脉压波动范围为 80~160 mm Hg、脉动频率为 60 Hz、温度(37±2)℃ 的实验条件下,将三种型号支架植入人工血管中进行疲劳试验。经 4 亿次相当于 10 年脉流循环后,观察支架表面的断裂位置[19]。
测试结果表明三种型号支架发生断裂的位置均在支撑体与连接体连接处的圆弧部位,这与前面有限元分析得到的最大应力点位置相匹配,进而验证了有限元分析结果的正确性。图6 中分别为疲劳测试仪 SGT 9120、光学显微镜放大 30 倍的支架断裂图和支架断面放大 3 000 倍的断面扫描图。
图 6.

Fatigue testing
疲劳试验
2.4. 支架动态安全系数
根据国际标准化组织关于血管支架疲劳强度的评价准则[1, 17-18],可将疲劳强度检验分为两类:一是 Goodman 准则,二是动态安全系数。血管支架在脉动循环载荷的作用下容易发生失效甚至断裂的极端情况,疲劳寿命评价方法 Goodman 曲线能显示支架的疲劳强度大小,而支架的动态安全系数又能定量反映支架的安全可靠性,计算公式如下[20]:
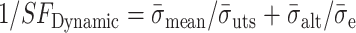 |
3 |
式中:
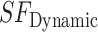 为动态安全系数;
为动态安全系数;
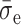 为疲劳极限;
为疲劳极限;
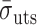 为拉伸强度极限。
为拉伸强度极限。
计算结果显示三种支架均是安全的,安全系数均大于 1。其中支架 Φ8 安全性能最好,动态安全系数最大,为 1.31;而 Φ12 安全性能最差,动态安全系数为 1.14。对三种支架安全系数的分析对比表明,随着支架原始直径的增大,支架安全系数有减小的趋势,即随着支架原始直径的增大安全可靠性下降。该结论也与宋迪[21]的论文中提到的疲劳失效与材料尺寸有关的说法一致。表3 为三种支架在动静态交变载荷作用下的动态安全系数计算结果。
3. 讨论与结论
本研究利用非线性有限元软件 Abaqus 中超弹性记忆合金材料作为本构模型,结合镍钛合金管材单轴拉伸试验数据,分析了镍钛合金复杂的相变机制以及非线性超弹性力学特性,并真实模拟了自膨式镍钛合金血管支架压握自膨胀、80 mm Hg/160 mm Hg 血压作用下血管壁收舒脉动的作用过程,分析了 Φ8×30 mm、Φ10×30 mm、Φ12×30 mm 三种L型血管支架逐步压握至 4 mm 过程中的应力集中危险区域以及可能出现的断裂部位,结果显示压握过程中随着压握量的增大,三款支架最大应力和最大塑性应变呈递增趋势,但支架最大应力和应变分布区域无显著变化,均集中在支撑体与连接体连接区域的圆弧内侧,这为优化支架在体温状态下的力学性能和确定最佳热处理定型工艺提供了理论指导。
通过计算三种支架的交替应力和平均应力值绘制支架疲劳强度 Goodman 图,分析血管支架置入后的疲劳寿命。结果显示三种支架应力分布区域图均位于疲劳极限直线的下方,满足 10 年以上的疲劳寿命要求,能够达到预定的使用效果。三种支架的最大危险点离疲劳极限较远,说明支架不会出现疲劳断裂。应力点分布区域离疲劳极限较远,说明支架整体不容易发生坍塌大变形失效。
本研究开展了镍钛合金血管支架体外加速疲劳寿命试验,验证了三种型号支架具有足够的疲劳强度的结论,且疲劳断裂位置与生理载荷下的模拟结果相吻合,该结论也与 Nakazawa 等[22]临床研究发现的断裂位置相一致。实验结果表明支架在弯曲变形时发生疲劳断裂的原因与支架结构尺寸、力学性能和材料特性有关,这为新型支架的设计与开发提供了重要的参考依据。
根据国际标准化组织推荐的支架动态安全系数,本研究定量分析了支架的安全可靠性。支架 Φ8 安全性能最好,动态安全系数最大,为 1.31;Φ10 动态安全系数为 1.23;Φ12 的安全性能最差,动态安全系数为 1.14。动态安全系数结果分析显示,随着支架原始直径的增大,支架安全性有减小的趋势。因此,可对支架结构表面进行氮化、喷丸硬化等方法进行处理,延长支架使用寿命,提高其安全性能。
利益冲突声明:本文全体作者均声明不存在利益冲突。
Funding Statement
内蒙古自然科学基金(2018MS08128);国家自然科学基金(81160186)
References
- 1.ASTM Standard F2477 07. Standard test methods for in vitro pulsatile durability testing of vascular stents. 2007.
- 2.Grujicic M, Pandurangan B, Arakere A, et al Fatigue-life computational analysis for the self-expanding endovascular nitinol stents. J Mater Eng Perform. 2012;21(11):2218–2230. doi: 10.1007/s11665-012-0150-2. [DOI] [Google Scholar]
- 3.Nes C S, Enkelhardt A, Bogdan L, et al Fatigue life assessment of self-expandable NiTi stent. Key Eng Mater. 2015;627(2):45–48. [Google Scholar]
- 4.Tokutake H, Iwasaki K, Zhu X, et al 2B15 Fatigue analysis on a self-expandable Nitinol stent deployed in femoral-popliteal artery under a multiple-load environment. J-GLOBAL. 2016;28:151–153. [Google Scholar]
- 5.Marrey R V, Burgermeister R, Grishaber R B, et al Fatigue and life prediction for cobalt-chromium stents: A fracture mechanics analysis. Biomaterials. 2006;27(9):1988–2000. doi: 10.1016/j.biomaterials.2005.10.012. [DOI] [PubMed] [Google Scholar]
- 6.张会娟, 王伟强, 齐民 自膨胀支架几何参数对服役影响的有限元分析. 功能材料. 2016;47(4):94–98. [Google Scholar]
- 7.赵振心, 刘道志, 孙康, 等 镍钛合金血管支架的有限元分析及疲劳测试. 中国医疗器械杂志. 2008;32(5):373–376. doi: 10.3969/j.issn.1671-7104.2008.05.016. [DOI] [PubMed] [Google Scholar]
- 8.李建军, 王盛章 镍钛合金支架关键尺寸对其疲劳性能影响的有限元分析. 生物医学工程学杂志. 2015;32(2):305–310. doi: 10.7507/1001-5515.20150056. [DOI] [Google Scholar]
- 9.邢海瑞, 朱明, 崔跃, 等 Ti-Ni合金血管支架的有限元分析及疲劳性能研究. 稀有金属. 2016;40(10):976–981. [Google Scholar]
- 10.李红霞, 张艺浩, 王希诚 基于有限元模拟的支架扩张、血流动力学及支架疲劳分析. 医用生物力学. 2012;27(2):178–185. doi: 10.3871/j.1004-7220.2012.02.185.. [DOI] [Google Scholar]
- 11.徐强, 刘玉岚, 王彪, 等 形状记忆合金心血管支架自扩张过程的数值模拟与支架的“最优化网格”. 生物医学工程学杂志. 2008;25(5):1101–1106. doi: 10.3321/j.issn:1001-5515.2008.05.025. [DOI] [PubMed] [Google Scholar]
- 12.郭飞飞, 冯海全, 江旭东, 等 球囊扩张式冠脉支架耦合扩张变形机理研究. 机械设计与研究. 2012;28(3):30–33, 37. doi: 10.3969/j.issn.1006-2343.2012.03.010. [DOI] [Google Scholar]
- 13.冯海全, 仇洪然, 刘佳, 等 永久性腔静脉滤器的生物力学和血流动力学性能分析. 机械工程学报. 2017;53(6):187–194. [Google Scholar]
- 14.冯海全, 李治国, 江旭东, 等 NiTi合金主动脉支架弯曲变形行为的研究. 功能材料. 2012;43(20):2823–2827. doi: 10.3969/j.issn.1001-9731.2012.20.021. [DOI] [Google Scholar]
- 15.冯海全, 江旭东, 胡志勇, 等 CoCr合金冠脉支架扩张变形的生物力学性能研究. 功能材料. 2012;43(S2):182–186. [Google Scholar]
- 16.赵振心. 镍钛合金血管支架的有限元分析及疲劳测试. 上海: 上海交通大学, 2007.
- 17.Guidance for Industry. Coronary drug-eluting stents nonclinical and clinical studies. U.S. Department of Health and Human Services, 2008.
- 18.The European Standard EN 14299. Non active surgical implants-particular requirements for cardiac and vascular iinplants-specific requirements for arterial stents. British Standard, 2004.
- 19.李治国, 冯海全 不同材质冠脉支架耦合变形机制研究. 稀有金属. 2018;42(9):931–936. [Google Scholar]
- 20.张瑞敏, 冯海全, 陈彦龙, 等 基于有限元分析的冠脉支架疲劳强度研究. 机械设计与制造. 2013;2(2):268–271. doi: 10.3969/j.issn.1001-3997.2013.02.085. [DOI] [Google Scholar]
- 21.宋迪. 超弹性NiTi形状记忆合金微管的疲劳行为及损伤演化模型研究. 成都: 西南交通大学, 2015.
- 22.Nakazawa G, Aloke V F, Marc V, et al Incidence and predictors of drug-eluting stent fracture in human coronary artery. J Am Coll Cardiol. 2009;54(21):1924–1931. doi: 10.1016/j.jacc.2009.05.075. [DOI] [PubMed] [Google Scholar]





