Abstract
本研究考察微振动刺激(MVS)对小鼠骨髓来源间充质干细胞(M-BMSCs)的早期力学适应性及成骨分化的调控作用。在体外给予 M-BMSCs 微振动刺激,检测细胞增殖及碱性磷酸酶(ALP)表达,荧光染色观察细胞凋亡与细胞骨架,流式检测细胞凋亡,通过 RT-PCR 检测早期成骨相关基因 runt 相关转录因子 2(Runx2)、Ⅰ型胶原(Col-Ⅰ)、ALP 表达,Western blotting 检测细胞外调节蛋白激酶 1/2(ERK1/2)磷酸水平。研究结果显示,微振动刺激诱导了细胞早期凋亡(受力 1 天后),但周期性受力 3 天后细胞的凋亡现象明显减少,而细胞的增殖活性并未受到明显影响;同时,微振动刺激促进了细胞骨架 F-actin 蛋白、ALP 合成和 ERK1/2 的磷酸化,并上调了 Runx2、Col-Ⅰ、ALP 的基因表达。研究结果表明微振动刺激能对 M-BMSCs 的细胞活性和结构产生早期适应性改变与调节,从而促进了细胞的早期成骨分化。
Keywords: 微振动, 间充质干细胞, 成骨分化, 力学适应性
Abstract
This study investigated the early mechanical adaptability and osteogenic differentiation of mouse bone marrow mesenchymal stem cells (M-BMSCs) under micro-vibration stimulation (MVS). M-BMSCs were stimulated by MVS in vitro, cell proliferation, alkaline phosphatase (ALP) activity assay, and cytoskeleton were measured, and cell apoptosis was observed by flow cytometry. Early osteoblast-associated genes, runt-related transcription factor 2 (Runx2), Collagen Ⅰ (Col-Ⅰ) and ALP, were observed by RT-PCR and the activation of extracellular regulated protein kinases 1/2 (ERK1/2) was determined by Western blotting. The results showed that MVS had no significant effect on the proliferation of M-BMSCs. The early apoptosis was induced by mechanical stimulation (for one day), but the apoptosis was decreased after cyclic stimulation for 3 days. At the same time, MVS significantly accelerated the expression of F-actin protein in cytoskeleton, the synthesis of ALP and the ERK1/2 pathway, also up-regulated the expressions of Runx2, Col-Ⅰ and ALP genes. This study indicates that MVS could regulate cellular activity, alter early adaptive structure and finally promote the early osteogenic differentiation of M-BMSCs.
Keywords: micro-vibration, mesenchymal stem cell, osteogenic differentiation, mechanical adaptability
引言
骨作为人体最主要的承力组织,骨量的维持主要取决于骨组织中成骨细胞与破骨细胞的动态平衡,其改建与代谢平衡受到力学刺激的共同调控,包括拉应力、压应力和剪切应力、微振动等[1-4]。研究显示细胞受到力学刺激后,通过细胞外基质-整合素-细胞骨架系统、离子通道、G 蛋白与酪氨酸激酶等多种途径将细胞外的力学信号转变为生物化学信号传导到细胞内,从而引发一系列应答反应,如细胞增殖、分化、凋亡、蛋白表达等[5-7]。研究同时发现,细胞并非对所有的力学刺激都会产生适应性变化,过高的强度与频率会使细胞发生不可逆死亡,只有当频率与强度在一定范围内,细胞才能维持正常的生物活性和结构,产生适应性改变[8-9]。微振动刺激(micro-vibration stimulation,MVS)是一种生理适应性力学负荷,该刺激一般是振幅 ≤ 50 μm、强度 < 1 × g、频率范围在 1~100 Hz 的低幅度、低强度、低频率力学刺激,具有促进骨形成和重建的效应。研究显示振动刺激可以调控成骨细胞与间充质干细胞的增殖和分化行为[10-11]。但目前对于力学刺激调控细胞应答的研究多侧重于应力刺激对细胞的成骨分化及力学信号转导机制方面[12],对于细胞早期的力学适应性行为及其与成骨分化之间的相关性影响方面却鲜有报道。力学适应性极有可能影响细胞在力学刺激条件下的细胞活性与成骨分化行为,并且提高细胞的力学适应性也将改善组织工程骨构建后的植入效果。
尽管目前已有不少工作探索了 MVS 对间充质干细胞分化和增殖的调控作用及机制[13-15],但这些工作仍存在以下问题需要深入探讨和完善:一是 MVS 环境设置,目前见于文献报道的类似研究所采用的 MVS 环境均为非生理环境,细胞置于单纯振动装置上进行加力刺激,这无疑会影响到细胞的活性状态,从而影响实验结果的准确性。而在本研究中,我们采用了自主研发设计并获得发明专利授权的微振动培养一体装置,该装置确保细胞在体外能处于适宜的生理环境下接受力学刺激,从而使得研究结果更加准确可靠。二是目前的研究聚焦于细胞的增殖和分化,但对细胞受力早期的生物学行为相关性关注很少,例如凋亡、细胞骨架蛋白表达与细胞增殖分化之间的相关性联系。而这些指标能够体现间充质干细胞受到力学刺激后所发生的生物学活动,进而直接或间接反映细胞的力学适应性[12, 16]。
目前绝大部分力学加载模型所带来的流体剪切力为单向式,例如由灌注式、机械搅拌式和旋转壁式等加载方式所产生的流体剪切力[17-18]。研究发现,人体骨组织受到各种应力作用时,骨组织中的骨小管网络在应力负荷下发生形变,引起网络中微流体流动,从而使效应细胞受到流体剪切力[19]。体内骨组织的组织液流动主要是以运动时的双向流动和静态转为动态时的单向流动。本研究所用的微振动培养一体装置能够在饱和湿度、37℃ 及 5% CO2 的生理环境下给予培养皿振动,进一步产生作用于细胞的流体剪切应力刺激,而在刺激过程中保持生理环境是绝大部分振动装置所不具备的关键要素。研究显示,振动时培养皿内液体流动方向由中央向外周发生波动,这是皿内液体受到振动而产生流动的结果,皿内细胞进而受到流体剪切应力的作用[20]。人体骨组织在生理环境下受到的力学刺激主要包括弯曲、压缩以及扭转载荷,一般不同的行为所产生的频率不同,例如在正常行走时与奔跑时的负荷频率[21-22]。在力学刺激中,微振动是唯一可以使液体产生双向流动的加载方式[1],而本装置所带来的微振动能够使液体产生振荡流,从而模拟运动时骨组织所产生的双向流体流动。
此外,已有的研究表明一定范围频率的振荡流体在细胞与细胞间相互作用和骨原细胞的成骨分化方面有积极的影响[23-24]。因此我们认为由设备产生的微振动刺激能够为细胞提供模拟体内生理状态下的应力刺激,故将其描述为生理应力刺激。基于此,本研究通过自主研发的微振动培养一体装置能够提供饱和湿度、适宜的 CO2 浓度与温度,在体外更真实地模拟体内的生理应力环境[20, 25-26],从而更加可靠地评估小鼠骨髓间充质干细胞(mouse bone marrow mesenchymal stem cells,M-BMSCs)受到 MVS 后所发生的凋亡、增殖与分化等生物学行为。这一研究为构建组织工程骨中种子细胞的优化提供理论依据,为构建成骨活性增强的组织工程骨提供依据,为临床骨缺损的再生修复治疗提供可能。
1. 材料与方法
1.1. 实验材料
M-BMSCs 由四川大学生物材料工程技术研究中心提供,磷酸盐缓冲液(phosphate buffered saline,PBS)、α-MEM 培养基(GIBCO 公司,美国),胎牛血清(fetal bovine serum,FBS)(Excell 公司,中国),AlamarBlue 溶液、Annexin V 凋亡检测试剂盒(Thermo fisher 公司,美国),碘化丙啶(PI)、钙黄绿素(Calcein)、FITC 标记的鬼笔环肽、4,6-二氨基-2-苯基吲哚(DAPI)(翊圣公司,中国),增强型 RIPA 细胞裂解液、BCA 总蛋白测定试剂盒(BOSTER 公司,中国),细胞总 RNA 提取试剂盒(天根公司,中国),引物合成由上海生工有限公司完成,一抗、二抗(谷歌公司,中国),iScriptTM cDNA Synthesis Kit 试剂盒、iQTM SYBR® Green supermix 试剂盒、PCR 反应仪、ChemiDocTMXRS+化学发光仪器、BD accuri C6 Plus(Bio-Rad 公司,美国)。
1.2. 细胞培养与接种
M-BMSCs 培养在含有 10% FBS 的 α-MEM 培养基内,添加 1% 青霉素/链霉素,置于 5% CO2、37℃ 及饱和湿度的细胞孵箱孵育。将细胞培养至第五代消化,按照 1.5 × 105/孔的密度接种于 24 孔板,静置 24 h 后进行振动加载。
1.3. 微振动加载
采用自主设计制备的微振动培养一体装置[27](中国发明专利授权号:CN 106399096 B),该装置包括信号发生器、信号放大器、信号检测器、孵箱及内部的振动台五大结构。目前的研究显示频率为 40 Hz、振幅为 50 μm、强度 0.3 g 的微振动有利于诱导细胞的成骨分化[26],因此在本研究中将样品分为振动(vibration stress,VS)组和静态(static state,SS)组。将振动组样品固定于振动台台面上,振动参数设置为:振幅为 50 μm,强度为 0.3 g,频率为 40 Hz,振动方向及波形为垂直正弦波。将接种后的孔板每隔 24 h 置于微振动培养一体装置内固定于振动台台面上,给予振动刺激 30 min,并同时给予 37℃、5% CO2、饱和湿度环境培养。
1.4. 微振动对 M-BMSCs 增殖活性影响
将第 5 代的 M-BMSCs 按照每孔 0.4 × 104 个细胞接种于 96 孔板,分为 VS 组与 SS 组,每组 5 个平行样。应用 1.3 节的加载方式,在第 1~7 天检测细胞增殖活性。加入 10% AlamarBlue 溶液,细胞孵箱孵育,在酶标仪波长 570 nm/600 nm 检测样品光密度(optical density,OD)值。
1.5. 微振动对 M-BMSCs 凋亡影响
将第 5 代 M-BMSCs 按照每皿 5 × 105 个细胞接种于培养皿内,分为 VS 组与 SS 组,应用 1.3 节的加载方式,在第 1、3 天定量检测细胞的凋亡情况。0.25% 胰酶消化细胞,PBS 清洗一次,缓冲液清洗一次,按照 5 × 105/mL 密度取 200 µL 细胞悬液,加入 FITC/APC 染液 5 µL 孵育 10 min,缓冲液清洗一次,重悬细胞加入 PI 染液 5 µL,上机检测。
1.6. M-BMSCs 凋亡荧光染色
将第 5 代 M-BMSCs 按照 1 × 104 个/片接种于细胞爬片,置于 24 孔板,分为 VS 组与 SS 组,应用 1.3 节的加载参数,第 1、3 天激光共聚焦显微镜下观察细胞凋亡。加入 PI 溶液避光孵育 20 min,PBS 清洗 2 次,加入 Calcein 溶液避光孵育 20 min,PBS 清洗 2 次,封片,激光共聚焦显微镜下观察,PI 激发/发射波长为 535 nm/615 nm,Calcein 激发/发射波长为 490 nm/515 nm。
1.7. M-BMSCs 细胞骨架荧光染色
将第 5 代 M-BMSCs 按照 1 × 103 个/片接种于细胞玻片上,置于 24 孔板,分为 VS 组与 SS 组,应用 1.3 节的加载参数,第 1、3 天激光共聚焦显微镜下观察细胞骨架。弃去培养基,37℃ 预热的 PBS 清洗细胞 2 次,4% 甲醛溶液固定细胞,PBS 清洗细胞 2 次,0.5% Triton X-100 透化处理,PBS 清洗 2 次,FITC 标记的鬼笔环肽覆盖细胞玻片孵育 30 min,PBS 清洗 3 次,DAPI 复染细胞核,清洗玻片,封片,激光共聚焦显微镜下观察,FITC 激发/发射波长为 496 nm/516 nm,DAPI 激发/发射波长为 364 nm/454 nm。
1.8. M-BMSCs 碱性磷酸酶活性检测
细胞加载 MVS 后,于第 7 天检测细胞碱性磷酸酶(alkaline phosphatase,ALP)蛋白表达量。用增强型 RIPA 裂解液处理,12 000 r/min 离心 10 min,取出上清液。50 µL 细胞裂解液加入 50 µL ALP 测定工作液,37℃ 孵育 15 min,加入 3 mol/L NaOH 终止反应,在酶标仪波长 405 nm 下检测 OD 值,利用 BCA 试剂盒测定样品的蛋白浓度,计算 NP/min/蛋白量。
1.9. RT-PCR 检测 M-BMSCs 成骨相关基因表达
细胞加载 MVS 后,于第 1、4、7 天检测细胞成骨基因 runt 相关转录因子 2(runt-related transcription factor 2,Runx2)、Ⅰ型胶原(Collagen Ⅰ,Col-Ⅰ)、ALP 的表达。弃去培养基,PBS 清洗 2 次,细胞总 RNA 提取试剂盒裂解细胞,提取总 mRNA。利用 iScriptTM cDNA Synthesis Kit 将提取的 mRNA 反转录为 cDNA,采用 iQTM SYBR Green Supermix 试剂盒进行 RT-PCR 检测。成骨基因引物序列见表 1。
表 1. Primers sequence of Runx2, Col-Ⅰ and ALP.
Runx2、Col-Ⅰ和 ALP 引物序列
| 目的基因 | 正向 | 反向 |
| Runx2 | AGAGGTGGACTCTGGGTCTG | TGACTCTGTAAGCGGGTCTG |
| Col-Ⅰ | ACAGACGAACAACCCAAACT | GGTTTTTGGTCACGTTCAGT |
| ALP | CCAACTCTTTTGTGCCAGAGA | GGCTACATTGGTGTTGAGCTTTT |
1.10. Western blotting 检测 ERK1/2 信号通路磷酸化
将第 5 代的 M-BMSCs 按照每皿接种 5 × 105 个细胞,分为 VS 组与 SS 组,在第 1、3 天进行 Western blotting 检测细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号通路磷酸化。弃去培养基,PBS 清洗 2 次,加入含 1% 广谱酶抑制剂与磷酸化酶抑制剂的增强型 RIPA 细胞裂解液充分裂解,12 000 r/min 离心 10 min,分离上清液。BCA 法测定样品总蛋白浓度,配制 10% SD-PAGE 胶将 95℃ 变性后的蛋白分离,然后转入 PVDF 膜上,将膜置于一抗孵育,再置于二抗孵育,最后将膜置于 ChemiDocTMXRS+化学发光仪器内曝光显影。使用软件 Image lab 记录目的条带灰度值并计算与之相应的 β-actin 比值。
1.11. 统计学处理
每组样品为 5 个,所有参数均做小样本 t 检验,P < 0.05 为差异有统计学意义。
2. 结果与讨论
2.1. M-BMSC 增殖活性
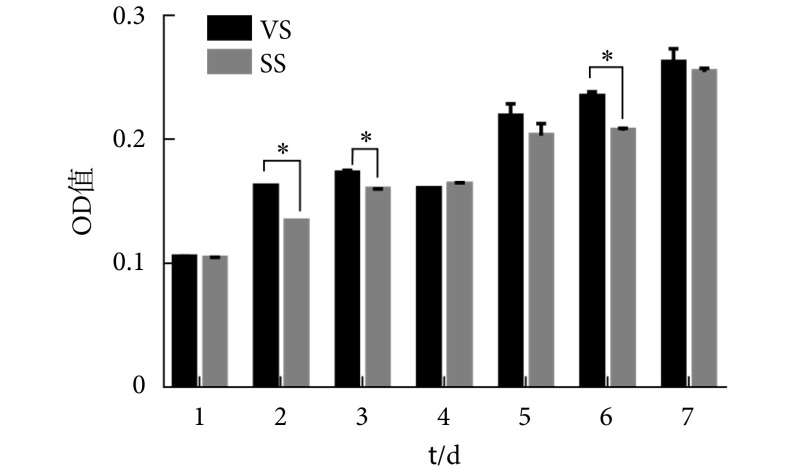
增殖实验结果如图 1 所示,实验组和对照组的 OD 值均随时间延长而递增,在第 7 天到达最高值。微振动加载早期(第 1 天)两组细胞的 OD 值无明显差异,在加力第 2 天和第 3 天,VS 组呈现出较明显的促进细胞生长的趋势,但随着加力时间的延长(第 4 天以后),VS 组的细胞生长速率有所减缓,在第 6 天 VS 组细胞的增殖活性较 SS 组高,而其他时间点 VS 组与 SS 组的 OD 值无显著差别。在力学加载早期(第 1~3 天),VS 组细胞在启动凋亡程序清除部分力学适应性较差细胞的情况下,相对于 SS 组细胞仍具有更高的增殖行为,这说明 MVS 在早期能够显著提高具有力学适应性的细胞的增殖活性,这抵消了受力后细胞因死亡(凋亡)带来的数量减少(第 1 天)。而到了后期两组之间无明显差异,说明 MVS 带来的促增殖作用主要体现在细胞受力早期,而并非是一种长时性效应。这可能是因为后期细胞对力学刺激产生适应改变后,激活了骨向分化应答,因此增殖活性也有所回落[28]。该结果也说明 MVS 并未对细胞的增殖活性造成负向影响。
图 1.
Effect of MVS on the proliferation of M-BMSCs
微振动对 M-BMSCs 增殖的影响
* P < 0.05
* P < 0.05
研究显示,振动刺激能激活效应细胞的细胞进程,包括细胞增殖、黏附、分化等。査丁胜等[29]的研究发现 20~50 Hz 的振动刺激能促进成骨细胞增殖活性。Kim 等的研究也显示 30~40 Hz、0.3 g 的振动能显著促进人 BMSCs 的增殖[1]。而 Zhou 等[8]的研究则发现 40~60 Hz、0.3 g 的微振动在促进人 BMSCs 成骨分化的同时对细胞增殖有抑制作用。大量研究已经证实间充质干细胞在对应力刺激做出响应的同时,也会受到细胞所处微环境的调控,甚至是细胞种属的影响[30-31]。而本研究结果则显示在模拟生理环境下,40 Hz、0.3 g、50 μm、30 min/天、正弦波的微振动能促进细胞早期的增殖行为,但随后这种促进作用逐渐减弱,这可能是因为随着周期性力学刺激的加载,细胞应答逐渐以骨向分化为主,从而使细胞的增殖速率有所减缓。
2.2. M-BMSCs 凋亡检测与荧光染色观察
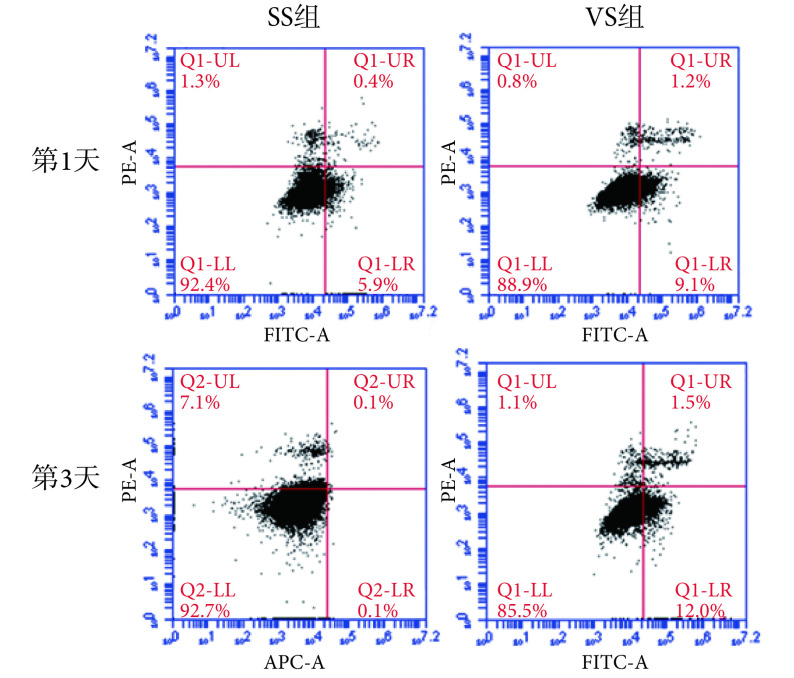
微振动加载后细胞凋亡流式检测结果如图 2 所示,通过 FITC/APC 与 PI 对细胞进行标记,早期凋亡细胞会发生细胞膜外翻,进而被 FITC/APC 结合散发绿色荧光,晚期凋亡和死亡细胞的细胞膜不完整,因而能够被 PI 进入结合细胞核,使其散发红色荧光,以此定量区分处于不同状态的细胞。加力 1 天后,VS 组出现 9.1% 的早期凋亡细胞,而 SS 组出现 5.9% 的早期凋亡细胞,VS 组的晚期凋亡细胞数量高于 SS 组。加力 3 天后,VS 组早期凋亡细胞数量较多,达到了 12%,但 SS 组死亡细胞数量达到 7.1%,两组之间晚期凋亡细胞数量无显著差异,这一结果提示不耐受 MVS 的细胞可能进一步通过凋亡被清除,留下的细胞除了发生早期凋亡外,其死亡细胞数量较 SS 组有所下降。结合细胞增殖活性,细胞加载微振动后,不耐受 MVS 的细胞被排除,留下的细胞相对于 SS 组细胞具有更好的力学适应性与增殖活性。
图 2.
Flow detection of M-BSMCs apoptosis
细胞凋亡的流式检测
UL: dead cells; UR: late apoptosis cells; LL: normal cells; LR: early apoptosis cells
UL:死亡细胞;UR:晚期凋亡细胞;LL:正常细胞;LR:早期凋亡细胞
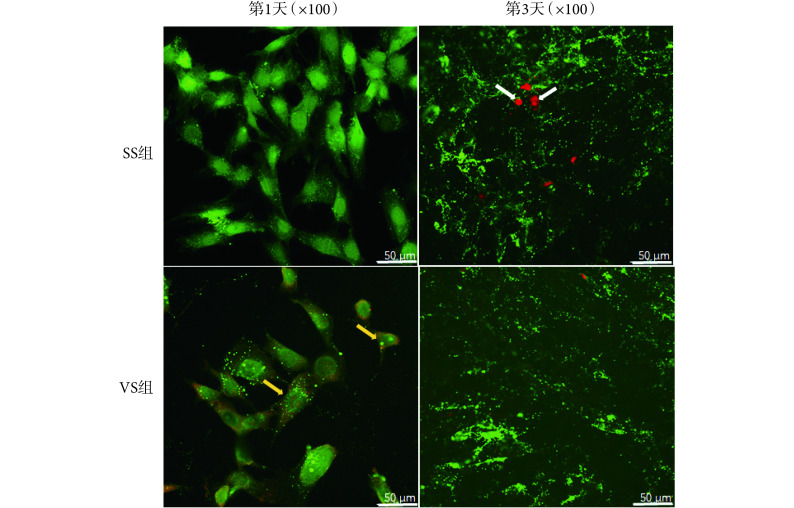
通过 Calcein 与 PI 对细胞进行染色(见图 3),正常细胞的细胞膜具有选择透过性,因此只能通过 Calcein,细胞呈现绿色形态;早凋细胞的细胞膜被打破,因此可以被 PI 进入,细胞内部呈现绿色,周围被 PI 染色呈现红色形态;晚凋细胞细胞膜不具备选择透过性,完全被 PI 染色,呈现红色形态。加力 1 天后,VS 组和 SS 组细胞均保持完整的细胞形态,SS 组细胞胞质内显示明亮的绿色荧光,而 VS 组部分细胞胞质外围出现红色荧光,内部则显示绿色荧光,说明细胞有较明显的凋亡现象,这一结果与流式检测结果比较吻合。加力 3 天后,两组细胞均呈现紧密堆积状态,SS 组可见呈现红色荧光的零星细胞,其形态收缩变圆,说明细胞有晚期凋亡现象;VS 组细胞胞质内呈现绿色荧光,凋亡细胞数量较少。
图 3.
Laser confocal observation of apoptosis of M-BMSCs
激光共聚焦观察 M-BMSCs 的凋亡
green: Calcein; red: PI. White arrow: late withered cell: yellow arrow: withered cells
绿色:钙黄绿素;红色:碘化丙啶。白色箭头示晚凋细胞,黄色箭头示早凋细胞
细胞凋亡是有特定控制的细胞自主有序死亡,又称程序性细胞死亡[32-33]。细胞的凋亡具有不可逆转性。研究表明适当的机械力学刺激可以促进细胞的生长、分化和功能的维持,但过度或持续时间过长的力学刺激又会对细胞的结构和功能造成损害[34]。本研究的结果显示尽管在微振动加载早期细胞出现了早凋行为,但这种行为未产生大量细胞死亡且未对细胞正常生物学行为造成影响,这可能是细胞通过结构和形态调整适应了这种力学刺激,即获得了力学自适应性[35-36]。通过 MVS 使得不耐受刺激的细胞发生凋亡而被清除,进而留下具有力学适应性的细胞,这一现象提示本研究给予细胞的 MVS 是一种生理适应性力学载荷,在少部分不耐受力学刺激的细胞被清除后,大部分细胞均能获得力学适应性,以及更强的增殖活性。
2.3. M-BMSCs 细胞骨架染色
图 4 所示为 VS 组与 SS 组细胞骨架染色。加载 MVS 1 天后,VS 组细胞较 SS 组铺展度更高,形态均为多角形,SS 组细胞形态不均一。VS 组细胞内肌动蛋白微丝沿细胞长轴排列,较 SS 组分布更为有序,荧光表达也更为明亮,说明 VS 组细胞 F-actin 蛋白表达量显著高于 SS 组。微振动加力 3 天后,两组细胞荧光亮度均有所降低,SS 组降低更为明显,且细胞有明显增殖,排列紧密,细胞内肌动蛋白微丝分布无序,VS 组细胞相较于 SS 组铺展度更高,微丝分布有序且荧光亮度高于 SS 组。
图 4.
Effect of MVS on expression of F-action in M-BMSCs cells
微振动对 M-BMSCs 中 F-actin 蛋白表达的影响
blue: nucleus; green: F-action
蓝色:细胞核;绿色:聚合态微丝
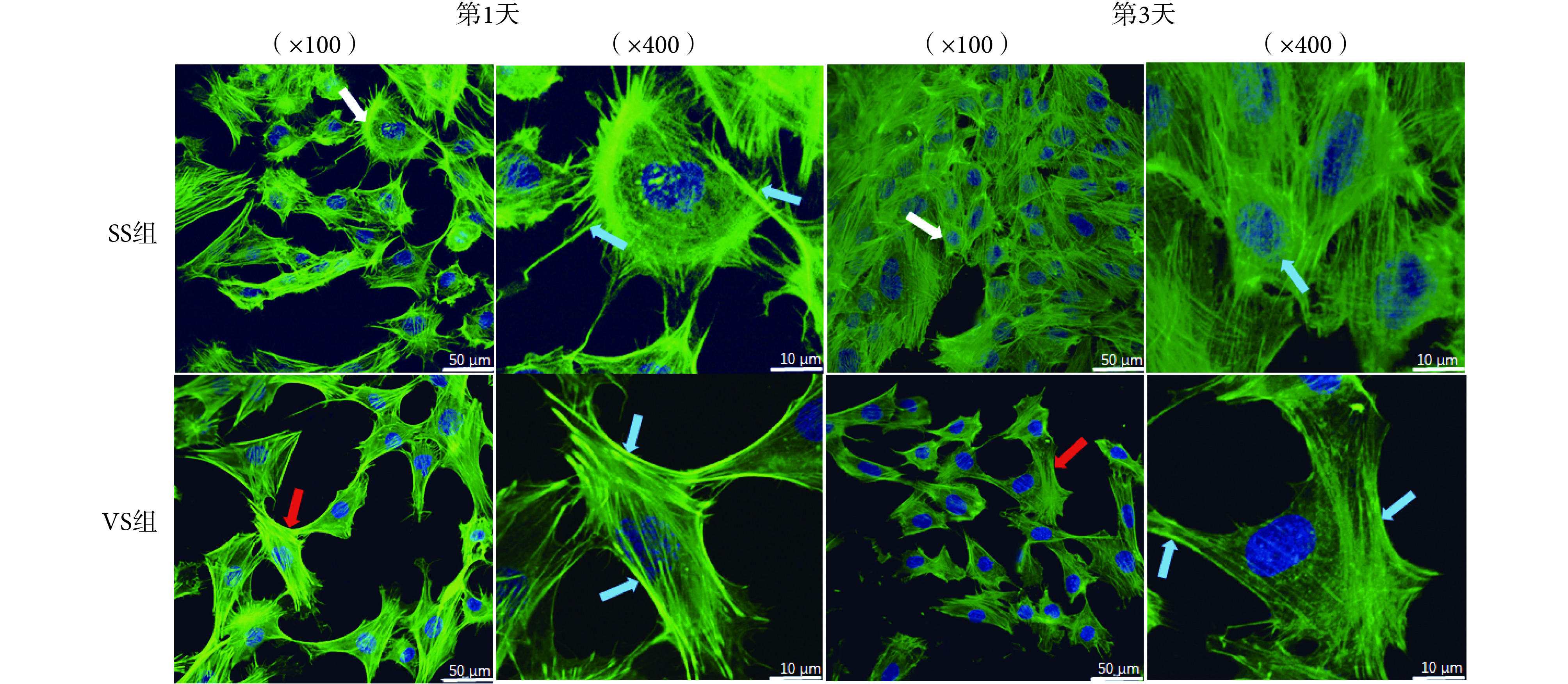
细胞骨架是真核细胞胞质中的纤维状网架,具有维持细胞形态及运动的功能,由微丝、微管和中间纤维组成。肌动蛋白与核膜相连,当有外力作用于细胞时,力学信号经细胞外基质-整合素-受体传递到细胞内,骨架系统发生解聚和重排,引发细胞形态变化[37-38],并激活细胞基因组,引起细胞生长、蛋白质合成等应答反应。本研究显示 MVS 力学刺激通过引起细胞骨架重构、F-actin 蛋白丝增粗及定向排列引起了 M-BMSCs 形态的变化,并在受力早期激活了细胞的增殖行为。随着细胞周期性受力一段时间后,MVS 产生力学信号通过重构的细胞骨架进一步对细胞作用,促使细胞骨向分化以及细胞铺展黏附,也因此抑制了细胞的增殖。研究结果显示细胞受到力学刺激后会发生结构与形态的快速改建与功能响应,当细胞在早期完成了适应性改变且清除不耐受力学刺激的细胞后,存活的细胞将会获得力学刺激耐受性,这就意味着细胞与支架复合后植入体内将会更快地适应体内生理应力的刺激[16]。
2.4. 微振动调控 M-BMSCs 碱性磷酸酶表达
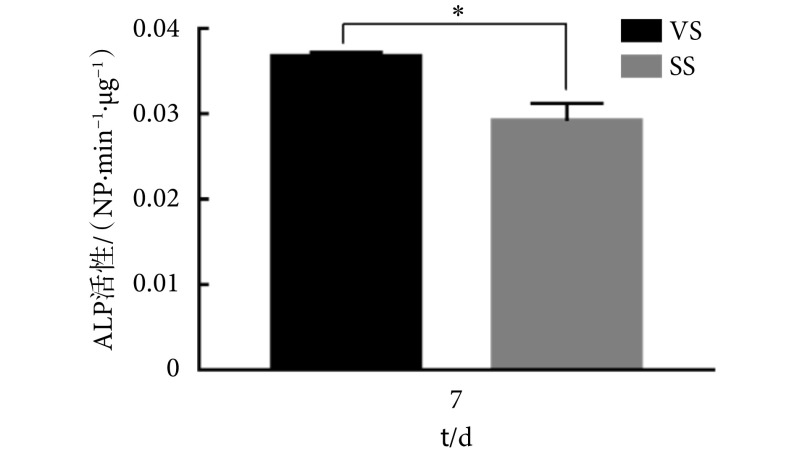
ALP 活性定量检测结果显示(见图 5),VS 组在第 7 天的 ALP 表达显著高于 SS 组(P < 0.05),这说明 VS 组细胞具有更好的成骨分化趋势。M-BMSCs 分化初期会伴随 ALP 的上升,ALP 是 M-BMSCs 分化的重要标志,ALP 作为成骨细胞系发育中期的标志物,反映其代谢水平,与细胞钙化及细胞外基质矿化有着紧密联系。研究表明 MVS 可以促进间充质干细胞成骨标志物 ALP、骨桥蛋白、Col-Ⅰ以及血管内皮生长因子的表达,这与本研究的 ALP 检测结果是一致的,这也与本研究中细胞增殖的结果互为印证。这一现象与目前文献报道的细胞分化促进的同时会使得细胞增殖活性降低的现象相一致,目前研究认为 [26],振动在促进人 BMSCs 成骨分化的同时,会降低细胞的增殖活性。本研究则发现,MVS 在促进 M-BMSCs 成骨分化的同时能够提高细胞的增殖活性,这可能是由于本研究所用的微振动培养一体装置在细胞接受 MVS 的同时提供了适宜的生理环境,排除了细胞因环境变化而造成的生理活性的异常。此外,不同的细胞来源可能也会对结果有一定的影响。
图 5.
Effect of MVS on ALP activity in M-BMSCs
微振动对 M-BMSCs 碱性磷酸酶活性的影响
* P < 0.05
* P < 0.05
2.5. M-BMSCs 早期成骨相关基因表达
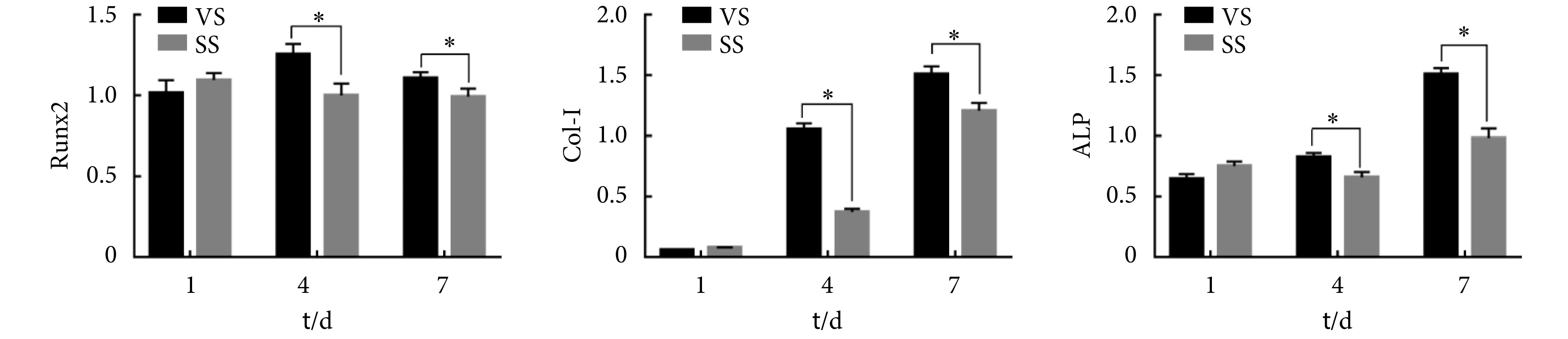
由 RT-PCR 结果可见(见图 6),相对于 SS 组细胞,VS 组细胞 Runx2、Col-Ⅰ和 ALP 的基因表达在第 4 天和第 7 天显著高于 SS 组,Runx2 在第 4 天时表达最高,Col-Ⅰ和 ALP 在第 7 天时表达最高(P < 0.05)。骨系细胞在成骨分化过程中通常按照相似的时序性基因表达模式和框架。一般来说,Runx2 作为成骨细胞的特异性转录因子,是干细胞早期向成骨分化的特征性表达因子,在骨形成和重建过程中发挥重要作用;ALP 和 Col-Ⅰ是成骨细胞分泌的主要细胞外基质蛋白,在成骨细胞中期也就是细胞外基质合成阶段表达 [39-40]。从 RT-PCR 结果看,SS 组的 M-BMSCs 成骨分化相关基因 Runx2 在第 1 天即达到表达水平顶峰,而 VS 组则在第 4 天到达顶峰,相较于 SS 组推迟了,这可能是因为 VS 组在受力早期处于增殖活性增强状态,从而抑制了细胞的分化行为。而两组的 Col-Ⅰ和 ALP 表达尽管均在第 7 天达到顶峰,但 VS 组的表达显著高于 SS 组,这说明 VS 组具有更强的促骨向分化能力。本研究的结果证明了 MVS 能够促进 M-BMSCs 早期增殖和中期骨向分化,促进细胞外基质矿化及相关胶原合成,并且这种促进仍然遵循了生理状态下骨系细胞成骨分化的时序性基因表达。
图 6.
Effect of MVS on osteoblast-associated gene expression of two-dimension cultured M-BMSCs
微振动对二维培养 M-BMSCs 成骨相关基因早期表达的影响
* P < 0.05
* P < 0.05
2.6. M-BMSCs 的 ERK1/2 信号通路磷酸化表达
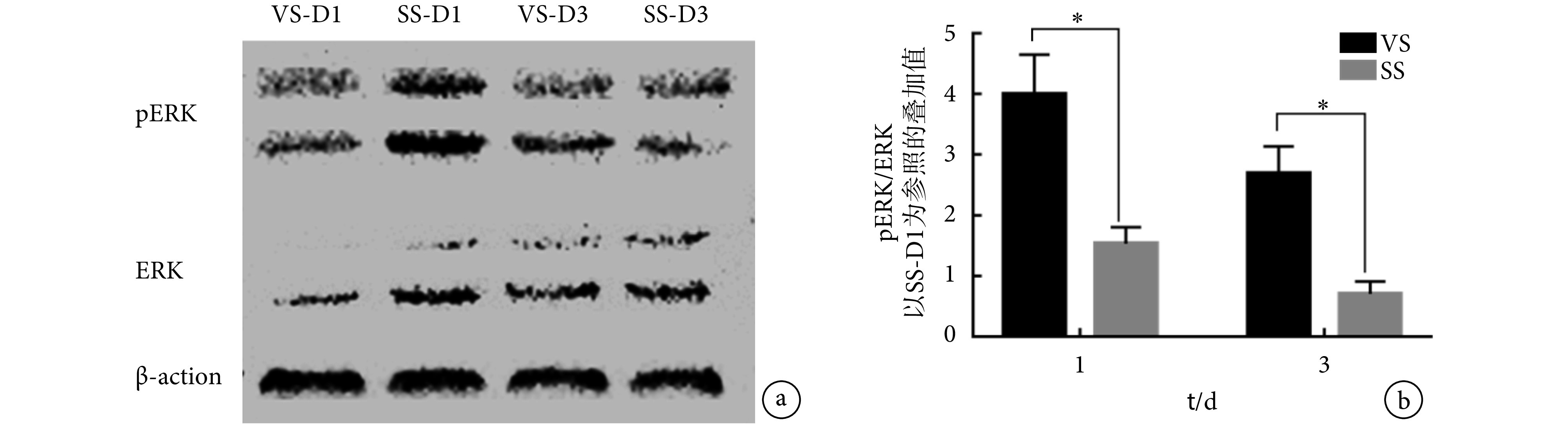
图 7 为 Western blotting 的验证结果。图 7a 为 ERK1/2、pERK 与 β-action 蛋白的化学发光图,目的蛋白分子量为 44 kD 左右;图 7b 为通过归一化处理后的各组 ERK1/2 的磷酸化比例直方图,以 SS-D1 表达量为参考,通过 Image Lab 计算各组 pERK 相对于 SS-D1 的 pERK 的相对灰度值、ERK1/2 的相对灰度值与 β-action 的相对灰度值。经过计算处理的 Western blotting 结果显示,第 1 天和第 3 天 VS 组细胞的 ERK1/2 磷酸化比例均明显高于 SS 组(P < 0.05),且 VS 组与 SS 组 ERK1/2 的磷酸化比例在第 1 天表达最高,随后两组细胞的 ERK1/2 磷酸化比例均明显下降,MVS 能够显著促进 ERK1/2 的磷酸化。
图 7.
Effect of MVS on the activation of ERK1/2 signaling pathway in two-dimension cultured M-BMSCs
微振动对二维培养 M-BMSCs 的 ERK1/2 磷酸化的影响
a. chemiluminiscence imaging of the target protein; b: histogram of proportion of ERK1/2 activation. * P < 0.05
a. 目的蛋白化学发光成像;b. ERK1/2 磷酸化比例直方图. * P < 0.05
ERK1/2 是丝裂原激活蛋白激酶家族的一个成员,是与细胞增殖、分化和凋亡相关的信号转导因子[41-43]。研究表明,ERK1/2 信号通路中 ERK1/2 的磷酸化水平显示了 MVS 对细胞分化的作用。本研究结果表明 MVS 可以促进 M-BMSCs 中 ERK1/2 的磷酸化,并且促进成骨早期分化。这提示 ERK1/2 磷酸化对细胞的早期成骨分化存在促进作用。此外,细胞在受力早期(第 1 天)增殖活性增强,F-actin 表达增加可能也与 ERK1/2 的磷酸化增高存在正性关系。
3. 结论
力学加载模型、频率与强度的不同都会对细胞的生物学行为产生不同的影响。本研究采用自主设计微振动培养一体装置,在体外给予 M-BMSCs 以频率 40 Hz、强度 0.3 g、振幅 50 µm、时间 30 min/天的周期性微振动刺激。研究结果显示 MVS 能对 M-BMSCs 的生物活性和结构产生早期适应性改变与调节,并可能通过力学适应性细胞骨架重构从而促进了细胞的早期成骨分化。
利益冲突声明:本文全体作者均声明不存在利益冲突。
Funding Statement
国家自然科学基金(31670985,31400809);国家重点研发计划(2016YFC1102000);国家大学生创新计划(201810613060);四川省大学生创新计划(2019129)
Contributor Information
雪宁 陈 (Xuening CHEN), Email: xchen6@scu.edu.cn.
伟 智 (Wei ZHI), Email: zhiwei@swjtu.edu.cn.
References
- 1.Mcclarren B, Olabisi R Strain and vibration in mesenchymal stem cells. Int J Biomater. 2018;2018(3):1–13. doi: 10.1155/2018/8686794. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Tsimbouri P M, Childs P G, Pemberton G D, et al Stimulation of 3D osteogenesis by mesenchymal stem cells using a nanovibrational bioreactor. Nat Biomed Eng. 2017;1(9):758–770. doi: 10.1038/s41551-017-0127-4. [DOI] [PubMed] [Google Scholar]
- 3.Chen Bailing, Lin Tao, Yang Xiaoxi, et al Low-magnitude, high-frequency vibration promotes the adhesion and the osteogenic differentiation of bone marrow-derived mesenchymal stem cells cultured on a hydroxyapatite-coated surface: The direct role of Wnt/β-catenin signaling pathway activation. Int J Mol Med. 2016;38(5):1531–1540. doi: 10.3892/ijmm.2016.2757. [DOI] [PubMed] [Google Scholar]
- 4.Oliveira L C, Oliveira R G, Pires-Oliveira D A A Effects of whole body vibration on bone mineral density in postmenopausal women: a systematic review and meta-analysis. Osteoporos Int. 2016;27(10):2913–2933. doi: 10.1007/s00198-016-3618-3. [DOI] [PubMed] [Google Scholar]
- 5.Brohawn S G, Su Zhenwei, Mackinnon R Mechanosensitivity is mediated directly by the lipid membrane in TRAAK and TREK1 K+ channels . Proc Natl Acad Sci U S A. 2014;111(9):3614–3619. doi: 10.1073/pnas.1320768111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Humphrey J D, Dufresne E R, Schwartz M A Mechanotransduction and extracellular matrix homeostasis. Nat Rev Mol Cell Biol. 2014;15(12):802–812. doi: 10.1038/nrm3896. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.李良, 邓力, 陈孟诗, 等 力学刺激对 3 月龄骨质疏松大鼠成骨细胞增殖与合成功能的影响. 生物医学工程学杂志. 2004;21(3):341–346, 349. doi: 10.3321/j.issn:1001-5515.2004.03.001. [DOI] [PubMed] [Google Scholar]
- 8.Zhou Yi, Guan Xiaoxu, Liu Tie, et al Whole body vibration improves osseointegration by up-regulating osteoblastic activity but down-regulating osteoblast-mediated osteoclastogenesis via ERK1/2 pathway. Bone. 2015;71:17–24. doi: 10.1016/j.bone.2014.09.026. [DOI] [PubMed] [Google Scholar]
- 9.Wang L, Hsu H Y, Li X, et al Effects of frequency and acceleration amplitude on osteoblast mechanical vibration responses: a finite element study. BioMed Res Int. 2016;2016:1–16. doi: 10.1155/2016/2735091. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Ota T, Chiba M, Hayashi H Vibrational stimulation induces osteoblast differentiation and the upregulation of osteogenic gene expression in vitro . Cytotechnology. 2016;68(6):2287–2299. doi: 10.1007/s10616-016-0023-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Lu Yuezhi, Zhao Qian, Liu Yang, et al Vibration loading promotes osteogenic differentiation of bone marrow-derived mesenchymal stem cells via p38 MAPK signaling pathway. J Biomech. 2018;71:67–75. doi: 10.1016/j.jbiomech.2018.01.039. [DOI] [PubMed] [Google Scholar]
- 12.孙凌璐, 苏雪莲, 何晓兰, 等 生物力学信号诱导骨髓间充质干细胞分化的现状. 口腔医学研究. 2018;34(1):94–96. [Google Scholar]
- 13.Wehland M, Warnke E, Frett T, et al The impact of hypergravity and vibration on gene and protein expression of thyroid cells. Microgravity Sci Technol. 2016;28(3):261–274. doi: 10.1007/s12217-015-9474-5. [DOI] [Google Scholar]
- 14.Zhang Chunxiang, Lu Yanqin, Zhang Linkun, et al Influence of different intensities of vibration on proliferation and differentiation of human periodontal ligament stem cells. Arch Med Sci. 2015;11(3):638–646. doi: 10.5114/aoms.2015.52370. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Demiray L, Ozcivici E Bone marrow stem cells adapt to low-magnitude vibrations by altering their cytoskeleton during quiescence and osteogenesis. Turk J Biol. 2015;39(1):88–97. [Google Scholar]
- 16.何万庆, 夏亚一, 王海明, 等 剪切力诱导细胞骨架重组在力学信号转导机制中的作用. 国际骨科学杂志. 2009;30(4):257–260. doi: 10.3969/j.issn.1673-7083.2009.04.016. [DOI] [Google Scholar]
- 17.李祥, 李涤尘, 王林, 等 旋转灌注式生物反应器系统构建及在骨组织工程中的应用. 生物医学工程学杂志. 2007;24(1):66–70. doi: 10.3321/j.issn:1001-5515.2007.01.015. [DOI] [PubMed] [Google Scholar]
- 18.林梅 生物反应器在构建组织工程产品中的应用研究. 医疗卫生装备. 2008;29(4):32–34. doi: 10.3969/j.issn.1003-8868.2008.04.013. [DOI] [Google Scholar]
- 19.You L D, Cowin S C, Schaffler M B, et al A model for strain amplification in the actin cytoskeleton of osteocytes due to fluid drag on pericellular matrix. J Biomech. 2001;34(11):1375–1386. doi: 10.1016/S0021-9290(01)00107-5. [DOI] [PubMed] [Google Scholar]
- 20.查丁胜. 成骨细胞对振动应力作用的早期应答及力学信号转导机制的初步研究. 广州: 南方医科大学, 2008.
- 21.Thompson W R, Rubin C T, Rubin J Mechanical regulation of signaling pathways in bone. Gene. 2012;503(2):179–193. doi: 10.1016/j.gene.2012.04.076. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Du Dajiang, Asaoka T, Ushida T, et al Fabrication and perfusion culture of anatomically shaped artificial bone using stereolithography. Biofabrication. 2014;6(4):11. doi: 10.1088/1758-5082/6/4/045002. [DOI] [PubMed] [Google Scholar]
- 23.Bhumiratana S, Bernhard J C, Alfi D M, et al Tissue-engineered autologous grafts for facial bone Reconstruction. Sci Transl Med. 2016;8(343):12. doi: 10.1126/scitranslmed.aad5904. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Li Zhaohui, Cui Zhanfeng Three-dimensional perfused cell culture. Biotechnol Adv. 2014;32(2):243–254. doi: 10.1016/j.biotechadv.2013.10.006. [DOI] [PubMed] [Google Scholar]
- 25.周腾. 利用仿真建模和有限元分析研究宏观孔隙结构与骨诱导行为的相关性. 成都: 西南交通大学, 2017.
- 26.Zhou Yi, Guan Xiaoxu, Zhu Zhuoli, et al Osteogenic differentiation of bone marrow-derived mesenchymal stromal cells on bone-derived scaffolds: effect of microvibration and role of ERK1/2 activation. Eur Cells Mater. 2011;22:12–25. doi: 10.22203/eCM.v022a02. [DOI] [PubMed] [Google Scholar]
- 27.智伟, 翁杰, 匙峰, 等. 一种细胞培养箱: ZL 201610900515.6. 2018-10-30.
- 28.赵丹, 胥春 力学影响细胞凋亡及其信号转导机制研究进展. 医用生物力学. 2014;29(2):188–192. doi: 10.3871/j.1004-7220.2014.02.192.. [DOI] [Google Scholar]
- 29.查丁胜, 陈建庭, 邓轩庚, 等 不同频率振动应变对成骨细胞增殖及分化能力的影响. 中国骨质疏松杂志. 2008;14(5):303–307, 312. doi: 10.3969/j.issn.1006-7108.2008.05.002. [DOI] [Google Scholar]
- 30.Marycz K, Lewandowski D, Tomaszewski K A, et al Low-frequency, low-magnitude vibrations (LFLM) enhances chondrogenic differentiation potential of human adipose derived mesenchymal stromal stem cells (hASCs) PeerJ. 2016:e1637. doi: 10.7717/peerj.1637. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Wei F Y, Chow S K, Leung K S, et al Low-magnitude high-frequency vibration enhanced mesenchymal stem cell recruitment in osteoporotic fracture healing through the SDF-1/CXCR4 pathway. Eur Cell Mater. 2016;31:341–354. doi: 10.22203/eCM.v031a22. [DOI] [PubMed] [Google Scholar]
- 32.Weyts F A A, Bosmans B, Niesing R, et al Mechanical control of human osteoblast apoptosis and proliferation in relation to differentiation. Calcif Tissue Int. 2003;72(4):505–512. doi: 10.1007/s00223-002-2027-0. [DOI] [PubMed] [Google Scholar]
- 33.Novaleski C K, Kimball E E, Mizuta M, et al Acute exposure to vibration is an apoptosis-inducing stimulus in the vocal fold epithelium. Tissue Cell. 2016;48(5):407–416. doi: 10.1016/j.tice.2016.08.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Pavalko F M, Gerard R L, Ponik S M, et al Fluid shear stress inhibits TNF-alpha-induced apoptosis in osteoblasts: a role for fluid shear stress-induced activation of PI3-kinase and inhibition of caspase-3. J Cell Physiol. 2003;194(2):194–205. doi: 10.1002/jcp.10221. [DOI] [PubMed] [Google Scholar]
- 35.王海芳, 梅其炳 生理性力学刺激对抗骨组织细胞凋亡的研究进展. 细胞生物学杂志. 2009;31(6):785–791. [Google Scholar]
- 36.Beltramo E, Berrone E, Giunti S, et al Effects of mechanical stress and high glucose on pericyte proliferation, apoptosis and contractile phenotype. Exp Eye Res. 2006;83(4):989–994. doi: 10.1016/j.exer.2006.05.008. [DOI] [PubMed] [Google Scholar]
- 37.Zemel A Active mechanical coupling between the nucleus, cytoskeleton and the extracellular matrix, and the implications for perinuclear actomyosin organization. Soft Matter. 2015;11(12):2353–2363. doi: 10.1039/C4SM02425G. [DOI] [PubMed] [Google Scholar]
- 38.Akhouayri O, Lafageproust M H, Rattner A, et al Effects of static or dynamic mechanical stresses on osteoblast phenotype expression in three-dimensional contractile collagen gels. J Cell Biochem. 2015;76(2):217–230. doi: 10.1002/(sici)1097-4644(20000201)76:2<217::aid-jcb6>3.3.co;2-b. [DOI] [PubMed] [Google Scholar]
- 39.Kim H S, Zheng Mingzhen, Kim D K, et al Effects of 1,25-dihydroxyvitamin D3 on the differentiation of MC3T3-E1 osteoblast-like cells . J Periodontal Implant Sci. 2018;48(1):34–46. doi: 10.5051/jpis.2018.48.1.34. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Zhang Yilin, Hou Weiwei, Liu Yang, et al Microvibration stimulatesβ-catenin expression and promotes osteogenic differentiation in osteoblasts. Arch Oral Biol. 2016;70:47–54. doi: 10.1016/j.archoralbio.2016.06.009. [DOI] [PubMed] [Google Scholar]
- 41.Sánchez I, Hughes R T, Mayer B J, et al Role of SAPK/ERK kinase-1 in the stress-activated pathway regulating transcription factor c-Jun. Nature. 1994;372(6508):794–798. doi: 10.1038/372794a0. [DOI] [PubMed] [Google Scholar]
- 42.Russo C, Lazzaro V, Gazzaruso C, et al Proinsulin C-peptide modulates the expression of ERK1/2, type I collagen and RANKL in human osteoblast-like cells (Saos-2) Mol Cell Endocrinol. 2017;442:134–141. doi: 10.1016/j.mce.2016.12.012. [DOI] [PubMed] [Google Scholar]
- 43.Sun Yu, Liu Wenzhou, Liu Tao, et al Signaling pathway of MAPK/ERK in cell proliferation, differentiation, migration, senescence and apoptosis. Journal of Receptors and Signal Transduction. 2015;35(6):600–604. doi: 10.3109/10799893.2015.1030412. [DOI] [PubMed] [Google Scholar]