Abstract
海洋源生物大分子具有资源丰富、功能独特、生物安全、成本低廉等特点,是生物医用材料研发的优良原料。海洋生物医用材料目前已成为生物医用材料产业的主要分支,符合全球倡导的“绿色产业、低碳经济”的发展大趋势,发展前景极为可观。壳聚糖与海藻酸盐是海洋源生物材料中商业化开发最多的两类材料,在伤口敷料、牙科材料、抗菌处理、药物控释、组织工程等领域均有广泛的应用。本文主要介绍壳聚糖与海藻酸盐的性质及其在生物医药领域的应用,以及作为医用材料发展面临的瓶颈与挑战。
Keywords: 壳聚糖, 海藻酸盐, 生物材料
Abstract
Marine-derived biopolymers are excellent raw materials for biomedical products due to their abundant resources, good biocompatibility, low cost and other unique functions. Marine-derived biomaterials become a major branch of biomedical industry and possess promising development prospects since the industry is in line with the trend of “green industry and low-carbon economy”. Chitosan and alginates are the most commonly commercialized marine-derived biomaterials and have exhibited great potential in biomedical applications such as wound dressing, dental materials, antibacterial treatment, drug delivery and tissue engineering. This review focuses on the properties and applications of chitosan and alginates in biomedicine.
Keywords: chitosan, alginates, biomaterials
引言
海洋源生物医用材料是指提取自海洋生物的医用材料,是海洋资源高技术开发利用的制高点之一[1]。海洋源生物医用材料种类繁多,根据其分子组成可分为无机类材料如珊瑚礁基生物材料、高分子多糖类材料如海藻酸盐和壳聚糖,以及蛋白类材料如胶原蛋白基生物材料等。海洋源生物医用材料来源丰富,属于天然生物再生资源,且结构多样、功能独特,具有一定的生物学活性。此外,大部分海洋生物医用材料为可生物降解吸收材料,生产加工成本相对低廉,但产品附加值高。目前,海洋源生物医用材料的制备与应用已成为生物材料领域研究的一个热点。
在海洋源生物材料中,开发利用最多的是壳聚糖和海藻酸盐。壳聚糖及其衍生物提取自水产品加工过程中的下脚料,如虾壳、蟹壳等,目前年产量达 5 万吨;而海藻酸盐提取自海带、巨藻、墨角藻、泡叶藻等褐藻,目前年产量超过 6 万吨。壳聚糖及海藻酸盐除应用于轻工业、农业、功能性食品、药品、环保等领域外,也是功能性生物医用材料的优质原料。本文主要介绍壳聚糖与海藻酸盐在生物医药领域的应用。
1. 壳聚糖及其衍生物在生物医药领域的应用
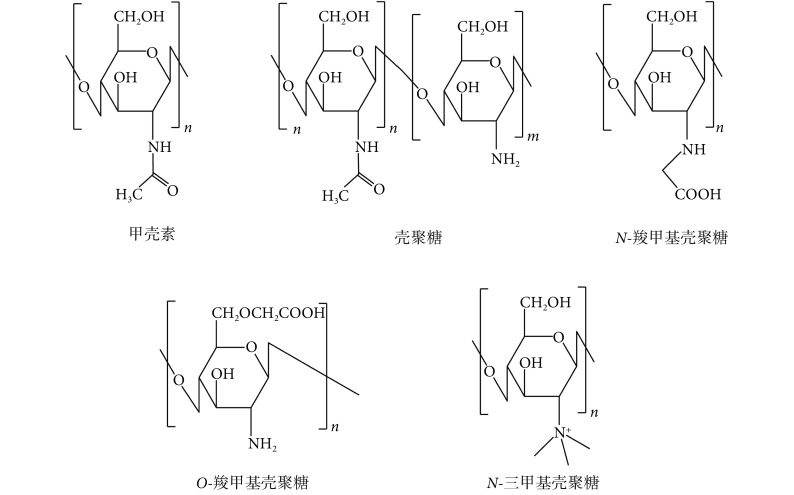
壳聚糖是甲壳素脱乙酰化后的产物,由随机分布的 2-乙酰氨基-2-脱氧-D-吡喃葡萄聚糖和 2-氨基-2-脱氧-D-吡喃葡萄聚糖,通过 β-1,4 糖苷键连接而成的二元线型聚合物,是自然界唯一大量存在的碱性阳离子聚多糖(见图 1)。壳聚糖具有生物可降解性,可以被氨基葡萄糖苷酶、脂肪酶、溶菌酶等分解,分解产物为氨基葡萄糖(glucosamine),可以通过新陈代谢排出体外。由于含有大量氨基、羟基、乙酰氨基等活性基团,壳聚糖具有良好的反应功能性和生理活性,已被广泛应用于生物医药、化工、食品、环境等领域。
图 1.
Chemical structures of chitin, chitosan and chitosan derivatives
甲壳素、壳聚糖及常见的壳聚糖衍生物的化学结构
对壳聚糖进行化学改性,可以得到一系列壳聚糖衍生物,比如羧甲基壳聚糖、N-三甲基壳聚糖和壳聚糖硫酸盐等。在壳聚糖分子上引入羧甲基可以显著提高壳聚糖的水溶性。根据羧甲基引入位置的不同,羧甲基壳聚糖可分为 O-羧甲基壳聚糖和 N-羧甲基壳聚糖(见图 1)。O-羧甲基壳聚糖可通过壳聚糖与一氯乙酸反应制备[2],N-羧甲基壳聚糖通过壳聚糖与乙醛酸反应得到[3],产物中随机分布着单羧基取代基团(-NH-CH2COOH)与双羧基取代基团(-N-(CH2COOH)2)。羧甲基壳聚糖是一种两性离子聚合物,其溶解度受 pH 值影响,与其氨基的质子化和羧基的解离平衡密切相关。
N-三甲基壳聚糖是另一类被广泛研究的季铵盐壳聚糖衍生物。其制备方法主要有三种:① 壳聚糖与甲醛-乙酸混合物反应得到 N-二甲基壳聚糖,之后再与碘甲烷和 N-甲基吡咯烷酮反应得到 N-三甲基壳聚糖[4];② 壳聚糖与二甲基硫酸盐和氢氧化钠反应直接得到 N-三甲基壳聚糖[5];③ 壳聚糖在甲磺酸盐的存在下与叔丁基二甲基甲硅烷基(tert-Butyldimethylsilyl ether,TBDMS)氯反应得到二叔丁基二甲基甲硅烷基(Di-TBDMS)壳聚糖以保护壳聚糖 C-3 和 C-6 上的羟基,之后与碘甲烷反应得到 Di-TBDMS 保护的 N-三甲基壳聚糖,最后脱去 Di-TBDMS 基团得到 N-三甲基壳聚糖[6]。N-三甲基壳聚糖由于含有季铵基团,所以在酸性与碱性条件下均有良好的水溶性,且黏膜黏附性能优于壳聚糖。此外,带正电 N-三甲基壳聚糖能与上皮膜(epithelial membrane)上带负电的位点作用,增强小分子与大分子物质的穿透性。
1.1. 壳聚糖及其衍生物在止血、抗炎、抗菌等方面的应用
壳聚糖是一种天然无毒的生物高分子,具有三种反应官能团即 C-2 上的氨基/乙酰氨基、C-3 上的羟基与 C-6 上的羟基,其中氨基是壳聚糖具有独特结构和物理化学性能的主要原因。壳聚糖生物相容性与生物可降解性好,兼具抗氧化、抗过敏、抗炎、抗菌、止血、促进创面愈合、减少疤痕增生等多种生物学功能,通过控制分子链结构,能进一步调节壳聚糖及其衍生物的各项性能,因而已广泛应用于生物医药领域。
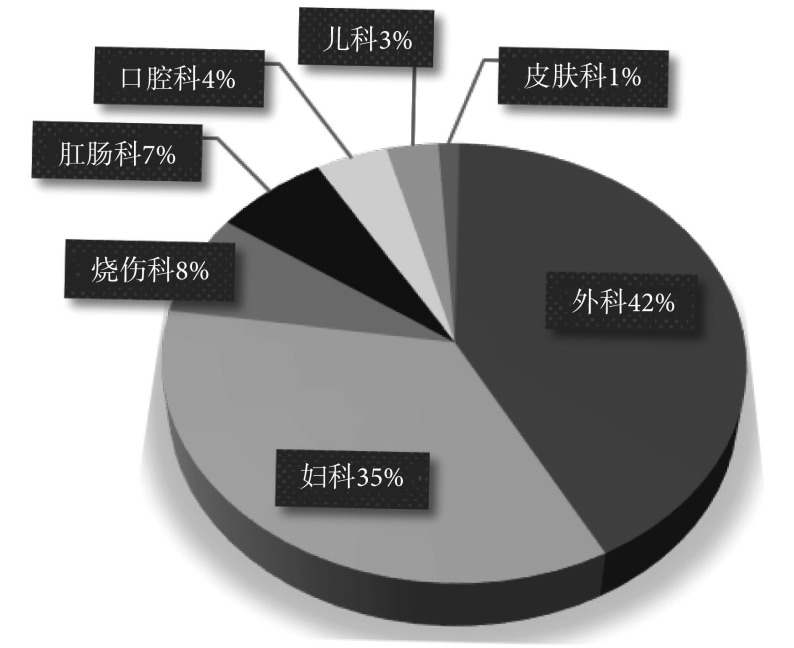
迄今为止,国内已申请的壳聚糖相关的专利已超过 5 000 项,已公布了 9 项壳聚糖基生物材料相关行业的国家级标准(见表 1),国家食品药品监督管理总局批准的壳聚糖基生物医用材料生产企业超过 100 家。已商业化的壳聚糖基医用产品在外科、妇科、烧伤科等多个方面有着广泛的应用(见图 2)。目前我国已上市的壳聚糖基医用产品,超过 40% 应用在外伤处理上。壳聚糖基敷料、凝胶、止血粉等已被广泛应用于处理具有大量渗出液的伤口,挫伤、擦伤、撕裂伤等无感染性浅层或表面伤口,外伤性创面,以及手术切口等,可预防创面感染,促进创面愈合,同时具有止血、消炎、减少组织液渗出、防止组织粘连的作用。在妇科应用上,壳聚糖凝胶栓剂和洗液可有效预防和减少女性下生殖道感染,祛除阴道过多的炎性分泌物,提高阴道清洁度,恢复阴道正常的生理酸性,调节阴道微生态平衡,改善阴道炎引起的阴部瘙痒灼痛、阴道分泌物增多、白带异味、外阴或阴道黏膜充血肿胀溃疡等不适症状。此外,壳聚糖痔疮凝胶可用于改善内痔、外痔、混合痔及肛裂、肛瘘手术后引起的出血、疼痛、肛门坠胀等症状,促进痔核缩小,防止痔核脱垂和减轻痔黏膜充血水肿。壳聚糖漱口水可用于抑制口腔内细菌总数,改善口臭、口腔溃疡等口腔状况。目前,大部分商业化的抗菌、消炎、止血的产品仍使用未经改性的壳聚糖。其优点是成本低、生产工艺成熟、质量控制容易,但相比于抗生素、消炎类激素等药物,壳聚糖的抗菌、止血、消炎性能仍较弱。因此,在分子水平上对壳聚糖进行改性,提升其抗菌、止血、消炎等的能力,并保持其良好的生物相容性,将有望大幅提升相关产品的性能。
表 1. Standards of chitosan products.
壳聚糖产品相关国家级标准
| 标准编号 | 标准名称 | 发布部门 | 发布日期 | 实施日期 |
| SC/T 3403-2004 | 甲壳质与壳聚糖 | 中华人民共和国农业部 | 2005-01-04 | 2005-02-01 |
| SN/T 2162-2008 | 壳聚糖抗菌棉纺织品检验规程 | 国家质量监督检验检疫总局 | 2008-09-04 | 2009-03-16 |
| YY/T 0606.7-2008 | 组织工程医疗产品 第 7 部分:壳聚糖 | 国家药品监督管理局 | 2008-04-25 | 2009-06-01 |
| FZ/T 52012-2011 | 壳聚糖短纤维 | 中华人民共和国工业和信息化部 | 2011-05-18 | 2011-08-01 |
| FZ/T 72011-2011 | 壳聚糖纤维混纺针织面料 | 中华人民共和国工业和信息化部 | 2011-12-20 | 2012-07-01 |
| FZ/T 12038-2013 | 壳聚糖纤维与棉混纺本色纱线 | 中华人民共和国工业和信息化部 | 2013-07-22 | 2013-12-01 |
| GB 29941-2013 | 食品安全国家标准 食品添加剂 脱乙酰
甲壳素(壳聚糖) |
国家卫生和计划生育委员会 | 2013-11-29 | 2014-06-01 |
| FZ/T 01125-2014 | 纺织品 定量化学分析壳聚糖纤维与某些
其他纤维的混合物(胶体滴定法) |
中华人民共和国工业和信息化部 | 2014-12-24 | 2015-06-01 |
| YY 0953-2015 | 医用羧甲基壳聚糖 | 国家食品药品监督管理总局 | 2015-03-02 | 2017-01-01 |
图 2.
Application of commercial chitosan-based medical products in China
我国商业化壳聚糖医用产品的应用
1.2. 壳聚糖及其衍生物在药物输送上的应用
药物输送是指通过合适的给药方式或使用合适的载体,将目标药物以合适的浓度输送到预设部位。壳聚糖因具有黏膜黏附性、生物安全性、可降解性、易于化学改性等特点,是一类很好的药物输送载体。为了实现药物的高效输送,通常将壳聚糖制成微米或纳米级的颗粒,药物可以负载在颗粒的表面,也可以均匀地分散在颗粒中。壳聚糖优异的黏膜黏附性能够显著增加颗粒与黏膜的接触时间,提高药物的输送效率。目前,许多研究小组设计了多种基于壳聚糖颗粒的药物输送系统,成功负载了如双氯芬酸钠、氟脲嘧啶、顺铂、非洛地平等各类药物[7]。然而,影响壳聚糖颗粒药物输送效率的一个关键问题是负载药物的不可控突释。在壳聚糖载药颗粒表面再包覆一层功能涂层是解决负载药物不可控突释的一个常用手段,选择合适的涂层材料还可以同时增加药物装载效率,提高颗粒的稳定性甚至为载药颗粒提供病灶靶向性。近年来,我们以利用毛细管微流控技术制备得到的 O/W/O 复乳体系作为模板,以对苯二甲醛作为交联剂经界面交联反应成功制备得到单分散的 pH 响应型壳聚糖微囊,该微囊具有明显的 pH 突释响应特性[8]。在此基础上,利用微流控技术设计构建了以具有酸致分解的壳聚糖凝胶材料作为微囊囊壁以及内含油核的核-壳型微囊,油核同时负载游离药物和载药纳米颗粒,成功实现了“先突释后缓释”的梯级控释给药新模式,为更合理的药效发挥提供了新途径[9]。为了进一步提升载药量或者药物输送能力,壳聚糖衍生物作为药物载体的可能性也被广泛地研究。例如,使用 N-三甲基壳聚糖与聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA)制备的纳米粒子,胰岛素的负载量能达到 47%,并且能帮助胰岛素穿过口服给药所遇到的胃肠黏膜等多重阻碍[10]。羧甲基壳聚糖也是一种良好的药物载体,负载药物的释放曲线可以通过羧甲基的量以及环境 pH 值来调节[11]。
1.3. 壳聚糖及其衍生物在骨、神经等组织修复上的应用
壳聚糖本身具有良好的骨传导(osteoconductivity)性能,同时也是一种优异的细胞支架材料,易于加工成海绵、纤维、薄膜及其他各种复杂的形态,利于成骨细胞生长以及间充质干细胞(mesenchymal stem cells,MSCs)向成骨细胞分化[12]。为了克服壳聚糖材料骨诱导(osteoinductive)能力相对较弱的不足,可以在壳聚糖基材中引入其他具有较强骨诱导能力的材料。研究表明,将羟基磷灰石引入壳聚糖细胞支架中,不仅能提高支架的力学性能,还能显著增强支架的骨诱导能力,加速骨愈合[13-14]。我们将聚吡咯引入壳聚糖材料中,制备了二维的导电薄膜和三维的导电细胞支架。通过使用这种导电支架对骨细胞进行电刺激,发现电刺激能显著促进骨质沉积[15-17],为研发促进骨愈合的新型医用技术提供了思路。
壳聚糖衍生物在骨修复应用方面也展现了独有的特点。季铵盐壳聚糖具有良好的水溶性和抗菌性能,而且可以通过调节季铵基团的取代度来控制季铵盐壳聚糖的抗菌性能。季铵盐壳聚糖修饰的聚甲基丙烯酸甲酯骨水泥[18],以及表面富含装载有季铵盐壳聚糖纳米管的钛植入体[19],在体内体外实验中均展现了良好的骨细胞相容性和抗菌性能,在治疗感染性骨缺损方面具有良好的应用前景。羧甲基壳聚糖因为羧基的存在,与壳聚糖相比,不仅具有水溶性,更易于加工,而且更容易与羟基磷灰石形成复合物。此外羧甲基壳聚糖的物理化学性质与透明软骨中的细胞外蛋白多糖相似,能够通过抑制 NO 的产生来减少软骨细胞的炎症反应,具有治疗骨关节炎的潜力[19]。
神经修复的关键是桥接横断的神经组织之间的缺损,目前的金标准是神经自体移植。然而,自体移植需要从患者身体其他部位获取神经组织,存在对获取部位的破坏、供给量有限、需多次手术等不足。因此,开发具有神经修复功能的组织工程材料已成为一个研究热点。研究发现,壳聚糖及壳聚糖衍生物均对雪旺细胞具有良好的生物相容性[20-21],因而可以用于制备神经导管。然而,单纯使用壳聚糖,制备的导管脆性较大,难以进行手术植入。南通大学的顾晓松院士团队[22]制备了壳聚糖/聚乳酸神经导管,在临床上实现了 30 mm 长的正中神经缺损的修复。他们还使用附着有 MSC 的壳聚糖/聚(乳酸-羟基乙酸)共聚物的神经导管,修复了猴子 50 mm 长的正中神经缺陷[23]。首都医科大学李晓光团队[24]制备了负载有神经营养因子-3(neurotrophin-3)的壳聚糖基神经导管,并用其修复了大鼠 5 mm 长的胸部脊髓缺损。中国医科大学敖强教授团队[25-26]采用附着有自体 MSC 的壳聚糖可降解神经导管,在大鼠上实现了 12 mm 坐骨神经缺损的修复,之后以羊为模型成功修复了 30 mm 的腓神经缺损。
2. 海藻酸盐在生物医药领域的应用
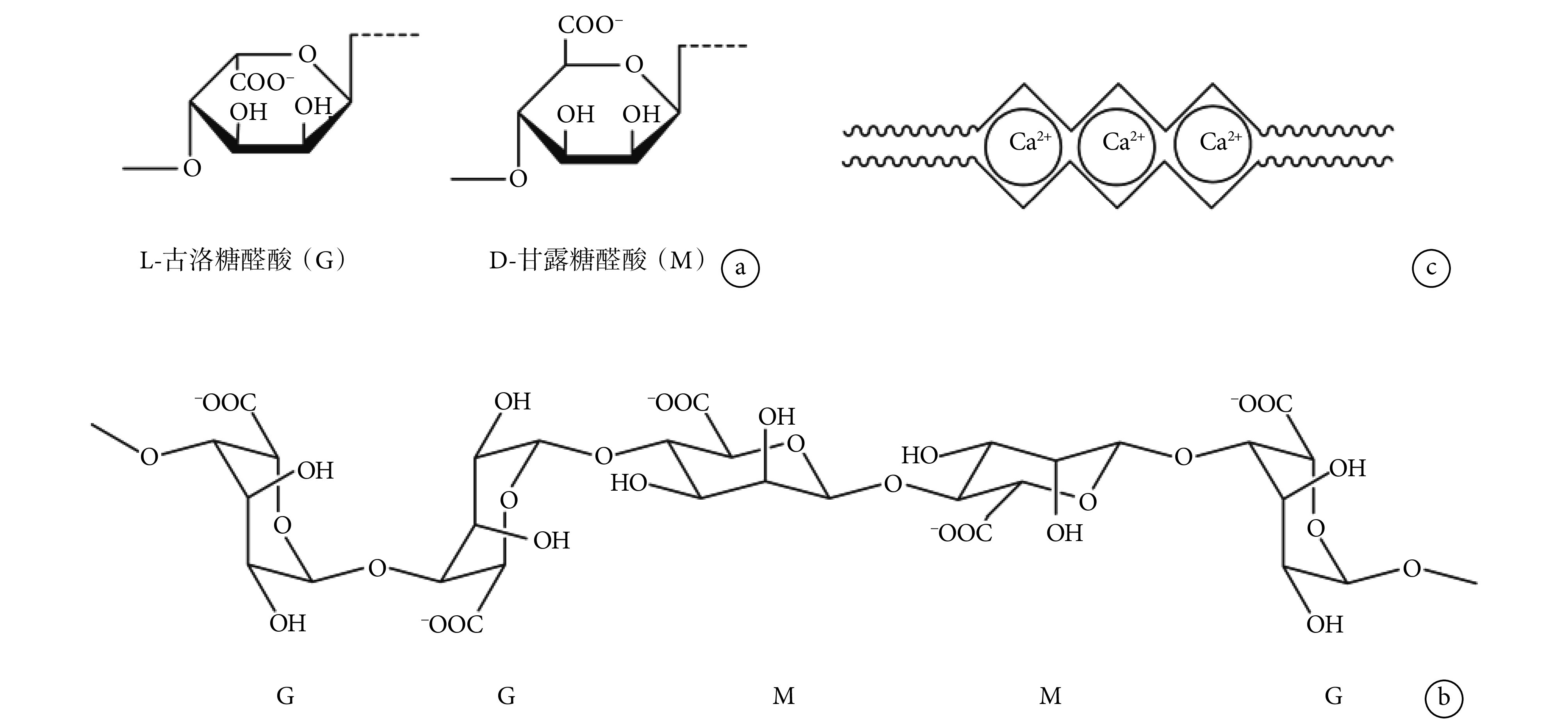
海藻酸盐是一种天然阴离子聚合物,主要提取自海洋中的褐藻,生物相容性良好、毒性低、成本相对较低,此外还能被多价离子如 Ca2+等温和地交联形成凝胶。海藻酸盐是以 L-古洛糖醛酸(G)和 D-甘露糖醛酸(M)为结构单元的共聚物(见图 3a),其链段可以是连续的 G 链段(GGGGG)和 M 链段(MMMMM),也可以是交替的 MGMG 链段(见图 3b)。目前认为,只有 G 单元会参与多价离子引起的海藻酸盐交联(见图 3c),因而 G 单元的含量、单元序列、链段长度等均会对海藻酸盐产品性能产生较大影响,增加 G 链段的长度能显著增强海藻酸盐水凝胶的力学性能。
图 3.
Chemical structure of alginates and scheme of Ca2+-crosslinked alginate
海藻酸盐化学结构及钙离子交联示意图
a. structures of G and M units; b. configurations of G and M units in alginate; c. schematic showing of Ca2+-crosslinked alginate
a. G 单元与 M 单元的结构式;b. 海藻酸钠分子中的 G 单元与 M 单元的构象;c. 钙离子交联海藻酸盐的示意图
2.1. 基于海藻酸盐的成熟商业化医用产品
迄今为止,国内已申请的海藻酸盐相关的专利已超过 1 300 项,已公布了 8 项海藻酸盐基生物材料相关行业标准(见表 2),国家食品药品监督管理总局批准的海藻酸盐基生物医用材料生产企业超过 20 家。已商业化的海藻酸盐医用产品主要用途是伤口敷料和齿科印模。海藻酸盐伤口敷料多采用离子(通常使用 Ca2+)交联海藻酸盐水溶液得到水凝胶,然后通过冷冻干燥得到多孔片状材料以及纤维状的无纺布。干燥状态下的海藻酸盐敷料吸收伤口流出液重新成为凝胶,不仅能为伤口提供生理润湿环境,降低感染概率,还能在一定程度上促进肉芽组织的形成,促进伤口重新上皮化。因此,海藻酸盐类敷料适用于处理有中重度渗透液的各级伤口。海藻酸盐齿模材料主要成分包括海藻酸盐、钙盐、滑石粉等,用水调和以后形成膏状物,可以用来塑型,随着时间的增加,材料的交联度增加,印模固化之后可灌注硬石膏。
表 2. Standards of alginate products.
海藻酸盐产品相关国家级标准
| 标准编号 | 标准名称 | 发布部门 | 发布日期 | 实施日期 |
| YY/T 0606.8-2008 | 组织工程医疗产品第 8 部分:海藻酸钠 | 国家食品药品监督管理局 | 2008-04-25 | 2009-06-01 |
| GB 29988-2013 | 食品安全国家标准食品添加剂海藻酸钾
(褐藻酸钾) |
国家卫生和计划生育委员会 | 2013-11-29 | 2014-06-01 |
| GB 1886.243-2016 | 食品安全国家标准食品添加剂海藻酸钠
(又名褐藻酸钠) |
国家卫生和计划生育委员会 | 2016-08-31 | 2017-01-01 |
| GB 1886.226-2016 | 食品安全国家标准食品添加剂海藻酸
丙二醇酯 |
国家卫生和计划生育委员会 | 2016-08-31 | 2017-01-01 |
| HG/T 5049-2016 | 含海藻酸尿素 | 中华人民共和国工业和信息化部 | 2016-10-22 | 2017-04-01 |
| HG/T 5050-2016 | 海藻酸类肥料 | 中华人民共和国工业和信息化部 | 2016-10-22 | 2017-04-01 |
| HG/T 5048~5050-2016 | 水溶性磷酸一铵、含海藻酸尿素和海藻
酸类肥料(2016)[合订本] |
中华人民共和国工业和信息化部 | 2016-10-22 | 2017-04-01 |
| YY/T 1574-2017 | 组织工程医疗器械产品海藻酸盐凝胶固
定或微囊化指南 |
国家食品药品监督管理总局 | 2017-08-18 | 2018-09-01 |
2.2. 基于海藻酸盐的在研新型医用材料及产品
2.2.1. 海藻酸盐在药物控释方面的应用
海藻酸盐凝胶是一种优异的药物载体,可以负载小分子、蛋白质等不同种类的药物。海藻酸盐凝胶可以与多种小分子药物形成包括共价键、氢键、离子键、配位键在内的多种强弱不一的相互作用,可以用来调控药物释放的速率,并且海藻酸盐凝胶具有纳米多孔结构(孔径约 5 nm),有利于小分子药物的扩散释放[27]。此外,还可以对海藻酸进行部分氧化,破坏糖醛酸单元上的顺式双醇之间的碳-碳键,增加海藻酸的降解能力以控制药物的释放速率。海藻酸盐还能与壳聚糖共混形成离子复合物作为药物载体,可以利用壳聚糖的黏膜黏附性在一定程度上实现药物靶向并提高药物的通透性。除了负载小分子药物,海藻酸盐凝胶还是蛋白质药物的良好载体,因为蛋白质药物可以在比较温和的条件下负载进海藻酸盐凝胶中,在释放之前水凝胶可以防止蛋白质的降解。一般来说,由于海藻酸盐水凝胶的亲水性与多孔性,蛋白质药物从水凝胶中的释放较快,通过改变海藻酸盐凝胶的交联方式、蛋白质与海藻酸盐之间的相互作用等方式能进行蛋白质药物释放的控制。最近,我们利用微流控技术制备了一系列基于海藻酸钙的中空纤维、胶囊膜、微球囊等不同形态的药物载体,在实现药物控释的基础上,还能兼具 pH 响应、温度响应等先进功能[28-30]。
2.2.2. 海藻酸盐在组织再生上的应用
海藻酸盐凝胶是一种优良的蛋白质和细胞载体,因而在组织与器官修复再生方面被广泛研究。对于通过细胞移植进行血管修复的研究来说,主要的困难来自于移植细胞的大规模死亡,植入细胞无法融入原有血管系统,以及难以引导宿主平滑肌细胞迁移以促进血管成熟等。精氨酸-甘氨酸-天冬氨酸(arginylglycylaspartic acid,RGD)多肽改性海藻酸钠凝胶在输送内皮祖细胞(endothelial progenitor cells)的同时还能负载相应的细胞生长因子,不仅能显著提升移植细胞的存活率,而且能诱导植入的内皮祖细胞的分化和引导宿主平滑肌细胞的迁移,因而在血管组织修复的应用上展示了良好的前景。海藻酸盐与具有肝素结合区(heparin-binding domain)的生长因子,如血管内皮生长因子(vascular endothelial growth factor,VEGF)之间有较强的相互作用,可以实现持续可控释放[31]。如果将没有肝素结合区的生长因子与 VEGF 同时负载入海藻酸盐凝胶中,因为前者与海藻酸盐的结合较弱,在初期会快速释放,而 VEGF 与海藻酸盐的作用较强,释放期比前者延迟,从而实现不同生长因子的顺序释放,利于血管组织再生[32]。
海藻酸盐水凝胶也是一种良好的骨修复材料,因为它具有一定的流动性,易于通过微创的方式植入体内,能修补不规则形状的缺陷,容易进行化学修饰,将黏附因子如 RGD 多肽引入水凝胶以提高细胞黏附性。动物实验表明使用海藻酸钠输送生长因子或者干细胞能显著修复临界骨缺损[33-34]。然而,海藻酸盐水凝胶的力学强度较低,不适用于在没有固定的情况下修复承重骨。为了增强力学强度,磷酸钙被引入到海藻酸盐水凝胶中[35],这种水凝胶可以在中等应力的环境中作为骨修复材料使用。低分子量(35 kD)的海藻酸盐可制备具有应力松弛和蠕变性能的黏弹性水凝胶,使用该水凝胶封装软骨细胞,能够促进软骨细胞形成相互连接的软骨基质,实现软骨细胞的三维培养,从而用于修复软骨缺损[36]。此外,利用微流控技术,可以实现在单个细胞尾部包裹一层几微米厚的海藻酸钠水凝胶,外层水凝胶不仅显著提高了细胞对流体剪切应力的抵抗,防止体内免疫系统对植入细胞进行清除,而且提高了外层水凝胶的模量,可以促进被包裹的鼠骨髓 MSC 向成骨细胞分化[37]。
2.2.3. 海藻酸盐在心衰治疗中的应用
海藻酸盐具有良好的生物相容性,且作为聚阴离子聚合物,具有一定的抗凝血性能。此外,海藻酸盐交联以后,其结构与细胞外基质类似,组织相容性优异。通过调控交联程度,能够得到具有流动性与力学性能可控的海藻酸钠水凝胶,其在心衰治疗上已展现了良好的应用前景。Jonathan Leor 团队[38]将 Ca2+交联的海藻酸钠水凝胶注射于梗死的猪心肌组织中以促进心肌修复,成功地实现了猪心肌梗死后的左心室重建。加州大学旧金山分校的 Randall Lee 教授团队[39]进一步在海藻酸钠上修饰了 RGD 多肽以提高内皮细胞的黏附与增殖,将这种多肽修饰的海藻酸钠经过 Ca2+交联后植入心肌梗死模型大鼠的心衰部位,可显著促进局部血管生成,增强左心室功能。杭州德诺科技有限公司目前与美国 LoneStar 公司合作开发的 Algisyl-LVR 可植入海藻酸钠抗心衰水凝胶产品已进入临床试验阶段,其控股的杭州琅达医疗科技有限公司独立开发的新一代海藻酸钠抗心衰水凝胶产品已进入医疗器械指定注册检验阶段。相信此类产品不久即可面市,进入临床应用。
2.2.4. 海藻酸盐在免疫治疗中的应用
实体癌通常的治疗方法是手术切除癌组织,但是对于某些癌症,例如黑色素瘤、宫颈癌和滑液细胞瘤等,直接切除是非常危险或者难以实现的。针对不适合手术切除的实体癌,过继细胞疗法(adoptive cell therapy)是一种有效的治疗手段。但是,传统的过继细胞疗法是直接将淋巴细胞注射在肿瘤组织中或肿瘤组织周围,淋巴细胞难以充分扩散至肿瘤组织中,并且在免疫抑制的肿瘤微环境中 T 细胞难以充分增殖,这些因素均会影响最终的治疗效果。为了提高过继细胞疗法中移植的淋巴细胞的抗癌作用,有报道采用海藻酸融合胶原蛋白纤维制备的介孔细胞支架作为淋巴细胞的运送及释放平台,能够有效地输送 T 细胞至肿瘤组织并促进 T 细胞的增殖,且动物实验结果表明在三周内就可清除小鼠体内的乳腺癌或卵巢癌组织[40-41]。此外,采用海藻酸制备的装载有树突状细胞的可注射水凝胶,注入小鼠体内后可迅速成胶,形成疫苗接种节点,同时吸引宿主的树突状细胞和大量的 T 细胞迁移至此节点,从而激活免疫反应以提高过继细胞疗法的效率[42]。
目前,最常用的海藻酸盐水凝胶都是通过离子交联制备的。离子交联的海藻酸盐水凝胶在生理环境中缺乏长期稳定性,凝胶会因交联离子与周围环境中一价离子的交换而溶解。这种现象对于生物医学应用既可以起到正面的作用,也可能出现负面的作用,取决于具体的产品。开发新型交联技术如共价交联、热致交联、细胞交联等,则有助于进一步扩展海藻酸盐水凝胶在生物医学上的应用。
3. 壳聚糖与海藻酸基医用材料发展瓶颈与挑战
经过多年的发展,海洋源生物医用材料行业的发展已初具规模,壳聚糖与海藻酸盐的制备与提纯已实现大规模工业化生产,对于其性质和功能的控制与衍生化工艺等已有较为深入的研究和积累。壳聚糖及其衍生物在快速止血、创伤敷料、痔疮凝胶等方面已有许多产品问世。我国在此领域已经具有相当强的研发实力。例如,中国海洋大学与青岛博益特生物材料有限公司开发的壳聚糖手术止血材料在止血能力、生物降解能力等方面已经处于世界领先水平;海藻酸钠水凝胶目前在伤口护理与牙科材料方面的研究成果也已经成功产业化。
尽管壳聚糖与海藻酸基医用材料目前发展势头良好,但仍存在以下瓶颈与挑战:① 目前壳聚糖及海藻酸盐的生产工艺仍需进一步改进。目前的生产工艺得到的壳聚糖与海藻酸盐产品,其品质严重依赖于初始生产原料。例如,不同种类的虾蟹制备的壳聚糖品质差别巨大,从不同海藻中提取的海藻酸钠 G 含量可相差几倍。原材料的限制严重制约了医用级壳聚糖与海藻酸盐的产量。此外,目前的工艺涉及大量清洗步骤,耗水严重。开发可工业化生产的壳聚糖与海藻酸盐的新型生物合成工艺特别是酶催化工艺,将可能突破此技术瓶颈。② 基于壳聚糖和海藻酸盐的医用产品产业化进程明显滞后于基础研究。在基础研究方面,基于壳聚糖与海藻酸盐的骨组织修复材料、神经导管、长效药物靶向与控释体系等,已取得了一定的阶段性成果。下一阶段相关的科研院所、企业与医院应强化合作,对产业化前景好的成果,尽快开展科学、系统的临床前研究和临床试验,产学研医全链条结合,加速成果的产业化。
4. 结论
壳聚糖与海藻酸基医用材料是海洋源生物材料中开发利用最多的两种材料,目前在生物医用领域已经开始展现出独特的优势。壳聚糖因其杀菌、止血、促进伤口愈合的功能在快速止血、防止伤口感染、妇科炎症处理等方面已有广泛应用。海藻酸盐因其生物相容性、交联条件温和等性能也已应用在伤口敷料与牙科造模等方面。尽管海洋源壳聚糖与海藻酸盐作为生物材料已经展现出良好的前景,但其生产工艺仍需进一步优化改进,并且在药物控释与组织工程方面的产业化应用还面临较大的挑战。
Funding Statement
中央高校基本科研业务费专项资助(YJ201626);四川大学专职博士后研发基金(2018SCU12056)
References
- 1.顾其胜, 位晓娟 我国海洋生物医用材料研究现状和发展趋势. 中国材料进展. 2011;30(4):11–15, 29. [Google Scholar]
- 2.He Guanghua, Chen Xiang, Yin Yihua, et al Preparation and antibacterial properties of O-carboxymethyl chitosan/lincomycin hydrogels . J Biomater Sci Polym Ed. 2016;27(4):370–384. doi: 10.1080/09205063.2015.1132616. [DOI] [PubMed] [Google Scholar]
- 3.Yin Tingjie, Zhang Ying, Liu Yanhong, et al The efficiency and mechanism of N-octyl-O, N-carboxymethyl chitosan-based micelles to enhance the oral absorption of silybin . Int J Pharm. 2018;536(1):231–240. doi: 10.1016/j.ijpharm.2017.11.034. [DOI] [PubMed] [Google Scholar]
- 4.Follmann H D M, Martins A F, Nobre T M, et al Extent of shielding by counterions determines the bactericidal activity of N, N, N-trimethyl chitosan salts . Carbohydr Polym. 2016;137:418–425. doi: 10.1016/j.carbpol.2015.10.083. [DOI] [PubMed] [Google Scholar]
- 5.de Britto D, Assis O B G A novel method for obtaining a quaternary salt of chitosan. Carbohydr Polym. 2007;69(2):305–310. doi: 10.1016/j.carbpol.2006.10.007. [DOI] [Google Scholar]
- 6.Kulkarni A D, Patel H M, Surana S J, et al N, N, N-Trimethyl chitosan: An advanced polymer with myriad of opportunities in nanomedicine . Carbohydr Polym. 2017;157:875–902. doi: 10.1016/j.carbpol.2016.10.041. [DOI] [PubMed] [Google Scholar]
- 7.Ahmed T A, Aljaeid B M Preparation, characterization, and potential application of chitosan, chitosan derivatives, and chitosan metal nanoparticles in pharmaceutical drug delivery. Drug Des Devel Ther. 2016;10:483–507. doi: 10.2147/DDDT.S99651. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Liu Li, Yang Jianping, Ju Xiaojie, et al Monodisperse core-shell chitosan microcapsules for pH-responsive burst release of hydrophobic drugs. Soft Matter. 2011;7(10):4821–4827. doi: 10.1039/c0sm01393e. [DOI] [Google Scholar]
- 9.Yang Xiulan, Ju Xiaojie, Mu Xiaoting, et al Core-shell chitosan microcapsules for programmed sequential drug release. ACS Appl Mater Interfaces. 2016;8(16):10524–10534. doi: 10.1021/acsami.6b01277. [DOI] [PubMed] [Google Scholar]
- 10.Sheng Jianyong, Han Limei, Qin Jing, et al N-trimethyl chitosan chloride-coated PLGA nanoparticles overcoming multiple barriers to oral insulin absorption . ACS Appl Mater Interfaces. 2015;7(28):15430–15441. doi: 10.1021/acsami.5b03555. [DOI] [PubMed] [Google Scholar]
- 11.Fonseca-Santos B, Chorilli M An overview of carboxymethyl derivatives of chitosan: Their use as biomaterials and drug delivery systems. Mater Sci Eng C Mater Biol Appl. 2017;77:1349–1362. doi: 10.1016/j.msec.2017.03.198. [DOI] [PubMed] [Google Scholar]
- 12.Logithkumar R, Keshavnarayan A, Dhivya S, et al A review of chitosan and its derivatives in bone tissue engineering. Carbohydr Polym. 2016;151:172–188. doi: 10.1016/j.carbpol.2016.05.049. [DOI] [PubMed] [Google Scholar]
- 13.Abueva C D G, Jang D W, Padalhin A, et al Phosphonate-chitosan functionalization of a multi-channel hydroxyapatite scaffold for interfacial implant-bone tissue integration. J Mater Chem B. 2017;5(6):1293–1301. doi: 10.1039/C6TB03228A. [DOI] [PubMed] [Google Scholar]
- 14.Huang Yixing, Zhang Xiaolei, Wu Aimin, et al An injectable nano-hydroxyapatite (n-HA)/glycol chitosan (G-CS)/hyaluronic acid (HyA) composite hydrogel for bone tissue engineering. RSC Adv. 2016;6(40):33529–33536. doi: 10.1039/C5RA26160K. [DOI] [Google Scholar]
- 15.Zhang Jieyu, Neoh K G, Kang Entang Electrical stimulation of adipose-derived mesenchymal stem cells and endothelial cells co-cultured in a conductive scaffold for potential orthopaedic applications. J Tissue Eng Regen Med. 2018;12(4):878–889. doi: 10.1002/term.v12.4. [DOI] [PubMed] [Google Scholar]
- 16.Zhang Jieyu, Li Min, Kang Entang, et al Electrical stimulation of adipose-derived mesenchymal stem cells in conductive scaffolds and the roles of voltage-gated ion channels. Acta Biomater. 2016;32:46–56. doi: 10.1016/j.actbio.2015.12.024. [DOI] [PubMed] [Google Scholar]
- 17.Zhang Jieyu, Neoh K G, Hu Xuefeng, et al Combined effects of direct current stimulation and immobilized BMP-2 for enhancement of osteogenesis. Biotechnol Bioeng. 2013;110(5):1466–1475. doi: 10.1002/bit.v110.5. [DOI] [PubMed] [Google Scholar]
- 18.Yang Ying, Yang Shengbing, Wang Yugang, et al Anti-infective efficacy, cytocompatibility and biocompatibility of a 3D-printed osteoconductive composite scaffold functionalized with quaternized chitosan. Acta Biomater. 2016;46:112–128. doi: 10.1016/j.actbio.2016.09.035. [DOI] [PubMed] [Google Scholar]
- 19.Yang Ying, Ao Haiyong, Wang Yugang, et al Cytocompatibility with osteogenic cells and enhanced in vivo anti-infection potential of quaternized chitosan-loaded titania nanotubes . Bone research. 2016;4:16027. doi: 10.1038/boneres.2016.27. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Gnavi S, Fornasari B E, Tonda-Turo C, et al In vitro evaluation of gelatin and chitosan electrospun fibres as an artificial guide in peripheral nerve repair: a comparative study . J Tissue Eng Regen Med. 2018;12(2):e679–e694. doi: 10.1002/term.v12.2. [DOI] [PubMed] [Google Scholar]
- 21.He Bin, Wu Fei, Fan Li, et al Carboxymethylated chitosan protects Schwann cells against hydrogen peroxide-induced apoptosis by inhibiting oxidative stress and mitochondria dependent pathway. Eur J Pharmacol. 2018;825:48–56. doi: 10.1016/j.ejphar.2018.02.024. [DOI] [PubMed] [Google Scholar]
- 22.Gu Jianhui, Hu Wen, Deng Aidong, et al Surgical repair of a 30 mm long human median nerve defect in the distal forearm by implantation of a chitosan-PGA nerve guidance conduit. J Tissue Eng Regen Med. 2012;6(2):163–168. doi: 10.1002/term.v6.2. [DOI] [PubMed] [Google Scholar]
- 23.Hu Nan, Wu Hong, Xue Chengbin, et al Long-term outcome of the repair of 50 mm long median nerve defects in rhesus monkeys with marrow mesenchymal stem cells-containing, chitosan-based tissue engineered nerve grafts. Biomaterials. 2013;34(1):100–111. doi: 10.1016/j.biomaterials.2012.09.020. [DOI] [PubMed] [Google Scholar]
- 24.Yang Zhaoyang, Zhang Aifeng, Duan Hongmei, et al NT3-chitosan elicits robust endogenous neurogenesis to enable functional recovery after spinal cord injury. Proc Natl Acad Sci U S A. 2015;112(43):13354–13359. doi: 10.1073/pnas.1510194112. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Ao Qiang, Fung C K, Tsui A Y, et al The regeneration of transected sciatic nerves of adult rats using chitosan nerve conduits seeded with bone marrow stromal cell-derived Schwann cells. Biomaterials. 2011;32(3):787–796. doi: 10.1016/j.biomaterials.2010.09.046. [DOI] [PubMed] [Google Scholar]
- 26.Muheremu A, Chen L, Wang X, et al Chitosan nerve conduits seeded with autologous bone marrow mononuclear cells for 30 mm goat peroneal nerve defect. Sci Rep. 2017;7:44002. doi: 10.1038/srep44002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Lopes M, Abrahim B, Veiga F, et al Preparation methods and applications behind alginate-based particles. Expert Opin Drug Deliv. 2017;14(6):769–782. doi: 10.1080/17425247.2016.1214564. [DOI] [PubMed] [Google Scholar]
- 28.He Xiaoheng, Wang Wei, Liu Yingmei, et al Microfluidic fabrication of bio-inspired microfibers with controllable magnetic spindle-knots for 3D assembly and water collection. ACS Appl Mater Interfaces. 2015;7(31):17471–17481. doi: 10.1021/acsami.5b05075. [DOI] [PubMed] [Google Scholar]
- 29.Mei Li, He Fan, Zhou Rongqing, et al Novel intestinal-targeted Ca-alginate-based carrier for pH-responsive protection and release of lactic acid bacteria. ACS Appl Mater Interfaces. 2014;6(8):5962–5970. doi: 10.1021/am501011j. [DOI] [PubMed] [Google Scholar]
- 30.Wu Fang, Wang Wei, Liu Li, et al Monodisperse hybrid microcapsules with an ultrathin shell of submicron thickness for rapid enzyme reactions. J Mater Chem B. 2015;3(5):796–803. doi: 10.1039/C4TB01803F. [DOI] [PubMed] [Google Scholar]
- 31.Marchioli G, Luca A D, de Koning E, et al Hybrid polycaprolactone/alginate scaffolds functionalized with VEGF to promote de Novo vessel formation for the transplantation of islets of langerhans. Adv Healthc Mater. 2016;5(13):1606–1616. doi: 10.1002/adhm.v5.13. [DOI] [PubMed] [Google Scholar]
- 32.Bai Yan, Bai Lijuan, Zhou Jing, et al Sequential delivery of VEGF, FGF-2 and PDGF from the polymeric system enhance HUVECs angiogenesis in vitro and CAM angiogenesis . Cell Immunol. 2018;323:19–32. doi: 10.1016/j.cellimm.2017.10.008. [DOI] [PubMed] [Google Scholar]
- 33.Saltz A, Kandalam U Mesenchymal stem cells and alginate microcarriers for craniofacial bone tissue engineering: A review. J Biomed Mater Res A. 2016;104(5):1276–1284. doi: 10.1002/jbm.a.v104.5. [DOI] [PubMed] [Google Scholar]
- 34.Bayer E A, Jordan J, Roy A, et al Programmed platelet-derived growth factor-BB and bone morphogenetic protein-2 delivery from a hybrid calcium phosphate/alginate scaffold. Tissue Eng Part A. 2017;23(23/24):1382–1393. doi: 10.1089/ten.tea.2017.0027. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Bendtsen S T, Quinnell S P, Wei Mei Development of a novel alginate-polyvinyl alcohol-hydroxyapatite hydrogel for 3D bioprinting bone tissue engineered scaffolds. J Biomed Mater Res A. 2017;105(5):1457–1468. doi: 10.1002/jbm.a.36036. [DOI] [PubMed] [Google Scholar]
- 36.Lee H P, Gu L, Mooney D J, et al Mechanical confinement regulates cartilage matrix formation by chondrocytes. Nat Mater. 2017;16:1243. doi: 10.1038/nmat4993. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Mao A S, Shin J W, Utech S, et al Deterministic encapsulation of single cells in thin tunable microgels for niche modelling and therapeutic delivery. Nat Mater. 2016;16:236. doi: 10.1038/nmat4781. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Leor J, Tuvia S, Guetta V, et al Intracoronary injection of in situ forming alginate hydrogel reverses left ventricular remodeling after myocardial infarction in swine. J Am Coll Cardiol. 2009;54(11):1014–1023. doi: 10.1016/j.jacc.2009.06.010. [DOI] [PubMed] [Google Scholar]
- 39.Yu J, Gu Yiping, Du K T, et al The effect of injected RGD modified alginate on angiogenesis and left ventricular function in a chronic rat infarct model. Biomaterials. 2009;30(5):751–756. doi: 10.1016/j.biomaterials.2008.09.059. [DOI] [PubMed] [Google Scholar]
- 40.Smith T T, Moffett H F, Stephan S B, et al , Biopolymers co-delivering engineered T cells and sting agonists can eliminate heterogeneous tumors. J Clin Invest 2017;127(6):2176–2191. doi: 10.1172/JCI87624. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Stephan S B, Taber A M, Jileaeva I, et al Biopolymer implants enhance the efficacy of adoptive T-cell therapy. Nat Biotechnol. 2015;33(1):97–101. doi: 10.1038/nbt.3104. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Hori Y, Winans A M, Huang C C, et al Injectable dendritic cell-carrying alginate gels for immunization and immunotherapy. Biomaterials. 2008;29(27):3671–3682. doi: 10.1016/j.biomaterials.2008.05.033. [DOI] [PubMed] [Google Scholar]