Abstract
运用表面引发原子转移自由基聚合反应(SI-ATRP)在玻璃表面构建甲基丙烯酸聚乙二醇酯(PEGMA)-甲基丙烯酸缩水甘油酯(GMA)的二元嵌段共聚物(PEGMA-GMA),然后利用 GMA 中丰富的环氧基团将内皮细胞选择性多肽精氨酸-谷氨酸-天冬氨酸-缬氨酸(REDV)通过开环反应固定在 PEGMA-GMA 聚合物刷的末端。采用静态水接触角、X 射线光电子能谱(XPS)以及原子力显微镜(AFM)等对聚合物刷的结构和亲水性能进行了表征,结果证明在玻璃基材表面成功构建了 REDV 多肽修饰的二元嵌段共聚物刷;同时利用紫外-可见吸收光谱(UV-Vis)对表面固定的 REDV 进行了定量表征。最后采用复钙化凝血时间和血小板黏附实验对涂层的血液相容性进行表征,结果显示聚合物涂层具有良好的血液相容性。这种修饰多肽的聚乙二醇生物活性涂层为后续表面内皮化研究奠定了良好的前期基础。
Keywords: 表面原子转移自由基聚合, 甲基丙烯酸聚乙二醇酯, 甲基丙烯酸缩水甘油酯, 活性涂层
Abstract
A diblock copolymer, poly(ethylene glycol) methacrylate-block-glycidyl methacrylate (PEGMA-GMA), was prepared on glass substrate by surface-initiated atom transfer radical polymerization (SI-ATRP), and endothelial specific peptide Arg-Glu-Asp-Val (REDV) was immobilized at the end of the PEGMA-GMA polymer brush by ring opening reaction through the rich epoxy groups in the GMA. The structure and hydrophilicity of the polymer brushes were characterized by static water contact angle, X-ray photoelectron spectroscopy (XPS) and atomic force microscopy (AFM). The results showed that the REDV modified copolymer brushes were successfully constructed on the glass substrates. The REDV peptide immobilized onto surface was quantitatively characterized by ultraviolet–visible spectroscopy (UV-VIS). The blood compatibility of the coating was characterized by recalcification time and platelet adhesion assay. The results showed that the polymer coating had good blood compatibility. The multifunctional active polymer coating with PEGMA and peptide produced an excellent prospect in surface construction with endothelial cells selectivity.
Keywords: surface-initiated atom transfer radical polymerization, poly(ethylene glycol) methacrylate, glycidyl methacrylate, active polymer coating
引言
药物洗脱支架是目前介入治疗心血管疾病最主要的手段,而由于药物释放带来的血管内皮延迟愈合,以及继而引发的晚期血栓等不良事件,是限制心血管支架临床应用的主要问题[1-3]。因此,材料表面的内皮化程度是影响生物材料体内应用的重要因素。采用一定手段对材料表面进行修饰改性,特异性固定可以促进内皮细胞黏附的生物分子,以此增强惰性材料表面的内皮细胞选择性以及促进表面内皮化程度,是解决支架现有晚期血栓、再狭窄等不良问题的有效手段之一[4-7]。
在功能性材料的制备中,材料表面的改性是一项重要的研究内容。前期研究中,我们采用表面涂覆方法构建了多肽修饰的内皮细胞选择涂层[7],并比较了不同多肽接枝后表面的内皮化效果[8]。该方法涂覆方便,但存在接枝密度不可控以及结合力不牢固的问题。为了克服这些问题,在本研究中,我们拟采用表面引发的原子转移自由基聚合方法(surface-initiated atom transfer radical polymerization,SI-ATRP)在玻璃基材表面构建多肽修饰的生物活性涂层。SI-ATRP 为近年来发展起来的一种新技术[9]。尤其在生物材料领域,该技术能够在生物材料表面形成一层结构致密的聚合物分子刷(polymer brush),改善涂层黏附力,从而改变材料表面的固有性质,构建良好的生物抗污表面[10-11]。聚乙二醇类材料(poly(ethylene glycol),PEG)因其优异的抗蛋白质、血小板等非特异性阻抗性能,广泛用于心血管植入材料的表面改性[12-15]。此外,甲基丙烯酸缩水甘油酯(glycidyl methacrylate,GMA)侧链含有大量的环氧基团,能够通过开环反应特异性固定生物活性分子[16-18]。惰性材料和活性分子的协同作用可以有效实现材料表面特定生物分子的特异性吸附。在现有表面固定生物活性分子的研究中,多肽精氨酸-谷氨酸-天冬氨酸-缬氨酸(Arg-Glu-Asp-Val,REDV)可被主要在内皮细胞膜中表达的整合素 α4β1 特异性识别,而不引起平滑肌细胞的增殖。Plouffe 等[19]在微流道表面固定 REDV 后发现,内皮细胞、平滑肌细胞和成纤维细胞混合液通过微流道表面时能够实现混合体系中内皮细胞的选择性黏附,再结合 PEG 对平滑肌细胞的非选择性抑制,二者协同作用构建的涂层可以有效阻抗表面平滑肌细胞非特异性黏附,同时促进内皮细胞的选择性生长和迁移,且不同的接枝密度可以调控内皮细胞和平滑肌细胞在表面的增殖量和增殖比例[20]。
基于此,本文在前期研究的基础上,探索采用 SI-ATRP 技术取代原有的表面涂覆方法,在玻璃基材表面构建甲基丙烯酸聚乙二醇酯和甲基丙烯酸缩水甘油酯(poly(ethylene glycol) methacrylate-block-glycidyl methacrylate,PEGMA-GMA)的双嵌段共聚物刷,并利用 GMA 侧链的环氧基团开环固定具有内皮细胞选择性的 REDV 活性多肽,从而在基材表面形成致密牢固的多肽修饰生物活性涂层。通过不同表征手段对表面结构、形貌和 REDV 接枝量进行了表征,并对涂层的血液相容性进行了研究。
1. 实验
1.1. 材料与试剂
PEGMA(分子量 950)、GMA、3-氨基丙基三乙氧基硅烷(APTES)、2-溴异丁酰溴(BIBB)、2,2’-联吡啶(Bpy)、溴化亚铜(CuBr)均购自 Aldrich 公司(美国),甲醇、二氯甲烷等有机试剂购自阿拉丁试剂(上海)有限公司。以上试剂均为分析纯。REDV 购自吉尔生化(上海)有限公司。
1.2. 玻璃表面 SI-ATRP 引发剂制备
载玻片切割成 1 cm × 1 cm 大小,用“Piranha”溶液(96% H2SO4∶30% H2O2 = 7∶3,V/V)浸泡清洗 10 min 后,超声洗涤真空干燥备用。将清洗后的玻璃片浸入含有 APTES 的无水甲苯溶液中,在氮气保护下反应过夜,分别用甲苯、丙酮超声洗涤真空干燥,得到富含氨基的表面。将偶联剂改性后的玻璃放入已滴加 α-溴代异丁酰溴和三乙胺的二氯甲烷溶液中,避光室温反应 12 h,依次用甲苯、丙酮-水混合液和丙酮超声洗涤,真空干燥,获得玻璃片 SI-ATRP 引发剂。如图 1 所示。
图 1.

Formation of the ATRP initiator layer on glass substrate
玻璃表面引发剂合成路线
1.3. PEGMA-GMA 聚合物刷的制备
将固定引发剂的玻璃片和 PEGMA、超纯水、甲醇、Bpy、CuBr 配制成的反应溶液一起加入到真空除氧的反应装置内,室温聚合 12 h,之后将玻璃片清洗并用氮气吹干,得到 PEGMA 修饰的表面(G-PEGMA)。 将超纯水、甲醇、GMA、CuBr 和 Bpy 配制成反应液,除去氧气后加入到装有 G-PEGMA 的反应装置中,氮气保护下反应过夜,清洗氮气吹干后真空干燥保存。反应过程如图 2 所示。
图 2.
Synthesis procedure of PEGMA-GMA copolymer brushes on glass substrate
玻璃表面 PEGMA-GMA 聚合物刷合成过程
1.4. REDV 活性分子的表面固定
REDV 与 GMA 聚合物刷末端的环氧基团可以发生开环反应,具体反应过程如下:将 G-PEGMA-GMA 样品浸入 20 μg/mL 的 REDV 多肽 PBS 溶液中(pH = 7.5),室温反应 24 h,随后放入赖氨酸溶液中 6 h,以消除没有与多肽反应的环氧基团,蒸馏水清洗,氮气吹干。
1.5. 材料表面表征
表面化学结构组成采用 X 射线光电子能谱(X-ray photoelectron spectroscopy,XPS,AXIS-HSi,岛津,日本)进行测试,表面形貌采用原子力显微镜(atomic force microscope,AFM,MultiMode8,布鲁克,德国)测定,静态水接触角采用自动水接触角仪(SL200C,科诺,美国)进行测量,REDV 的接枝量由紫外-可见分光光度仪(ultraviolet–visible spectroscopy,UV-VIS,UV-2450,岛津,日本)表征。
1.6. 血液相容性表征[21]
1.6.1. 复钙化凝血时间测试
将已预热至 37℃ 的人体抗凝血浆(已除 Ca2+)100 μL 和生理盐水 100 μL 依次加入到内表面已修饰聚合物刷的硅化玻璃管中,将试管静置于 37℃ 恒温水浴中 60 s 后,加入 100 μL 已预热的 0.025 mol/L CaCl2 溶液,开始计时。将自制不锈钢钩针在玻璃管中缓慢搅动,直至不锈钢钩针开始出现丝状纤维蛋白,停止计时,此时间即复钙化凝血时间。并以空白玻璃管和 PEGMA 修饰的惰性玻璃管作为参照,每种样品平行测定 6 次,取其平均值即样品的最终复钙化时间。采用 origin8.5 软件对实验数据进行统计学分析,采用平均值 ± 标准差表示实验结果。组间比较采用 t 检验,当 P < 0.05 时视为差异有统计学意义。
1.6.2. 血小板黏附
取现抽 10 mL 新鲜抗凝全血于离心管中,离心(1 000 r/min)10 min,得上层清液即为富血小板血浆(platelet rich plasma,PRP)。将玻璃裸材与经相应修饰后的材料分别置于洁净滤纸上,用微量进样器移取 20 μL PRP 于玻璃裸材和经相应修饰后的材料,并与修饰后的材料接触 30 min,然后用 PBS 缓冲液(pH7.4)小心清洗表面以除去黏附不牢的血小板。将玻璃裸材与经相应修饰后的材料分别浸入 1% 戊二醛固定液中固定 30 min,然后用纯水清洗表面 3 次,再依次用 10%、30%、50%、70%、90%、100%(V/V)乙醇/水梯度溶液浸洗,使黏附的血小板脱水。自然干燥后置于干燥器中保存。使用场发射扫描电子显微镜对玻璃裸材与经相应修饰后的材料表面黏附的血小板形貌进行表征。
2. 结果与讨论
2.1. 表面化学组成分析
图 3 给出了玻璃基材表面以及经过不同接枝反应后的表面结构组成的 XPS 表征结果。由于玻璃本身成分复杂,可以看出未改性的玻璃基材表面(G-OH)有较多杂峰,其中 103 eV 和 155 eV 分别属于 Si2p 和 Si2s 元素。修饰 APTES 后,玻璃表面的谱图中出现了氮元素的 N1s(400 eV)特征峰,证明玻璃基材表面成功修饰上了氨基基团(G-NH2)。当表面进一步固定 BIBB 引发剂后,谱图中出现了溴元素(68 eV,Br3d)的特征峰,证明引发剂已成功接枝在玻璃表面(G-Br)。继续修饰 PEGMA 聚合物(G-PEGMA)和 GMA 聚合物(G-PEGMA-GMA)后,表面基本被聚合物刷所覆盖,氮元素和硅元素的特征峰大大减小;在聚合物刷末端开环固定 REDV 活性分子后(G-PEGMA-GMA-REDV),由于多肽中的氨基存在,使得表面又出现了 N1s(400 eV)的特征峰,表明 REDV 多肽已成功接枝到基材表面。
图 3.

XPS spectra of different surfaces
玻璃表面 XPS 结构表征
2.2. 表面接触角分析
表面引发接枝反应过程中,接触角随着表面组分的不同而发生变化。表 1 列出了玻璃表面各步反应后接触角的变化过程。玻璃表面经“Piranha”溶液处理后,表面富含亲水性的羟基,静态接触角为 42.8°,接枝 APTES 和 BIBB 后,表面疏水性增强[22],接触角数据分别增加至 71.1°和 79.3°。接枝 PEGMA 聚合物刷后,由于 PEGMA 的亲水性,接触角降到 63.4°;二次引发 GMA 聚合后,水接触角增至 74.6°;亲水性多肽 REDV 修饰到表面以后亲水性又明显增强,并伴随产生了羟基[23],因此表面接触角降至 55.1°。以上各表面的亲水程度反映了不同接枝过程后基材表面结构组成的变化,进一步证明了聚合物刷的成功构建。
表 1. Water contact angles of different surfaces.
各步接枝表面接触角数值
| 表面 | 接触角/(°) |
| G-OH | 42.8 ± 1.2 |
| G-NH2 | 71.1 ± 2.2 |
| G-Br | 79.3 ± 1.1 |
| G-PEGMA | 63.4 ± 1.0 |
| G-PEGMA-GMA | 74.6 ± 0.9 |
| G-PEGMA-GMA-REDV | 55.1 ± 1.6 |
2.3. 表面形貌表征
利用原子力显微镜对玻璃基材接枝前后的表面形貌进行了表征,结果如图 4 所示。图中分别为 G-OH、G-PEGMA、G-PEGMA-GMA 和 G-PEGMA-GMA-REDV 的二维相结构图(上)和三维表面形貌图(下)。其中玻璃基材表面比较光滑均匀,其三维图也较为平整,表面粗糙度参数为 0.7 nm。表面接枝 PEGMA 聚合物刷以后,与未修饰的 G-OH 表面相比,粗糙度增大,相结构图呈现明显相分离,三维相结构也出现山峰状凸起,表面粗糙度增至 1.4 nm;接枝 GMA 后,相结构图和表面形貌起伏程度进一步增加,表面粗糙度也随之增加到 1.8 nm;接枝 REDV 多肽后,三维结构山峰状凸起变高且变得更多,粗糙度增大到 2.1 nm,侧面证明 G-PEGMA-GMA-REDV 聚合物刷的成功构建。
图 4.

AFM phase (top) and height (below) images of different surfaces
各步接枝表面相图(上)与三维形貌图(下)
2.4. 表面活性分子的定量表征
REDV 多肽中含有丰富的氨基,可与 GMA 聚合物刷末端的环氧基团发生开环反应,从而实现生物活性多肽分子的表面固定。由于多肽在紫外-可见分光光度计下有紫外吸收,因此,在紫外吸收 280 nm 左右计算 PBS 溶液在样品进入前后的吸收曲线差值,即可得到玻璃基材表面 REDV 多肽的接枝量。根据玻璃基材面积可以得出最终表面接枝量为(16 ± 1.3)ng/cm2。
2.5. 血液相容性表征
2.5.1. 复钙化凝血时间结果表征
采用空白的硅化玻璃试管和惰性的 PEGMA 涂层修饰的玻璃试管作为参照,测定了固定 PEGMA-GMA-REDV 涂层的玻璃试管内表面的复钙化凝血时间,其结果见图 5。由图中可见,空白玻璃试管的复钙化时间为(297 ± 15)s,而 PEGMA 修饰的涂层复钙化凝血时间为(352 ± 28)s,固定 REDV 多肽的仿生涂层表面的复钙化凝血时间为(341 ± 19)s。PEGMA 基团的引入能够使复钙化凝血时间增加,提高聚合物刷的血液相容性。
图 5.
Columnar scheme of plasma recalcification time (PRT) (* compared to glass control group,P < 0.05)
血液复钙化时间测试结果(* 与玻璃对照组比较,P < 0.05)
2.5.2. 血小板黏附结果表征
为进一步表征嵌段共聚物涂层的亲水性和血液相容性,采用扫描电镜对 PEGMA-GMA-REDV 嵌段共聚物涂层的血小板黏附情况进行了表征,并以空白玻璃片和 PEGMA 聚合物修饰的玻璃片作为参照,结果如图 6 所示。由图可见,对照样品空白玻璃片表面与血液接触后,黏附了大量活化的血小板以及大块的纤维状物质;而在 PEGMA 聚合物涂层和 PEGMA-GMA-REDV 嵌段共聚物涂层表面,仅仅存在一些未被激活的血小板,且血小板的数量很少,远远低于空白样品,表明 PEGMA 具有良好的亲水抗污效果,该嵌段共聚物涂层具有良好的抗血小板黏附性质。PEGMA 的引入是改善材料表面血液相容性的关键因素。
图 6.
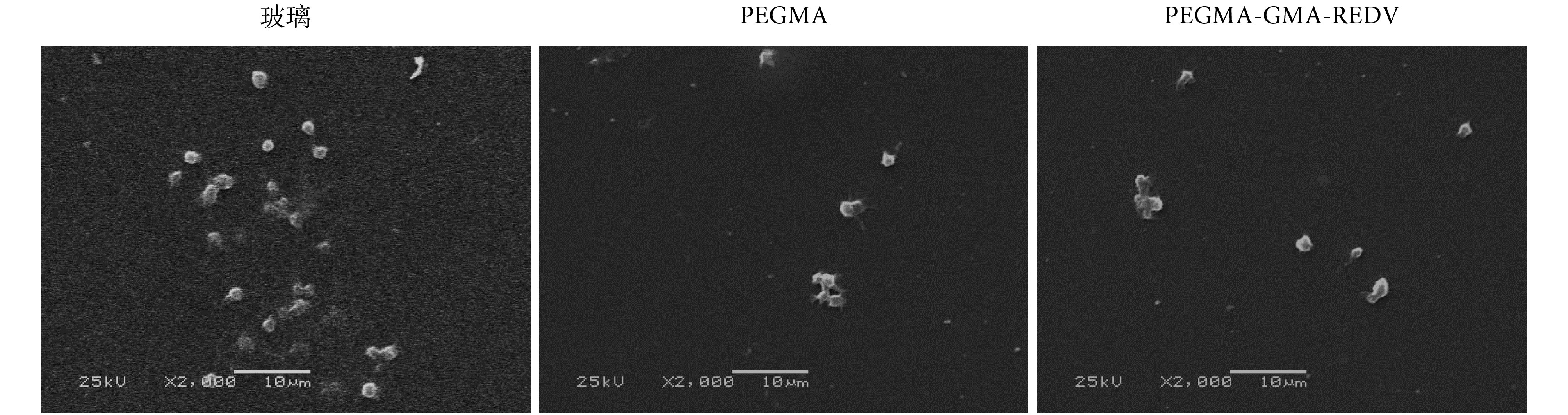
Typical images of platelet adhesion
血小板黏附结果
3. 结论
本研究利用 SI-ATRP 技术在玻璃基材表面构建了 PEGMA-GMA 二元嵌段共聚物刷,并通过 GMA 末端环氧基与氨基的开环反应固定了 REDV 活性多肽。静态水接触角、XPS 和 AFM 从不同角度证明了玻璃基材表面各步接枝反应的成功。通过紫外-可见分光光度计对表面固定的 REDV 多肽进行了定量表征,血浆复钙化实验和血小板黏附结果表明该二元嵌段共聚物刷构建的涂层具有良好的血液相容性。PEG 可以阻抗非特异性吸附,包括血小板和细胞的黏附。在 PEG 阻抗的基础上,REDV 作为一种活性多肽,可以特异性地促进内皮细胞的黏附和增殖,从而实现表面的内皮化。尽管由于 PEG 的存在,内皮细胞的黏附数量和速度会变慢,但是随着时间的延长,内皮细胞和平滑肌细胞之间的数量比会越来越大,这也是形成表面内皮化的重要条件;而且 PEG 和 REDV 之间的竞争关系以及内皮细胞黏附的数量和快慢可以通过 REDV 的表面接枝量来进行调控。本研究提供了一种惰性聚合物 PEGMA 与生物活性分子 REDV 协同作用的表面构建新方法,为后续原位内皮化功能界面的研究提供了理论与实验依据。
Funding Statement
国家自然科学基金项目(51203001);河南省教育厅高等学校重点科研项目(17A430003);河南省高等学校青年骨干教师资助项目(2016GGJS-144)
References
- 1.Weng Yajun, Chen Junying, Tu Qiufen, et al Biomimetic modification of metallic cardiovascular biomaterials: from function mimicking to endothelialization in vivo . Interface Focus. 2012;2(3):356–365. doi: 10.1098/rsfs.2011.0126. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Wei Y, Zhang J X, Ji Y, et al REDV Rapamycin-loaded polymer combinations as a coordinated strategy to enhance endothelial cells selectivity for a stent system. Colloids Surf B Biointerfaces. 2015;136:1166–1173. doi: 10.1016/j.colsurfb.2015.11.012. [DOI] [PubMed] [Google Scholar]
- 3.Pana C J, Wang J, Huang N Preparation, characterization and in vitro anticoagulation of emodin-eluting controlled biodegradable stent coatings . Colloids Surf B Biointerfaces. 2010;77:155–160. doi: 10.1016/j.colsurfb.2010.01.019. [DOI] [PubMed] [Google Scholar]
- 4.Chen Jialong, Cao Jianjun, Wang Juan, et al Biofunctionalization of titanium with PEG and anti-CD34 for hemocompatibility and stimulated endothelialization. J Colloid Interface Sci. 2012;368(1):636–647. doi: 10.1016/j.jcis.2011.11.039. [DOI] [PubMed] [Google Scholar]
- 5.魏雨, 张景迅, 范娟娟, 等 心血管支架表面改性及应用. 生物医学工程学杂志. 2016;33(3):593–597. [PubMed] [Google Scholar]
- 6.Chang Hao, Liu Xiqiu, Hu Mi, et al Substrate stiffness combined with hepatocyte growth factor modulates endothelial cell behavior. Biomacromolecules. 2016;17(9):2767–2776. doi: 10.1021/acs.biomac.6b00318. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Wei Y, Ji Y, Xiao L L Surface engineering of cardiovascular stent with endothelial cellselectivity for in vivo re-endothelialisation . Biomaterials. 2013;34(11):2588–2599. doi: 10.1016/j.biomaterials.2012.12.036. [DOI] [PubMed] [Google Scholar]
- 8.魏雨, 张景迅, 范娟娟, 等. 基于聚乙二醇和不同多肽构建的生物涂层及其内皮细胞选择性研究. 高分子学报, 2016(1): 118-124.
- 9.Huang C F Surface-initiated atom transfer radical polymerization for applications in sensors, non-biofouling surfaces and adsorbents. Polym J. 2016;48(4, SI):341–350. doi: 10.1038/pj.2016.24. [DOI] [Google Scholar]
- 10.Xu F J, Neoh K G, Kang E T Bioactive surfaces and biomaterials via atom transfer radical polymerization. Prog Polym Sci. 2009;34(8):719–761. doi: 10.1016/j.progpolymsci.2009.04.005. [DOI] [Google Scholar]
- 11.Wang Jingjing, Wei Jun Hydrogel brushes grafted from stainless steel via surface-initiated atom transfer radical polymerization for marine antifouling. Appl Surf Sci. 2016;382:202–216. doi: 10.1016/j.apsusc.2016.03.223. [DOI] [Google Scholar]
- 12.Wei Yu, Zhang Jingxun, Li Haolie, et al Multifunctional copolymer coating of polyethylene glycol, glycidyl methacrylate, and REDV to enhance the selectivity of endothelial cells. J Biomater Sci Polym Ed. 2015;26(18):1357–1371. doi: 10.1080/09205063.2015.1095024. [DOI] [PubMed] [Google Scholar]
- 13.Li Xin, Wang Mengmeng, Wang Lei, et al Block copolymer modified surfaces for conjugation of biomacromolecules with control of quantity and activity. Langmuir. 2013;29(4):1122–1128. doi: 10.1021/la3044472. [DOI] [PubMed] [Google Scholar]
- 14.郑军, 李丹, 袁琳, 等. 表面接枝嵌段共聚物刷实现内皮细胞的选择性黏附. 高分子学报, 2013(8): 1108-1114.
- 15.Liu Yingshuai, Wang Wei, Hu Weihua, et al Highly sensitive poly[glycidyl methacrylate-co-poly(ethylene glycol) methacrylate] brush-based flow-through microarray immunoassay device. Biomed Microdevices. 2011;13(4):769–777. doi: 10.1007/s10544-011-9547-1. [DOI] [PubMed] [Google Scholar]
- 16.Iwata R, Satoh R, Iwasaki Y, et al Covalent immobilization of antibody fragments on well-defined polymer brushes via site-directed method. Colloids Surf B Biointerfaces. 2008;62(2):288–298. doi: 10.1016/j.colsurfb.2007.10.018. [DOI] [PubMed] [Google Scholar]
- 17.Pimpha N, Chaleawlert-umpon S, Chruewkamlow N, et al Preparation of anti-CD4 monoclonal antibody-conjugated magnetic poly(glycidyl methacrylate) particles and their application on CD4(+) lymphocyte separation. Talanta. 2011;84(1):89–97. doi: 10.1016/j.talanta.2010.12.032. [DOI] [PubMed] [Google Scholar]
- 18.Xu F J, Zhu Y, Chai M Y, et al Comparison of ethanolamine/ethylenediamine-functionalized poly(glycidyl methacrylate) for efficient gene delivery. Acta Biomater. 2011;7(8):3131–3140. doi: 10.1016/j.actbio.2011.04.023. [DOI] [PubMed] [Google Scholar]
- 19.Plouffe B D, Njoka D N, Harris J, et al Peptide-mediated selective adhesion of smooth muscle and endothelial cells in microfluidic shear flow. Langmuir. 2007;23:5050–5055. doi: 10.1021/la0700220. [DOI] [PubMed] [Google Scholar]
- 20.Wei Yu, Ji Ying, Xiao Linlin, et al Different complex surfaces of polyethyleneglycol (PEG) and REDV ligand to enhance the endothelial cells selectivity over smooth muscle cells. Colloids Surf B Biointerfaces. 2011;84(2):369–378. doi: 10.1016/j.colsurfb.2011.01.028. [DOI] [PubMed] [Google Scholar]
- 21.魏雨. 内皮细胞选择性心血管支架仿生涂层材料的研究. 杭州: 浙江大学, 2011.
- 22.Wu Zhaoqiang, Chen Hong, Liu Xiaoli, et al Protein adsorption on poly(n-vinylpyrrolidone)-modified silicon surfaces prepared by surface-initiated atom transfer radical polymerization. Langmuir. 2009;25(5):2900–2906. doi: 10.1021/la8037523. [DOI] [PubMed] [Google Scholar]
- 23.Xu F J, Cai Q J, Li Y L, et al Covalent immobilization of glucose oxidase on well-defined poly(glycidyl methacrylate)-Si(111) hybrids from surface-initiated atom-transfer radical polymerization. Biomacromolecules. 2005;6(2):1012–1020. doi: 10.1021/bm0493178. [DOI] [PubMed] [Google Scholar]




