Abstract
青光眼的生物力学风险因素众多,相互关系纷繁复杂。本文综述了青光眼有关力学作用方面的最新研究状况。在青光眼生物力学研究的发展前景方面,提出了一个全新的生物力学评估指标——压力储备分数(FPR),并提出利用人工智能和机器学习等新技术构建面向临床应用的青光眼风险评估算法和应用系统。
Keywords: 青光眼, 眼生物力学, 统计分析, 研究进展
Abstract
There are so many biomechanical risk factors related with glaucoma and their relationship is much complex. This paper reviewed the state-of-the-art research works on glaucoma related mechanical effects. With regards to the development perspectives of studies on glaucoma biomechanics, a completely novel biomechanical evaluation factor -- Fractional Flow Reserve (FPR) for glaucoma was proposed, and developing clinical application oriented glaucoma risk assessment algorithm and application system by using the new techniques such as artificial intelligence and machine learning were suggested.
Keywords: glaucoma, ocular biomechanics, statistics, research progression
引言
青光眼是全球第一位不可逆的致盲性眼病。据统计,全球青光眼患者约 6 050 万,双眼盲者 840 万。美国每年因青光眼治疗的直接费用达 29 亿美元。我国目前尚无关于青光眼治疗的花费统计,但由于我国青光眼患者数量为美国的 5~6 倍,如果所有青光眼患者都接受治疗,估计我国青光眼治疗的直接花费可达 150~180 亿美元,而由青光眼造成的间接经济损失可能更大。更为严重的是,随着人口的老龄化,预计到 2020 年青光眼患者将增至 7 964 万,其中 1 120 万人可能因青光眼发展为双眼盲。因此,对于青光眼的防治研究具有非常重要的社会和经济意义。
眼压被认为是与青光眼直接相关的一个重要的生物力学因素。眼压是指眼球内部的压力,即眼内容物对眼球壁施加的均衡压力,因此也称为眼内压。眼内容物有房水、晶状体、玻璃体,其中对眼压影响最大的是房水。正常眼压的范围为 10~21 mm Hg(1.33~2.80 kPa)[(15.5 ± 2.75) mm Hg],高于此范围即可认为是高眼压。高眼压易导致青光眼是被广泛接受的共识,这样的青光眼被称为高眼压性青光眼(high tension glaucoma,HTG)。然而,低眼压(正常眼压)也会导致青光眼,这样的青光眼被称为低眼压(正常眼压)性青光眼(normal tension glaucoma,NTG)。眼压与青光眼的复杂联系就引起了争论和新的探索[1-3]。除了眼压之外,还有许多生物力学因素被认为与青光眼的发病风险有关,因此,吸引了生物力学领域和临床医学领域的共同关注。
本文综述的关注焦点是与青光眼发病风险相关的各种生物力学因素,并从生物力学的角度提出全新的青光眼评估指标,对人工智能和机器学习技术在面向临床青光眼评估方法方面的应用研究进行了展望。
1. 国内外研究现状
1.1. 与青光眼相关的生物力学因素
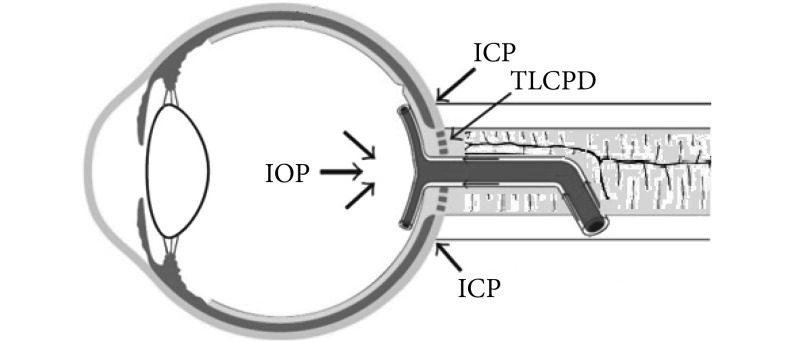
由于仅仅依据眼压来评估青光眼的发病风险会导致相互冲突的结果,因此有人把关注点放到了颅内压(intracranial pressure,ICP)和眼内压(intraocular pressure,IOP)的相互关系上,提出跨筛板压力差(trans-lamina cribrosa pressure difference,TLCPD)(TLCPD=IOP-ICP)作为评价指标。当然还有更多的生物力学因素如收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、灌注压(ocular perfusion pressure,OPP)、静脉压等也被列入青光眼危险因素当中[1]。以上这些指标均以绝对值的形式被用于青光眼的风险评估。然而,绝对值往往带有很明显的个性化差异,也没有考虑到压力基线高低对压差大小的影响。另外,生物组织的应力-生长关系会引起眼睛相关组织的适应性改变,因此会有 HTG 和 NTG 这样的结果。
高眼压被广泛认为是青光眼的高危致病因素,而且也是目前为止可以调节和控制的因素[2]。IOP 与房水流动及青光眼之间具有直接的关系,而且容易利用眼压仪测量,因此 IOP 一直是青光眼诊治中的主要关注点。但并不是高 IOP 一定导致青光眼,也不是所有青光眼都是高 IOP[3]。因此,研究的焦点又关注到更多的影响因素上来。陈燕云等[4]认为 NTG 不仅是眼部的疾病,更倾向于是一组全身的系统性疾病。Tham 等[5]针对 PubMed、Medline 和 Web of Science 等数据库进行了荟萃分析,探讨性别、年龄、人种等因素与青光眼之间的相关性。Marek 等[6]对多种力学参数(SBP、DBP、IOP、ICP、TLCPD 等)和体征参数(性别、年龄、糖尿病、体重指数 BMI 等)与青光眼之间的关系进行了综合分析,发现关于这些指标的研究之间往往会得出互相不一致甚至冲突的结论。Marek 等认为血液系统、眼睛和颅脑等部位的压力对青光眼的发展都有深远的影响,TLCPD 与筛板结构改变及视神经损伤存在密切的联系。Liu 等[7]的临床病例研究也发现,TLCPD 在 NTG 患者中显著高于正常人群的数值。在流行病学研究中,OPP 和眼动脉血流(ophthalmic artery flow,OAF)被认为与青光眼有关联[8]。Fan 等[9]认为,只是降低 IOP 对治疗青光眼是不够的,治疗策略中应考虑对视神经的保护,如改善血流情况就是至关重要的问题。Samsudin 等[10]针对 NTG 患者的 OPP 和 OAF 之间的关系进行了研究,建立了眼灌注压与血压/眼压之间的经验公式:OPP = 2/3[DBP + 1/3(SBP − DBP)] – IOP,认为 OPP 的波动幅度对 NTG 的发展有重要作用,而血液灌注不全则对 NTG 不起作用。Hou 等[11]的动物实验表明,降低 ICP 将对颅脊液在视神经管和框内腔的流动阻力产生影响,从而导致视神经损伤。Yavin 等[12]通过荟萃分析发现,IOP 和 ICP 之间具有相关性。颅内压与眼压的失衡有可能是正常眼压性青光眼的原因之一[13]。Lindén 等[14]针对人体在不同位姿下 IOP、ICP 及 TLCPD 的变化,探讨它们与 NTG 之间的关系,结果表明 ICP 与 NTG 之间没有相关性。因此,ICP、IOP 及 TLCPD 等一起成了目前研究的新热点,而发表的成果还不多。
1.2. 颅内压与青光眼的关系
ICP 之所以受到关注,是因为 TLCPD 产生的机械应力/应变会影响视神经头等视神经相关组织的适应性改变[15-18]。吴文文等[13]认为,相对于正常人,近视患者的筛板较薄,接触异常脑脊液的概率大,患青光眼的风险高;NTG 患者颅内压低,不适于应用碳酸酐酶抑制剂,因其可一定程度减少脑脊液分泌;中度高眼压症患者 ICP 升高,可以抵消升高的 IOP 的作用,从而防止潜在或延缓青光眼性视神经损害。在原发性开角型青光眼(open-angle glaucoma,OAG)发病机制中,IOP 成为一个具有争议的因素。首都医科大学附属北京同仁医院王宁利带领的课题组在“北京颅眼压力研究”(intracranial and intraocular pressure,iCOP)计划中,通过临床前瞻性研究发现 TLCPD 可能是视神经乳头生理、病理改变的重要因素,并在青光眼视神经病变中起重要作用。他们认为理论上颅内压的降低与眼内压的升高对视神经的损伤是相似的,但青光眼性视神经病变与 TLCPD 的相关性比与 IOP 的相关性更显著[16]。通过对大量病例数据的统计分析,得到了正常人眼内压和颅内压的统计值:IOP ≈ (14.3 ± 2.6)mm Hg,ICP ≈ (12.9 ± 1.9)mm Hg[17]。ICP 与 IOP 之间似乎存在一定的数量关系。而 Wang 等[18]的研究表明对脑水肿患者而言,IOP 不能直接用于估算 ICP。Lee 等[19]认为 TLCPD 与 NTG 相关,但不是简单的单调关系。Chen 等[20]回顾性研究发现,低 ICP 会因为 TLCPD 增大而导致视神经损伤而使 NTG 的发展恶化。Gallina 等[21]的研究表明,正常颅压脑积水行分流术后过低的 ICP 可能导致 NTG。可见,除了高 IOP 之外,低 ICP 也是诱发青光眼的危险因素。Feola 等[22]则利用有限元分析方法研究 ICP 对视神经头变形的影响,结果表明 ICP 和视神经头的力学性能将影响视神经产生过度的应变,从而导致视神经损伤。
1.3. 颅内压与眼内压的关系
早在 20 世纪 70 年代,就有人通过动物实验研究 IOP 与 ICP 之间的关系,以及它们对 TLCPD 的影响[23]。Wang 等[24]用猴子作为实验对象,利用压力蓄能器分别对 IOP 和 ICP 进行在体实验控制,利用光学相干断层扫描技术(optical coherence tomography,OCT)观测筛板形态,探讨不同 IOP、ICP 数值对筛板结构改变的影响。结果表明,同时考虑 IOP 和 ICP 来探讨筛板结构的改变是非常必要的。首都医科大学附属北京同仁医院王宁利带领的课题组分别用比格犬和猕猴作为实验对象,通过穿刺、探针及传感器等手段改变和控制动物的 IOP 和 ICP,探讨 ICP 与 IOP 的相关性及对视神经的影响[25-26]。研究表明 ICP 与 IOP 之间存在动态平衡关系,这种平衡被打破可能会导致不同程度视神经损伤。Tran 等[27]对猴子进行动物实验,发现 IOP 和 ICP 的非生理性升高造成视神经组织的过度牵张或压缩,这将导致视神经损伤直至失去视觉。Lindén 等[14]针对人体在不同位姿下 IOP、ICP 及 TLCPD 的变化,探讨它们与 NTG 之间的关系,结果表明 ICP 与 NTG 之间没有相关性。Gonzálezcamarena 等[28]研究了脊柱穿刺前后 IOP 与 ICP 的关系,但没有发现二者之间具有确定的关系。以上这些实验研究奠定了很有价值的借鉴基础,然而这些实验基本上都是观测实验对象的即刻反应,暴露时间很短,缺乏较长时间的随访研究结果,因此其结论也仅仅作为一种参考。
生物力学中有一句经典名言“form follows function”,即功能决定了结构,也可以理解为应力-生长关系的一种表现。青光眼的视神经功能损伤往往表现在微结构改变上,青光眼诊断和治疗的最好方法也是从结构和功能两方面相结合来寻求解决方案的[29]。因此,无论是就理论上的生物力学机制还是临床应用上的诊疗手段而言,生物力学因素都是影响青光眼评估的重要指标。
2. 研究展望
2.1. 提出青光眼评估的生物力学新指标
将生物力学理论和方法应用于青光眼的临床诊断评估当中,是业内人士孜孜以求的目标[30]。相关的生物力学基础研究和临床诊疗应用研究考虑了包括多种压力因素在内的生物力学指标与青光眼之间的统计学关系,特别是重点关注了 IOP、ICP、TLCPD 等力学因素与青光眼之间的作用关系。究其原因,一方面 IOP 一直是临床眼科常规检查项目,另一方面 ICP、TLCPD 是最近几年研究人员和医生关注的新热点,而且 IOP、ICP、TLCPD 在眼底视神经周围发挥作用(见图 1),对视神经的影响最为直接。这样,既考虑了与青光眼相关生物力学因素的主要矛盾,又兼顾了青光眼临床检测的可操作性。尽管如此,根据这一压力指标的绝对值大小来评估青光眼,仍然会导致互相冲突的结果。
图 1.
Diagram of the action relationship between the optic nerve related IOP and ICP
视神经相关压力 IOP 及 ICP 在眼部作用关系示意图
参照血流动力学中的血流储备分数(fractional flow reserve,FFR,即 FFR = Pd/Pa,其中 Pd 为血管下游压力,Pa 为血管上游的主动脉压力),作者针对青光眼提出了一个全新的无量纲的生物力学评价指标──压力储备分数(fractional pressure reserve,FPR),FPR = P1/P2,其中 P1 和 P2 可以是任意两个相关联的压力值。这样就把压力绝对值转化为相对值,同时考虑到了压力基线(base-line)高低对压差幅度大小的影响。在这里,定义压力储备分数为公式(1):
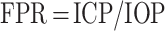 |
1 |
一般情况下,FPR 是介于 0~1 之间的一个实数。FPR 较高者表明 ICP 高而 IOP 相对较低,或者说 TLCPD 较小。
提出 FPR 这一评价指标的科学依据是:影响眼生物力学的各种压力的绝对值也许不是青光眼的客观评价指标,因为压力基线及其漂移可能会因为相关眼组织的应力-生长关系而影响到青光眼的生物力学指标,而 FPR 这一相对值也许能够更客观地评价青光眼的生物力学问题。
提出 FPR 的科学意义和现实意义在于:将 FPR 用于青光眼的生物力学评价,将大大简化各种压力因素的绝对值高低变化对青光眼临床数据分析的复杂影响,从而更加客观地评估各种压力的相对变化对青光眼的作用;从临床实践的角度来看,FPR 有可能为提前筛查青光眼甚至制定新的临床诊断标准奠定科学基础。
需要特别说明的是,尽管这里定义的 FPR 重点考虑的是 IOP、ICP 和 TLCPD 这几项压力指标,但 FPR 的概念可以延伸到其他相关的压力指标中,从而可以为深入探讨各种压力指标和体征参数对青光眼的影响开拓研究思路。
2.2. 应用人工智能新技术进行青光眼的风险评估
人工智能和机器学习等新技术正如火如荼地遍地开花,应用于各个领域。而医学科学作为经验性很强的专业领域,其发展水平非常依赖于知识的学习、积累、推理和应用。基于医学大数据的人工智能和机器学习,非常适合于临床医学的诊断和治疗。有人说机器学习就是数理统计分析。而实际上,机器学习和数理统计之间的关系远没有这么简单。首先,机器学习更多地关心如何构建一个系统去分析数据,而不是针对特定的程序化指令。其次,机器学习更多地强调优化和性能,而统计学则更注重推导。再次,机器学习并不需要对有关变量之间的潜在关系提出先验假设。相比之下,统计学则必须了解数据的收集方式、估计量(包括 P 值和无偏估计)的统计特征、被研究人群的潜在分布规律,以及多次试验的期望参数的类型,统计建模通常用于较低维度的数据集。机器学习的关键词是预测、监督学习和非监督学习等。而数理统计是关于抽样、统计和假设检验的科学。另外,针对青光眼的常规临床检查项目,目前往往还缺乏精心的试验设计,即没有遵循六西格玛试验设计原则:重复试验、随机化和区组化,这样就造成了大量病例样本产生的数据是无效数据的现象。因此,面对人工智能和机器学习等新技术,应科学合理地进行系统研究和试验设计,完善临床试验样本和病例信息,这样才能得到具有创新性和科学性的青光眼评估方法。
就目前发表的文献来看,统计分析中关于青光眼生物力学影响因素的前瞻性研究成果还比较少,利用人工智能和机器学习等新技术如人工神经网络(artificial neural network,ANN)技术辅助进行青光眼诊断的研究内容更少,且仅限于眼底图中杯盘比的识别[31-32],而利用 ANN 等人工智能和机器学习技术来研究生物力学因素与青光眼关系的问题更是鲜有报道。我国人口众多,临床病例丰富,这为收集医学大数据提供了很便利的条件。相信在不久的将来,利用人工智能和机器学习等新技术对临床病例进行回顾性和前瞻性分析研究,探讨生物力学因素在青光眼评估诊疗中的应用,将为青光眼风险评估提供强有力而切实可行的工具。
3. 总结
与青光眼相关的生物力学风险因素众多,相互关系纷繁复杂。无论是基础研究还是临床应用研究者,都需要关注临床医学大数据获取、数据挖掘与试验设计等重要科学技术问题,创新性地提出针对青光眼的全新的生物力学评估指标,并利用人工智能和机器学习等新技术构建面向临床应用的评估算法和应用系统,顺应新世纪临床医学的新技术发展趋势,才会具有更好的发展前景。
Funding Statement
北京市自然科学基金(7152022);国家自然科学基金(10802053)
References
- 1.Wostyn P, De Groot V, Van dam D, et al The glymphatic hypothesis of glaucoma: A unifying concept incorporating vascular, biomechanical, and biochemical aspects of the disease. BioMed Research International. 2017:5123148-1–5123148-7. doi: 10.1155/2017/5123148. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Guy A, Wiggs J L, Turalba A, et al Translating the low translaminar cribrosa pressure gradient hypothesis into the clinical care of glaucoma. Seminars in Ophthalmology. 2016;31(1-2):131–139. doi: 10.3109/08820538.2015.1114855. [DOI] [PubMed] [Google Scholar]
- 3.Kass M, Heuer D K, Higginbotham EJ, et al The ocular hypertension treatment study: a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002;120(6):701–713. doi: 10.1001/archopht.120.6.701. [DOI] [PubMed] [Google Scholar]
- 4.陈燕云, 梁远波, 乔利亚 正常眼压性青光眼病因学相关因素与分型. 眼科. 2012;21(1):19–23. doi: 10.3969/j.issn.1000-4432.2012.01.004. [DOI] [Google Scholar]
- 5.Tham Y C, Wong T Y, Quigley H A, et al Global prevalence of glaucoma and projections of glaucoma burden through 2040: a systematic review and meta-analysis. Ophthalmology. 2014;121(11):2081–2090. doi: 10.1016/j.ophtha.2014.05.013. [DOI] [PubMed] [Google Scholar]
- 6.Marek B, Harris A, Kanakamedala P, et al Cerebrospinal fluid pressure and glaucoma: regulation of trans-lamina cribrosa pressure. Br J Ophthalmol. 2014;98(6):721–725. doi: 10.1136/bjophthalmol-2013-303884. [DOI] [PubMed] [Google Scholar]
- 7.Liu Hanruo, Yang Diya, Ma Teng, et al Measurement and associations of the optic nerve subarachnoid space in normal tension and primary open-angle glaucoma. Am J Ophthalmol. 2018;186:128–137. doi: 10.1016/j.ajo.2017.11.024. [DOI] [PubMed] [Google Scholar]
- 8.Leske M C, Wu S Y, Hennis A, et al Risk factors for incident open-angle glaucoma: the Barbados Eye Studies. Ophthalmology. 2008;115(1):85–93. doi: 10.1016/j.ophtha.2007.03.017. [DOI] [PubMed] [Google Scholar]
- 9.Fan N, Wang P, Tang L, et al. Ocular blood flow and normal tension glaucoma. BioMed Research International, 2015: 308505. DOI: 10.1155/2015/308505.
- 10.Samsudin A, Isaacs N, Tai M L S, et al. Ocular perfusion pressure and ophthalmic artery flow in patients with normal tension glaucoma. BMC Ophthalmol, 2016, 16: 39. DOI: 10.1186/s12886-016-0215-3.
- 11.Hou R, Zhang Z, Yang D, et al Intracranial pressure (ICP) and optic nerve subarachnoid space pressure (ONSP) correlation in the optic nerve chamber: the Beijing Intracranial and Intraocular Pressure (iCOP) study. Brain Research. 2016;1635:201–208. doi: 10.1016/j.brainres.2016.01.011. [DOI] [PubMed] [Google Scholar]
- 12.Yavin D, Luu J, James M T, et al Diagnostic accuracy of intraocular pressure measurement for the detection of raised intracranial pressure: meta-analysis. J Neurosurg. 2014;121(3):680–687. doi: 10.3171/2014.4.JNS13932. [DOI] [PubMed] [Google Scholar]
- 13.吴文文, 唐莉 低颅压与正常眼压性青光眼的关系. 眼科新进展. 2015;35(4):390–392. [Google Scholar]
- 14.Lindén C, Qvarlander S, Jóhannesson G, et al Normal-tension glaucoma has normal intracranial pressure a prospective study of intracranial pressure and intraocular pressure in different body positions. Ophthalmology. 2018;125(3):361–368. doi: 10.1016/j.ophtha.2017.09.022. [DOI] [PubMed] [Google Scholar]
- 15.Downs J C, Girkin C A Lamina cribrosa in glaucoma. Curr Opin Ophthalmol. 2017;28(2):113–119. doi: 10.1097/ICU.0000000000000354. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.梁庆丰, 刘旭阳 北京眼压与颅压相关疾病研究中跨筛板压力差致青光眼视神经损伤的机制. 中华眼科杂志. 2014;50(10):798–800. doi: 10.3760/cma.j.issn.0412-4081.2014.10.020. [DOI] [PubMed] [Google Scholar]
- 17.Ren Ruojin, Jonas J B, Tian G, et al Cerebrospinal fluid pressure in glaucoma: a prospective study. Ophthalmology. 2010;117(2):259–266. doi: 10.1016/j.ophtha.2009.06.058. [DOI] [PubMed] [Google Scholar]
- 18.Wang W, Wang M, Li Z, et al The intraocular pressure could not be used to determine the intracranial pressure in patients with hydrocephalus. Int J Neurosci. 2018;8:1–19. doi: 10.1080/00207454.2018.1486832. [DOI] [PubMed] [Google Scholar]
- 19.Lee S H, Kwak S W, Kang E M, et al Estimated trans-lamina cribrosa pressure differences in low-teen and high-teen intraocular pressure normal tension glaucoma: the korean National Health and Nutrition Examination Survey. PLoS One. 2016;11(2):e0148412. doi: 10.1371/journal.pone.0148412. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Chen B H, Drucker M D, Louis K M Progression of normal-tension glaucoma after ventriculoperitoneal shunt to decrease cerebrospinal fluid pressure. J Glaucoma. 2016;25(1):E50–E52. doi: 10.1097/IJG.0000000000000186. [DOI] [PubMed] [Google Scholar]
- 21.Gallina P, Savastano A, Becattini E, et al Glaucoma in patients with shunt-treated normal pressure hydrocephalus. J Neurosurg. 2018;129(4):1078–1084. doi: 10.3171/2017.5.JNS163062. [DOI] [PubMed] [Google Scholar]
- 22.Feola A J, Myers J G, Raykin J, et al Finite element modeling of factors influencing optic nerve head deformation due to intracranial pressure. Invest Ophthalmol Vis Sci. 2016;57(4):1901–1911. doi: 10.1167/iovs.15-17573. [DOI] [PubMed] [Google Scholar]
- 23.Yablonski M, Ritch R, Pokorny K S Effect of decreased intracranial pressure on optic disc. Invest Ophthalmol Vis Sci. 1979;18(Suppl):165. [Google Scholar]
- 24.Wang Bo, Tran H, Smith M A, et al In-vivo effects of intraocular and intracranial pressures on the lamina cribrosa microstructure . PLoS One. 2017;12(11):e0188302. doi: 10.1371/journal.pone.0188302. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.侯若武, 章征, 杨迪亚, 等 颅内压与眼内压的相关性及对视神经的影响: 北京颅眼压力研究 (iCOP) 中国科学: 生命科学. 2016;46:1413–1422. [Google Scholar]
- 26.Yang Diya, Fu Jidi, Hou Ruowu, et al Optic neuropathy induced by experimentally reduced cerebrospinal fluid pressure in monkeys. Invest Ophthalmol Vis Sci. 2014;55(5):3067–3073. doi: 10.1167/iovs.13-13657. [DOI] [PubMed] [Google Scholar]
- 27.Tran H, Grimma J, Wanga B, et al. Mapping in-vivo optic nerve head strains caused by intraocular and intracranial pressures. Proc SPIE Int Soc Opt Eng, 2017: 10067. DOI: 10.1117/12.2257360.
- 28.Gonzálezcamarena P I, Sanjuan D, Gonzálezolhovich I, et al Dynamic changes of the intraocular pressure and the pressure of cerebrospinal fluid in nonglaucomatous neurological patients. Acta Ophthalmologica. 2017;95(2):e138–e143. doi: 10.1111/aos.2017.95.issue-2. [DOI] [PubMed] [Google Scholar]
- 29.Zhao Da, He Zheng, Vingrys A J, et al The effect of intraocular and intracranial pressure on retinal structure and function in rats. Physiol Rep. 2015;3(8):e12507. doi: 10.14814/phy2.12507. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Abe R Y, Diniz-Filho A, Costa V P, et al Predicting vision-related disability in glaucoma. Ophthalmology. 2018;125(1):22–30. doi: 10.1016/j.ophtha.2017.08.034. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Rajandran N Glaucoma detection using DWT based energy features and ANN classifier. IOSR Journal of Computer Engineering. 2014;16(5):35–42. doi: 10.9790/0661. [DOI] [Google Scholar]
- 32.Choudhary K, Tiwari S ANN glaucoma detection using cup-to-disk ratio and neuroretinal rim. Int J Comput Appl. 2015;111(11):8–14. [Google Scholar]