Abstract
门静脉高压(PHT)是肝硬化的常见并发症,门静脉压力(PVP)评估是研究 PHT 的必要手段,但目前尚无一种准确可靠的方式来实现 PVP 的无创评估。本文采用体外模拟装置,在低压环境下,首先采集不同超声造影剂(UCA)浓度下的超声图像和射频回波信号;然后通过超声灰阶图像重建和快速傅里叶变换(FFT)获得回波信号中亚谐波的幅度;最后基于线性回归分析亚谐波幅度(SA)和仿生门静脉压力(BPVP)的关系。结果,在 7.5~45 mm Hg 和 8~20 mm Hg 的压力区间,当 UCA 浓度为 1∶3 000 时,SA 和 BPVP 的线性相关系数(LCC)分别为 0.927 和 0.913;UCA 浓度为 1∶6 000 时,LCC 分别为 0.737 和 0.568;将两种 UCA 浓度的 SA 同时作为 BPVP 的特征时,LCC 分别为 0.968 和 0.916。结果表明,SA 和 BPVP 存在良好的线性关系;将不同 UCA 浓度下得到的 SA 同时作为 BPVP 的特征,能提高二者之间的线性相关性。本文为临床上通过 SA 来无创评估 PVP 提供了可靠的实验验证,而且为提高该方法的准确性提出了新方向。
Keywords: 门静脉压力, 亚谐波, 无创, 超声造影剂, 线性回归
Abstract
Portal hypertension (PHT) is a common complication of liver cirrhosis, which could be measured by the means of portal vein pressure (PVP). However, there is no report about an effective and reliable way to achieve noninvasive assessment of PVP so far. In this study, firstly, we collected ultrasound images and echo signals of different ultrasound contrast agent (UCA) concentrations and different pressure ranges in a low-pressure environment based on an in vitro simulation device. Then, the amplitudes of the subharmonics in the echo signal were obtained by ultrasound grayscale image construction and fast Fourier transform (FFT). Finally, we analyzed the relationship between subharmonic amplitude (SA) and bionic portal vein pressure (BPVP) through linear regression. As a result, in the pressure range of 7.5–45 mm Hg and 8–20 mm Hg, the linear correlation coefficients (LCC) between SA and BPVP were 0.927 and 0.913 respectively when the UCA concentration was 1∶3 000, and LCC were 0.737 and 0.568 respectively when the UCA concentration was 1∶6 000. Particularly, LCC was increased to 0.968 and 0.916 respectively while the SAs of two UCA concentrations were used as the features of BPVP. Therefore, the results show a good performance on the linear relationship between SA and BPVP, and the LCC will be improved by using SAs obtained at different UCA concentrations as the features of BPVP. The proposed method provides reliable experimental verification for noninvasive evaluation of PVP through SA in clinical practice, which could be a guidance for improving the accuracy of PVP assessment.
Keywords: portal vein pressure, subharmonic, noninvasive, ultrasound contrast agent, linear regression
引言
门静脉高压(portal hypertension,PHT)是肝硬化的常见并发症,随着门静脉压力的增加,会出现食管胃底静脉曲张破裂出血、脾功能亢进、腹水、肝性脑病等并发症,严重威胁患者的健康和生命[1-3]。门静脉压力评估是研究 PHT 的必要手段,可以作为 PHT 诊断、疗效评估、预后判断等的重要参考指标[4-6]。
无创评估门静脉压力一直是研究的热点和难点。目前无创评估门静脉压力的方法主要有血清学检查、计算机断层扫描成像、磁共振成像、磁共振弹性成像和超声成像等;这些方法虽然可以在一定程度上评估门静脉压力,但是相关指标和门静脉压力的相关性较低,同时不能对门静脉压力进行分级,在准确评估门静脉压力时存在明显的不足[7-22]。所以,急需找到一种能准确地无创评估门静脉压力的新方法。
人体门静脉压力一般小于 50 mm Hg,正常范围为 8.8~14.2 mm Hg,大于 14.2 mm Hg 则为 PHT。有研究发现,超声造影剂(ultrasound contrast agent,UCA)微泡在超声激励下可以激发出亚谐波信号,在一定的压力区间,亚谐波信号的幅度会随着环境压力的增加而线性降低,利用这一关系可以非侵入性地测量体内组织的压力水平[23-33]。该方法为体内组织压力的无创测量提供了新方向。
但是,目前尚无研究表明,在低压环境下(≤ 50 mm Hg),亚谐波幅度也会随着环境压力的增加而线性降低。上述文献在研究亚谐波幅度和环境压力的关系时,实验中所选取的环境压力范围和压力变化步长均较大:Shi 等[26]和 Leodore 等[27]研究的环境压力范围为 0~186 mm Hg,压力变化步长为 50 mm Hg;Andersen 等[28]、Sun 等[29]和 Wu 等[30]研究的环境压力范围为 0~25 kPa,压力变化步长为 5 kPa;李德玉等[31]和李飞[32]研究的环境压力范围为 0~200 mm Hg,压力变化步长为 50 mm Hg。
本文旨在基于上述研究的不足,采用体外模拟装置,在低压环境下研究是否可以通过 UCA 微泡产生的亚谐波幅度来无创评估门静脉的压力,为临床上通过亚谐波幅度实现门静脉压力的无创评估提供可靠的体外实验验证;同时,在此基础上提出了一种能提高亚谐波幅度和仿生门静脉压力线性相关性的新方法。
1. 方法
1.1. 实验装置
本文所用的体外实验装置的示意图见图1。如图1 所示,超声亚谐波压力测量实验装置主要由门静脉仿体、压力控制装置、超声设备及探头三部分组成。门静脉仿体用于模拟门静脉在人体内的真实环境,由导管、仿生门静脉、腔体等部分组成。腔体内盛有无气水,超声探头、仿生门静脉及腔体内的导管部分均浸没在无气水中;导管和仿生门静脉中装满生理盐水。压力控制装置用于调节和控制仿生门静脉的压力。本实验装置的压力测量范围为-10~100 mm Hg,精度 0.1% F.S.。超声设备及探头用于产生超声激励信号并采集门静脉仿体内的回波信号。本实验装置使用的超声设备是改装的 Philips iU 22(飞利浦,荷兰)超声诊断仪,超声探头为 C5-1 探头(飞利浦,荷兰),实验时不仅能实时观察超声图像,还能保存同一时刻的超声图像和回波信号。超声探头位于仿生门静脉的正上方,二者之间的距离为 3~8 cm,超声探头的位置可固定。
图 1.
Schematic diagram of experimental device for pressure measurement
超声亚谐波压力测量实验装置示意图
门静脉系统属于非搏动性的静脉系统,成人门静脉管径约 10 mm。本文设计的超声亚谐波压力测量实验装置中仿生门静脉类似于人体的门静脉,其管径约 10 mm,管壁厚约 2 mm,在超声显像时可以清楚地显示仿生门静脉的管壁和管腔。同时,在超声谐波造影成像时,仿生门静脉的管壁几乎不产生谐波信号,不会对仿生门静脉内造影剂产生的谐波信号造成干扰,保证了体外实验的可靠性。
1.2. 实验介绍
1.2.1. 实验参数
(1)仿生门静脉压力。因为人体门静脉压力一般小于 50 mm Hg,正常范围为 8.8~14.2 mm Hg,大于 14.2 mm Hg 则为 PHT,所以本文选取两个压力区间与之对应进行体外实验:对应门静脉压力正常范围,选取 8~20 mm Hg 的压力区间,压力变化间隔为 1 mm Hg;对应 PHT,选取 7.5~45 mm Hg 的压力区间,压力变化间隔为 7.5 mm Hg(约 1 kPa)。
(2)造影剂。本文选用的造影剂为 SonoVue(Bracco,意大利)。SonoVue 的包膜材料为磷脂,内部填充气体为 SF6,微泡的平均粒径为 2.5 μm,在 1~10 MHz 的医学超声频率范围内,SonoVue 获得了较好的临床应用[31]。临床上进行肝脏血管造影时,一般通过静脉注射 1~2 mL 的超声造影剂原液,因为人体血液总量约为 5 000 mL,所以造影剂的浓度约为 1∶5 000~1∶2 500。为了模拟临床上肝脏血管造影的造影剂浓度,本文选取浓度 1∶3 000 进行体外实验,同时选择浓度 1∶6 000 作为对照组。
(3)其他参数。实验中选取的超声机械指数为 0.05,以防止微泡破裂,提高造影效果。C5-1 探头中心频率设为 4 MHz[30],采样频率为 32 MHz。超声探头和仿生门静脉之间距离固定为 4 cm,以模拟临床上门静脉距体表超声探头的距离。
1.2.2. 实验过程
根据 1.2.1 节设定的实验参数,本文在 UCA 浓度为 1∶3 000 的条件下,在 8~20 mm Hg 的仿生门静脉压力区间以 1 mm Hg 为变化间隔进行了 13 组实验,在 7.5~45 mm Hg 的仿生门静脉压力区间以 7.5 mm Hg 为变化间隔进行了 6 组实验。在 UCA 浓度为 1∶6 000 的条件下,按同样的方法在 8~20 mm Hg 和 7.5~45 mm Hg 的压力区间分别进行了 13 组和 6 组实验。每组实验包括如下 3 个步骤:
(1)配制 UCA 溶液并注入仿生门静脉。实验时,先在 59 mg 的 SonoVue 冻干粉中加入 5 mL 的生理盐水,用力振摇后形成微泡混悬液;然后将微泡混悬液和生理盐水按照 1∶3 000 或 1∶6 000 的比例配成均匀的 UCA 溶液;最后将 UCA 溶液通过 UCA 注入口注入仿生门静脉。
(2)设定并调节仿生门静脉的压力。实验时,压力控制装置通过压力施加点将设定好的压力施加给仿生门静脉,然后通过导管上的压力传感器获得仿生门静脉的实际压力值,比较实际压力值和设定压力值后,对仿生门静脉的压力进行微调以实现仿生门静脉压力的精确控制。仿生门静脉的压力在 10 s 内可以稳定下来以进行下一步实验。
(3)超声激励、采集回波信号并保存超声图像。本文使用同一个超声探头发射超声波并接收仿生门静脉内的回波信号,同时在超声设备上实时观察超声图像。实验中,待超声成像清晰便开始连续保存 5 s 的超声图像和同一时刻的回波信号,用于下一步的数据处理。如果当次实验超声成像不清晰,则表明当次实验失败,需要重新进行该组实验。
2. 数据处理
本文使用 MATLAB(The MathWorks Inc.,美国)进行数据处理,主要包括 4 个步骤:
(1)选取超声图像和回波信号数据。对于每个压力值,本文从 1.2.2 节步骤(3)保存的超声图像中选择 3 张成像质量最好的图像作为当次成像的结果,并将其回波信号的数据做进一步处理。实验中得到的超声图像如图2 所示,该超声图像的回波信号数据是一个 4 288*256 的矩阵,其中 256 表示 256 条扫描线,4 288 表示每条扫描线上有 4 288 个数据点。图2 中的红色矩形区域表示仿生门静脉。
图 2.
Ultrasound image of bionic portal vein
仿生门静脉超声图像
(2)重建超声灰阶图像并获取仿生门静脉的回波信号数据。由回波信号重建超声图像的过程主要包括去除低频干扰、动态正交解调、低通滤波及下采样、时间增益补偿、信号包络检测、动态显示范围压缩和扫描转换等[34]。通过重建超声灰阶图像,本文选取每条扫描线(数据点 1~4 288)上第 1 401~1 900 个点的数据为仿生门静脉的回波信号数据(即图2 中红色矩形区域对应的回波信号数据),由原始的 4 288*256 的数据矩阵得到了一个新的 500*256 的数据矩阵。
(3)快速傅里叶变换(fast Fourier transform,FFT)和对数变换。本文通过 FFT 将仿生门静脉每条扫描线上的数据由时域变换到频域,然后通过对数变换得到回波信号中不同频率成分的幅度值。其中,某条扫描线的时域信号如图 3 所示。
图 3.
Echo signal time domain diagram of a scan line
单条扫描线回波信号时域图
(4)获得仿生门静脉回波信号的频谱图。通过步骤(3)对仿生门静脉每条扫描线上的数据均做 FFT 和对数变换,然后对 256 条扫描线得到的结果取平均,可得仿生门静脉回波信号的频谱图,如图 4 所示。本文使用的超声探头的发射频率为 4 MHz,在图 4 中可以看到明显的亚谐波分量(2 MHz)。
图 4.
Spectrum of echo signals of bionic portal vein
仿生门静脉回波信号频谱图
3. 结果分析
本文基于 Python 的 NumPy 库,使用最小二乘法对结果进行线性回归分析[35]。最小二乘法是线性回归分析的常用方法,具有最优解唯一、求解方便、解析性质好等优点。记 UCA 浓度为 1∶3 000 时亚谐波幅度值为特征x1,UCA 浓度为 1∶6 000 时亚谐波幅度值为特征x2,仿生门静脉压力值为y。其中,由每组仿生门静脉压力得到的亚谐波幅度值均为 3 次实验结果得到的平均值。
3.1. 7.5~45 mm Hg 压力区间实验结果
在 7.5~45 mm Hg 的压力区间,UCA 浓度为 1∶3 000 和 1∶6 000 得到的亚谐波幅度值如表 1 所示。
表 1. Subharmonic amplitude value in the pressure range of 7.5–45 mm Hg.
仿生门静脉压力为 7.5~45 mm Hg 时的亚谐波幅度值
| 仿生门静脉
压力/mm Hg |
浓度 1∶3 000
幅度值/dB |
浓度 1∶6 000
幅度值/dB |
| 7.5 | 37.37 | 35.20 |
| 15.0 | 37.38 | 35.38 |
| 22.5 | 37.25 | 34.91 |
| 30.0 | 37.06 | 34.40 |
| 37.5 | 36.35 | 34.87 |
| 45.0 | 36.09 | 34.61 |
基于线性回归,可得仿生门静脉压力和亚谐波幅度的关系,如图 5 所示。当 UCA 浓度为 1∶3 000 时,仿生门静脉压力和亚谐波幅度的线性回归方程为
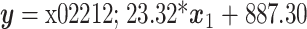 ,线性相关系数(linear correlation coefficient,LCC)为 0.927,线性相关性良好。当 UCA 浓度为 1∶6 000 时,仿生门静脉压力和亚谐波幅度的线性回归方程为
,线性相关系数(linear correlation coefficient,LCC)为 0.927,线性相关性良好。当 UCA 浓度为 1∶6 000 时,仿生门静脉压力和亚谐波幅度的线性回归方程为

 ,线性相关系数为 0.737,线性相关性较好。
,线性相关系数为 0.737,线性相关性较好。
图 5.
Relationship between BPVP and SA in the pressure range of 7.5–45 mm Hg
7.5~45 mm Hg 压力区间仿生门静脉压力和亚谐波幅度关系图
3.2. 8~20 mm Hg 压力区间实验结果
在 8~20 mm Hg 的压力区间,UCA 浓度为 1∶3 000 和 1∶6 000 得到的亚谐波幅度如表 2 所示。
表 2. Subharmonic amplitude value in the pressure range of 8–20 mm Hg.
仿生门静脉压力 8~20 mm Hg 时的亚谐波幅度值
| 仿生门静脉
压力/mm Hg |
浓度 1∶3 000
幅度值/dB |
浓度 1∶6 000
幅度值/dB |
仿生门静脉
压力/mm Hg |
浓度 1∶3 000
幅度值/dB |
浓度 1∶6 000
幅度值/dB |
|
| 8 | 37.48 | 36.25 | 15 | 37.44 | 36.15 | |
| 9 | 37.72 | 36.20 | 16 | 37.26 | 36.21 | |
| 10 | 37.56 | 36.36 | 17 | 37.14 | 35.98 | |
| 11 | 37.54 | 35.92 | 18 | 37.04 | 35.97 | |
| 12 | 37.49 | 36.17 | 19 | 36.95 | 36.06 | |
| 13 | 37.30 | 35.90 | 20 | 37.06 | 35.87 | |
| 14 | 37.38 | 36.11 |
基于线性回归,可得仿生门静脉压力和亚谐波幅度的关系,如图 6 所示。当 UCA 浓度为 1∶3 000 时,仿生门静脉压力和亚谐波幅度的线性回归方程为
 ,线性相关系数为 0.913,线性相关性良好。当 UCA 浓度为 1∶6 000 时,仿生门静脉压力和亚谐波幅度的线性回归方程为
,线性相关系数为 0.913,线性相关性良好。当 UCA 浓度为 1∶6 000 时,仿生门静脉压力和亚谐波幅度的线性回归方程为
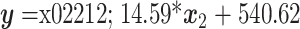 ,线性相关系数为 0.568,线性相关性较差。
,线性相关系数为 0.568,线性相关性较差。
图 6.
Relationship between BPVP and SA in the pressure range of 8–20 mm Hg
8~20 mm Hg 压力区间仿生门静脉压力和亚谐波幅度关系图
3.3. 基于线性回归的血压预测模型
本文 3.1 节和 3.2 节中,在 7.5~45 mm Hg 和 8~20 mm Hg 的压力区间,分别研究了 y 和 x1 以及 y 与 x2 的线性关系。本节基于线性回归,将 x1 和 x2 作为 y 的两个特征,进一步研究仿生门静脉压力和亚谐波幅度的关系。基于不同特征得到的线性回归模型的线性相关系数如表 3 所示。
表 3. Linear correlation coefficient of linear regression model based on different features.
基于不同特征的线性回归模型的线性相关系数
| 压力区间 | 基于 x1 | 基于 x2 | 基于 x1 + x2 |
| 7.5~45 mm Hg | 0.927 | 0.737 | 0.968 |
| 8~20 mm Hg | 0.913 | 0.568 | 0.916 |
在 7.5~45 mm Hg 的压力区间,可得线性回归方程
 ,仿生门静脉压力和亚谐波幅度的线性相关系数为 0.968。在 8~20 mm Hg 的压力区间,可得线性回归方程
,仿生门静脉压力和亚谐波幅度的线性相关系数为 0.968。在 8~20 mm Hg 的压力区间,可得线性回归方程
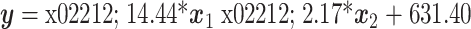 ,仿生门静脉压力和亚谐波幅度的线性相关系数为 0.916。
,仿生门静脉压力和亚谐波幅度的线性相关系数为 0.916。
4. 讨论
由 3.1 节和 3.2 节的实验结果可知,在 7.5~45 mm Hg 和 8~20 mm Hg 的压力区间,UCA 浓度为 1∶3 000 时得到的亚谐波幅度和仿生门静脉压力的线性相关系数均高于 UCA 浓度为 1∶6 000 时;前者得到的线性相关性良好,后者得到的线性相关性较差。所以,基于体外模拟装置,在门静脉压力范围内,选取合适的 UCA 浓度(例如 1∶3 000),使用常规的超声设备,获得的亚谐波幅度和仿生门静脉压力之间存在良好的线性相关性,即亚谐波幅度会随着仿生门静脉压力的增加而降低,可以将该关系用于门静脉压力以及低压环境下(≤ 50 mm Hg)其他血管压力的无创评估。上述研究为临床上通过亚谐波幅度来无创评估门静脉压力提供了可靠的实验验证。
由 3.3 节的实验结果可知,将不同 UCA 浓度下得到的亚谐波幅度同时作为仿生门静脉压力的特征,相比于只将一种 UCA 浓度下的亚谐波幅度作为特征,前者得到线性回归方程的线性相关系数大于后者。在 7.5~45 mm Hg 和 8~20 mm Hg 的压力区间,均取得了相同的实验结果。说明这是一种提高仿生门静脉压力和亚谐波幅度线性相关性的有效手段,通过该方法可以提高基于亚谐波幅度来无创评估仿生门静脉压力的准确性和可靠性。上述研究为提高亚谐波幅度和仿生门静脉压力的线性相关性提供了新的方向和思路。
由 3.3 节的实验结果还可知,在 7.5~45 mm Hg 和 8~20 mm Hg 的压力区间,基于线性回归的血压预测模型得到的亚谐波幅度和仿生门静脉压力的线性相关系数分别为 0.968 和 0.916,线性相关性较强,通过该模型能够较准确地预测仿生门静脉的压力,从而可以实现仿生门静脉压力的分级。
但是,本文的研究还存在以下有待改进的地方。一是整个研究过程中数据处理和分析采取的是离线方式,而不是实时方式,实时性较差。二是本文在提出基于线性回归的血压预测模型时,选择将不同 UCA 浓度下得到的亚谐波幅度作为仿生门静脉压力的特征,对于临床应用,改变 UCA 浓度需要对被测者进行多次 UCA 注射,会给被测者带来较大的负担;相对于改变 UCA 的浓度,改变超声探头的发射频率会更方便,可以进一步研究将不同超声频率下得到的亚谐波幅度作为仿生门静脉压力的特征来提高二者线性相关性的可能性。
利益冲突声明:本文全体作者均声明不存在利益冲突。
Funding Statement
国家自然科学面上基金(81571697);中央高校基本科研业务费专项资金
References
- 1.Qi X, Berzigotti A, Cardenas A, et al Emerging non-invasive approaches for diagnosis and monitoring of portal hypertension. Lancet Gastroenterol Hepatol. 2018;3(10):708–719. doi: 10.1016/S2468-1253(18)30232-2. [DOI] [PubMed] [Google Scholar]
- 2.宋珂达, 姜洪池 门静脉压力无创测定应给予重视. 中华普通外科学文献(电子版) 2018;12(6):373–375. [Google Scholar]
- 3.Bolognesi M, Di Pascoli M, Sacerdoti D Clinical role of non-invasive assessment of portal hypertension. World J Gastroenterol. 2017;23(1):15–24. doi: 10.3748/wjg.v23.i1.1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Ravaioli F, Montagnani M, Lisotti A, et al Noninvasive assessment of portal hypertension in advanced chronic liver disease: An update. Gastroenterol Res Prac. 2018;2018:1–11. doi: 10.1155/2018/4202091. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Thabut D, Moreau R, Lebrec D Noninvasive assessment of portal hypertension in patients with cirrhosis. Hepatology. 2011;53(2):683–694. doi: 10.1002/hep.24129. [DOI] [PubMed] [Google Scholar]
- 6.Addley J, Tham T C, Cash W J Use of portal pressure studies in the management of variceal haemorrhage. World J Gastrointest Endosc. 2012;4(7):281–289. doi: 10.4253/wjge.v4.i7.281. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Leung J C-F, Loong T C-W, Pang J, et al Invasive and non-invasive assessment of portal hypertension. Hepatol Int. 2018;12:44–55. doi: 10.1007/s12072-017-9795-0. [DOI] [PubMed] [Google Scholar]
- 8.Levick C, Phillips-Hughes J, Collier J, et al Non-invasive assessment of portal hypertension by multi-parametric magnetic resonance imaging of the spleen: A proof of concept study. PLoS ONE. 2019;14(8):e0221066. doi: 10.1371/journal.pone.0221066. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Wang J, Gao F, Shen J L Noninvasive assessment of portal hypertension using spectral computed tomography. J Clin Gastroenterol. 2019;53(9):e387–e391. doi: 10.1097/MCG.0000000000001185. [DOI] [PubMed] [Google Scholar]
- 10.Roccarina D, Rosselli M, Genesca J, et al Elastography methods for the non-invasive assessment of portal hypertension. Expert Rev Gastroenterol Hepatol. 2018;12(2):155–164. doi: 10.1080/17474124.2017.1374852. [DOI] [PubMed] [Google Scholar]
- 11.Elmahdy A M, Berzigotti A Non-invasive measurement of portal pressure. Curr Hepat Rep. 2019;18:20–27. doi: 10.1007/s11901-019-00446-4. [DOI] [Google Scholar]
- 12.Leeming D J, Veidal S S, Karsdal M A, et al Pro-C5, a marker of true type V collagen formation and fibrillation, correlates with portal hypertension in patients with alcoholic cirrhosis. Scand J Gastroenterol. 2015;50(5):584–592. doi: 10.3109/00365521.2014.996590. [DOI] [PubMed] [Google Scholar]
- 13.La Mura V, Reverter J C, Flores-Arroyo A, et al Von Willebrand factor levels predict clinical outcome in patients with cirrhosis and portal hypertension. Gut. 2011;60(8):1133–1138. doi: 10.1136/gut.2010.235689. [DOI] [PubMed] [Google Scholar]
- 14.Zhang Q W, Wang Y, Wang J, et al A non-invasive magnetic resonance imaging-based model predicts portal venous pressure. J Digest Dis. 2016;17(3):175–185. doi: 10.1111/1751-2980.12325. [DOI] [PubMed] [Google Scholar]
- 15.Chen J, Yin M, Talwalkar J A, et al Diagnostic performance of MR elastography and vibration-controlled transient elastography in the detection of hepatic fibrosis in patients with severe to morbid obesity. Radiology. 2016:160685. doi: 10.1148/radiol.2016160685. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Andaluz I, Abadía M, Ponce D, et al SAT-409-Hepatic vein arrival time assessed by contrast-enhanced ultrasound in the non-invasive evaluation of portal hypertension. J Hepatol. 2019;70(1):e813. [Google Scholar]
- 17.Ferraioli G, Tinelli C, Dal Bello B, et al Accuracy of real-time shear wave elastography for assessing liver fibrosis in chronic hepatitis C: A pilot study. Hepatology. 2012;56(6):2125–2133. doi: 10.1002/hep.25936. [DOI] [PubMed] [Google Scholar]
- 18.Xie Limei Real-time elastography for diagnosis of liver fibrosis in chronic hepatitis B. J Ultrasound Med. 2012;31(7):1053–1060. doi: 10.7863/jum.2012.31.7.1053. [DOI] [PubMed] [Google Scholar]
- 19.Wiechowska-Kozłowska A, Zasada K, Milkiewicz M, et al Correlation between endosonographic and Doppler ultrasound features of portal hypertension in patients with cirrhosis. Gastroenterol Res Prac. 2012;2012(1):395345. doi: 10.1155/2012/395345. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Elwan N, Salah R, Hamisa M, et al Evaluation of portal pressure by Doppler ultrasound in patients with cirrhosis before and after simvastatin administration - a randomized controlled trial. F1000 Res. 2018;7:256. doi: 10.12688/f1000research.13915.1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Postema M, Gilja O H Contrast-enhanced and targeted ultrasound. World J Gastroenterol. 2011;17(1):28–41. doi: 10.3748/wjg.v17.i1.28. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Jansen C, Bogs C, Verlinden W, et al Shear-wave elastography of the liver and spleen identifies clinically significant portal hypertension: A prospective multicentre study. Liver Int. 2017;37(3):396–405. doi: 10.1111/liv.13243. [DOI] [PubMed] [Google Scholar]
- 23.吕道文, 张拥军, 赵挺, 等 超声造影剂微泡次谐波辅助压力估测技术研究进展. 中国医学物理学杂志. 2016;33(9):959–962. doi: 10.3969/j.issn.1005-202X.2016.09.019. [DOI] [Google Scholar]
- 24.Eisenbrey J R, Dave J K, Halldorsdottir V G, et al Chronic liver disease: Noninvasive subharmonic aided pressure estimation of hepatic venous pressure gradient. Radiology. 2013;268(2):581–588. doi: 10.1148/radiol.13121769. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Li F, Li D, Yan F Improvement of detection sensitivity of microbubbles as sensors to detect ambient pressure. Sensors. 2018;18(12):4083. doi: 10.3390/s18124083. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Shi W T, Forsberg F, Raichlen J S, et al Pressure dependence of subharmonic signals from contrast microbubbles. Ultrasound Med Biol. 1999;25(2):275–283. doi: 10.1016/S0301-5629(98)00163-X. [DOI] [PubMed] [Google Scholar]
- 27.Leodore L M, Forsberg F, Shi W T P5B-6 in vitro pressure estimation obtained from subharmonic contrast microbubble signals//2007 IEEE Ultrasonics Symposium . New York: IEEE. 2007:2207–2210. [Google Scholar]
- 28.Andersen K S, Jensen J A Impact of acoustic pressure on ambient pressure estimation using ultrasound contrast agent. Ultrasonics. 2010;50(2):294–299. doi: 10.1016/j.ultras.2009.09.016. [DOI] [PubMed] [Google Scholar]
- 29.Sun T, Jia N, Zhang D, et al Ambient pressure dependence of the ultra-harmonic response from contrast microbubbles. J Acoust Soc Am. 2012;131(6):4358. doi: 10.1121/1.4707512. [DOI] [PubMed] [Google Scholar]
- 30.Wu Jun, Fan Tingbo, Xu Di, et al Investigation on the relationship between overpressure and sub-harmonic response from encapsulated microbubbles. Chin Phys B. 2014;23(10):104302. doi: 10.1088/1674-1056/23/10/104302. [DOI] [Google Scholar]
- 31.李德玉, 李飞, 樊瑜波, 等. 基于微泡超声造影剂的血压无创测量装置: CN101982156B. 2010.
- 32.李飞. 基于超声造影剂次谐波的无创血压测量方法研究. 北京: 北京航空航天大学, 2012.
- 33.Dave J K, Halldorsdottir V G, Eisenbrey J R, et al Noninvasive LV pressure estimation using subharmonic emissions from microbubbles. JACC-Cardiovasc Imag. 2012;5(1):7–92. doi: 10.1016/j.jcmg.2011.08.017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.黄韫栀, 刘奇, 肖勇 基于超声RF信号的超声成像实验设计. 实验科学与技术. 2016;14(6):32–35, 84. doi: 10.3969/j.issn.1672-4550.2016.06.009. [DOI] [Google Scholar]
- 35.周志华. 机器学习. 北京: 清华大学出版社, 2016.








