Abstract
本文旨在研究中药乳浆大戟抑制多药耐药人胃癌细胞增殖、迁移、侵袭的作用,以及诱导细胞凋亡的作用及其作用通路。用不同浓度的乳浆大戟提取液处理人胃癌多药耐药 SGC7901/ADR 细胞,MTT 试验观察细胞增殖抑制情况,Hochest33528 染色荧光显微镜观察凋亡细胞核形态并测定凋亡指数,流式细胞术测定细胞凋亡率,Transwell 法检测细胞迁移能力和侵袭能力,分光光度法检测 caspase-3 和 caspase-9 的酶活性表达,Western blotting 检测细胞色素 c 的亚细胞分布。结果发现,乳浆大戟提取液对人胃癌多药耐药 SGC7901/ADR 细胞有明显的增殖抑制作用,该作用具有时间和浓度依赖性。乳浆大戟提取液处理的人胃癌多药耐药 SGC7901/ADR 细胞,凋亡指数和凋亡率均比对照组显著升高,并有时间和剂量依赖性;但添加了 caspase 酶抑制剂的细胞,凋亡指数没有明显上升。Transwell 法检测显示,乳浆大戟提取液处理后的 SGC7901/ADR 细胞,迁移能力和侵袭能力显著下降。分光光度法检测发现,乳浆大戟提取液处理后的 SGC7901/ADR 细胞中,caspase-3 和 caspase-9 表达均增加,与对照组有明显差异。Western blotting 检测显示,细胞色素 c 在线粒体中的分布下降,在细胞质中的分布上升(即细胞色素 c 从线粒体向细胞质逸出)。研究表明,乳浆大戟提取液具有抑制人胃癌多药耐药 SGC7901/ADR 细胞增殖、抑制细胞迁移侵袭和诱导细胞凋亡的作用;乳浆大戟提取液诱导细胞凋亡的作用有细胞色素 c、caspase-9 和 caspase-3 的参与,提示内源性或线粒体凋亡通路。
Keywords: 乳浆大戟, 胃癌, 多药耐药, 细胞增殖, 细胞迁移, 细胞侵袭, 细胞凋亡
Abstract
This paper aims to study the effects of traditional Chinese medicine Euphorbia esula on multidrug resistant human gastric cancer cells in the cell proliferation, migration, invasion and apoptosis, and to study the apoptosis-inducing pathway. Different dilutions of Euphorbia esula extract were used to process human multidrug resistant gastric cancer SGC7901/ADR cells. Cell proliferation inhibition phenomenon was determined by MTT experiment. Nuclear morphological changes of apoptotic cells and apoptotic indexes were observed and determined by Hochest33528 staining followed with fluorescence microscope observing. Flow cytometry was used to detect cell apoptosis rate. Cell migration and invasion ability were observed and determined by Transwell method. Spectrophotometry was used to detect caspase-3 and caspase-9 enzyme activity. Western blotting was used to detect subcellular distribution of cytochrome c. The results showed that Euphorbia esula extract had obvious inhibition effect on proliferation of gastric cancer multidrug resistant SGC7901/ADR cells, which was time- and concentration-dependent. After processing multidrug resistant gastric cancer SGC7901/ADR cells with Euphorbia esula extract, the apoptotic index and apoptosis rate were significantly increased than those in the control group, which showed a time- and dose-dependent mode; but if a caspase inhibitor was added, apoptosis index was not obviously increased. Transwell method showed that migration and invasion ability of the Euphorbia esula extract-processed SGC7901/ADR cells dropped significantly. Spectrophotometry showed that in Euphorbia esula extract-processed SGC7901/ADR cells, caspase-3 and caspase-9 expression were increased, which had significant differences with the control group. Western blotting test showed that the distribution of cytochrome c decreased in mitochondria, while increased in the cytoplasm (i.e., cytochrome c escaped from mitochondria to the cytoplasm). In conclusion, Euphorbia esula extract could inhibit the proliferation, migration and invasion, and induce apoptosis in human gastric cancer multidrug resistant SGC7901/ADR cells; and cytochrome c, caspase-9 and caspase-3 might be involved in cell apoptosis induced by Euphorbia esula extract, suggesting endogenous or mitochondrial apoptotic pathway.
Keywords: Euphorbia esula, gastric cancer, multidrug resistance, cell proliferation, cell migration, cell invasion, cell apoptosis
引言
胃癌(gastric carcinoma)是全世界特别是东亚国家常见的一种恶性肿瘤,在我国其发病率近年分别为乡村和城市所有恶性肿瘤发病率的第一和第二位[1-2]。早期胃癌的治疗多以外科手术为主,手术后辅以化学药物治疗,而对进展期的胃癌或中晚期的胃癌,其治疗措施以化学药物治疗为主[3]。但是因为胃癌细胞经常对化学治疗药物产生多药耐药(multiple drug resistance,MDR),从而影响了其治疗效果[4-5]。所以,研究能够拮抗或逆转胃癌细胞多药耐药性的药物对提高胃癌化学治疗的疗效有非常重要的意义。乳浆大戟(拉丁学名 Euphorbia esula Linn)亦称乳浆草,是大戟科大戟属的一种多年生草本植物,其地上部分可作为药材,在多种中药材书籍或文献中有记载。文献报道民间用乳浆大戟汁液涂抹治疗皮肤疣和地上全草煎服辅助治疗恶性肿瘤。研究已经发现,乳浆大戟的全草提取液能够有效地抑制非耐药的人胃癌细胞系 SGC7901 的增殖并诱导其发生显著的凋亡[6]。本文研究了乳浆大戟提取物对人胃癌多药耐药细胞系 SGC7901/ADR 增殖、迁移和侵袭的抑制作用,并研究了乳浆大戟提取物对该细胞系的凋亡诱导作用及其基本作用途径,旨在探寻一种可以拮抗或逆转人胃癌多药耐药的天然药物。
1. 材料与方法
1.1. 主要实验材料
人胃癌多药耐药细胞株 SGC7901/ADR 由第四军医大学西京消化病医院实验室馈赠;乳浆大戟提取液由本实验室自己制备;胎牛血清(fetal bovine serum,FBS)购自杭州四季青生物公司;RPMI-1640 细胞培养基和胰蛋白酶为 Gibco 公司产品;MTT 试剂、二甲基亚砜、Hochest33528 和碘化丙啶购自美国 Sigma 公司;Caspase 比色试剂盒为南京生物技术有限公司产品;细胞培养板(6 孔、96 孔)为丹麦 Cyclone 公司产品;流式细胞仪为美国 Beckman 公司产品;倒置荧光显微镜为日本 Olympus 公司产品;聚丙烯酰胺凝胶电泳分离与 Western blotting 电转膜设备和酶标仪均为美国 Bio-Rad 公司产品。
1.2. 细胞培养和耐药性维持
人胃癌多药耐药细胞株 SGC7901/ADR 用含 100 U/mL 青霉素和 100 μg/mL 链霉素的 10% FBS RPMI-1640 培养液,在饱和湿度的无菌条件下 37℃ 与 5% CO2 常规培养;每隔 2 d 更换培养液 1 次;当细胞生长铺满瓶底接近 80% 时进行传代。所有培养过程中均在培养液中加入终浓度为 0.1 μg/mL 的阿霉素以维持细胞的耐药性。
1.3. 细胞生长抑制实验
乳浆大戟提取液用含 10% FBS 的 RPMI-1640 培养液配制成六个不同的浓度:20、40、80、160、320、640 μg/mL。将处于对数生长的多药耐药人胃癌 SGC7901/ADR 细胞,用 0.25% 胰蛋白酶消化,用含 10% FBS 的 RPMI-1640 细胞培养液配成浓度为 1 × 104/mL 的单细胞悬液,接种 96 孔培养板,每孔 0.1 mL,37℃、5% CO2 孵育 24 h 后,弃去旧的培养液,将不同浓度的乳浆大戟提取液按每孔 0.2 mL 加入培养孔,每个浓度 6 个复孔,并设正常细胞对照 6 个复孔(不含乳浆大戟的 10% FBS RPMI-1640 细胞培养液),37℃、5% CO2 饱和湿度培养。培养 24 h 或 48 h 后,加入 5% MTT 溶液,20 μL/孔(终浓度 5 mg/mL),37℃、5% CO2 继续培养 4 h,弃去各细胞孔的培养液,每孔加入 100 μL 二甲基亚砜,缓慢振荡 10 min,充分溶解结晶,用酶标仪在 570 nm 波长处读取吸光值(A 值)。用只含 10% FBS RPMI-1640 培养液的孔调零,计算 6 个复孔的算术平均值,并按以下公式计算细胞生长抑制率:抑制率 =(未加药细胞对照孔的平均 A 值 — 乳浆大戟处理孔的平均 A 值)/未加药细胞对照孔的平均 A 值 × 100%。
1.4. 凋亡核形态观察和凋亡指数测定
将人胃癌多药耐药细胞 SGC7901/ADR 在 10% FBS RPMI-1640 培养液中 37℃、5% CO2 培养至对数生长期,用 0.25% 胰蛋白酶消化细胞后配成浓度 1 × 104/mL 的单细胞悬液,将细胞接种于 6 孔板,每孔接种 2 mL,5% CO2、37℃ 培养 24 h,弃去旧的培养液,分成 3 组进行试验:乳浆大戟组加入用 10% FBS RPMI-1640 细胞培养基稀释的 80 μg/mL 的乳浆大戟提取液,caspase 酶抑制组在乳浆大戟组的基础上加入终浓度为 15 μmol/L 的 Z-VAD-FMK,对照组只加 10% FBS RPMI-1640 细胞培养液,每孔均加 4 mL,5% CO2、37℃ 饱和湿度培养。在第 24、48、72 小时三个时间点收集细胞,以 4% 甲醛溶液固定,用 Hochest33528 染色,在荧光显微镜下观察细胞核形态并计数凋亡细胞数。细胞核缩小、浓染、染色质出现凝聚(染色不均匀)者为凋亡细胞。取 5 个随机视野,每个视野总共计数 400 个细胞并计数其中的凋亡细胞数。按公式计算细胞凋亡指数:细胞凋亡指数 =(凋亡细胞数/细胞总数)× 100%。
1.5. 流式细胞术检测细胞凋亡率
对数生长期的人胃癌多药耐药细胞 SGC7901/ADR,以 0.25% 胰蛋白酶消化,用含 10% FBS 的 RPMI-1640 细胞培养液配制成 1 × 104/mL 的单细胞悬液,接种于 6 孔板,每孔 2 mL,37℃、5% CO2 培养 24 h,观察细胞生长良好,弃去原培养液,加入用 10% FBS RPMI-1640 细胞培养液稀释的不同浓度(40、80、160 μg/mL)的乳浆大戟提取液,每孔加 4 mL,并以不含乳浆大戟的 10% FBS RPMI-1640 培养液作对照组。继续培养 24、48 和 72 h 后,每孔分别收集 1 × 106个细胞,以 1 000 r/min 离心 7 min,弃去上清液,用磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤 2 次。加入在 4℃ 预冷的 500 μL 70% 乙醇,4℃ 下固定 1 h,1 000 r/min 离心 7 min,弃去上清液,再用 PBS 洗涤 2 次后用 3 mL PBS 重悬细胞。每管加碘化丙啶溶液 1 mL,充分混匀后室温下避光静置 30 min,用流式细胞仪进行检测。每组 3 个样本,每个样本检测 10 000 个细胞,取平均值计算细胞凋亡率:细胞凋亡率 = 凋亡细胞数/(凋亡细胞数十非凋亡细胞数)× 100%。
1.6. Transwell 法检测细胞迁移能力和侵袭能力
收集不同浓度(40、80、160 μg/mL)的乳浆大戟稀释液处理 24 h 后的人胃癌多药耐药 SGC7901/ADR 细胞,用不含血清的 RPMI-1640 细胞培养基配置成 1 × 105/mL 的细胞悬液,同样方法配制未用药物处理的细胞作为对照。将细胞悬液 100 μL 加入 Transwell 的上室,并向 Transwell 的下室加入 600 μL 含 10% FBS 的 RPMI-1640 细胞培养基。37℃、5% CO2 饱和湿度下培养 24 h 后取出 Transwell,用棉签轻轻擦去上室中的细胞,迁移至下室的细胞用 4% 多聚甲醛溶液室温固定 30 min,加 0.1% 结晶紫染液 2 mL 染色 10 min。在 200 倍光学显微镜下随机选 5 个视野,计数每个视野的细胞数目(迁移细胞数),取平均值比较乳浆大戟稀释液对 SGC7901/ADR 细胞迁移的抑制情况。
将 Matrigel 胶与无血清 RPMI-1640 培养基按 1∶4 稀释并混匀,取 50 μL 加入 Transwell 小室的膜上,置 37℃ 培养箱中 3 h 使其固态化。按上述方法准备细胞和对照,在有 Matrigel 胶的 Transwell 上室中加入细胞悬液 200 μL,并向下室加入 600 μL 含 10% FBS 的 RPMI-1640 培养基,37℃、5% CO2、饱和湿度培养 48 h。取出 Transwell,用棉签拭去上室中的 Matrigel 胶和细胞,侵袭入下室细胞用 4% 多聚甲醛溶液室温固定 30 min,加 0.1% 结晶紫染液 2 mL 染色 10 min。在 200 倍光学显微镜下随机选取 5 个视野,计数每个视野的细胞数目(侵袭细胞数),取平均值比较乳浆大戟稀释液对 SGC7901/ADR 细胞侵袭的抑制情况。
1.7. 分光光度法检测 caspase-3 和 caspase-9 活性
人胃癌多药耐药 SGC7901/ADR 细胞在 37℃、5% CO2 的饱和湿度条件下常规培养,细胞增殖至对数生长期时以 80 mg/L 乳浆大戟提取液进行处理,48 h 后收集细胞,用预冷的 PBS 洗 2 遍,去掉上清,加预冷的细胞裂解缓冲液(Caspase 比色试剂盒,南京生物技术有限公司),每 2 × 106 细胞加 50 μL,置冰浴 30 min,期间轻摇 3 次,每次 10 s。裂解产物以 12 000 r/min、4℃ 离心 20 min,取上清放入新的离心管,并置冰上。按照 Caspase 比色试剂盒说明书立即测定 caspase-3 和 caspase-9 活性。酶标仪读
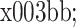 = 405 nm 处的 A 值。以未用乳浆大戟处理的 SGC7901/ADR 细胞做阴性对照。
= 405 nm 处的 A 值。以未用乳浆大戟处理的 SGC7901/ADR 细胞做阴性对照。
1.8. Western blotting 检测细胞色素 c 的亚细胞分布情况
收集用 80 μg/mL 的乳浆大戟稀释液处理 24 h 后的人胃癌多药耐药 SGC7901/ADR 细胞,用预冷的 PBS,1 200 r/min、7 min 离心洗 3 遍,弃上清,用预冷的细胞浆提取缓冲液重悬细胞沉淀,用超声波破碎仪裂解细胞,1 500 r/min 离心 10 min,收集上清,10 000 r/min、4℃ 离心 30 min,收集上清液(为细胞浆成分,不含细胞器和线粒体),并用线粒体提取缓冲液重悬沉淀(含线粒体),涡旋混匀器混匀 10 s。用 BCA 法对样品进行蛋白定量,上样做 SDS-聚丙烯酰胺凝胶电泳,电转至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜,用 5% 脱脂奶粉封闭 1 h,PBS 漂洗 3 次,加一抗(兔抗人细胞色素 c 单克隆抗体),4℃ 孵育过夜,PBS 漂洗 3 次,加二抗(HPR 标记的羊抗兔抗体)室温孵育 1 h,洗膜后加入显色剂显色观察条带。以电压依赖性阴离子通道(voltage-dependent anion channels,VDAC)蛋白作为线粒体蛋白的内参照,以 β-actin 作为细胞质蛋白的内参照,以未用乳浆大戟稀释液处理的 SGC7901/ADR 细胞做阴性对照。
1.9. 统计学分析
数据以均数±标准差形式表示,用 SPSS19.0 统计软件做统计学分析,两组数据间的比较用 t 检验,多组数据比较用单因素方差分析,率的比较用 χ2 检验。P < 0.05 表示差异有统计学意义。
2. 结果
2.1. MTT 实验显示乳浆大戟对细胞的增殖有抑制作用
不同稀释度的乳浆大戟提取液处理人胃癌多药耐药细胞 SGC7901/ADR 后,MTT 检测结果显示,乳浆大戟稀释液明显地抑制了多药耐药人胃癌 SGC7901/ADR 细胞的增殖活性,与不加药的对照组比较,差异有统计学意义(P < 0.05);而且随着药物浓度的增加和作用时间的延长,抑制作用呈现逐渐增强的趋势,并有统计学意义( P < 0.05)。具体结果见 表 1。
表 1. Inhibition of SGC7901/ADR cell proliferation by Euphorbia esula extract (n = 6).
乳浆大戟对 SGC7901/ADR 细胞增殖的抑制作用(n = 6)
| 乳浆大戟浓度/
(μg·mL–1) |
平均 A490 值(
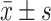 )
)
|
抑制率(%) | |||
| 24 h | 48 h | 24 h | 48 h | ||
| △与对照组比较 P < 0.05, #与前一浓度组比较 P < 0.05, *与 24 h 组抑制率比较 P < 0.05 | |||||
| 0 | 0.812 ± 0.079 | 0.789 ± 0.085 | 0.00 | 0.00 | |
| 20 | 0.714 ± 0.093△ | 0.703 ± 0.087△ | 12.1 | 10.9* | |
| 40 | 0.656 ± 0.080△,# | 0.593 ± 0.092△,# | 19.2 | 24.8* | |
| 80 | 0.417 ± 0.094△,# | 0.387 ± 0.086△,# | 48.6 | 51.0* | |
| 160 | 0.352 ± 0.069△,# | 0.290 ± 0.077△,# | 56.7 | 63.2* | |
| 320 | 0.274 ± 0.071△,# | 0.216 ± 0.081△, | 66.3 | 72.6* | |
| 640 | 0.229 ± 0.081△,# | 0.212 ± 0.090△,# | 71.8 | 73.1* | |
2.2. 乳浆大戟处理细胞后荧光显微镜检测显示凋亡指数升高
乳浆大戟稀释液处理后的人胃癌多药耐药细胞 SGC7901/ADR,经 Hochest33528 染色后在荧光显微镜下观察,可见细胞核体积缩小、形状不规则、荧光染色增强和染色不均匀(染色体凝聚化)等细胞凋亡的形态学改变。凋亡细胞计数和凋亡指数计算的结果显示,乳浆大戟处理后的 SGC7901/ADR 细胞凋亡指数显著升高,与对照组比较差异有统计学意义(P < 0.01);但是,在乳浆大戟处理同时加了 caspase 酶抑制剂的细胞(caspase 抑制组),凋亡指数上升不明显,与对照组比较差异没有统计学意义( P > 0.05)。具体结果见 表 2。
表 2. The apoptotic index of SGC7901/ADR cells treated by Euphorbia esula extract.
人胃癌多药耐药细胞 SGC7901/ADR 经乳浆大戟处理后的凋亡指数
| 组别(n = 5) | 乳浆大戟浓度/(μg·mL–1) | 凋亡指数(%) | ||
| 24 h | 48 h | 72 h | ||
| △与对照组比较 P < 0.01, #与乳浆大戟组比较 P < 0.05, *与前一时间组比较 P < 0.05 | ||||
| 乳浆大戟组 | 80 | 12.34 ± 3.95△,# | 17.03 ± 4.55△,#,* | 25.32 ± 4.98△,#,* |
| caspase 抑制组 | 80 | 3.47 ± 2.07 | 3.93 ± 2.13 | 4.19 ± 2.32 |
| 对照组 | 0 | 2.56 ± 1.95 | 2.78 ± 2.01 | 2.89 ± 2.13 |
2.3. 流式细胞术检测显示乳浆大戟处理后细胞凋亡率上升
人胃癌多药耐药细胞 SGC7901/ADR 经梯度稀释的乳浆大戟提取液处理 24、48、72 h 后,用流式细胞仪检测细胞凋亡情况,可以看到各药物浓度组 SGC7901/ADR 细胞的凋亡率显著上升,与未加药的对照组比较有明显差异(P < 0.01),并可见细胞凋亡率随药物浓度增加和作用时间延长而升高,且有统计学意义( P < 0.05)。具体结果见 表 3。
表 3. The apoptotic rate of SGC7901/ADR cells treated by Euphorbia esula extract (n = 3).
人胃癌多药耐药细胞 SGC7901/ADR 经乳浆大戟处理后 的凋亡率(n = 3)
| 乳浆大戟浓度/
(μg·mL–1) |
凋亡率(%) | ||
| 24 h | 48 h | 72 h | |
| 各试验组凋亡率与对照组比较均 P < 0.01; △与前一浓度组比较 P < 0.05, #与前一时间组比较 P < 0.05 | |||
| 0 | 3.96 ± 1.09 | 4.13 ± 1.64 | 4.70 ± 1.82 |
| 40 | 11.33 ± 1.96 | 16.65 ± 2.09# | 14.65 ± 2.96# |
| 80 | 18.42 ± 2.97△ | 27.14 ± 3.85△,# | 29.57 ± 4.43△,# |
| 160 | 29.01 ± 3.96△ | 31.88 ± 4.63△,# | 36.93 ± 5.07△,# |
2.4. Transwell 法检测显示乳浆大戟可抑制细胞迁移和侵袭
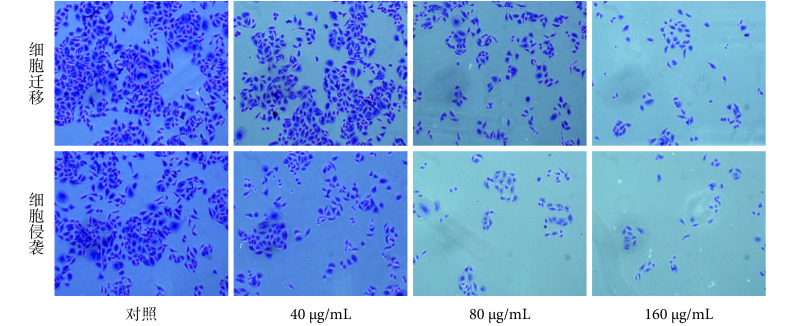
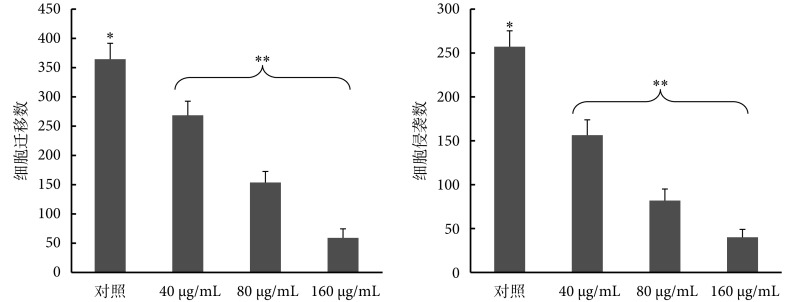
Transwell 法检测迁移能力的结果显示,乳浆大戟提取液处理后的人胃癌多药耐药 SGC7901/ADR 细胞的迁移能力显著下降,与对照组比较差异有统计学意义(P < 0.05);而且,随着药物浓度的增加抑制效果更加明显,差异亦有统计学意义( P < 0.05)。具体结果见 图 1、图 2。
图 1.
SGC7901/ADR cell migration and invasion after Euphorbia esula extract treatment (200 ×)
乳浆大戟处理 SGC7901/ADR 后的细胞迁移和细胞侵袭(200 ×)
图 2.
Migration number and invasion number of SGC7901/ADR cells treated by Euphorbia esula extract
乳浆大戟处理 SGC7901/ADR 后的细胞迁移数和细胞侵袭数
*each testing group compared to the control group, P < 0.05; **compared to each previous concentration, P < 0.05
*乳浆大戟提取液各浓度组与对照组比较,P < 0.05;**各相邻梯度浓度之间比较, P < 0.05
Transwell 法检测细胞侵袭能力的结果显示,乳浆大戟提取液能抑制人胃癌多药耐药 SGC7901/ADR 细胞的侵袭能力,不同浓度的乳浆大戟稀释液与对照组比较差异均有统计学意义(P < 0.05);而且,该抑制作用呈现剂量依赖性,不同浓度乳浆大戟组间对细胞侵袭力的抑制效果有明显差异,且有统计学意义( P < 0.05)。具体结果见 图 1、图 2。
2.5. 分光光度法检测显示乳浆大戟处理后细胞中 caspase 酶活性升高
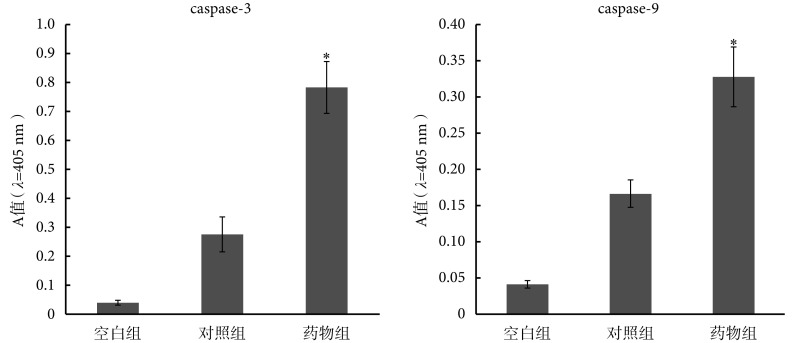
分光光度法 caspase 活力测定结果显示:以 80 mg/L 的乳浆大戟提取液处理人胃癌多药耐药 SGC7901/ADR 细胞后,表示 caspase-3 酶活力的 A 值在对照组和药物组分别为 0.275 和 0.782,二者差异有统计学意义(P < 0.01);表示 caspase-9 酶活力的 A 值在对照组和药物组分别为 0.166 和 0.327,二者差异亦有统计学意义( P < 0.01)。具体结果见 图 3。说明乳浆大戟提取液处理 SGC7901/ADR 细胞后,参与内源性凋亡通路的 caspase-9 以及细胞中的凋亡执行蛋白 caspase-3 被活化。
图 3.
Relative expressions of caspase-3 and caspase-9 in Euphorbia esula extract treated-SGC7901/ADR cells
乳浆大戟提取液处理后 SGC7901/ADR 细胞中 caspase-3 和 caspase-9 的相对表达活性
*compared to the control group, P < 0.01
*与对照组比较,P < 0.01
2.6. Western blot 显示乳浆大戟处理后细胞色素 c 从线粒体向细胞质逸出
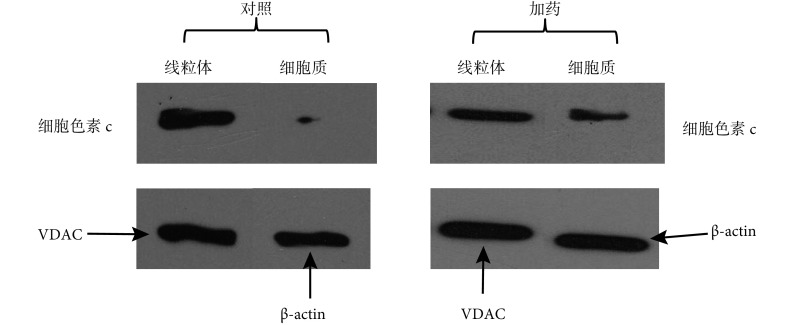
Western blotting 检测分析发现,未用乳浆大戟提取液处理的 SGC7901/ADR 细胞对照,细胞色素 c 主要分布于线粒体内,细胞质内含量很少。经 80 μg/mL 的乳浆大戟提取液处理 24 h 后的 SGC7901/ADR 细胞,线粒体内细胞色素 c 含量明显减少,细胞质中的细胞色素 c 含量明显增加,表示经乳浆大戟提取液处理后,SGC7901/ADR 细胞中的细胞色素 c 从线粒体逸出到细胞质。具体结果见图 4。
图 4.
The sub-cellular distribution of cytochrome c in Euphorbia esula extract treated-SGC7901/ADR cells
乳浆大戟提取液处理后 SGC7901/ADR 细胞中细胞色素 c 亚细胞分布改变
3. 讨论
肿瘤的发生是由于各种致瘤因素的作用导致细胞的正常调控机制发生异常使细胞增殖和细胞凋亡失去平衡的结果;诱导细胞凋亡并抑制其增殖,是多年来国际上对恶性肿瘤预防和治疗的一个非常重要的研究领域。在我国,从中药材中寻找选择能够抑制肿瘤细胞增殖和诱导肿瘤细胞凋亡的有效或活性成分,是多年来抗肿瘤研究的一个重点[7-8]。特别是这几年来因中药研究获得了国际性的大奖,对中药抗癌的研究更加受到重视。
肿瘤多药耐药这个术语指的是肿瘤一旦对一种化学治疗药物产生了耐药性,就会对许多种化学结构不同和作用机制不同的化学治疗药物出现交叉性耐药的一种现象。肿瘤形成多药耐药的方式有多种,包括细胞膜上 ABC 转运蛋白超家族的 P-糖蛋白(亦称多药耐药蛋白 1)表达上调使肿瘤细胞对进入细胞内的药物向胞外的排出增加、肿瘤细胞抑制或逃避细胞凋亡(比如影响 bcl-2 和 Bax 等的表达)、药物在肿瘤细胞内被氧化降解或灭活的速度增快,以及肿瘤细胞通过改变代谢而增强 DNA 修复能力或减低药物的毒性等[9-14]。多年来,对肿瘤多药耐药的研究在国内外一直受到重视,但这一问题至今仍未能够解决。逆转或拮抗肿瘤多药耐药目前仍然是国际上肿瘤治疗研究的重点和热点之一;而中药因毒副作用比较小和作用靶点比较多等特点,在逆转或拮抗肿瘤多药耐药方面具有一定甚至是明显的优势[15-17]。
乳浆大戟在中国和欧洲国家均有分布,在我国它是大戟属植物分布最广泛的一个种。乳浆大戟的变异幅度比较大,常因生长环境的不同而产生多种多样的变异,包括植株大小、叶型和苞叶形状等的明显不同。和乳浆大戟非常相似的一种植物叫猫眼草,这两种植物在外观上很难区分,最新出版的《中国植物志》将二者合并为一种植物并保留了乳浆大戟这个名称[18]。在中药材书籍和文献中乳浆大戟被描述为归胃、肺等经脉,味苦而性寒凉,有微毒,有散结、消肿以及拔毒等作用[19]。近年来国内多项研究显示,乳浆大戟和大戟科的另外一些种的植物提取物具有很好的诱导多种恶性肿瘤细胞凋亡和抑制多种恶性肿瘤细胞增殖的作用[20-29]。
本文探讨了乳浆大戟全草提取物对多药耐药人胃癌 SGC7901/ADR 细胞系增殖、迁移以及侵袭的抑制现象,研究了乳浆大戟全草提取物对 SGC7901/ADR 细胞凋亡的诱导作用及其基本机制。具体包括:用 MTT 研究了乳浆大戟对 SGC7901/ADR 细胞系的增殖抑制作用,用 Hochest33528 染色荧光显微镜观察研究了乳浆大戟处理 SGC7901/ADR 细胞后细胞核形态的改变及其对细胞凋亡指数的影响(同时设 caspase 酶抑制剂对照和不加药细胞对照),用流式细胞仪分析了乳浆大戟处理 SGC7901/ADR 细胞后细胞凋亡率的改变,用 Transwell 法研究了乳浆大戟对 SGC7901/ADR 细胞的迁移和侵袭能力的抑制作用,用分光光度法研究了 SGC7901/ADR 细胞内 caspase-3 和 caspase-9 酶活性升高的情况,用 Western blotting 检测了 SGC7901/ADR 细胞内细胞色素 c 在线粒体和细胞质的分布情况。结果发现,乳浆大戟对多药耐药的 SGC7901/ADR 细胞具有明显的抑制细胞增殖、抑制细胞迁移侵袭和诱导细胞凋亡的作用;经乳浆大戟作用后的 SGC7901/ADR 细胞,caspase-3 和 caspase-9 两种凋亡蛋白活性升高,但在乳浆大戟处理细胞的同时如加入 caspase 酶抑制剂,则细胞凋亡指数没有明显上升;乳浆大戟作用后的 SGC7901/ADR 细胞,细胞色素 c 部分地从线粒体逸出而分布于细胞质。以上结果提示,乳浆大戟诱导 SGC7901/ADR 细胞凋亡的机制可能属于内源性或线粒体途径。这项研究为利用中药乳浆大戟对抗或逆转胃癌多药耐药性从而进行胃癌或其他癌症的辅助治疗奠定了一定的基础。
Funding Statement
国家自然科学基金项目(81760732);陕西省科学技术研究发展计划项目(2016SF-280);陕西省卫生计生科研基金项目(2016D075)
References
- 1.Siegel R L, Miller K D, Jemal A Cancer statistics, 2015. CA Cancer J Clin. 2015;65(1):5–29. doi: 10.3322/caac.21254. [DOI] [PubMed] [Google Scholar]
- 2.邹文斌, 李兆申 中国胃癌发病率及死亡率研究进展. 中国实用内科杂志. 2014;34(4):408–415. [Google Scholar]
- 3.Mihmanli M, Ilhan E, Idiz U O, et al Recent developments and innovations in gastric cancer. World J Gastroenterol. 2016;22(17):4307–4320. doi: 10.3748/wjg.v22.i17.4307. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.An X, Sarmiento C, Tan T, et al Regulation of multidrug resistance by microRNAs in anti-cancer therapy. Acta Pharm Sin B. 2017;7:38–51. doi: 10.1016/j.apsb.2016.09.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Zhang Dexin, Fan Daiming New insights into the mechanisms of gastric cancer multidrug resistance and future perspectives. Future Oncol. 2010;6(4):527–537. doi: 10.2217/fon.10.21. [DOI] [PubMed] [Google Scholar]
- 6.Fu Zhaoying, Han Xiaodong, Wang Aihong, et al Apoptosis of human gastric carcinoma cells induced by Euphorbia esula latex . World J Gastroenterol. 2016;22(13):3564–3572. doi: 10.3748/wjg.v22.i13.3564. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.高枫, 符兆英 天然产物诱导肿瘤细胞凋亡作用机制的研究进展. 中华肿瘤防治杂志. 2011;18(7):557–560. [Google Scholar]
- 8.Hu Bing, An Hongmei, Wang Shuangshuang, et al Preventive and therapeutic effects of Chinese herbal compounds against hepatocellular carcinoma. Molecules. 2016;21(2):142. doi: 10.3390/molecules21020142. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Wang Ying, Wu Kaichun, Yang Zhiping, et al Multidrug-resistance related long non-coding RNA expression profile analysis of gastric cancer. PLoS One. 2015;10(8):e0135461. doi: 10.1371/journal.pone.0135461. [DOI] [PMC free article] [PubMed] [Google Scholar] [Retracted]
- 10.Ye Xiaolei, Zhao Yarong, Weng Guobin, et al IL-33-induced JNK pathway activation confers gastric cancer chemotherapy resistance. Oncol Rep. 2015;33(6):2746–2752. doi: 10.3892/or.2015.3898. [DOI] [PubMed] [Google Scholar]
- 11.Shang Yulong, Feng Bin, Zhou Lin, et al The miR27b-CCNG1-P53-miR-508-5p axis regulates multidrug resistance of gastric cancer. Oncotarget. 2016;7(1):538–549. doi: 10.18632/oncotarget.6374. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Kopczyńska E Role of microRNAs in the resistance of prostate cancer to docetaxel and paclitaxel. Contemp Oncol (Pozn) 2015;19(6):423–427. doi: 10.5114/wo.2015.56648. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Souza P S, Madigan J P, Gillet J P, et al Expression of the multidrug transporter P-glycoprotein is inversely related to that of apoptosis-associated endogenous TRAIL. Exp Cell Res. 2015;336(2):318–328. doi: 10.1016/j.yexcr.2015.06.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.宋敏, 韩雪, 任秀花, 等 GCS 通过影响 bcl-2 的表达介导结肠癌细胞的多药耐药. 世界华人消化杂志. 2016;24(11):1708–1713. [Google Scholar]
- 15.Rauf A, Uddin G, Raza M, et al Reversal of multidrug resistance in mouse lymphoma cells by extracts and flavonoids from Pistacia integerrima . Asian Pac J Cancer Prev. 2016;17(1):51–55. doi: 10.7314/apjcp.2016.17.1.51. [DOI] [PubMed] [Google Scholar]
- 16.米志宽, 符兆英, 王爱红, 等 乳浆大戟抑制原代人胃癌多药耐药细胞增殖和诱导凋亡的研究. 陕西医学杂志. 2017;46(7):836–839. [Google Scholar]
- 17.王炜, 黄赞松, 周喜汉, 等 苦参素逆转人肝癌细胞株 HepG2/ADM 多药耐药的作用. 世界华人消化杂志. 2014;22(10):1409–1416. [Google Scholar]
- 18.中国科学院中国植物志编辑委员会. 乳浆大戟 (E.esula) 中国植物志. 北京: 科学出版社, 2006, 44(3): 125-126
- 19.侯士良. 中药八百种详解. 第 2 版. 郑州: 河南科学技术出版社, 2009: 638
- 20.田红英, 王爱红, 符兆英 新月大戟提取液诱导人胃癌细胞 SGC7901 凋亡的研究. 华西药学杂志. 2014;29(5):527–530. [Google Scholar]
- 21.王爱红, 庞秋霞, 陈美霓, 等 乳浆大戟提取物对人肺癌细胞生长的影响. 山西医科大学学报. 2014;45(6):460–464. [Google Scholar]
- 22.涂金晶, 王磊, 任清泉, 等 乳浆大戟抑制人宫颈癌细胞增殖迁移和诱导细胞凋亡的研究. 延安大学学报:医学科学版. 2016;14(4):1–5. [Google Scholar]
- 23.王文博, 韩肖肖, 符兆英, 等 乳浆大戟增加多药耐药胃癌细胞对化疗药敏感性的研究. 延安大学学报: 医学科学版. 2017;15(4):1–6. [Google Scholar]
- 24.Fu Zhaoying, Han Xiaodong, Du Juan, et al Euphorbia lunulata extract acts on multidrug resistant gastric cancer cells to inhibit cell proliferation, migration and invasion, arrest cell cycle progression, and induce apoptosis . J Ethnopharmacol. 2018;212:8–17. doi: 10.1016/j.jep.2017.08.014. [DOI] [PubMed] [Google Scholar]
- 25.Gao Feng, Fu Zhaoying, Tian Hongying, et al The euphorbia lunulata Bge extract inhibits proliferation of human hepatoma HepG2 cells and induces apoptosis. J BUON. 2013;18(2):491–495. [PubMed] [Google Scholar]
- 26.Cheng Junsheng, Han Wei, Wang Zheyuan, et al Hepatocellular carcinoma growth is inhibited by Euphorbia helioscopia L. extract in nude mice xenografts . Biomed Res Int. 2015;2015:601015. doi: 10.1155/2015/601015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Cheng Fangfang, Yang Yanjing, Zhang Li, et al A natural triterpene derivative from Euphorbia kansui inhibits cell proliferation and induces apoptosis against rat intestinal epithelioid cell line in vitro . Int J Mol Sci. 2015;16(8):18956–18975. doi: 10.3390/ijms160818956. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Yan Xiaojing, Zhang Li, Cao Yudan, et al An ingenol derived from Euphorbia kansui induces hepatocyte cytotoxicity by triggering G0/G1 cell cycle arrest and regulating the mitochondrial apoptosis pathwayin vitro . Molecules. 2016;21(6):pii: E813. doi: 10.3390/molecules21060813. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Han M H, Lee W S, Nagappan A, et al Polyphenols from Korean prostrate spurge Euphorbia supina induce apoptosis through the Fas-associated extrinsic pathway and activation of ERK in human leukemic U937 cells . Oncol Rep. 2016;36(1):99–107. doi: 10.3892/or.2016.4778. [DOI] [PMC free article] [PubMed] [Google Scholar]