Abstract
帕金森病(PD)患者的运动功能障碍是其主要的临床症状和诊断依据。本文共招募 30 名受试者,其中包括 15 例 PD 患者(PD 组)和 15 例健康受试者(对照组),然后将 5 个惯性传感器节点分别佩戴在受试者的四肢和腰部,通过提取和分析受试者在 6 个范式动作下的加速度、角速度信号,得到 20 个评估不同身体部位运动功能的定量指标,包含动作的幅度、频率以及疲劳程度等信息。通过对两组受试者的数据进行对比分析,使用误差反向传播(BP)神经网络进行自动判别并预测患者临床量表评分。最终统计结果表明,两组受试者的多数指标的差异均有统计学意义;10 次 5 折交叉验证表明,BP 神经网络对两个受试组的分类准确率达 90%,对 PD 组的亨-雅(H-Y)分期和统一帕金森氏病评分量表运动功能(UPDRS Ⅲ)评分的预测准确率分别为 72.80% 和 68.64%。该研究表明了利用可穿戴设备来对 PD 患者运动症状进行定量评估的可行性,文中所获得的定量指标对于今后的相关研究也具有一定的参考价值。
Keywords: 帕金森病, 运动功能, 可穿戴设备, 定量评定
Abstract
Motor dysfunction is the main clinical symptom and diagnosis basis of patients with Parkinson’s disease (PD). A total of 30 subjects were recruited in this study, including 15 PD patients (PD group) and 15 healthy subjects (control group). Then 5 wearable inertial sensor nodes were worn on the bilateral upper limbs, lower limbs and waist of subjects. When completing the 6 paradigm tasks, the acceleration and angular velocity signals from different parts of the body were acquired and analyzed to obtain 20 quantitative parameters which contain information about the amplitude, frequency, and fatigue degree of movements to assess the motor function. The clinical data of the two groups were statistically analyzed and compared, and then Back Propagation (BP) Neural Network was used to classify the two groups and predict the clinical score. The final results showed that most of the parameters had significant difference between the two groups, ten times of 5-fold cross validation showed that the classification accuracy of the BP Neural Network for the two groups was 90%, and the predictive accuracy of Hoehn-Yahr (H-Y) staging and unified PD rating scale (UPDRS) Ⅲ score of the patients were 72.80% and 68.64%, respectively. This study shows the feasibility of quantitative assessment of motor function in PD patients using wearable sensors, and the quantitative parameters obtained in this paper may have reference value for future related research.
Keywords: Parkinson’s disease, motor function, wearable sensors, quantitative assessment
引言
帕金森病(Parkinson’s disease,PD)是一种神经系统退行性疾病,在临床上表现出的运动症状主要包括震颤、肌强直、运动障碍和运动迟缓等[1-2]。随着人口老龄化问题的日益严重,PD 发病率也逐年增高,给患者家庭和整个社会都带来沉重的负担[3]。对 PD 的临床诊断通常使用一系列量表如统一帕金森氏病评分量表(unified Parkinson’s disease rating scale,UPDRS)来进行判定[4],将这些量表用于 PD 诊断虽然简单易行但容易存在主观偏差和分级诊断的“天花板效应”[5],导致得到的分值难以准确地反映患病情况。而基于医学传感器的定量评估则是一种较为客观的评估方法,其中对运动功能的检测是其主要的检测项目。它不受检测者主观因素的影响,能敏感地发现运动功能的轻微改变,提高诊断的准确性,可用于 PD 早期诊断、病情评估,亦可对睡眠改善、药物治疗效果等进行评价[6-7]。
随着传感技术和无线通信技术的发展,可穿戴设备已被越来越多地应用到了 PD 的定量评定上,其中利用惯性传感器获得加速度和角速度信号的应用最为广泛。汪丰等[8]设计了一套基于穿戴式无线传感器网络的运动功能评价系统,通过计算人体上下肢和躯干的运动参数,包括动作的幅度、频率、角度等信息来评价 PD 患者运动的协调性和对称性,然而该系统缺少对动作疲劳程度和身体平衡能力的评估。Espay 等[9]通过计算 PD 患者在动作前期和后期的幅度变化评估动作的疲劳程度,但没有结合其他定量指标建立一个患病程度的判别模型。Rigas 等[10]和 Sterpi 等[11]用可穿戴式惯性传感器来评估 PD 患者的震颤和肌强直症状,完成了对正常和患病受试者的自动分类,并建立了不同震颤类型的判别模型,但没有研究患者的运动障碍、运动迟缓等症状。总体来说,目前国内外基于惯性传感器的 PD 定量评估研究已经在临床症状检测、疗效评估上得到了初步的应用[12-13],但多数研究只是针对单一的运动症状或身体部位,缺乏多部位、多指标的定量评估[14]。这与 PD 诊断标准中对运动功能评定的要求相比还有一定差距[15]。
针对以上问题,本文采用 5 个可穿戴的惯性传感器节点分别佩戴在 PD 患者的双侧上肢、双侧下肢和腰部来构建一个覆盖全身主要运动部位的传感器网络;本文规定的试验范式动作是根据 UPDRS 第三部分(UPDRS Ⅲ)运动功能评定条目进行制定的,更符合临床诊断的需求;然后进一步通过多指标的计算和误差反向传播(back propagation,BP)神经网络算法对 30 名受试者(15 名健康受试、15 名 PD 患者)进行运动功能定量评估,最终实现对 PD 患者运动功能的准确全面地定量评定。因此,本文的研究可以证明利用可穿戴设备来对 PD 患者运动症状进行定量评估的可行性,文中所获得的定量指标对于今后的相关研究也具有一定的参照价值。
1. 设备和方法
1.1. 多节点可穿戴惯性传感器
本文采用 5 个可穿戴式传感器节点分别佩戴在受试者的双侧上肢、双侧下肢和腰部,以获取人体主要运动部位的运动信号,如图 1 所示。每个传感器节点尺寸为 39 × 33 × 16 mm3,平均重量为 18 g。节点硬件电路主要包括传感器模块、电源模块和控制器模块[16]。为了减小节点的体积和重量,传感器模块选用 9 轴姿态传感芯片 MPU9250(InvenSense Inc.,美国),采样频率 fs 为 100 Hz,可以同时记录三轴加速度、三轴角速度及三轴磁场信号。其中加速度量程为 ± 16 g,分辨率为 0.48 mg/LSB;陀螺仪量程为 ± 1 000 (°)/s,分辨率为 0.06 (°)/s ·LSB;磁力计量程为 ± 4 800 μT,分辨率为 0.63 μT/LSB。电源采用锂电池供电。控制器模块采用无线微控制芯片 CC3200(TexasInstruments Inc.,美国),主要功能包括低功耗电源管理和无线局域网(wireless fidelity,Wi-Fi)数据传输,不仅能保证设备的长时程工作,还能通过 Wi-Fi 技术实现运动数据的大范围无线通信和组网。试验时使用弹性绑带将 5 个传感器节点分别固定在受试者左手、右手、左腿、右腿和腰部,以确保节点不会发生相对位移或影响运动。传感器节点的实物图以及在人体上对应的穿戴位置如图 1 所示。
图 1.
Multiple-node wearable inertial sensors
多节点可穿戴惯性传感器
1.2. 临床试验
本文试验共招募了 30 名受试者,其中 15 名 PD 患者,定义为:PD 组,包含男性 8 名,女性 7 名,年龄(58.7 ± 7.5)岁,身高(164.9 ± 6.7)cm,体重(68.3 ± 10.9)kg,临床医生给出的亨-雅(Hoehn-Yahr,H-Y)分期为 1~3 期,UPDRS Ⅲ 评分为 6~28 分。PD 组的基本信息及临床量表信息如表 1 所示。对照组相应招募了 15 位正常健康受试者,其中男性受试者 11 名,女性受试者 4 名,年龄(25.1 ± 1.8)岁,身高(168.1 ± 6.5)cm,体重(62.2 ± 8.7)kg,无运动障碍类相关疾病。临床试验在苏州大学附属第二医院进行,由当地伦理委员会审批通过,且经过了受试者及其家属的知情同意。
表 1. Basic information and clinical scale information of patients in PD group.
PD 组各个患者的基本信息与临床量表信息
| 患者
编号 |
性别 | 年龄/岁 | 身高/cm | 体重/kg | H-Y
分期 |
UPDRS
Ⅲ 评分 |
| H-Y 分期:1 期:仅单侧病变;2 期:双侧轻度病变;3 期:双侧病变伴早期平衡障碍;4 期:严重病变,生活需要大量帮助;5 期:局限于床上或轮椅中,生活完全不能自理;UPDRS Ⅲ 评分越高,表明该患者的运动症状病变程度越严重 | ||||||
| 1 | 女 | 42 | 171 | 56 | 2.5 | 25 |
| 2 | 男 | 68 | 176 | 84 | 1.5 | 9 |
| 3 | 男 | 59 | 168 | 80 | 1 | 13 |
| 4 | 男 | 68 | 156 | 54 | 1 | 6 |
| 5 | 女 | 54 | 165 | 75 | 2.5 | 19 |
| 6 | 男 | 48 | 169 | 72 | 1 | 10 |
| 7 | 女 | 58 | 158 | 61 | 3 | 26 |
| 8 | 女 | 64 | 162 | 57 | 2.5 | 13 |
| 9 | 男 | 59 | 172 | 68 | 1.5 | 14 |
| 10 | 男 | 65 | 169 | 80 | 3 | 18 |
| 11 | 男 | 67 | 168 | 68 | 1.5 | 16 |
| 12 | 男 | 58 | 168 | 87 | 2.5 | 28 |
| 13 | 女 | 60 | 153 | 58 | 2.5 | 23 |
| 14 | 女 | 60 | 160 | 65 | 1 | 8 |
| 15 | 女 | 51 | 158 | 60 | 1.5 | 15 |
试验时,受试者需完成规定的范式动作并录像,传感器节点将运动信号通过 Wi-Fi 实时传送到电脑上位机显示并保存。试验的 6 个范式动作参照 UPDRS Ⅲ 的运动功能评定部分,并与临床医生讨论后制定,每两个动作之间有 1~2 min 的休息时间。6 个范式动作依次为:
(1)10 m 往返:受试者静止端坐在椅子上,起立以正常步速向前行走 10 m 后,绕标记点转身返回,坐回椅子保持静止;
(2)10 m 往返双任务:试验人员指定一个 90 以上的数字,受试者完成 10 m 往返任务的同时从该数字开始每次减 3 或减 7 报数,若报错数字不影响继续行走;
(3)手部轮替:受试者静坐在椅子上平举双臂,然后左、右手同时以最快速度,最大幅度完成 15 s 的连续旋前、旋后动作;
(4)静坐抬腿:受试者静坐在椅子上,先用左脚连续快速踩上踏板的标记位置(高度固定为 11.5 cm),15 s 后停止。完成后休息 1~2 min,换右脚完成相同的动作流程;
(5)睁眼站立:受试者双脚并拢,双臂自然下垂,身体不接触任何物体,保持睁眼站立 1 min;
(6)闭眼站立:受试者双脚并拢,双臂自然下垂,身体不接触任何物体,保持闭眼站立 1 min。
1.3. 数据分析
1.3.1. 信号预处理
将传感器节点采集到的X、Y、Z三轴加速度和角速度信号进行窗长为 5 的中值滤波,消除孤立的噪声点,然后采用带通滤波(0.1~12 Hz)去除低频自主运动和高频噪声影响。对于 10 m 往返、10 m 往返双任务、手部轮替、静坐抬腿的 4 个动作,通过计算信号方差选取出三轴角速度信号中信噪比最大的一轴进行分析。
对于睁眼站立、闭眼站立两个动作,由于只考虑水平面的晃动情况,故采用腰部传感器节点水平面X、Y两轴的加速度信号进行分析。先对信号进行去趋势处理以消除偏移,并绘制出水平面上腰部节点的加速度轨迹图。由于个别受试者在站立过程中受外界干扰存在异常晃动,导致部分加速度信号出现大幅度波动,所以用如下算法移除这部分信号来减小误差:对X、Y两轴的加速度信号 ax(t),ay(t)分别处理。以 ax(t)为例,将信号按 1 s(100 点)的窗长进行分帧,计算每一帧内信号的标准差 σ(ax(i))和除该帧外其余信号的标准差 σ(ax) 做判定,若 σ(ax(i)) ≥ 2σ(ax),则将该帧信号 ax(i)移除。移除异常值前后的腰部节点加速度轨迹如图 2 所示。
图 2.
The acceleration trail of the waist node before and after removing outliers
移除异常值前后的腰部节点加速度轨迹
1.3.2. 各范式动作数据分析
对于 10 m 往返和 10 m 往返双任务,采用左腿、右腿和腰部节点的角速度信号 v(t)进行分析。以左腿节点为例,首先计算出信号的均值 E(v(t))和标准差 σ(v(t)),如式(1)所示,得出判断阈值
 ,将信号 v(t)中每一时刻的值逐个与阈值
,将信号 v(t)中每一时刻的值逐个与阈值
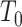 比较,若一段信号超过了阈值
比较,若一段信号超过了阈值
 ,则记为步数 b+1,并记录下这一小段信号中最大值所在时刻 t(b)。然后对信号 v(t)求积分,即得到该轴角度的信号 A(t),在之前记录的 t(b)和 t(b+1)中找到角度信号 A(t)的最大值所在时刻
,则记为步数 b+1,并记录下这一小段信号中最大值所在时刻 t(b)。然后对信号 v(t)求积分,即得到该轴角度的信号 A(t),在之前记录的 t(b)和 t(b+1)中找到角度信号 A(t)的最大值所在时刻
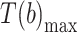 和最小值所在时刻
和最小值所在时刻
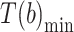 ,如式(2)、(3)所示,可以分别计算出这一步左腿的步幅 A(b)和步频 F(b):
,如式(2)、(3)所示,可以分别计算出这一步左腿的步幅 A(b)和步频 F(b):
 |
1 |
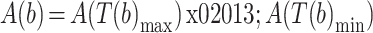 |
2 |
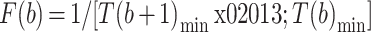 |
3 |
最后对每一步的步幅和步频求取平均值,得到该受试者在 10 m 往返或 10 m 往返双任务下左腿的步幅和步频。对腰部节点的角速度信号 v(t)求积分得到角度信号 A(t),由于往返行走中的转身动作,A(t)的值会从 0° 左右升至 180° 左右,将 A(t)从 40° 变化至 140° 所需要的时间定义为转身时间。如图 3 左图所示,为 10 m 往返中右腿的角速度信号(蓝色曲线),从中可以看出每步的开始(绿线标注)和结束(紫线标注)时刻,此外可以得到每步的时间间隔等信息。
图 3.

The motion signals in some of the paradigm tasks
部分范式动作中的运动信号
对于手部轮替动作,主要分析左手和右手节点的角速度信号。采用和上面计算步幅、步频相同的算法分别得到左手和右手轮替的次数、幅度和频率。除此之外,定义时间疲劳程度为前 5 次与后 5 次手部轮替频率的比值,定义幅度疲劳程度为前 5 次与后 5 次手部轮替平均幅度的比值,数值越大则表示疲劳程度越大。对于静坐抬腿动作,主要分析左腿和右腿节点的角速度信号,采用以上相同的算法分别计算出左腿和右腿的抬腿次数、抬腿频率。由于抬腿的幅度固定,只计算其时间疲劳程度,定义为前 5 次与后 5 次抬腿频率的比值。
对于睁眼站立和闭眼站立,主要分析腰部节点在水平面X、Y两轴的加速度信号 ax(t)和 ay(t)。以睁眼站立为例,先画出水平面加速度轨迹,如式(4)所示,得到加速度的均方根(root mean square of acceleration,RMSA)(以符号 RMSA 表示)。对两轴加速度信号分别求导和求积分后得到加加速度信号 jx(t)、jy(t)和速度信号 vx(t)、vy(t)。如式(5)、(6)所示,分别得到加加速度的均方根(root mean square of jerk,RMSJ)(以符号 RMSJ 表示)和平均速率(mean velocity,MV)(以符号 MV 表示)。如图 3 右图所示为睁眼站立下,腰部节点在水平面两个方向上的速度波动情况。如表 2 所示,为对于以上各范式动作计算出的定量指标。
表 2. Summary of the quantitative parameters of each paradigm task.
各范式动作的定量指标总结
| 范式动作 | 身体部位 | 定量指标 |
| 10 m 往返 | 双侧下肢 | 步频/(次·min–1)、步幅/(°) |
| 腰部 | 转身时间/s | |
| 10 m 往返双任务 | 双侧下肢 | 步频/(次·min–1)、步幅/(°) |
| 腰部 | 转身时间/s | |
| 手部轮替 | 双侧上肢 | 幅度/(°)、次数/次、频率/(次·s–1)、时间疲劳程度、幅度疲劳程度 |
| 静坐抬腿 | 双侧下肢 | 次数/次、频率/(次·s–1)、时间疲劳程度 |
| 睁眼站立 | 腰部 | RMSA/(m·s–2)、RMSJ/(m·s–3)、MV/(m·s–1) |
| 闭眼站立 | 腰部 | RMSA/(m·s–2)、RMSJ/(m·s–3)、MV/(m·s–1) |
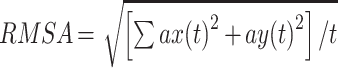 |
4 |
 |
5 |
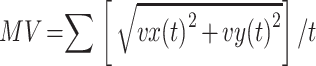 |
6 |
1.3.3. BP神经网络分类及评分预测
BP 神经网络是一种多层前馈神经网络,可根据预测误差不断调整网络权值和阈值,具有自学习能力[17]。本文使用 BP 神经网络将多个定量指标通过样本的训练自动建立出最佳的输出判别模型,从而进行 PD 患者的自动识别以及 PD 临床量表评分的预测。如表 2 所示,共提取出 20 个和运动相关的定量指标,将它们构建为 1 × 20 维的特征矩阵,为避免因为输入输出数量级差别较大而造成的网络预测误差,进行了归一化处理。首先进行对照组和 PD 组的自动判别,使用特征矩阵作为输入,受试者类别作为标签(PD 组为 1,对照组为 2)来训练网络进行分类。将 30 个受试者随机划分为 5 组,每组 6 人,每次选取 4 组作为训练集,另外 1 组作为测试集来完成 5 折交叉验证,共计算 10 次以提高结果可信度。接下来分别使用 15 个 PD 组受试者的 H-Y 分期以及 UPDRS Ⅲ评分作为标签来训练网络,完成这两项评分的自动预测,同样进行 10 次 5 折交叉验证。信号的分析以及基于 BP 神经网络的数据分类和预测都在矩阵计算软件 MATLAB R2015b(MathWorks Inc.,美国)上进行。对运动信号分析处理的流程如图 4 所示。
图 4.
A flow chart of motion signal processing
运动信号分析流程
1.3.4. 统计学方法
分别对左右手、左右腿的计算结果求平均得到双侧上下肢的运动定量指标。在 PD 组和对照组之间用独立样本 t 检验得到差异具有统计学意义的定量指标,在每个组内分别对 10 m 往返、10 m 往返双任务、睁眼站立和闭眼站立的定量指标进行独立样本 t 检验。对各指标进行受试者工作特征(receiver operating characteristic,ROC)曲线分析,计算曲线下面积(area under curve,AUC)得到其诊断性能。因需综合考虑诊断的敏感性和特异性,本文对 AUC 大于 0.7 的指标找到其最大约登指数(Youden index)的对应值作为诊断临界值(cut-off 值)。统计分析相关运算在专业数据统计分析软件 IBM SPSS Statistics 22(IBM Inc.,美国)上进行。
对于 BP 神经网络的分类结果计算其准确率、敏感性和特异性。对于临床评分的预测值,以真实评分作为标准计算其相对误差率 = (预测评分 — 真实评分)/真实评分 × 100%,则预测的准确率 = 1 — 相对误差率。对 10 次分类及预测结果求平均,得到最终结果。
2. 结果与分析
2.1. 各定量指标统计分析结果
6 个范式动作下,组间各个定量指标的计算及统计分析结果如表 3 所示,PD 组和对照组之间大多数指标的差异均具有统计学意义(P < 0.05),且部分指标 P < 0.01。这表明 PD 组和对照组相比,部分运动功能受到患病影响,如步频变快(慌张步态)、转身时间变长、手部轮替较慢、动作更容易疲劳等,体现出运动障碍和运动迟缓的症状。两组受试者在睁、闭眼站立下的 RMSA、MV 等指标的差异,显示出 PD 患者的身体平衡能力也受到影响。ROC 曲线分析表明,10 m 往返的步频、转身时间以及手部轮替的次数、频率有着较高的诊断准确性,AUC 均大于 0.9。其他一些指标如步幅、手部轮替的幅度、抬腿次数以及睁、闭眼站立的 MV 等指标有较好的诊断价值。此外未在表中列出的结果包括:PD 组 10 m 往返双任务的步频、步幅均小于 10 m 往返的对应指标,转身时间变长,其中步频的变化差异具有统计学意义(P = 0.001);对照组也有相似结果,但各指标之间的差异没有统计学意义。这表明认知任务会对步态造成影响,且对 PD 组的影响大于对对照组的影响。有个别定量指标的差异没有统计学意义,这可能是因为受试者样本量还不够,且 PD 组部分受试者为发病较轻或者服药后的患者。后续工作应增加试验的样本量,将不同患病程度的 PD 患者作为受试者来进行研究,同时研究服药前后各患者运动功能的变化情况。
表 3. Statistical results of each quantitative parameter (
 )
.
)
.
各定量指标的统计结果(
 )
)
| 分组 | 10 m 往返 | 10 m 往返双任务 | |||||||
| 步频/(次·min–1) | 步幅/(°) | 转身时间/s | 步频/(次·min–1) | 步幅/(°) | 转身时间/s | ||||
| PD 组 | 58.81 ± 2.34 | 68.56 ± 7.30 | 1.46 ± 0.62 | 53.49 ± 4.99 | 64.48 ± 9.60 | 1.51 ± 0.54 | |||
| 对照组 | 52.92 ± 3.96 | 75.70 ± 4.02 | 0.80 ± 0.13 | 51.36 ± 4.55 | 74.46 ± 4.41 | 0.87 ± 0.19 | |||
| P 值 | ** P < 0.001 | ** P = 0.003 | ** P = 0.001 | NA | ** P = 0.001 | ** P < 0.001 | |||
| AUC | 0.90 | 0.80 | 0.91 | 0.63 | 0.88 | 0.86 | |||
| 临界值 | 56.6 | 70.8 | 0.95 | NA | 68.79 | 1.20 | |||
由于篇幅所限,本文并未列出各个 PD 患者的运动功能定量指标。对比患者相应的临床量表评分,可以发现较高的 UPDRS Ⅲ 得分对应于较差的运动功能,这具体表现为定量指标的变化,如:步幅较小、转身时间较长、翻腕及抬腿的频率较低、站立时腰部的 MV 较大等 。而且 H-Y 分期与 PD 的发展程度有关,随着分期的增加疾病从单侧发展到双侧,并出现平衡障碍。但这一变化并不是简单地表现为运动功能的定量变化,需要对比单侧和双侧肢体的运动功能并结合腰部平衡功能的定量指标来进行评估。
2.2. BP神经网络分类及预测结果
经过 10 次 5 折交叉验证,BP 神经网络对两个组的分类准确率为 90.00% ± 3.85%,敏感性为 85.33% ± 8.20%,特异性为 94.67% ± 2.81%。对患者临床 H-Y 分期和 UPDRS Ⅲ 的一次预测结果如图 5 所示,其中蓝色圆圈为预测值,红色星号为真实值,样本顺序为随机生成。可以看出预测值和真实值的大致趋势相同,H-Y 分期的预测误差在 1 期以内,UPDRS Ⅲ 的预测误差在 10 分以内,大部分误差保持在 5 分以内。10 次运算结果表明,BP 神经网络对 H-Y 分期的预测准确率为 72.80% ± 5.60%,对 UPDRS Ⅲ 评分预测的准确率为 68.64% ± 2.84%。分类和预测结果表明,本文方法可以很好地区分出对照组和 PD 组,且有着较高的特异性,但由于样本量不足和 PD 患病复杂性的影响,导致对个别患者的 H-Y 分期和 UPDRS Ⅲ评分预测误差较大,整体的准确性还有待提高。后续工作需要进一步优化算法,选取特征,同时完善试验动作范式使其能够涵盖 PD 患者不同层面的运动功能。
图 5.

BP neural network prediction results for the H-Y stage and UPDRS Ⅲ score of the PD group
BP 神经网络对 PD 组 H-Y 分期和 UPDRS Ⅲ 评分的预测结果
3. 结论
为了客观全面评估 PD 患者的运动症状,本文提出了一种基于多节点可穿戴设备来对 PD 患者运动功能进行定量评定的方法。在 6 个试验范式动作下通过 5 个传感器节点记录到运动的加速度、角速度信号,提取出 20 个反映不同身体部位运动功能的定量指标,并使用 BP 神经网络进行 PD 组和对照组的自动分类,给出与临床评估量表相对应的量化评分。30 例 PD 组和对照组的临床试验结果表明,两个组之间多数指标的差异具有统计学意义,10 次 5 折交叉验证表明 BP 神经网络对两个组的分类准确率达到 90.00%,对患者组的 H-Y 分期和 UPDRS Ⅲ 评分预测的准确率分别为 72.80% ± 5.60% 和 68.64% ± 2.84%。以上结果表明,本文方法做到了对 PD 患者运动功能多个身体部位、多指标、自动化的定量评定,这对 PD 的定量评估研究以及临床辅助诊断具有一定的参考价值。
Funding Statement
江苏省社会发展项目(BE2015648);苏州市科技计划项目(SS201533,SS201608)
References
- 1.Jankovic J Parkinson’s disease: clinical features and diagnosis. J Neurol Neurosurg Psychiatry. 2008;79(4):368–376. doi: 10.1136/jnnp.2007.131045. [DOI] [PubMed] [Google Scholar]
- 2.中华医学会神经病学分会帕金森病及运动障碍学组, 中国医师协会神经内科医师分会帕金森病及运动障碍专业 中国帕金森病的诊断标准 (2016 版) 中华神经科杂志. 2016;49(4):268–271. [Google Scholar]
- 3.Zhang Zhenxin, Roman G C, Hong Zhen, et al Parkinson’s disease in China: prevalence in Beijing, Xi’an, and Shanghai. Lancet. 2005;365(9459):595–597. doi: 10.1016/S0140-6736(05)17909-4. [DOI] [PubMed] [Google Scholar]
- 4.Lang A E, Eberly S, Goetz C G, et al Movement disorder society unified Parkinson disease rating scale experiences in daily living: longitudinal changes and correlation with other assessments. Mov Disord. 2013;28(14):1980–1986. doi: 10.1002/mds.25671. [DOI] [PubMed] [Google Scholar]
- 5.刘春风, 毛成洁 探索新的评价方法,全面客观评价帕金森病患者的运动和非运动症状. 中华医学杂志. 2014;94(11):801–803. [Google Scholar]
- 6.孙志强, 王广志, 陈滨, 等 人体震颤定量检测仪在临床的初步应用. 中国康复理论与实践. 2006;12(6):521–522. [Google Scholar]
- 7.高强, 何成奇 帕金森病患者运动功能评定与运动疗法的进展. 中国康复医学杂志. 2008;23(5):473–476. [Google Scholar]
- 8.汪丰, 邹亚, 乔子晏, 等 帕金森患者步行运动的定量分析. 东南大学学报:自然科学版. 2015;45(2):266–269. [Google Scholar]
- 9.Espay A J, Giuffrida J P, Chen R, et al Differential response of speed, amplitude, and rhythm to dopaminergic medications in Parkinson’s disease. Mov Disord. 2011;26(14):2504–2508. doi: 10.1002/mds.23893. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Rigas G, Tzallas A T, Tsipouras M G, et al Assessment of tremor activity in the Parkinson’s disease using a set of wearable sensors. IEEE Trans Inf Technol Biomed. 2012;16(3):478–487. doi: 10.1109/TITB.2011.2182616. [DOI] [PubMed] [Google Scholar]
- 11.Sterpi L, Caroli A, Meazza E, et al Lower limb spasticity assessment using an inertial sensor: a reliability study. Physiol Meas. 2013;34(11):1423–1434. doi: 10.1088/0967-3334/34/11/1423. [DOI] [PubMed] [Google Scholar]
- 12.Heldman D A, Pulliam C L, Mendoza E U, et al Computer-Guided deep brain stimulation programming for Parkinson’s disease. Neuromodulation. 2016;19(2):127–132. doi: 10.1111/ner.12372. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Mera T O, Burack M A, Giuffrida J P. Quantitative assessment of levodopa-induced dyskinesia using automated motion sensing technology, Conf Proc IEEE Eng Med Biol Soc, 2012: 154-157
- 14.Maetzler W, Domingos J, Srulijes K, et al Quantitative wearable sensors for objective assessment of Parkinson’s disease. Mov Disord. 2013;28(12):1628–1637. doi: 10.1002/mds.25628. [DOI] [PubMed] [Google Scholar]
- 15.Deutch A Y Parkinson’s disease redefined. Lancet Neurol. 2013;12(5):422–423. doi: 10.1016/S1474-4422(13)70052-8. [DOI] [PubMed] [Google Scholar]
- 16.李亮, 俞乾, 徐宝腾, 等 帕金森病患者多节点运动监测可穿戴设备. 生物医学工程学杂志. 2016;(6):1183–1190. [Google Scholar]
- 17.史峰, 王小川, 郁磊, 等. MATLAB 神经网络 30 个案例分析. 北京: 北京航空航天大学出版社, 2010: 1-20





