Abstract
肝癌是全球范围内最常见的一种恶性肿瘤,具有发病隐匿、化疗不敏感、预后差等特点,给其临床治疗带来了严峻的挑战。近年来,随着纳米技术的发展,越来越多的纳米药物被开发应用于生物医学领域。通过合理的设计,纳米药物可被制备成具有适宜尺寸、表面修饰特异性肝癌靶向配体以及同时负载多种不同作用机制的治疗剂,从而提高药物的生物利用度,增强对肝癌的靶向性,降低对正常组织的毒副作用,为肝癌的治疗提供了新的希望。本文将对纳米药物的靶向设计策略及其在联合治疗肝癌的研究进展等方面进行综述。
Keywords: 纳米药物, 肝癌, 靶向, 联合治疗
Abstract
Hepatocellular carcinoma (HCC) is one of the most common cancers worldwide, with insidious onset, insensitive to chemotherapy and poor prognosis, which make its clinical treatment face an enormous challenge. In recent years, with the rapid development of nanotechnology, increasing kinds of nanomedicine come to the forefront in biomedical fields. Through rational design, nanomedicine can be prepared in suitable size and modified with specific liver targeting ligands. Moreover, various therapeutic agents of different mechanisms can be co-loaded into the same nanosystem, thus achieving the synergistic therapeutic effects towards HCC. Nanomedicine is able to enhance drug bioavailability and liver-targeting effect as well as reduce the side effects to normal tissues, which provide a great potential in HCC therapy. This review summarizes the recent progress in the application of nanomedicine for HCC therapy from two aspects: their liver-targeting design strategies and the recent progress in combination therapy of HCC.
Keywords: nanomedicine, hepatocellular carcinoma, targeting, combination therapy
引言
肝细胞肝癌(hepatocellular carcinoma,HCC)是全球最常见的恶性肿瘤之一,其发病率位居第五,死亡率位居第三,严重危害着人类的健康[1]。目前,临床治疗肝癌的手段主要有:手术治疗、射频消融、介入治疗以及分子靶向药物治疗等。手术治疗及射频消融仅适用于少部分早期患者,然而,由于肝癌发病隐匿,许多患者确诊时病情已经处于中晚期,错过了手术治疗的最佳时机。传统化疗、放疗对肝癌疗效较差。随着放射介入治疗的发展及技术完善,肝动脉介入治疗成为失去手术机会的肝癌患者最常用的治疗手段[2],但是这种方法往往存在“残留病灶”的问题,使其预后不甚理想。索拉非尼是美国食品药品监督管理局(Food and Drug Administration,FDA)批准的唯一用于晚期肝癌的靶向治疗药物,最新的美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)肝胆肿瘤临床实践指南将其推荐为不可手术切除或不适合肝移植肝癌患者的一线治疗药物[3]。然而,临床实践表明,患者服用索拉非尼后,其总体生存期仅延长不足三个月,且在用药后易产生耐药现象,促使肿瘤转移增加[4-6]。
为改善肝癌的临床治疗现状,提高药物治疗肝癌的敏感性及靶向性,纳米药物作为一种新兴的治疗手段正在迅速发展。纳米药物是通过适当的载体与药物以一定方式结合在一起,制成尺寸为纳米级的药物,其粒径在 1~1 000 nm 范围内。在这种尺度下,由于表面效应和小体积效应,纳米药物表现出一些特殊的分子性质。通过合理的设计,纳米药物可以有效地改善多种非水溶性药物的溶解性,提高基因、蛋白类药物的稳定性,增加针对肝癌的靶向性[7]。此外,将两种及以上针对不同作用机制的药物同时负载于同一纳米体系中,能够实现协同治疗肝癌的目的。如图 1 所示,本文将从纳米药物的靶向肝癌设计策略和联合治疗应用进展等方面进行综述。
图 1.
Schematic illustration of nanomedicine targeting HCC
纳米药物靶向肝癌治疗的示意图
EPR: enhanced permeability and retention; FR: folate receptor; GA-R: glycyrrhetinic acid receptor; ASPGR: asialoglycoprotein receptor; EGFR: epidermal growth factor receptor; TfR: transferrin receptor
EPR:增强渗透及滞留;FR:叶酸受体;GA-R:甘草次酸受体;ASPGR:去唾液酸糖蛋白受体;EGFR:表皮生长因子受体;TfR:转铁蛋白受体
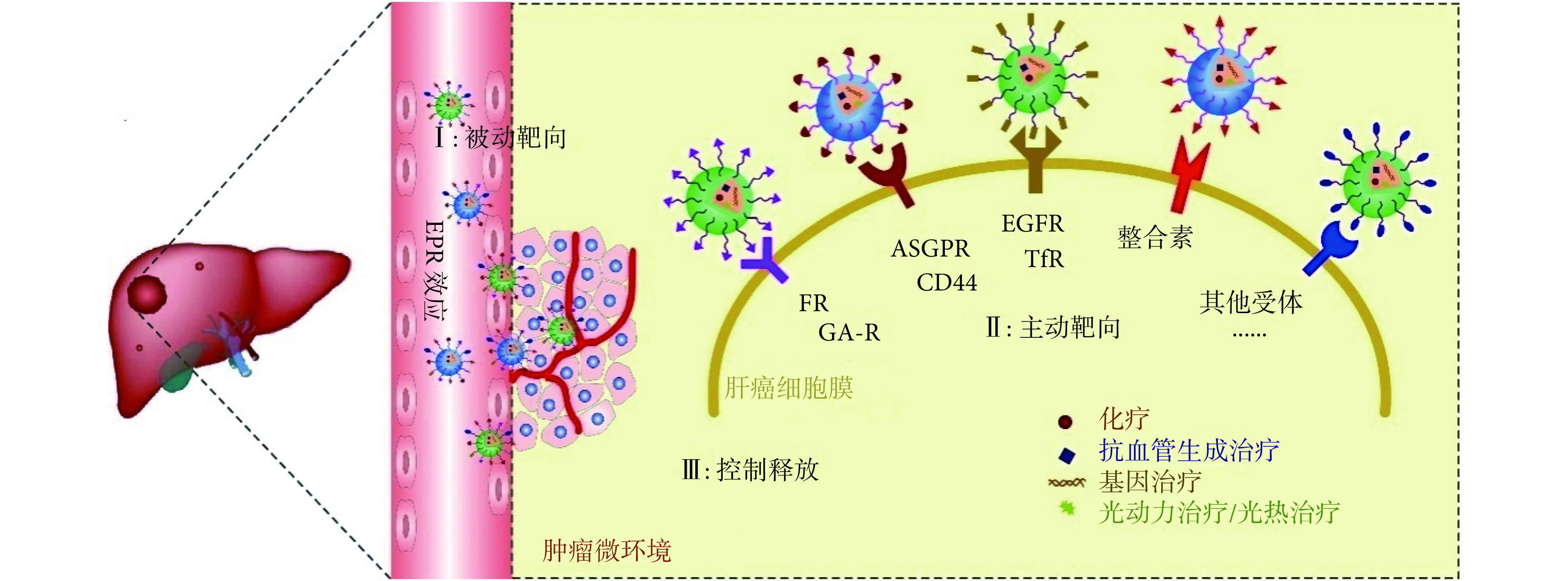
1. 纳米药物的肝癌靶向策略
1.1. 被动靶向
纳米药物对肝肿瘤的被动靶向作用是通过机体器官或组织对不同尺寸粒子的阻留性不同而实现的。正常组织微血管间隙致密、结构完整,大分子颗粒不易透过。然而,在肿瘤过度生长过程中,肿瘤组织新生的毛细血管具有数量丰富、血管壁间隙较宽、结构完整性差、淋巴回流缺失等病理结构特点,使得纳米药物可以通过血管壁并滞留在肿瘤组织内,这种现象称 EPR 效应[8]。EPR 效应可以使纳米药物被动靶向至肿瘤部位,实现在肿瘤部位的蓄积(如图 1Ⅰ 所示)。
为了更大程度地提高药物在肿瘤部位的疗效以及避免其对正常组织的损伤,研究者们利用肿瘤特定微环境设计纳米药物以增强其抗肿瘤效果[9]。通常,这类纳米药物在血液循环中保持“隐形”状态,而当到达肿瘤部位后,受到肿瘤微环境的刺激(如低氧、弱酸性、酶等),纳米药物结构发生改变,其非活化状态迅速转变为活化状态,从而增强其与肿瘤细胞的作用或者促进治疗剂的释放(如图 1Ⅲ 所示)。例如,Zhang 等[10]将索拉非尼载入透明质酸/脂质杂化纳米粒子中,当纳米粒子到达肝癌部位,在透明质酸酶的作用下降解,快速释放药物。
1.2. 主动靶向
肝脏细胞或肝癌细胞表面常常特异性表达或过表达某些受体,因此,在设计纳米药物时,在纳米药物表面偶联与这些受体具有高度亲和力的配体分子,使其连接上“导弹分子”,可将药物导向性运送至靶部位,实现药物在肝组织或肝癌细胞内的蓄积(如图 1Ⅱ 所示)。这些主动靶向配体分子包括一些小分子、糖类、多肽、抗体等。在受体-配体介导的主动靶向作用下,纳米药物可通过内吞途径进入细胞,增加细胞内药物浓度。下面针对不同的受体分子及其相应配体分子进行分别总结与阐述(见表 1[11-22])。
表 1. Summary of characteristics and application of HCC active-targeting receptors.
肝癌主动靶向受体特点及应用总结
| 受体类型 | 靶向特点 | 配体分子 | 载体材料 | 负载物 | 细胞种类 | 文献 |
| —:无明确受体。PEG-PHIS:聚乙二醇-b-聚组氨酸;TPGS:D-α-生育酚琥珀酸聚乙二醇酯;PLL-CD:聚赖氨酸-g-(β-环糊精);PEG-PLA:聚乙二醇-b-聚乳酸;DSPE-PEG:二硬脂酰基磷脂酰乙醇胺-聚乙二醇;PLGA:聚乳酸-羟基乙酸共聚物;LHRH:促黄体激素释放激素 | ||||||
| FR | 肿瘤细胞 | 叶酸 | 脂质体 | 去甲斑蝥素 | H22 | [11] |
| GA-R | 肝及肝癌细胞 | 甘草次酸 | PEG-PHIS | 穿心莲内酯 | Hep3B | [12] |
| ASGPR | 肝及肝癌细胞 | 乳糖酸 | TPGS | 依托泊苷 | HepG2 | [13] |
| 普鲁兰多糖 | PBAE/PLGA | 紫杉醇
考布他汀 |
HepG2 | [14] | ||
| CD44 | 肝癌及肝癌干细胞 | 透明质酸 | PLL-CD | 阿霉素
核酸 |
MHCC-97H
HepG2 |
[15] |
| 整合素 | 新生血管内皮细胞
肿瘤细胞 |
iRGD | PEG-PLA | 凡德他尼 | BEL-7402 | [16] |
| — | 肝癌细胞 | SP94 | HYNIC | 99mTc、188Re | Huh-7 | [17] |
| EGFR | 肿瘤细胞 | Anti-EGFR Fab′ | DSPE-PEG | 阿霉素 | SMMC-7721 | [18] |
| TfR | 肿瘤细胞 | 转铁蛋白 | PLGA | 阿霉素、顺铂 | HepG2 | [19] |
| LHRH 受体 | 肿瘤细胞 | LHRH | 壳聚糖 | pEGFP-C1 | HepG2 | [20] |
| 甘露糖受体 | 巨噬细胞、肝癌细胞 | 甘露聚糖 | 腺病毒 | 阿霉素、PTEN | H22 | [21] |
| CD133 | 肝癌及肝癌干细胞 | 核酸适配体 A15 | PLGA | 盐霉素 | Huh7、Hep3B | [22] |
1.2.1. 小分子
FR 是通过糖基磷脂酰肌醇锚定在细胞膜表面的一种分泌性蛋白,通常过表达于多种恶性肿瘤表面,而在正常组织细胞表面的表达水平很低[23]。叶酸是细胞代谢、DNA 合成及修复的必需物质,肿瘤组织特殊的代谢速率使其需要大量的叶酸以满足 DNA 的合成需求。由于叶酸具备小分子、无毒、无免疫原性等特点,被广泛修饰在纳米药物表面用于提高纳米药物对肿瘤细胞的靶向性。
GA-R 是肝实质细胞表面甘草次酸的特异性结合位点,在肝细胞表面数量较多。甘草次酸可与肝实质细胞表面 GA-R 特异性结合,是一种重要的靶向肝癌的配体分子[24]。
1.2.2. 糖类
ASGPR 是肝细胞表面表达的一种特异性糖蛋白受体,表达丰度很高[25]。ASGPR 可特异性识别末端有半乳糖基的糖蛋白,在维持血清糖蛋白的平衡方面发挥着重要作用。ASGPR 配体偶联的纳米粒子被广泛应用于靶向 HCC 的药物输送。普鲁兰多糖是一种水溶性多糖,也是 ASGPR 的一种天然配体,与 ASGPR 具有较高的亲和力[26]。
CD44 是与细胞增殖、转移密切相关的标志物之一,研究发现其也是肝癌干细胞的标志物之一[27]。近年来越来越多的研究者将肿瘤干细胞作为治疗肿瘤的靶点,因此,靶向肿瘤干细胞成为治疗肿瘤的一种新策略。透明质酸(hyaluronic acid,HA)在细胞外基质中广泛存在,是 CD44 的天然配体,可作为一种良好的肝癌靶向配体分子[15]。
1.2.3. 多肽及蛋白
整合素(integrin)是一类由 α 和 β 两个亚单位形成的异二聚体跨膜蛋白家族,大部分整合素通过识别细胞外基质蛋白中的精-甘-天冬序列(Arg-Gly-Asp,RGD),介导细胞内外环境的信号转导及细胞黏附等[28]。整合素在多种肿瘤表面和新生血管内皮细胞中高表达,在肿瘤血管生成方面发挥着重要作用。iRGD 是 RGD 的一种环状衍生物,也能够特异性识别整合素受体,实现肿瘤的主动靶向[29]。
SP94(SFSIIHTPILPL)是噬菌体展示技术发现的多肽,能与多种肝癌细胞选择性结合,而与正常细胞(正常肝细胞、内皮细胞、免疫细胞等)只有少量结合[30]。SP94 这种良好的肝癌选择性使其成为一种实用的肝癌靶向配体[17]。
EGFR 是蛋白激酶超家族中的一类跨膜糖蛋白,与表皮生长因子结合可促进细胞增殖和血管生成,抑制细胞凋亡。EGFR 在多种肿瘤细胞中呈高表达状态,与肿瘤的预后呈负相关[31-32]。研究显示,许多 HCC 患者肿瘤标本检测均显示 EGFR 表达较高,因此,EGFR 可作为靶向肝癌治疗的潜在靶点[33]。
TfR 是一种同源二聚体的跨膜糖蛋白,在调节细胞内铁离子含量及细胞生长中发挥着重要作用,与铁离子-转铁蛋白复合物具有高度亲和力[34]。TfR 往往在高增殖的细胞及需要大量铁离子的细胞表面表达增加,因此在肝癌靶向治疗方面受到广泛的关注。
1.2.4. 其他
除此之外,促黄体激素释放激素受体[20]、甘露糖受体[21]等也经常作为主动靶向肝癌纳米药物的靶点。近年来,采用指数富集的配基系统进化技术(systematic evolution of ligands by exponential enrichment,SELEX)技术筛选出来的一些核酸适配体[35]能够特异性识别肝癌细胞,在靶向肝癌的纳米药物的设计中具有良好的应用前景。目前已报道的具有肝癌靶向作用的核酸适配体包括:A15[22]、CL4[22]、TLS11a[36]、AS1411[37]、LY1[38]等。
2. 纳米药物联合治疗肝癌策略
肝癌的发生发展是一个多步骤参与的复杂过程,单一治疗剂往往不能取得理想的治疗效果。由于肝癌本身的耐药性,临床上尚缺乏有效地用于治疗肝癌的化疗药物。随着对肿瘤发生发展相关分子生物学机制的进一步认识,越来越多的研究者尝试联合两种或以上不同作用机制的治疗剂,以期通过协同作用增强治疗效应,以及通过减少药物剂量降低药物毒副作用,改善其耐药性[39]。
2.1. 小分子药物联合治疗
2.1.1. 联合化疗药物和分子靶向药
索拉非尼是临床治疗晚期肝癌的常用手段,但是药物毒副作用及其产生的肿瘤耐药性,使得索拉非尼治疗效果不够理想。临床试验研究数据显示,将索拉非尼与阿霉素应用于晚期肝癌患者,治疗效果良好[40]。Zhang 等[41]采用 iRGD 修饰的脂质-聚合物杂化纳米粒子共同递送阿霉素和索拉非尼,与两种游离药物物理联合相比,纳米药物对 HepG2 细胞的杀伤作用显著增加,在体内也表现出更强的抗肿瘤作用。
2.1.2. 联合化疗药物和抗血管生成剂
血管生成是实体肿瘤的一个重要特征,也是肿瘤发生、发展及转移的一个重要原因。肝癌组织中存在大量的新生血管,以维持肿瘤的营养供给,因此,抗血管生成成为治疗肝癌的一个新手段[42]。然而,临床研究表明仅仅依赖抗血管生成剂治疗效果有限。将抗血管生成剂与化疗药物联合,有望通过抑制新生血管生成和杀伤肝癌细胞发挥协同抗肝癌作用[43]。康普瑞汀是一种常用的抗血管生成剂,Wang 等[44]将其与甲氨蝶呤同时负载于基于普鲁兰多糖的纳米体系中,在体内实现时序释放,通过抗血管生成及直接杀伤肿瘤的双重效应实现抗肿瘤。
2.2. 基因/药物联合治疗
肝癌的发生和发展过程中涉及多种基因的表达和功能异常,而这些基因异常与细胞的生长、分化、死亡以及耐药等过程密切相关。以这些异常表达的基因作为治疗靶点,将有治疗作用的核酸(主要包括 pDNA、siRNA、microRNA)引入到细胞内,纠正相关异常基因的表达,是一种极具前景的治疗模式。
2.2.1. 联合化疗药物和 pDNA
存活素是凋亡抑制蛋白家族成员,具有调节细胞分化及抑制细胞凋亡的重要作用,且与 HCC 患者的预后密切相关。Xu 等[45]将多烯紫杉醇与嵌入存活素抑制子的 pDNA 共载,制备多功能纳米系统,研究发现,与载有单一治疗剂的纳米体系相比,多功能纳米系统能够发挥药物和基因的联合治疗作用,显著抑制肿瘤生长。
2.2.2. 联合化疗药物和 siRNA
利用 siRNA 沉默细胞内特定基因的 RNA 干扰技术,也是基因治疗的一种重要手段。核苷酸还原酶 M2(ribonucleotide reductase M2,RRM2)在 DNA 合成和修复中具有重要作用,是肿瘤治疗的一个重要靶点。在 Gao 等[46]的研究中,他们研制了一种免疫脂质体联合 RRM2 siRNA 和阿霉素治疗肝癌,通过沉默 RRM2 的表达显著增强了阿霉素抑制细胞增殖和促进细胞凋亡的作用。Oh 等[47]将沉默波形蛋白基因的 siRNA 与阿霉素联合治疗肝癌,也呈现了显著的协同抗肿瘤作用。
2.2.3. 联合化疗药物和 miRNA
miRNA 是一类内源基因编码的长度约为 22 个核苷酸的非编码单链 RNA 分子,在基因表达转录后调节过程中发挥了重要作用[48]。在肝癌组织中,有一些 miRNA(miR-221、miR-21、miR-18 等)表达上调,而另外一些 miRNA(miR-122a、miR-199a、miR-200 等)则呈现下调状态[49-50]。因此,针对不同的肝癌中 miRNA 的异常表达,可以导入 miRNA 类似物或者 miRNA 抑制剂调节细胞内 miRNA 的表达水平。将 miRNA 与化疗药物联合也是肝癌治疗的一种主要策略。miR-101 在肝癌组织中呈下调状态,Xu 等[51]采用脂质体共载 miR-101 类似物与阿霉素制备纳米药物 miR-101/DOX-L,研究结果显示,与单独携载 miR101 或阿霉素的纳米体系相比,miR-101/DOX-L 可以显著提高细胞凋亡率,发挥协同抗肿瘤作用。
2.3. 化疗/光疗法联合
近年来,光疗法由于其操作便利、创伤小等优势引起了极大的关注,成为肿瘤强有力的治疗手段。光疗法主要包括光热治疗(photothermal therapy,PTT)和光动力治疗(photodynamic therapy,PDT),其原理是光敏剂在光照的作用下产生热能或活性氧来起到杀伤肿瘤的作用[52]。许多无机纳米材料如纳米金、碳纳米材料、硫化铜等均可以在近红外光照射下产热杀伤肿瘤细胞。血卟啉是一种最常见的光动力治疗光敏剂,而最近吲哚菁绿、普鲁士蓝等有机染料也被用于光动力治疗,受到广泛的关注。
Wu 等[53]制备了一种聚乙二醇修饰的载阿霉素介孔硅与硫化铜的杂化纳米粒子,当纳米粒子到达肿瘤部位后,给予近红外光照射,负载在介孔硅孔隙口的硫化铜粒子产热,同时从孔隙口离开,使负载在介孔硅内部的阿霉素释放出来,实现光热治疗和化疗的协同抗肿瘤效应。最近,他们又将低氧敏感的前药 AQ4N 通过 pH 敏感键与 HCC 特异性 DNA 适配体的碱基偶联,同时适配体末端连接金纳米粒子;实验表明复合纳米粒子能够稳定存在于生理环境中,而当其到达肿瘤部位时,受肿瘤微环境中的低 pH 值及高谷胱甘肽刺激,释放前药和金纳米粒子;在光照条件下,金纳米粒子产热同时消耗肿瘤微环境中的氧气,造成局部缺氧,使 AQ4N 转变成活性分子 AQ4,发挥抗肝癌作用[54]。
此外,基于上转换材料的近红外光载体系统[55]以及联合光动力治疗及 RNA 干扰的多功能纳米粒子[56]也被开发作为肿瘤联合治疗的载体平台。基于这类材料的纳米药物在肝癌联合治疗及诊疗一体化方面具有广泛的应用前景。
3. 展望
纳米药物发展至今种类繁多,在肝癌治疗领域中取得了巨大的进步。纳米药物良好的靶向性、可修饰性,使其能显著提高肿瘤部位的药物浓度,降低对非肿瘤部位的毒副作用。此外,联合不同治疗机制的纳米药物有望实现肝癌的精准治疗。然而,大部分纳米药物仍处于临床前研究阶段。开发可用于临床肝癌治疗的纳米药物仍有很多问题需要解决,包括寻找更为安全、有效的给药载体,以及如何实现临床个体化治疗等。
Funding Statement
国家自然科学基金青年科学基金项目资助(81501575);天津市卫生行业重点攻关项目资助(14KG142)
References
- 1.Yang Judong, Roberts L R Hepatocellular carcinoma: A global view. Nat Rev Gastroenterol Hepatol. 2010;7(8):448–458. doi: 10.1038/nrgastro.2010.100. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Galle P R, Tovoli F, Foerster F, et al The treatment of intermediate stage tumours beyond TACE: From surgery to systemic therapy. J Hepatol. 2017;67(1):173–183. doi: 10.1016/j.jhep.2017.03.007. [DOI] [PubMed] [Google Scholar]
- 3.Benson A B 3rd, D’Angelica M I, Abbott D E, et al NCCN guidelines insights: hepatobiliary cancers, version 1.2017. J Natl Compr Canc Netw. 2017;15(5):563–573. doi: 10.6004/jnccn.2017.0059. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Llovet J M, Ricci S, Mazzaferro V, et al Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008;359(4):378–390. doi: 10.1056/NEJMoa0708857. [DOI] [PubMed] [Google Scholar]
- 5.Bruix J, Takayama T, Mazzaferro V, et al Adjuvant sorafenib for hepatocellular carcinoma after resection or ablation (STORM): a phase 3, randomised, double-blind, placebo-controlled trial. Lancet Oncol. 2015;16(13):1344–1354. doi: 10.1016/S1470-2045(15)00198-9. [DOI] [PubMed] [Google Scholar]
- 6.Bouattour M, Soubrane O, de Gramont A, et al Adjuvant therapies in advanced hepatocellular carcinoma: moving forward from the STORM. Trials. 2016;17(1):563. doi: 10.1186/s13063-016-1675-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Dutta R, Mahato R I Recent advances in hepatocellular carcinoma therapy. Pharmacol Ther. 2017;173:106–117. doi: 10.1016/j.pharmthera.2017.02.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Iyer A K, Khaled G, Fang Jun, et al Exploiting the enhanced permeability and retention effect for tumor targeting. Drug Discov Today. 2006;11(17/18):812–818. doi: 10.1016/j.drudis.2006.07.005. [DOI] [PubMed] [Google Scholar]
- 9.Dai Yunlu, Xu Can, Sun Xiaolian, et al Nanoparticle design strategies for enhanced anticancer therapy by exploiting the tumour microenvironment. Chem Soc Rev. 2017;46(12):3830–3852. doi: 10.1039/c6cs00592f. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Zhang Jing, Wang Tianqi, Mu Shengjun, et al Biomacromolecule/lipid hybrid nanoparticles for controlled delivery of sorafenib in targeting hepatocellular carcinoma therapy. Nanomedicine (Lond) 2017;12(8):911–925. doi: 10.2217/nnm-2016-0402. [DOI] [PubMed] [Google Scholar]
- 11.Liu Minchen, Liu Lin, Wang Xiarong, et al Folate receptor-targeted liposomes loaded with a diacid metabolite of norcantharidin enhance antitumor potency for H22 hepatocellular carcinoma both in vitro and in vivo. Int J Nanomedicine. 2016;11:1395–1412. doi: 10.2147/IJN.S96862. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Zhang Jinming, Zhang Min, Ji Juan, et al Glycyrrhetinic acid-mediated polymeric drug delivery targeting the acidic microenvironment of hepatocellular carcinoma. Pharm Res. 2015;32(10):3376–3390. doi: 10.1007/s11095-015-1714-2. [DOI] [PubMed] [Google Scholar]
- 13.Tsend-Ayush A, Zhu Xiumei, Ding Yu, et al Lactobionic acid-conjugated TPGS nanoparticles for enhancing therapeutic efficacy of etoposide against hepatocellular carcinoma. Nanotechnology. 2017;28(19):195602. doi: 10.1088/1361-6528/aa66ba. [DOI] [PubMed] [Google Scholar]
- 14.Zhang Cong, An Tong, Wang Dan, et al Stepwise pH-responsive nanoparticles containing charge-reversible pullulan-based shells and poly(beta-amino ester)/poly(lactic-co-glycolic acid) cores as carriers of anticancer drugs for combination therapy on hepatocellular carcinoma. J Control Release. 2016;226:193–204. doi: 10.1016/j.jconrel.2016.02.030. [DOI] [PubMed] [Google Scholar]
- 15.Xiong Qingqing, Cui Mangmang, Bai Yang, et al A supramolecular nanoparticle system based on β-cyclodextrin-conjugated poly-l-lysine and hyaluronic acid for co-delivery of gene and chemotherapy agent targeting hepatocellular carcinoma. Colloids Surf B Biointerfaces. 2017;155:93–103. doi: 10.1016/j.colsurfb.2017.04.008. [DOI] [PubMed] [Google Scholar]
- 16.Wang J, Wang Hangxiang, Li Jie, et al iRGD-decorated polymeric nanoparticles for the efficient delivery of vandetanib to hepatocellular carcinoma: preparation and in vitro and in vivo evaluation . ACS Appl Mater Interfaces. 2016;8(30):19228–19237. doi: 10.1021/acsami.6b03166. [DOI] [PubMed] [Google Scholar]
- 17.Li Yanli, Hu Yan, Xiao Jie, et al Investigation of SP94 peptide as a specific probe for hepatocellular carcinoma imaging and therapy. Sci Rep. 2016;6:33511. doi: 10.1038/srep33511. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Gao Jie, Xia Yu, Chen Huaiwen, et al Polymer-lipid hybrid nanoparticles conjugated with anti-EGF receptor antibody for targeted drug delivery to hepatocellular carcinoma. Nanomedicine (Lond) 2014;9(2):279–293. doi: 10.2217/nnm.13.20. [DOI] [PubMed] [Google Scholar]
- 19.Zhang Xiaoran, Li Jinxiu, Yan Meixing Targeted hepatocellular carcinoma therapy: transferrin modified, self-assembled polymeric nanomedicine for co-delivery of cisplatin and doxorubicin. Drug Dev Ind Pharm. 2016;42(10):1590–1599. doi: 10.3109/03639045.2016.1160103. [DOI] [PubMed] [Google Scholar]
- 20.Liu Lanxia, Dong Xia, Zhu Dunwan, et al TAT-LHRH conjugated low molecular weight chitosan as a gene carrier specific for hepatocellular carcinoma cells. Int J Nanomedicine. 2014;9:2879–2889. doi: 10.2147/IJN.S61392. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Liu Zhongbing, Ke Famin, Duan Chenggang, et al Mannan-conjugated adenovirus enhanced gene therapy effects on murine hepatocellular carcinoma cells in vitro and in vivo . Bioconjug Chem. 2013;24(8):1387–1397. doi: 10.1021/bc400215a. [DOI] [PubMed] [Google Scholar]
- 22.Jiang Jianxin, Chen Huaiwen, Yu Chao, et al The promotion of salinomycin delivery to hepatocellular carcinoma cells through EGFR and CD133 aptamers conjugation by PLGA nanoparticles. Nanomedicine (Lond) 2015;10(12):1863–1879. doi: 10.2217/nnm.15.43. [DOI] [PubMed] [Google Scholar]
- 23.Chen Chen, Ke Jiyuan, Zhou X E, et al Structural basis for molecular recognition of folic acid by folate receptors. Nature. 2013;500(7463):486–489. doi: 10.1038/nature12327. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Cai Yuee, Xu Yingqi, Chan H F, et al Glycyrrhetinic acid mediated drug delivery carriers for hepatocellular carcinoma therapy. Mol Pharm. 2016;13(3):699–709. doi: 10.1021/acs.molpharmaceut.5b00677. [DOI] [PubMed] [Google Scholar]
- 25.Shi Bin, Abrams M, Sepp-Lorenzino L Expression of asialoglycoprotein receptor 1 in human hepatocellular carcinoma. J Histochem Cytochem. 2013;61(12):901–909. doi: 10.1369/0022155413503662. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Pranatharthiharan S, Patel M D, Malshe V C, et al Asialoglycoprotein receptor targeted delivery of doxorubicin nanoparticles for hepatocellular carcinoma. Drug Deliv. 2017;24(1):20–29. doi: 10.1080/10717544.2016.1225856. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Oishi N, Yamashita T, Kaneko S Molecular biology of liver cancer stem cells. Liver Cancer. 2014;3(2):71–84. doi: 10.1159/000343863. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Marelli U K, Rechenmacher F, Sobahi T R, et al Tumor targeting via integrin ligands. Front Oncol. 2013;3:222. doi: 10.3389/fonc.2013.00222. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Yin Hong, Yang Jie, Zhang Qing, et al iRGD as a tumor—penetrating peptide for cancer therapy (Review) Mol Med Rep. 2017;15(5):2925–2930. doi: 10.3892/mmr.2017.6419. [DOI] [PubMed] [Google Scholar]
- 30.Lo A, Lin C T, Wu H C Hepatocellular carcinoma cell-specific peptide ligand for targeted drug delivery. Mol Cancer Ther. 2008;7(3):579–589. doi: 10.1158/1535-7163.MCT-07-2359. [DOI] [PubMed] [Google Scholar]
- 31.Liu Xiaomin, Wang Ping, Zhang Caiyan, et al Epidermal growth factor receptor (EGFR): A rising star in the era of precision medicine of lung cancer. Oncotarget. 2017;8(30):50209–50220. doi: 10.18632/oncotarget.16854. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Fan Gaowei, Zhang Kuo, Ding Jiansheng, et al Prognostic value of EGFR and KRAS in circulating tumor DNA in patients with advanced non-small cell lung cancer: a systematic review and meta-analysis. Oncotarget. 2017;8(20):33922–33932. doi: 10.18632/oncotarget.15412. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Berasain C, Avila M A The EGFR signalling system in the liver: from hepatoprotection to hepatocarcinogenesis. J Gastroenterol. 2014;49(1):9–23. doi: 10.1007/s00535-013-0907-x. [DOI] [PubMed] [Google Scholar]
- 34.Tortorella S, Karagiannis T C Transferrin receptor-mediated endocytosis: a useful target for cancer therapy. J Membr Biol. 2014;247(4):291–307. doi: 10.1007/s00232-014-9637-0. [DOI] [PubMed] [Google Scholar]
- 35.Sun Hongguang, Zu Youli Aptamers and their applications in nanomedicine. Small. 2015;11(20):2352–2364. doi: 10.1002/smll.201403073. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Sun Duanping, Lu Jing, Zhong Yuwen, et al Sensitive electrochemical aptamer cytosensor for highly specific detection of cancer cells based on the hybrid nanoelectrocatalysts and enzyme for signal amplification. Biosens Bioelectron. 2016;75:301–307. doi: 10.1016/j.bios.2015.08.056. [DOI] [PubMed] [Google Scholar]
- 37.Trinh T L, Zhu Guizhi, Xiao Xilin, et al A synthetic aptamer-drug adduct for targeted liver cancer therapy. PLoS One. 2015;10(11):e0136673. doi: 10.1371/journal.pone.0136673. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Wang Fubing, Rong Yuan, Fang Min, et al Recognition and capture of metastatic hepatocellular carcinoma cells using aptamer-conjugated quantum dots and magnetic particles. Biomaterials. 2013;34(15):3816–3827. doi: 10.1016/j.biomaterials.2013.02.018. [DOI] [PubMed] [Google Scholar]
- 39.Hu Quanyin, Sun Wujin, Wang Chao, et al Recent advances of cocktail chemotherapy by combination drug delivery systems. Adv Drug Deliv Rev. 2016;98:19–34. doi: 10.1016/j.addr.2015.10.022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Richly H, Schultheis B, Adamietz I A, et al Combination of sorafenib and doxorubicin in patients with advanced hepatocellular carcinoma: results from a phase Ⅰ extension trial. Eur J Cancer. 2009;45(4):579–587. doi: 10.1016/j.ejca.2008.10.039. [DOI] [PubMed] [Google Scholar]
- 41.Zhang Jinming, Hu Jie, Chan H F, et al iRGD decorated lipid-polymer hybrid nanoparticles for targeted co-delivery of doxorubicin and sorafenib to enhance anti-hepatocellular carcinoma efficacy. Nanomedicine. 2016;12(5):1303–1311. doi: 10.1016/j.nano.2016.01.017. [DOI] [PubMed] [Google Scholar]
- 42.Taketomi A Clinical trials of antiangiogenic therapy for hepatocellular carcinoma. Int J Clin Oncol. 2016;21(2):213–218. doi: 10.1007/s10147-016-0966-0. [DOI] [PubMed] [Google Scholar]
- 43.Chang Huiju Optimal combination of antiangiogenic therapy for hepatocellular carcinoma. World J Hepatol. 2015;7(16):2029–2040. doi: 10.4254/wjh.v7.i16.2029. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Wang Yinsong, Chen Hongli, Liu Yuanyuan, et al pH-sensitive pullulan-based nanoparticle carrier of methotrexate and combretastatin A4 for the combination therapy against hepatocellular carcinoma. Biomaterials. 2013;34(29):7181–7190. doi: 10.1016/j.biomaterials.2013.05.081. [DOI] [PubMed] [Google Scholar]
- 45.Xu Zhenghong, Zhang Zhiwen, Chen Yi, et al The characteristics and performance of a multifunctional nanoassembly system for the co-delivery of docetaxel and iSur-pDNA in a mouse hepatocellular carcinoma model. Biomaterials. 2010;31(5):916–922. doi: 10.1016/j.biomaterials.2009.09.103. [DOI] [PubMed] [Google Scholar]
- 46.Gao Jie, Chen Huaiwen, Yu Yongsheng, et al Inhibition of hepatocellular carcinoma growth using immunoliposomes for co-delivery of adriamycin and ribonucleotide reductase M2 siRNA. Biomaterials. 2013;34(38):10084–10098. doi: 10.1016/j.biomaterials.2013.08.088. [DOI] [PubMed] [Google Scholar]
- 47.Oh H R, Jo H Y, Park J S, et al Galactosylated liposomes for targeted co-delivery of doxorubicin/vimentin siRNA to hepatocellular carcinoma. Nanomaterials (Basel) 2016;6(8):E141. doi: 10.3390/nano6080141. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Hayes C N, Chayama K MicroRNAs as biomarkers for liver disease and hepatocellular carcinoma. Int J Mol Sci. 2016;17(3):280. doi: 10.3390/ijms17030280. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Yang Ningning, Ekanem N R, Sakyi C A, et al Hepatocellular carcinoma and microRNA: New perspectives on therapeutics and diagnostics. Adv Drug Deliv Rev. 2015;81:62–74. doi: 10.1016/j.addr.2014.10.029. [DOI] [PubMed] [Google Scholar]
- 50.George J, Patel T Noncoding RNA as therapeutic targets for hepatocellular carcinoma. Semin Liver Dis. 2015;35(1):63–74. doi: 10.1055/s-0034-1397350. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Xu Fei, Liao Jiazhi, Xiang Guangya, et al MiR-101 and doxorubicin codelivered by liposomes suppressing malignant properties of hepatocellular carcinoma. Cancer Med. 2017;6(3):651–661. doi: 10.1002/cam4.1016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Peng Juanjuan, Zhao Lingzhi, Zhu Xingjun, et al Hollow silica nanoparticles loaded with hydrophobic phthalocyanine for near-infrared photodynamic and photothermal combination therapy. Biomaterials. 2013;34(32):7905–7912. doi: 10.1016/j.biomaterials.2013.07.027. [DOI] [PubMed] [Google Scholar]
- 53.Wu Lingjie, Wu Ming, Zeng Yongyi, et al Multifunctional PEG modified DOX loaded mesoporous silica nanoparticle@CuS nanohybrids as photo-thermal agent and thermal-triggered drug release vehicle for hepatocellular carcinoma treatment. Nanotechnology. 2015;26(2):025102. doi: 10.1088/0957-4484/26/2/025102. [DOI] [PubMed] [Google Scholar]
- 54.Zhang Da, Zheng Aixian, Li Juan, et al Smart Cu(II)-aptamer complexes based gold nanoplatform for tumor micro-environment triggered programmable intracellular prodrug release, photodynamic treatment and aggregation induced photothermal therapy of hepatocellular carcinoma. Theranostics. 2017;7(1):164–179. doi: 10.7150/thno.17099. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Jin G, Feng Guangxue, Qin Wei, et al Multifunctional organic nanoparticles with aggregation-induced emission (AIE) characteristics for targeted photodynamic therapy and RNA interference therapy. Chem Commun (Camb) 2016;52(13):2752–2755. doi: 10.1039/c5cc07818k. [DOI] [PubMed] [Google Scholar]
- 56.Lin Min, Gao Yan, Hornicek F, et al Near-infrared light activated delivery platform for cancer therapy. Adv Colloid Interface Sci. 2015;226(Pt B):123–137. doi: 10.1016/j.cis.2015.10.003. [DOI] [PMC free article] [PubMed] [Google Scholar]


