Abstract
本研究拟探究血根碱对大鼠气道平滑肌细胞(rASMCs)的刚度、牵张力、应力纤维分布等细胞生物力学特性的影响。体外培养的 rASMCs 经过血根碱溶液在不同浓度(0.005~5 μmol/L)条件下分别处理 12 h、24 h、36 h 和 48 h 后,采用噻唑盐比色法、光学磁粒扭转细胞测量仪、傅里叶变换牵张力显微术、划痕实验和免疫荧光显微技术等检测其活性、刚度、牵张力、迁移速度和微丝骨架分布等细胞生物力学特性的变化。实验结果显示,在浓度低于 0.5 μmol/L 时,血根碱对细胞活性没有明显影响,但对细胞生物力学特性呈现浓度和时间依赖性,具体表现为 rAMSCs 经 0.05 μmol/L 和 0.5 μmol/L 浓度的血根碱处理 12 h 和 24 h 后细胞刚度、细胞牵张力和细胞迁移速度均明显降低、细胞骨架应力纤维出现解聚。鉴于气道平滑肌细胞(ASMCs)生物力学特性在哮喘气道高反应性(AHR)中的关键作用,上述的实验结果提示,血根碱有可能通过改变气道平滑肌细胞生物力学特性而改善 AHR,进而为开发基于血根碱的气道松弛剂等哮喘治疗药物奠定基础。
Keywords: 气道平滑肌细胞, 血根碱, 生物力学, 细胞刚度, 细胞牵张力
Abstract
This study aimed to evaluate the effect of sanguinarine on biomechanical properties of rat airway smooth muscle cells (rASMCs) including stiffness, traction force and cytoskeletal stress fiber organization. To do so, rASMCs cultured in vitro were treated with sanguinarine solution at different concentrations (0.005~5 μmol/L) for 12 h, 24 h, 36 h, and 48 h, respectively. Subsequently, the cells were tested for their viability, stiffness, traction force, migration and microfilament distribution by using methylthiazolyldiphenyl-tetrazolium bromide assay, optical magnetic twisting cytometry, Fourier transform traction microscopy, scratch wound healing method, and immunofluorescence microscopy, respectively. The results showed that at concentration below 0.5 μmol/L sanguinarine had no effect on cell viability, but caused dose and time dependent effect on cell biomechanics. Specifically, rASMCs treated with sanguinarine at 0.05 μmol/L and 0.5 μmol/L for 12 and 24 h exhibited significant reduction in stiffness, traction force and migration speed, together with disorganization of the cytoskeletal stress fibers. Considering the essential role of airway smooth muscle cells (ASMCs) biomechanics in the airway hyperresponsiveness (AHR) of asthma, these findings suggest that sanguinarine may ameliorate AHR via alteration of ASMCs biomechanical properties, thus providing a novel approach for asthma drug development.
Keywords: airway smooth muscle cells, sanguinarine, biomechanics, cell stiffness, cell traction force
引言
哮喘的典型特征是气道高反应性(airway hyperresponsiveness,AHR),该现象是指患者气道对收缩剂的响应比正常人群更强或者更敏感[1-3]。无论是正常人群还是哮喘患者的气道平滑肌在受到乙酰胆碱、组胺等刺激物刺激时均会发生收缩,但哮喘患者的气道平滑肌细胞(airway smooth muscle cells,ASMCs)收缩幅度更明显,易导致气道狭窄[4-5],进而引发哮喘患者呼吸困难。
导致 AHR 的原因包括 ASMCs 和气道间质的连接减弱、ASMCs 增多和增大以及 ASMCs 生物力学特性的变化,如刚度和收缩能力增加等[6-8]。其中,ASMCs 生物力学特性是 AHR 的最终决定因素,因此也是哮喘治疗的重要靶点[9-10]。故而具有调控 ASMCs 生物力学特性(如降低细胞刚度和收缩能力)的药物可能具有改善 AHR 的能力,从而可能用于哮喘的治疗[11]。
然而,定量评估药物对细胞生物力学特性(特别是细胞刚度和牵张力)的影响一直是棘手的问题。近年来发展起来的光学磁粒扭转细胞测量仪(optical magnetic twisting cytometry,OMTC)、傅里叶变换牵张力显微术(Fourier transform traction microscopy,FTTM)为快速检测群体细胞的刚度和牵张力提供了相对简单的技术手段[12-13]。OMTC 检测细胞刚度的原理是将表面修饰得有精氨酸–甘氨酸–天门冬氨酸 (Arg-Gly-Asp,RGD)的磁粒与贴壁细胞表面黏附蛋白整合素结合而黏附在细胞表面,然后通过外加磁场对磁粒施加一定的扭转磁力矩从而驱动磁粒产生扭转运动。由于磁粒在外力驱动下的运动与其通过细胞整合素联结的细胞微丝骨架结构的力学性质相关,通过光学方法跟踪记录磁粒运动的位移值并计算磁力矩与磁粒位移的比值即可测量到细胞的刚度。FTTM 的基本原理则是将细胞贴壁生长在一层含有荧光微粒的聚丙烯酰胺凝胶表面。由于贴壁细胞施加牵张力在弹性的聚丙烯酰胺凝胶上,使得凝胶内部的荧光微粒发生位移。同样利用光学方法追踪记录荧光微粒的位移,进一步通过傅里叶变换计算即可得到细胞对基底施加牵张力的大小和分布。目前,这两种方法已在探究 ASMCs 生物力学行为与哮喘病理机制的关系[14-15]、苦味物质对 ASMCs 的舒张作用[16]以及高通量新型药物筛选等[17]方面得到了广泛的应用并取得了相应的结果。
血根碱(C20H15O5N)是从罂粟科博落回属等植物当中提取的异喹啉类生物碱,其药理作用主要包括抗炎、抗氧化及抗肿瘤等。近年来还发现血根碱具有调控平滑肌收缩–舒张活动的作用。例如,血根碱对大鼠胸主动脉平滑肌具有浓度依赖的舒张效应,并且还可抑制由肾上腺素和高浓度 K+ 引起的平滑肌收缩[18];血根碱对乙酰胆碱、组胺及高浓度 K+ 诱导的小肠平滑肌细胞收缩也具有明显的抑制作用,其内在作用机制是血根碱抑制了细胞蛋白激酶 Cp/蛋白激酶 C 磷酸酶抑制剂信号传导通路,并可抑制毒蕈碱型受体的表达[19-20]。此外,血根碱对上皮细胞也有降低细胞牵张力的效应[17]。
上述研究显示,血根碱可以调节多种平滑肌的收缩—舒张活动,同时可以降低上皮细胞的细胞牵张力,但血根碱对 ASMCs 的生物力学特性的影响未见报道。本研究的目的主要是评估血根碱是否可以降低 ASMCs 刚度和收缩能力等与 AHR 密切相关的细胞生物力学特性,为后续开发基于血根碱的气道松弛剂等哮喘治疗药物奠定基础。
1. 材料和方法
1.1. 实验材料
雌性 Sprague Dawley 大鼠(简称 SD 大鼠)购自常州卡文斯动物实验有限公司;培养瓶、共聚焦培养皿、离心管、6 孔细胞培养板和 96 孔细胞培养板购自美国 Corning 公司(Corning,NY)。
1.2. 实验仪器
CO2 细胞培养箱(MCO-18AIC)购自日本三洋公司;生物安全柜(BSC-1300IIA2)购自苏州安泰空气技术有限公司;超级纯水仪(Milli Q Plus,Integral 10)购自美国 Millipore 公司;高速台式冷冻离心机(Coulter Allegra X-30R)购自美国 Beckman 公司;倒置显微镜(Primo Vert)、倒置荧光显微镜(cell observer)、激光共聚焦显微镜(LSM710)购自德国 Zeiss 公司;酶联免疫分析仪(Infinite F50)购自瑞士 TECAN 公司;体视显微镜(S8APO)购自德国 Leica 公司;光学磁粒扭转细胞测量仪(OMTC-1D)购自瑞士 EDL Eberhard 公司。
1.3. 试剂
血根碱、转铁蛋白、牛胰岛素购自上海源叶生物科技有限公司,杜氏改良培养基(Dulbecco’s modified Eagle medium,DMEM)、胎牛血清(fetal bovine serum,FBS)、牛血清白蛋白(bovine serum albumin,BSA)、青霉素、链霉素及胰蛋白酶购自美国 Gibco 公司,α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)一抗、免疫球蛋白荧光二抗、抗荧光淬灭封片剂和多聚甲醛购自武汉博士德生物工程有限公司;磁粒购自美国 Invitrogen 公司;噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)、I 型鼠尾胶原购自美国 Sigma 公司;罗丹明标记的鬼笔环肽购自上海翊圣生物科技有限公司;戊巴比妥钠购自德国 Merck 公司;二甲基亚砜(dimethyl sulfoxide,DMSO)购自上海凌峰化学试剂有限公司;聚乙二醇辛基苯基醚(Triton-X-100)、RGD 购自上海阿拉丁公司;其他化学试剂均为分析纯。
1.4. 大鼠 ASMCs 原代培养
SD 大鼠 ASMCs(rASMCs)的体外原代培养按参考文献[21]的方法加以改进后培养。先在 SD 大鼠(0.18~0.22 kg)腹腔注射戊巴比妥钠(30~40 mg/kg)施以麻醉,在无菌条件下打开胸腔后取出气道,放入盛有磷酸盐缓冲液(phosphate buffer solution,PBS)(pH7.4)的培养皿中,在体视显微镜下剥离气道黏膜层,用眼科剪将气道组织剪成 1 mm × 1 mm × 1 mm 细小碎块,用 PBS 洗涤 3 次后,加入 10 倍体积的胰蛋白酶(0.1%)在 37℃ 条件下消化 15 min,随后添加含 20% FBS 的 DMEM 终止胰蛋白酶消化;然后于 4℃ 条件下 1 500 r/min 离心 5 min,弃上清,加入完全培养基(含 80%DMEM、20%FBS、100 U/mL 青霉素和 100 μg/mL 链霉素),将组织块吹散并转移至培养瓶;最后,倒置于 CO2 细胞培养箱培养 6 h 后,轻轻翻转培养瓶,加入 1.5 mL 完全培养基,静置培养 3~4 d 后待细胞爬出。大约 15 d 后,细胞会生长成“峰—谷”状。其后,将细胞贴壁纯化 2 代,采用免疫荧光染色技术标记 α-SMA,鉴定为 rASMCs,取 3~10 代的细胞进行实验。
1.5. MTT 比色法检测细胞活性
收集本文 1.4 小节培养的对数生长期的 rASMCs,以 1 × 104 个/孔的密度接种于 96 孔细胞培养板中,培养 24 h 后换成无血清培养基(DMEM 中加入 5 mg/L 胰岛素、5 mg/L 转铁蛋白、100 U/mL 青霉素和 100 μg/mL 链霉素),12 h 后实验组培养皿分别加入不同浓度血根碱(最终浓度为 0.005、0.05、0.5、5 μmol/L),分别命名为 0.005 μmol/L 组、0.050 μmol/L 组、0.500 μmol/L 组、5.000 μmol/L 组。由于实验中的血根碱采用 DMSO 溶解,导致实验组不仅含有不同浓度的血根碱,还含有 0.1%DMSO。因此,对照组培养皿加入 DMSO(最终浓度为 0.1%),每个组 6 个复孔。以上各组细胞在 37℃ 条件下培养 12、24、36、48 h 后,每孔加入 5 mg/mL 的 MTT 各 20 μL,孵育 4 h 后,吸弃孔内液体,每孔加 200 μL 的 DMSO,将 96 孔细胞培养板放置于摇床上振荡 10 min 后,用酶联免疫分析仪测定波长为 495 nm 下的光密度值,进而筛选血根碱作用的安全浓度,以排除血根碱的细胞毒性对实验结果的影响。
1.6. OMTC 检测细胞刚度
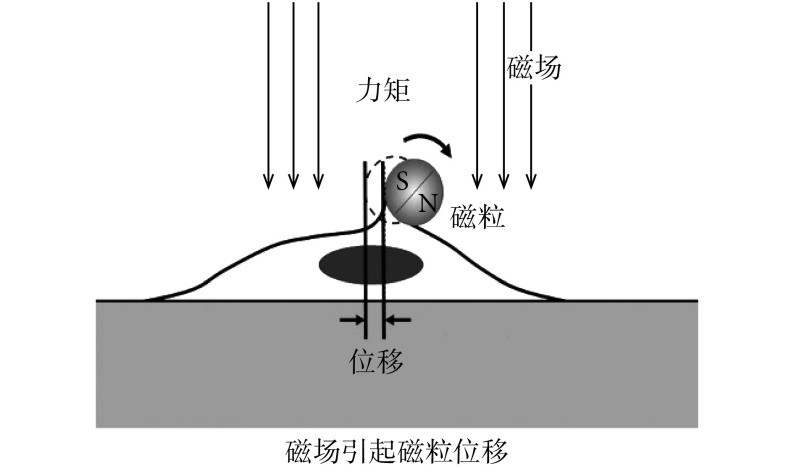
本文将 rASMCs 经血根碱处理后,用 OMTC 检测细胞刚度变化[13]。具体操作方法为:先将细胞接种于可拆 96 孔细胞培养板中,细胞密度为 1 × 104 个/孔,贴壁生长 24 h 后,换无血清培养基,继续培养 12 h 后加入经 1.5 小节确定的对细胞毒性较小的不同浓度的血根碱分别处理 12 h 和 24 h,随后加入表面已包被 RGD、直径为 4.5 μm 的磁粒,37℃ 条件下孵育 30 min 后,PBS 冲洗掉未结合的磁粒,加入 200 μL 无血清培养基,将 96 孔细胞培养板小室放入 OMTC 专用线圈中,通过外加 1 000 Gs 的磁场磁化磁粒 3 次,随后施加一个随时间正弦变化的磁场扭转磁粒(频率为 0.3 Hz,扭转 54 次),如图 1 所示,同时通过显微镜拍照记录磁粒的移动情况,用 MATLAB 软件(MathWorks Inc.,美国)编写的程序进行分析处理,计算细胞刚度,每组重复 3 次。
图 1.
Schematic diagram of OMTC to measure cell stiffness
OMTC 检测细胞刚度示意图
1.7. FTTM 检测细胞牵张力
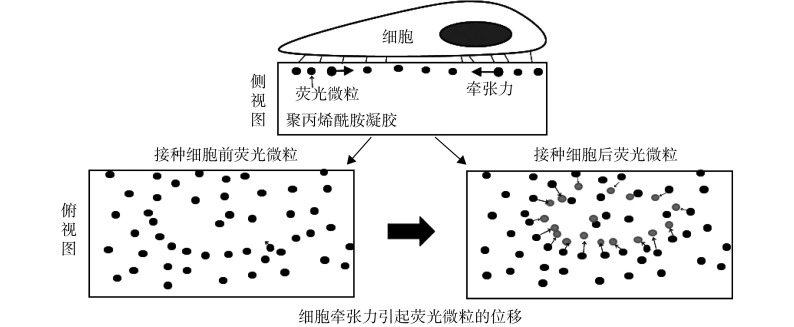
采用 FTTM 检测细胞牵张力[22-23]。具体操作方法为:在 35 mm 共聚焦培养皿底部制备刚度为 4 kPa 聚丙烯酰胺凝胶(厚度为 100 μm,含荧光素标记直径为 0.2 μm 的微粒),采用Ⅰ型鼠尾胶原包被后,接种 rASMCs(5 000 个/皿),24 h 后更换无血清培养基,加入经 1.5 小节确定的对细胞毒性较小的不同浓度血根碱分别处理 12 h 和 24 h 后,在倒置荧光显微镜下寻找单个生长的 rASMCs,拍照采集细胞相差和荧光微粒分布图片;随后向培养皿中加入 200 μL 氢氧化钠水溶液(浓度为 1 mol/L),待细胞裂解后再次拍照采集荧光微粒分布图片,通过 MATLAB 软件(MathWorks Inc.,美国)编写的程序分析相对应的两张荧光微粒分布图片,获得细胞脱落前后凝胶内部微粒的位移场,如图 2 所示,再通过傅里叶变换反演出细胞力场分布图,由此可以得出细胞的牵张力。每组实验采集 20 个细胞作为重复。
图 2.
Schematic diagram of FTTM to measure traction force
FTTM 检测细胞牵张力示意图
1.8. 免疫荧光技术检测细胞骨架应力纤维分布
将 rASMCs 以经 1.5 小节确定的对细胞毒性较小的不同浓度血根碱处理 12、24、36、48 h 后,弃上清,4% 多聚甲醛室温固定 20 min 后,用 PBS(含 0.3%Triton X-100)洗涤 3 次,每次 5 min;用 1% BSA 溶液封闭 30 min 后,以罗丹明标记的鬼笔环肽(1:200 比例稀释)室温染色 1 h 后,PBS 洗涤 3 次,每次 5 min;用抗荧光淬灭封片剂封片后在激光共聚焦显微镜(63×)下观察细胞骨架的应力纤维并拍照。
1.9. 划痕实验检测细胞迁移能力
取对数生长期 rASMCs,以 4 × 105 个/孔的密度接种于 6 孔细胞培养板,当融合度达 90% 时,用 10 μL 无菌枪头划过细胞群落,PBS 冲洗掉脱落细胞后,换无血清培养基,分别加入经 1.5 小节确定的对细胞毒性较小的不同浓度的血根碱,对照组加入 DMSO(最终浓度为 0.1%),将细胞培养板放置于 CO2 细胞培养箱继续培养,分别于 0、12、24、36、48 h 将培养板放置于倒置荧光显微镜下对划痕区域进行观察、拍照。随后采用专业图像分析软件 Image Pro Plus 6.0(Media cybernetics Inc.,美国)测量划痕区域面积,进而计算愈合率。计算公式为:划痕愈合率 =(起始划痕面积 – 不同时间点划痕面积)/起始划痕面积 × 100%。
1.10. 统计学分析
全部数据采用医学绘图软件 GraphPad Prism 5.0(GraphPad Software Inc.,美国)进行统计分析,结果以均数 ± 标准差表示,采用 t 检验比较实验组与对照组之间差异,P < 0.05 为差异具有统计学意义。
2. 结果
2.1. 血根碱对 rASMCs 活性的影响
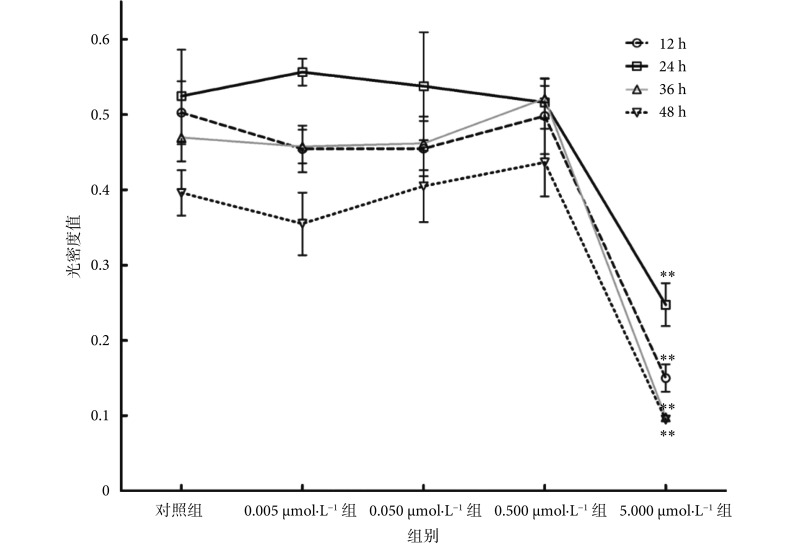
浓度为 0.005、0.05、0.5、5 μmol/L 的血根碱分别处理 rASMCs 达 12、24、36、48 h 后,采用 MTT 实验检测细胞活性,结果如图 3 所示。浓度为 0.005、0.05、0.5μmol/L 的血根碱处理 12~48 h 均没有明显改变细胞光密度值(P > 0.05),但浓度为 5 μmol/L 的血根碱处理 12 h 即明显降低细胞光密度值( P < 0.01),且随着处理时间的延长细胞光密度降低更加明显。上述实验结果表明,血根碱在浓度低于等于 0.5 μmol/L 时,对 rASMCs 的活性影响较小,但当浓度从 0.5 μmol/L 提高到 5 μmol/L 时,血根碱对细胞的毒性随浓度上升逐渐加大,最终可降低 rASMCs 活性达 80%~90%。因此,所有后续实验均采用血根碱浓度在 0.5 μmol/L 及以下的条件,以排除血根碱的细胞毒性对实验结果的影响。
图 3.
Effect of sanguinarine on rASMCs viability
血根碱对 rASMCs 活性的影响
Compared to control cells, **P < 0.01
与对照组相比,**P < 0.01
2.2. 血根碱对 rASMCs 刚度的影响
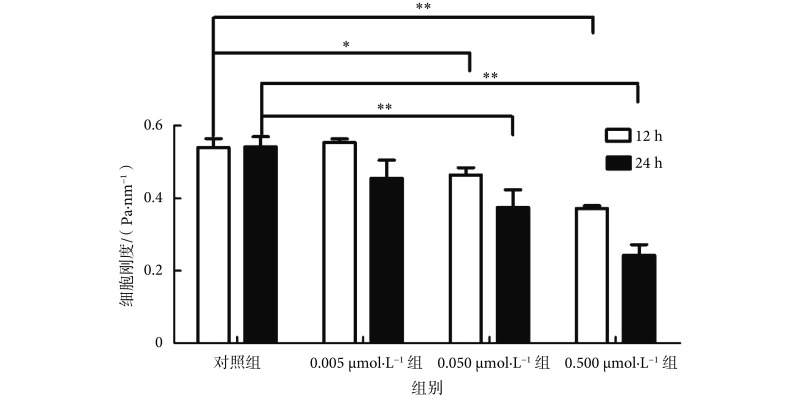
采用 OMTC 检测血根碱处理后 rASMCs 的刚度,结果如图 4 所示。对照组(0.1%DMSO 处理的 rASMCs)在 12 h 后的细胞刚度为(0.54 ± 0.03) Pa/nm,而经浓度为 0.005、0.05、0.5 μmol/L 的血根碱处理 12 h 后的 rASMCs 刚度分别为(0.55 ± 0.01)、(0.46 ± 0.02)、(0.37 ± 0.01) Pa/nm。统计分析显示,与对照组相比,浓度为 0.05 μmol/L 和 0.5 μmol/L 的血根碱处理 12 h 后,rASMCs 的刚度明显降低(P < 0.05)。同样浓度条件下,血根碱处理 rASMCs 24 h 与处理 12 h 相比,细胞刚度进一步降低。
图 4.
Effect of sanguinarine on rASMCs stiffness
血根碱对 rASMCs 刚度的影响
Compared to control cells, *P < 0.05, **P < 0.01
与对照组相比,*P < 0.05, **P < 0.01
2.3. 血根碱对 rASMCs 牵张力的影响
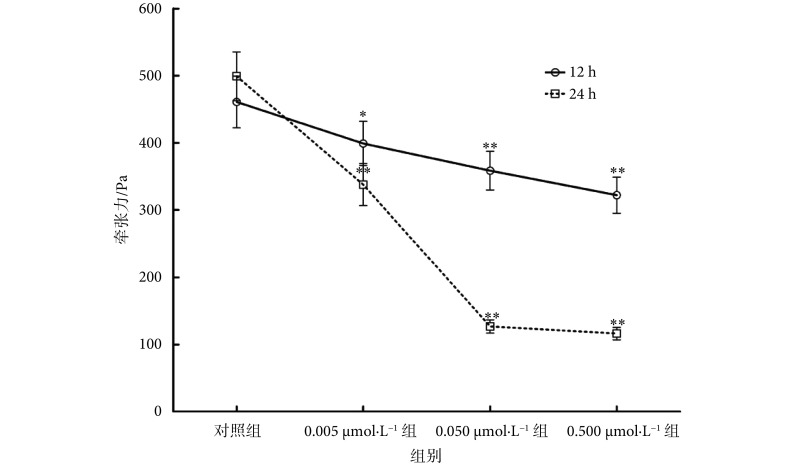
采用 FTTM 检测血根碱对 rASMCs 产生的细胞牵张力的影响,结果如图 5 所示。对照组(0.1% DMSO 处理的 rASMCs)在 12 h 后的细胞牵张力为(460 ± 38) Pa/nm,而经浓度为 0.005、0.05、0.5 μmol/L 的血根碱处理 12 h 后的细胞牵张力分别为(399 ± 32)、(358 ± 28)、(328 ± 26) Pa/nm。与对照组相比,浓度为 0.005 μmol/L 的血根碱处理组的细胞牵张力低于对照组,且差异具有统计学意义(P < 0.05),浓度为 0.05 μmol/L 和 0.5 μmol/L 的血根碱处理组的细胞牵张力和对照组相比差异仍具有统计学意义( P < 0.01)。与血根碱处理 12 h 的结果相比,血根碱处理 24 h 后将进一步降低细胞的牵张力。上述实验结果显示了血根碱的处理将明显降低 rASMCs 的细胞牵张力。
图 5.
Effect of sanguinarine on rAMSCstraction force
血根碱对 rASMCs 牵张力的影响
Compared to control cells, *P < 0.05, **P < 0.01
与对照组相比,*P < 0.05, **P < 0.01
2.4. 血根碱对 rASMCs 迁移能力的影响
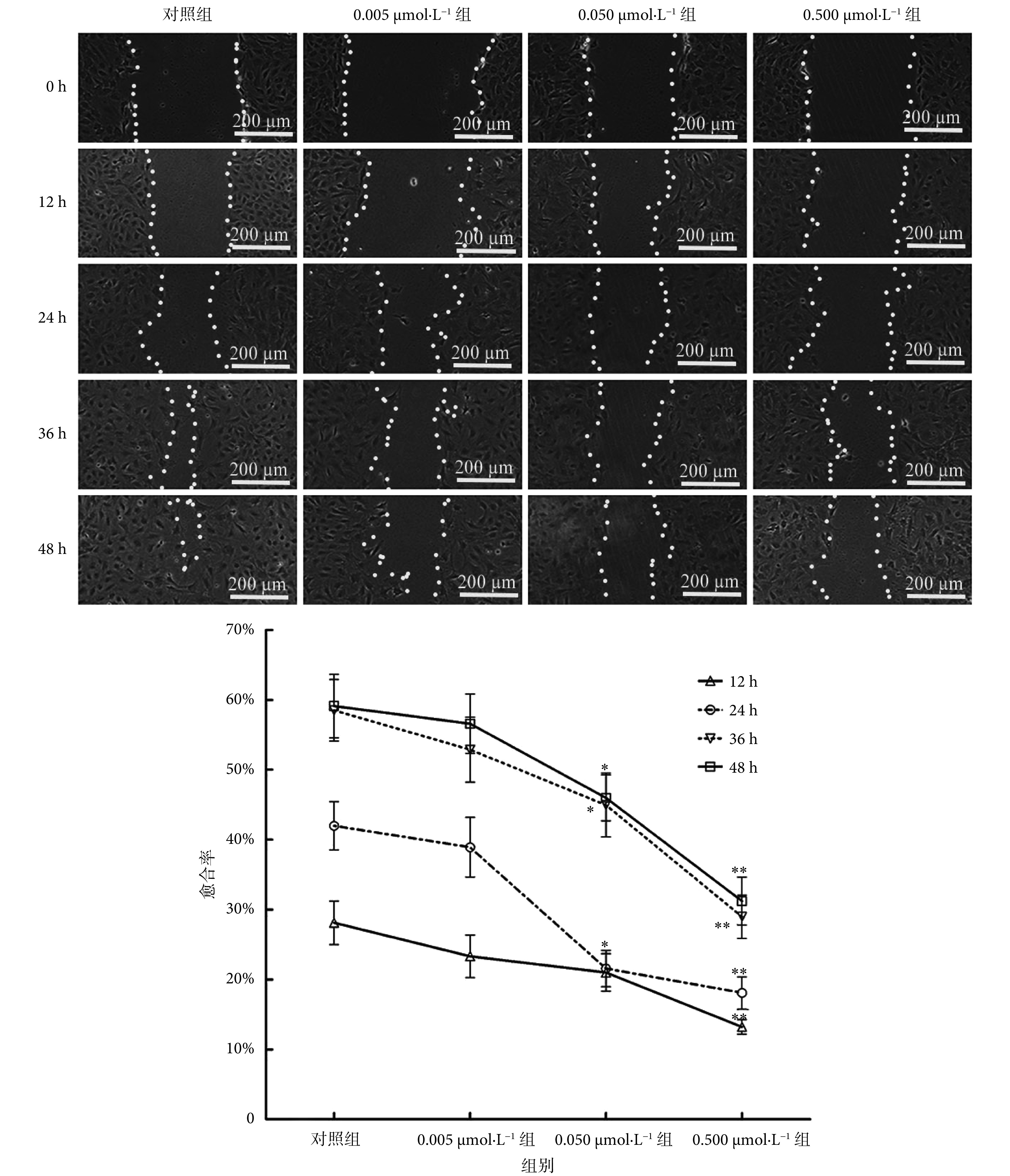
采用划痕实验检测浓度为 0.005、0.05、0.5 μmol/L 的血根碱处理 rASMCs 12、24、36、48 h 后的细胞迁移情况,结果如图 6 所示。随着时间的延长,对照组和各血根碱处理组愈合均有增加。血根碱浓度为 0.005 μmol/L 时,细胞愈合率开始显现降低趋势,但和对照组相比差异无统计学意义(P > 0.05);而浓度为 0.05 μmol/L 时,血根碱处理 12 h 后的细胞愈合率明显低于对照组( P < 0.05),当浓度增加到 0.5 μmol/L 时,rAMSCs 愈合率与对照组相比进一步降低( P < 0.01),且随着作用时间的延长,愈合率进一步降低,差异均具有统计学意义。上述实验结果显示,血根碱明显降低 rASMCs 的迁移能力。
图 6.
Effect of sanguinarine on rASMCs migration (10 ×)
血根碱对 rASMCs 迁移的影响(10 ×)
Compared to control cells (20 ×), *P < 0.05, **P < 0.01
与对照组相比,*P < 0.05, **P < 0.01
2.5. 血根碱对 rASMCs 骨架应力纤维分布的影响
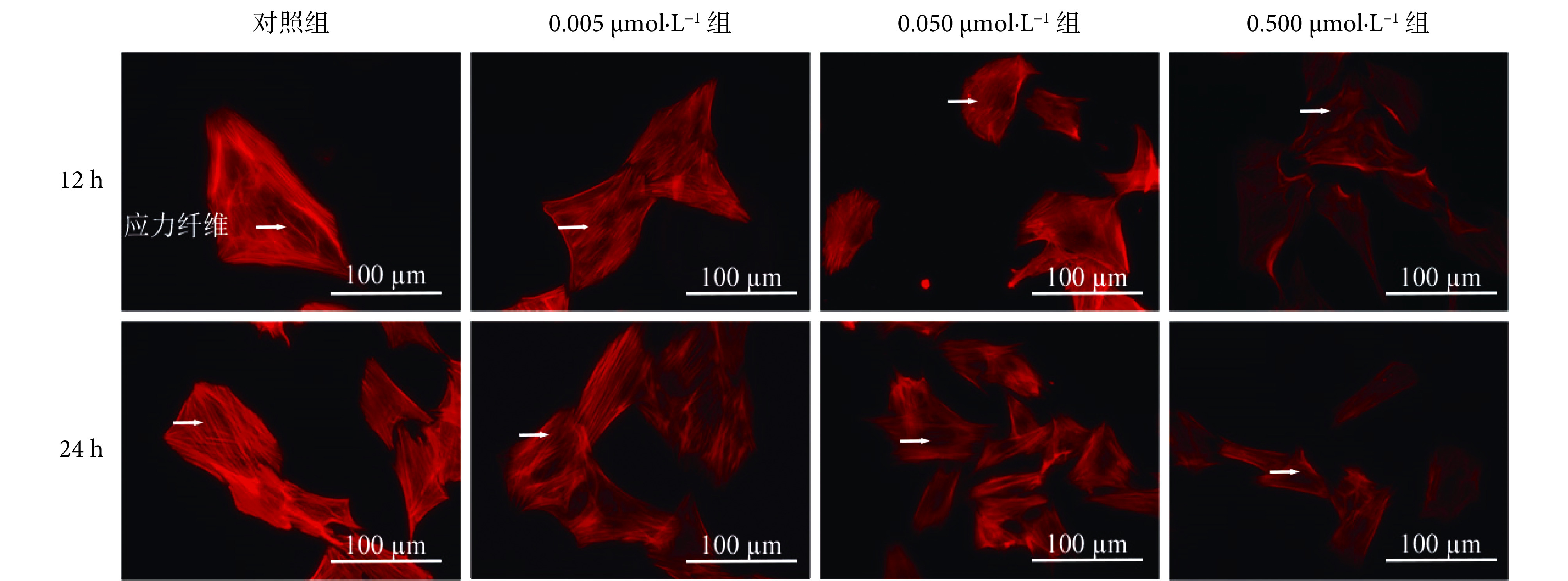
采用免疫荧光技术检测浓度为 0.005、0.05、0.5 μmol/L 的血根碱处理 rASMCs 12 h 和 24 h 后细胞骨架应力纤维的分布,实验结果如图 7 所示。与对照组比较,浓度为 0.005 μmol/L 的血根碱没有明显影响细胞内应力纤维的形成,但浓度为 0.05 μmol/L 和 0.5 μmol/L 的血根碱处理 12 h 和 24 h 均导致细胞应力纤维变细,并且中间区域的应力纤维数量降低。且随着作用时间的增加,血根碱对应力纤维的抑制效果更明显,提示血根碱可以诱导 rASMCs 的微丝解聚。
图 7.
Effectof sanguinarine on the distribution of stress fibers in rASMCs (63 ×)
血根碱对 rASMCs 细胞骨架应力纤维分布的影响(63 ×)
3. 分析与讨论
哮喘是一种慢性呼吸道疾病,目前临床常用的哮喘治疗药物主要是糖皮质激素(抗炎)、β2-肾上腺素受体激动剂(扩张支气管)等,但这些药物容易发生耐受,且副作用大。其中 β2-肾上腺素受体激动剂在很多患者中产生脱敏现象,导致难以持续有效地控制其哮喘典型症状 AHR,成为临床上棘手的问题。因此,探索和开发可以降低 AHR 的新型支气管扩张剂药物具有重要意义。
大鼠模型中的研究表明,AHR 与 ASMCs 的刚度正相关,提示降低 ASMCs 刚度的药物可以降低 AHR[24]。本研究实验结果显示,浓度为 0.05 μmol/L 和 0.5 μmol/L 血根碱可以明显降低 rASMCs 的细胞刚度,并具有时间和浓度依赖效应,提示其可能具有降低 AHR 的能力。
细胞收缩力在心肌、骨骼肌和平滑肌等多种细胞生理和病理环境中发挥重要作用,调节细胞收缩能力是调节肌肉细胞收缩—舒张药物的重要作用机制。血根碱调控多种非气道平滑肌(包括胸主动脉、肠道和子宫等组织平滑肌)收缩—舒张活动已有报道[25]。本研究表明,血根碱可以降低 rASMCs 的牵张力,并表现出时间和浓度依赖效应,提示血根碱可以降低 ASMCs 的收缩能力,进一步提示血根碱可能是 AHR 的一种调控药物。
细胞迁移是哮喘病理过程中 ASMCs 重构的一个重要环节。本研究显示,血根碱可以抑制 rASMCs 的迁移能力,提示血根碱可能会通过影响细胞迁移从而影响 AHR。细胞骨架是调控细胞生物力学特性的核心元件,可影响细胞刚度、细胞收缩—舒张以及细胞迁移。本研究显示,血根碱诱导应力纤维解聚,同时降低了细胞刚度、细胞牵张力和细胞迁移能力,提示血根碱可能通过影响细胞骨架的重构过程从而影响细胞的生物力学特性。
本实验结果还显示,在 0.5 μmol/L 以下的浓度条件下,血根碱没有明显降低 ASMCs 的活性,提示其具有较好的生物安全性。而当血根碱的浓度为 0.05 μmol/L 和 0.5 μmol/L 时,rASMCs 的刚度和细胞牵张力均明显下降,提示 0.05 μmol/L 和 0.5 μmol/L 是将来进一步药物开发较为理想的药物浓度。但需要注意的是,当浓度增加到 5 μmol/L 时,血根碱明显降低了 rASMCs 的活性,提示在微摩尔级别浓度的血根碱具有一定的生物毒性,这是在后期药物开发中需要考虑的因素。尤为重要的是,目前文献报道血根碱对胸主动脉、肠道和子宫等组织平滑肌具有明显收缩抑制效应的浓度主要在微摩尔级别,而我们的实验结果提示纳摩尔级别浓度的血根碱即具有降低 ASMCs 刚度及收缩力、抑制细胞迁移和诱导微丝骨架解聚的能力。上述研究结果在细胞水平下证实了血根碱对 ASMCs 生物力学特性的影响,这为后期以血根碱为对象进一步开发哮喘治疗药物中的新型气道扩张剂奠定了基础,但血根碱影响 ASMCs 生物力学特性的具体作用机制还有待进一步阐明,其对 AHR 的治疗效果也还需要在动物模型水平进一步的研究。
4. 结论
作为从常见植物中提取的天然产物,血根碱不仅具有抗炎、抗氧化和抗肿瘤作用,而且本文研究结果显示,在生物安全的浓度条件下具有明显降低体外培养 rASMCs 刚度和牵张力等生物力学特性的能力,提示血根碱有可能作为一种靶向气道平滑肌力学特性的气道扩张剂,为临床哮喘治疗中控制和改善患者 AHR 提供新的途径。
Funding Statement
国家自然科学基金重点项目(11532003);国家自然科学基金面上项目(31670950);江苏省自然科学基金(BK20151186);常州市应用基础研究计划(CJ20179039)
References
- 1.Mccracken J L, Veeranki S P, Ameredes B T, et al Diagnosis and management of asthma in adults: a review. JAMA. 2017;318(3):279–290. doi: 10.1001/jama.2017.8372. [DOI] [PubMed] [Google Scholar]
- 2.Rydell-Törmänen K, Risse P A, Kanabar V, et al Smooth muscle in tissue remodeling and hyper-reactivity: airways and arteries. Pulm Pharmacol Ther. 2013;26(1):13–23. doi: 10.1016/j.pupt.2012.04.003. [DOI] [PubMed] [Google Scholar]
- 3.Chapman D G, Irvin C G Mechanisms of airway hyper-responsiveness in asthma: the past, present and yet to come. Clinical and Experimental Allergy. 2015;45(4):706–719. doi: 10.1111/cea.12506. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Bates J H, Maksym G N Mechanical determinants of airways hyperresponsiveness. Crit Rev Biomed Eng. 2011;39(4):281–296. doi: 10.1615/critrevbiomedeng.v39.i4.30. [DOI] [PubMed] [Google Scholar]
- 5.Ozier A, Allard B, Bara I, et al The pivotal role of airway smooth muscle in asthma pathophysiology. J Allergy (Cairo) 2011:742710. doi: 10.1155/2011/742710. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Affonce D A, Lutchen K R New perspectives on the mechanical basis for airway hyperreactivity and airway hypersensitivity in asthma. J Appl Physiol (1985) 2006;101(6):1710–1719. doi: 10.1152/japplphysiol.00344.2006. [DOI] [PubMed] [Google Scholar]
- 7.Janssen L J Airway smooth muscle as a target in asthma and the beneficial effects of bronchial thermoplasty. J Allergy (Cairo) 2012:593784. doi: 10.1155/2012/593784. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Camoretti-Mercado B Targeting the airway smooth muscle for asthma treatment. Transl Res. 2009;154(4):165–174. doi: 10.1016/j.trsl.2009.06.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Zuyderduyn S, Sukkar M B, Fust A, et al Treating asthma means treating airway smooth muscle cells. Eur Respir J. 2008;32(2):265–274. doi: 10.1183/09031936.00051407. [DOI] [PubMed] [Google Scholar]
- 10.Stephens N L, Li Weilong, Jiang He, et al The biophysics of asthmatic airway smooth muscle. Respir Physiol Neurobiol. 2003;137(2/3):125–140. doi: 10.1016/s1569-9048(03)00142-3. [DOI] [PubMed] [Google Scholar]
- 11.Black J L, Panettieri R A, Banerjee A, et al. Airway smooth muscle in asthma: just a target for bronchodilation?. Clin Chest Med, 2012, 33(3): 543-558
- 12.Oria R, Wiegand T, Escribano J, et al Force loading explains spatial sensing of ligands by cells. Nature. 2017;552(7684):219–224. doi: 10.1038/nature24662. [DOI] [PubMed] [Google Scholar]
- 13.Dinardo C L, Santos H C, Vaquero A R, et al Smoking and female sex: independent predictors of human vascular smooth muscle cells stiffening. PLoS One. 2015;10(12):e0145062. doi: 10.1371/journal.pone.0145062. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Trepat X, DENG Linhong, An S S, et al Universal physical responses to stretch in the living cell. Nature. 2007;447(7144):592–595. doi: 10.1038/nature05824. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Rosner S R, Pascoe C D, Blankman E, et al The actin regulator zyxin reinforces airway smooth muscle and accumulates in airways of fatal asthmatics. PLoS One. 2017;12(3):e0171728. doi: 10.1371/journal.pone.0171728. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Deshpande D A, Wang W C H, Mcilmoyle E L, et al Bitter taste receptors on airway smooth muscle bronchodilate by a localized Calcium flux and reverse obstruction. Nat Med. 2010;16(11):1299–1304. doi: 10.1038/nm.2237. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Park C Y, Zhou E H, Tambe D, et al High-throughput screening for modulators of cellular contractile force. Integr Biol (Camb) 2015;7(10):1318–1324. doi: 10.1039/c5ib00054h. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Hu C M, Cheng H W, Cheng Y W, et al Mechanisms underlying the induction of vasorelaxation in rat thoracic aorta by sanguinarine. Jpn J Pharmacol. 2001;85(1):47–53. doi: 10.1254/jjp.85.47. [DOI] [PubMed] [Google Scholar]
- 19.王慧, 王悦尚, 刘兆颖, 等 血根碱对大鼠肠平滑肌细胞收缩的抑制作用. 湖南农业大学学报:自然科学版. 2012;38(05):519–525. [Google Scholar]
- 20.Wang Hui, Yin G, Yu Chunhong, et al Inhibitory effect of sanguinarine on PKC-CPI-17 pathway mediating by muscarinic receptors in dispersed intestinal smooth muscle cells. Res Vet Sci. 2013;95(3):1125–1133. doi: 10.1016/j.rvsc.2013.07.022. [DOI] [PubMed] [Google Scholar]
- 21.Wang Yue, Lu Yun, Luo Mingzhi, et al Evaluation of pharmacological relaxation effect of the natural product naringin on in vitro cultured airway smooth muscle cells and in vivo ovalbumin-induced asthma Balb/c mice . Biomedical reports. 2016;5(6):715–722. doi: 10.3892/br.2016.797. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Zhang Ying, Ng S S, Wang Yilei, et al Collective cell traction force analysis on aligned smooth muscle cell sheet between three-dimensional microwalls. Interface Focus. 2014;4(2):20130056. doi: 10.1098/rsfs.2013.0056. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.An S S, Fabry B, Trepat X, et al. Do biophysical properties of the airway smooth muscle in culture predict airway hyperresponsiveness?. Am J Respir Cell Mol Biol, 2006, 35(1): 55-64
- 24.Seow C Y. Passive stiffness of airway smooth muscle: the next target for improving airway distensibility and treatment for asthma?. Pulm Pharmacol Ther, 2013, 26(1): 37-41
- 25.贾海燕, 徐婉晴, 张庭华, 等 血根碱对大鼠离体子宫平滑肌收缩的影响及其机制研究. 中国畜牧兽医. 2017;44(07):2209–2213. [Google Scholar]